Method Article
Выделение, культивирование и характеристика первичных дермальных фибробластов из келоидной ткани человека
В этой статье
Резюме
В этом исследовании описывается оптимизированный протокол создания первичных фибробластов из келоидных тканей, которые могут эффективно и стабильно обеспечивать чистые и жизнеспособные фибробласты.
Аннотация
Фибробласты, основной тип клеток в келоидной ткани, играют важную роль в образовании и развитии келоидов. Выделение и культивирование первичных фибробластов, полученных из келоидной ткани, являются основой для дальнейших исследований биологической функции и молекулярных механизмов келоидов, а также новых терапевтических стратегий их лечения. Традиционный метод получения первичных фибробластов имеет ограничения, такие как плохое клеточное состояние, смешивание с другими типами клеток и восприимчивость к контаминации. В этой статье описывается оптимизированный и легко воспроизводимый протокол, который может уменьшить возникновение возможных проблем при получении фибробластов. В этом протоколе фибробласты можно наблюдать через 5 дней после выделения и достигать почти 80% слияния после 10 дней культивирования. Затем фибробласты пассируют и верифицируют с помощью антител к PDGFRα и виментину для иммунофлуоресцентного анализа и антител к CD90 для проточной цитометрии. В заключение, фибробласты из келоидной ткани могут быть легко получены с помощью этого протокола, что может обеспечить обильный и стабильный источник клеток в лаборатории для исследования келоидов.
Введение
Келоид, фибропролиферативное заболевание, проявляется в виде непрерывного роста бляшек, которые часто вторгаются в окружающую нормальную кожу без самоограничения и вызывают зуд, боль, а также косметические и психологические нагрузки для пациентов1. Фибробласты, первичные клетки, участвующие в келоидах, играют важную роль в формировании и развитии этого заболевания из-за чрезмерной пролиферации, избыточной продукции внеклеточного матрикса и дезорганизованных коллагенов 2,3. Тем не менее, основной патогенез остается неясным, и эффективный метод лечения келоида до сих пор отсутствует; Поэтому существует острая необходимость в дальнейших исследованиях 4,5.
Поскольку не существует идеальной животной модели для исследования келоидов in vivo 6,7, построение модели in vitro путем получения первичных фибробластов из келоидных тканей может обеспечить осуществимость и надежность исследования келоидов 2,6. Первичными клетками являются клетки, полученные непосредственно из живой ткани, и общепризнано, что эти клетки могут более близко напоминать физиологическое состояние и генетический фон нескольких индивидуумов по сравнению с клеточными линиями 8,9. Культивирование первичных клеток является мощным средством для изучения роста и метаболизма клеток, а также других клеточных фенотипов.
В настоящее время существует два метода получения первичных фибробластов: ферментное расщепление и эксплант-культура. Тем не менее, было выявлено несколько препятствий для получения первичных фибробластов, таких как риск заражения различными бактериями или грибами, смешивание с другими типами клеток, которые не так легко удаляются, длительный период цикла культивирования, последующие изменения характеристик клеток по сравнению с исходными клеткамии так далее.. Поэтому разработка осуществимого и эффективного процесса получения первичных фибробластов является основой для дальнейших исследований и применений. В этом исследовании описан оптимизированный протокол извлечения первичных фибробластов из келоидных тканей, который может эффективно и стабильно обеспечивать чистые и жизнеспособные фибробласты.
протокол
Это исследование было одобрено институциональным наблюдательным советом Дерматологической больницы Южного медицинского университета (2020081). Информированное согласие пациента было получено до того, как у пациентов были взяты ткани.
1. Подготовка
ПРИМЕЧАНИЕ: Следующие процедуры должны выполняться в стерильной среде под шкафом биологической безопасности.
- Готовят полную питательную среду, добавляя 10% фетальную бычью сыворотку (FBS) и 1% раствор пенициллина-стрептомицина-амфотерицина B (ПСА) в модифицированную среду Eagle (DMEM) с высоким содержанием глюкозы Dulbecco.
- Приготовьте фосфатно-буферный солевой раствор (PBS) с PSA, добавив 1% PSA в 1x PBS. Подготовьте PBS с помощью FBS, добавив 1% FBS к 1x PBS.
- Подготовьте несколько стерилизованных ножниц, щипцов и скальпелей в автоклаве.
2. Получение удаленных тканей
- Получение тканей у пациентов с келоидными рубцами хирургическим путем. Соберите свежие келоидные ткани в стерильный упаковочный пакет или стерильную центрифужную пробирку и как можно скорее перенесите их в шкаф биологической безопасности в лаборатории.
ПРИМЕЧАНИЕ: В этом протоколе размер приобретенной келоидной ткани составлял примерно ~20 x 20 x 10мм3, и размер может варьироваться в зависимости от операции.
3. Изоляция
- Удалите келоидную ткань стерильным пинцетом и поместите ее в стерильную центрифужную пробирку объемом 50 мл, содержащую 10-25 мл PBS с 1% ПСА на 10 минут. Затем подготовьте планшет на 6 лунок и добавьте в каждую лунку 4 мл PBS с добавлением 1% PSA. Выньте салфетку стерилизованным пинцетом и дважды промойте ее PBS с добавлением 1% PSA. С помощью стерильных щипцов последовательно переносят ткань из одной лунки в другую.
- Удалите слои жира и эпидермиса с помощью хирургических ножниц или хирургического скальпеля, а слой дермы оставьте нетронутым. Обрезают и рассекают ножницами слой дермы на3-5 мм 2 штуки, переносят эти кусочки стерильными щипцами в следующую лунку и снова промывают в ПБС с 1% раствором ПСА.
4. Культура
- Поместите кусочки ткани дермы в чашки Петри с помощью стерилизованных щипцов; Убедитесь, что количество деталей составляет от 10 до 30, а расстояние между ними составляет >5 мм. Поставьте чашки Петри вверх дном в инкубатор с 5%СО2 при температуре 37 °C на 30-60 мин, пока кусочки тканей немного не подсохнут и не прилипнут к чашке Петри. Затем добавьте DMEM с добавлением 10% FBS и 1% PSA и осторожно поместите чашки Петри в инкубатор с 5%CO2 при температуре 37 °C.
ПРИМЕЧАНИЕ: Фибробласты представляют собой морфологически и функционально гетерогенную клеточную популяцию. Учитывая эту сложность, этапы изоляции и культивирования должны выполняться с осторожностью; Равномерно выберите кусочки келоидной дермальной ткани и хорошо перемешайте эти кусочки, прежде чем поместить их в чашку Петри. - Через 3 дня замените половину надосадочной жидкости полной питательной средой. Меняйте питательную среду каждые 2-3 дня. Наблюдайте за фибробластами под микроскопом при 40-кратном увеличении каждый день.
ПРИМЕЧАНИЕ: Все шаги должны выполняться аккуратно. Не перемещайте чашку Петри в течение 2 дней после изоляции, так как кусочкам ткани требуется время, чтобы прилипнуть к чашкам Петри. - Когда фибробласты, растущие вокруг кусочков ткани, достигнут примерно 90% слияния, удалите кусочки ткани и питательную среду. Промойте фибробласты стерильным 1x PBS и добавьте 2 мл стерильного 1x раствора трипсина-ЭДТА на пластины. Инкубируют клетки примерно ~3-5 мин при 37 °C в увлажненном инкубаторе с 5%СО2 . Осторожно постучите по чашке для закваски и понаблюдайте за ней под микроскопом. Когда большая часть клеток отделится от пластины, добавьте 2 мл полной среды, чтобы завершить процесс пищеварения.
- Переложите клеточную суспензию в стерильную центрифужную пробирку объемом 15 мл и центрифугируйте пробирку при 300 × г в течение 3 мин при комнатной температуре. Осторожно выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в полной среде. Высевают фибробласты в чашку для культивирования клеток диаметром 9 см и инкубируют при температуре 37 °C в инкубаторе с содержанием 5%CO2 .
5. Обслуживание и консервация
- Примерно через 3-4 дня, когда фибробласты вырастут до 80% слияния, повторите шаги 4.2-4.4 и проведите фибробласты в соотношении 1:3. Используйте пассированные фибробласты для дальнейших экспериментов.
ПРИМЕЧАНИЕ: Культивирование фибробластов следует прекратить после 10 пассажей, потому что клетки могут начать проявлять измененные характеристики по сравнению с исходными клетками. - Криоконсервировать пассажированные клетки Р1-Р3 в жидком азоте для дальнейшего использования.
- Повторите шаги 4.2-4.3. Переложите клеточную суспензию в стерильную центрифужную пробирку объемом 15 мл и центрифугируйте пробирку в течение 3 мин при 300 × г. Тщательно выбросьте надосадочную жидкость, повторно суспендируйте клеточную гранулу в 1 мл среды для замораживания клеток, содержащей 90% FBS и 10% DMSO, и перенесите суспензию в клеточные криопробирки.
- Переместите клетки в морозильную камеру, а затем поместите замороженную коробку в морозильную камеру с температурой −80 °C. Через 1 сутки переведите клетки в жидкий азот для длительного сохранения.
6. Идентификация фибробластов методом иммунофлуоресцентного окрашивания
- Поместите круглые покровные стекла в 24-луночный планшет и культивируйте пассированные фибробласты в концентрации 1 × 104 клеток/лунку. Когда фибробласты достигнут 60% слияния, питательную среду удаляют. Добавьте 1 мл 4% параформальдегида, чтобы зафиксировать фибробласты в течение 20 минут при комнатной температуре, и промойте 3 раза PBS в течение 1 минуты каждый раз.
ПРИМЕЧАНИЕ: Подсчитайте количество клеток с помощью предметного стекла гемоцитометра под микроскопом или автоматического счетчика клеток. - Удалите PBS, инкубируйте с 0,5% Triton X-100 в течение 20 мин для пермеабилизации клеточных мембран, а затем промывают 3 раза PBS в течение 1 мин каждый раз. Добавьте PBS с 0,5% бычьим сывороточным альбумином и выдержите 30 минут. Затем удалите его и добавьте антитело PDGFR-α/vimentin, разведенное в разбавителе антител в соотношении 1:1000. Инкубировать в течение ночи при температуре 4 °C.
- На следующий день удалите первичное антитело, промойте клетки 3 раза PBS в течение 3 мин и добавьте вторичное антитело Alexa Fluor-555 козий антикроличий IgG, разбавленное разбавителем антител в соотношении 1:200, для замачивания в течение 1 ч.
- Удалите вторичное антитело и промойте клетки 3 раза PBS. Вынимают круглые покровные стекла с помощью щипцов, надевают их на предметные стекла и добавляют 50 мкл раствора 4',6-диамидино-2-фенилиндола (DAPI) 50 мкл 5 мкг/мл для окрашивания клеточных ядер. Храните образцы во влажной темной коробке и наблюдайте за ними под лазерным конфокальным флуоресцентным микроскопом.
ПРИМЕЧАНИЕ: Добавьте отрицательную контрольную группу без первичного антитела, но с вторичным антителом, чтобы исключить неспецифическое окрашивание.
7. Идентификация фибробластов методом проточной цитометрии
- Соберите клеточную гранулу в стерильную центрифужную пробирку объемом 1,5 мл и ресуспендируйте 50 мкл PBS, содержащего 1% FBS. Инкубируют с анти-CD90 в течение 30 мин в темноте и добавляют контроль изотипа анти-IgG в контрольную группу. Затем добавляют 200 мкл PBS, содержащего 1% FBS, и центрифугируют пробирку в течение 10 мин при 300 × g при 4 °C.
- Удалите надосадочную жидкость и добавьте 200 мкл PBS, содержащего 1% FBS. Ресуспендировать и отфильтровать суспензию через сетчатый фильтр (70 меш). Добавьте к фильтрату исходный раствор DAPI в концентрации 5 мкг/мл в соотношении 1:100, а затем получите результаты методом проточной цитометрии. Установите прямое рассеяние (FSC) в качестве абсциссы и боковое рассеяние (SSC) в качестве ординаты и обведите основную популяцию клеток. Выберите популяцию клеток и установите фикоэритрин в качестве абсциссы и количество в качестве ординаты для анализа.
Результаты
Временная шкала протокола представлена на рисунке 1A. Некоторые репрезентативные изображения процесса изоляции показаны на рисунке 2; эпидермис и жировые слои осторожно удаляли, а слой дермы разделяли на мелкие фрагменты по 3-4мм2, которые засевали в чашки Петри.
Как показано на рисунке 3А, через 5 суток после обработки под микроскопом наблюдалось несколько фибробластов кусочков ткани. Как показано на рисунке 3B, фибробласты показали высокую скорость пролиферации и достигли высокого уровня слияния через 10 дней. Эти фибробласты имели удлиненные, веретенообразные клеточные тела и выстраивались в пучки, когда достигали высокого уровня слияния. Следуя этому протоколу, фибробласты пассировали и расширили до желаемого количества в течение 2-3 недель.
Для верификации идентичности и чистоты фибробластов был использован иммунофлуоресцентный анализ окрашивания для выявления фибробласт-специфичных маркеров PDGFRα10 и виментина. Как и ожидалось, на рисунках 4A и 4C видно, что все фибробласты были положительно окрашены антителом PDGFRα/vimentin, с красной иммунофлуоресценцией и синей иммунофлуоресценцией в клеточном ядре. Как показано на рисунке 4C, анализ проточной цитометрии также показал положительный результат CD90 почти во всех фибробластах.

Рисунок 1: Обзор процедуры выделения и культивирования келоидных фибробластов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 2: Репрезентативные изображения выделения и культивирования фибробластов из келоидных тканей . (А) Вымойте салфетку. (Б) Удалите эпидермис и жировые слои. (C) Рассеките дерму на 3-4 мм3 части и снова промойте PBS. (D) Поместите фрагменты ткани в чашку Петри. (E) Поместите чашки Петри вверх дном в инкубатор с 5%СО2 при температуре 37 °C на 30-60 минут, чтобы кусочки ткани немного подсохли и прилипли к чашке Петри. (F) Добавьте полную питательную среду в чашку Петри и культуру в клеточный инкубатор, содержащийСО2. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
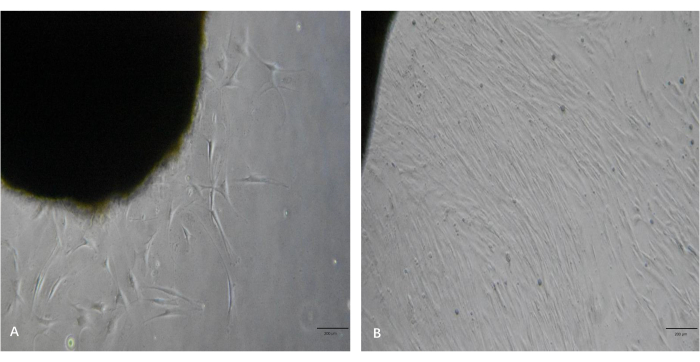
Рисунок 3: Репрезентативные изображения выростов фибробластов из кусочков келоидной ткани. (A) Вырастание фибробластов из кусочков ткани через ~5 дней. (B) Фибробласты достигли высокого уровня слияния через ~10 дней. Масштабные линейки = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
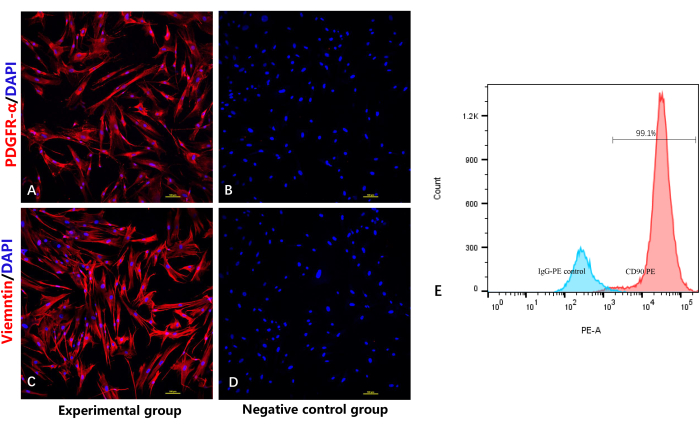
Рисунок 4: Идентификация высокоочищенных фибробластов методом иммунофлуоресцентного окрашивания и проточной цитометрии. (А) Иммунофлуоресцентное окрашивание фибробластов анти-PDGFRα. (B) Отрицательная контрольная группа без первичного антитела к PDGFRα. (C) Иммунофлуоресцентное окрашивание фибробластов антивиментином. (D) Отрицательная контрольная группа без первичного антитела к виментину. (E) Анализ фибробластов методом проточной цитометрии. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Получение первичных фибробластов из келоидных тканей является важнейшей основой для дальнейших исследований. До сих пор существовало два метода получения первичных фибробластов: ферментное расщепление и эксплант-культура11,12,13,14. Однако оба традиционных метода имеют ограничения, такие как восприимчивость к контаминации, смешивание с другими типами клеток, длительный период культивирования и низкая вероятность успеха15,16. В этом исследовании описан оптимизированный метод и даны четкие инструкции для решения этих существующих проблем и увеличения шансов на успех в выделении и культивировании келоидных фибробластов.
Возможность микробной контаминации является одной из основных проблем при получении первичных фибробластов. Все оборудование и растворы должны быть стерилизованы, а стандартные асептические методы должны быть внедрены на всех этапах протокола. Протокол содержит напоминания о необходимости оставаться асептическими, чтобы снизить риск заражения. Первым критическим шагом является процесс изоляции; Целью замачивания тканей в PBS с добавлением 1% PSA и нескольких промывок является удаление существующих микробов и остаточных пятен крови. Чтобы предотвратить возможную передачу загрязнения, следует подготовить дополнительную пару стерилизованных ножниц и щипцов; Эти инструменты могут быть заменены на неиспользуемые в следующей операции. Кроме того, в питательную среду добавляют ПСА для предотвращения размножения микробов. Периодическое тестирование на микоплазму во время выделения и последующего культивирования келоидных фибробластов должно быть включено в протокол. Благодаря этим процессам можно значительно снизить вероятность микробного загрязнения.
Другой проблемой является смешивание с другими типами клеток, такими как кератиноциты. Этот тип клеток также обладает интенсивной пролиферативной способностью, что затрудняет их удаление. Чистота фибробластов сильно зависит от процесса выделения; Эпидермис и жировые слои должны быть полностью удалены, чтобы избежать смешивания с другими клетками. PDGFR-α является фибробласт-специфическим маркером, который экспрессируется в мембране и цитоплазме фибробластов10,17,18. CD90 и виментин также являются специфическими мезенхимальными маркерами, которые специфически экспрессируются в мембранах фибробластов 19,20,21. Иммунофлуоресцентный анализ в этой работе показал, что все клетки положительно экспрессируют PDGFR-α и виментин. Анализ проточной цитометрии также непосредственно продемонстрировал CD90-положительность почти во всех фибробластах и более высокую CD90-положительность по сравнению с изотипным контролем, тем самым подтвердив, что мы получили фибробласты относительно высокой чистоты с использованием этого протокола.
Основные рекомендуемые шаги по стимулированию роста и повышению пролиферативной эффективности фибробластов заключаются в следующем. Во-первых, кусочки ткани должны быть нарезаны на соответствующие размеры 3-5мм2, так как более мелкие кусочки ткани с большей вероятностью всплывут во время движения чашки Петри, и клетки не будут легко перерастать более крупные куски. Во-вторых, первая смена среды должна быть после третьего дня, так как кусочкам ткани требуется время, чтобы прилипнуть к чашкам Петри. Слишком раннее перемещение чашек Петри, как правило, нарушает ткани и снижает вероятность роста фибробластов. В-третьих, все шаги в этом протоколе должны выполняться аккуратно; Неправильное обращение приведет к ненужному перемещению кусочков ткани и ухудшению роста клеток.
Фибробласты представляют собой морфологически и функционально гетерогенную клеточную популяцию, которую можно разделить на несколько субпопуляций. Одним из ограничений этого исследования является то, что мы можем получить общие фибробласты из всей келоидной ткани, но не из различных субпопуляций фибробластов. Мы пытаемся найти лучшие методы решения этой проблемы в будущем.
Как показали наши предыдущие исследования с помощью РНК-секвенирования, существует много различий между келоидными фибробластами и нормальными фибробластами. Келоидные фибробласты вырабатывают больше коллагена I и коллагена III. Кроме того, келоидные фибробласты экспрессируют специфические маркеры, такие как POSTN, среди прочих. После пассажа фибробласты все еще сохраняют эти характеристики, что доказывает, что первичные фибробласты также могут проявлять некоторые особенности, обнаруженные у келоидных пациентов.
В заключение, это исследование предлагает оптимизированный метод и дает четкие инструкции для решения существующих трудностей в экстракции келоидных фибробластов, таких как микробное загрязнение, смешивание с другими типами клеток и длительный период культивирования, а также для увеличения шансов на успех. В настоящее время в работе представлен простой и воспроизводимый метод выделения и культивирования первичных фибробластов келоидного типа, который обеспечит богатый ресурс для будущих исследований или может быть заморожен в жидком азоте для хранения.
Раскрытие информации
Конфликт интересов, о котором можно было бы заявлять, отсутствует.
Благодарности
Работа выполнена при поддержке грантов Национального фонда естественных наук Китая (гранты No 81903189 и 82073418) и Научно-технического фонда Гуанчжоу (грант No 202102020025).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL sterile centrifuge tube | JETBIOFIL | CFT002015 | |
| 15 mL sterile centrifuge tube | JETBIOFIL | 8076 | |
| 4% polyformaldehyde | Beyotime Biotechnology | P0099 | Cell fixation |
| 50 mL sterile centrifuge tube | JETBIOFIL | 8081 | Put keloid tissue |
| Alexa Fluor-555 goat anti-rabbit IgG | Abcam | Alexa Fluor 555 | second antibody for immunofluorescence staining assay |
| Anti human CD90 | BioLegend | B301002 | Identify the purity of fibroblasts |
| Antibody diluent | Beyotime Biotechnology | P0262 | |
| Biological safety cabinet | Thermo Scientific | 1300 series A2 | Isolation and culture cells |
| Bovine serum albumin | aladdin | B265993 | Blocking for immunofluorescence staining assay |
| Carbon dioxide incubator | ESCO | CCL-170B-8 | Using for culturing cells |
| Cell cryotubes | Corning | 43513 | Store the cells in low temperature |
| centrifugal machine | Thermo Fisher | ST 16R | Discard supernatant |
| DAPI | Beyotime Biotechnology | C1006 | Stain the cellular nucleus |
| DMSO | MP Biomedicals | 196055 | Using for preserving cells |
| Dulbecco's modified eagle medium | Gibco | C11995500BT | Culture medium solution |
| Fetal bovine serum | BI | 04-001-1A | |
| Flow cytometer | BD | BD FACSCelesta | Observing the identity of cells |
| frozen box | Thermo Scientific | 5100-0050 | |
| Inverted microscope | Nikon | ECLIPSE Ts2 | |
| Laser confocal microscope | Nikon | AIR-HD25 | Observing the immunofluorescence staining assay |
| PDGFR-α antibody | CST | 3174T | First antibody for immunofluorescence staining assay |
| Penicillin-streptomycin-Am solution | Solarbio | P1410 | Add in culture medium solution to avoid contamination |
| petri dish | JETBIOFIL | 7556 | Culture fibroblasts |
| Phosphate buffered saline solution | Gibco | C10010500BT | Culture medium solution |
| Rabbit (DAIE) mAB IgG XR (R) Isotuge Control (PE) | Cell Signaling Technology | 5742S | As a control for flow cytometry |
| Round coverslip | Biosharp | 801007 | Cell culture |
| Triton X 100 | Solarbio | T8200 | Punch holes in the cell membrane |
| Trypsin-EDTA | Gibco | 25200072 | Used for passaging cells |
| Vimentin antibody | Abcam | ab8978 | First antibody for immunofluorescence staining assay |
Ссылки
- Zhu, Y. Q., et al. Genome-wide analysis of Chinese keloid patients identifies novel causative genes. Annals Of Translational Medicine. 10 (16), 883(2022).
- Feng, F., et al. Biomechanical regulatory factors and therapeutic targets in keloid fibrosis. Frontiers in Pharmacology. 13, 906212(2022).
- Cohen, A. J., Nikbakht, N., Uitto, J. Keloid disorder: Genetic basis, gene expression profiles, and immunological modulation of the fibrotic processes in the skin. Cold Spring Harbor Perspectives in Biology. , (2022).
- Wang, W., et al. Current advances in the selection of adjuvant radiotherapy regimens for keloid. Frontiers in Medicine. 9, 1043840(2022).
- Ghadiri, S. J., Kloczko, E., Flohr, C. Topical treatments in the management of keloids and hypertrophic scars: A critically appraised topic. British Journal of Dermatology. 187 (6), 855-856 (2022).
- Neves, L. M. G., Wilgus, T. A., Bayat, A. In vitro, ex vivo, and in vivo approaches for investigation of skin scarring: Human and animal models. Advances in Wound Care. 12 (2), 97-116 (2023).
- Supp, D. M. Animal models for studies of keloid scarring. Advances in Wound Care. 8 (2), 77-89 (2019).
- Künzel, S. R., et al. Ultrasonic-augmented primary adult fibroblast isolation. Journal of Visualized Experiments. (149), e59858(2019).
- He, Y., et al. An improved explants culture method: Sustainable isolation of keloid fibroblasts with primary characteristics. Journal of Cosmetic Dermatology. 21 (12), 7131-7139 (2022).
- Philippeos, C., et al. Spatial and single-cell transcriptional profiling identifies functionally distinct human dermal fibroblast subpopulations. Journal of Investigative Dermatology. 138 (4), 811-825 (2018).
- Li, L., et al. Hydrogen sulfide suppresses skin fibroblast proliferation via oxidative stress alleviation and necroptosis inhibition. Medicine and Cellular Longevity. 2022, 7434733(2022).
- Zhou, B. Y., et al. Nintedanib inhibits keloid fibroblast functions by blocking the phosphorylation of multiple kinases and enhancing receptor internalization. Acta Pharmacologica Sinica. 41 (9), 1234-1245 (2020).
- Wang, X. M., Liu, X. M., Wang, Y., Chen, Z. Y. Activating transcription factor 3 (ATF3) regulates cell growth, apoptosis, invasion and collagen synthesis in keloid fibroblast through transforming growth factor beta (TGF-beta)/SMAD signaling pathway. Bioengineered. 12 (1), 117-126 (2021).
- Sato, C., et al. Conditioned medium obtained from amnion-derived mesenchymal stem cell culture prevents activation of keloid fibroblasts. Plastic and Reconstructive Surgery. 141 (2), 390-398 (2018).
- Li, J., et al. Long-term explant culture: An improved method for consistently harvesting homogeneous populations of keloid fibroblasts. Bioengineered. 13 (1), 1565-1574 (2022).
- Wang, Q., et al. Altered glucose metabolism and cell function in keloid fibroblasts under hypoxia. Redox Biology. 38, 101815(2021).
- Fan, C., et al. Single-cell transcriptome integration analysis reveals the correlation between mesenchymal stromal cells and fibroblasts. Frontiers in Genetics. 13, 798331(2022).
- Yao, L., et al. Temporal control of PDGFRα regulates the fibroblast-to-myofibroblast transition in wound healing. Cell Reports. 40 (7), 111192(2022).
- Domdey, M., et al. Consecutive dosing of UVB irradiation induces loss of ABCB5 expression and activation of EMT and fibrosis proteins in limbal epithelial cells similar to pterygium epithelium. Stem Cell Research. 40, 102936(2022).
- Lin, Z., et al. Renal tubular epithelial cell necroptosis promotes tubulointerstitial fibrosis in patients with chronic kidney disease. FASEB Journal. 36 (12), e22625(2022).
- Korosec, A., et al. Lineage identity and location within the dermis determine the function of papillary and reticular fibroblasts in human skin. Journal of Investigative Dermatology. 139 (2), 342-351 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены