Method Article
Aislamiento, cultivo y caracterización de fibroblastos dérmicos primarios a partir de tejido queloide humano
En este artículo
Resumen
Este estudio describe un protocolo optimizado para establecer fibroblastos primarios a partir de tejidos queloides que puedan proporcionar fibroblastos puros y viables de manera efectiva y constante.
Resumen
Los fibroblastos, el principal tipo de célula en el tejido queloide, juegan un papel esencial en la formación y desarrollo de los queloides. El aislamiento y cultivo de fibroblastos primarios derivados del tejido queloide son la base para futuros estudios de la función biológica y los mecanismos moleculares de los queloides, así como nuevas estrategias terapéuticas para su tratamiento. El método tradicional de obtención de fibroblastos primarios tiene limitaciones, como el mal estado celular, la mezcla con otros tipos de células y la susceptibilidad a la contaminación. En este trabajo se describe un protocolo optimizado y fácilmente reproducible que podría reducir la aparición de posibles problemas a la hora de obtener fibroblastos. En este protocolo, los fibroblastos se pueden observar 5 días después del aislamiento y alcanzan casi el 80% de confluencia después de 10 días de cultivo. A continuación, los fibroblastos se hacen pasar y se verifican utilizando anticuerpos PDGFRα y vimentina para ensayos de inmunofluorescencia y anticuerpos CD90 para citometría de flujo. En conclusión, los fibroblastos del tejido queloide se pueden adquirir fácilmente a través de este protocolo, lo que puede proporcionar una fuente abundante y estable de células en el laboratorio para la investigación de queloides.
Introducción
El queloide, una enfermedad fibroproliferativa, se manifiesta como el crecimiento continuo de placas que a menudo invaden la piel normal circundante sin autolimitación y causan diversos grados de picazón, dolor y cargas cosméticas y psicológicas para los pacientes1. Los fibroblastos, las principales células implicadas en los queloides, desempeñan un papel esencial en la formación y desarrollo de esta enfermedad a través de la proliferación excesiva, la producción redundante de matriz extracelular y el desorden de los colágenos 2,3. Sin embargo, la patogenia subyacente sigue sin estar clara y aún no existe un método terapéutico eficaz para el queloide; Por lo tanto, existe una necesidad urgente de más investigación 4,5.
Dado que no existe un modelo animal ideal para la investigación de queloides in vivo 6,7, la construcción de un modelo in vitro mediante la adquisición de fibroblastos primarios de tejidos queloides puede ofrecer viabilidad y fiabilidad para la investigación de queloides 2,6. Las células primarias son aquellas derivadas directamente de tejidos vivos, y generalmente se reconoce que estas células pueden parecerse más al estado fisiológico y al fondo genético de múltiples individuos en comparación con las líneas celulares 8,9. El cultivo de células primarias proporciona un medio poderoso para estudiar el crecimiento y el metabolismo de las células, así como otros fenotipos celulares.
En la actualidad, existen dos métodos para la adquisición de fibroblastos primarios: la digestión enzimática y el cultivo de explantes. Sin embargo, se han identificado varios obstáculos para la obtención de fibroblastos primarios, como el riesgo de contaminación por diversas bacterias u hongos, la mezcla con otros tipos de células que no se eliminan fácilmente, el largo período del ciclo de cultivo, los cambios posteriores en las características celulares en comparación con las células originales, etc.9. Por lo tanto, el desarrollo de un proceso factible y eficaz para la obtención de fibroblastos primarios es la base para futuros estudios y aplicaciones. Este estudio describe un protocolo optimizado para extraer fibroblastos primarios de tejidos queloides que pueden proporcionar fibroblastos puros y viables de manera efectiva y constante.
Protocolo
Este estudio fue aprobado por la junta de revisión institucional del Hospital de Dermatología de la Universidad Médica del Sur (2020081). Se obtuvo el consentimiento informado del paciente antes de que se recolectaran tejidos de los individuos.
1. Preparación
NOTA: Los siguientes procedimientos deben realizarse en un ambiente estéril bajo una cabina de seguridad biológica.
- Prepare un medio de cultivo completo añadiendo suero fetal bovino (FBS) al 10 % y solución de penicilina, estreptomicina y anfotericina B (PSA) al medio Eagle modificado de Dulbecco (DMEM) con alto contenido de glucosa.
- Prepare una solución salina tamponada con fosfato (PBS) con PSA agregando PSA al 1% en 1x PBS. Prepare PBS con FBS agregando 1% de FBS a 1x PBS.
- Prepare varias tijeras, pinzas y bisturíes esterilizados en autoclave.
2. Obtención de tejidos extraídos
- Obtener tejidos de pacientes queloides a través de cirugía. Recoja los tejidos queloides frescos en una bolsa de embalaje estéril o en un tubo de centrífuga estéril y transfiéralos a un gabinete de seguridad biológica en el laboratorio lo antes posible.
NOTA: En este protocolo, el tamaño del tejido queloide adquirido fue de aproximadamente ~20 x 20 x 10 mm3, y el tamaño puede variar dependiendo de la cirugía.
3. Aislamiento
- Extraiga el tejido queloide con pinzas estériles y colóquelo en un tubo de centrífuga estéril de 50 ml que contenga 10-25 ml de PBS con PSA al 1% durante 10 min. Luego, prepare una placa de 6 pocillos y agregue 4 ml de PBS suplementado con PSA al 1% a cada pocillo. Saque el pañuelo con pinzas esterilizadas y lávelo dos veces con PBS suplementado con PSA al 1%. Con pinzas estériles, transfiera el tejido secuencialmente de un pocillo a otro.
- Retire las capas adiposas y de la epidermis con unas tijeras quirúrgicas o un bisturí quirúrgico y deje intacta la capa de la dermis. Recorte y diseccione la capa dérmica en 2 piezas de 3-5 mm con unas tijeras, transfiera estas piezas conpinzas estériles al siguiente pocillo y lávelas en PBS con una solución de PSA al 1% nuevamente.
4. Cultura
- Coloque los trozos de tejido dérmico en placas de Petri con pinzas esterilizadas; Asegúrese de que el número de piezas esté entre 10 y 30 y que la distancia entre cada pieza sea de >5 mm. Coloque las placas de Petri boca abajo en una incubadora de CO2 al 5% a 37 °C durante 30-60 min hasta que los trozos de tejido se sequen un poco y se peguen a la placa de Petri. A continuación, añadir DMEM suplementado con un 10% de FBS y un 1% de PSA, y colocar con cuidado las placas de Petri en una incubadora de CO2 al 5% a 37 °C.
NOTA: Los fibroblastos son una población celular morfológica y funcionalmente heterogénea. Teniendo en cuenta esta complejidad, los pasos de aislamiento y cultivo deben realizarse con cuidado; seleccione las piezas de tejido dérmico queloide de manera uniforme y mezcle bien estas piezas antes de colocarlas en la placa de Petri. - Después de 3 días, reemplace la mitad del sobrenadante con un medio de cultivo completo. Cambie el medio de cultivo cada 2-3 días. Observe los fibroblastos bajo un microscopio con un aumento de 40x todos los días.
NOTA: Todos los pasos deben realizarse suavemente. No mueva la placa de Petri durante 2 días después del aislamiento, ya que las piezas de tejido tardan en adherirse a las placas de Petri. - Cuando los fibroblastos que crecen alrededor de las piezas de tejido alcancen aproximadamente el 90% de confluencia, retire las piezas de tejido y el medio de cultivo. Lave los fibroblastos con 1x PBS estéril y agregue 2 ml de solución estéril de tripsina-EDTA 1x a las placas. Incubar las células durante aproximadamente ~3-5 min a 37 °C en una incubadora humidificada con 5% de CO2 . Golpee suavemente la placa de cultivo y obsérvela bajo un microscopio. Cuando la mayoría de las células se desprendan de la placa, agregue 2 ml de medio completo para finalizar el proceso de digestión.
- Transfiera la suspensión celular a un tubo de centrífuga estéril de 15 ml y centrifugue el tubo a 300 × g durante 3 minutos a temperatura ambiente. Deseche el sobrenadante con cuidado y vuelva a suspender el gránulo celular en medio completo. Siembre los fibroblastos en una placa de cultivo celular de 9 cm e incube a 37 °C en una incubadora humidificada con 5% de CO2 .
5. Mantenimiento y conservación
- Aproximadamente 3-4 días después, cuando los fibroblastos hayan crecido hasta el 80% de confluencia, repita los pasos 4.2-4.4 y pase los fibroblastos en una proporción de 1:3. Utilice los fibroblastos pasados para realizar más experimentos.
NOTA: El cultivo de fibroblastos debe detenerse después de 10 pasadas, ya que las células pueden comenzar a mostrar características modificadas en comparación con las células originales. - Criopreservar las células transitadas de P1-P3 en nitrógeno líquido para su uso posterior.
- Repita los pasos 4.2-4.3. Transfiera la suspensión celular a un tubo de centrífuga estéril de 15 ml y centrifugue el tubo durante 3 minutos a 300 × g. Deseche el sobrenadante con cuidado, vuelva a suspender el gránulo celular en 1 ml de medio de congelación celular que contenga 90% de FBS y 10% de DMSO, y transfiera la suspensión a criotubos celulares.
- Mueva las células a una caja congelada y luego coloque la caja congelada en un congelador a -80 °C. Después de 1 día, transfiera las células a nitrógeno líquido para su conservación a largo plazo.
6. Identificación de fibroblastos mediante tinción de inmunofluorescencia
- Coloque cubreobjetos redondos en una placa de 24 pocillos y cultive los fibroblastos pasados a una concentración de 1 × 104 células/pocillo. Cuando los fibroblastos alcancen el 60% de confluencia, retire el medio de cultivo. Agregue 1 ml de paraformaldehído al 4% para fijar los fibroblastos durante 20 minutos a temperatura ambiente y lave 3 veces con PBS durante 1 minuto cada vez.
NOTA: Cuente el número de células utilizando un portaobjetos de hemocitómetro bajo un microscopio o un contador automático de células. - Retire el PBS, incube con Triton X-100 al 0,5% durante 20 minutos para la permeabilización de las membranas celulares y luego lave 3 veces con PBS durante 1 minuto cada vez. Añadir PBS con albúmina sérica bovina al 0,5% y remojar durante 30 min. A continuación, retíralo y añade el anticuerpo PDGFR-α/vimentina diluido en diluyente de anticuerpos a 1:1.000. Incubar durante la noche a 4 °C.
- Al día siguiente, retire el anticuerpo primario, lave las células 3 veces con PBS durante 3 minutos y agregue el anticuerpo secundario Alexa Fluor-555 cabra anti-conejo IgG diluido con diluyente de anticuerpos a 1:200 para remojar durante 1 h.
- Retire el anticuerpo secundario y lave las células 3 veces con PBS. Saque los cubreobjetos redondos con fórceps, colóquelos en portaobjetos de vidrio y agregue 50 μL de solución de 5 μg/ml de 4',6-diamidino-2-fenilindol (DAPI) para teñir los núcleos celulares. Mantenga las muestras en una caja húmeda y oscura y obsérvelas bajo un microscopio láser de fluorescencia confocal.
NOTA: Agregue un grupo de control negativo sin un anticuerpo primario pero con un anticuerpo secundario para excluir la tinción inespecífica.
7. Identificación de fibroblastos por citometría de flujo
- Recoja el gránulo de celda en un tubo de centrífuga estéril de 1,5 ml y vuelva a suspender con 50 μl de PBS que contenga 1% de FBS. Incubar con anti-CD90 durante 30 min en la oscuridad y añadir un control de isotipo anti-IgG al grupo de control. A continuación, añadir 200 μL de PBS que contenga un 1% de FBS y centrifugar el tubo durante 10 min a 300 × g a 4 °C.
- Retire el sobrenadante y agregue 200 μL de PBS que contenga 1% de FBS. Vuelva a suspender y filtre la suspensión a través de un colador de celdas (malla 70). Agregue una solución madre de 5 μg/mL de DAPI a 1:100 al filtrado y luego adquiera los resultados por citometría de flujo. Establezca la dispersión directa (FSC) como la abscisa y la dispersión lateral (SSC) como la ordenada, y encierre en un círculo la población de células principal. Seleccione la población celular y establezca la ficoeritrina como la abscisa y el recuento como la ordenada para el análisis.
Resultados
La cronología del protocolo se resume en la Figura 1A. En la Figura 2 se muestran algunas imágenes representativas del proceso de aislamiento; las capas de epidermis y adiposa se eliminaron cuidadosamente, y la capa de dermis se separó en pequeños fragmentos de 3-4mm2, que se inocularon en las placas de Petri.
Como se muestra en la Figura 3A, se observaron varias excrecencias de fibroblastos de las piezas de tejido bajo el microscopio 5 días después del procesamiento. Como se muestra en la Figura 3B, los fibroblastos mostraron altas tasas de proliferación y alcanzaron un alto nivel de confluencia después de 10 días. Estos fibroblastos tenían cuerpos celulares alargados, en forma de huso, y se alineaban en haces cuando alcanzaban un alto nivel de confluencia. Siguiendo este protocolo, los fibroblastos se dejaron pasar y se expandieron a la cantidad deseada en 2-3 semanas.
Para verificar la identidad y pureza de los fibroblastos, se empleó un ensayo de tinción de inmunofluorescencia para detectar los marcadores específicos de fibroblastos PDGFRα10 y vimentina. Como era de esperar, las figuras 4A y 4C muestran que todos los fibroblastos fueron teñidos positivamente por el anticuerpo PDGFRα/vimentina, con inmunofluorescencia roja e inmunofluorescencia azul en el núcleo celular. Como se demuestra en la Figura 4C, el ensayo de citometría de flujo también mostró positividad para CD90 en casi todos los fibroblastos.

Figura 1: Descripción general del procedimiento de aislamiento y cultivo de fibroblastos queloides. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Imágenes representativas del aislamiento y cultivo de fibroblastos a partir de tejidos queloides . (A) Lavar el tejido. (B) Eliminar la epidermis y las capas adiposas. (C) Diseccionar la dermis en 3-4 mm3 pedazos y lavar con PBS nuevamente. (D) Coloque los fragmentos de tejido en una placa de Petri. (E) Coloque las placas de Petri boca abajo en la incubadora de CO2 al 5% a 37 °C durante 30-60 minutos para que los trozos de tejido se sequen un poco y se adhieran a la placa de Petri. (F) Agregue medio de cultivo completo en la placa de Petri y cultive en la incubadora de células que contiene CO2. Haga clic aquí para ver una versión más grande de esta figura.
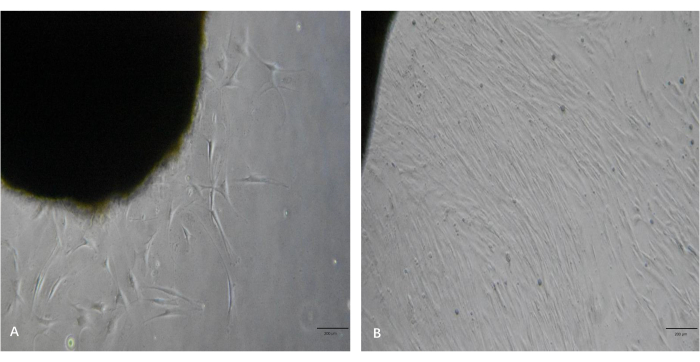
Figura 3: Imágenes representativas de las excrecencias de fibroblastos de las piezas de tejido queloide. (A) Excrecencias de fibroblastos de las piezas de tejido en ~ 5 días. (B) Los fibroblastos alcanzaron un alto nivel de confluencia en ~10 días. Barras de escala = 200 μm. Haga clic aquí para ver una versión más grande de esta figura.
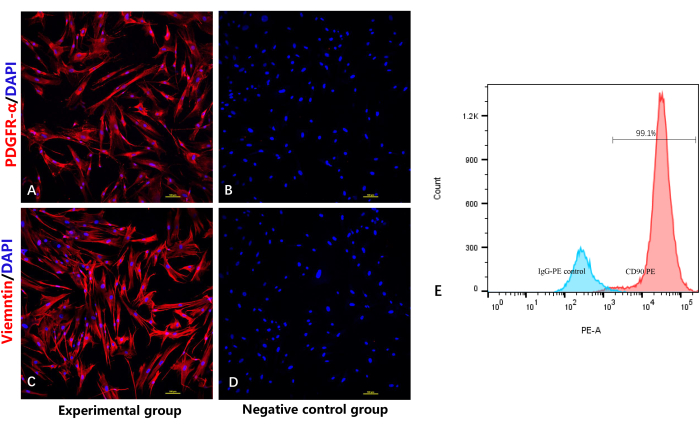
Figura 4: Identificación de fibroblastos altamente purificados mediante tinción de inmunofluorescencia y citometría de flujo. (A) Tinción por inmunofluorescencia de fibroblastos por anti-PDGFRα. (B) Grupo de control negativo sin el anticuerpo primario para PDGFRα. (C) Tinción por inmunofluorescencia de los fibroblastos mediante anti-vimentina. (D) Grupo de control negativo sin el anticuerpo primario para vimentina. (E) Análisis por citometría de flujo de los fibroblastos. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La obtención de fibroblastos primarios a partir de tejidos queloides es una base fundamental para futuras investigaciones. Hasta el momento, existen dos métodos para la adquisición de fibroblastos primarios: la digestión enzimática y el cultivo de explantes11,12,13,14. Sin embargo, ambos métodos tradicionales tienen limitaciones, como la susceptibilidad a la contaminación, la mezcla con otros tipos de células, un largo período de cultivo y una baja tasa de éxito15,16. Este estudio ha descrito un método optimizado y ha proporcionado instrucciones claras para resolver estos desafíos existentes y aumentar las posibilidades de éxito para el aislamiento y cultivo de fibroblastos queloides.
La posibilidad de contaminación microbiana es uno de los principales problemas en la obtención de fibroblastos primarios. Todos los equipos y soluciones deben estar esterilizados, y se deben implementar técnicas asépticas estándar durante todos los pasos del protocolo. El protocolo contiene recordatorios para permanecer aséptico para reducir el riesgo de contaminación. El primer paso crítico es el proceso de aislamiento; el objetivo de remojar los tejidos en PBS suplementado con PSA al 1% y lavar varias veces es eliminar los microbios existentes y las manchas de sangre residuales. Para evitar la posible transferencia de contaminación, se debe preparar un par adicional de tijeras y pinzas esterilizadas; Estos instrumentos podrían ser reemplazados por otros no utilizados en la próxima operación. Además, se agrega PSA al medio de cultivo para evitar el crecimiento de microbios. Las pruebas periódicas para el micoplasma durante el aislamiento y el posterior cultivo de los fibroblastos queloides deben incorporarse al protocolo. A través de estos procesos, se puede reducir significativamente la posibilidad de contaminación microbiana.
El otro reto es la mezcla con otros tipos de células, como los queratinocitos. Este tipo de célula también tiene una intensa capacidad proliferativa, lo que dificulta su eliminación. La pureza de los fibroblastos depende en gran medida del proceso de aislamiento; La epidermis y las capas adiposas deben eliminarse por completo para evitar que se mezclen con otras células. El PDGFR-α es un marcador específico de fibroblastos que se expresa en la membrana y el citoplasma de los fibroblastos10,17,18. El CD90 y la vimentina también son marcadores mesenquimales específicos que se expresan específicamente en las membranas de los fibroblastos 19,20,21. El ensayo de tinción de inmunofluorescencia en este trabajo mostró que todas las células expresaron positivamente PDGFR-α y vimentina. El ensayo de citometría de flujo también demostró directamente la positividad de CD90 en casi todos los fibroblastos y una mayor positividad de CD90 en comparación con el control del isotipo, lo que confirma que obtuvimos fibroblastos de pureza relativamente alta utilizando este protocolo.
Los pasos cruciales recomendados para promover el crecimiento y mejorar la eficiencia proliferativa de los fibroblastos son los siguientes. Primero, las piezas de tejido deben cortarse en tamaños apropiados de 3-5 mm2, ya que es más probable que las piezas de tejido más pequeñas floten durante el movimiento de la placa de Petri y las células no superarán fácilmente las piezas más grandes. En segundo lugar, el primer cambio de medio debe ser después del tercer día, ya que las piezas de tejido tardan en adherirse a las placas de Petri. Mover las placas de Petri demasiado pronto tiende a perturbar los tejidos y disminuir la posibilidad de crecimiento de fibroblastos. En tercer lugar, todos los pasos de este protocolo deben llevarse a cabo con delicadeza; El manejo inadecuado causará un movimiento innecesario de las piezas de tejido y perjudicará el crecimiento celular.
Los fibroblastos son una población celular morfológica y funcionalmente heterogénea que puede dividirse en varias subpoblaciones. Una limitación de este estudio es que podemos obtener fibroblastos generales de todo el tejido queloide, pero no de las diferentes subpoblaciones de fibroblastos. Estamos tratando de encontrar mejores métodos para resolver este problema en el futuro.
Como se demostró en nuestros estudios previos por RNA-seq, existen muchas diferencias entre los fibroblastos queloides y los fibroblastos normales. Los fibroblastos queloides producen más colágeno I y colágeno III. Además, los fibroblastos queloides expresan marcadores específicos como POSTN, entre otros. Después del paso, los fibroblastos aún mantienen estas características, lo que demuestra que los fibroblastos primarios también podrían exhibir algunas características que se encuentran en los pacientes queloides.
En conclusión, este estudio proporciona un método optimizado y da instrucciones claras para resolver las dificultades existentes en la extracción de fibroblastos queloides, como la contaminación microbiana, la mezcla con otros tipos celulares y el largo período de cultivo, y para aumentar las posibilidades de éxito. El trabajo actual proporciona un método simple y reproducible para aislar y cultivar fibroblastos primarios queloides, que proporcionará un rico recurso para futuros estudios e investigaciones o podría congelarse en nitrógeno líquido para su almacenamiento.
Divulgaciones
No hay conflictos de intereses que declarar.
Agradecimientos
Este trabajo contó con el apoyo de subvenciones de la Fundación Nacional de Ciencias Naturales de China (números de subvención 81903189 y 82073418) y de la Fundación de Ciencia y Tecnología de Guangzhou (subvención número 202102020025).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL sterile centrifuge tube | JETBIOFIL | CFT002015 | |
| 15 mL sterile centrifuge tube | JETBIOFIL | 8076 | |
| 4% polyformaldehyde | Beyotime Biotechnology | P0099 | Cell fixation |
| 50 mL sterile centrifuge tube | JETBIOFIL | 8081 | Put keloid tissue |
| Alexa Fluor-555 goat anti-rabbit IgG | Abcam | Alexa Fluor 555 | second antibody for immunofluorescence staining assay |
| Anti human CD90 | BioLegend | B301002 | Identify the purity of fibroblasts |
| Antibody diluent | Beyotime Biotechnology | P0262 | |
| Biological safety cabinet | Thermo Scientific | 1300 series A2 | Isolation and culture cells |
| Bovine serum albumin | aladdin | B265993 | Blocking for immunofluorescence staining assay |
| Carbon dioxide incubator | ESCO | CCL-170B-8 | Using for culturing cells |
| Cell cryotubes | Corning | 43513 | Store the cells in low temperature |
| centrifugal machine | Thermo Fisher | ST 16R | Discard supernatant |
| DAPI | Beyotime Biotechnology | C1006 | Stain the cellular nucleus |
| DMSO | MP Biomedicals | 196055 | Using for preserving cells |
| Dulbecco's modified eagle medium | Gibco | C11995500BT | Culture medium solution |
| Fetal bovine serum | BI | 04-001-1A | |
| Flow cytometer | BD | BD FACSCelesta | Observing the identity of cells |
| frozen box | Thermo Scientific | 5100-0050 | |
| Inverted microscope | Nikon | ECLIPSE Ts2 | |
| Laser confocal microscope | Nikon | AIR-HD25 | Observing the immunofluorescence staining assay |
| PDGFR-α antibody | CST | 3174T | First antibody for immunofluorescence staining assay |
| Penicillin-streptomycin-Am solution | Solarbio | P1410 | Add in culture medium solution to avoid contamination |
| petri dish | JETBIOFIL | 7556 | Culture fibroblasts |
| Phosphate buffered saline solution | Gibco | C10010500BT | Culture medium solution |
| Rabbit (DAIE) mAB IgG XR (R) Isotuge Control (PE) | Cell Signaling Technology | 5742S | As a control for flow cytometry |
| Round coverslip | Biosharp | 801007 | Cell culture |
| Triton X 100 | Solarbio | T8200 | Punch holes in the cell membrane |
| Trypsin-EDTA | Gibco | 25200072 | Used for passaging cells |
| Vimentin antibody | Abcam | ab8978 | First antibody for immunofluorescence staining assay |
Referencias
- Zhu, Y. Q., et al. Genome-wide analysis of Chinese keloid patients identifies novel causative genes. Annals Of Translational Medicine. 10 (16), 883 (2022).
- Feng, F., et al. Biomechanical regulatory factors and therapeutic targets in keloid fibrosis. Frontiers in Pharmacology. 13, 906212 (2022).
- Cohen, A. J., Nikbakht, N., Uitto, J. Keloid disorder: Genetic basis, gene expression profiles, and immunological modulation of the fibrotic processes in the skin. Cold Spring Harbor Perspectives in Biology. , (2022).
- Wang, W., et al. Current advances in the selection of adjuvant radiotherapy regimens for keloid. Frontiers in Medicine. 9, 1043840 (2022).
- Ghadiri, S. J., Kloczko, E., Flohr, C. Topical treatments in the management of keloids and hypertrophic scars: A critically appraised topic. British Journal of Dermatology. 187 (6), 855-856 (2022).
- Neves, L. M. G., Wilgus, T. A., Bayat, A. In vitro, ex vivo, and in vivo approaches for investigation of skin scarring: Human and animal models. Advances in Wound Care. 12 (2), 97-116 (2023).
- Supp, D. M. Animal models for studies of keloid scarring. Advances in Wound Care. 8 (2), 77-89 (2019).
- Künzel, S. R., et al. Ultrasonic-augmented primary adult fibroblast isolation. Journal of Visualized Experiments. (149), e59858 (2019).
- He, Y., et al. An improved explants culture method: Sustainable isolation of keloid fibroblasts with primary characteristics. Journal of Cosmetic Dermatology. 21 (12), 7131-7139 (2022).
- Philippeos, C., et al. Spatial and single-cell transcriptional profiling identifies functionally distinct human dermal fibroblast subpopulations. Journal of Investigative Dermatology. 138 (4), 811-825 (2018).
- Li, L., et al. Hydrogen sulfide suppresses skin fibroblast proliferation via oxidative stress alleviation and necroptosis inhibition. Medicine and Cellular Longevity. 2022, 7434733 (2022).
- Zhou, B. Y., et al. Nintedanib inhibits keloid fibroblast functions by blocking the phosphorylation of multiple kinases and enhancing receptor internalization. Acta Pharmacologica Sinica. 41 (9), 1234-1245 (2020).
- Wang, X. M., Liu, X. M., Wang, Y., Chen, Z. Y. Activating transcription factor 3 (ATF3) regulates cell growth, apoptosis, invasion and collagen synthesis in keloid fibroblast through transforming growth factor beta (TGF-beta)/SMAD signaling pathway. Bioengineered. 12 (1), 117-126 (2021).
- Sato, C., et al. Conditioned medium obtained from amnion-derived mesenchymal stem cell culture prevents activation of keloid fibroblasts. Plastic and Reconstructive Surgery. 141 (2), 390-398 (2018).
- Li, J., et al. Long-term explant culture: An improved method for consistently harvesting homogeneous populations of keloid fibroblasts. Bioengineered. 13 (1), 1565-1574 (2022).
- Wang, Q., et al. Altered glucose metabolism and cell function in keloid fibroblasts under hypoxia. Redox Biology. 38, 101815 (2021).
- Fan, C., et al. Single-cell transcriptome integration analysis reveals the correlation between mesenchymal stromal cells and fibroblasts. Frontiers in Genetics. 13, 798331 (2022).
- Yao, L., et al. Temporal control of PDGFRα regulates the fibroblast-to-myofibroblast transition in wound healing. Cell Reports. 40 (7), 111192 (2022).
- Domdey, M., et al. Consecutive dosing of UVB irradiation induces loss of ABCB5 expression and activation of EMT and fibrosis proteins in limbal epithelial cells similar to pterygium epithelium. Stem Cell Research. 40, 102936 (2022).
- Lin, Z., et al. Renal tubular epithelial cell necroptosis promotes tubulointerstitial fibrosis in patients with chronic kidney disease. FASEB Journal. 36 (12), e22625 (2022).
- Korosec, A., et al. Lineage identity and location within the dermis determine the function of papillary and reticular fibroblasts in human skin. Journal of Investigative Dermatology. 139 (2), 342-351 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados