Method Article
בידוד, תרבית ואפיון פיברובלסטים עוריים ראשוניים מרקמת קלואיד אנושית
In This Article
Summary
מחקר זה מתאר פרוטוקול אופטימלי לביסוס פיברובלסטים ראשוניים מרקמות קלואידיות שיכולים לספק פיברובלסטים טהורים ויציבים ביעילות ובהתמדה.
Abstract
פיברובלסטים, סוג התא העיקרי ברקמת קלואיד, ממלאים תפקיד חיוני בהיווצרות והתפתחות קלואידים. הבידוד והתרבית של פיברובלסטים ראשוניים שמקורם ברקמה קלואידית הם הבסיס למחקרים נוספים על הפונקציה הביולוגית והמנגנונים המולקולריים של קלואידים, כמו גם אסטרטגיות טיפוליות חדשות לטיפול בהם. לשיטה המסורתית להשגת פיברובלסטים ראשוניים יש מגבלות, כגון מצב תאי ירוד, ערבוב עם סוגים אחרים של תאים ורגישות לזיהום. מאמר זה מתאר פרוטוקול ממוטב וקל לשחזור שיכול להפחית את התרחשותן של בעיות אפשריות בעת השגת פיברובלסטים. בפרוטוקול זה, ניתן לצפות בפיברובלסטים 5 ימים לאחר הבידוד ולהגיע לכמעט 80% מפגש לאחר 10 ימי תרבית. לאחר מכן, הפיברובלסטים עוברים ומאומתים באמצעות נוגדני PDGFRα ווימנטין לבדיקות אימונופלואורסנציה ונוגדני CD90 לציטומטריית זרימה. לסיכום, פיברובלסטים מרקמה קלואידית ניתן לרכוש בקלות באמצעות פרוטוקול זה, אשר יכול לספק מקור שופע ויציב של תאים במעבדה למחקר קלואיד.
Introduction
קלואיד, מחלה פיברופרוליפרטיבית, מתבטאת בצמיחה מתמשכת של פלאקים שלעתים קרובות פולשים לעור הרגיל שמסביב ללא הגבלה עצמית וגורמים לדרגות שונות של גירוד, כאב ונטל קוסמטי ופסיכולוגי לחולים1. פיברובלסטים, התאים העיקריים המעורבים בקלואידים, ממלאים תפקיד חיוני בהיווצרות ובהתפתחות של מחלה זו באמצעות התרבות יתר, ייצור מטריצות חוץ-תאיות מיותרות וקולגןלא מאורגן 2,3. עם זאת, הפתוגנזה הבסיסית נותרה לא ברורה, ושיטה טיפולית יעילה לקלואיד עדיין חסרה; לכן, יש צורך דחוף במחקר נוסף 4,5.
מכיוון שאין מודל אידיאלי בבעלי חיים למחקר קלואיד in vivo 6,7, בניית מודל במבחנה על ידי רכישת פיברובלסטים ראשוניים מרקמות קלואידיות יכולה להציע היתכנות ואמינות למחקר קלואיד 2,6. תאים ראשוניים הם אלה שמקורם ישירות ברקמה חיה, וידוע בדרך כלל כי תאים אלה יכולים להידמות יותר למצב הפיזיולוגי ולרקע הגנטי של אנשים רבים בהשוואה לשורות תאים 8,9. טיפוח תאים ראשוניים מספק אמצעי רב עוצמה לחקר הצמיחה והמטבוליזם של תאים, כמו גם פנוטיפים אחרים של תאים.
כיום, ישנן שתי שיטות לרכישת פיברובלסטים ראשוניים: עיכול אנזימים ותרבית צמחים. עם זאת, זוהו מספר מכשולים להשגת פיברובלסטים ראשוניים, כגון הסיכון לזיהום על ידי חיידקים או פטריות שונים, ערבוב עם סוגים אחרים של תאים שאינם מוסרים בקלות, התקופה הארוכה של מחזור התרבית, השינויים הבאים במאפייני התא בהשוואה לתאים המקוריים, וכן הלאה9. לכן, פיתוח תהליך אפשרי ויעיל להשגת פיברובלסטים ראשוניים הוא הבסיס למחקרים ויישומים נוספים. מחקר זה מתאר פרוטוקול אופטימלי לחילוץ פיברובלסטים ראשוניים מרקמות קלואידיות שיכולים לספק פיברובלסטים טהורים ויציבים ביעילות ובהתמדה.
Protocol
מחקר זה אושר על ידי ועדת הסקירה המוסדית של בית החולים לדרמטולוגיה, האוניברסיטה הרפואית הדרומית (2020081). הסכמה מדעת של המטופל התקבלה לפני איסוף הרקמות.
1. הכנה
הערה: יש לבצע את ההליכים הבאים בסביבה סטרילית תחת ארון בטיחות ביולוגי.
- הכינו מדיום תרבית שלם על ידי הוספת 10% סרום בקר עוברי (FBS) ו-1% פניצילין-סטרפטומיצין-אמפוטריצין B תמיסת (PSA) לתמיסת Eagle medium (DMEM) בעלת גלוקוז גבוה של Dulbecco.
- הכינו תמיסת מלח חוצצת פוספט (PBS) עם PSA על ידי הוספת 1% PSA ל-1x PBS. הכן PBS עם FBS על ידי הוספת 1% FBS ל- 1x PBS.
- הכינו מספר מספריים, מלקחיים ואזמלים מעוקרים על ידי אוטוקלאבינג.
2. השגת רקמות שהוסרו
- להשיג רקמות מחולי קלואיד באמצעות ניתוח. אספו את רקמות הקלואיד הטריות בשקית אריזה סטרילית או בצינור צנטריפוגה סטרילי, והעבירו אותן לארון בטיחות ביולוגי במעבדה בהקדם האפשרי.
הערה: בפרוטוקול זה, גודל הרקמה הקלואידית הנרכשת היה בערך ~ 20 x 20 x 10 מ"מ3, והגודל עשוי להשתנות בהתאם לניתוח.
3. בידוד
- הוציאו את הרקמה הקלואידית באמצעות פינצטה סטרילית, והניחו אותה בצינור צנטריפוגה סטרילי של 50 מ"ל המכיל 10-25 מ"ל PBS עם 1% PSA למשך 10 דקות. לאחר מכן, להכין צלחת 6 בארות, ולהוסיף 4 מ"ל של PBS בתוספת 1% PSA לכל באר. הוציאו את הרקמה באמצעות פינצטה מעוקרת, ושטפו אותה פעמיים עם PBS בתוספת 1% PSA. באמצעות מלקחיים סטריליים, להעביר את הרקמה ברצף מבאר אחת לאחרת.
- הסר את שכבות השומן והאפידרמיס באמצעות מספריים כירורגיים או אזמל כירורגי, והשאר את שכבת הדרמיס ללא נגיעה. חותכים ומנתחים את שכבת הדרמיס ל 3-5 מ"מ2 חתיכות עם מספריים, מעבירים חתיכות אלה באמצעות מלקחיים סטריליים לבאר הבאה, ושוטפים אותם ב- PBS עם תמיסת PSA 1% שוב.
4. תרבות
- מניחים את חתיכות רקמת הדרמיס בצלחות פטרי באמצעות מלקחיים מעוקרים; ודא שמספר החתיכות הוא בין 10 ל -30 והמרחק בין כל חתיכה הוא >5 מ"מ. הניחו את צלחות הפטרי הפוכות באינקובטור 5% CO2 בטמפרטורה של 37°C למשך 30-60 דקות עד שחתיכות הרקמות מתייבשות מעט ונדבקות לצלחת הפטרי. לאחר מכן, להוסיף DMEM בתוספת 10% FBS ו 1% PSA, בזהירות להניח את צלחות פטרי לתוך אינקובטור 5% CO2 ב 37 ° C.
הערה: פיברובלסטים הם אוכלוסיית תאים הטרוגנית מבחינה מורפולוגית ותפקודית. בהתחשב במורכבות זו, צעדי הבידוד והתרבות צריכים להתבצע בזהירות; בחר את חתיכות רקמת העור קלואיד באופן שווה, וערבב חתיכות אלה היטב לפני הנחתם בצלחת פטרי. - לאחר 3 ימים, החליפו מחצית מהסופרנאטנט במדיום תרבית שלם. שנה את מדיום התרבות כל 2-3 ימים. צפו בפיברובלסטים תחת מיקרוסקופ בהגדלה של פי 40 בכל יום.
הערה: יש לבצע את כל השלבים בעדינות. אל תזיזו את צלחת הפטרי במשך יומיים לאחר הבידוד, מכיוון שלוקח זמן לחתיכות הרקמה להיצמד לצלחות הפטרי. - כאשר הפיברובלסטים הגדלים סביב חלקי הרקמה מגיעים לכ-90% התמזגות, הסר את פיסות הרקמה ואת מדיום התרבית. שטפו את הפיברובלסטים עם PBS 1x סטרילי, והוסיפו 2 מ"ל של תמיסת טריפסין-EDTA סטרילית 1x לצלחות. לדגור על התאים במשך כ~ 3-5 דקות ב 37 ° C באינקובטור לח 5% CO2 . טפחו בעדינות על צלחת התרבית, והתבוננו בה תחת מיקרוסקופ. כאשר רוב התאים מתנתקים מהצלחת, מוסיפים 2 מ"ל של מדיום שלם כדי לסיים את תהליך העיכול.
- מעבירים את מתלה התא לצינור צנטריפוגה סטרילי בנפח 15 מ"ל, וצנטריפוגות את הצינור בטמפרטורה של 300 × גרם למשך 3 דקות בטמפרטורת החדר. השליכו את הסופרנאטנט בזהירות, והשהו מחדש את כדורית התא בתווך מלא. זרעו את הפיברובלסטים בצלחת תרבית תאים בקוטר 9 ס"מ, ודגרו בטמפרטורה של 37°C באינקובטור לח של 5%CO2 .
5. תחזוקה ושימור
- כעבור 3-4 ימים, כאשר הפיברובלסטים גדלו למפגש של 80%, חזרו על שלבים 4.2-4.4, ועברו את הפיברובלסטים ביחס של 1:3. השתמש בפיברובלסטים העוברים לניסויים נוספים.
הערה: יש לעצור את תרבית הפיברובלסטים לאחר 10 מעברים, מכיוון שהתאים עשויים להתחיל להראות מאפיינים משתנים בהשוואה לתאים המקוריים. - Cryoלשמר את התאים העוברים של P1-P3 בחנקן נוזלי לשימוש נוסף.
- חזור על שלבים 4.2-4.3. מעבירים את מתלה התא לצינור צנטריפוגה סטרילי בנפח 15 מ"ל, וצנטריפוגות את הצינור למשך 3 דקות ב-300 × גרם. השליכו את הסופרנאטנט בזהירות, השהו מחדש את גלולת התא ב-1 מ"ל של מדיום הקפאת תאים המכיל 90% FBS ו-10% DMSO, והעבירו את התרחיף לצינוריות הקפאה של התא.
- העבירו את התאים לקופסה קפואה, ואז הכניסו את הקופסה הקפואה למקפיא בטמפרטורה של -80°C. לאחר יום אחד, להעביר את התאים לחנקן נוזלי לשימור לטווח ארוך.
6. זיהוי פיברובלסטים על ידי צביעה אימונופלואורסצנטית
- מניחים את הכיסויים העגולים בצלחת של 24 בארות, ומגדלים את הפיברובלסטים העוברים בריכוז של 1 × 104 תאים/באר. כאשר הפיברובלסטים מגיעים למפגש של 60%, הסר את מדיום התרבית. הוסף 1 מ"ל של 4% paraformaldehyde כדי לקבע את הפיברובלסטים במשך 20 דקות בטמפרטורת החדר, ולשטוף 3x עם PBS במשך 1 דקות בכל פעם.
הערה: ספור את מספר התאים באמצעות שקופית המוציטומטר מתחת למיקרוסקופ או מונה תאים אוטומטי. - הסר את PBS, לדגור עם 0.5% Triton X-100 במשך 20 דקות עבור חדירה של קרום התא, ולאחר מכן לשטוף 3x עם PBS במשך 1 דקות בכל פעם. הוסיפו PBS עם אלבומין בסרום בקר 0.5% והשרו למשך 30 דקות. לאחר מכן, הסר אותו, והוסף את נוגדן PDGFR-α/vimentin מדולל בנוגדנים ב 1:1,000. לדגור לילה ב 4 °C (75 °F).
- למחרת, להסיר את הנוגדן הראשוני, לשטוף את התאים 3x עם PBS במשך 3 דקות, ולהוסיף את הנוגדן המשני Alexa Fluor-555 עז נגד ארנב IgG מדולל עם נוגדנים מדלל ב 1:200 כדי להשרות במשך 1 שעה.
- הסר את הנוגדן המשני, ולשטוף את התאים 3x עם PBS. הוציאו את הכיסויים העגולים בעזרת מלקחיים, הניחו אותם על מגלשות זכוכית והוסיפו 50 μL של תמיסת 5 מיקרוגרם/מ"ל 4',6-diamidino-2-phenylindole (DAPI) כדי להכתים את גרעיני התא. שמרו את הדגימות בקופסה רטובה וחשוכה, והתבוננו בהן תחת מיקרוסקופ לייזר קונפוקלי פלואורסצנטי.
הערה: הוסף קבוצת ביקורת שלילית ללא נוגדן ראשוני אך עם נוגדן משני כדי לא לכלול כתמים לא ספציפיים.
7. זיהוי פיברובלסטים לפי ציטומטריית זרימה
- אספו את גלולת התא לתוך צינור צנטריפוגה סטרילית של 1.5 מ"ל, והשהו מחדש עם 50 מיקרוליטר של PBS המכיל 1% FBS. יש לדגור עם anti-CD90 למשך 30 דקות בחושך, ולהוסיף בקרת איזוטיפ אנטי-IgG לקבוצת הביקורת. לאחר מכן, הוסף 200 μL של PBS המכיל 1% FBS, וצנטריפוגה את הצינור במשך 10 דקות ב 300 × גרם ב 4 ° C.
- הסר את supernatant, ולהוסיף 200 μL של PBS המכיל 1% FBS. השהה מחדש וסנן את המתלה דרך מסננת תאים (70 רשת). הוסף תמיסת מלאי של 5 מיקרוגרם/מ"ל של DAPI בשעה 1:100 לתסנין, ולאחר מכן קבל את התוצאות באמצעות ציטומטריית זרימה. הגדר את הפיזור הקדמי (FSC) כאבסיסה ואת הפיזור הצדדי (SSC) כאורדינטה, והקף את אוכלוסיית התאים הראשית. בחר את אוכלוסיית התא, והגדר את phycoerythrin כמו abscissa ואת הספירה כמו הקואורדינטה לניתוח.
תוצאות
ציר הזמן של הפרוטוקול מסוכם באיור 1A. כמה תמונות מייצגות של תהליך הבידוד מוצגות באיור 2; שכבות האפידרמיס והשומן הוסרו בקפידה, ושכבת הדרמיס הופרדו לשברים קטנים של 3-4 מ"מ2, שחוסנו לצלחות הפטרי.
כפי שניתן לראות באיור 3A, כמה גידולים פיברובלסטים של חלקי הרקמה נצפו תחת המיקרוסקופ 5 ימים לאחר העיבוד. כפי שניתן לראות באיור 3B, הפיברובלסטים הציגו שיעורי התרבות גבוהים והגיעו לרמה גבוהה של מפגש לאחר 10 ימים. לפיברובלסטים אלה היו גופי תאים מוארכים דמויי ציר והם היו מיושרים בצרורות כאשר הם הגיעו לרמה גבוהה של מפגש. על ידי ביצוע פרוטוקול זה, הפיברובלסטים עברו והורחבו לכמות הרצויה תוך 2-3 שבועות.
כדי לאמת את הזהות והטוהר של הפיברובלסטים, נעשה שימוש בבדיקת צביעה אימונופלואורסצנטית לאיתור הסמנים הספציפיים לפיברובלסטים PDGFRα10 ווימנטין. כצפוי, איור 4A ואיור 4C מראים שכל הפיברובלסטים הוכתמו באופן חיובי על-ידי נוגדן PDGFRα/vimentin, עם אימונופלואורסנציה אדומה ואימונופלואורסנציה כחולה בגרעין התא. כפי שהודגם באיור 4C, בדיקת ציטומטריית הזרימה הראתה גם חיוביות CD90 כמעט בכל הפיברובלסטים.

איור 1: סקירה כללית של הליך בידוד פיברובלסטים קלואידים ותרבית. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: תמונות מייצגות של בידוד ותרבית של פיברובלסטים מרקמות קלואידיות . (A) לשטוף את הרקמה. (B) להסיר את שכבות האפידרמיס והשומן. (C) חתכו את הדרמיס ל-3-4 מ"מ3 חתיכות, ושטפו שוב עם PBS. (D) הניחו את שברי הרקמה בצלוחית פטרי. (E) הניחו את צלחות הפטרי הפוכות לתוך אינקובטור 5% CO2 בטמפרטורה של 37°C למשך 30-60 דקות כדי לתת לחתיכות הרקמה להתייבש מעט ולהידבק לצלחת הפטרי. (F) להוסיף מדיום תרבית שלם לצלחת הפטרי, ולתרבית באינקובטור התאים המכיל CO2. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
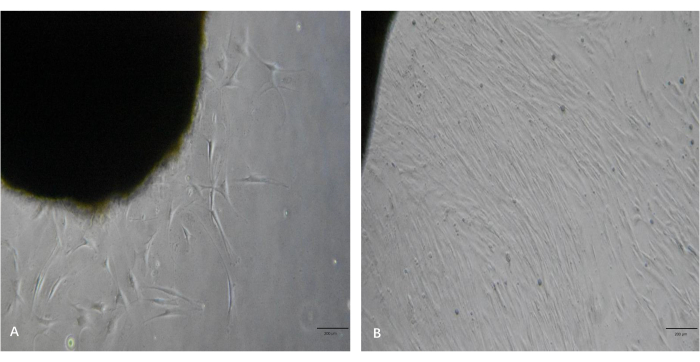
איור 3: תמונות מייצגות של גידולי פיברובלסטים מפיסות הרקמה הקלואידית. (A) גידולי פיברובלסט מחתיכות הרקמה ב~5 ימים. (B) הפיברובלסטים הגיעו לרמה גבוהה של מפגש תוך ~10 ימים. פסי קנה מידה = 200 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
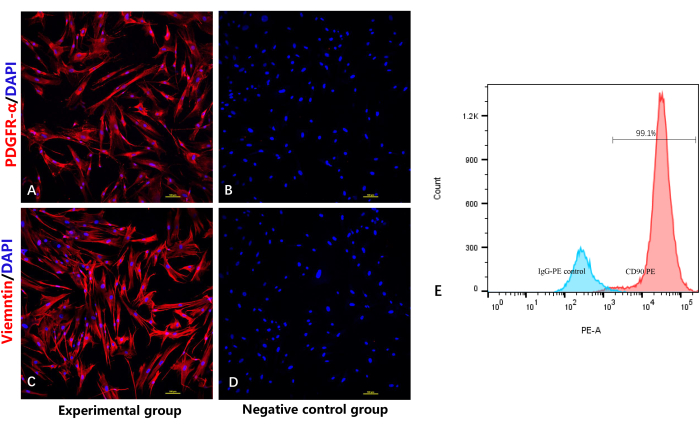
איור 4: זיהוי פיברובלסטים מטוהרים מאוד על-ידי צביעה אימונופלואורסצנטית וציטומטריית זרימה. (A) צביעה אימונופלואורסצנטית של פיברובלסטים על ידי אנטי-PDGFRα. (B) קבוצת ביקורת שלילית ללא הנוגדן העיקרי ל-PDGFRα. (C) Immunofluorescencestaining של הפיברובלסטים על ידי אנטי וימנטין. (D) קבוצת ביקורת שלילית ללא הנוגדן העיקרי לוימנטין. (E) ניתוח ציטומטריית זרימה של הפיברובלסטים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Discussion
השגת פיברובלסטים ראשוניים מרקמות קלואידיות היא בסיס קריטי למחקר נוסף. עד כה, היו שתי שיטות לרכישת פיברובלסטים ראשוניים: עיכול אנזימים ותרבית צמחים11,12,13,14. עם זאת, לשתי השיטות המסורתיות יש מגבלות, כגון רגישות לזיהום, ערבוב עם סוגים אחרים של תאים, תקופת תרבית ארוכה, ושיעור הצלחה נמוך15,16. מחקר זה תיאר שיטה אופטימלית וסיפק הוראות ברורות לפתרון אתגרים קיימים אלה ולהגדיל את סיכויי ההצלחה לבידוד ולתרבית של פיברובלסטים קלואידים.
האפשרות של זיהום מיקרוביאלי היא אחת הבעיות העיקריות בהשגת פיברובלסטים ראשוניים. יש לעקר את כל הציוד והתמיסות, וליישם טכניקות אספטיות סטנדרטיות במהלך כל השלבים בפרוטוקול. הפרוטוקול מכיל תזכורות להישאר אספטי כדי להפחית את הסיכון לזיהום. השלב הקריטי הראשון הוא תהליך הבידוד; מטרת השריית הרקמות ב-PBS בתוספת 1% PSA ושטיפה מספר פעמים היא להסיר חיידקים קיימים ושאריות כתמי דם. כדי למנוע העברה אפשרית של זיהום, זוג נוסף של מספריים מעוקרים ומלקחיים צריך להיות מוכן; מכשירים אלה יכולים להיות מוחלפים על ידי אלה שאינם בשימוש בפעולה הבאה. יתר על כן, PSA מתווסף למדיום התרבית כדי למנוע צמיחה של חיידקים. יש לשלב בפרוטוקול בדיקות תקופתיות למיקופלסמה במהלך הבידוד והתרבית שלאחר מכן של הפיברובלסטים הקלואידים. באמצעות תהליכים אלה, את האפשרות של זיהום מיקרוביאלי יכול להיות מופחת באופן משמעותי.
האתגר השני הוא ערבוב עם סוגים אחרים של תאים, כגון קרטינוציטים. סוג תא זה יש גם יכולת שגשוג אינטנסיבית, מה שהופך אותו קשה להסיר. טוהר הפיברובלסטים תלוי מאוד בתהליך הבידוד; יש להסיר לחלוטין את שכבות האפידרמיס והשומן כדי למנוע ערבוב עם תאים אחרים. PDGFR-α הוא סמן ספציפי לפיברובלסטים המתבטא בקרום ובציטופלסמה של פיברובלסטים10,17,18. CD90 ווימנטין הם גם סמנים מזנכימליים ספציפיים המתבטאים באופן ספציפי בקרומים של פיברובלסטים 19,20,21. בדיקת צביעת האימונופלואורסנציה בעבודה זו הראתה כי כל התאים ביטאו באופן חיובי PDGFR-α ווימנטין. בדיקת ציטומטריית הזרימה גם הדגימה ישירות חיוביות CD90 כמעט בכל הפיברובלסטים וחיוביות CD90 גדולה יותר בהשוואה לבקרת האיזוטיפ, ובכך אישרה כי השגנו פיברובלסטים בעלי טוהר גבוה יחסית באמצעות פרוטוקול זה.
הצעדים המומלצים המכריעים לקידום הצמיחה ולשיפור יעילות ההתרבות של פיברובלסטים הם כדלקמן. ראשית, יש לחתוך את חתיכות הרקמה לגדלים מתאימים של 3-5 מ"מ2, מכיוון שחתיכות רקמה קטנות יותר נוטות יותר לצוף במהלך תנועת צלחת הפטרי, והתאים לא יגדלו בקלות חתיכות גדולות יותר. שנית, השינוי הבינוני הראשון צריך להיות לאחר היום השלישי, מכיוון שלוקח לחתיכות הרקמה זמן להיצמד לצלחות הפטרי. הזזת צלחות הפטרי מוקדם מדי נוטה להפריע לרקמות ולהקטין את האפשרות לצמיחת פיברובלסט. שלישית, כל השלבים בפרוטוקול זה צריכים להתנהל בעדינות; טיפול לא נכון יגרום לתזוזה מיותרת של חלקי הרקמה ויפגע בצמיחת התא.
פיברובלסטים הם אוכלוסיית תאים הטרוגנית מבחינה מורפולוגית ותפקודית שניתן לחלק למספר תת-אוכלוסיות. מגבלה אחת של מחקר זה היא שאנו יכולים לקבל פיברובלסטים כלליים מכל הרקמה הקלואידית, אך לא מתת-האוכלוסיות השונות של פיברובלסטים. אנו מנסים למצוא שיטות טובות יותר לפתור בעיה זו בעתיד.
כפי שהודגם במחקרים קודמים שלנו על ידי RNA-seq, ישנם הבדלים רבים בין פיברובלסטים קלואידים לבין פיברובלסטים רגילים. פיברובלסטים קלואידים מייצרים יותר קולגן I וקולגן III. בנוסף, פיברובלסטים קלואידים מבטאים סמנים ספציפיים כגון POSTN, בין היתר. לאחר המעבר, הפיברובלסטים עדיין שומרים על מאפיינים אלה, מה שמוכיח כי פיברובלסטים ראשוניים יכולים גם להציג כמה תכונות שנמצאו אצל חולי קלואידים.
לסיכום, מחקר זה מספק שיטה אופטימלית ונותן הוראות ברורות לפתרון הקשיים הקיימים במיצוי פיברובלסטים קלואידים, כגון זיהום מיקרוביאלי, ערבוב עם סוגי תאים אחרים, ותקופת התרבית הארוכה, ולהגדיל את סיכויי ההצלחה. העבודה הנוכחית מספקת שיטה פשוטה וניתנת לשחזור לבידוד וגידול פיברובלסטים ראשוניים קלואידים, שתספק משאב עשיר למחקרים ומחקרים עתידיים או שניתן יהיה להקפיא בחנקן נוזלי לבנקאות.
Disclosures
אין ניגודי עניינים להצהיר.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהקרן הלאומית למדעי הטבע של סין (מספרי מענקים 81903189 ו -82073418) וקרן המדע והטכנולוגיה של גואנגזו (מענק מספר 202102020025).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL sterile centrifuge tube | JETBIOFIL | CFT002015 | |
| 15 mL sterile centrifuge tube | JETBIOFIL | 8076 | |
| 4% polyformaldehyde | Beyotime Biotechnology | P0099 | Cell fixation |
| 50 mL sterile centrifuge tube | JETBIOFIL | 8081 | Put keloid tissue |
| Alexa Fluor-555 goat anti-rabbit IgG | Abcam | Alexa Fluor 555 | second antibody for immunofluorescence staining assay |
| Anti human CD90 | BioLegend | B301002 | Identify the purity of fibroblasts |
| Antibody diluent | Beyotime Biotechnology | P0262 | |
| Biological safety cabinet | Thermo Scientific | 1300 series A2 | Isolation and culture cells |
| Bovine serum albumin | aladdin | B265993 | Blocking for immunofluorescence staining assay |
| Carbon dioxide incubator | ESCO | CCL-170B-8 | Using for culturing cells |
| Cell cryotubes | Corning | 43513 | Store the cells in low temperature |
| centrifugal machine | Thermo Fisher | ST 16R | Discard supernatant |
| DAPI | Beyotime Biotechnology | C1006 | Stain the cellular nucleus |
| DMSO | MP Biomedicals | 196055 | Using for preserving cells |
| Dulbecco's modified eagle medium | Gibco | C11995500BT | Culture medium solution |
| Fetal bovine serum | BI | 04-001-1A | |
| Flow cytometer | BD | BD FACSCelesta | Observing the identity of cells |
| frozen box | Thermo Scientific | 5100-0050 | |
| Inverted microscope | Nikon | ECLIPSE Ts2 | |
| Laser confocal microscope | Nikon | AIR-HD25 | Observing the immunofluorescence staining assay |
| PDGFR-α antibody | CST | 3174T | First antibody for immunofluorescence staining assay |
| Penicillin-streptomycin-Am solution | Solarbio | P1410 | Add in culture medium solution to avoid contamination |
| petri dish | JETBIOFIL | 7556 | Culture fibroblasts |
| Phosphate buffered saline solution | Gibco | C10010500BT | Culture medium solution |
| Rabbit (DAIE) mAB IgG XR (R) Isotuge Control (PE) | Cell Signaling Technology | 5742S | As a control for flow cytometry |
| Round coverslip | Biosharp | 801007 | Cell culture |
| Triton X 100 | Solarbio | T8200 | Punch holes in the cell membrane |
| Trypsin-EDTA | Gibco | 25200072 | Used for passaging cells |
| Vimentin antibody | Abcam | ab8978 | First antibody for immunofluorescence staining assay |
References
- Zhu, Y. Q., et al. Genome-wide analysis of Chinese keloid patients identifies novel causative genes. Annals Of Translational Medicine. 10 (16), 883(2022).
- Feng, F., et al. Biomechanical regulatory factors and therapeutic targets in keloid fibrosis. Frontiers in Pharmacology. 13, 906212(2022).
- Cohen, A. J., Nikbakht, N., Uitto, J. Keloid disorder: Genetic basis, gene expression profiles, and immunological modulation of the fibrotic processes in the skin. Cold Spring Harbor Perspectives in Biology. , (2022).
- Wang, W., et al. Current advances in the selection of adjuvant radiotherapy regimens for keloid. Frontiers in Medicine. 9, 1043840(2022).
- Ghadiri, S. J., Kloczko, E., Flohr, C. Topical treatments in the management of keloids and hypertrophic scars: A critically appraised topic. British Journal of Dermatology. 187 (6), 855-856 (2022).
- Neves, L. M. G., Wilgus, T. A., Bayat, A. In vitro, ex vivo, and in vivo approaches for investigation of skin scarring: Human and animal models. Advances in Wound Care. 12 (2), 97-116 (2023).
- Supp, D. M. Animal models for studies of keloid scarring. Advances in Wound Care. 8 (2), 77-89 (2019).
- Künzel, S. R., et al. Ultrasonic-augmented primary adult fibroblast isolation. Journal of Visualized Experiments. (149), e59858(2019).
- He, Y., et al. An improved explants culture method: Sustainable isolation of keloid fibroblasts with primary characteristics. Journal of Cosmetic Dermatology. 21 (12), 7131-7139 (2022).
- Philippeos, C., et al. Spatial and single-cell transcriptional profiling identifies functionally distinct human dermal fibroblast subpopulations. Journal of Investigative Dermatology. 138 (4), 811-825 (2018).
- Li, L., et al. Hydrogen sulfide suppresses skin fibroblast proliferation via oxidative stress alleviation and necroptosis inhibition. Medicine and Cellular Longevity. 2022, 7434733(2022).
- Zhou, B. Y., et al. Nintedanib inhibits keloid fibroblast functions by blocking the phosphorylation of multiple kinases and enhancing receptor internalization. Acta Pharmacologica Sinica. 41 (9), 1234-1245 (2020).
- Wang, X. M., Liu, X. M., Wang, Y., Chen, Z. Y. Activating transcription factor 3 (ATF3) regulates cell growth, apoptosis, invasion and collagen synthesis in keloid fibroblast through transforming growth factor beta (TGF-beta)/SMAD signaling pathway. Bioengineered. 12 (1), 117-126 (2021).
- Sato, C., et al. Conditioned medium obtained from amnion-derived mesenchymal stem cell culture prevents activation of keloid fibroblasts. Plastic and Reconstructive Surgery. 141 (2), 390-398 (2018).
- Li, J., et al. Long-term explant culture: An improved method for consistently harvesting homogeneous populations of keloid fibroblasts. Bioengineered. 13 (1), 1565-1574 (2022).
- Wang, Q., et al. Altered glucose metabolism and cell function in keloid fibroblasts under hypoxia. Redox Biology. 38, 101815(2021).
- Fan, C., et al. Single-cell transcriptome integration analysis reveals the correlation between mesenchymal stromal cells and fibroblasts. Frontiers in Genetics. 13, 798331(2022).
- Yao, L., et al. Temporal control of PDGFRα regulates the fibroblast-to-myofibroblast transition in wound healing. Cell Reports. 40 (7), 111192(2022).
- Domdey, M., et al. Consecutive dosing of UVB irradiation induces loss of ABCB5 expression and activation of EMT and fibrosis proteins in limbal epithelial cells similar to pterygium epithelium. Stem Cell Research. 40, 102936(2022).
- Lin, Z., et al. Renal tubular epithelial cell necroptosis promotes tubulointerstitial fibrosis in patients with chronic kidney disease. FASEB Journal. 36 (12), e22625(2022).
- Korosec, A., et al. Lineage identity and location within the dermis determine the function of papillary and reticular fibroblasts in human skin. Journal of Investigative Dermatology. 139 (2), 342-351 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved