Method Article
Isolement, culture et caractérisation des fibroblastes cutanés primaires à partir de tissus chéloïdes humains
Dans cet article
Résumé
Cette étude décrit un protocole optimisé pour établir des fibroblastes primaires à partir de tissus chéloïdes capables de fournir efficacement et régulièrement des fibroblastes purs et viables.
Résumé
Les fibroblastes, le principal type cellulaire dans le tissu chéloïde, jouent un rôle essentiel dans la formation et le développement des chéloïdes. L’isolement et la culture de fibroblastes primaires dérivés de tissus chéloïdes sont à la base d’études plus approfondies de la fonction biologique et des mécanismes moléculaires des chéloïdes, ainsi que de nouvelles stratégies thérapeutiques pour les traiter. La méthode traditionnelle d’obtention de fibroblastes primaires présente des limites, telles qu’un mauvais état cellulaire, le mélange avec d’autres types de cellules et la susceptibilité à la contamination. Cet article décrit un protocole optimisé et facilement reproductible qui pourrait réduire l’apparition de problèmes possibles lors de l’obtention de fibroblastes. Dans ce protocole, les fibroblastes peuvent être observés 5 jours après l’isolement et atteignent près de 80% de confluence après 10 jours de culture. Ensuite, les fibroblastes sont passés et vérifiés à l’aide d’anticorps PDGFRα et vimentine pour les tests d’immunofluorescence et d’anticorps CD90 pour la cytométrie en flux. En conclusion, les fibroblastes du tissu chéloïde peuvent être facilement acquis grâce à ce protocole, ce qui peut fournir une source abondante et stable de cellules dans le laboratoire pour la recherche chéloïde.
Introduction
Chéloïde, une maladie fibroproliférative, se manifeste par la croissance continue de plaques qui envahissent souvent la peau normale environnante sans autolimitation et provoquent divers degrés de démangeaisons, de douleurs et de fardeaux cosmétiques et psychologiques pour les patients1. Les fibroblastes, les cellules primaires impliquées dans les chéloïdes, jouent un rôle essentiel dans la formation et le développement de cette maladie par une prolifération excessive, une production redondante de matrice extracellulaire et des collagènes désorganisés 2,3. Cependant, la pathogenèse sous-jacente reste floue et il manque encore une méthode thérapeutique efficace pour la chéloïde; Par conséquent, il est urgent de poursuivre les recherches 4,5.
Comme il n’existe pas de modèle animal idéal pour la recherche chéloïde in vivo 6,7, la construction d’un modèle in vitro par l’acquisition de fibroblastes primaires à partir de tissus chéloïdes peut offrir faisabilité et fiabilité pour la recherche chéloïde 2,6. Les cellules primaires sont celles qui proviennent directement de tissus vivants, et il est généralement reconnu que ces cellules peuvent ressembler davantage à l’état physiologique et au bagage génétique de plusieurs individus que les lignées cellulaires 8,9. La culture de cellules primaires fournit un moyen puissant d’étudier la croissance et le métabolisme des cellules, ainsi que d’autres phénotypes cellulaires.
À l’heure actuelle, il existe deux méthodes d’acquisition de fibroblastes primaires: la digestion enzymatique et la culture d’explant. Cependant, plusieurs obstacles ont été identifiés à l’obtention de fibroblastes primaires, tels que le risque de contamination par diverses bactéries ou champignons, le mélange avec d’autres types de cellules qui ne sont pas facilement éliminées, la longue période du cycle de culture, les modifications ultérieures des caractéristiques cellulaires par rapport aux cellules d’origine, etc.9. Par conséquent, le développement d’un processus réalisable et efficace pour obtenir des fibroblastes primaires est la base d’études et d’applications ultérieures. Cette étude décrit un protocole optimisé pour extraire les fibroblastes primaires des tissus chéloïdes qui peuvent fournir efficacement et régulièrement des fibroblastes purs et viables.
Protocole
Cette étude a été approuvée par le comité d’examen institutionnel de l’hôpital de dermatologie de la Southern Medical University (2020081). Le consentement éclairé du patient a été obtenu avant que les tissus ne soient prélevés sur les individus.
1. Préparation
REMARQUE : Les procédures suivantes doivent être effectuées dans un environnement stérile sous une enceinte de sécurité biologique.
- Préparer un milieu de culture complet en ajoutant 10 % de sérum fœtal bovin (FBS) et 1 % de solution de pénicilline-streptomycine-amphotéricine B (PSA) au milieu Eagle modifié de Dulbecco (DMEM) à haute teneur en glucose.
- Préparer une solution saline tamponnée au phosphate (PBS) avec du PSA en ajoutant 1% de PSA dans 1x PBS. Préparez PBS avec FBS en ajoutant 1% FBS à 1x PBS.
- Préparez plusieurs ciseaux, pinces et scalpels stérilisés par autoclavage.
2. Obtention de tissus enlevés
- Obtenir des tissus de patients chéloïdes par chirurgie. Recueillir les tissus chéloïdes frais dans un sac d’emballage stérile ou un tube à centrifuger stérile et les transférer dans une enceinte de sécurité biologique en laboratoire dès que possible.
REMARQUE: Dans ce protocole, la taille du tissu chéloïde acquis était d’environ ~20 x 20 x 10 mm3, et la taille peut varier en fonction de la chirurgie.
3. Isolement
- Retirez le tissu chéloïde à l’aide d’une pince à épiler stérile et placez-le dans un tube centrifuge stérile de 50 ml contenant 10 à 25 ml de PBS avec 1% de PSA pendant 10 min. Ensuite, préparez une plaque de 6 puits et ajoutez 4 mL de PBS complété par 1% PSA à chaque puits. Retirez le mouchoir à l’aide d’une pince à épiler stérilisée et lavez-le deux fois avec du PBS supplémenté en PSA à 1%. À l’aide de pinces stériles, transférez le tissu séquentiellement d’un puits à l’autre.
- Retirez les couches adipeuses et épidermiques à l’aide de ciseaux chirurgicaux ou d’un scalpel chirurgical et laissez la couche dermique intacte. Couper et disséquer la couche de derme en 3-5 mm2 morceaux avec des ciseaux, transférer ces morceaux à l’aide de pinces stériles au puits suivant et les laver à nouveau dans du PBS avec une solution de PSA à 1%.
4. La culture
- Placez les morceaux de tissu dermique dans des boîtes de Petri à l’aide de forceps stérilisés; Assurez-vous que le nombre de pièces est compris entre 10 et 30 et que la distance entre chaque pièce est de >5 mm. Mettez les boîtes de Petri à l’envers dans un incubateur à 5% de CO2 à 37 °C pendant 30-60 minutes jusqu’à ce que les morceaux de tissus sèchent un peu et collez à la boîte de Pétri. Ensuite, ajoutez du DMEM complété par 10% FBS et 1% PSA, et placez soigneusement les boîtes de Petri dans un incubateur à 5% de CO2 à 37 ° C.
NOTE: Les fibroblastes sont une population cellulaire morphologiquement et fonctionnellement hétérogène. Compte tenu de cette complexité, les étapes d’isolement et de culture doivent être effectuées avec soin; Sélectionnez les morceaux de tissu dermique chéloïde uniformément et mélangez-les bien avant de les placer dans la boîte de Pedia. - Après 3 jours, remplacer la moitié du surnageant par un milieu de culture complet. Changez le milieu de culture tous les 2-3 jours. Observez les fibroblastes au microscope à un grossissement de 40x tous les jours.
REMARQUE: Toutes les étapes doivent être effectuées en douceur. Ne déplacez pas la boîte de Petri pendant 2 jours après l’isolement, car les morceaux de tissu prennent du temps à adhérer aux boîtes de Pétri. - Lorsque les fibroblastes qui se développent autour des morceaux de tissu atteignent environ 90% de confluence, retirez les morceaux de tissu et le milieu de culture. Lavez les fibroblastes avec 1x PBS stérile et ajoutez 2 ml de solution stérile 1x trypsine-EDTA aux plaques. Incuber les cellules pendant environ ~3-5 min à 37 °C dans un incubateur humidifié à 5% de CO2 . Tapotez doucement le plat de culture et observez-le au microscope. Lorsque la majorité des cellules se détachent de la plaque, ajouter 2 mL de milieu complet pour mettre fin au processus de digestion.
- Transférer la suspension cellulaire dans un tube à centrifuger stérile de 15 ml et centrifuger le tube à 300 × g pendant 3 minutes à température ambiante. Jeter soigneusement le surnageant et remettre en suspension la pastille de cellule dans un milieu complet. Ensemencer les fibroblastes dans une boîte de culture cellulaire de 9 cm et incuber à 37 °C dans un incubateur humidifié à 5% de CO2 .
5. Entretien et préservation
- Environ 3-4 jours plus tard, lorsque les fibroblastes ont atteint 80% de confluence, répétez les étapes 4.2-4.4 et passez les fibroblastes dans un rapport de 1:3. Utilisez les fibroblastes passés pour d’autres expériences.
REMARQUE: La culture de fibroblastes doit être arrêtée après 10 passages, car les cellules peuvent commencer à montrer des caractéristiques modifiées par rapport aux cellules d’origine. - Cryoconserver les cellules de passage de P1-P3 dans de l’azote liquide pour une utilisation ultérieure.
- Répétez les étapes 4.2 à 4.3. Transférer la suspension cellulaire dans un tube centrifuge stérile de 15 ml et centrifuger le tube pendant 3 min à 300 × g. Jeter soigneusement le surnageant, remettre en suspension la pastille cellulaire dans 1 mL de milieu de congélation cellulaire contenant 90 % de FBS et 10 % de DMSO, et transférer la suspension dans des cryotubes cellulaires.
- Déplacez les cellules dans une boîte congelée, puis mettez la boîte congelée dans un congélateur à −80 °C. Après 1 jour, transférer les cellules dans de l’azote liquide pour une conservation à long terme.
6. Identification des fibroblastes par coloration par immunofluorescence
- Placer des lamelles de couverture rondes dans une assiette de 24 puits et mettre en culture les fibroblastes passés à une concentration de 1 × 104 cellules/puits. Lorsque les fibroblastes atteignent 60% de confluence, retirez le milieu de culture. Ajouter 1 mL de paraformaldéhyde à 4% pour fixer les fibroblastes pendant 20 min à température ambiante, et laver 3x avec du PBS pendant 1 min à chaque fois.
REMARQUE: Comptez le nombre de cellules à l’aide d’une lame d’hémocytomètre sous un microscope ou un compteur de cellules automatique. - Retirer le PBS, incuber avec 0,5% de Triton X-100 pendant 20 min pour la perméabilisation des membranes cellulaires, puis laver 3x avec du PBS pendant 1 min à chaque fois. Ajouter le PBS avec 0,5 % d’albumine sérique bovine et laisser tremper pendant 30 minutes. Ensuite, retirez-le et ajoutez l’anticorps PDGFR-α/vimentine dilué dans un diluant d’anticorps à 1:1 000. Incuber pendant une nuit à 4 °C.
- Le lendemain, retirez l’anticorps primaire, lavez les cellules 3x avec du PBS pendant 3 min, et ajoutez l’anticorps secondaire Alexa Fluor-555 chèvre anti-lapin IgG dilué avec un diluant d’anticorps à 1:200 pour faire tremper pendant 1 h.
- Retirez l’anticorps secondaire et lavez les cellules 3x avec du PBS. Retirez les lamelles rondes à l’aide d’une pince, placez-les sur des lames de verre et ajoutez 50 μL de solution de 4',6-diamidino-2-phénylindole (DAPI) à 5 μg/mL pour colorer les noyaux cellulaires. Conservez les échantillons dans une boîte humide et sombre et observez-les au microscope confocale à fluorescence laser.
REMARQUE: Ajouter un groupe témoin négatif sans anticorps primaire mais avec un anticorps secondaire pour exclure la coloration non spécifique.
7. Identification des fibroblastes par cytométrie en flux
- Recueillir la pastille cellulaire dans un tube centrifuge stérile de 1,5 mL et la remettre en suspension avec 50 μL de PBS contenant 1 % de FBS. Incuber avec anti-CD90 pendant 30 minutes dans l’obscurité et ajouter un contrôle d’isotype anti-IgG au groupe témoin. Ensuite, ajouter 200 μL de PBS contenant 1% de FBS et centrifuger le tube pendant 10 min à 300 × g à 4 °C.
- Retirer le surnageant et ajouter 200 μL de PBS contenant 1 % de FBS. Resuspendre et filtrer la suspension à travers une crépine à cellules (70 mesh). Ajouter une solution mère de 5 μg/mL de DAPI à 1:100 au filtrat, puis obtenir les résultats par cytométrie en flux. Définissez la diffusion vers l’avant (FSC) comme abscisse et la diffusion latérale (SSC) comme ordonnée, et encerclez la population cellulaire principale. Sélectionnez la population cellulaire et définissez la phycoérythrine comme abscisse et le nombre comme ordonnée pour l’analyse.
Résultats
La chronologie du protocole est résumée à la figure 1A. Quelques images représentatives du processus d’isolement sont présentées à la figure 2; L’épiderme et les couches adipeuses ont été soigneusement enlevés et la couche dermique a été séparée en petits fragments de 3-4 mm2, qui ont été inoculés dans les boîtes de Pétri.
Comme le montre la figure 3A, plusieurs excroissances de fibroblastes des morceaux de tissu ont été observées au microscope 5 jours après le traitement. Comme le montre la figure 3B, les fibroblastes présentaient des taux de prolifération élevés et atteignaient un niveau élevé de confluence après 10 jours. Ces fibroblastes avaient des corps cellulaires allongés, fusiformes et étaient alignés en faisceaux lorsqu’ils atteignaient un niveau élevé de confluence. En suivant ce protocole, les fibroblastes ont été passés et étendus à la quantité souhaitée dans les 2-3 semaines.
Pour vérifier l’identité et la pureté des fibroblastes, un test de coloration par immunofluorescence a été utilisé pour détecter les marqueurs spécifiques des fibroblastes PDGFRα10 et la vimentine. Comme prévu, les figures 4A et 4C montrent que tous les fibroblastes ont été colorés positivement par l’anticorps PDGFRα/vimentine, avec une immunofluorescence rouge et une immunofluorescence bleue dans le noyau cellulaire. Comme le montre la figure 4C, le test de cytométrie en flux a également montré une positivité de CD90 dans presque tous les fibroblastes.

Figure 1 : Vue d’ensemble de la procédure d’isolement et de culture des fibroblastes chéloïdes. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Images représentatives de l’isolement et de la culture de fibroblastes à partir de tissus chéloïdes. (A) Laver le tissu. (B) Enlevez l’épiderme et les couches adipeuses. (C) Disséquer le derme en 3-4 mm3 morceaux, et laver à nouveau avec du PBS. (D) Placez les fragments de tissu dans une boîte de Pétri. (E) Mettez les boîtes de Petri à l’envers dans l’incubateur à 5% de CO2 à 37 °C pendant 30-60 minutes pour laisser les morceaux de tissu sécher un peu et coller à la boîte de Pedia. (F) Ajouter le milieu de culture complet dans la boîte de Pétri et la culture dans l’incubateur cellulaire contenant du CO2. Veuillez cliquer ici pour voir une version agrandie de cette figure.
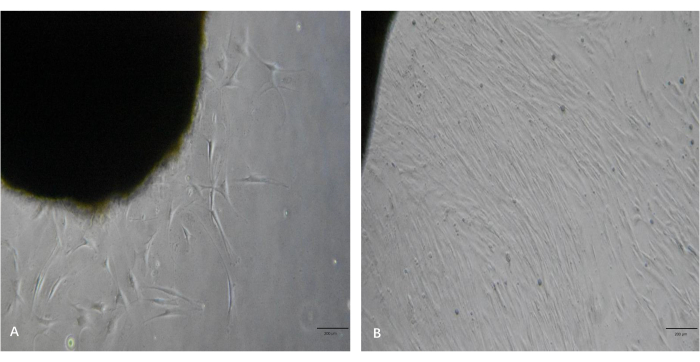
Figure 3 : Images représentatives des excroissances de fibroblastes à partir des morceaux de tissu chéloïde. (A) Les fibroblastes excroissancent des morceaux de tissu en ~5 jours. (B) Les fibroblastes ont atteint un niveau élevé de confluence en ~10 jours. Barres d’échelle = 200 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
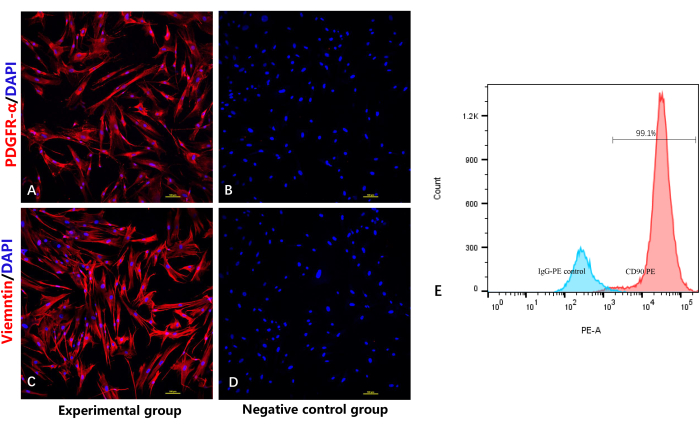
Figure 4 : Identification de fibroblastes hautement purifiés par coloration par immunofluorescence et cytométrie en flux. (A) Coloration par immunofluorescence des fibroblastes par anti-PDGFRα. (B) Groupe témoin négatif sans anticorps primaire pour PDGFRα. (C) Immunofluorescence coloration des fibroblastes par anti-vimentine. (D) Groupe témoin négatif sans anticorps primaire contre la vimentine. (E) Analyse par cytométrie de flux des fibroblastes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
L’obtention de fibroblastes primaires à partir de tissus chéloïdes est une base essentielle pour la poursuite des recherches. Jusqu’à présent, il existait deux méthodes d’acquisition de fibroblastes primaires: la digestion enzymatique et la culture d’explant11,12,13,14. Cependant, les deux méthodes traditionnelles ont des limites, telles que la susceptibilité à la contamination, le mélange avec d’autres types de cellules, une longue période de culture et un faible taux de réussite15,16. Cette étude a décrit une méthode optimisée et fourni des instructions claires pour résoudre ces défis existants et augmenter les chances de succès pour l’isolement et la culture des fibroblastes chéloïdes.
La possibilité de contamination microbienne est l’un des principaux problèmes liés à l’obtention de fibroblastes primaires. Tous les équipements et solutions doivent être stérilisés et des techniques d’asepsie standard doivent être mises en œuvre pendant toutes les étapes du protocole. Le protocole contient des rappels de rester aseptique pour réduire le risque de contamination. La première étape critique est le processus d’isolement; le but de tremper les tissus dans du PBS complété avec 1% de PSA et de laver plusieurs fois est d’éliminer les microbes existants et les taches de sang résiduelles. Pour éviter le transfert possible de contamination, une paire supplémentaire de ciseaux et de pinces stérilisés doit être préparée; Ces instruments pourraient être remplacés par des instruments inutilisés lors de la prochaine opération. De plus, le PSA est ajouté au milieu de culture pour empêcher la prolifération des microbes. Des tests périodiques pour le mycoplasme pendant l’isolement et la culture ultérieure des fibroblastes chéloïdes doivent être intégrés au protocole. Grâce à ces processus, la possibilité de contamination microbienne peut être considérablement réduite.
L’autre défi est le mélange avec d’autres types de cellules, telles que les kératinocytes. Ce type de cellule a également une capacité proliférative intense, ce qui le rend difficile à enlever. La pureté des fibroblastes dépend fortement du processus d’isolement; L’épiderme et les couches adipeuses doivent être entièrement enlevés pour éviter de se mélanger avec d’autres cellules. PDGFR-α est un marqueur spécifique aux fibroblastes qui est exprimé dans la membrane et le cytoplasme des fibroblastes10,17,18. CD90 et vimentine sont également des marqueurs mésenchymateux spécifiques qui sont spécifiquement exprimés dans les membranes des fibroblastes 19,20,21. Le test de coloration par immunofluorescence dans ce travail a montré que toutes les cellules exprimaient positivement PDGFR-α et vimentine. Le test de cytométrie en flux a également démontré directement la positivité de CD90 dans presque tous les fibroblastes et une plus grande positivité de CD90 par rapport au contrôle d’isotype, confirmant ainsi que nous avons obtenu des fibroblastes de pureté relativement élevée en utilisant ce protocole.
Les étapes cruciales recommandées pour favoriser l’excroissance et améliorer l’efficacité proliférative des fibroblastes sont les suivantes. Tout d’abord, les morceaux de tissu doivent être coupés dans des tailles appropriées de 3-5 mm2, car les petits morceaux de tissu sont plus susceptibles de flotter pendant le mouvement de la boîte de Pétri, et les cellules ne deviendront pas facilement trop gros morceaux. Deuxièmement, le premier changement de milieu devrait avoir lieu après le troisième jour, car les morceaux de tissu prennent du temps à adhérer aux boîtes de Pétri. Déplacer les boîtes de Petri trop tôt a tendance à perturber les tissus et à diminuer la possibilité de croissance des fibroblastes. Troisièmement, toutes les étapes de ce protocole doivent être menées en douceur; Une mauvaise manipulation entraînera un mouvement inutile des morceaux de tissu et nuira à la croissance cellulaire.
Les fibroblastes sont une population cellulaire morphologiquement et fonctionnellement hétérogène qui peut être divisée en plusieurs sous-populations. L’une des limites de cette étude est que nous pouvons obtenir des fibroblastes généraux à partir de l’ensemble du tissu chéloïde, mais pas des différentes sous-populations de fibroblastes. Nous essayons de trouver de meilleures méthodes pour résoudre ce problème à l’avenir.
Comme démontré dans nos études précédentes par RNA-seq, il existe de nombreuses différences entre les fibroblastes chéloïdes et les fibroblastes normaux. Les fibroblastes chéloïdes produisent plus de collagène I et de collagène III. De plus, les fibroblastes chéloïdes expriment des marqueurs spécifiques tels que POSTN, entre autres. Après le passage, les fibroblastes conservent toujours ces caractéristiques, ce qui prouve que les fibroblastes primaires pourraient également présenter certaines caractéristiques trouvées chez les patients chéloïdes.
En conclusion, cette étude fournit une méthode optimisée et donne des instructions claires pour résoudre les difficultés existantes dans l’extraction des fibroblastes chéloïdes, telles que la contamination microbienne, le mélange avec d’autres types de cellules et la longue période de culture, et pour augmenter les chances de succès. Les travaux actuels fournissent une méthode simple et reproductible pour isoler et cultiver des fibroblastes primaires chéloïdes, qui fournira une riche ressource pour les études et les recherches futures ou pourrait être congelée dans de l’azote liquide pour la mise en banque.
Déclarations de divulgation
Il n’y a pas de conflits d’intérêts à déclarer.
Remerciements
Ce travail a été soutenu par des subventions de la Fondation nationale des sciences naturelles de Chine (numéros de subvention 81903189 et 82073418) et de la Fondation pour la science et la technologie de Guangzhou (numéro de subvention 202102020025).
matériels
| Name | Company | Catalog Number | Comments |
| 1.5 mL sterile centrifuge tube | JETBIOFIL | CFT002015 | |
| 15 mL sterile centrifuge tube | JETBIOFIL | 8076 | |
| 4% polyformaldehyde | Beyotime Biotechnology | P0099 | Cell fixation |
| 50 mL sterile centrifuge tube | JETBIOFIL | 8081 | Put keloid tissue |
| Alexa Fluor-555 goat anti-rabbit IgG | Abcam | Alexa Fluor 555 | second antibody for immunofluorescence staining assay |
| Anti human CD90 | BioLegend | B301002 | Identify the purity of fibroblasts |
| Antibody diluent | Beyotime Biotechnology | P0262 | |
| Biological safety cabinet | Thermo Scientific | 1300 series A2 | Isolation and culture cells |
| Bovine serum albumin | aladdin | B265993 | Blocking for immunofluorescence staining assay |
| Carbon dioxide incubator | ESCO | CCL-170B-8 | Using for culturing cells |
| Cell cryotubes | Corning | 43513 | Store the cells in low temperature |
| centrifugal machine | Thermo Fisher | ST 16R | Discard supernatant |
| DAPI | Beyotime Biotechnology | C1006 | Stain the cellular nucleus |
| DMSO | MP Biomedicals | 196055 | Using for preserving cells |
| Dulbecco's modified eagle medium | Gibco | C11995500BT | Culture medium solution |
| Fetal bovine serum | BI | 04-001-1A | |
| Flow cytometer | BD | BD FACSCelesta | Observing the identity of cells |
| frozen box | Thermo Scientific | 5100-0050 | |
| Inverted microscope | Nikon | ECLIPSE Ts2 | |
| Laser confocal microscope | Nikon | AIR-HD25 | Observing the immunofluorescence staining assay |
| PDGFR-α antibody | CST | 3174T | First antibody for immunofluorescence staining assay |
| Penicillin-streptomycin-Am solution | Solarbio | P1410 | Add in culture medium solution to avoid contamination |
| petri dish | JETBIOFIL | 7556 | Culture fibroblasts |
| Phosphate buffered saline solution | Gibco | C10010500BT | Culture medium solution |
| Rabbit (DAIE) mAB IgG XR (R) Isotuge Control (PE) | Cell Signaling Technology | 5742S | As a control for flow cytometry |
| Round coverslip | Biosharp | 801007 | Cell culture |
| Triton X 100 | Solarbio | T8200 | Punch holes in the cell membrane |
| Trypsin-EDTA | Gibco | 25200072 | Used for passaging cells |
| Vimentin antibody | Abcam | ab8978 | First antibody for immunofluorescence staining assay |
Références
- Zhu, Y. Q., et al. Genome-wide analysis of Chinese keloid patients identifies novel causative genes. Annals Of Translational Medicine. 10 (16), 883 (2022).
- Feng, F., et al. Biomechanical regulatory factors and therapeutic targets in keloid fibrosis. Frontiers in Pharmacology. 13, 906212 (2022).
- Cohen, A. J., Nikbakht, N., Uitto, J. Keloid disorder: Genetic basis, gene expression profiles, and immunological modulation of the fibrotic processes in the skin. Cold Spring Harbor Perspectives in Biology. , (2022).
- Wang, W., et al. Current advances in the selection of adjuvant radiotherapy regimens for keloid. Frontiers in Medicine. 9, 1043840 (2022).
- Ghadiri, S. J., Kloczko, E., Flohr, C. Topical treatments in the management of keloids and hypertrophic scars: A critically appraised topic. British Journal of Dermatology. 187 (6), 855-856 (2022).
- Neves, L. M. G., Wilgus, T. A., Bayat, A. In vitro, ex vivo, and in vivo approaches for investigation of skin scarring: Human and animal models. Advances in Wound Care. 12 (2), 97-116 (2023).
- Supp, D. M. Animal models for studies of keloid scarring. Advances in Wound Care. 8 (2), 77-89 (2019).
- Künzel, S. R., et al. Ultrasonic-augmented primary adult fibroblast isolation. Journal of Visualized Experiments. (149), e59858 (2019).
- He, Y., et al. An improved explants culture method: Sustainable isolation of keloid fibroblasts with primary characteristics. Journal of Cosmetic Dermatology. 21 (12), 7131-7139 (2022).
- Philippeos, C., et al. Spatial and single-cell transcriptional profiling identifies functionally distinct human dermal fibroblast subpopulations. Journal of Investigative Dermatology. 138 (4), 811-825 (2018).
- Li, L., et al. Hydrogen sulfide suppresses skin fibroblast proliferation via oxidative stress alleviation and necroptosis inhibition. Medicine and Cellular Longevity. 2022, 7434733 (2022).
- Zhou, B. Y., et al. Nintedanib inhibits keloid fibroblast functions by blocking the phosphorylation of multiple kinases and enhancing receptor internalization. Acta Pharmacologica Sinica. 41 (9), 1234-1245 (2020).
- Wang, X. M., Liu, X. M., Wang, Y., Chen, Z. Y. Activating transcription factor 3 (ATF3) regulates cell growth, apoptosis, invasion and collagen synthesis in keloid fibroblast through transforming growth factor beta (TGF-beta)/SMAD signaling pathway. Bioengineered. 12 (1), 117-126 (2021).
- Sato, C., et al. Conditioned medium obtained from amnion-derived mesenchymal stem cell culture prevents activation of keloid fibroblasts. Plastic and Reconstructive Surgery. 141 (2), 390-398 (2018).
- Li, J., et al. Long-term explant culture: An improved method for consistently harvesting homogeneous populations of keloid fibroblasts. Bioengineered. 13 (1), 1565-1574 (2022).
- Wang, Q., et al. Altered glucose metabolism and cell function in keloid fibroblasts under hypoxia. Redox Biology. 38, 101815 (2021).
- Fan, C., et al. Single-cell transcriptome integration analysis reveals the correlation between mesenchymal stromal cells and fibroblasts. Frontiers in Genetics. 13, 798331 (2022).
- Yao, L., et al. Temporal control of PDGFRα regulates the fibroblast-to-myofibroblast transition in wound healing. Cell Reports. 40 (7), 111192 (2022).
- Domdey, M., et al. Consecutive dosing of UVB irradiation induces loss of ABCB5 expression and activation of EMT and fibrosis proteins in limbal epithelial cells similar to pterygium epithelium. Stem Cell Research. 40, 102936 (2022).
- Lin, Z., et al. Renal tubular epithelial cell necroptosis promotes tubulointerstitial fibrosis in patients with chronic kidney disease. FASEB Journal. 36 (12), e22625 (2022).
- Korosec, A., et al. Lineage identity and location within the dermis determine the function of papillary and reticular fibroblasts in human skin. Journal of Investigative Dermatology. 139 (2), 342-351 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon