Method Article
Анализ хлорорганических пестицидов в образце почвы модифицированным подходом QuEChERS с использованием формиата аммония
В этой статье
Резюме
Настоящий протокол описывает использование формиата аммония для фазового разделения в QuEChERS вместе с газовой хроматографией-масс-спектрометрией для успешного определения остатков хлорорганических пестицидов в образце почвы.
Аннотация
В настоящее время метод QuEChERS представляет собой наиболее широко используемый протокол пробоподготовки во всем мире для анализа остатков пестицидов в широком спектре матриц как в официальных, так и в неофициальных лабораториях. Метод QuEChERS с использованием формиата аммония ранее оказался выгодным по сравнению с оригинальной и двумя официальными версиями. С одной стороны, простого добавления 0,5 г формиата аммония на грамм образца достаточно для индуцирования разделения фаз и достижения хороших аналитических показателей. С другой стороны, формиат аммония снижает потребность в техническом обслуживании в рутинных анализах. Здесь был применен модифицированный метод QuEChERS с использованием формиата аммония для одновременного анализа остатков хлорорганических пестицидов (OCP) в сельскохозяйственных почвах. В частности, 10 г образца гидратировали 10 мл воды, а затем экстрагировали 10 мл ацетонитрила. Далее фазовое разделение проводили с использованием 5 г формиата аммония. После центрифугирования супернатант подвергали дисперсионной твердофазной стадии очистки экстракции безводным сульфатом магния, первичным вторичным амином и октадецилсилананом. В качестве аналитического метода использовалась газовая хроматография-масс-спектрометрия. Метод QuEChERS с использованием формиата аммония демонстрируется в качестве успешной альтернативы для извлечения остатков OCP из образца почвы.
Введение
Необходимость увеличения производства продуктов питания привела к интенсивному и широкому использованию пестицидов во всем мире в течение последних нескольких десятилетий. Пестициды применяются к сельскохозяйственным культурам для защиты их от вредителей и повышения урожайности, но их остатки обычно попадают в почвенную среду, особенно в сельскохозяйственных районах1. Кроме того, некоторые пестициды, такие как хлорорганические пестициды (OCP), имеют очень стабильную структуру, поэтому их остатки не разлагаются легко и сохраняются в почве в течение длительного времени2. Как правило, почва обладает высокой способностью накапливать остатки пестицидов, особенно когда она имеет высокое содержание органического вещества3. В результате почва является одним из экологических отсеков, наиболее загрязненных остатками пестицидов. Например, одно из полных исследований на сегодняшний день показало, что 83% из 317 сельскохозяйственных почв со всего Европейского Союза были загрязнены одним или несколькими остатками пестицидов4.
Загрязнение почвы остатками пестицидов может повлиять на нецелевые виды, функцию почвы и здоровье потребителей через пищевую цепь из-за высокой токсичности остатков 5,6. Следовательно, оценка остатков пестицидов в почвах имеет важное значение для оценки их потенциального негативного воздействия на окружающую среду и здоровье человека, особенно в развивающихся странах из-за отсутствия строгих правил использования пестицидов7. Это делает анализ пестицидов с несколькими остатками все более важным. Однако быстрый и точный анализ остатков пестицидов в почвах является сложной задачей из-за большого количества мешающих веществ, а также низкого уровня концентрации и разнообразных физико-химических свойств этих аналитов4.
Из всех методов анализа остатков пестицидов метод QuEChERS стал самым быстрым, простым, дешевым, эффективным, надежным и безопасным вариантом8. Метод QuEChERS состоит из двух этапов. На первом этапе выполняется микромасштабная экстракция, основанная на разделении путем засолки между водным и ацетонитрильным слоем. На втором этапе осуществляется процесс очистки с использованием дисперсионной твердофазной экстракции (dSPE); этот метод использует небольшие количества нескольких комбинаций пористых сорбентов для удаления матричных мешающих компонентов и преодолевает недостатки обычного SPE9. Следовательно, QuEChERS является экологически чистым подходом с небольшим количеством растворителей / химических веществ, поступающих в отходы, который обеспечивает очень точные результаты и сводит к минимуму потенциальные источники случайных и систематических ошибок. Фактически, он был успешно применен для высокопроизводительного рутинного анализа сотен пестицидов, с сильным применением почти во всех типах экологических, агропищевых и биологических образцов 8,10. Эта работа направлена на применение и проверку новой модификации метода QuEChERS, который был ранее разработан и связан с GC-MS для анализа OCP в сельскохозяйственных почвах.
протокол
1. Подготовка стоковых решений
ПРИМЕЧАНИЕ: Рекомендуется носить нитриловые перчатки, лабораторный халат и защитные очки в течение всего протокола.
- Приготовьте стандартный раствор в ацетоне по 400 мг/л из коммерческой смеси OCP (см. Таблицу материалов) по 2000 мг/л в гексане:толуоле (1:1) в объемной колбе объемом 25 мл. В таблице 1 показаны все выбранные OCP.
- Последующие исходные растворы готовят в ацетоне в концентрациях 50 мг/л, 1 мг/л и 0,08 мг/л в объемных колбах по 10 мл и хранят их во флаконах из янтарного стекла при −18 °C.
ПРИМЕЧАНИЕ: Одни и те же решения могут использоваться на протяжении всей работы, но важно хранить их в этих условиях сразу после каждого использования. - Готовят исходные растворы в ацетоне в концентрациях 20 мг/л и 0,4 мг/л из коммерческого стандарта 4,4'-DDE-d8 при 100 мг/л в ацетоне в объемных колбах по 10 мл и хранят во флаконах из янтарного стекла при −18 °C. Используйте 4,4'-DDE-d8 в качестве внутреннего стандарта (IS).
2. Сбор образцов
- Соберите примерно 0,5 кг верхнего 10-сантиметрового слоя сельскохозяйственной почвы в стеклянную емкость. Почвенный объект данного исследования был собран в традиционной сельскохозяйственной зоне посевов картофеля.
ПРИМЕЧАНИЕ: Был проведен отбор проб поверхности шпателем. Однако глубина почвы могла влиять на ее физико-химические характеристики. Поэтому, если содержание органического углерода меняется с глубиной, необходимо брать пробы на разных глубинах. - Возьмите образец почвы в лабораторию, просейте его ситом диаметром 1 мм и храните до анализа при 4 °C в янтарном стеклянном контейнере.
ПРИМЕЧАНИЕ: Один и тот же образец почвы может быть использован на протяжении всей работы, но важно хранить его в этих условиях сразу после каждого использования.
3. Пробоподготовка модифицированным методом QuEChERS с использованием формиата аммония
ПРИМЕЧАНИЕ: На рисунке 1 показано схематическое представление модифицированного метода QuEChERS.
- Взвесьте 10 г образца почвы в центрифужной пробирке объемом 50 мл и добавьте 50 мкл раствора ИС при 20 мг/л для получения 100 мкг/кг. Для целей рекуперации также добавляют растворы пестицидов, приготовленные на стадии 1.2, чтобы получить 10 мкг/кг, 50 мкг/кг и 200 мкг/кг (n = 3 каждый).
- Встряхните трубку с помощью вихря в течение 30 с, чтобы лучше интегрировать шип в образец.
- Добавьте 10 мл воды. Встряхните трубку с помощью автоматического шейкера при 10 х г в течение 5 мин.
- Добавьте 10 мл ацетонитрила. Снова встряхните пробирку по 10 х г в течение 5 мин.
- Добавьте 5 г формиата аммония (см. Таблицу материалов), энергично встряхните трубку в течение 1 мин вручную и центрифугу при 1 800 х г в течение 5 мин.
- Переложить 1 мл экстракта ацетонитрила в центрифужную трубку объемом 2 мл, содержащую 150 мг безводного MgSO4, 50 мг первично-вторичного амина (ПСА) и 50 мг октадецилсилана (С18) (см. Таблицу материалов) для целей очистки путем дисперсионно-твердофазной экстракции (d-SPE)8, вихря в течение 30 с и центрифуги при 1 800 х г в течение 5 мин.
- Перенесите 200 мкл экстракта в надлежащим образом маркированный флакон автосамплера с расплавленной вставкой объемом 300 мкл и выполните инструментальный анализ с использованием системы GC-MS (этап 4).
ПРИМЕЧАНИЕ: Матричную калибровку проводят на тех же этапах, что и ранее с использованием пустых экстрактов, но 5 мл супернатанта очищают в пробирках по 15 мл на стадии d-SPE (стадия 3.6), и шип и растворы IS не добавляют до стадии 3.7. Добавьте калибровочные стандартные растворы во флаконы автопробоотборника для получения 5 мкг/кг, 10 мкг/кг, 50 мкг/кг, 100 мкг/кг, 200 мкг/кг и 400 мкг/кг, испаритесь до сухости и добавьте 200 мкл экстрактов матрицы.
4. Инструментальный анализ по ГК-МС
- Выполнение анализа GC-MS с использованием системы GC-MS с одним квадрупольным масс-спектрометром и интерфейсом электронной ионизации (−70 эВ) (см. Таблицу материалов).
- Установите линию передачи MS при 280 °C и источник ионов при 230 °C.
- Используйте 5%-фенил-метилполисилоксан 30 м x 250 мкм x 0,25 мкм колонку (см. Таблицу материалов) и сверхвысокой чистоты He в качестве газа-носителя при постоянном расходе 1,2 мл/мин.
- Сначала выдерживайте духовку GC при температуре 60 °C в течение 2 мин, затем увеличьте температуру до 160 °C при 25 °C/мин и подержите в течение 1 минуты. Затем увеличьте температуру до 175 °C при 15 °C/мин и подержите в течение 3 минут. Затем увеличьте до 220 °C при 40 °C/мин и подержите в течение 3 минут. Снова увеличьте до 250 °C при 30 °C/мин и подержите в течение 2 минут. Наконец, доведите температуру до 310 °C при 30 °C/мин и подержите в течение 2 минут. Общее время анализа составляет 22.125 мин.
- Проведите полную автонастройку и проверку воздуха и воды MS перед каждой последовательностью.
- Откройте программу сбора MassHunter, которая контролирует все параметры системы GC-MS.
ПРИМЕЧАНИЕ: Приборная система по умолчанию включает в себя программное обеспечение для сбора MassHunter. - Откройте опцию «Просмотр» на панели инструментов и нажмите « Управление вакуумом», нажмите « Настроить» и нажмите « Автонастройка». Автонастройка завершится через несколько минут.
- Откройте опцию «Вид» и нажмите « Управление приборами».
- Нажмите кнопку Да и сохраните новый файл настроек для автонастройки.
- Откройте опцию «Вид» на панели инструментов и нажмите « Управление вакуумом», снова нажмите « Настроить » и нажмите « Проверка воздуха и воды». Проверка воздуха и воды закончится через несколько секунд.
- Откройте опцию «Вид» и нажмите « Управление приборами».
- Нажмите «Да» и сохраните новый файл настроек для проверки воздуха и воды.
- Откройте программу сбора MassHunter, которая контролирует все параметры системы GC-MS.
- Выполняйте впрыск с помощью автопробоотборника (см. Таблицу материалов) при 280 °C в сплит-режиме, сохраняя объем впрыска 1,5 мкл. После 0,75 мин впрыска откройте сплит со скоростью потока 40 мл/мин.
ПРИМЕЧАНИЕ: Между инъекциями шприц объемом 10 мкл необходимо промыть три раза этилацетатом и три раза циклогексаном. Все инъекции делаются в двух экземплярах. - Анализ анализируемых веществ в выбранном режиме мониторинга ионов (SIM). Это стандартный режим, используемый в системах MS с одним квадруполем.
ПРИМЕЧАНИЕ: В таблице 1 показано время удержания (мин) и параметры количественной оценки, основанные на использовании одного количественного определения и двух идентификационных ионов для OCP и IS. Количественный анализ основан на соотношении пиковой площади иона количественного определения к иону ИС.
5. Сбор данных
- Откройте программу сбора MassHunter, которая контролирует все параметры системы GC-MS.
- Откройте параметр «Последовательность» на панели инструментов и отредактируйте последовательность, включая имя образца, номер флакона, количество инъекций, инструментальный метод и имя создаваемого файла. Добавьте столько строк, сколько необходимо.
- Нажмите кнопку ОК и сохраните новую последовательность.
- Снова откройте опцию «Последовательность» на панели инструментов и нажмите «Запустить последовательность» в раскрывающемся меню. Откроется новое окно для подтверждения метода внедрения и папки, в которой будут сохранены образцы. Нажмите кнопку Запустить последовательность еще раз, и начнется инъекция.
Результаты
Полная валидация аналитического метода была выполнена с точки зрения линейности, матричных эффектов, восстановления и повторяемости.
Для оценки линейности использовались матричные калибровочные кривые с шипованными пустыми образцами при шести уровнях концентрации (5 мкг/кг, 10 мкг/кг, 50 мкг/кг, 100 мкг/кг, 200 мкг/кг и 400 мкг/кг). Коэффициенты определения (R2) были выше или равны 0,99 для всех OCP. Самый низкий калибровочный уровень (LCL) был установлен на уровне 5 мкг/кг, что соответствует максимально допустимому пределу, установленному на уровне 10 мкг/кг для целей мониторинга в пищевых применениях11.
Оценка матричного эффекта проводилась путем сравнения наклонов калибровочных кривых OCP в чистом растворителе и матричных калибровочных кривых. Матричный эффект был рассчитан с использованием следующего уравнения12:
Матричный эффект (%) = (наклон калибровочной кривой с матричным соответствием − наклон калибровочной кривой на основе чистого растворителя)/(наклон калибровочной кривой на основе чистого растворителя) × 100.
На рисунке 2 показано распределение матричного эффекта для OCP, изученных путем применения модифицированного метода QuEChERS с использованием формиата аммония к образцам почвы. Процент положительного матричного эффекта соответствует усилению сигнала, в то время как отрицательный процент означает, что происходит подавление сигнала. В частности, (1) значения в диапазоне от −20% до 20% соответствуют эффекту мягкой матрицы; (2) значения в диапазоне от −20% до -50% или от 20% до 50% соответствуют среднему матричному эффекту; (3) и значения выше 50% или ниже −50% означают, что существует сильный матричный эффект. Как было отмечено, больше OCP страдали от мягких или средних матричных эффектов, в то время как меньше OCP страдали от сильных матричных эффектов.
Рекуперацию и повторяемость оценивали путем проб с пестицидами с тремя уровнями концентрации (10 мкг/кг, 50 мкг/кг и 200 мкг/кг). На рисунке 3 показаны общие значения извлечения и значения относительного стандартного отклонения (RSD) для всех пестицидов и уровней всплеска (n = 9). Как можно наблюдать, подавляющее большинство изученных OCP представили средние проценты извлечения в диапазоне 70-120%, при этом RSD ниже 20%, за исключением гептахлора, эндрина и β-эндосульфана, которые дали несколько более высокие средние извлечения.

Рисунок 1: Представление модифицированного метода QuEChERS с использованием формиата аммония для извлечения остатков пестицидов из образца почвы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
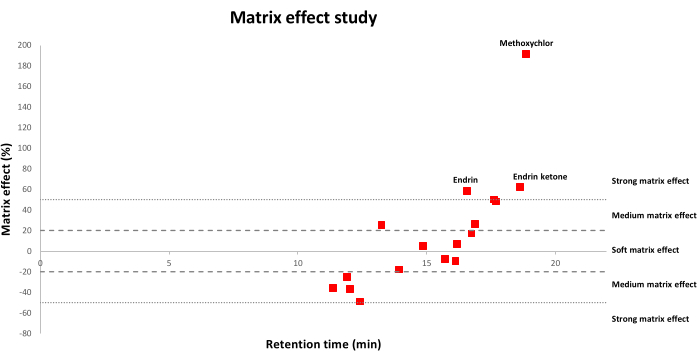
Рисунок 2: Распределение матричных эффектов по времени удержания (мин) для 17 OCP. Эффект мягкой матрицы соответствует значениям от −20% до 20%; матричный эффект среды соответствует значениям в диапазоне от −20% до −50% или от 20% до 50%; сильный матричный эффект соответствует значениям, превышающим 50% или менее −50%. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Среднее извлечение для 17 OCP после скачков 10 мкг/кг, 50 мкг/кг и 200 мкг/кг (n = 9) в образце почвы. Количество аналитов в пределах допустимого диапазона извлечения (70%-120%) и RSD (<20%) наряду с теми, которые помечены за пределами этого диапазона. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Аналит | Время хранения (мин. | Квантификатор ион | Квалификатор ион 1 | Квалификатор ион 2 |
| α-БХК | 11.35 | 181 | 219 | 111 |
| β-БХК | 11.90 | 181 | 219 | 109 |
| Линдан | 12.01 | 181 | 183 | 219 |
| δ-БХК | 12.39 | 181 | 219 | 111 |
| Гептахлор | 13.24 | 272 | 100 | 274 |
| Альдрин | 13.94 | 263 | 66 | 265 |
| Эпоксид гептахлора | 14.86 | 353 | 355 | 81 |
| α-эндосульфан | 15.71 | 241 | 239 | 195 |
| 4,4'-DDE-d8 (ИС) | 16.09 | 254 | 184 | 326 |
| 4,4'-DDE | 16.12 | 246 | 318 | 248 |
| Дильдрин | 16.18 | 79 | 263 | 81 |
| Эндрин | 16.57 | 263 | 317 | 345 |
| β-эндосульфан | 16.73 | 195 | 241 | 159 |
| 4,4'-DDD | 16.89 | 235 | 237 | 165 |
| Эндосульфан сульфат | 17.61 | 387 | 227 | 272 |
| 4,4'-ДДТ | 17.65 | 235 | 237 | 165 |
| Эндрин кетон | 18.64 | 317 | 67 | 315 |
| Метоксихлор | 18.86 | 227 | 228 | 212 |
Таблица 1: Время удержания (мин) и количественные параметры для анализа GC-MS OCP. Альфа-бензолгексахлорид (α-BHC); бета-бензолгексахлорид (β-BHC); Линдан; дельта-бензолгексахлорид (δ-БХК); Гептахлор; альдрин; эпоксид гептахлора; α-эндосульфан; 4,4'-дихлордифенилдихлорэтилен-d8 (4,4'-DDE-d8) (IS); 4,4'-дихлордифенилдихлорэтилен (4,4'-ДДЭ); Дильдрин; Эндрин; β-эндосульфан; 4,4'-дихлордифенилдихлорэтан (4,4'-DDD); эндосульфана сульфат; 4,4'-дихлордифенилтрихлорэтан (4,4'-ДДТ); эндрин кетон; метоксихлор.
Обсуждение
Оригинальнаяверсия 9 и две официальные версии13,14 метода QuEChERS используют сульфат магния вместе с солями хлорида натрия, ацетата или цитрата для содействия разделению смеси ацетонитрила и воды во время экстракции. Однако эти соли, как правило, осаждаются в виде твердых тел на поверхностях в источнике масс-спектрометрии (МС), что вызывает необходимость в усилении поддержки методов жидкостной хроматографии (LC)-MS. Что касается преодоления этих недостатков, González-Curbelo et al.15 сообщили, что более летучий формиат аммония хорошо индуцирует разделение фаз и извлечение остатков пестицидов как для LC-, так и для GC-тандемной масс-спектрометрии (MS/MS). В последующих исследованиях также использовалось 0,5 г формиата аммония на грамм образца для извлечения остатков пестицидов из различных комплексных матриц 16,17,18,19. Кроме того, было показано, что использование формиата аммония обеспечивает более низкие количества совместно экстрагированного материала20, что оправдывает его использование для методов, основанных на GC-MS. В настоящем исследовании впервые сообщается об этой версии для анализа остатков пестицидов в почвах21.
Анализ GC остатков пестицидов в сложных матрицах, таких как почвы, имеет некоторые ограничения из-за действия совместно экстрагированных компонентов матрицы на инструментальную реакцию пестицидов, что вызывает неточное определение и более низкую чувствительность22,23. Таким образом, был внесен ряд улучшений для минимизации эффекта матрицы, включая оптимизированные этапы очистки21. Тем не менее, матричный эффект все же имеет место и должен быть максимально скорректирован. В этом смысле матричная калибровка была основным используемым подходом, поскольку она очень практична для компенсации усиления хроматографического сигнала по сравнению с чистыми растворителями24. Таким образом, в данном исследовании линейность оценивали путем построения калибровочных кривых в чистом ацетонитриле и с использованием почвенных экстрактов, а значенияR2 выше или равны 0,99 для всех OCP были получены с использованием обоих подходов. Однако при сравнении обеих калибровочных кривых были обнаружены заметные матричные эффекты в диапазоне от –49% до 191% (рисунок 2). Хотя количество пестицидов, которые пострадали от сильного матричного эффекта, составляло всего 3 из 17 (эндрин, эндрин кетон и метоксихлор), последующие исследования проводились с использованием матричных калибровочных кривых для компенсации матричных эффектов в большей степени.
Максимальные предельные значения остатков (МДОУ) не были установлены для остатков пестицидов в почвах, но для всех OCP был установлен LCL в размере 5 мкг/кг, что ниже очень требовательного стандарта MRL, установленного на уровне 10 мкг/кг международным законодательством для анализа остатков пестицидов в агропродовольственных продуктах (Постановление 396/2005)11. Кроме того, LCL 5 мкг/кг обеспечивал отношение сигнал/шум (S/N) около 10 для всех OCP. Высокая чувствительность этого метода аналогична или даже лучше, чем у других исследований, которые также анализировали OCP в почвах с использованием метода QuEChERS, за которым следует GC-MS. Например, в одном исследовании 34 OCP были проанализированы с использованием официальной версии метода QuEChERS, использующего цитратный буфер, а пределы количественной оценки (LOQ) были равны или выше 7 мкг/кг25. В частности, значения LOQ α-BHC, β-BHC, линдана и δ-BHC составляли от 206 мкг/кг до 384 мкг/кг. В другой работе линдан и дильдрин были проанализированы с использованием той же версии метода QuEChERS, и были получены значения LOQ 42 мкг/кг и 292 мкг/кг, соответственно26. Аналогичным образом, другая исследовательская работа также определила альдрин и гептахлор с использованием QuEChERS и GC-MS со значениями LOQ 13 и 23 мкг / кг соответственно27.
Оценка восстановления и воспроизводимости была разработана на трех уровнях концентрации (низкий, средний и высокий) в трех экземплярах (n = 9). С этой целью общие значения извлечения были определены путем сравнения пиковых площадей пестицидов/IS (4,4'-DDE-d8), полученных из образцов почвы, полученных в начале применения метода QuEChERS с использованием формиата аммония с матричной калибровкой. Во всех случаях каждая реплика вводилась дважды в одной и той же последовательности. Следует отметить, что использование ИС, изотопно меченого стандарта, позволяет компенсировать возможные потери пестицидов, которые имеют место в течение всей процедуры, а также матричный эффект и/или возможную изменчивость в приборе. Согласно результатам, большинство пестицидов соответствовали критериям приемлемости 70%-120% значений извлечения с RSD ≤20% на каждом пиковом уровне28, что продемонстрировало эффективность и повторяемость метода. Тем не менее, общие значения извлечения (n = 9) были несколько выше 120% для гептахлора (122%), эндрина (121%) и β-эндосульфана (130%), хотя они были последовательными (RSDs <13%). В этом смысле, учитывая общие значения восстановления на трех пиковых уровнях, установлен критерий приемлемости 30-140% со значениями RSD ≤20%28.
В заключение, метод QuEChERS с использованием формиата аммония в сочетании с GC-MS может успешно определять OCP в образцах сельскохозяйственной почвы. В этом исследовании было показано, что простое добавление 5 г формиата аммония для индуцирования разделения фаз между слоями воды и ацетонитрила обеспечивает подходящую экстракцию с высоким извлечением выбранных пестицидов. Тем не менее, матричный эффект продолжал иметь место, поэтому другие подходы, такие как добавление анализируемых протекторов, должны быть изучены в последующих работах. В любом случае, эта альтернатива официальным версиям QuEChERS может быть использована для предотвращения нежелательных твердых веществ, осажденных в аналитической системе из-за использования солей магния и натрия, особенно в рутинном анализе на основе LC-MS. В последнем случае это было бы еще более интересно, поскольку формиат аммония является вспомогательным средством для ионизации при положительной электрораспылительной ионизации и может усиливать образование аддуктов аммония вместо аддуктов натрия.
Раскрытие информации
У меня нет конфликтов интересов, которые можно было бы раскрыть.
Благодарности
Я хотел бы поблагодарить Хавьера Эрнандеса-Борхеса и Сесилию Ортегу-Самору за их неоценимую поддержку. Я также хочу поблагодарить Universidad EAN и Universidad de La Laguna.
Материалы
| Name | Company | Catalog Number | Comments |
| 15 mL disposable glass conical centrifuge tubes | PYREX | 99502-15 | |
| 2 mL centrifuge tubes | Eppendorf | 30120094 | |
| 50 mL centrifuge tubes with screw caps | VWR | 21008-169 | |
| 5977B mass-selective detector | Agilent Technologies | 1617R019 | |
| 7820A gas chromatography system | Agilent Technologies | 16162016 | |
| Acetone | Supelco | 1006582500 | |
| Acetonitrile | VWR | 83642320 | |
| Ammonium formate | VWR | 21254260 | |
| Automatic shaker KS 3000 i control | IKA | 3940000 | |
| Balance | Sartorius Lab Instruments Gmbh & Co | ENTRIS224I-1S | |
| Bondesil-C18, 40 µm | Agilent Technologies | 12213012 | |
| Bondesil-PSA, 40 µm | Agilent Technologies | 12213024 | |
| Cyclohexane | VWR | 85385320 | |
| EPA TCL pesticides mix | Sigma Aldrich | 48913 | |
| Ethyl acetate | Supelco | 1036492500 | |
| G4567A automatic sampler | Agilent Technologies | 19490057 | |
| HP-5ms Ultra Inert (5%-phenyl)-methylpolysiloxane 30 m x 250 µm x 0.25 µm column | Agilent Technologies | 19091S-433UI | |
| Magnesium sulfate monohydrate | Sigma Aldrich | 434183-1KG | |
| Mega Star 3.R centrifuge | VWR | 521-1752 | |
| Milli-Q gradient A10 | Millipore | RR400Q101 | |
| p,p'-DDE-d8 | Dr Ehrenstorfer | DRE-XA12041100AC | |
| Pipette tips 2 - 200 µL | BRAND | 732008 | |
| Pipette tips 5 mL | BRAND | 702595 | |
| Pipette tips 50 - 1000 uL | BRAND | 732012 | |
| Pippette Transferpette S variabel 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variabel 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variabel 20 - 200 µL | BRAND | 704778 | |
| Pippette Transferpette S variabel 500 - 5000 µL | BRAND | 704782 | |
| Vials with fused-in insert | Sigma Aldrich | 29398-U | |
| OCPs | CAS registry number | ||
| α-BHC | 319-84-6 | ||
| β-BHC | 319-85-7 | ||
| Lindane | 58-89-9 | ||
| δ-BHC | 319-86-8 | ||
| Heptachlor | 76-44-8 | ||
| Aldrin | 309-00-2 | ||
| Heptachlor epoxide | 1024-57-3 | ||
| α-Endosulfan | 959-98-8 | ||
| 4,4'-DDE-d8 (IS) | 93952-19-3 | ||
| 4,4'-DDE | 72-55-9 | ||
| Dieldrin | 60-57-1 | ||
| Endrin | 72-20-8 | ||
| β-Endosulfan | 33213-65-9 | ||
| 4,4'-DDD | 72-54-8 | ||
| Endosulfan sulfate | 1031-07-8 | ||
| 4,4'-DDT | 50-29-3 | ||
| Endrin ketone | 53494-70-5 | ||
| Methoxychlor | 72-43-5 |
Ссылки
- Sabzevari, S., Hofman, J. A worldwide review of currently used pesticides' monitoring in agricultural soils. Science of The Total Environment. 812, 152344 (2022).
- Tzanetou, E. N., Karasali, H. A. Comprehensive review of organochlorine pesticide monitoring in agricultural soils: The silent threat of a conventional agricultural past. Agriculture. 12 (5), 728 (2022).
- Farenhorst, A. Importance of soil organic matter fractions in soil-landscape and regional assessments of pesticide sorption and leaching in soil. Soil Science Society of America Journal. 70 (3), 1005-1012 (2006).
- Silva, V., et al. Pesticide residues in European agricultural soils - A hidden reality unfolded. Science of The Total Environment. 653, 1532-1545 (2019).
- Vischetti, C., et al. Sub-lethal effects of pesticides on the DNA of soil organisms as early ecotoxicological biomarkers. Frontiers in Microbiology. 11, 1892 (2020).
- Alengebawy, A., Abdelkhalek, S. T., Qureshi, S. R., Wang, M. -. Q. Heavy metals and pesticides toxicity in agricultural soil and plants: Ecological risks and human health implications. Toxics. 9 (3), 42 (2021).
- Zikankuba, V. L., Mwanyika, G., Ntwenya, J. E., James, A. Pesticide regulations and their malpractice implications on food and environment safety. Cogent Food & Agriculture. 5 (1), 1601544 (2019).
- Varela-Martínez, D. A., González-Sálamo, J., González-Curbelo, M. &. #. 1. 9. 3. ;., Hernández-Borges, J. Quick, Easy, Cheap, Effective, Rugged and Safe (QuEChERS) extraction. Handbooks in Separation Science. , 399-437 (2020).
- Anastassiades, M., Lehotay, S. J., Štajnbaher, D., Schenck, F. J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce. Journal of AOAC International. 86 (2), 412-431 (2003).
- González-Curbelo, M. &. #. 1. 9. 3. ;., et al. Evolution and applications of the QuEChERS method. Trends in Analytical Chemistry. 71, 169-185 (2015).
- European Union. European Regulation (EC) NO 396/2005 of the European Parliament and of the Council of 23 February 2005 on maximum residue levels of pesticides in or on food and feed of plant and animal origin and amending Council Directive 91/414/EEC. Official Journal of the European Union. 70, 1-16 (2005).
- Kwon, H., Lehotay, S. J., Geis-Asteggiante, L. Variability of matrix effects in liquid and gas chromatography-mass spectrometry analysis of pesticide residues after QuEChERS sample preparation of different food crops. Journal of Chromatography A. 1270, 235-245 (2012).
- Lehotay, S. J., et al. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate: Collaborative study. Journal of AOAC International. 90 (2), 485-520 (2007).
- European Committee for Standardization (CEN). Standard Method EN 15662. Food of plant origin-Determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and clean-up by dispersive SPE-QuEChERS method. European Committee for Standardization. , (2008).
- González-Curbelo, M. &. #. 1. 9. 3. ;., Lehotay, S. J., Hernández-Borges, J., Rodríguez-Delgado, M. &. #. 1. 9. 3. ;. Use of ammonium formate in QuEChERS for high-throughput analysis of pesticides in food by fast, low-pressure gas chromatography and liquid chromatography tandem mass spectrometry. Journal of Chromatography A. 1358, 75-84 (2014).
- Han, L., Sapozhnikova, Y., Lehotay, S. J. Method validation for 243 pesticides and environmental contaminants in meats and poultry by tandem mass spectrometry coupled to low-pressure gas chromatography and ultrahigh-performance liquid chromatography. Food Control. 66, 270-282 (2016).
- Lehotay, S. J., Han, L., Sapozhnikova, Y. Automated mini-column solid-phase extraction clean-up for high-throughput analysis of chemical contaminants in foods by low-pressure gas chromatography-tandem mass spectrometry. Chromatographia. 79 (17), 1113-1130 (2016).
- Lehotay, S. J. Possibilities and limitations of isocratic fast liquid chromatography-tandem mass spectrometry analysis of pesticide residues in fruits and vegetables. Chromatographia. 82 (1), 235-250 (2019).
- Han, L., Matarrita, J., Sapozhnikova, Y., Lehotay, S. J. Evaluation of a recent product to remove lipids and other matrix co-extractives in the analysis of pesticide residues and environmental contaminants in foods. Journal of Chromatography A. 1449, 17-29 (2016).
- Varela-Martínez, D. A., González-Curbelo, M. &. #. 1. 9. 3. ;., González-Sálamo, J., Hernández-Borges, J. Analysis of pesticides in cherimoya and gulupa minor tropical fruits using AOAC 2007.1 and ammonium formate QuEChERS versions: A comparative study. Microchemical Journal. 157, 104950 (2020).
- González-Curbelo, M. &. #. 1. 9. 3. ;., Varela-Martínez, D. A., Riaño-Herrera, D. A. Pesticide-residue analysis in soils by the QuEChERS method: A review. Molecules. 27 (13), 4323 (2022).
- Anastassiades, M., Maštovská, K., Lehotay, S. Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides. Journal of Chromatography A. 1015 (1-2), 163-184 (2003).
- Maštovská, K., Lehotay, S., Anastassiades, M. Combination of analyte protectants to overcome matrix effects in routine GC analysis of pesticide residues in food matrixes. Analytical Chemistry. 77 (24), 8129-8137 (2005).
- Rahman, M., Abd El-Aty, A., Shim, J. Matrix enhancement effect: A blessing or a curse for gas chromatography? - A review. Analytica Chimica Acta. 801, 14-21 (2013).
- Rouvire, F., Buleté, A., Cren-Olivé, C., Arnaudguilhem, C. Multiresidue analysis of aromatic organochlorines in soil by gas chromatography-mass spectrometry and QuEChERS extraction based on water/dichloromethane partitioning. Comparison with accelerated solvent extraction. Talanta. 93, 336-344 (2012).
- Lesueur, C., Gartner, M., Mentler, A., Fuerhacker, M. Comparison of four extraction methods for the analysis of 24 pesticides in soil samples with gas chromatography-mass spectrometry and liquid chromatography-ion trap-mass spectrometry. Talanta. 75 (1), 284-293 (2008).
- Ðurović-Pejčev, R. D., Bursić, V. P., Zeremski, T. M. Comparison of QuEChERS with traditional sample preparation methods in the determination of multiclass pesticides in soil. Journal of AOAC International. 102 (1), 46-51 (2019).
- European Commission. SANTE/11312/2021. Guidance document on analytical quality control and method validation procedures for pesticide residues analysis in food and feed. European Commission. , (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены