Method Article
Análise de pesticidas organoclorados em uma amostra de solo por uma abordagem QuEChERS modificada usando formato de amônio
Neste Artigo
Resumo
O presente protocolo descreve a utilização de formato de amônio para particionamento de fases em QuEChERS, juntamente com cromatografia gasosa-espectrometria de massa, para determinar com sucesso resíduos de pesticidas organoclorados em uma amostra de solo.
Resumo
Atualmente, o método QuEChERS representa o protocolo de preparação de amostras mais utilizado em todo o mundo para a análise de resíduos de pesticidas em uma ampla variedade de matrizes, tanto em laboratórios oficiais quanto não oficiais. O método QuEChERS usando formato de amônio já provou ser vantajoso em comparação com as versões original e oficial. Por um lado, a simples adição de 0,5 g de formato de amónio por grama de amostra é suficiente para induzir a separação de fases e alcançar um bom desempenho analítico. Por outro lado, o formato de amônio reduz a necessidade de manutenção em análises de rotina. Aqui, um método QuEChERS modificado utilizando formato de amônio foi aplicado para a análise simultânea de resíduos de pesticidas organoclorados (OCP) em solo agrícola. Especificamente, 10 g da amostra foram hidratados com 10 mL de água e, em seguida, extraídos com 10 mL de acetonitrila. Em seguida, a separação de fases foi realizada com 5 g de formato de amônio. Após a centrifugação, o sobrenadante foi submetido a uma etapa de limpeza de extração em fase sólida dispersiva com sulfato de magnésio anidro, amina primária-secundária e octadecilsilano. Cromatografia gasosa-espectrometria de massas foi utilizada como técnica analítica. O método QuEChERS usando formato de amônio é demonstrado como uma alternativa bem-sucedida para extrair resíduos de OCP de uma amostra de solo.
Introdução
A necessidade de aumentar a produção de alimentos levou ao uso intensivo e generalizado de pesticidas em todo o mundo nas últimas décadas. Os pesticidas são aplicados nas lavouras para protegê-las de pragas e aumentar o rendimento das culturas, mas seus resíduos geralmente acabam no ambiente do solo, especialmente nas áreas agrícolas1. Além disso, alguns pesticidas, como os pesticidas organoclorados (OCPs), possuem uma estrutura muito estável, de modo que seus resíduos não se decompõem facilmente e persistem no solo por muito tempo2. Geralmente, o solo tem alta capacidade de acumular resíduos de agrotóxicos, principalmente quando apresenta alto teor de matéria orgânica3. Como resultado, o solo é um dos compartimentos ambientais mais contaminados por resíduos de pesticidas. A título de exemplo, um dos estudos completos até à data constatou que 83% dos 317 solos agrícolas de toda a União Europeia estavam contaminados com um ou mais resíduos de pesticidas4.
A poluição do solo por resíduos de pesticidas pode afetar espécies não visadas, a função do solo e a saúde do consumidor ao longo da cadeia alimentar, devido à alta toxicidade dos resíduos 5,6. Consequentemente, a avaliação de resíduos de pesticidas em solos é essencial para avaliar seus potenciais efeitos negativos sobre o meio ambiente e a saúde humana, particularmente nos países em desenvolvimento, devido à falta de regulamentação rigorosa sobre o uso de pesticidas7. Isso torna a análise de múltiplos resíduos de pesticidas cada vez mais importante. No entanto, a análise rápida e precisa dos resíduos de agrotóxicos nos solos é um desafio difícil devido ao grande número de substâncias interferentes, bem como ao baixo nível de concentração e às diversas propriedades físico-químicas desses analitos4.
De todos os métodos de análise de resíduos de pesticidas, o método QuEChERS tornou-se a opção mais rápida, fácil, barata, eficaz, robusta e segura8. O método QuEChERS envolve duas etapas. Na primeira etapa, é realizada uma extração em microescala baseada na particionamento via salga entre uma camada aquosa e uma de acetonitrila. Na segunda etapa, um processo de limpeza é realizado empregando uma extração dispersiva em fase sólida (dSPE); esta técnica utiliza pequenas quantidades de várias combinações de sorventes porosos para remover componentes que interferem na matriz e supera as desvantagens do SPE convencional9. Assim, o QuEChERS é uma abordagem ambientalmente amigável com pouco solvente / produto químico indo para o desperdício que fornece resultados muito precisos e minimiza fontes potenciais de erros aleatórios e sistemáticos. De fato, tem sido aplicado com sucesso para a análise rotineira de alto rendimento de centenas de agrotóxicos, com forte aplicabilidade em quase todos os tipos de amostras ambientais, agroalimentares e biológicas 8,10. Este trabalho tem como objetivo aplicar e validar uma nova modificação do método QuEChERS que foi previamente desenvolvido e acoplado ao GC-MS para analisar OCPs em solo agrícola.
Protocolo
1. Preparação das soluções-mãe
NOTA: Recomenda-se o uso de luvas nitrílicas, jaleco de laboratório e óculos de segurança durante todo o protocolo.
- Preparar uma solução-mãe em acetona a 400 mg/L a partir de uma mistura comercial de OCP (ver Tabela de Materiais) a 2 000 mg/L em hexano:tolueno (1:1) num balão aferido de 25 ml. A Tabela 1 mostra cada um dos OCPs selecionados.
- Preparar as soluções-mãe subsequentes em acetona nas concentrações de 50 mg/L, 1 mg/L e 0,08 mg/L em frascos volumétricos de 10 ml e guardá-las em frascos para injetáveis de vidro âmbar a -18 °C.
NOTA: As mesmas soluções podem ser usadas durante todo o trabalho, mas é importante armazená-las nessas condições logo após cada uso. - Preparar as soluções-mãe em acetona nas concentrações de 20 mg/L e 0,4 mg/L a partir de um padrão comercial de 4,4'-DDE-d8 a 100 mg/L em acetona em balões aferidos de 10 ml e conservar em frascos para injetáveis de vidro âmbar a -18 °C. Use 4,4'-DDE-d8 como um padrão interno (IS).
2. Coleta de amostras
- Coletar aproximadamente 0,5 kg da camada superior de 10 cm de um solo agrícola em um recipiente de vidro. O solo objeto deste trabalho foi coletado em uma zona agrícola tradicional de culturas de batata.
NOTA: Realizou-se amostragem superficial com espátula. No entanto, a profundidade do solo pode influenciar suas características físico-químicas. Portanto, se o teor de carbono orgânico varia com a profundidade, é necessário coletar amostras em diferentes profundidades. - Levar a amostra de solo ao laboratório, peneirar-a com uma peneira de 1 mm de diâmetro e armazená-la até à análise a 4 °C num recipiente de vidro âmbar.
NOTA: A mesma amostra de solo pode ser usada durante todo o trabalho, mas é importante armazená-la nessas condições logo após cada uso.
3. Preparação da amostra através do método QuEChERS modificado utilizando formato de amónio
NOTA: A Figura 1 mostra uma representação esquemática do método QuEChERS modificado.
- Pesar 10 g da amostra de solo num tubo de centrífuga de 50 ml e adicionar 50 μL da solução de SI a 20 mg/L para obter 100 μg/kg. Para efeitos de recuperação, adicionar também as soluções de pesticidas preparadas na etapa 1.2 para produzir 10 μg/kg, 50 μg/kg e 200 μg/kg (n = 3 cada).
- Agite o tubo usando um vórtice por 30 s para integrar melhor o pico na amostra.
- Adicione 10 mL de água. Agite o tubo utilizando um agitador automático a 10 x g durante 5 minutos.
- Adicionar 10 mL de acetonitrila. Agite o tubo novamente a 10 x g durante 5 minutos.
- Adicionar 5 g de formato de amónio (ver Tabela de Materiais), agitar o tubo vigorosamente durante 1 min à mão e centrifugar a 1.800 x g durante 5 min.
- Transferir 1 mL do extrato de acetonitrila para um tubo de centrífuga de 2 mL contendo 150 mg de MgSO4 anidro, 50 mg de amina primária-secundária (PSA) e 50 mg de octadecilsilano (C18) (ver Tabela de Materiais) para fins de limpeza por extração de fase sólido-dispersiva (d-SPE)8, vórtice por 30 s e centrífuga a 1.800 x g por 5 min.
- Transfira 200 μL do extracto para um frasco para injetáveis de amostrador automático devidamente rotulado com uma inserção fundida de 300 μL e efectue uma análise instrumental utilizando um sistema GC-MS (passo 4).
NOTA: A calibração combinada com matriz é realizada seguindo as mesmas etapas que anteriormente usando extratos em branco, mas 5 mL do sobrenadante são limpos em tubos de 15 mL na etapa d-SPE (etapa 3.6) e as soluções spike e IS não são adicionadas até a etapa 3.7. Adicionar as soluções-padrão de calibração nos frascos para injetáveis do amostrador automático para produzir 5 μg/kg, 10 μg/kg, 50 μg/kg, 100 μg/kg, 200 μg/kg e 400 μg/kg, evaporar até à secura e adicionar 200 μL dos extractos da matriz.
4. Análise instrumental por GC-MS
- Realizar as análises GC-MS usando um sistema GC-MS com um único espectrômetro de massa quadrupolo e uma interface de ionização eletrônica (-70 eV) (ver Tabela de Materiais).
- Ajuste a linha de transferência MS a 280 °C e a fonte iónica a 230 °C.
- Use uma coluna de 5%-fenil-metilpolissiloxano 30 m x 250 μm x 0,25 μm (ver Tabela de Materiais) e um He de pureza ultra-alta como gás transportador a uma taxa de fluxo constante de 1,2 mL/min.
- Manter o forno GC a 60 °C inicialmente durante 2 min, depois aumentar a temperatura para 160 °C a 25 °C/min e manter a temperatura durante 1 min. Em seguida, aumente a temperatura para 175 °C a 15 °C/min e segure por 3 min. Em seguida, aumente para 220 °C a 40 °C/min e segure por 3 min. Novamente, aumente para 250 °C a 30 °C/min e segure por 2 min. Finalmente, leve a temperatura a 310 °C a 30 °C/min e segure por 2 min. O tempo total de análise é de 22.125 min.
- Realize um autotune completo e uma verificação de ar e água do MS antes de cada sequência.
- Abra o software de aquisição MassHunter que controla todos os parâmetros do sistema GC-MS.
NOTA: O sistema de instrumentos inclui o software de aquisição MassHunter por padrão. - Abra a opção "Visualizar" na barra de ferramentas e clique em Controle de vácuo, clique em Ajustar e clique em Autotune. O autotune terminará após alguns minutos.
- Abra a opção "Visualizar" e clique em Controle de instrumentos.
- Clique em Sim e salve o novo arquivo de sintonia para o autotune.
- Abra a opção "Visualizar" na barra de ferramentas e clique em Controle de vácuo, clique em Sintonizar novamente e clique em Verificar ar e Água. A verificação de ar e água terminará após alguns segundos.
- Abra a opção "Visualizar" e clique em Controle de instrumentos.
- Clique em Sim e salve o novo arquivo de sintonia para a verificação de ar e água.
- Abra o software de aquisição MassHunter que controla todos os parâmetros do sistema GC-MS.
- Efectuar a injecção utilizando um amostrador automático (ver Tabela de Materiais) a 280 °C no modo splitless, mantendo o volume de injeção 1,5 μL. Após 0,75 min da injecção, abra a fractura a um caudal de 40 ml/min.
NOTA: Entre as injecções, a seringa de 10 μL deve ser lavada três vezes com acetato de etila e três vezes com ciclohexano. Todas as injeções estão em duplicata. - Analise os analitos no modo de monitoramento de íons selecionados (SIM). Este é o modo padrão usado em sistemas MS com um único quadrupolo.
NOTA: A Tabela 1 mostra os tempos de retenção (min) e os parâmetros de quantificação com base no uso de uma quantificação e dois íons de identificação para os OCPs e o IS. A análise quantitativa baseia-se na razão entre a área de pico da ião de quantificação e o íon de SI.
5. Aquisição de dados
- Abra o software de aquisição MassHunter que controla todos os parâmetros do sistema GC-MS.
- Abra a opção "Sequência" na barra de ferramentas e edite a sequência, incluindo o nome da amostra, o número do frasco para injetáveis, o número de injeções, o método instrumental e o nome do ficheiro a gerar. Adicione quantas linhas forem necessárias.
- Clique em OK e salve a nova sequência.
- Abra a opção "Sequência" na barra de ferramentas novamente e clique em Executar sequência no menu suspenso. Uma nova janela será aberta para confirmar o método de injeção e a pasta onde as amostras serão salvas. Clique em Executar sequência novamente, e a injeção começará.
Resultados
A validação completa do método analítico foi realizada em termos de linearidade, efeitos matriciais, recuperação e repetibilidade.
Curvas de calibração pareadas por matriz com amostras em branco cravadas em seis níveis de concentração (5 μg/kg, 10 μg/kg, 50 μg/kg, 100 μg/kg, 200 μg/kg e 400 μg/kg) foram utilizadas para a avaliação da linearidade. Os coeficientes de determinação (R2) foram maiores ou iguais a 0,99 para todos os OCPs. O menor nível de calibração (LCL) foi fixado em 5 μg/kg, o que atende ao limite máximo permitido estabelecido em 10 μg/kg para fins de monitoramento em aplicações alimentares11.
A avaliação do efeito da matriz foi realizada comparando-se as inclinações das curvas de calibração OCP em solvente puro e as curvas de calibração pareadas pela matriz. O efeito matricial foi calculado utilizando-se a seguinte equação12:
Efeito da matriz (%) = (inclinação da curva de calibração correspondente à matriz − inclinação da curva de calibração pura baseada em solvente)/(inclinação da curva de calibração à base de solvente puro) × 100.
A Figura 2 mostra as distribuições de efeito matricial para os OCPs estudados pela aplicação de um método QuEChERS modificado usando formato de amônio em amostras de solo. As porcentagens de efeito de matriz positiva correspondem a um aumento de sinal, enquanto porcentagens negativas significam que há supressão de sinal. Especificamente, (1) valores que variam entre -20% e 20% correspondem a um efeito de matriz mole; (2) valores que variam entre -20% e -50% ou entre 20% e 50% correspondem a um efeito matricial médio; (3) e valores superiores a 50% ou inferiores a -50% significam que há um forte efeito matricial. Como observado, mais OCPs sofreram efeitos de matriz suaves ou médios, enquanto menos OCPs sofreram fortes efeitos matriciais.
A recuperação e a repetibilidade foram avaliadas por meio do pico de amostras em branco com agrotóxicos em três níveis de concentração (10 μg/kg, 50 μg/kg e 200 μg/kg). A Figura 3 mostra os valores gerais de recuperação e os valores de desvio padrão relativo (RSD) para todos os pesticidas e níveis de pico (n = 9). Como pode ser observado, a grande maioria dos OCPs estudados apresentou percentuais médios de recuperação na faixa de 70%-120%, com RSDs inferiores a 20%, exceto heptacloro, endrina e β-endossulfano, o que proporcionou recuperações médias ligeiramente superiores.

Figura 1: Representação do método QuEChERS modificado usando formato de amônio para extrair resíduos de pesticidas da amostra de solo. Clique aqui para ver uma versão maior desta figura.
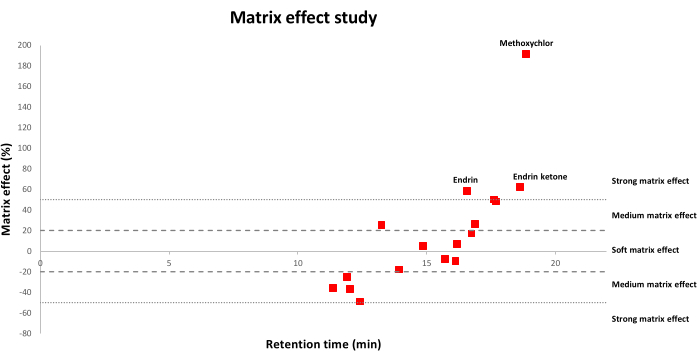
Figura 2: Distribuição dos efeitos da matriz versus tempos de retenção (min) para os 17 OCPs. Um efeito de matriz mole corresponde a valores entre -20% e 20%; um efeito de matriz média corresponde a valores que variam entre -20% e -50% ou entre 20% e 50%; um efeito de matriz forte corresponde a valores superiores a 50% ou inferiores a -50%. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 3: Recuperações médias para os 17 OCPs após picos de 10 μg/kg, 50 μg/kg e 200 μg/kg (n = 9) na amostra de solo. O número de analitos dentro da faixa de recuperação aceitável (70%-120 %) e RSD (<20 %) é fornecido, juntamente com aqueles rotulados fora desse intervalo. Por favor, clique aqui para ver uma versão maior desta figura.
| Analito | Tempo de retenção (min) | Íon quantificador | Eliminatória íon 1 | Eliminatória íon 2 |
| α-BHC | 11.35 | 181 | 219 | 111 |
| β-BHC | 11.90 | 181 | 219 | 109 |
| Lindano | 12.01 | 181 | 183 | 219 |
| δ-BHC | 12.39 | 181 | 219 | 111 |
| Heptacloro | 13.24 | 272 | 100 | 274 |
| Aldrina | 13.94 | 263 | 66 | 265 |
| Heptacloro epóxido | 14.86 | 353 | 355 | 81 |
| α-Endosulfano | 15.71 | 241 | 239 | 195 |
| 4,4'-DDE-d8 (IS) | 16.09 | 254 | 184 | 326 |
| 4,4'-DDE | 16.12 | 246 | 318 | 248 |
| Dieldrina | 16.18 | 79 | 263 | 81 |
| Endrina | 16.57 | 263 | 317 | 345 |
| β-Endosulfano | 16.73 | 195 | 241 | 159 |
| 4,4'-DDD | 16.89 | 235 | 237 | 165 |
| Sulfato de endossulfano | 17.61 | 387 | 227 | 272 |
| 4,4'-DDT | 17.65 | 235 | 237 | 165 |
| Endrina cetona | 18.64 | 317 | 67 | 315 |
| Metoxicloro | 18.86 | 227 | 228 | 212 |
Tabela 1: Tempos de retenção (min) e parâmetros de quantificação para a análise GC-MS dos OCPs. Alfa-benzenohexacloreto (α-BHC); beta-benzenohexacloreto (β-BHC); lindano; delta-benzenohexacloreto (δ-BHC); Heptacloro; aldrina; epóxido de heptacloro; α-endossulfano; 4,4'-diclorodifenildicloroetileno-d8 (4,4'-DDE-d8) (IS); 4,4'-diclorodifenildicloroetileno (4,4'-DDE); dieldrina; endrina; β-endossulfano; 4,4'-diclorodifenildicloroetano (4,4'-DDD); sulfato de endossulfano; 4,4'-diclorodifeniltricloroetano (4,4'-DDT); endrina cetona; metoxicloro.
Discussão
O9 original e as duas versões oficiais13,14 do método QuEChERS usam sulfato de magnésio juntamente com sais de cloreto de sódio, acetato ou citrato para promover a separação da mistura acetonitrila/água durante a extração. No entanto, esses sais tendem a ser depositados como sólidos nas superfícies na fonte de espectrometria de massa (MS), o que causa a necessidade de maior manutenção de métodos baseados em cromatografia líquida (LC)-MS. Em termos de superação dessas desvantagens, González-Curbelo et al.15 relataram que o formato de amônio mais volátil funcionou bem para induzir a separação de fases e a extração de resíduos de pesticidas para espectrometria de massas em tandem LC e GC (MS/MS). Estudos subsequentes também utilizaram 0,5 g de formato de amônio por grama de amostra para extrair resíduos de agrotóxicos de várias matrizes complexas16,17,18,19. Além disso, o uso de formato de amônio demonstrou fornecer menores quantidades de material co-extraído20, o que justifica seu uso para métodos baseados em GC-MS. O presente estudo, pela primeira vez, relata esta versão para analisar resíduos de agrotóxicos em solos21.
A análise de CG de resíduos de agrotóxicos em matrizes complexas, como solos, apresenta algumas limitações devido à ação dos componentes da matriz co-extraídos sobre a resposta instrumental dos agrotóxicos, o que causa determinação imprecisa e menor sensibilidade22,23. Assim, várias melhorias foram feitas para minimizar o efeito da matriz, incluindo etapas de limpeza otimizadas21. No entanto, o efeito matricial ainda ocorre e deve ser corrigido o máximo possível. Nesse sentido, a calibração matricial tem sido a principal abordagem utilizada, pois é muito prática na compensação do aprimoramento do sinal cromatográfico em relação ao dos solventes puros24. Assim, neste estudo, a linearidade foi avaliada pela construção das curvas de calibração em acetonitrila pura e utilizando extratos de solo, e valores de R2 maiores ou iguais a 0,99 para todos os OCPs foram obtidos utilizando ambas as abordagens. No entanto, quando ambas as curvas de calibração foram comparadas, efeitos de matriz apreciáveis foram encontrados na faixa de -49% a 191% (Figura 2). Embora o número de pesticidas que sofreram um forte efeito de matriz tenha sido de apenas 3 de 17 (endrina, endrina cetona e metoxicloro), estudos subsequentes foram realizados usando as curvas de calibração pareadas por matriz para compensar os efeitos da matriz em maior medida.
Não foram estabelecidos limites máximos de resíduos (LMR) para os resíduos de pesticidas nos solos, mas foi fixado um LCL de 5 μg/kg para todos os OCP, o que é inferior ao LMR padrão muito exigente fixado em 10 μg/kg pela legislação internacional para a análise de resíduos de pesticidas em produtos agroalimentares (Regulamento (CE) n.º 396/2005)11. Além disso, o LCL de 5 μg/kg forneceu uma relação sinal-ruído (S/N) de cerca de 10 para todos os OCPs. A alta sensibilidade deste método é semelhante ou até melhor do que a obtida em outros estudos que também analisaram OCPs em solos usando o método QuEChERS seguido de GC-MS. Por exemplo, em um estudo, 34 OCPs foram analisados usando a versão oficial do método QuEChERS que usa um tampão citrato, e os limites de quantificação (LOQs) foram iguais ou superiores a 7 μg/kg25. Em particular, os valores de LOQ de α-BHC, β-BHC, lindano e δ-BHC ficaram entre 206 μg/kg e 384 μg/kg. Em outro trabalho, lindano e dieldrina foram analisados utilizando a mesma versão do método QuEChERS, e valores de LOQ de 42 μg/kg e 292 μg/kg foram obtidos, respectivamente26. Da mesma forma, outro trabalho de pesquisa também determinou aldrina e heptacloro utilizando QuEChERS e GC-MS, com valores de LOQ de 13 e 23 μg/kg, respectivamente27.
A avaliação da recuperação e reprodutibilidade foi desenvolvida em três níveis de concentração (baixa, média e alta) em triplicado (n = 9). Para este fim, os valores globais de recuperação foram determinados comparando-se as razões de área de pico de pesticidas/área de pico de IS (4,4'-DDE-d8) obtidas a partir das amostras de solo cravadas no início da aplicação do método QuEChERS usando formato de amônio com aquelas de calibração pareada por matriz. Em todos os casos, cada réplica foi injetada duas vezes na mesma sequência. Ressalta-se que a utilização de um SI, um padrão isotopicamente rotulado, permite compensar as possíveis perdas dos agrotóxicos que ocorrem durante todo o procedimento, bem como o efeito matricial e/ou possível variabilidade no instrumento. De acordo com os resultados, a maioria dos agrotóxicos atendeu aos critérios de aceitabilidade de 70%-120% de valores de recuperação com RSD ≤20% a cada nível de pico28, o que demonstrou a eficácia e repetibilidade do método. No entanto, os valores gerais de recuperação (n = 9) foram ligeiramente superiores a 120% para heptacloro (122%), endrina (121%) e β-endossulfão (130%), embora tenham sido consistentes (RSDs <13%). Nesse sentido, considerando os valores globais de recuperação em três níveis de pico, estabeleceu-se um critério de aceitabilidade de 30%-140% com valores de RSD ≤20%28.
Em conclusão, o método QuEChERS usando formato de amônio acoplado com GC-MS pode determinar com sucesso OCPs em amostras de solo agrícola. Foi demonstrado neste estudo que a simples adição de 5 g de formato de amônio para induzir a separação de fases entre as camadas de água e acetonitrila garantiu extração adequada com altas recuperações dos pesticidas selecionados. No entanto, o efeito matricial continuou a ocorrer, de modo que outras abordagens, como a adição de protetores de analito, devem ser estudadas em trabalhos subsequentes. Em qualquer caso, esta alternativa às versões oficiais do QuEChERS pode ser usada para evitar os sólidos indesejáveis depositados no sistema analítico devido ao uso de sais de magnésio e sódio, especialmente na análise de rotina baseada em LC-MS. Neste último caso, seria ainda mais interessante, uma vez que o formato de amônio é um auxílio para ionização na ionização por eletrospray positivo e pode aumentar a formação de adutos de amônio em vez de adutos de sódio.
Divulgações
Não tenho conflitos de interesse para divulgar.
Agradecimentos
Gostaria de agradecer a Javier Hernández-Borges e Cecilia Ortega-Zamora o seu inestimável apoio. Quero também agradecer à Universidad EAN e à Universidad de La Laguna.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL disposable glass conical centrifuge tubes | PYREX | 99502-15 | |
| 2 mL centrifuge tubes | Eppendorf | 30120094 | |
| 50 mL centrifuge tubes with screw caps | VWR | 21008-169 | |
| 5977B mass-selective detector | Agilent Technologies | 1617R019 | |
| 7820A gas chromatography system | Agilent Technologies | 16162016 | |
| Acetone | Supelco | 1006582500 | |
| Acetonitrile | VWR | 83642320 | |
| Ammonium formate | VWR | 21254260 | |
| Automatic shaker KS 3000 i control | IKA | 3940000 | |
| Balance | Sartorius Lab Instruments Gmbh & Co | ENTRIS224I-1S | |
| Bondesil-C18, 40 µm | Agilent Technologies | 12213012 | |
| Bondesil-PSA, 40 µm | Agilent Technologies | 12213024 | |
| Cyclohexane | VWR | 85385320 | |
| EPA TCL pesticides mix | Sigma Aldrich | 48913 | |
| Ethyl acetate | Supelco | 1036492500 | |
| G4567A automatic sampler | Agilent Technologies | 19490057 | |
| HP-5ms Ultra Inert (5%-phenyl)-methylpolysiloxane 30 m x 250 µm x 0.25 µm column | Agilent Technologies | 19091S-433UI | |
| Magnesium sulfate monohydrate | Sigma Aldrich | 434183-1KG | |
| Mega Star 3.R centrifuge | VWR | 521-1752 | |
| Milli-Q gradient A10 | Millipore | RR400Q101 | |
| p,p'-DDE-d8 | Dr Ehrenstorfer | DRE-XA12041100AC | |
| Pipette tips 2 - 200 µL | BRAND | 732008 | |
| Pipette tips 5 mL | BRAND | 702595 | |
| Pipette tips 50 - 1000 uL | BRAND | 732012 | |
| Pippette Transferpette S variabel 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variabel 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variabel 20 - 200 µL | BRAND | 704778 | |
| Pippette Transferpette S variabel 500 - 5000 µL | BRAND | 704782 | |
| Vials with fused-in insert | Sigma Aldrich | 29398-U | |
| OCPs | CAS registry number | ||
| α-BHC | 319-84-6 | ||
| β-BHC | 319-85-7 | ||
| Lindane | 58-89-9 | ||
| δ-BHC | 319-86-8 | ||
| Heptachlor | 76-44-8 | ||
| Aldrin | 309-00-2 | ||
| Heptachlor epoxide | 1024-57-3 | ||
| α-Endosulfan | 959-98-8 | ||
| 4,4'-DDE-d8 (IS) | 93952-19-3 | ||
| 4,4'-DDE | 72-55-9 | ||
| Dieldrin | 60-57-1 | ||
| Endrin | 72-20-8 | ||
| β-Endosulfan | 33213-65-9 | ||
| 4,4'-DDD | 72-54-8 | ||
| Endosulfan sulfate | 1031-07-8 | ||
| 4,4'-DDT | 50-29-3 | ||
| Endrin ketone | 53494-70-5 | ||
| Methoxychlor | 72-43-5 |
Referências
- Sabzevari, S., Hofman, J. A worldwide review of currently used pesticides' monitoring in agricultural soils. Science of The Total Environment. 812, 152344 (2022).
- Tzanetou, E. N., Karasali, H. A. Comprehensive review of organochlorine pesticide monitoring in agricultural soils: The silent threat of a conventional agricultural past. Agriculture. 12 (5), 728 (2022).
- Farenhorst, A. Importance of soil organic matter fractions in soil-landscape and regional assessments of pesticide sorption and leaching in soil. Soil Science Society of America Journal. 70 (3), 1005-1012 (2006).
- Silva, V., et al. Pesticide residues in European agricultural soils - A hidden reality unfolded. Science of The Total Environment. 653, 1532-1545 (2019).
- Vischetti, C., et al. Sub-lethal effects of pesticides on the DNA of soil organisms as early ecotoxicological biomarkers. Frontiers in Microbiology. 11, 1892 (2020).
- Alengebawy, A., Abdelkhalek, S. T., Qureshi, S. R., Wang, M. -. Q. Heavy metals and pesticides toxicity in agricultural soil and plants: Ecological risks and human health implications. Toxics. 9 (3), 42 (2021).
- Zikankuba, V. L., Mwanyika, G., Ntwenya, J. E., James, A. Pesticide regulations and their malpractice implications on food and environment safety. Cogent Food & Agriculture. 5 (1), 1601544 (2019).
- Varela-Martínez, D. A., González-Sálamo, J., González-Curbelo, M. &. #. 1. 9. 3. ;., Hernández-Borges, J. Quick, Easy, Cheap, Effective, Rugged and Safe (QuEChERS) extraction. Handbooks in Separation Science. , 399-437 (2020).
- Anastassiades, M., Lehotay, S. J., Štajnbaher, D., Schenck, F. J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce. Journal of AOAC International. 86 (2), 412-431 (2003).
- González-Curbelo, M. &. #. 1. 9. 3. ;., et al. Evolution and applications of the QuEChERS method. Trends in Analytical Chemistry. 71, 169-185 (2015).
- European Union. European Regulation (EC) NO 396/2005 of the European Parliament and of the Council of 23 February 2005 on maximum residue levels of pesticides in or on food and feed of plant and animal origin and amending Council Directive 91/414/EEC. Official Journal of the European Union. 70, 1-16 (2005).
- Kwon, H., Lehotay, S. J., Geis-Asteggiante, L. Variability of matrix effects in liquid and gas chromatography-mass spectrometry analysis of pesticide residues after QuEChERS sample preparation of different food crops. Journal of Chromatography A. 1270, 235-245 (2012).
- Lehotay, S. J., et al. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate: Collaborative study. Journal of AOAC International. 90 (2), 485-520 (2007).
- European Committee for Standardization (CEN). Standard Method EN 15662. Food of plant origin-Determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and clean-up by dispersive SPE-QuEChERS method. European Committee for Standardization. , (2008).
- González-Curbelo, M. &. #. 1. 9. 3. ;., Lehotay, S. J., Hernández-Borges, J., Rodríguez-Delgado, M. &. #. 1. 9. 3. ;. Use of ammonium formate in QuEChERS for high-throughput analysis of pesticides in food by fast, low-pressure gas chromatography and liquid chromatography tandem mass spectrometry. Journal of Chromatography A. 1358, 75-84 (2014).
- Han, L., Sapozhnikova, Y., Lehotay, S. J. Method validation for 243 pesticides and environmental contaminants in meats and poultry by tandem mass spectrometry coupled to low-pressure gas chromatography and ultrahigh-performance liquid chromatography. Food Control. 66, 270-282 (2016).
- Lehotay, S. J., Han, L., Sapozhnikova, Y. Automated mini-column solid-phase extraction clean-up for high-throughput analysis of chemical contaminants in foods by low-pressure gas chromatography-tandem mass spectrometry. Chromatographia. 79 (17), 1113-1130 (2016).
- Lehotay, S. J. Possibilities and limitations of isocratic fast liquid chromatography-tandem mass spectrometry analysis of pesticide residues in fruits and vegetables. Chromatographia. 82 (1), 235-250 (2019).
- Han, L., Matarrita, J., Sapozhnikova, Y., Lehotay, S. J. Evaluation of a recent product to remove lipids and other matrix co-extractives in the analysis of pesticide residues and environmental contaminants in foods. Journal of Chromatography A. 1449, 17-29 (2016).
- Varela-Martínez, D. A., González-Curbelo, M. &. #. 1. 9. 3. ;., González-Sálamo, J., Hernández-Borges, J. Analysis of pesticides in cherimoya and gulupa minor tropical fruits using AOAC 2007.1 and ammonium formate QuEChERS versions: A comparative study. Microchemical Journal. 157, 104950 (2020).
- González-Curbelo, M. &. #. 1. 9. 3. ;., Varela-Martínez, D. A., Riaño-Herrera, D. A. Pesticide-residue analysis in soils by the QuEChERS method: A review. Molecules. 27 (13), 4323 (2022).
- Anastassiades, M., Maštovská, K., Lehotay, S. Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides. Journal of Chromatography A. 1015 (1-2), 163-184 (2003).
- Maštovská, K., Lehotay, S., Anastassiades, M. Combination of analyte protectants to overcome matrix effects in routine GC analysis of pesticide residues in food matrixes. Analytical Chemistry. 77 (24), 8129-8137 (2005).
- Rahman, M., Abd El-Aty, A., Shim, J. Matrix enhancement effect: A blessing or a curse for gas chromatography? - A review. Analytica Chimica Acta. 801, 14-21 (2013).
- Rouvire, F., Buleté, A., Cren-Olivé, C., Arnaudguilhem, C. Multiresidue analysis of aromatic organochlorines in soil by gas chromatography-mass spectrometry and QuEChERS extraction based on water/dichloromethane partitioning. Comparison with accelerated solvent extraction. Talanta. 93, 336-344 (2012).
- Lesueur, C., Gartner, M., Mentler, A., Fuerhacker, M. Comparison of four extraction methods for the analysis of 24 pesticides in soil samples with gas chromatography-mass spectrometry and liquid chromatography-ion trap-mass spectrometry. Talanta. 75 (1), 284-293 (2008).
- Ðurović-Pejčev, R. D., Bursić, V. P., Zeremski, T. M. Comparison of QuEChERS with traditional sample preparation methods in the determination of multiclass pesticides in soil. Journal of AOAC International. 102 (1), 46-51 (2019).
- European Commission. SANTE/11312/2021. Guidance document on analytical quality control and method validation procedures for pesticide residues analysis in food and feed. European Commission. , (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados