Method Article
Analyse de pesticides organochlorés dans un échantillon de sol par une approche QuEChERS modifiée utilisant le formate d’ammonium
Dans cet article
Résumé
Le présent protocole décrit l’utilisation du formate d’ammonium pour la répartition en phase dans QuEChERS, ainsi que la chromatographie en phase gazeuse-spectrométrie de masse, pour déterminer avec succès les résidus de pesticides organochlorés dans un échantillon de sol.
Résumé
Actuellement, la méthode QuEChERS représente le protocole de préparation d’échantillons le plus largement utilisé dans le monde pour analyser les résidus de pesticides dans une grande variété de matrices dans les laboratoires officiels et non officiels. La méthode QuEChERS utilisant le formate d’ammonium s’est déjà révélée avantageuse par rapport à l’original et aux deux versions officielles. D’une part, la simple addition de 0,5 g de formate d’ammonium par gramme d’échantillon suffit pour induire la séparation des phases et obtenir de bonnes performances analytiques. D’autre part, le formate d’ammonium réduit le besoin de maintenance dans les analyses de routine. Ici, une méthode QuEChERS modifiée utilisant le formate d’ammonium a été appliquée pour l’analyse simultanée des résidus de pesticides organochlorés (PCO) dans les sols agricoles. Plus précisément, 10 g de l’échantillon ont été hydratés avec 10 mL d’eau, puis extraits avec 10 mL d’acétonitrile. Ensuite, la séparation de phase a été réalisée à l’aide de 5 g de formiate d’ammonium. Après centrifugation, le surnageant a été soumis à une étape de nettoyage d’extraction dispersive en phase solide avec du sulfate de magnésium anhydre, de l’amine primaire-secondaire et de l’octadécylsilane. La chromatographie en phase gazeuse-spectrométrie de masse a été utilisée comme technique analytique. La méthode QuEChERS utilisant le formate d’ammonium est démontrée comme une alternative efficace pour extraire les résidus OCP d’un échantillon de sol.
Introduction
La nécessité d’augmenter la production alimentaire a conduit à l’utilisation intensive et généralisée de pesticides dans le monde entier au cours des dernières décennies. Des pesticides sont appliqués sur les cultures pour les protéger des ravageurs et augmenter les rendements des cultures, mais leurs résidus se retrouvent généralement dans l’environnement du sol, en particulier dans les zones agricoles1. De plus, certains pesticides, tels que les pesticides organochlorés (OCP), ont une structure très stable, de sorte que leurs résidus ne se décomposent pas facilement et persistent longtemps dans le sol2. Généralement, le sol a une grande capacité à accumuler des résidus de pesticides, surtout lorsqu’il a une teneur élevée en matière organique3. En conséquence, le sol est l’un des compartiments environnementaux les plus contaminés par les résidus de pesticides. À titre d’exemple, l’une des études complètes réalisées à ce jour a révélé que 83 % des 317 sols agricoles de l’Union européenne étaient contaminés par un ou plusieurs résidus de pesticides4.
La pollution des sols par les résidus de pesticides peut affecter les espèces non ciblées, la fonction du sol et la santé des consommateurs tout au long de la chaîne alimentaire en raison de la toxicité élevée des résidus 5,6. Par conséquent, l’évaluation des résidus de pesticides dans les sols est essentielle pour évaluer leurs effets négatifs potentiels sur l’environnement et la santé humaine, en particulier dans les pays en développement en raison de l’absence de réglementation stricte sur l’utilisation des pesticides7. Cela rend l’analyse multi-résidus de pesticides de plus en plus importante. Cependant, l’analyse rapide et précise des résidus de pesticides dans les sols est un défi difficile en raison du grand nombre de substances interférentes, ainsi que du faible niveau de concentration et des diverses propriétés physico-chimiques de ces analytes4.
De toutes les méthodes d’analyse des résidus de pesticides, la méthode QuEChERS est devenue l’option la plus rapide, la plus facile, la moins chère, la plus efficace, la plus robuste et la plus sûre8. La méthode QuEChERS comporte deux étapes. Dans un premier temps, une extraction à l’échelle microscopique basée sur la séparation par salage entre une couche aqueuse et une couche d’acétonitrile est effectuée. Dans la deuxième étape, un processus de nettoyage est effectué à l’aide d’une extraction dispersive en phase solide (dSPE); cette technique utilise de petites quantités de plusieurs combinaisons de sorbants poreux pour éliminer les composants interférents avec la matrice et surmonte les inconvénients de la SPE9 conventionnelle. Par conséquent, le QuEChERS est une approche respectueuse de l’environnement avec peu de solvants / produits chimiques gaspillés qui fournit des résultats très précis et minimise les sources potentielles d’erreurs aléatoires et systématiques. En fait, il a été appliqué avec succès pour l’analyse de routine à haut débit de centaines de pesticides, avec une forte applicabilité dans presque tous les types d’échantillons environnementaux, agroalimentaires et biologiques 8,10. Ce travail vise à appliquer et valider une nouvelle modification de la méthode QuEChERS qui a été précédemment développée et couplée à GC-MS pour analyser les OCP dans les sols agricoles.
Protocole
1. Préparation des solutions mères
REMARQUE: Il est recommandé de porter des gants en nitrile, une blouse de laboratoire et des lunettes de sécurité pendant toute la durée du protocole.
- Préparer une solution mère dans de l’acétone à 400 mg/L à partir d’un mélange commercial de PCO (voir le tableau des matières) à 2 000 mg/L dans de l’hexane:toluène (1:1) dans une fiole jaugée de 25 mL. Le tableau 1 montre chacun des OCP sélectionnés.
- Préparer les solutions mères suivantes dans de l’acétone à des concentrations de 50 mg/L, 1 mg/L et 0,08 mg/L dans des fioles jaugées de 10 mL et les conserver dans des flacons en verre ambré à −18 °C.
NOTE : Les mêmes solutions peuvent être utilisées tout au long du travail, mais il est important de les stocker dans ces conditions juste après chaque utilisation. - Préparer les solutions mères dans de l’acétone à des concentrations de 20 mg/L et de 0,4 mg/L à partir d’un étalon commercial de 4,4'-DDE-d8 à 100 mg/L dans de l’acétone dans des fioles jaugées de 10 mL, et conserver dans des flacons en verre ambré à −18 °C. Utiliser le 4,4'-DDE-d8 comme étalon interne (IS).
2. Prélèvement d’échantillons
- Prélever environ 0,5 kg de la couche supérieure de 10 cm d’un sol agricole dans un récipient en verre. L’objet du sol de cette étude a été collecté dans une zone agricole traditionnelle de cultures de pommes de terre.
NOTE: Un échantillonnage de surface à l’aide d’une spatule a été effectué. Cependant, la profondeur du sol pourrait influencer ses caractéristiques physico-chimiques. Par conséquent, si la teneur en carbone organique varie avec la profondeur, il est nécessaire de prélever des échantillons à différentes profondeurs. - Apporter l’échantillon de sol au laboratoire, le tamiser avec un tamis de 1 mm de diamètre et le conserver jusqu’à l’analyse à 4 °C dans un récipient en verre ambré.
NOTE : Le même échantillon de sol peut être utilisé tout au long des travaux, mais il est important de le stocker dans ces conditions juste après chaque utilisation.
3. Préparation des échantillons par la méthode QuEChERS modifiée utilisant le formate d’ammonium
Remarque : La figure 1 montre une représentation schématique de la méthode QuEChERS modifiée.
- Peser 10 g de l’échantillon de sol dans un tube à centrifuger de 50 mL et ajouter 50 μL de la solution IS à 20 mg/L pour obtenir 100 μg/kg. À des fins de récupération, ajouter également les solutions de pesticides préparées à l’étape 1.2 pour obtenir 10 μg/kg, 50 μg/kg et 200 μg/kg (n = 3 chacune).
- Secouez le tube à l’aide d’un vortex pendant 30 s pour mieux intégrer le pic dans l’échantillon.
- Ajouter 10 ml d’eau. Agiter le tube à l’aide d’un agitateur automatique à 10 x g pendant 5 min.
- Ajouter 10 mL d’acétonitrile. Agiter à nouveau le tube à 10 x g pendant 5 min.
- Ajouter 5 g de formate d’ammonium (voir le tableau des matières), agiter vigoureusement le tube pendant 1 min à la main et centrifuger à 1 800 x g pendant 5 min.
- Transférer 1 mL de l’extrait d’acétonitrile dans un tube à centrifuger de 2 mL contenant 150 mg de MgSO4 anhydre, 50 mg d’amine secondaire primaire (PSA) et 50 mg d’octadécylsilane (C18) (voir le tableau des matières) à des fins de nettoyage par extraction en phase solide dispersive (d-SPE)8, vortex pendant 30 s et centrifugeuse à 1 800 x g pendant 5 min.
- Transférer 200 μL de l’extrait dans un flacon d’échantillonneur automatique correctement étiqueté avec un insert fusionné de 300 μL et effectuer une analyse instrumentale à l’aide d’un système GC-MS (étape 4).
REMARQUE : L’étalonnage par correspondance matricielle est effectué en suivant les mêmes étapes que précédemment à l’aide d’extraits blancs, mais 5 mL du surnageant sont nettoyés dans des tubes de 15 mL à l’étape d-SPE (étape 3.6) et les solutions de pointe et de IS ne sont pas ajoutées avant l’étape 3.7. Ajouter les solutions étalons d’étalonnage dans les flacons de l’échantillonneur automatique pour obtenir 5 μg/kg, 10 μg/kg, 50 μg/kg, 100 μg/kg, 200 μg/kg et 400 μg/kg, évaporer à sec et ajouter 200 μL des extraits matriciels.
4. Analyse instrumentale par GC-MS
- Effectuer les analyses GC-MS à l’aide d’un système GC-MS avec un seul spectromètre de masse quadripolaire et une interface d’ionisation électronique (−70 eV) (voir le tableau des matériaux).
- Réglez la ligne de transfert MS à 280 °C et la source d’ions à 230 °C.
- Utiliser une colonne de 5 % de phényl-méthylpolysiloxane de 30 m x 250 μm x 0,25 μm (voir le tableau des matières) et un gaz porteur de très haute pureté comme gaz porteur à un débit constant de 1,2 mL/min.
- Maintenir l’étuve GC à 60 °C pendant 2 minutes, puis augmenter la température à 160 °C à 25 °C/min, et maintenir pendant 1 min. Ensuite, augmentez la température à 175 °C à 15 °C/min, et maintenez pendant 3 min. Ensuite, augmenter à 220 °C à 40 °C/min, et maintenir pendant 3 min. Encore une fois, augmenter à 250 °C à 30 °C/min, et maintenir pendant 2 min. Enfin, portez la température à 310 °C à 30 °C/min, et maintenez pendant 2 min. Le temps total d’analyse est de 22,125 min.
- Effectuez un réglage automatique complet et une vérification de l’air et de l’eau du MS avant chaque séquence.
- Ouvrez le logiciel d’acquisition MassHunter qui contrôle tous les paramètres du système GC-MS.
REMARQUE: Le système d’instruments inclut le logiciel d’acquisition MassHunter par défaut. - Ouvrez l’option « Affichage » dans la barre d’outils, puis cliquez sur Contrôle du vide, cliquez sur Réglage et cliquez sur Autotune. L’autotune se terminera après quelques minutes.
- Ouvrez l’option « Affichage » et cliquez sur Contrôle de l’instrument.
- Cliquez sur Oui et enregistrez le nouveau fichier de musique pour l’autotune.
- Ouvrez l’option « Affichage » dans la barre d’outils, puis cliquez sur Contrôle du vide, cliquez à nouveau sur Régler , puis cliquez sur Vérification de l’air et de l’eau. La vérification de l’air et de l’eau se terminera après quelques secondes.
- Ouvrez l’option « Affichage » et cliquez sur Contrôle de l’instrument.
- Cliquez sur Oui et enregistrez le nouveau fichier de réglage pour la vérification de l’air et de l’eau.
- Ouvrez le logiciel d’acquisition MassHunter qui contrôle tous les paramètres du système GC-MS.
- Effectuer l’injection à l’aide d’un échantillonneur automatique (voir le tableau des matériaux) à 280 °C en mode splitless, en maintenant le volume d’injection à 1,5 μL. Après 0,75 min d’injection, ouvrir la fente à un débit de 40 mL/min.
NOTE: Entre les injections, la seringue de 10 μL doit être lavée trois fois avec de l’acétate d’éthyle et trois fois avec du cyclohexane. Toutes les injections sont en double. - Analysez les analytes en mode de surveillance ionique sélectionnée (SIM). C’est le mode standard utilisé dans les systèmes MS avec un seul quadripôle.
NOTE : Le tableau 1 montre les temps de rétention (min) et les paramètres de quantification basés sur l’utilisation d’une quantification et de deux ions d’identification pour les OCP et les IS. L’analyse quantitative est basée sur le rapport de l’aire de pic de l’ion de quantification à l’ion de IS.
5. Acquisition des données
- Ouvrez le logiciel d’acquisition MassHunter qui contrôle tous les paramètres du système GC-MS.
- Ouvrez l’option « Séquence » dans la barre d’outils et modifiez la séquence, y compris le nom de l’échantillon, le numéro du flacon, le nombre d’injections, la méthode instrumentale et le nom du fichier à générer. Ajoutez autant de lignes que nécessaire.
- Cliquez sur OK et enregistrez la nouvelle séquence.
- Ouvrez à nouveau l’option « Séquence » dans la barre d’outils et cliquez sur Exécuter la séquence dans le menu déroulant. Une nouvelle fenêtre s’ouvrira pour confirmer la méthode d’injection et le dossier dans lequel les échantillons seront enregistrés. Cliquez à nouveau sur Run Sequence (Exécuter la séquence ) et l’injection commencera.
Résultats
La validation complète de la méthode analytique a été effectuée en termes de linéarité, d’effets de matrice, de récupération et de répétabilité.
Des courbes d’étalonnage appariées par matrice avec des échantillons blancs enrichis à six niveaux de concentration (5 μg/kg, 10 μg/kg, 50 μg/kg, 100 μg/kg, 200 μg/kg et 400 μg/kg) ont été utilisées pour l’évaluation de la linéarité. Les coefficients de détermination (R2) étaient supérieurs ou égaux à 0,99 pour tous les OCP. Le niveau d’étalonnage le plus bas (LCL) a été fixé à 5 μg/kg, ce qui correspond à la limite maximale admissible établie à 10 μg/kg à des fins de surveillance dans les applications alimentaires11.
L’évaluation de l’effet de la matrice a été réalisée en comparant les pentes des courbes d’étalonnage OCP dans les courbes d’étalonnage du solvant pur et les courbes d’étalonnage appariées à la matrice. L’effet de matrice a été calculé à l’aide de l’équation12 suivante :
Effet de matrice (%) = (pente de la courbe d’étalonnage appariée à la matrice − pente de la courbe d’étalonnage à base de solvant pur)/(pente de la courbe d’étalonnage à base de solvant pur) × 100.
La figure 2 montre les distributions d’effet de matrice pour les OCP étudiés en appliquant une méthode QuEChERS modifiée utilisant un formiate d’ammonium à des échantillons de sol. Les pourcentages d’effet de matrice positive correspondent à une amélioration du signal, tandis que les pourcentages négatifs signifient qu’il y a suppression du signal. Plus précisément, (1) des valeurs comprises entre −20 % et 20 % correspondent à un effet de matrice molle; (2) des valeurs comprises entre −20 % et -50 % ou entre 20 % et 50 % correspondent à un effet de matrice moyenne; (3) et des valeurs supérieures à 50 % ou inférieures à −50 % signifient qu’il existe un fort effet de matrice. Comme on l’a observé, un plus grand nombre de PCO ont subi des effets de matrice mous ou moyens, tandis que moins d’OCP ont subi de forts effets de matrice.
La récupération et la répétabilité ont été évaluées en prélevant des échantillons blancs avec des pesticides à trois niveaux de concentration (10 μg/kg, 50 μg/kg et 200 μg/kg). La figure 3 montre les valeurs de récupération globales et les valeurs de l’écart-type relatif (DSR) pour tous les pesticides et les niveaux de pointe (n = 9). Comme on peut l’observer, la grande majorité des PCO étudiés présentaient des pourcentages de récupération moyens compris entre 70 % et 120 %, avec des DSR inférieurs à 20 %, à l’exception de l’heptachlore, de l’endrine et du β-endosulfan, qui ont donné des taux de récupération moyens légèrement plus élevés.

Figure 1 : Représentation de la méthode QuEChERS modifiée utilisant le formate d’ammonium pour extraire les résidus de pesticides de l’échantillon de sol. Veuillez cliquer ici pour voir une version agrandie de cette figure.
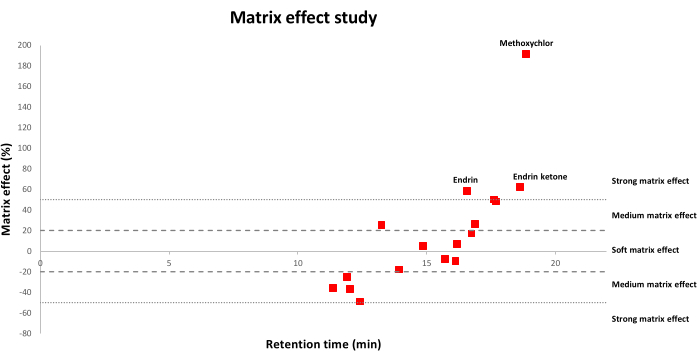
Figure 2 : Distribution des effets de matrice en fonction des temps de rétention (min) pour les 17 OCP. Un effet de matrice molle correspond à des valeurs comprises entre −20 % et 20 % ; un effet de matrice moyen correspond à des valeurs comprises entre −20 % et −50 % ou entre 20 % et 50 %; Un effet de matrice fort correspond à des valeurs supérieures à 50 % ou inférieures à −50 %. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Récupération moyenne des 17 PCO après avoir atteint 10 μg/kg, 50 μg/kg et 200 μg/kg (n = 9) dans l’échantillon de sol. Le nombre d’analytes dans la plage de récupération acceptable (70 % à 120 %) et de DSR (<20 %) est fourni, ainsi que ceux étiquetés en dehors de cette plage. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Analyte | Temps de rétention (min) | Ion quantificateur | Qualificatif ion 1 | Qualificatif ion 2 |
| α-BHC | 11.35 | 181 | 219 | 111 |
| β-BHC | 11.90 | 181 | 219 | 109 |
| Lindane | 12.01 | 181 | 183 | 219 |
| δ-BHC | 12.39 | 181 | 219 | 111 |
| Heptachlore | 13.24 | 272 | 100 | 274 |
| Aldrine | 13.94 | 263 | 66 | 265 |
| Héptachlore époxyde | 14.86 | 353 | 355 | 81 |
| α-endosulfan | 15.71 | 241 | 239 | 195 |
| 4,4'-DDE-d8 (IS) | 16.09 | 254 | 184 | 326 |
| 4,4'-DDE | 16.12 | 246 | 318 | 248 |
| Dieldrine | 16.18 | 79 | 263 | 81 |
| Endrine | 16.57 | 263 | 317 | 345 |
| β-Endosulfan | 16.73 | 195 | 241 | 159 |
| 4,4'-DDD | 16.89 | 235 | 237 | 165 |
| Sulfate d’endosulfan | 17.61 | 387 | 227 | 272 |
| 4,4'-DDT | 17.65 | 235 | 237 | 165 |
| Endrine cétone | 18.64 | 317 | 67 | 315 |
| Méthoxychlore | 18.86 | 227 | 228 | 212 |
Tableau 1 : Temps de rétention (min) et paramètres de quantification pour l’analyse GC-SM des PCO. Hexachlorure d’alpha-benzène (α-BHC); hexachlorure de bêta-benzène (β-BHC); lindane; hexachlorure de delta-benzène (δ-BHC); Heptachlore; aldrine; époxyde d’heptachlore; α-endosulfan; 4,4'-dichlorodiphényldichloroéthylène-d8 (4,4'-DDE-d8) (IS); 4,4'-dichlorodiphényldichloroéthylène (4,4'-DDE); dieldrine; endrine; β-endosulfan; 4,4'-dichlorodiphényldichloroéthane (4,4'-DDD); sulfate d’endosulfan; 4,4'-dichlorodiphényltrichloroéthane (4,4'-DDT); endrine cétone; méthoxychlore.
Discussion
L’original9 et les deux versions officielles13,14 de la méthode QuEChERS utilisent du sulfate de magnésium avec du chlorure de sodium, de l’acétate ou des sels de citrate pour favoriser la séparation du mélange acétonitrile/eau pendant l’extraction. Cependant, ces sels ont tendance à se déposer sous forme de solides sur les surfaces de la source de spectrométrie de masse (SM), ce qui nécessite une maintenance accrue des méthodes basées sur la chromatographie liquide (LC) et la SM. Pour ce qui est de surmonter ces inconvénients, González-Curbelo et al.15 ont rapporté que le formate d’ammonium plus volatil fonctionnait bien pour induire la séparation des phases et l’extraction des résidus de pesticides pour la spectrométrie de masse en tandem LC- et GC (MS/MS). Des études ultérieures ont également utilisé 0,5 g de formate d’ammonium par gramme d’échantillon pour extraire les résidus de pesticides de diverses matrices complexes16,17,18,19. En outre, il a été démontré que l’utilisation du formate d’ammonium fournit des quantités plus faibles de matière co-extraite20, ce qui justifie son utilisation pour les méthodes basées sur la GC-MS. La présente étude, pour la première fois, rapporte cette version pour analyser les résidus de pesticides dans les sols21.
L’analyse GC des résidus de pesticides dans des matrices complexes telles que les sols présente certaines limites en raison de l’action des composants de la matrice co-extraits sur la réponse instrumentale des pesticides, ce qui entraîne une détermination inexacte et une sensibilité plus faible22,23. Par conséquent, plusieurs améliorations ont été apportées pour minimiser l’effet de matrice, y compris l’optimisation des étapesde nettoyage 21. Néanmoins, l’effet de matrice a toujours lieu et doit être corrigé autant que possible. En ce sens, l’étalonnage par correspondance matricielle a été la principale approche utilisée car elle est très pratique pour compenser l’amélioration du signal chromatographique par rapport à celui des solvants purs24. Ainsi, dans cette étude, la linéarité a été évaluée en construisant les courbes d’étalonnage dans l’acétonitrile pur et en utilisant des extraits de sol, et des valeursR2 supérieures ou égales à 0,99 pour tous les OCP ont été obtenues en utilisant les deux approches. Cependant, lorsque les deux courbes d’étalonnage ont été comparées, des effets de matrice appréciables ont été trouvés dans la gamme de –49% à 191% (Figure 2). Bien que le nombre de pesticides ayant subi un fort effet de matrice n’ait été que de 3 sur 17 (endrine, endrine cétone et méthoxychlore), des études ultérieures ont été menées en utilisant les courbes d’étalonnage appariées par matrice pour compenser davantage les effets de la matrice.
Aucune limite maximale de résidus (LMR) n’a été établie pour les résidus de pesticides dans les sols, mais une LCL de 5 μg/kg a été fixée pour tous les PCO, ce qui est inférieur à la LMR standard très exigeante fixée à 10 μg/kg par la législation internationale pour l’analyse des résidus de pesticides dans les produits agroalimentaires (règlement 396/2005)11. En outre, le LCL de 5 μg/kg a fourni un rapport signal/bruit (S/N) d’environ 10 pour tous les OCP. La sensibilité élevée de cette méthode est similaire ou même meilleure que celle obtenue dans d’autres études qui ont également analysé les OCP dans les sols en utilisant la méthode QuEChERS suivie de GC-MS. Par exemple, dans une étude, 34 OCP ont été analysés à l’aide de la version officielle de la méthode QuEChERS qui utilise un tampon de citrate, et les limites de quantification (LQ) étaient égales ou supérieures à 7 μg/kg25. En particulier, les valeurs de LQ du α-BHC, du β-BHC, du lindane et du δ-BHC se situaient entre 206 μg/kg et 384 μg/kg. Dans un autre travail, le lindane et la dieldrine ont été analysés en utilisant la même version de la méthode QuEChERS, et des valeurs de LQ de 42 μg/kg et 292 μg/kg ont été obtenues, respectivement26. De même, un autre travail de recherche a également déterminé l’aldrine et l’heptachlore en utilisant QuEChERS et GC-MS, avec des valeurs LOQ de 13 et 23 μg / kg, respectivement27.
L’évaluation de la récupération et de la reproductibilité a été élaborée à trois niveaux de concentration (faible, moyen et élevé) en triple exemplaire (n = 9). À cette fin, les valeurs de récupération globales ont été déterminées en comparant les rapports surface de pic de pesticide/surface de pointe IS (4,4'-DDE-d8) obtenus à partir des échantillons de sol enrichis au début de l’application de la méthode QuEChERS utilisant le formate d’ammonium avec ceux de l’étalonnage apparié par matrice. Dans tous les cas, chaque réplique a été injectée deux fois dans la même séquence. Il est à noter que l’utilisation d’un IS, un étalon marqué isotopiquement, permet de compenser les pertes éventuelles des pesticides qui ont lieu pendant toute la procédure, ainsi que l’effet de matrice et/ou la variabilité éventuelle de l’instrument. Selon les résultats, la plupart des pesticides répondaient aux critères d’acceptabilité de valeurs de récupération de 70 % à 120 % avec une DSR ≤20 % à chaque niveau de pointe28, ce qui a démontré l’efficacité et la répétabilité de la méthode. Néanmoins, les valeurs de récupération globales (n = 9) étaient légèrement supérieures à 120 % pour l’heptachlore (122 %), l’endrine (121 %) et le β-endosulfan (130 %), bien qu’elles soient constantes (DSR <13 %). En ce sens, compte tenu des valeurs globales de récupération à trois niveaux de pointe, un critère d’acceptabilité de 30% à 140% avec des valeurs RSD ≤20% a été établi28.
En conclusion, la méthode QuEChERS utilisant le formate d’ammonium couplé à la GC-MS peut déterminer avec succès les OCP dans les échantillons de sol agricole. Il a été démontré dans cette étude que la simple addition de 5 g de formiate d’ammonium pour induire une séparation de phase entre les couches d’eau et d’acétonitrile assurait une extraction appropriée avec des récupérations élevées des pesticides sélectionnés. Cependant, l’effet de matrice a continué à se produire, de sorte que d’autres approches, telles que l’ajout de protecteurs d’analytes, devraient être étudiées dans des travaux ultérieurs. Dans tous les cas, cette alternative aux versions officielles de QuEChERS peut être utilisée pour éviter les solides indésirables déposés dans le système analytique en raison de l’utilisation de sels de magnésium et de sodium, en particulier dans les analyses de routine basées sur la LC-MS. Dans ce dernier cas, ce serait encore plus intéressant puisque le formate d’ammonium est une aide à l’ionisation dans l’ionisation électropulvérisée positive et peut améliorer la formation d’adduits d’ammonium au lieu d’adduits de sodium.
Déclarations de divulgation
Je n’ai aucun conflit d’intérêts à divulguer.
Remerciements
Je tiens à remercier Javier Hernández-Borges et Cecilia Ortega-Zamora pour leur soutien inestimable. Je tiens également à remercier l’Universidad EAN et l’Universidad de La Laguna.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL disposable glass conical centrifuge tubes | PYREX | 99502-15 | |
| 2 mL centrifuge tubes | Eppendorf | 30120094 | |
| 50 mL centrifuge tubes with screw caps | VWR | 21008-169 | |
| 5977B mass-selective detector | Agilent Technologies | 1617R019 | |
| 7820A gas chromatography system | Agilent Technologies | 16162016 | |
| Acetone | Supelco | 1006582500 | |
| Acetonitrile | VWR | 83642320 | |
| Ammonium formate | VWR | 21254260 | |
| Automatic shaker KS 3000 i control | IKA | 3940000 | |
| Balance | Sartorius Lab Instruments Gmbh & Co | ENTRIS224I-1S | |
| Bondesil-C18, 40 µm | Agilent Technologies | 12213012 | |
| Bondesil-PSA, 40 µm | Agilent Technologies | 12213024 | |
| Cyclohexane | VWR | 85385320 | |
| EPA TCL pesticides mix | Sigma Aldrich | 48913 | |
| Ethyl acetate | Supelco | 1036492500 | |
| G4567A automatic sampler | Agilent Technologies | 19490057 | |
| HP-5ms Ultra Inert (5%-phenyl)-methylpolysiloxane 30 m x 250 µm x 0.25 µm column | Agilent Technologies | 19091S-433UI | |
| Magnesium sulfate monohydrate | Sigma Aldrich | 434183-1KG | |
| Mega Star 3.R centrifuge | VWR | 521-1752 | |
| Milli-Q gradient A10 | Millipore | RR400Q101 | |
| p,p'-DDE-d8 | Dr Ehrenstorfer | DRE-XA12041100AC | |
| Pipette tips 2 - 200 µL | BRAND | 732008 | |
| Pipette tips 5 mL | BRAND | 702595 | |
| Pipette tips 50 - 1000 uL | BRAND | 732012 | |
| Pippette Transferpette S variabel 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variabel 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variabel 20 - 200 µL | BRAND | 704778 | |
| Pippette Transferpette S variabel 500 - 5000 µL | BRAND | 704782 | |
| Vials with fused-in insert | Sigma Aldrich | 29398-U | |
| OCPs | CAS registry number | ||
| α-BHC | 319-84-6 | ||
| β-BHC | 319-85-7 | ||
| Lindane | 58-89-9 | ||
| δ-BHC | 319-86-8 | ||
| Heptachlor | 76-44-8 | ||
| Aldrin | 309-00-2 | ||
| Heptachlor epoxide | 1024-57-3 | ||
| α-Endosulfan | 959-98-8 | ||
| 4,4'-DDE-d8 (IS) | 93952-19-3 | ||
| 4,4'-DDE | 72-55-9 | ||
| Dieldrin | 60-57-1 | ||
| Endrin | 72-20-8 | ||
| β-Endosulfan | 33213-65-9 | ||
| 4,4'-DDD | 72-54-8 | ||
| Endosulfan sulfate | 1031-07-8 | ||
| 4,4'-DDT | 50-29-3 | ||
| Endrin ketone | 53494-70-5 | ||
| Methoxychlor | 72-43-5 |
Références
- Sabzevari, S., Hofman, J. A worldwide review of currently used pesticides' monitoring in agricultural soils. Science of The Total Environment. 812, 152344 (2022).
- Tzanetou, E. N., Karasali, H. A. Comprehensive review of organochlorine pesticide monitoring in agricultural soils: The silent threat of a conventional agricultural past. Agriculture. 12 (5), 728 (2022).
- Farenhorst, A. Importance of soil organic matter fractions in soil-landscape and regional assessments of pesticide sorption and leaching in soil. Soil Science Society of America Journal. 70 (3), 1005-1012 (2006).
- Silva, V., et al. Pesticide residues in European agricultural soils - A hidden reality unfolded. Science of The Total Environment. 653, 1532-1545 (2019).
- Vischetti, C., et al. Sub-lethal effects of pesticides on the DNA of soil organisms as early ecotoxicological biomarkers. Frontiers in Microbiology. 11, 1892 (2020).
- Alengebawy, A., Abdelkhalek, S. T., Qureshi, S. R., Wang, M. -. Q. Heavy metals and pesticides toxicity in agricultural soil and plants: Ecological risks and human health implications. Toxics. 9 (3), 42 (2021).
- Zikankuba, V. L., Mwanyika, G., Ntwenya, J. E., James, A. Pesticide regulations and their malpractice implications on food and environment safety. Cogent Food & Agriculture. 5 (1), 1601544 (2019).
- Varela-Martínez, D. A., González-Sálamo, J., González-Curbelo, M. &. #. 1. 9. 3. ;., Hernández-Borges, J. Quick, Easy, Cheap, Effective, Rugged and Safe (QuEChERS) extraction. Handbooks in Separation Science. , 399-437 (2020).
- Anastassiades, M., Lehotay, S. J., Štajnbaher, D., Schenck, F. J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce. Journal of AOAC International. 86 (2), 412-431 (2003).
- González-Curbelo, M. &. #. 1. 9. 3. ;., et al. Evolution and applications of the QuEChERS method. Trends in Analytical Chemistry. 71, 169-185 (2015).
- European Union. European Regulation (EC) NO 396/2005 of the European Parliament and of the Council of 23 February 2005 on maximum residue levels of pesticides in or on food and feed of plant and animal origin and amending Council Directive 91/414/EEC. Official Journal of the European Union. 70, 1-16 (2005).
- Kwon, H., Lehotay, S. J., Geis-Asteggiante, L. Variability of matrix effects in liquid and gas chromatography-mass spectrometry analysis of pesticide residues after QuEChERS sample preparation of different food crops. Journal of Chromatography A. 1270, 235-245 (2012).
- Lehotay, S. J., et al. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate: Collaborative study. Journal of AOAC International. 90 (2), 485-520 (2007).
- European Committee for Standardization (CEN). Standard Method EN 15662. Food of plant origin-Determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and clean-up by dispersive SPE-QuEChERS method. European Committee for Standardization. , (2008).
- González-Curbelo, M. &. #. 1. 9. 3. ;., Lehotay, S. J., Hernández-Borges, J., Rodríguez-Delgado, M. &. #. 1. 9. 3. ;. Use of ammonium formate in QuEChERS for high-throughput analysis of pesticides in food by fast, low-pressure gas chromatography and liquid chromatography tandem mass spectrometry. Journal of Chromatography A. 1358, 75-84 (2014).
- Han, L., Sapozhnikova, Y., Lehotay, S. J. Method validation for 243 pesticides and environmental contaminants in meats and poultry by tandem mass spectrometry coupled to low-pressure gas chromatography and ultrahigh-performance liquid chromatography. Food Control. 66, 270-282 (2016).
- Lehotay, S. J., Han, L., Sapozhnikova, Y. Automated mini-column solid-phase extraction clean-up for high-throughput analysis of chemical contaminants in foods by low-pressure gas chromatography-tandem mass spectrometry. Chromatographia. 79 (17), 1113-1130 (2016).
- Lehotay, S. J. Possibilities and limitations of isocratic fast liquid chromatography-tandem mass spectrometry analysis of pesticide residues in fruits and vegetables. Chromatographia. 82 (1), 235-250 (2019).
- Han, L., Matarrita, J., Sapozhnikova, Y., Lehotay, S. J. Evaluation of a recent product to remove lipids and other matrix co-extractives in the analysis of pesticide residues and environmental contaminants in foods. Journal of Chromatography A. 1449, 17-29 (2016).
- Varela-Martínez, D. A., González-Curbelo, M. &. #. 1. 9. 3. ;., González-Sálamo, J., Hernández-Borges, J. Analysis of pesticides in cherimoya and gulupa minor tropical fruits using AOAC 2007.1 and ammonium formate QuEChERS versions: A comparative study. Microchemical Journal. 157, 104950 (2020).
- González-Curbelo, M. &. #. 1. 9. 3. ;., Varela-Martínez, D. A., Riaño-Herrera, D. A. Pesticide-residue analysis in soils by the QuEChERS method: A review. Molecules. 27 (13), 4323 (2022).
- Anastassiades, M., Maštovská, K., Lehotay, S. Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides. Journal of Chromatography A. 1015 (1-2), 163-184 (2003).
- Maštovská, K., Lehotay, S., Anastassiades, M. Combination of analyte protectants to overcome matrix effects in routine GC analysis of pesticide residues in food matrixes. Analytical Chemistry. 77 (24), 8129-8137 (2005).
- Rahman, M., Abd El-Aty, A., Shim, J. Matrix enhancement effect: A blessing or a curse for gas chromatography? - A review. Analytica Chimica Acta. 801, 14-21 (2013).
- Rouvire, F., Buleté, A., Cren-Olivé, C., Arnaudguilhem, C. Multiresidue analysis of aromatic organochlorines in soil by gas chromatography-mass spectrometry and QuEChERS extraction based on water/dichloromethane partitioning. Comparison with accelerated solvent extraction. Talanta. 93, 336-344 (2012).
- Lesueur, C., Gartner, M., Mentler, A., Fuerhacker, M. Comparison of four extraction methods for the analysis of 24 pesticides in soil samples with gas chromatography-mass spectrometry and liquid chromatography-ion trap-mass spectrometry. Talanta. 75 (1), 284-293 (2008).
- Ðurović-Pejčev, R. D., Bursić, V. P., Zeremski, T. M. Comparison of QuEChERS with traditional sample preparation methods in the determination of multiclass pesticides in soil. Journal of AOAC International. 102 (1), 46-51 (2019).
- European Commission. SANTE/11312/2021. Guidance document on analytical quality control and method validation procedures for pesticide residues analysis in food and feed. European Commission. , (2021).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon