Method Article
Analisi di pesticidi organoclorurati in un campione di terreno mediante un approccio QuEChERS modificato utilizzando formiato di ammonio
In questo articolo
Riepilogo
Il presente protocollo descrive l'utilizzo del formiato di ammonio per la partizionazione di fase in QuEChERS, insieme alla gascromatografia-spettrometria di massa, per determinare con successo i residui di pesticidi organoclorurati in un campione di terreno.
Abstract
Attualmente, il metodo QuEChERS rappresenta il protocollo di preparazione dei campioni più utilizzato in tutto il mondo per l'analisi dei residui di pesticidi in un'ampia varietà di matrici sia nei laboratori ufficiali che non ufficiali. Il metodo QuEChERS che utilizza il formiato di ammonio si è dimostrato in precedenza vantaggioso rispetto all'originale e alle due versioni ufficiali. Da un lato, la semplice aggiunta di 0,5 g di formiato di ammonio per grammo di campione è sufficiente per indurre la separazione di fase e ottenere buone prestazioni analitiche. D'altra parte, il formiato di ammonio riduce la necessità di manutenzione nelle analisi di routine. Qui, è stato applicato un metodo QuEChERS modificato utilizzando formiato di ammonio per l'analisi simultanea dei residui di pesticidi organoclorurati (OCP) nel suolo agricolo. Nello specifico, 10 g del campione sono stati idratati con 10 ml di acqua e quindi estratti con 10 ml di acetonitrile. Successivamente, la separazione di fase è stata effettuata utilizzando 5 g di formiato di ammonio. Dopo la centrifugazione, il surnatante è stato sottoposto a una fase di pulizia dell'estrazione in fase solida dispersiva con solfato di magnesio anidro, ammina primaria-secondaria e ottadecilsilano. La gascromatografia-spettrometria di massa è stata utilizzata come tecnica analitica. Il metodo QuEChERS che utilizza il formiato di ammonio si è dimostrato un'alternativa efficace per estrarre residui di OCP da un campione di terreno.
Introduzione
La necessità di aumentare la produzione alimentare ha portato all'uso intensivo e diffuso di pesticidi in tutto il mondo negli ultimi decenni. I pesticidi vengono applicati alle colture per proteggerle dai parassiti e aumentare i raccolti, ma i loro residui di solito finiscono nell'ambiente del suolo, specialmente nelle aree agricole1. Inoltre, alcuni pesticidi, come i pesticidi organoclorurati (OCP), hanno una struttura molto stabile, quindi i loro residui non si decompongono facilmente e persistono nel terreno per lungo tempo2. Generalmente, il suolo ha un'elevata capacità di accumulare residui di pesticidi, soprattutto quando ha un alto contenuto di sostanza organica3. Di conseguenza, il suolo è uno dei compartimenti ambientali più contaminati dai residui di pesticidi. Ad esempio, uno degli studi completi finora condotti ha rilevato che l'83% dei 317 terreni agricoli provenienti da tutta l'Unione europea era contaminato da uno o più residui di pesticidi4.
L'inquinamento del suolo da residui di antiparassitari può influire sulle specie non bersaglio, sulla funzione del suolo e sulla salute dei consumatori lungo tutta la catena alimentare a causa dell'elevata tossicità dei residui 5,6. Di conseguenza, la valutazione dei residui di antiparassitari nel suolo è essenziale per valutare i loro potenziali effetti negativi sull'ambiente e sulla salute umana, in particolare nei paesi in via di sviluppo a causa della mancanza di norme rigorose sull'uso dei pesticidi7. Ciò rende l'analisi multiresiduo dei pesticidi sempre più importante. Tuttavia, l'analisi rapida e accurata dei residui di pesticidi nel suolo è una sfida difficile a causa del gran numero di sostanze interferenti, nonché del basso livello di concentrazione e delle diverse proprietà fisico-chimiche di questi analiti4.
Di tutti i metodi di analisi dei residui di pesticidi, il metodo QuEChERS è diventato l'opzione più rapida, più semplice, più economica, più efficace, più robusta e più sicura8. Il metodo QuEChERS prevede due passaggi. Nella prima fase, viene eseguita un'estrazione su microscala basata sulla suddivisione tramite salatura tra uno strato acquoso e uno acetonitrile. Nella seconda fase viene effettuato un processo di pulizia che utilizza un'estrazione dispersiva in fase solida (dSPE); questa tecnica utilizza piccole quantità di diverse combinazioni di assorbenti porosi per rimuovere i componenti che interferiscono con la matrice e supera gli svantaggi dellaSPE 9 convenzionale. Quindi, il QuEChERS è un approccio ecologico con pochi solventi / sostanze chimiche che vanno sprecati che fornisce risultati molto accurati e riduce al minimo le potenziali fonti di errori casuali e sistematici. Infatti, è stato applicato con successo per l'analisi di routine ad alta produttività di centinaia di pesticidi, con forte applicabilità in quasi tutti i tipi di campioni ambientali, agroalimentari e biologici 8,10. Questo lavoro mira ad applicare e convalidare una nuova modifica del metodo QuEChERS che è stato precedentemente sviluppato e accoppiato a GC-MS per analizzare gli OCP nel suolo agricolo.
Protocollo
1. Preparazione delle soluzioni madre
NOTA: Si consiglia di indossare guanti in nitrile, camice da laboratorio e occhiali di sicurezza durante l'intero protocollo.
- Preparare una soluzione madre in acetone a 400 mg/L da una miscela commerciale di OCP (vedere Tabella dei materiali) a 2.000 mg/L in esano:toluene (1:1) in un matraccio tarato da 25 ml. Nella tabella 1 sono riportati tutti gli OCP selezionati.
- Preparare le successive soluzioni madre in acetone a concentrazioni di 50 mg/L, 1 mg/L e 0,08 mg/L in matraccio tarato da 10 mL e conservarle in flaconcini di vetro ambrato a -18 °C.
NOTA: Le stesse soluzioni possono essere utilizzate durante tutto il lavoro, ma è importante conservarle in queste condizioni subito dopo ogni utilizzo. - Preparare le soluzioni madre in acetone a concentrazioni di 20 mg/L e 0,4 mg/L da uno standard commerciale di 4,4'-DDE-d8 a 100 mg/L in acetone in matraccio tarato da 10 mL e conservare in flaconcini di vetro ambrato a -18 °C. Utilizzare 4,4'-DDE-d8 come standard interno (IS).
2. Raccolta dei campioni
- Raccogliere circa 0,5 kg dello strato superiore di 10 cm di un terreno agricolo in un contenitore di vetro. Il suolo oggetto di questo studio è stato raccolto in una zona agricola tradizionale di colture di patate.
NOTA: è stato effettuato un campionamento superficiale con una spatola. Tuttavia, la profondità del suolo potrebbe influenzare le sue caratteristiche fisico-chimiche. Pertanto, se il contenuto di carbonio organico varia con la profondità, è necessario prelevare campioni a profondità diverse. - Portare il campione di terreno in laboratorio, setacciarlo con un setaccio di 1 mm di diametro e conservarlo fino all'analisi a 4 °C in un contenitore di vetro ambrato.
NOTA: Lo stesso campione di terreno può essere utilizzato durante tutto il lavoro, ma è importante conservarlo in queste condizioni subito dopo ogni utilizzo.
3. Preparazione del campione tramite il metodo QuEChERS modificato utilizzando formiato di ammonio
Nota : la Figura 1 mostra una rappresentazione schematica del metodo QuEChERS modificato.
- Pesare 10 g del campione di terreno in una provetta da centrifuga da 50 mL e aggiungere 50 μL della soluzione IS a 20 mg/L per ottenere 100 μg/kg. Ai fini del recupero, aggiungere anche le soluzioni di pesticidi preparate nella fase 1.2 per ottenere 10 μg/kg, 50 μg/kg e 200 μg/kg (n = 3 ciascuna).
- Agitare il tubo usando un vortice per 30 s per integrare meglio il picco nel campione.
- Aggiungere 10 ml di acqua. Agitare il tubo con uno shaker automatico a 10 x g per 5 minuti.
- Aggiungere 10 ml di acetonitrile. Agitare nuovamente il tubo a 10 x g per 5 minuti.
- Aggiungere 5 g di formiato di ammonio (vedi tabella dei materiali), agitare vigorosamente il tubo per 1 minuto a mano e centrifugare a 1.800 x g per 5 minuti.
- Trasferire 1 mL di estratto di acetonitrile in una provetta da centrifuga da 2 mL contenente 150 mg diMgSO 4 anidro, 50 mg di ammina primaria-secondaria (PSA) e 50 mg di ottadecilsilano (C18) (vedere Tabella dei materiali) per scopi di pulizia mediante estrazione in fase dispersiva-solida (d-SPE)8, vortice per 30 s e centrifugare a 1.800 x g per 5 minuti.
- Trasferire 200 μL dell'estratto in un flaconcino di autocampionatore opportunamente etichettato con un inserto fuso da 300 μL ed eseguire un'analisi strumentale utilizzando un sistema GC-MS (fase 4).
NOTA: la calibrazione abbinata alla matrice viene eseguita seguendo gli stessi passaggi di cui si utilizzavano in precedenza estratti in bianco, ma 5 mL del surnatante vengono puliti in provette da 15 mL nella fase d-SPE (fase 3.6) e le soluzioni spike e IS non vengono aggiunte fino al punto 3.7. Aggiungere le soluzioni standard di taratura nei flaconcini dell'autocampionatore per ottenere 5 μg/kg, 10 μg/kg, 50 μg/kg, 100 μg/kg, 200 μg/kg e 400 μg/kg, evaporare fino all'essiccazione e aggiungere 200 μL degli estratti della matrice.
4. Analisi strumentale da parte di GC-MS
- Eseguire le analisi GC-MS utilizzando un sistema GC-MS con un singolo spettrometro di massa a quadrupolo e un'interfaccia di ionizzazione elettronica (-70 eV) (vedi Tabella dei materiali).
- Impostare la linea di trasferimento MS a 280 °C e la sorgente di ioni a 230 °C.
- Utilizzare una colonna 5%-fenil-metilpolisilossano 30 m x 250 μm x 0,25 μm (vedi Tabella dei materiali) e He di purezza ultraelevata come gas di trasporto a una portata costante di 1,2 ml / min.
- Mantenere il forno GC a 60 °C inizialmente per 2 minuti, quindi aumentare la temperatura a 160 °C a 25 °C/min e tenere premuto per 1 minuto. Quindi, aumentare la temperatura a 175 °C a 15 °C/min e tenere premuto per 3 minuti. Quindi, aumentare a 220 °C a 40 °C/min e tenere premuto per 3 min. Anche in questo caso, aumentare a 250 °C a 30 °C/min e tenere premuto per 2 minuti. Infine, portare la temperatura a 310 °C a 30 °C/min e tenere premuto per 2 minuti. Il tempo totale di analisi è di 22.125 min.
- Condurre un autotune completo e un controllo dell'aria e dell'acqua del MS prima di ogni sequenza.
- Aprire il software di acquisizione MassHunter che controlla tutti i parametri del sistema GC-MS.
NOTA: Il sistema di strumenti include il software di acquisizione MassHunter per impostazione predefinita. - Apri l'opzione "Visualizza" sulla barra degli strumenti e fai clic su Controllo vuoto, fai clic su Sintonizzazione e fai clic su Autotune. L'autotune terminerà dopo pochi minuti.
- Apri l'opzione "Visualizza" e fai clic su Controllo strumento.
- Fare clic su Sì e salvare il nuovo file di melodia per l'autotune.
- Apri l'opzione "Visualizza" sulla barra degli strumenti e fai clic su Controllo vuoto, fai nuovamente clic su Sintonizza e fai clic su Controllo aria e acqua. Il controllo dell'aria e dell'acqua terminerà dopo pochi secondi.
- Apri l'opzione "Visualizza" e fai clic su Controllo strumento.
- Fare clic su Sì e salvare il nuovo file di melodia per il controllo dell'aria e dell'acqua.
- Aprire il software di acquisizione MassHunter che controlla tutti i parametri del sistema GC-MS.
- Eseguire l'iniezione utilizzando un autocampionatore (vedere Tabella dei materiali) a 280 °C in modalità splitless, mantenendo il volume di iniezione 1,5 μL. Dopo 0,75 minuti dall'iniezione, aprire la divisione a una portata di 40 ml/min.
NOTA: Tra un'iniezione e l'altra, la siringa da 10 μL deve essere lavata tre volte con acetato di etile e tre volte con cicloesano. Tutte le iniezioni sono in duplicato. - Analizzare gli analiti in modalità di monitoraggio ionico selezionato (SIM). Questa è la modalità standard utilizzata nei sistemi MS con un singolo quadrupolo.
NOTA: la tabella 1 mostra i tempi di ritenzione (min) e i parametri di quantificazione basati sull'utilizzo di una quantificazione e due ioni di identificazione per gli OCP e l'IS. L'analisi quantitativa si basa sul rapporto tra l'area di picco dello ione di quantificazione e lo ione di IS.
5. Acquisizione dei dati
- Aprire il software di acquisizione MassHunter che controlla tutti i parametri del sistema GC-MS.
- Aprire l'opzione "Sequenza" sulla barra degli strumenti e modificare la sequenza, incluso il nome del campione, il numero della fiala, il numero di iniezioni, il metodo strumentale e il nome del file da generare. Aggiungere tutte le righe necessarie.
- Fare clic su OK e salvare la nuova sequenza.
- Apri nuovamente l'opzione "Sequenza" sulla barra degli strumenti e fai clic su Esegui sequenza nel menu a discesa. Si aprirà una nuova finestra per confermare il metodo di iniezione e la cartella in cui verranno salvati i campioni. Fare nuovamente clic su Run Sequence e inizierà l'iniezione.
Risultati
La validazione completa del metodo analitico è stata eseguita in termini di linearità, effetti matriciali, recupero e ripetibilità.
Per la valutazione della linearità sono state utilizzate curve di calibrazione abbinate alla matrice con campioni bianchi a spillo a sei livelli di concentrazione (5 μg/kg, 10 μg/kg, 50 μg/kg, 100 μg/kg, 200 μg/kg e 400 μg/kg). I coefficienti di determinazione (R2) erano superiori o uguali a 0,99 per tutti gli OCP. Il livello minimo di taratura (LCL) è stato fissato a 5 μg/kg, che soddisfa il limite massimo consentito fissato a 10 μg/kg a fini di monitoraggio nelle applicazioni alimentari11.
La valutazione dell'effetto della matrice è stata effettuata confrontando le pendenze delle curve di calibrazione OCP in solvente puro e le curve di calibrazione abbinate alla matrice. L'effetto della matrice è stato calcolato utilizzando la seguente equazione12:
Effetto matrice (%) = (pendenza della curva di taratura abbinata alla matrice − pendenza della curva di taratura a base di solvente puro)/(pendenza della curva di taratura a base di solvente puro) × 100.
La figura 2 mostra le distribuzioni dell'effetto matrice per gli OCP studiati applicando un metodo QuEChERS modificato utilizzando formiato di ammonio ai campioni di terreno. Le percentuali positive dell'effetto della matrice corrispondono a un miglioramento del segnale, mentre le percentuali negative significano che c'è soppressione del segnale. In particolare, (1) valori compresi tra -20% e 20% corrispondono a un effetto matrice morbida; (2) valori compresi tra -20% e -50% o tra il 20% e il 50% corrispondono a un effetto matrice medio; (3) e valori superiori al 50% o inferiori a -50% significano che c'è un forte effetto matrice. Come osservato, un maggior numero di OCP ha subito effetti di matrice morbida o media, mentre un minor numero di OCP ha subito forti effetti di matrice.
Il recupero e la ripetibilità sono stati valutati mediante campioni in bianco con pesticidi a tre livelli di concentrazione (10 μg/kg, 50 μg/kg e 200 μg/kg). La figura 3 mostra i valori complessivi di recupero e i valori di deviazione standard relativa (RSD) per tutti i pesticidi e i livelli di picchiata (n = 9). Come si può osservare, la grande maggioranza degli OCP studiati presentava percentuali medie di recupero comprese tra il 70% e il 120%, con RSD inferiori al 20%, ad eccezione di eptacloro, endrin e β-endosulfan, che hanno dato recuperi medi leggermente più alti.

Figura 1: Rappresentazione del metodo QuEChERS modificato utilizzando formiato di ammonio per estrarre residui di pesticidi dal campione di terreno. Fare clic qui per visualizzare una versione ingrandita di questa figura.
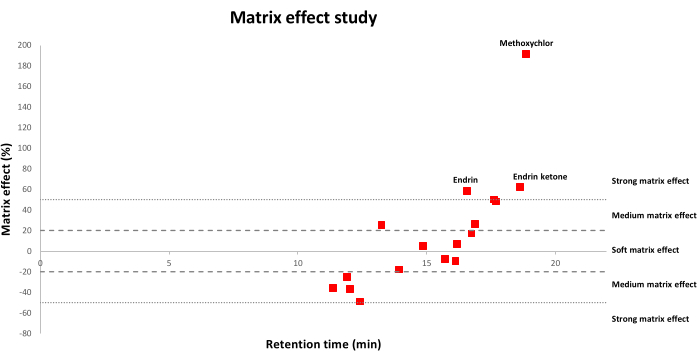
Figura 2: Distribuzione degli effetti della matrice rispetto ai tempi di ritenzione (min) per i 17 OCP. Un effetto matrice morbida corrisponde a valori compresi tra -20% e 20%; un effetto matrice medio corrisponde a valori compresi tra -20% e -50% o tra il 20% e il 50%; Un effetto matrice forte corrisponde a valori superiori al 50% o inferiori a -50%. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 3: Recuperi medi per i 17 OCP dopo aver picchiato 10 μg/kg, 50 μg/kg e 200 μg/kg (n = 9) nel campione di terreno. Viene fornito il numero di analiti all'interno dell'intervallo di recupero accettabile (70%-120%) e RSD (<20%), insieme a quelli etichettati al di fuori di tale intervallo. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Analita | Tempo di ritenzione (min) | Ione quantificatore | Qualificatore ione 1 | Qualificatore ione 2 |
| α-BHC | 11.35 | 181 | 219 | 111 |
| β-BHC | 11.90 | 181 | 219 | 109 |
| Lindano | 12.01 | 181 | 183 | 219 |
| δ-BHC | 12.39 | 181 | 219 | 111 |
| Eptacloro | 13.24 | 272 | 100 | 274 |
| Aldrin | 13.94 | 263 | 66 | 265 |
| Eptacloro epossido | 14.86 | 353 | 355 | 81 |
| α-endosulfan | 15.71 | 241 | 239 | 195 |
| 4,4'-DDE-d8 (IS) | 16.09 | 254 | 184 | 326 |
| 4,4'-DDE | 16.12 | 246 | 318 | 248 |
| Dieldrin | 16.18 | 79 | 263 | 81 |
| Endrin | 16.57 | 263 | 317 | 345 |
| β-endosulfan | 16.73 | 195 | 241 | 159 |
| 4,4'-DDD | 16.89 | 235 | 237 | 165 |
| Endosulfan solfato | 17.61 | 387 | 227 | 272 |
| 4,4'-DDT | 17.65 | 235 | 237 | 165 |
| Endrin chetone | 18.64 | 317 | 67 | 315 |
| Metossicloro | 18.86 | 227 | 228 | 212 |
Tabella 1: Tempi di ritenzione (min) e parametri di quantificazione per l'analisi GC-MS degli OCP. alfa-benzeneesacloruro (α-BHC); beta-benzeneesacloruro (β-BHC); lindano; delta-benzeneesacloruro (δ-BHC); eptacloro; aldrin; eptacloro epossido; α-endosulfan; 4,4'-diclorodifenildicloroetilene-d8 (4,4'-DDE-d8) (IS); 4,4'-diclorodifenildicloroetilene (4,4'-DDE); dieldrin; endrin; β-endosulfan; 4,4'-diclorodifenildicloroetano (4,4'-DDD); endosulfan solfato; 4,4'-diclorodifeniltricloroetano (4,4'-DDT); endrin chetone; metossicloro.
Discussione
La9 originale e le due versioni ufficiali13,14 del metodo QuEChERS utilizzano solfato di magnesio insieme a cloruro di sodio, acetato o sali di citrato per promuovere la separazione della miscela acetonitrile/acqua durante l'estrazione. Tuttavia, questi sali tendono ad essere depositati come solidi sulle superfici nella sorgente di spettrometria di massa (MS), il che causa la necessità di una maggiore manutenzione dei metodi basati sulla cromatografia liquida (LC)-MS. In termini di superamento di questi svantaggi, González-Curbelo et al.15 hanno riferito che il formiato di ammonio più volatile ha funzionato bene per indurre la separazione di fase e l'estrazione di residui di pesticidi per la spettrometria di massa sia LC che GC-tandem (MS / MS). Studi successivi hanno anche utilizzato 0,5 g di formiato di ammonio per grammo di campione per estrarre residui di pesticidi da varie matrici complesse16,17,18,19. Inoltre, è stato dimostrato che l'uso del formiato di ammonio fornisce quantità inferiori di materiale co-estratto20, il che giustifica il suo uso per i metodi basati su GC-MS. Il presente studio, per la prima volta, riporta questa versione per analizzare i residui di pesticidi nei suoli21.
L'analisi GC dei residui di pesticidi in matrici complesse come i suoli presenta alcune limitazioni a causa dell'azione dei componenti della matrice co-estratti sulla risposta strumentale dei pesticidi, che causa determinazione imprecisa e minore sensibilità22,23. Pertanto, sono stati apportati diversi miglioramenti per ridurre al minimo l'effetto matrice, inclusi i passaggi di pulizia ottimizzati21. Tuttavia, l'effetto matrice è ancora in atto e dovrebbe essere corretto il più possibile. In questo senso, la calibrazione a matrice è stata l'approccio principale utilizzato perché è molto pratica nel compensare il potenziamento del segnale cromatografico rispetto a quello dei solventi puri24. Pertanto, in questo studio, la linearità è stata valutata costruendo le curve di calibrazione in acetonitrile puro e utilizzando estratti del suolo, e valori di R2 superiori o uguali a 0,99 per tutti gli OCP sono stati ottenuti utilizzando entrambi gli approcci. Tuttavia, quando sono state confrontate entrambe le curve di calibrazione, sono stati riscontrati effetti di matrice apprezzabili nell'intervallo compreso tra -49% e 191% (Figura 2). Sebbene il numero di pesticidi che hanno subito un forte effetto della matrice fosse solo 3 su 17 (endrin, endrin chetone e metossicloro), sono stati condotti studi successivi utilizzando le curve di calibrazione abbinate alla matrice per compensare gli effetti della matrice in misura maggiore.
Non sono stati fissati limiti massimi di residui (LMR) per i residui di antiparassitari nel suolo, ma è stato fissato un LCL di 5 μg/kg per tutti gli OCP, che è inferiore all'LMR standard molto esigente fissato a 10 μg/kg dalla legislazione internazionale per l'analisi dei residui di antiparassitari nei prodotti agroalimentari (regolamento (CE) n. 396/2005)11. Inoltre, il LCL di 5 μg/kg ha fornito un rapporto segnale/rumore (S/N) di circa 10 per tutti gli OCP. L'elevata sensibilità di questo metodo è simile o addirittura migliore di quella ottenuta in altri studi che hanno analizzato anche gli OCP nei terreni utilizzando il metodo QuEChERS seguito da GC-MS. Ad esempio, in uno studio, 34 OCP sono stati analizzati utilizzando la versione ufficiale del metodo QuEChERS che utilizza un tampone citrato e i limiti di quantificazione (LOQ) erano uguali o superiori a 7 μg / kg25. In particolare, i valori LOQ di α-BHC, β-BHC, lindano e δ-BHC erano compresi tra 206 μg/kg e 384 μg/kg. In un altro lavoro, il lindano e il dieldrin sono stati analizzati utilizzando la stessa versione del metodo QuEChERS e sono stati ottenuti valori LOQ di 42 μg / kg e 292 μg / kg, rispettivamente26. Allo stesso modo, un altro lavoro di ricerca ha anche determinato aldrin ed eptacloro utilizzando QuEChERS e GC-MS, con valori LOQ di 13 e 23 μg / kg, rispettivamente27.
La valutazione del recupero e della riproducibilità è stata sviluppata a tre livelli di concentrazione (basso, medio e alto) in triplice copia (n = 9). A tal fine, i valori complessivi di recupero sono stati determinati confrontando i rapporti area di picco del pesticida/IS (4,4'-DDE-d8) ottenuti dai campioni di terreno picchiati all'inizio dell'applicazione del metodo QuEChERS utilizzando formiato di ammonio con quelli di calibrazione abbinata alla matrice. In tutti i casi, ogni replica è stata iniettata due volte nella stessa sequenza. Va notato che l'utilizzo di un IS, uno standard etichettato isotopicamente, consente di compensare le possibili perdite dei pesticidi che si verificano durante l'intera procedura, nonché l'effetto matrice e / o la possibile variabilità nello strumento. Secondo i risultati, la maggior parte dei pesticidi ha soddisfatto i criteri di accettabilità del 70% -120% dei valori di recupero con RSD ≤20% ad ogni livello di spiking28, che ha dimostrato l'efficacia e la ripetibilità del metodo. Tuttavia, i valori di recupero complessivi (n = 9) erano leggermente superiori al 120% per eptacloro (122%), endrin (121%) e β-endosulfan (130%), sebbene fossero coerenti (RSD <13%). In questo senso, considerando i valori di recupero complessivi a tre livelli di picchiata, è stato stabilito un criterio di accettabilità del 30%-140% con valori RSD ≤20%28.
In conclusione, il metodo QuEChERS che utilizza formiato di ammonio accoppiato con GC-MS può determinare con successo OCP in campioni di terreno agricolo. In questo studio è stato dimostrato che la semplice aggiunta di 5 g di formiato di ammonio per indurre la separazione di fase tra gli strati di acqua e acetonitrile ha garantito un'estrazione adeguata con elevati recuperi dei pesticidi selezionati. Tuttavia, l'effetto matrice ha continuato a verificarsi, quindi altri approcci, come l'aggiunta di protettori dell'analita, dovrebbero essere studiati nei lavori successivi. In ogni caso, questa alternativa alle versioni ufficiali di QuEChERS può essere utilizzata per evitare i solidi indesiderati depositati nel sistema analitico a causa dell'uso di sali di magnesio e sodio, specialmente nelle analisi di routine basate su LC-MS. In quest'ultimo caso, sarebbe ancora più interessante poiché il formiato di ammonio è un aiuto per la ionizzazione nella ionizzazione elettrospray positiva e può migliorare la formazione di addotti di ammonio invece di addotti di sodio.
Divulgazioni
Non ho conflitti di interesse da rivelare.
Riconoscimenti
Vorrei ringraziare Javier Hernández-Borges e Cecilia Ortega-Zamora per il loro inestimabile sostegno. Voglio anche ringraziare l'Universidad EAN e l'Universidad de La Laguna.
Materiali
| Name | Company | Catalog Number | Comments |
| 15 mL disposable glass conical centrifuge tubes | PYREX | 99502-15 | |
| 2 mL centrifuge tubes | Eppendorf | 30120094 | |
| 50 mL centrifuge tubes with screw caps | VWR | 21008-169 | |
| 5977B mass-selective detector | Agilent Technologies | 1617R019 | |
| 7820A gas chromatography system | Agilent Technologies | 16162016 | |
| Acetone | Supelco | 1006582500 | |
| Acetonitrile | VWR | 83642320 | |
| Ammonium formate | VWR | 21254260 | |
| Automatic shaker KS 3000 i control | IKA | 3940000 | |
| Balance | Sartorius Lab Instruments Gmbh & Co | ENTRIS224I-1S | |
| Bondesil-C18, 40 µm | Agilent Technologies | 12213012 | |
| Bondesil-PSA, 40 µm | Agilent Technologies | 12213024 | |
| Cyclohexane | VWR | 85385320 | |
| EPA TCL pesticides mix | Sigma Aldrich | 48913 | |
| Ethyl acetate | Supelco | 1036492500 | |
| G4567A automatic sampler | Agilent Technologies | 19490057 | |
| HP-5ms Ultra Inert (5%-phenyl)-methylpolysiloxane 30 m x 250 µm x 0.25 µm column | Agilent Technologies | 19091S-433UI | |
| Magnesium sulfate monohydrate | Sigma Aldrich | 434183-1KG | |
| Mega Star 3.R centrifuge | VWR | 521-1752 | |
| Milli-Q gradient A10 | Millipore | RR400Q101 | |
| p,p'-DDE-d8 | Dr Ehrenstorfer | DRE-XA12041100AC | |
| Pipette tips 2 - 200 µL | BRAND | 732008 | |
| Pipette tips 5 mL | BRAND | 702595 | |
| Pipette tips 50 - 1000 uL | BRAND | 732012 | |
| Pippette Transferpette S variabel 10 - 100 µL | BRAND | 704774 | |
| Pippette Transferpette S variabel 100 - 1000 µL | BRAND | 704780 | |
| Pippette Transferpette S variabel 20 - 200 µL | BRAND | 704778 | |
| Pippette Transferpette S variabel 500 - 5000 µL | BRAND | 704782 | |
| Vials with fused-in insert | Sigma Aldrich | 29398-U | |
| OCPs | CAS registry number | ||
| α-BHC | 319-84-6 | ||
| β-BHC | 319-85-7 | ||
| Lindane | 58-89-9 | ||
| δ-BHC | 319-86-8 | ||
| Heptachlor | 76-44-8 | ||
| Aldrin | 309-00-2 | ||
| Heptachlor epoxide | 1024-57-3 | ||
| α-Endosulfan | 959-98-8 | ||
| 4,4'-DDE-d8 (IS) | 93952-19-3 | ||
| 4,4'-DDE | 72-55-9 | ||
| Dieldrin | 60-57-1 | ||
| Endrin | 72-20-8 | ||
| β-Endosulfan | 33213-65-9 | ||
| 4,4'-DDD | 72-54-8 | ||
| Endosulfan sulfate | 1031-07-8 | ||
| 4,4'-DDT | 50-29-3 | ||
| Endrin ketone | 53494-70-5 | ||
| Methoxychlor | 72-43-5 |
Riferimenti
- Sabzevari, S., Hofman, J. A worldwide review of currently used pesticides' monitoring in agricultural soils. Science of The Total Environment. 812, 152344 (2022).
- Tzanetou, E. N., Karasali, H. A. Comprehensive review of organochlorine pesticide monitoring in agricultural soils: The silent threat of a conventional agricultural past. Agriculture. 12 (5), 728 (2022).
- Farenhorst, A. Importance of soil organic matter fractions in soil-landscape and regional assessments of pesticide sorption and leaching in soil. Soil Science Society of America Journal. 70 (3), 1005-1012 (2006).
- Silva, V., et al. Pesticide residues in European agricultural soils - A hidden reality unfolded. Science of The Total Environment. 653, 1532-1545 (2019).
- Vischetti, C., et al. Sub-lethal effects of pesticides on the DNA of soil organisms as early ecotoxicological biomarkers. Frontiers in Microbiology. 11, 1892 (2020).
- Alengebawy, A., Abdelkhalek, S. T., Qureshi, S. R., Wang, M. -. Q. Heavy metals and pesticides toxicity in agricultural soil and plants: Ecological risks and human health implications. Toxics. 9 (3), 42 (2021).
- Zikankuba, V. L., Mwanyika, G., Ntwenya, J. E., James, A. Pesticide regulations and their malpractice implications on food and environment safety. Cogent Food & Agriculture. 5 (1), 1601544 (2019).
- Varela-Martínez, D. A., González-Sálamo, J., González-Curbelo, M. &. #. 1. 9. 3. ;., Hernández-Borges, J. Quick, Easy, Cheap, Effective, Rugged and Safe (QuEChERS) extraction. Handbooks in Separation Science. , 399-437 (2020).
- Anastassiades, M., Lehotay, S. J., Štajnbaher, D., Schenck, F. J. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce. Journal of AOAC International. 86 (2), 412-431 (2003).
- González-Curbelo, M. &. #. 1. 9. 3. ;., et al. Evolution and applications of the QuEChERS method. Trends in Analytical Chemistry. 71, 169-185 (2015).
- European Union. European Regulation (EC) NO 396/2005 of the European Parliament and of the Council of 23 February 2005 on maximum residue levels of pesticides in or on food and feed of plant and animal origin and amending Council Directive 91/414/EEC. Official Journal of the European Union. 70, 1-16 (2005).
- Kwon, H., Lehotay, S. J., Geis-Asteggiante, L. Variability of matrix effects in liquid and gas chromatography-mass spectrometry analysis of pesticide residues after QuEChERS sample preparation of different food crops. Journal of Chromatography A. 1270, 235-245 (2012).
- Lehotay, S. J., et al. Determination of pesticide residues in foods by acetonitrile extraction and partitioning with magnesium sulfate: Collaborative study. Journal of AOAC International. 90 (2), 485-520 (2007).
- European Committee for Standardization (CEN). Standard Method EN 15662. Food of plant origin-Determination of pesticide residues using GC-MS and/or LC-MS/MS following acetonitrile extraction/partitioning and clean-up by dispersive SPE-QuEChERS method. European Committee for Standardization. , (2008).
- González-Curbelo, M. &. #. 1. 9. 3. ;., Lehotay, S. J., Hernández-Borges, J., Rodríguez-Delgado, M. &. #. 1. 9. 3. ;. Use of ammonium formate in QuEChERS for high-throughput analysis of pesticides in food by fast, low-pressure gas chromatography and liquid chromatography tandem mass spectrometry. Journal of Chromatography A. 1358, 75-84 (2014).
- Han, L., Sapozhnikova, Y., Lehotay, S. J. Method validation for 243 pesticides and environmental contaminants in meats and poultry by tandem mass spectrometry coupled to low-pressure gas chromatography and ultrahigh-performance liquid chromatography. Food Control. 66, 270-282 (2016).
- Lehotay, S. J., Han, L., Sapozhnikova, Y. Automated mini-column solid-phase extraction clean-up for high-throughput analysis of chemical contaminants in foods by low-pressure gas chromatography-tandem mass spectrometry. Chromatographia. 79 (17), 1113-1130 (2016).
- Lehotay, S. J. Possibilities and limitations of isocratic fast liquid chromatography-tandem mass spectrometry analysis of pesticide residues in fruits and vegetables. Chromatographia. 82 (1), 235-250 (2019).
- Han, L., Matarrita, J., Sapozhnikova, Y., Lehotay, S. J. Evaluation of a recent product to remove lipids and other matrix co-extractives in the analysis of pesticide residues and environmental contaminants in foods. Journal of Chromatography A. 1449, 17-29 (2016).
- Varela-Martínez, D. A., González-Curbelo, M. &. #. 1. 9. 3. ;., González-Sálamo, J., Hernández-Borges, J. Analysis of pesticides in cherimoya and gulupa minor tropical fruits using AOAC 2007.1 and ammonium formate QuEChERS versions: A comparative study. Microchemical Journal. 157, 104950 (2020).
- González-Curbelo, M. &. #. 1. 9. 3. ;., Varela-Martínez, D. A., Riaño-Herrera, D. A. Pesticide-residue analysis in soils by the QuEChERS method: A review. Molecules. 27 (13), 4323 (2022).
- Anastassiades, M., Maštovská, K., Lehotay, S. Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides. Journal of Chromatography A. 1015 (1-2), 163-184 (2003).
- Maštovská, K., Lehotay, S., Anastassiades, M. Combination of analyte protectants to overcome matrix effects in routine GC analysis of pesticide residues in food matrixes. Analytical Chemistry. 77 (24), 8129-8137 (2005).
- Rahman, M., Abd El-Aty, A., Shim, J. Matrix enhancement effect: A blessing or a curse for gas chromatography? - A review. Analytica Chimica Acta. 801, 14-21 (2013).
- Rouvire, F., Buleté, A., Cren-Olivé, C., Arnaudguilhem, C. Multiresidue analysis of aromatic organochlorines in soil by gas chromatography-mass spectrometry and QuEChERS extraction based on water/dichloromethane partitioning. Comparison with accelerated solvent extraction. Talanta. 93, 336-344 (2012).
- Lesueur, C., Gartner, M., Mentler, A., Fuerhacker, M. Comparison of four extraction methods for the analysis of 24 pesticides in soil samples with gas chromatography-mass spectrometry and liquid chromatography-ion trap-mass spectrometry. Talanta. 75 (1), 284-293 (2008).
- Ðurović-Pejčev, R. D., Bursić, V. P., Zeremski, T. M. Comparison of QuEChERS with traditional sample preparation methods in the determination of multiclass pesticides in soil. Journal of AOAC International. 102 (1), 46-51 (2019).
- European Commission. SANTE/11312/2021. Guidance document on analytical quality control and method validation procedures for pesticide residues analysis in food and feed. European Commission. , (2021).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon