Method Article
Имплантация и оценка меланомы в сосудистой оболочке мыши с помощью оптической когерентной томографии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Настоящий протокол описывает имплантацию и оценку меланомы в сосудистой оболочке мыши с использованием оптической когерентной томографии.
Аннотация
Создание экспериментальных моделей меланомы хориоидеи является сложной задачей с точки зрения способности индуцировать опухоли в правильной локализации. Кроме того, трудности в наблюдении за меланомой задней хориоидеи in vivo ограничивают локализацию опухоли и оценку роста в режиме реального времени. Описанный здесь подход оптимизирует методы определения меланомы хориоидеи у мышей с помощью многоступенчатой процедуры субхориоидальной инъекции клеток B16LS9. Чтобы обеспечить точность при введении в небольшие размеры сосудистой оболочки мыши, вся процедура выполняется под микроскопом. Сначала конъюнктивальная перитомия формируется в дорсально-височной области глаза. Затем путем введения иглы через обнаженную склеру создается тракт в подхориоидальное пространство. Затем следует введение тупой иглы в тракт и инъекция клеток меланомы в сосудистую оболочку. Сразу после инъекции используется неинвазивная оптическая когерентная томография (ОКТ) для определения местоположения и прогрессирования опухоли. Отслойка сетчатки оценивается как предиктор локализации и размера опухоли. Представленный метод позволяет воспроизвести индукцию меланомы, локализованной в сосудистой оболочке у мышей, и визуализировать оценку роста опухоли в реальном времени. Таким образом, он является ценным инструментом для изучения внутриглазных опухолей.
Введение
Увеальная меланома (УМ) является наиболее частым внутриглазным первичным злокачественным новообразованием у взрослых. Приблизительно 90% меланом глаза происходят из меланоцитов в сосудистой оболочке увеального тракта1. UM является основной причиной заболеваемости и смертности, поскольку, по оценкам, около 50% пациентов развивают метастатическое заболевание, причем печень является основным местом метастазирования2. Раннее лечение первичных поражений может снизить вероятность метастазов, однако никакое эффективное лечение не предотвращает образование метастазов3.
Стандартное лечение увеальной меланомы включает лучевую терапию, которая связана с потерей зрения из-за оптической нейропатии, ретинопатии, синдрома сухого глаза и катаракты. Хирургическая резекция обычно откладывается до тех пор, пока рост поражения не будет распознан и охарактеризован. Однако такая задержка может привести к развитию метастатического заболевания4. В некоторых случаях требуется бесполезная энуклеация. Конечно, эта радикальная процедура ставит под угрозу зрение и приводит к резкому ухудшению эстетики.
Было предпринято много усилий, посвященных разработке экспериментальных моделей для изучения увеальной меланомы. Доклинические модели на животных, которые позволяют точно оценить это злокачественное новообразование, являются ключевыми для изучения новых диагностических и терапевтических стратегий увеальной меланомы. Экспериментальные модели меланомы глаза на животных в основном основаны на инокуляции опухолевых клеток у мышей, крыс и кроликов 5,6. Мышиные модели экономически эффективны и широко используются для исследований меланомы из-за их быстрой скорости размножения и высокого сходства генома с людьми. Клеточная линия меланомы кожи мышей B16 обычно используется для инокуляции мышей C57BL6 и индуцирования сингенных опухолей. При использовании этой модели для индукции увеальной меланомы опухолевидные глаза обычно необходимо энуклеировать через 7-14 дней после инокуляции. Кроме того, B16 является высокоинвазивной моделью. Иммунно-привилегированная природа глаза поддерживает метастазирование, и метастазы обычно могут быть обнаружены через 3-4 недели после инокуляции опухолевых клеток. Субкультуры исходной линии B16 проявляют отчетливые метастатические свойства6. Например, линия меланомы Квинса имеет высокий показатель метастазов 7,8. Клеточная линия B16LS9 имеет морфологию дендритных клеток и была получена из метастазов в печень мышей C57BL / 6, которым была введена родительская линия кожной меланомы B16F19. Было показано, что при введении в задний отдел глаза эти клетки образуют внутриглазные опухоли, которые гистологически напоминают увеальную меланому человека и образуют специфические для печени метастазы у C57BL / 6, но не у Balb / C, мышей10,11,12. Генетически клетки характеризуются более высокой экспрессией протоонкогена c-met, который действует как клеточный рецептор для фактора роста гепатоцитов13. Напротив, B16F10,10-й пассаж родительского B16, в первую очередь метастазирует в легкие при инокуляциивнутриглазно 14. И B16F10, и B16LS9 пигментированы12.
Несколько ключевых проблем ограничивают успех моделей увеальной меланомы у мышей. Во-первых, рефлюкс опухолевых клеток может привести к экстраокулярной или субконъюнктивальной меланоме. Во-вторых, рост опухоли после внутриглазной инокуляции клеток меланомы часто сильно варьируется, что создает трудности в оценке лечения и прогресса. Другой серьезной трудностью является ограниченная способность следить за ростом опухоли in vivo. В то время как биолюминесцентная визуализация, такая как опухоли, экспрессирующие люциферазу, обычно используется для мониторинга роста опухолиглаза 15,16, она не может предоставить информацию о внутриглазном расположении опухоли. Поэтому оценка опухоли обычно проводится после энуклеации глаза10,17. Это значительно ограничивает способность характеризовать прогрессирование опухоли и широкий ответ на лечение. Еще одним серьезным препятствием в изучении увеальной меланомы является трудность мониторинга поражений у пигментированных мышей. Новые подходы, которые преодолевают эти трудности, необходимы для содействия исследованию увеальной меланомы на животных моделях.
Оптическая когерентная томография (ОКТ) предоставляет отличительные возможности для получения изображений вглубь различных участков глаза с высоким разрешением, что не имеет аналогов в других методологиях, включая ультразвук18,19. ОКТ-визуализация использовалась на животных моделях для изучения различных глазных заболеваний20. Недавно ОКТ-визуализация была продемонстрирована как неинвазивное средство оценки внутриглазного роста опухоли21. Описанный здесь протокол изображает имплантацию клеток меланомы в сосудистую оболочку мыши и использование ОКТ для прогнозирования локализации и размера внутриглазной опухоли во время инокуляции клеток.
протокол
Эксперименты в протоколе были одобрены Израильским национальным советом по экспериментам на животных и соответствуют Заявлению ARVO об использовании животных в офтальмологических исследованиях и исследованиях зрения. Самки мышей C57BL / 6 в возрасте 8-10 недель были использованы для настоящего исследования и подвергались воздействию 12/12-часовых циклов света-темноты. Животные были получены из коммерческого источника (см. Таблицу материалов).
1. Клеточная культура
- Культивирование клеток B16LS9 в среде RPMI 1640 с добавлением 10% эмбриональной бычьей сыворотки, 2 мМ L-глутамина, 1 мМ пирувата натрия, 25 мМ HEPES, 1% смеси незаменимых витаминов, 200 ЕД/мл пенициллина и 200 мг/мл стрептомицина (см. Таблицу материалов), в увлажненном инкубаторе с температурой 37 °C с 5%CO2.
- Собирают клетки для инъекций при слиянии 70%-80%.
2. Подготовка животных
- Приготовьте обезболивающую смесь кетамина (75 мг/кг массы тела) и медетомидина (0,5 мг/кг массы тела). Обезболивают мышей, вводя анестезирующую смесь внутрибрюшинно за одну инъекцию.
- Нанесите местный офтальмологический анестетик оксибупрокаин (0,4%) на оба глаза.
- Расширьте зрачки мышей, местно применяя тропикамид (0,5%).
3. Создание перитомии конъюнктивы и склерального тракта в подхориоидальное пространство
- Нанесите 1,4% гидроксиэтилцеллюлозу (см. Таблицу материалов) в качестве смазки на оба глаза, чтобы избежать высыхания. Нанесите 0,5% тропикамида на правый глаз.
- Наблюдайте за прооперированным глазом мыши под операционным микроскопом (см. Таблицу материалов). Держите веки открытыми стерильными внутриглазными щипцами.
- С помощью внутриглазных щипцов возьмитесь за верхневисочную лимбальную конъюнктиву и потяните в сторону инфрананазального положения22. Закрепите это положение, удерживая его на протяжении всей процедуры (рис. 1А).
- Используя кончик иглы 30 G, сделайте небольшую (1-2 мм) перитомию конъюнктивы в дорсально-височной области, примерно на 1-2 мм кзади от лимба.
ПРИМЕЧАНИЕ: Использование более тонких игл может предотвратить чрезмерную пункцию и повысить точность определения местоположения опухоли. - Удалите излишки капсулы Тенона из отверстия перитомии.
ПРИМЕЧАНИЕ: Капсула Тенона представляет собой слой плотной соединительной ткани, которая окружает глазнойшар 22. - В этом месте вставьте кончик иглы, чтобы проникнуть через склеру. Сделайте иссечение, чтобы создать тракт в субхориоидальном пространстве до тех пор, пока коричневый цвет сосудистой оболочки не появится через обнаженное белое вещество склеры (рис. 1B).

Рисунок 1: Инокуляция опухолевых клеток . (A) Верхневисочная лимбальная конъюнктива удерживается с помощью внутриглазных щипцов и подтягивается к инфраносальному положению. (B) Наконечник иглы 30 G вводится для проникновения через склеру, и делается иссечение для создания дорожки в подхориоидальном пространстве. (C) Шприц, наполненный клетками и оснащенный иглой 32 G, вставляется в дорожку, и клетки вводятся. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Инокуляция клеток меланомы
- Ресуспендирование 70 000 клеток B16LS9 в 2 мкл PBS. Эта сумма рассчитана на один глаз.
- Загрузите клетки в стерильный стеклянный шприц Гамильтона объемом 10 мкл (см. Таблицу материалов), установленный с помощью тупой иглы 32 G, скрученной под углом 45°.
- Вставьте загруженную иглу шприца примерно на 2 мм в дорожку, созданную на шаге 3.
- Вводят 2 мкл клеточной суспензии.
- Удерживайте иглу на месте после инъекции в течение 2-3 с, пока вся жидкость не очистится.
- Извлеките иглу, осторожно и медленно вытащив ее, чтобы избежать утечки из дорожки (рис. 1C).
ПРИМЕЧАНИЯ: Регулировка скорости и силы инъекции может повлиять на характер развития опухоли. Предлагается, чтобы эти параметры были откалиброваны людьми, экспериментирующими, чтобы определить правильную приложенную силу и скорость. Всего в предварительных экспериментах было определено 70 000 клеток. Однако, поскольку могут быть различия в типах или партиях клеточных культур или между штаммами мышей, калибровка этого числа необходима.
5. Оценка места инъекции
- Наблюдайте за инъецированным глазом с помощью ОКТ-сканирования сразу после инокуляции клеток меланомы, чтобы определить появление отслойки сетчатки (RD), повреждения сетчатки и / или клеток в стекловидном теле23.
ПРИМЕЧАНИЯ: При необходимости повторно нанесите тропикамид, оксибупрокаин и этилцеллюлозу. - На основе ОКТ-сканирования из шага 5.1 классифицируйте шаблоны21 RD в соответствии с: (1) локальным сайтом RD-one RD; (2) утечка в материал клеток стекловидного тела в стекловидном теле; (3) расширенные RD-множественные сайты RD.
- Прогнозировать локализацию опухоли на основе: (1) локальных РД-ожидаемых опухолей хориоидеи; (2) утечка в ожидаемые опухоли стекловидного тела в стекловидном теле; (3) расширенные РД-ожидаемые вариабельные и дисперсные опухоли (рис. 2).
ПРИМЕЧАНИЕ: Ожидается, что только у мышей с локальным RD (около 50%) разовьются опухоли, ограниченные сосудистой оболочкой.
6. Прогнозирование размера опухоли на основе высоты RD
- Измерьте высоту локального RD в ОКТ-сканировании с помощью программного обеспечения для сегментации/анализа ОКТ (см. Таблицу материалов) и классифицируйте по следующим группам: малый = <300 мкм; средний = 300-400 мкм; большой = >400 мкм.
- Оцените объем, который, как ожидается, опухоли достигнут в течение 5 дней после инъекции в соответствии со следующими критериями:
Небольшая высота RD обычно наблюдается при опухолях небольшого размера (объем опухоли колеблется от 0,0059 мм3 до 0,07 мм3 со средним объемом 0,027 ± 0,005мм3).
Средняя высота РД обнаруживается как при малых, так и при средних опухолях (объем опухоли колеблется от 0,015 мм3 до 0,15 мм3 со средним объемом 0,056 ± 0,016мм3).
Большая высота РД связана с широким диапазоном объемов опухоли до 0,36мм3.
ПРИМЕЧАНИЕ: Диапазон ожидаемых размеров опухоли был получен из предыдущих результатов и разделен на три группы малых, средних и крупных опухолей.
7. Послеоперационные процедуры
- Применяют офтальмологический офлоксацин 0,3% местно.
- Отмените анестезию, введя атипамезола гидрохлорид (3 мг / кг) подкожно.
- Подкожно вводят бупренорфин (0,05 мг/кг массы тела) два раза в день в течение 3 дней, чтобы уменьшить боль и страдания животных.
- Через 5 дней после инъекции клеток меланомы оцените размер опухоли, выполнив следующие действия.
- Обезболивайте мышей, как описано в шаге 2.1. Применяют тропикамид (0,5%).
- Исследуйте глаза с помощью продольного и сагиттального ОКТ-сканирования и используйте программное обеспечение для сегментации/анализа ОКТ для измерения объема и локализации опухоли.
- Рассчитайте объем опухоли по формуле24: V = a*b*c*6/π (a, b и c = длина, ширина и высота соответственно).
- Исследуйте размер опухоли каждые 2-3 дня, как описано в шагах 7.4.1-7.4.3.
ПРИМЕЧАНИЕ: Процедура должна быть оптимизирована при использовании разных штаммов мышей или клеточных линий.
Результаты
Глаза исследовали с помощью ОКТ сразу после инъекции клеток B16LS9. После инъекции наблюдалась локальная отслойка сетчатки. У мышей наблюдалось три паттерна РД: очаговая (рис. 2, верхняя панель), утечка в стекловидное тело (рис. 2, средняя панель) и расширенная РД (рис. 2, нижняя панель). Расширенный RD, вероятно, вызван повреждением от инъекции. Выявлена связь между картиной РД сразу после инъекции и локализацией опухолей через 5-7 дней после инъекции. Как показано на рисунке 2, фокальный RD был связан с ростом опухолевых клеток, который был ограничен сосудистой оболочкой. Однако наблюдение за клетками стекловидного тела после инъекции у животных с фокальным РД указывало на рост опухоли в витреальной полости в дополнение к сосудистой оболочке. Наконец, когда после инъекции наблюдался расширенный RD или RD в нескольких местах, опухоли были рассеяны по всей сосудистой оболочке и стекловидному телу через 5 дней. Предыдущие исследования показали, что характеристика опухолей с помощью ОКТ полностью коррелирует с гистологическим исследованием21.

Рисунок 2: Прогнозирование роста опухоли после инъекции субхориоидальных клеток на основе ОКТ. В общей сложности 7 × 10клеток 4 B16LS9 в 2 мкл PBS были введены в подсосудистое пространство глаз мыши. Место инъекции визуализировали с помощью ОКТ и визуализации глазного дна сразу после инъекции клеток (слева). Пунктирными линиями обозначено обнаружение фокального РД (вверху), клеточного материала на стекловидном теле (посередине) и расширенного РД (внизу). Справа пунктирными линиями обозначена опухолевая масса через 5 дней после инъекции. Эта цифра адаптирована из Zaks et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Диапазон размеров опухолей, индуцированных в этой модели, можно разделить на маленькие, средние и большие (рис. 3). Высота РД после инъекции была связана с размером опухоли через 5 дней после инъекции, измеренной с помощью горизонтального и вертикального ОКТ-сканирования (рис. 4). Высоты RD, связанные с размерами опухоли, показаны в таблице 1.
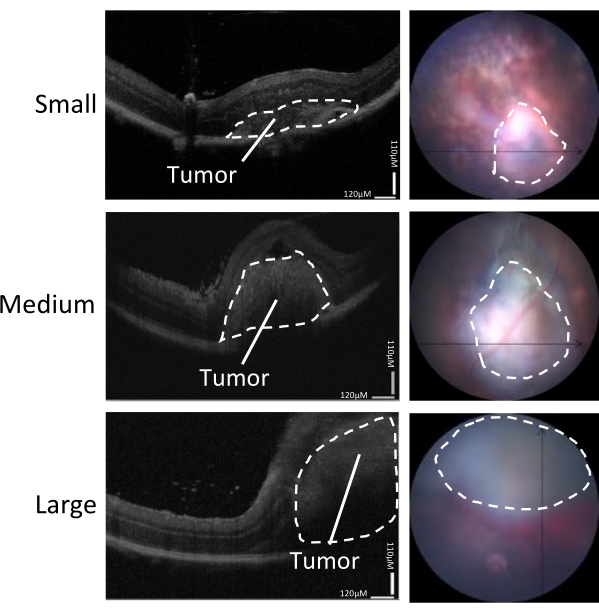
Рисунок 3: Определение размера опухоли. Рост опухоли оценивали с помощью ОКТ-сканирования (слева) и изображения глазного дна в режиме реального времени (справа) через 5-7 дней после инокуляции. Показаны репрезентативные изображения малых, средних и крупных опухолей. Эта цифра адаптирована из Zaks et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
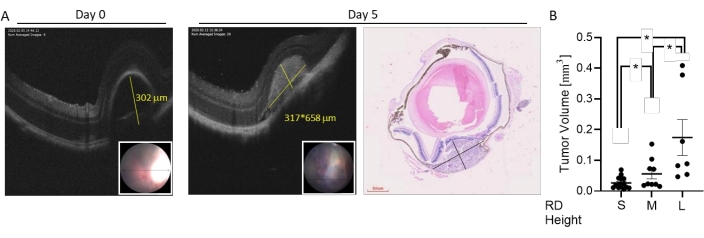
Рисунок 4: Классификация размера опухоли на основе ОКТ-визуализации в реальном времени. Опухоли индуцировали субхориоидальной инъекцией 7 × 104 клеток B16LS9. Рост опухоли оценивали в живой ОКТ-визуализации сразу и через 5 дней после инъекции. (A) Репрезентативное ОКТ-измерение роста РД после инъекции (день 0, слева, желтая линия указывает высоту), высоты и ширины опухоли при горизонтальном ОКТ-сканировании (5-й день, середина, желтые линии указывают высоту и ширину) и окрашенного H & E разреза глаза (справа). Вставка: изображение глазного дна зоны РД. (B) Диапазон индуцированных размеров опухоли был разделен на три группы. Представлены измерения объема опухоли у мышей, у которых был маленький (S, n = 15), средний (M, n = 9) или большой (L, n = 7) RD сразу после инъекции клеток. *p < 0,05. Эта цифра адаптирована из Zaks et al.21. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Высота RD | Объем опухоли |
| <300 мкм (маленький) | 0,0059 мм 3 до 0,07 мм 3 (в среднем 0,027 ± 0,005 мм3) |
| 300-400 мкм (средний) | От 0,015 мм 3 до 0,15 мм 3 (в среднем 0,056 ± 0,016 мм3) |
| > 400 мкм (большой) | От 0,05 мм 3 до 0,36 мм 3 (в среднем 0,017 ± 0,06 мм3) |
Таблица 1: Связанные высоты RD с размером опухоли.
Обсуждение
Увеальная меланома является разрушительным заболеванием, для которого крайне необходимы новые терапевтические подходы. Однако исследования увеальной меланомы и потенциальных методов лечения ограничены техническими проблемами моделей увеальной меланомына животных 1,25. Опухоли глаз, которые индуцируются внутриглазной инъекцией раковых клеток, сильно различаются как по локализации, так и по размеру, вероятно, из-за небольших размеров мышиного глаза. Такая вариабельность является препятствием для всесторонней оценки опухолевой прогрессии. Экспериментальный подход, описанный в настоящем описании, позволяет оценить внутриглазную локализацию опухоли и прогнозируемый размер сразу после субхориоидальной инъекции клеток меланомы B16LS9 на основе ОКТ-визуализации21 в реальном времени. На протяжении многих лет развитие методов визуализации в реальном времени обеспечивало преимущества в исследованиях рака, позволяя отслеживать прогрессирование опухоли на протяжении всех экспериментов, а не только в заранее определенных конечных точках. К таким методам относятся, например, биолюминесцентная визуализация с использованием репортерных клеток, что позволяет контролировать расположение опухолей и метастазов у живых животных, включая идентификацию опухолейглаза 16. Другим сложным методом является фотоакустическая визуализация, которая позволяет получать изображения клеток с высоким разрешением и отличать клетки меланомы от здоровыхклеток 26,27. Однако несомненным преимуществом ОКТ является возможность идентифицировать внутриглазное расположение опухолей и оценить их размер у живых животных.
Описанный здесь протокол изображает внутриглазную инокуляцию клеток меланомы путем формирования перитомии и тракта в субхориоидальное пространство с последующим аккуратным введением тупой иглы в кончик тракта и инъекцией клеток. Это исключает чрезмерную пункцию и направляет место инокуляции клеток. Инъекция вызывает отслоение сетчатки, что отражает локализацию и размер опухоли, которая будет развиваться. Наши наблюдения говорят о том, что опухоли, образующиеся в положении локального РД, как правило, являются очаговыми, а их размер соответствует высоте РД после инъекции. Напротив, множественные РД или обнаружение клеток в стекловидном теле после инъекции обычно приводят к дисперсным опухолям21.
Вполне вероятно, что фокальная РД отражает то, что инъекция уплотняет большинство клеток в определенном месте, что позволяет формировать локализованную опухоль. С другой стороны, множественные участки RD подразумевают, что инъекция достигла нескольких мест по всей сетчатке, увеличивая вероятность того, что опухолевые клетки были имплантированы в многочисленные участки и образовали дисперсные опухоли.
Оценка локализации и прогнозируемого размера опухоли на ранней стадии после инъекции особенно важна при оценке прогрессирования опухоли, например, при изучении влияния конкретных факторов или потенциальных методов лечения. Раннее определение может позволить включить однородную исследовательскую комиссию, повышая воспроизводимость модели, тем самым повышая точность исследования и экономя драгоценное время и затраты. Кроме того, поскольку ОКТ-визуализация внутриглазных опухолей предоставляет точную информацию как о расположении, так и о размере опухолей у живых животных, мыши могут контролироваться для долгосрочных экспериментов, например, для оценки метастазов. Еще одна трудность в мышиных моделях меланомы заключается в том, что пигментация мышей, например, у мышей C57BL / 6, часто ограничивает анализ пигментных опухолей. Таким образом, еще одним преимуществом ОКТ-визуализации является то, что она не зависит от пигментации и может применяться к пигментированным мышам или поражениям.
Следует отметить, что различные параметры, такие как штамм мыши, клеточная линия или техника инъекции, могут влиять на инициацию и рост опухоли. Поэтому рекомендуется оптимизировать модель для конкретных штаммов или клеток. Необходимо также учитывать, что вторичная катаракта может развиваться с течением времени1, ограничивая возможность использования ОКТ. Хотя это вряд ли произойдет в короткие сроки, описанные в настоящем документе, следует рассмотреть возможность увеличения размера группы при проведении более длительных экспериментов, чтобы исключить катаракту глаз.
Таким образом, описанный протокол использует общую модель меланомы B16LS9, оцениваемую с помощью ОКТ-визуализации в реальном времени, для разработки воспроизводимой модели для оценки опухолей хориоидеи у живых животных. Этот подход может быть использован для будущих исследований, изучающих основные механизмы увеальной меланомы, новых экспериментальных моделей и потенциальных новых методов лечения.
Раскрытие информации
Маркович А.Л.: Steba Biotech (), Йеда Вейцман (), АйЙон Медикал (К,), Мор Исум (). c) = консультант; (P) = Патент. У всех остальных авторов нет конкурирующих интересов.
Благодарности
Это исследование было частично поддержано грантом 1304/20 от Израильского научного фонда (ISF), Израиль, для Арье Марковича. Благодарим Шахар Иш-Шалом и Ади Йосиповича из отделения патологии Медицинского центра Каплан, Реховот, Израиль, за гистологический анализ.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
Ссылки
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335 (2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431 (2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. . Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264 (2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены