Method Article
Impianto e valutazione del melanoma nella coroide murina mediante tomografia a coerenza ottica
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il presente protocollo descrive l'impianto e la valutazione del melanoma nella coroide murina utilizzando la tomografia a coerenza ottica.
Abstract
Stabilire modelli sperimentali di melanoma coroideale è impegnativo in termini di capacità di indurre tumori alla corretta localizzazione. Inoltre, le difficoltà nell'osservazione del melanoma coroideale posteriore in vivo limitano la localizzazione del tumore e la valutazione della crescita in tempo reale. L'approccio qui descritto ottimizza le tecniche per stabilire il melanoma coroideale nei topi attraverso una procedura di iniezione di cellule sub-coroideali B16LS9 in più fasi. Per consentire la precisione nell'iniezione nelle piccole dimensioni dell'uvea del topo, la procedura completa viene eseguita al microscopio. In primo luogo, si forma una peritomia congiuntivale nell'area dorsale-temporale dell'occhio. Quindi, viene creato un tratto nello spazio sub-coroideale inserendo un ago attraverso la sclera esposta. Questo è seguito dall'inserimento di un ago smussato nel tratto e l'iniezione di cellule di melanoma nella coroide. Immediatamente dopo l'iniezione, viene utilizzata la tomografia a coerenza ottica non invasiva (OCT) per determinare la posizione e il progresso del tumore. Il distacco di retina viene valutato come predittore del sito e delle dimensioni del tumore. Il metodo presentato consente l'induzione riproducibile del melanoma localizzato dalla coroide nei topi e l'imaging dal vivo della valutazione della crescita tumorale. Come tale, fornisce uno strumento prezioso per lo studio dei tumori intraoculari.
Introduzione
Il melanoma uveale (UM) è la neoplasia primaria intraoculare più frequente negli adulti. Circa il 90% dei melanomi oculari proviene da melanociti nella regione coroidea del tratto uveale1. La UM è una delle principali cause di morbilità e mortalità, poiché si stima che quasi il 50% dei pazienti sviluppi la malattia metastatica, con il fegato che è il sito principale delle metastasi2. Il trattamento precoce delle lesioni primarie può ridurre la possibilità di metastasi, ma nessun trattamento efficace previene la formazione di metastasi3.
Il trattamento standard del melanoma uveale comprende la terapia con irradiazione, che è associata alla perdita della vista a causa di neuropatia ottica, retinopatia, sindrome dell'occhio secco e cataratta. La resezione chirurgica è tipicamente ritardata fino a quando la crescita della lesione è riconosciuta e caratterizzata. Tuttavia, tale ritardo può consentire lo sviluppo di malattia metastatica4. In alcuni casi, è necessaria un'enucleazione futile. Naturalmente, questa procedura radicale compromette la visione e provoca un drammatico deterioramento estetico.
Ci sono stati molti sforzi dedicati allo sviluppo di modelli sperimentali per studiare il melanoma uveale. I modelli animali preclinici che consentono una valutazione accurata di questa neoplasia sono fondamentali per studiare nuove strategie diagnostiche e terapeutiche per il melanoma uveale. I modelli animali sperimentali di melanoma oculare si basano principalmente sull'inoculazione di cellule tumorali in topi, ratti e conigli 5,6. I modelli murini sono economici e ampiamente utilizzati per gli studi sul melanoma a causa del loro rapido tasso di riproduzione e dell'elevata somiglianza del genoma con gli esseri umani. La linea cellulare di melanoma cutaneo murino B16 è comunemente utilizzata per inoculare topi C57BL6 e indurre tumori singeneici. Quando si utilizza questo modello per indurre il melanoma uveale, gli occhi portatori di tumore in genere devono essere enucleati 7-14 giorni dopo l'inoculazione. Inoltre, B16 è un modello altamente invasivo. La natura immuno-privilegiata dell'occhio supporta le metastasi e le metastasi possono essere rilevate in genere 3-4 settimane dopo l'inoculazione delle cellule tumorali. Le sottoculture della linea B16 originale mostrano proprietà metastatiche distinte6. Ad esempio, la linea di melanoma Queens ha un alto tasso metastatico 7,8. La linea cellulare B16LS9 ha morfologia cellulare dendritica ed è stata derivata da metastasi epatiche di topi C57BL/6 iniettati con la linea di melanoma cutaneo parentale B16F19. Quando iniettate nel compartimento posteriore dell'occhio, queste cellule hanno dimostrato di formare tumori intraoculari, che istologicamente assomigliano al melanoma uveale umano e formano metastasi specifiche del fegato in C57BL / 6, ma non Balb / C, topi10,11,12. Geneticamente, le cellule sono caratterizzate da una maggiore espressione del proto-oncogene c-met, che agisce come recettore cellulare per il fattore di crescita degli epatociti13. Al contrario, B16F10, il decimopassaggio del B16 parentale, metastatizza principalmente ai polmoni quando inoculato per via intraoculare14. Sia B16F10 che B16LS9 sono pigmentati12.
Diverse sfide chiave limitano il successo dei modelli di melanoma uveale murino. In primo luogo, il reflusso delle cellule tumorali può portare al melanoma extraoculare o subcongiuntivale. In secondo luogo, la crescita tumorale dopo l'inoculazione intraoculare delle cellule di melanoma è spesso molto variabile, ponendo difficoltà nella valutazione del trattamento e dei progressi. Un'altra grande difficoltà è la limitata capacità di seguire la crescita tumorale in vivo. Mentre l'imaging bioluminescente, come i tumori che esprimono luciferasi, è comunemente usato per monitorare la crescita del tumore oculare15,16, non può fornire informazioni sulla posizione intraoculare del tumore. Pertanto, la valutazione del tumore viene tipicamente eseguita dopo l'enucleazione dell'occhio10,17. Ciò limita notevolmente la capacità di caratterizzare ampiamente la progressione del tumore e la risposta ai trattamenti. Un altro ostacolo importante nello studio del melanoma uveale è la difficoltà nel monitorare le lesioni nei topi pigmentati. Sono necessari nuovi approcci, che superino queste difficoltà, per promuovere la ricerca del melanoma uveale in modelli animali.
La tomografia a coerenza ottica (OCT) fornisce capacità distintive per l'immagine in profondità nelle diverse sezioni dell'occhio in alta risoluzione, che non ha eguali con altre metodologie, tra cui l'ecografia18,19. L'imaging OCT è stato utilizzato in modelli animali per studiare varie malattie oculari20. Recentemente, l'imaging OCT è stato dimostrato come mezzo non invasivo per valutare la crescita tumorale intraoculare21. Il protocollo qui descritto descrive l'impianto di cellule di melanoma nella coroide murina e l'utilizzo di OCT per prevedere la localizzazione e le dimensioni del tumore intraoculare al momento dell'inoculazione cellulare.
Protocollo
Gli esperimenti nel protocollo sono stati approvati dal Consiglio nazionale israeliano sulla sperimentazione animale e sono conformi alla dichiarazione ARVO per l'utilizzo di animali nella ricerca oftalmica e visiva. Topi femmina C57BL/6, di età compresa tra 8-10 settimane, sono stati utilizzati per il presente studio e sono stati esposti a cicli luce-buio di 12/12 ore. Gli animali sono stati ottenuti da una fonte commerciale (vedi Tabella dei materiali).
1. Coltura cellulare
- Coltura di cellule B16LS9 in terreno RPMI 1640, integrate con siero bovino fetale al 10%, 2 mM di L-glutammina, 1 mM di piruvato di sodio, 25 mM HEPES, miscela vitaminica essenziale all'1%, 200 U / mL di penicillina e 200 mg / ml di streptomicina (vedi tabella dei materiali), in un incubatore umidificato a 37 °C con il 5% di CO2.
- Raccogliere le cellule per iniezione al 70% -80% di confluenza.
2. Preparazione degli animali
- Preparare una miscela anestetica di ketamina (75 mg/kg di peso corporeo) e medetomidina (0,5 mg/kg di peso corporeo). Anestetizzare i topi iniettando la miscela anestetica per via intraperitoneale in una singola iniezione.
- Applicare l'anestetico oftalmico topico ossibuprocaina (0,4%) su entrambi gli occhi.
- Dilatare le pupille del topo applicando topicamente tropicamide (0,5%).
3. Creazione di una peritomia congiuntivale e di un tratto sclerale nello spazio sub-coroideale
- Applicare idrossietilcellulosa all'1,4% (vedere la tabella dei materiali) come lubrificante su entrambi gli occhi per evitare l'essiccazione. Applicare lo 0,5% di tropicamide sull'occhio destro.
- Osservare l'occhio operato del topo al microscopio operatorio (vedere Tabella dei materiali). Tenere le palpebre aperte con una pinza intraoculare sterile.
- Usando una pinza intraoculare, tenere la congiuntiva limbare supero-temporale e tirare verso una posizione infranasale22. Assicuratevi questa posizione mantenendola per tutta la durata della procedura (Figura 1A).
- Utilizzando una punta dell'ago da 30 G, eseguire una piccola peritomia congiuntivale (1-2 mm) nell'area dorsale-temporale, circa 1-2 mm posteriormente al limbus.
NOTA: L'uso di aghi più sottili può prevenire una puntura eccessiva e consentire una migliore precisione della posizione del tumore. - Rimuovere la capsula di Tenon in eccesso dall'apertura della peritomia.
NOTA: La capsula di Tenon è uno strato di tessuto connettivo denso che circonda il globo dell'occhio22. - In questa posizione, inserire la punta dell'ago per penetrare attraverso la sclera. Fare un'escissione per creare un tratto nello spazio sub-coroideale fino a quando il colore marrone della coroide appare attraverso la sostanza bianca esposta della sclera (Figura 1B).

Figura 1: Inoculazione delle cellule tumorali . (A) La congiuntiva limbare supero-temporale viene tenuta usando una pinza intraoculare e tirata verso una posizione infranasale. (B) La punta di un ago da 30 G viene inserita per penetrare attraverso la sclera e l'escissione viene effettuata per creare una traccia nello spazio sub-coroideale. (C) Una siringa caricata con cellule e montata con un ago da 32 G viene inserita nel binario e le cellule vengono iniettate. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Inoculazione di cellule di melanoma
- Risospendere 70.000 cellule B16LS9 in 2 μL di PBS. Questa quantità è stimata per occhio.
- Caricare le celle in una siringa Hamilton sterile in vetro da 10 μL (vedere la tabella dei materiali) montata con un ago smussato da 32 G attorcigliato con un angolo di 45°.
- Inserire l'ago della siringa caricato di circa 2 mm nella traccia creata al punto 3.
- Iniettare 2 μL di sospensione cellulare.
- Tenere l'ago in posizione dopo l'iniezione per 2-3 s fino a quando tutto il liquido non si è eliminato.
- Rimuovere l'ago estraendolo delicatamente e lentamente per evitare perdite dal binario (Figura 1C).
NOTE: La regolazione della velocità e della forza di iniezione può influenzare il modello di sviluppo del tumore. Si suggerisce che questi parametri siano calibrati da individui che sperimentano per identificare la giusta forza e velocità applicata. Un totale di 70.000 cellule è stato determinato in esperimenti preliminari. Tuttavia, poiché possono verificarsi variazioni nei tipi o nei lotti di colture cellulari o tra ceppi murini, è necessaria la calibrazione di questo numero.
5. Valutazione della posizione dell'iniezione
- Osservare l'occhio iniettato mediante scansioni OCT immediatamente dopo l'inoculazione delle cellule di melanoma per identificare la comparsa di distacco di retina (RD), danno retinico e / o cellule al vitreo23.
NOTE: Riapplicare tropicamide, ossibuprocaina ed etilcellulosa secondo necessità. - Sulla base delle scansioni OCT del passaggio 5.1, classificare i modelli RD21 in base a: (1) sito RD-one locale di RD; (2) fuoriuscita nel materiale cellulare vitreo di osservazione nel vitreo; (3) siti RD-multipli estesi di RD.
- Prevedere la localizzazione del tumore in base a: (1) tumori coroideali locali RD-attesi; (2) fuoriuscita nei tumori vitreali-attesi nel vitreo; (3) tumori variabili e dispersi estesi attesi da RD (Figura 2).
NOTA: Solo i topi con RD locale (circa il 50%) dovrebbero sviluppare tumori limitati alla coroide.
6. Prevedere le dimensioni del tumore in base all'altezza RD
- Misurare l'altezza della RD locale nelle scansioni OCT utilizzando un software di segmentazione/analisi OCT (vedi Tabella dei materiali) e classificare secondo i seguenti gruppi: piccolo = <300 μm; medio = 300-400 μm; grande = >400 μm.
- Valutare il volume che i tumori dovrebbero raggiungere entro 5 giorni dall'iniezione secondo i seguenti criteri:
Una piccola altezza RD è tipicamente osservata nei tumori di piccole dimensioni (volume tumorale compreso tra 0,0059 mm 3 e 0,07 mm 3 con un volume medio di 0,027 ± 0,005 mm3).
Un'altezza RD media si trova sia nei tumori di piccole che di medie dimensioni (volume tumorale compreso tra 0,015 mm 3 e 0,15 mm 3 con un volume medio di 0,056 ± 0,016 mm3).
Una grande altezza RD è associata a una vasta gamma di volumi tumorali fino a 0,36 mm3.
NOTA: La gamma di dimensioni tumorali attese è stata ottenuta dai risultati precedenti e divisa in tre gruppi di tumori piccoli, medi e grandi.
7. Procedure postoperatorie
- Applicare ofloxacina oftalmica 0,3% topicamente.
- Invertire l'anestesia iniettando atipamezolo cloridrato (3 mg/kg) per via sottocutanea.
- Iniettare per via sottocutanea buprenorfina (0,05 mg/kg di peso corporeo) due volte al giorno per 3 giorni per ridurre il dolore e la sofferenza degli animali.
- A 5 giorni dopo l'iniezione di cellule di melanoma, valutare le dimensioni del tumore seguendo i passaggi seguenti.
- Anestetizzare i topi come descritto al punto 2.1. Applicare tropicamide (0,5%).
- Esaminare gli occhi mediante scansioni OCT longitudinali e sagittali e utilizzare il software di segmentazione/analisi OCT per misurare il volume e la localizzazione del tumore.
- Calcola il volume del tumore usando la formula24: V = a * b * c * 6 / π (a, b e c = lunghezza, larghezza e altezza, rispettivamente).
- Esaminare le dimensioni del tumore ogni 2-3 giorni come descritto nei passaggi 7.4.1-7.4.3.
NOTA: la procedura deve essere ottimizzata se si utilizzano diversi ceppi di topo o linee cellulari.
Risultati
Gli occhi sono stati esaminati tramite OCT immediatamente dopo l'iniezione delle cellule B16LS9. Dopo l'iniezione è stato osservato distacco locale della retina. I topi hanno mostrato tre modelli di RD: focale (Figura 2, pannello superiore), perdita al vitreo (Figura 2, pannello centrale) e RD esteso (Figura 2, pannello inferiore). La RD estesa è probabilmente causata da danni causati dall'iniezione. C'era un'associazione tra il modello di RD immediatamente dopo l'iniezione e la localizzazione dei tumori 5-7 giorni dopo l'iniezione. Come dimostrato nella Figura 2, la RD focale era associata alla crescita delle cellule tumorali limitata alla coroide. Tuttavia, l'osservazione delle cellule nel vitreo dopo l'iniezione in animali che mostravano RD focale ha indicato la crescita tumorale nella cavità vitreale oltre alla coroide. Infine, quando è stata osservata una RD estesa, o RD in più siti, dopo l'iniezione, i tumori sono stati dispersi in tutta la coroide e vitrei dopo 5 giorni. Studi precedenti hanno dimostrato che la caratterizzazione dei tumori mediante OCT è completamente correlata con l'esame istologico21.

Figura 2: Previsione basata sull'OCT della crescita tumorale dopo iniezione di cellule sub-coroideali. Un totale di 7 × 104 cellule B16LS9 in 2 μL di PBS sono state iniettate nello spazio sub-coroideo degli occhi del topo. Il sito di iniezione è stato visualizzato mediante OCT e fundus imaging immediatamente dopo l'iniezione cellulare (a sinistra). Le linee tratteggiate indicano il rilevamento di RD focale (in alto), materiale cellulare nel vitreo (al centro) e RD esteso (in basso). A destra, le linee tratteggiate indicano la massa tumorale 5 giorni dopo l'iniezione. Questa figura è adattata da Zaks et al.21. Fare clic qui per visualizzare una versione ingrandita di questa figura.
La gamma di dimensioni tumorali indotte in questo modello può essere suddivisa in piccola, media e grande (Figura 3). L'altezza della RD dopo l'iniezione è stata associata alla dimensione del tumore a 5 giorni dopo l'iniezione, come misurato dalle scansioni OCT orizzontali e verticali (Figura 4). Le altezze RD associate alle dimensioni del tumore sono mostrate nella Tabella 1.
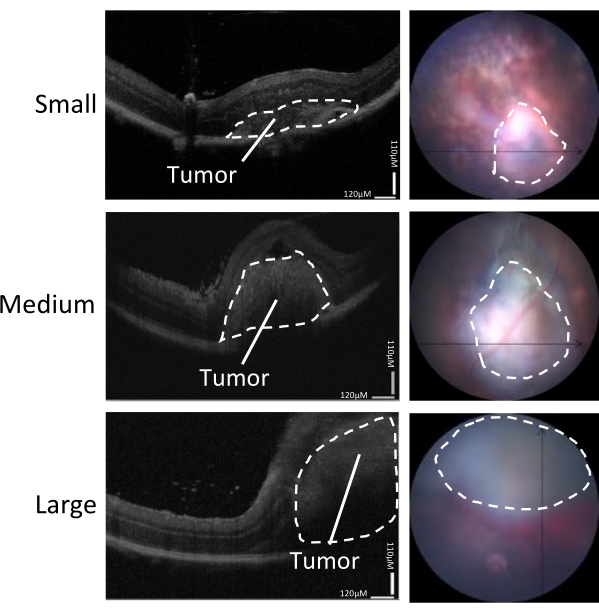
Figura 3: Determinazione della dimensione del tumore. La crescita tumorale è stata valutata mediante scansioni OCT (a sinistra) e visualizzazione in tempo reale della telecamera del fondo oculare (a destra) 5-7 giorni dopo l'inoculazione. Sono mostrate immagini rappresentative di tumori piccoli, medi e grandi. Questa figura è adattata da Zaks et al.21. Fare clic qui per visualizzare una versione ingrandita di questa figura.
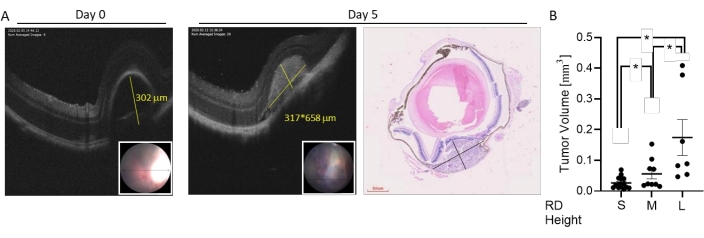
Figura 4: Classificazione delle dimensioni del tumore basata sull'imaging live OCT. I tumori sono stati indotti mediante iniezione sub-coroideale di 7 × 104 cellule B16LS9. La crescita tumorale è stata valutata nell'imaging OCT dal vivo immediatamente e 5 giorni dopo l'iniezione. (A) Una misurazione rappresentativa dell'OCT dell'altezza RD dopo l'iniezione (giorno 0, a sinistra, la linea gialla indica l'altezza), l'altezza e la larghezza del tumore in una scansione OCT orizzontale (giorno 5, al centro, le linee gialle indicano altezza e larghezza) e una sezione oculare colorata con H & E (destra). Riquadro: immagine del fondo oculare dell'area RD. (B) La gamma di dimensioni tumorali indotte è stata divisa in tre gruppi. Sono rappresentate le misurazioni del volume tumorale dei topi che presentavano RD piccola (S, n = 15), media (M, n = 9) o grande (L, n = 7) immediatamente dopo l'iniezione cellulare. *p < 0,05. Questa figura è adattata da Zaks et al.21. Fare clic qui per visualizzare una versione ingrandita di questa figura.
| Altezza RD | Volume tumorale |
| <300 μm (piccolo) | 0,0059 mmda 3 a 0,07 mm 3 (media 0,027 ± 0,005 mm3) |
| 300-400 μm (medio) | Da 0,015 mm 3 a 0,15 mm 3 (media 0,056 ± 0,016 mm3) |
| > 400 μm (grande) | Da 0,05 mm 3 a 0,36 mm 3 (media 0,017 ± 0,06 mm3) |
Tabella 1: Le altezze RD associate alla dimensione del tumore.
Discussione
Il melanoma uveale è una malattia devastante per la quale sono estremamente necessari nuovi approcci terapeutici. Tuttavia, la ricerca sul melanoma uveale e sui potenziali trattamenti è limitata dalle sfide tecniche dei modelli animali di melanoma uveale 1,25. I tumori oculari, che sono indotti dall'iniezione intraoculare di cellule tumorali, sono altamente variabili sia nella localizzazione che nelle dimensioni, probabilmente a causa delle piccole dimensioni dell'occhio del topo. Tale variabilità è un ostacolo alla valutazione completa della progressione tumorale. L'approccio sperimentale qui descritto consente di valutare la localizzazione intraoculare del tumore e le dimensioni previste immediatamente dopo l'iniezione di cellule di melanoma sub-coroideale B16LS9, sulla base dell'imaging OCT vivo21. Nel corso degli anni, lo sviluppo di tecniche di imaging dal vivo ha fornito vantaggi nella ricerca sul cancro consentendo di seguire la progressione del tumore durante gli esperimenti, non solo a endpoint predefiniti. Tali metodi includono, ad esempio, l'imaging bioluminescente utilizzando cellule reporter, che consente il monitoraggio della posizione di tumori e metastasi negli animali viventi, compresa l'identificazione dei tumori oculari16. Un altro metodo sofisticato è l'imaging fotoacustico, che consente l'imaging ad alta risoluzione delle cellule e distingue le cellule di melanoma dalle cellule sane26,27. Tuttavia, il netto vantaggio dell'OCT è la capacità di identificare la posizione intraoculare dei tumori e valutare le loro dimensioni negli animali vivi.
Il protocollo qui descritto descrive l'inoculazione intraoculare delle cellule di melanoma formando una peritomia e un tratto nello spazio sub-coroideale, seguita dall'inserimento delicato di un ago smussato sulla punta del tratto e dall'iniezione cellulare. Ciò elimina la puntura eccessiva e dirige la posizione dell'inoculazione cellulare. L'iniezione induce il distacco di retina, che riflette la localizzazione e le dimensioni del tumore che si svilupperà. Le nostre osservazioni suggeriscono che i tumori formati nella posizione di una RD locale tendono ad essere focali e la loro dimensione corrisponde all'altezza della RD dopo l'iniezione. Al contrario, RD multipli, o cellule rilevanti al vitreo dopo l'iniezione, in genere provocano tumori dispersi21.
È plausibile che la RD focale rifletta che l'iniezione ha compattato la maggior parte delle cellule in una certa posizione, consentendo la formazione di un tumore localizzato. D'altra parte, più siti RD implicano che l'iniezione ha raggiunto diverse posizioni attraverso la retina, aumentando la probabilità che le cellule tumorali siano state impiantate in numerosi siti e abbiano formato tumori dispersi.
La valutazione della localizzazione e delle dimensioni previste del tumore subito dopo l'iniezione è particolarmente importante quando si valutano le progressioni tumorali, come l'esame dell'effetto di fattori specifici o potenziali trattamenti. La determinazione precoce può consentire l'inclusione di un gruppo di studio omogeneo, migliorando la riproducibilità del modello, migliorando così l'accuratezza dello studio e risparmiando tempo e costi preziosi. Inoltre, poiché l'imaging OCT dei tumori intraoculari fornisce informazioni accurate sia sulla posizione che sulle dimensioni dei tumori negli animali vivi, i topi possono essere monitorati per esperimenti a lungo termine, ad esempio, per valutare le metastasi. Un'altra difficoltà nei modelli murini di melanoma è che la pigmentazione del topo, come nei topi C57BL / 6, spesso limita l'analisi dei tumori pigmentati. Pertanto, un altro vantaggio dell'imaging OCT è che è indipendente dalla pigmentazione e può essere applicato a topi pigmentati o lesioni.
Va notato che vari parametri, come il ceppo del topo, la linea cellulare o la tecnica di iniezione, possono influenzare l'inizio e la crescita del tumore. Pertanto, si consiglia l'ottimizzazione del modello per ceppi o cellule specifici. Va inoltre considerato che la cataratta secondaria può svilupparsi nel tempo1, limitando la capacità di utilizzare l'OCT. Mentre è improbabile che ciò accada nel breve lasso di tempo qui descritto, si dovrebbe considerare di aumentare le dimensioni del gruppo se si eseguono esperimenti più lunghi per consentire l'esclusione degli occhi della cataratta.
In sintesi, il protocollo descritto utilizza un modello comune di melanoma B16LS9, valutato mediante imaging OCT vivo, per sviluppare un modello riproducibile per la valutazione dei tumori coroideali negli animali vivi. Questo approccio può essere utilizzato per studi futuri che indagano i meccanismi alla base del melanoma uveale, nuovi modelli sperimentali e potenziali nuove terapie.
Divulgazioni
Marcovich A.L.: Steba Biotech (P), Yeda Weizmann (P), EyeYon Medical (C, P), Mor Isum (P). (c) = consulente; (P) = Brevetto. Tutti gli altri autori non hanno interessi concorrenti.
Riconoscimenti
Questo studio è stato sostenuto in parte dalla sovvenzione 1304/20 della Israel Science Foundation (ISF), Israele, per Arie Marcovich. Ringraziamo Shahar Ish-Shalom e Ady Yosipovich, del Dipartimento di Patologia, Kaplan Medical Center, Rehovot, Israele, per l'analisi istologica.
Materiali
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
Riferimenti
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335 (2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431 (2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. . Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264 (2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon