Method Article
Implantation et évaluation du mélanome dans la choroïde murine par tomographie par cohérence optique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le présent protocole décrit l’implantation et l’évaluation du mélanome dans la choroïde murine à l’aide de la tomographie par cohérence optique.
Résumé
L’établissement de modèles expérimentaux de mélanome choroïdien est difficile en termes de capacité à induire des tumeurs à la localisation correcte. De plus, les difficultés à observer le mélanome choroïdien postérieur in vivo limitent l’emplacement de la tumeur et l’évaluation de la croissance en temps réel. L’approche décrite ici optimise les techniques d’établissement du mélanome choroïdien chez la souris via une procédure d’injection de cellules sous-choroïdiennes B16LS9 en plusieurs étapes. Pour permettre une injection précise dans les petites dimensions de l’uvée de la souris, la procédure complète est réalisée au microscope. Tout d’abord, une péritomie conjonctivale se forme dans la région dorso-temporale de l’œil. Ensuite, un tractus dans l’espace sous-choroïdien est créé en insérant une aiguille à travers la sclérotique exposée. Ceci est suivi par l’insertion d’une aiguille émoussée dans le tractus et l’injection de cellules de mélanome dans la choroïde. Immédiatement après l’injection, l’imagerie non invasive par tomographie par cohérence optique (OCT) est utilisée pour déterminer l’emplacement et la progression de la tumeur. Le décollement de la rétine est évalué comme un prédicteur du site et de la taille de la tumeur. La méthode présentée permet l’induction reproductible du mélanome localisé choroïde chez la souris et l’imagerie en direct de l’évaluation de la croissance tumorale. En tant que tel, il fournit un outil précieux pour l’étude des tumeurs intraoculaires.
Introduction
Le mélanome uvéal (UM) est la tumeur maligne primitive intraoculaire la plus fréquente chez l’adulte. Environ 90 % des mélanomes oculaires proviennent de mélanocytes de la région choroïde du tractus uvéal1. L’UM est une cause majeure de morbidité et de mortalité, car on estime que près de 50% des patients développent une maladie métastatique, le foie étant le principal site de métastases2. Un traitement précoce des lésions primaires peut réduire le risque de métastases, mais aucun traitement efficace n’empêche la formation de métastases3.
Le traitement standard du mélanome uvéal comprend l’irradiation, qui est associée à une perte de vision due à la neuropathie optique, à la rétinopathie, au syndrome de l’œil sec et à la cataracte. La résection chirurgicale est généralement retardée jusqu’à ce que la croissance de la lésion soit reconnue et caractérisée. Cependant, un tel délai peut permettre le développement d’une maladie métastatique4. Dans certains cas, une énucléation futile est nécessaire. Bien sûr, cette procédure radicale compromet la vision et entraîne une détérioration esthétique dramatique.
De nombreux efforts ont été consacrés au développement de modèles expérimentaux pour étudier le mélanome uvéal. Les modèles animaux précliniques qui permettent une évaluation précise de cette malignité sont essentiels pour étudier de nouvelles stratégies diagnostiques et thérapeutiques pour le mélanome uvéal. Les modèles animaux expérimentaux de mélanome oculaire sont principalement basés sur l’inoculation de cellules tumorales chez la souris, le rat et le lapin 5,6. Les modèles murins sont rentables et largement utilisés pour les études sur le mélanome en raison de leur taux de reproduction rapide et de leur grande similitude génomique avec les humains. La lignée cellulaire de mélanome cutané murin B16 est couramment utilisée pour inoculer des souris C57BL6 et induire des tumeurs syngéniques. Lors de l’utilisation de ce modèle pour induire un mélanome uvéal, les yeux porteurs de tumeurs doivent généralement être énucléés 7 à 14 jours après l’inoculation. De plus, la vitamine B16 est un modèle très invasif. La nature immuno-privilégiée de l’œil favorise les métastases, et les métastases peuvent généralement être détectées 3-4 semaines après l’inoculation des cellules tumorales. Les sous-cultures de la ligne B16 originale présentent des propriétés métastatiques distinctes6. Par exemple, la lignée du mélanome du Queens a un taux métastatique élevéde 7,8. La lignée cellulaire B16LS9 a une morphologie cellulaire dendritique et a été dérivée de métastases hépatiques de souris C57BL/6 injectées avec la lignée parentale de mélanome cutané B16F19. Lorsqu’elles ont été injectées dans le compartiment postérieur de l’œil, il a été démontré que ces cellules formaient des tumeurs intraoculaires, qui ressemblent histologiquement au mélanome uvéal humain et forment des métastases spécifiques au foie chez les souris C57BL / 6, mais pas Balb / C10,11,12. Génétiquement, les cellules sont caractérisées par une expression plus élevée du proto-oncogène c-met, qui agit comme un récepteur cellulaire du facteur de croissance des hépatocytes13. En revanche, B16F10, le 10epassage de la B16 parentale, métastase principalement aux poumons lorsqu’elle est inoculée par voie intraoculaire14. B16F10 et B16LS9 sont pigmentés12.
Plusieurs défis clés limitent le succès des modèles murins de mélanome uvéal. Tout d’abord, le reflux des cellules tumorales peut conduire à un mélanome extraoculaire ou sous-conjonctival. Deuxièmement, la croissance tumorale après inoculation intraoculaire des cellules de mélanome est souvent très variable, ce qui pose des difficultés dans l’évaluation du traitement et des progrès. Une autre difficulté majeure est la capacité limitée à suivre la croissance tumorale in vivo. Bien que l’imagerie bioluminescente, telle que celle des tumeurs exprimant la luciférase, soit couramment utilisée pour surveiller la croissance tumoraleoculaire 15,16, elle ne peut pas fournir d’informations sur l’emplacement intraoculaire de la tumeur. Par conséquent, l’évaluation de la tumeur est généralement réalisée après énucléation de l’œil10,17. Cela limite considérablement la capacité de caractériser la progression tumorale et la réponse aux traitements de manière approfondie. Un autre obstacle majeur dans l’étude du mélanome uvéal est la difficulté de surveiller les lésions chez les souris pigmentées. De nouvelles approches, qui surmontent ces difficultés, sont nécessaires pour promouvoir la recherche sur le mélanome uvéal dans les modèles animaux.
La tomographie par cohérence optique (TCO) offre des capacités distinctives pour imager profondément dans les différentes sections de l’œil en haute résolution, ce qui est inégalé par d’autres méthodologies, y compris l’échographie18,19. L’imagerie OCT a été utilisée dans des modèles animaux pour étudier diverses maladies oculaires20. Récemment, l’imagerie OCT a été démontrée comme moyen non invasif d’évaluer la croissance tumorale intraoculaire21. Le protocole décrit ici décrit l’implantation de cellules de mélanome dans la choroïde murine et l’utilisation de l’OCT pour prédire la localisation et la taille de la tumeur intraoculaire au moment de l’inoculation cellulaire.
Protocole
Les expériences du protocole ont été approuvées par le Conseil national israélien de l’expérimentation animale et sont conformes à la déclaration de l’ARVO pour l’utilisation des animaux dans la recherche ophtalmique et visuelle. Des souris C57BL/6 femelles, âgées de 8 à 10 semaines, ont été utilisées pour la présente étude et ont été exposées à des cycles lumière-obscurité de 12/12 h. Les animaux ont été obtenus d’une source commerciale (voir le tableau des matériaux).
1. Culture cellulaire
- Culture de cellules B16LS9 en milieu RPMI 1640, supplémentée avec 10 % de sérum bovin fœtal, 2 mM de L-glutamine, 1 mM de pyruvate de sodium, 25 mM de HEPES, 1 % de mélange de vitamines essentielles, 200 U/mL de pénicilline et 200 mg/mL de streptomycine (voir le tableau des matières), dans un incubateur humidifié à 37 °C contenant 5 % de CO2.
- Récolter les cellules pour injection à 70%-80% de confluence.
2. Préparation des animaux
- Préparer un mélange anesthésique de kétamine (75 mg/kg de poids corporel) et de médétomidine (0,5 mg/kg de poids corporel). Anesthésier les souris en injectant le mélange anesthésique par voie intrapéritonéale en une seule injection.
- Appliquer un anesthésique ophtalmique topique oxybuprocaïne (0,4%) sur les deux yeux.
- Dilater les pupilles de souris en appliquant localement du tropicamide (0,5%).
3. Création d’une péritomie conjonctivale et d’un tractus scléral dans l’espace sous-choroïdien
- Appliquez de l’hydroxyéthylcellulose à 1,4 % (voir le tableau des matières) comme lubrifiant sur les deux yeux pour éviter le dessèchement. Appliquer 0,5% de tropicamide sur l’œil droit.
- Observez l’œil opéré de la souris sous un microscope opératoire (voir Tableau des matériaux). Tenez les paupières ouvertes avec des pinces intraoculaires stériles.
- À l’aide d’une pince intraoculaire, tenir la conjonctive limbique supero-temporale et tirer vers une position infranasale22. Sécurisez cette position en la maintenant tout au long de la procédure (Figure 1A).
- À l’aide d’une pointe d’aiguille de 30 G, faire une petite péritomie conjonctivale (1-2 mm) dans la région dorso-temporale, environ 1-2 mm postérieure au limbe.
REMARQUE: L’utilisation d’aiguilles plus fines peut prévenir une ponction excessive et permettre une meilleure précision de l’emplacement de la tumeur. - Retirez l’excès de capsule de Tenon de l’ouverture de la péritomie.
NOTE: La capsule de Tenon est une couche de tissu conjonctif dense qui entoure le globe de l’œil22. - À cet endroit, insérez la pointe de l’aiguille pour pénétrer à travers la sclérotique. Faire une excision pour créer un tractus dans l’espace sous-choroïdien jusqu’à ce que la couleur brune de la choroïde apparaisse à travers la substance blanche exposée de la sclérotique (Figure 1B).

Figure 1 : Inoculation des cellules tumorales. (A) La conjonctive limbique supero-temporale est maintenue à l’aide d’une pince intraoculaire et tirée vers une position infra-nasale. (B) La pointe d’une aiguille de 30 G est insérée pour pénétrer à travers la sclérotique, et l’excision est faite pour créer une piste dans l’espace sous-choroïdien. (C) Une seringue chargée de cellules et montée avec une aiguille de 32 G est insérée dans la piste, et les cellules sont injectées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Inoculation des cellules de mélanome
- Resuspendre 70 000 cellules B16LS9 dans 2 μL de PBS. Ce montant est estimé par œil.
- Charger les cellules dans une seringue Hamilton en verre stérile de 10 μL (voir le tableau des matériaux) montée à l’aide d’une aiguille émoussée de 32 G torsadée à un angle de 45°.
- Insérez l’aiguille de seringue chargée d’environ 2 mm dans la piste créée à l’étape 3.
- Injecter 2 μL de suspension cellulaire.
- Maintenez l’aiguille en place après l’injection pendant 2-3 s jusqu’à ce que tout le liquide soit éliminé.
- Retirez l’aiguille en la tirant doucement et lentement pour éviter les fuites de la piste (figure 1C).
NOTES: L’ajustement de la vitesse et de la force d’injection peut affecter le modèle de développement de la tumeur. Il est suggéré que ces paramètres soient calibrés par des personnes expérimentant pour identifier la bonne force et la bonne vitesse appliquées. Un total de 70 000 cellules a été déterminé dans des expériences préliminaires. Cependant, comme il peut y avoir des variations dans les types de culture cellulaire ou les lots ou entre les souches de souris, l’étalonnage de ce nombre est nécessaire.
5. Évaluation de l’emplacement de l’injection
- Observer l’œil injecté par OCT scans immédiatement après l’inoculation des cellules de mélanome pour identifier l’apparition d’un décollement de la rétine (DR), de lésions rétiniennes et / ou de cellules au niveau du vitré23.
NOTES: Réappliquez le tropicamide, l’oxybuprocaïne et l’éthylcellulose au besoin. - Sur la base des analyses de l’OCT de l’étape 5.1, classer les modèles de DR21 selon : (1) le site RD-un local de RD; (2) fuite dans le matériau cellulaire d’observation du vitré dans le vitré; (3) RD-sites multiples étendus de RD.
- Prédire la localisation tumorale en fonction de: (1) tumeurs choroïdiennes locales attendues par DR; (2) fuite dans les tumeurs attendues du vitré dans le vitré; (3) tumeurs variables et dispersées attendues par DR étendues (Figure 2).
REMARQUE: Seules les souris atteintes de RD locale (environ 50%) devraient développer des tumeurs limitées à la choroïde.
6. Prédire la taille de la tumeur en fonction de la hauteur DR
- Mesurer la hauteur de la DR locale dans les balayages de la TCO à l’aide d’un logiciel de segmentation/analyse de la TCO (voir le tableau des matériaux) et classer selon les groupes suivants : petit = < 300 μm; milieu = 300-400 μm; grande = >400 μm.
- Évaluer le volume que les tumeurs devraient atteindre dans les 5 jours suivant l’injection selon les critères suivants:
Une petite hauteur DR est généralement observée dans les tumeurs de petite taille (volume tumoral allant de 0,0059 mm3 à 0,07 mm3 avec un volume moyen de 0,027 ± 0,005 mm 3).
Une taille RD moyenne est retrouvée dans les tumeurs de petite et moyenne taille (volume tumoral allant de 0,015 mm 3 à 0,15mm3 avec un volume moyen de 0,056 ± 0,016 mm3).
Une grande hauteur DR est associée à une large gamme de volumes tumoraux allant jusqu’à 0,36 mm3.
REMARQUE: La gamme de tailles de tumeurs attendues a été obtenue à partir des résultats précédents et divisée en trois groupes de petites, moyennes et grandes tumeurs.
7. Procédures postopératoires
- Appliquer ophtalmique ofloxacine 0,3% par voie topique.
- Inverser l’anesthésie en injectant du chlorhydrate d’atipamézole (3 mg/kg) par voie sous-cutanée.
- Injecter par voie sous-cutanée de la buprénorphine (0,05 mg/kg de poids corporel) deux fois par jour pendant 3 jours pour réduire la douleur et la souffrance des animaux.
- À 5 jours après l’injection de cellules de mélanome, évaluez la taille de la tumeur en suivant les étapes ci-dessous.
- Anesthésiez les souris comme décrit à l’étape 2.1. Appliquer le tropicamide (0,5%).
- Examinez les yeux par des tomodensitogrammes longitudinaux et sagittaux et utilisez un logiciel de segmentation/analyse OCT pour mesurer le volume et la localisation de la tumeur.
- Calculez le volume tumoral en utilisant la formule24: V = a * b * c * 6 / π (a, b et c = longueur, largeur et hauteur, respectivement).
- Examiner la taille de la tumeur tous les 2-3 jours comme décrit dans les étapes 7.4.1-7.4.3.
REMARQUE: La procédure doit être optimisée si vous utilisez différentes souches de souris ou lignées cellulaires.
Résultats
Les yeux ont été examinés par OCT immédiatement après l’injection des cellules B16LS9. Un décollement local de la rétine a été observé après l’injection. Les souris présentaient trois modèles de DR : focale (Figure 2, panneau supérieur), fuite vers le vitré (Figure 2, panneau du milieu) et DR étendue (Figure 2, panneau inférieur). La DR prolongée est probablement causée par des dommages causés par l’injection. Il y avait une association entre le schéma de RD immédiatement après l’injection et la localisation des tumeurs 5-7 jours après l’injection. Comme le montre la figure 2, la DR focale était associée à une croissance des cellules tumorales limitée à la choroïde. Cependant, l’observation de cellules dans le vitré après injection chez des animaux présentant une DR focale a indiqué une croissance tumorale dans la cavité vitréenne en plus de la choroïde. Enfin, lorsque la RD étendue, ou RD à plusieurs endroits, a été observée après l’injection, les tumeurs ont été dispersées dans toute la choroïde et le vitré après 5 jours. Des études antérieures ont démontré que la caractérisation des tumeurs par OCT était entièrement corrélée à l’examen histologique21.

Figure 2 : Prédiction de la croissance tumorale basée sur l’OCT après injection de cellules sous-choroïdiennes. Un total de 7 × 104 cellules B16LS9 dans 2 μL de PBS ont été injectées dans l’espace sous-choroïde des yeux de souris. Le site d’injection a été visualisé par OCT et imagerie du fond d’œil immédiatement après l’injection cellulaire (à gauche). Les lignes pointillées indiquent la détection de RD focal (en haut), de matériel cellulaire au niveau du vitré (milieu) et de RD étendu (en bas). À droite, les lignes pointillées indiquent la masse tumorale 5 jours après l’injection. Ce chiffre est adapté de Zaks et al.21. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La gamme de tailles de tumeurs induites dans ce modèle peut être divisée en petite, moyenne et grande (Figure 3). La hauteur de la DR après injection a été associée à la taille de la tumeur 5 jours après l’injection, telle que mesurée par les tomodensitogrammes horizontaux et verticaux (Figure 4). Les hauteurs DR associées à la taille des tumeurs sont indiquées dans le tableau 1.
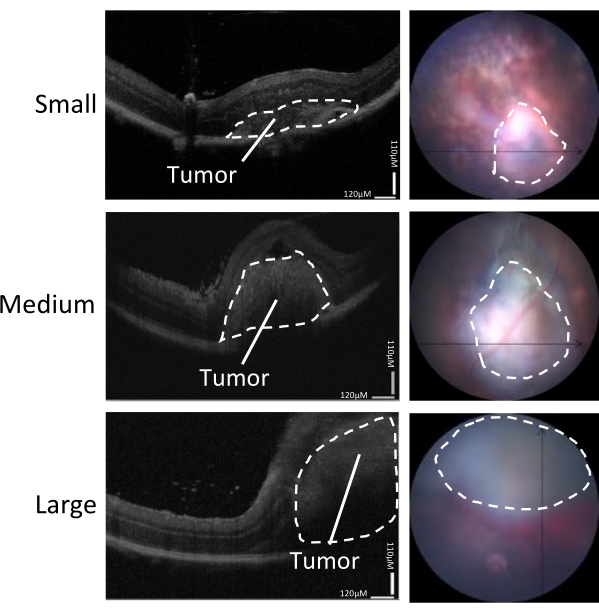
Figure 3: Détermination de la taille de la tumeur. La croissance tumorale a été évaluée par des scanners OCT (à gauche) et une vue caméra en temps réel du fond d’œil (à droite) 5 à 7 jours après l’inoculation. Sont montrées des images représentatives de petites, moyennes et grandes tumeurs. Ce chiffre est adapté de Zaks et al.21. Veuillez cliquer ici pour voir une version agrandie de cette figure.
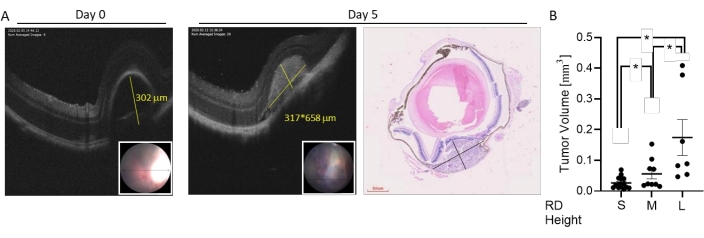
Figure 4 : Classification de la taille de la tumeur basée sur l’imagerie en direct OCT. Les tumeurs ont été induites par injection sous-choroïdienne de 7 × 104 cellules B16LS9. La croissance tumorale a été évaluée dans l’imagerie OCT en direct immédiatement et 5 jours après l’injection. (A) Une mesure OCT représentative de la hauteur DR après injection (jour 0, gauche, ligne jaune indique la taille), de la hauteur et de la largeur de la tumeur dans un tomodensitogramme horizontal (jour 5, le milieu, les lignes jaunes indiquent la hauteur et la largeur) et une coupe oculaire colorée H & E (droite). Encart : image du fond d’œil de la zone RD. (B) La gamme de tailles de tumeurs induites a été divisée en trois groupes. Les mesures du volume tumoral de souris présentant un DR faible (S, n = 15), moyen (M, n = 9) ou grand (L, n = 7) immédiatement après l’injection de cellule. *p < 0,05. Ce chiffre est adapté de Zaks et al.21. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Hauteur RD | Volume tumoral |
| <300 μm (petit) | 0,0059 mm 3 à 0,07 mm 3 (moyenne 0,027 ± 0,005 mm3) |
| 300-400 μm (moyen) | 0,015 mm 3 à 0,15 mm 3 (moyenne 0,056 ± 0,016 mm3) |
| > 400 μm (large) | 0,05 mm 3 à 0,36 mm 3 (moyenne 0,017 ± 0,06 mm3) |
Tableau 1: Les hauteurs de RD associées à la taille de la tumeur.
Discussion
Le mélanome uvéal est une maladie dévastatrice pour laquelle de nouvelles approches thérapeutiques sont grandement nécessaires. Cependant, la recherche sur le mélanome uvéal et les traitements potentiels est limitée par les défis techniques des modèles animaux de mélanome uvéal 1,25. Les tumeurs oculaires, qui sont induites par injection intraoculaire de cellules cancéreuses, sont très variables à la fois dans la localisation et la taille, probablement en raison des petites dimensions de l’œil de souris. Une telle variabilité est un obstacle à l’évaluation complète de la progression tumorale. L’approche expérimentale décrite ici permet d’évaluer la localisation intraoculaire de la tumeur et la taille prévue immédiatement après l’injection de cellules de mélanome sous-choroïdien B16LS9, sur la base de l’imagerie OCT en direct21. Au fil des ans, le développement de techniques d’imagerie en direct a fourni des avantages dans la recherche sur le cancer en permettant de suivre la progression tumorale tout au long des expériences, et pas seulement à des critères prédéfinis. Ces méthodes comprennent, par exemple, l’imagerie bioluminescente utilisant des cellules rapporteures, qui permet de surveiller l’emplacement des tumeurs et des métastases chez les animaux vivants, y compris l’identification des tumeurs oculaires16. Une autre méthode sophistiquée est l’imagerie photoacoustique, qui permet l’imagerie à haute résolution des cellules et la distinction des cellules de mélanome des cellules saines26,27. Cependant, l’avantage distinct de l’OCT est la capacité d’identifier l’emplacement intraoculaire des tumeurs et d’évaluer leur taille chez les animaux vivants.
Le protocole décrit ici décrit l’inoculation intraoculaire des cellules de mélanome en formant une péritomie et un tractus dans l’espace sous-choroïdien, suivie de l’insertion douce d’une aiguille émoussée à l’extrémité du tractus et de l’injection cellulaire. Cela élimine la ponction excessive et dirige l’emplacement de l’inoculation cellulaire. L’injection induit un décollement de la rétine, qui reflète la localisation et la taille de la tumeur qui sera développée. Nos observations suggèrent que les tumeurs formées à la position d’un DR local ont tendance à être focales, et leur taille correspond à la hauteur de la DR après injection. En revanche, plusieurs DR, ou la détection de cellules au niveau du vitré après injection, entraînent généralement des tumeurs dispersées21.
Il est plausible que la RD focale reflète que l’injection a compacté la plupart des cellules à un certain endroit, permettant la formation d’une tumeur localisée. D’autre part, plusieurs sites RD impliquent que l’injection a atteint plusieurs endroits à travers la rétine, augmentant la probabilité que les cellules tumorales aient été implantées dans de nombreux sites et aient formé des tumeurs dispersées.
L’évaluation de la localisation et de la taille prédite de la tumeur tôt après l’injection est particulièrement importante lors de l’évaluation des progressions tumorales, telles que l’examen de l’effet de facteurs spécifiques ou de traitements potentiels. Une détermination précoce peut permettre l’inclusion d’un groupe d’étude homogène, améliorant ainsi la reproductibilité du modèle, améliorant ainsi la précision de l’étude et économisant un temps et des coûts précieux. En outre, comme l’imagerie OCT des tumeurs intraoculaires fournit des informations précises sur l’emplacement et la taille des tumeurs chez les animaux vivants, les souris peuvent être surveillées pour des expériences à long terme, par exemple, pour évaluer les métastases. Une autre difficulté dans les modèles murins de mélanome est que la pigmentation de la souris, comme chez les souris C57BL / 6, limite souvent l’analyse des tumeurs pigmentées. Par conséquent, un autre avantage de l’imagerie OCT est qu’elle est indépendante de la pigmentation et peut être appliquée à des souris pigmentées ou à des lésions.
Il convient de noter que divers paramètres, tels que la souche de souris, la lignée cellulaire ou la technique d’injection, peuvent affecter l’initiation et la croissance de la tumeur. Par conséquent, l’optimisation du modèle pour des souches ou des cellules spécifiques est conseillée. Il faut également tenir compte du fait que la cataracte secondaire peut se développer au fil du temps1, ce qui limite la capacité d’utiliser l’OCT. Bien qu’il soit peu probable que cela se produise dans le court laps de temps décrit ici, il faut envisager d’augmenter la taille du groupe si l’on effectue des expériences plus longues pour permettre l’exclusion des yeux de cataracte.
En résumé, le protocole décrit utilise un modèle commun de mélanome B16LS9, évalué par imagerie OCT vivante, pour développer un modèle reproductible pour évaluer les tumeurs choroïdiennes chez les animaux vivants. Cette approche peut être utilisée pour de futures études sur les mécanismes sous-jacents du mélanome uvéal, de nouveaux modèles expérimentaux et de nouvelles thérapies potentielles.
Déclarations de divulgation
Marcovich A.L. : Steba Biotech (P), Yeda Weizmann (P), EyeYon Medical (C, P), Mor Isum (P). c) = consultant; (P) = Brevet. Tous les autres auteurs n’ont pas d’intérêts concurrents.
Remerciements
Cette étude a été financée en partie par la subvention 1304/20 de la Fondation israélienne pour la science (ISF), Israël, pour Arie Marcovich. Nous remercions Shahar Ish-Shalom et Ady Yosipovich, du département de pathologie du Kaplan Medical Center, Rehovot, Israël, pour l’analyse histologique.
matériels
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
Références
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335 (2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431 (2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. . Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264 (2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon