Method Article
Implantação e Avaliação do Melanoma na Coroide Murina via Tomografia de Coerência Óptica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
O presente protocolo descreve o implante e a avaliação do melanoma em coroide murina utilizando tomografia de coerência óptica.
Resumo
O estabelecimento de modelos experimentais de melanoma de coroide é um desafio em termos da capacidade de induzir tumores na localização correta. Além disso, as dificuldades na observação in vivo do melanoma de coroide posterior limitam a localização do tumor e a avaliação do crescimento em tempo real. A abordagem aqui descrita otimiza as técnicas para o estabelecimento do melanoma de coroide em camundongos por meio de um procedimento de injeção de células B16LS9 subcoroidal em várias etapas. Para permitir a precisão na injeção nas pequenas dimensões da úvea do rato, o procedimento completo é realizado sob um microscópio. Primeiro, uma peritomia conjuntival é formada na área dorso-temporal do olho. Em seguida, um trato no espaço subcoroidal é criado inserindo uma agulha através da esclera exposta. Isto é seguido pela inserção de uma agulha romba no trato e a injeção de células de melanoma na coroide. Imediatamente após a injeção, a tomografia de coerência óptica (OCT) não invasiva é utilizada para determinar a localização e a evolução do tumor. O descolamento de retina é avaliado como preditor da localização e tamanho do tumor. O método apresentado permite a indução reprodutível de melanoma localizado em coroide em camundongos e a avaliação do crescimento tumoral em imagens ao vivo. Como tal, fornece uma ferramenta valiosa para o estudo de tumores intraoculares.
Introdução
O melanoma uveal (UMT) é a neoplasia maligna primária intraocular mais frequente em adultos. Aproximadamente 90% dos melanomas oculares originam-se de melanócitos da região coroide do trato uveal1. A UMTT é uma importante causa de morbidade e mortalidade, pois estima-se que cerca de 50% dos pacientes desenvolvam doença metastática, sendo o fígado o principal sítio de metástase2. O tratamento precoce das lesões primárias pode reduzir a chance de metástases, porém nenhum tratamento efetivo previne a formação de metástases3.
O tratamento padrão do melanoma uveal inclui terapia de irradiação, que está associada à perda da visão devido à neuropatia óptica, retinopatia, síndrome do olho seco e catarata. A ressecção cirúrgica é tipicamente retardada até que o crescimento da lesão seja reconhecido e caracterizado. No entanto, esse atraso pode permitir o desenvolvimento de doençametastática4. Em alguns casos, a enucleação fútil é necessária. É claro que esse procedimento radical compromete a visão e resulta em dramática deterioração estética.
Muitos esforços têm sido dedicados ao desenvolvimento de modelos experimentais para o estudo do melanoma uveal. Modelos animais pré-clínicos que permitam a avaliação precisa dessa malignidade são fundamentais para a investigação de novas estratégias diagnósticas e terapêuticas para o melanoma uveal. Modelos animais experimentais de melanoma ocular baseiam-se principalmente na inoculação de células tumorais em camundongos, ratos ecoelhos5,6. Modelos em camundongos são custo-efetivos e amplamente utilizados para estudos de melanoma devido à sua rápida taxa de reprodução e alta similaridade genômica com humanos. A linhagem celular de melanoma cutâneo murino B16 é comumente utilizada para inocular camundongos C57BL6 e induzir tumores singênicos. Ao usar esse modelo para induzir melanoma uveal, os olhos portadores de tumor normalmente precisam ser enucleados 7-14 dias após a inoculação. Além disso, o B16 é um modelo altamente invasivo. A natureza imunoprivilegiada do olho suporta metástases, e as metástases podem tipicamente ser detectadas 3-4 semanas após a inoculação de células tumorais. Subculturas da linhagem B16 original exibem propriedades metastáticas distintas6. Por exemplo, a linhagem de melanoma de Queens tem alta taxa de metástase7,8. A linhagem celular B16LS9 possui morfologia de células dendríticas e foi derivada de metástases hepáticas de camundongos C57BL/6 injetados com a linhagem de melanoma cutâneo parental B16F19. Quando injetadas no compartimento posterior do olho, essas células formaram tumores intraoculares, que histologicamente se assemelham ao melanoma uveal humano e formam metástases hepatoespecíficas em camundongos C57BL/6, mas não Balb/C10,11,12. Geneticamente, as células são caracterizadas por maior expressão do proto-oncogene c-met, que atua como receptor celular para o fator de crescimento de hepatócitos13. Em contraste, o B16F10, a10ª passagem do B16 parental, metastatiza primariamente para os pulmões quando inoculado intraocularmente14. Tanto o B16F10 quanto o B16LS9 são pigmentados12.
Vários desafios-chave limitam o sucesso de modelos de melanoma uveal murino. Primeiro, o refluxo de células tumorais pode levar a melanoma extraocular ou subconjuntival. Em segundo lugar, o crescimento tumoral após a inoculação intraocular de células de melanoma é frequentemente muito variável, dificultando a avaliação do tratamento e da evolução. Outra grande dificuldade é a capacidade limitada de acompanhar o crescimento tumoral in vivo. Embora imagens bioluminescentes, como a luciferase expressando tumores, sejam comumente usadas para monitorar o crescimento ocular do tumor15,16, elas não podem fornecer informações sobre a localização intraocular do tumor. Portanto, a avaliação do tumor é tipicamente realizada após a enucleação doolho10,17. Isso limita muito a capacidade de caracterizar a progressão tumoral e a resposta aos tratamentos extensivamente. Outro grande obstáculo no estudo do melanoma uveal é a dificuldade de monitoramento de lesões em camundongos pigmentados. Novas abordagens, que superem essas dificuldades, são necessárias para promover a pesquisa do melanoma uveal em modelos animais.
A tomografia de coerência óptica (OCT) fornece capacidades distintas para obter imagens profundas nas diferentes seções do olho em alta resolução, o que é incomparável com outras metodologias, incluindo a ultrassonografia18,19. A OCT tem sido utilizada em modelos animais para o estudo de diversas doenças oculares20. Recentemente, a OCT foi demonstrada como meio não invasivo para avaliar o crescimento tumoralintraocular21. O protocolo aqui descrito descreve a implantação de células de melanoma na coroide murina e o uso da OCT para predizer a localização e o tamanho do tumor intraocular no momento da inoculação celular.
Protocolo
Os experimentos do protocolo foram aprovados pelo Conselho Nacional de Experimentação Animal de Israel e estão de acordo com a Declaração ARVO para uso de Animais em Pesquisa Oftalmológica e de Visão. Camundongos C57BL/6 fêmeas, com idade entre 8-10 semanas, foram utilizados para o presente estudo e foram expostos a ciclos claro-escuro de 12/12 h. Os animais foram obtidos de fonte comercial (ver Tabela de Materiais).
1. Cultura celular
- Cultura de células B16LS9 em meio RPMI 1640, suplementado com 10% de soro fetal bovino, 2 mM de L-glutamina, 1 mM de piruvato de sódio, 25 mM de HEPES, 1% de mistura vitamínica essencial, 200 U/mL de penicilina e 200 mg/mL de estreptomicina (ver Tabela de Materiais), em estufa umidificada a 37 °C com 5% de CO2.
- Colher as células para injeção a 70%-80% de confluência.
2. Preparação dos animais
- Preparar uma mistura anestésica de cetamina (75 mg/kg de peso corporal) e medetomidina (0,5 mg/kg de peso corporal). Anestesiar os camundongos injetando a mistura anestésica intraperitonealmente em uma única injeção.
- Aplicar anestésico oftálmico tópico oxibuprocaína (0,4%) em ambos os olhos.
- Dilatar as pupilas de camundongos aplicando topicamente tropicamida (0,5%).
3. Criação de peritomia conjuntival e trato escleral no espaço subcoroidal
- Aplicar 1,4% de hidroxietilcelulose (ver Tabela de Materiais) como lubrificante em ambos os olhos para evitar a secagem. Aplicar tropicamida a 0,5% no olho direito.
- Observe o olho operado do camundongo sob um microscópio cirúrgico (ver Tabela de Materiais). Mantenha as pálpebras abertas com pinça intraocular estéril.
- Com o uso de pinça intraocular, segurar a conjuntiva limbal súpero-temporal e tracionar em direção à posição infranasal22. Fixe essa posição mantendo-a durante todo o procedimento (Figura 1A).
- Com uma ponta de agulha de 30 G, fazer uma pequena peritomia conjuntival (1-2 mm) na área dorso-temporal, aproximadamente 1-2 mm posterior ao limbo.
OBS: O uso de agulhas mais finas pode evitar a punção excessiva e permitir melhor precisão da localização do tumor. - Remova o excesso de cápsula de Tenon da abertura da peritomia.
OBS: A cápsula de Tenon é uma camada de tecido conjuntivo denso que envolve o globo ocular22. - Neste local, insira a ponta da agulha para penetrar através da esclera. Fazer uma excisão para criar um trato no espaço subcoroidal até que a cor marrom da coroide apareça através da substância branca exposta da esclera (Figura 1B).

Figura 1: Inoculação de células tumorais . (A) A conjuntiva limbal súpero-temporal é mantida com pinça intraocular e tracionada em direção à posição infranasal. (B) A ponta de uma agulha de 30 G é inserida para penetrar através da esclera, e a excisão é feita para criar um rastro no espaço subcoroidal. (C) Uma seringa carregada com células e montada com uma agulha 32 G é inserida na esteira, e as células são injetadas. Clique aqui para ver uma versão maior desta figura.
4. Inoculação de células de melanoma
- Ressuspender 70.000 células B16LS9 em 2 μL de PBS. Esse valor é estimado por olho.
- Coloque as células numa seringa Hamilton de vidro estéril de 10 μL (ver Tabela de Materiais) montada com uma agulha romba de 32 G torcida num ângulo de 45°.
- Introduza a agulha da seringa carregada aproximadamente 2 mm na via criada no passo 3.
- Injetar 2 μL de suspensão celular.
- Segure a agulha no lugar após a injeção por 2-3 s até que todo o líquido tenha clareado.
- Retire a agulha puxando-a suave e lentamente para evitar vazamento da esteira (Figura 1C).
NOTAS: Ajustar a velocidade e a força de injeção pode afetar o padrão de desenvolvimento do tumor. Sugere-se que esses parâmetros sejam calibrados por indivíduos que experimentam para identificar a força e a velocidade corretas aplicadas. Um total de 70.000 células foi determinado em experimentos preliminares. No entanto, como pode haver variações nos tipos ou lotes de cultura celular ou entre linhagens de camundongos, a calibração desse número é necessária.
5. Avaliação do local da injeção
- Observar o olho injetado por exames de OCT imediatamente após a inoculação de células de melanoma para identificar o aparecimento de descolamento de retina (DR), lesão retiniana e/ou células no vítreo23.
NOTAS: Reaplicar tropicamida, oxibuprocaína e etilcelulose conforme necessário. - Com base nos exames de OCT da etapa 5.1, classifique os padrões de DR21 de acordo com: (1) local RD-um local de DR; (2) vazamento para o material celular observador do vítreo no vítreo; (3) extensão de RD-múltiplos locais de RD.
- Predizer a localização do tumor com base em: (1) tumores de coroide locais com DR esperada; (2) extravasamento para os tumores vítreos esperados no vítreo; (3) DR estendida variável esperada e tumores dispersos (Figura 2).
NOTA: Espera-se que apenas camundongos com DR local (cerca de 50%) desenvolvam tumores limitados à coroide.
6. Predição do tamanho do tumor com base na altura da DR
- Meça a altura da DR local nos exames de OCT usando um software de segmentação/análise de OCT (ver Tabela de Materiais) e classifique de acordo com os seguintes grupos: pequeno = <300 μm; média = 300-400 μm; grande = >400 μm.
- Avaliar o volume que se espera que os tumores atinjam dentro de 5 dias após a injeção de acordo com os seguintes critérios:
Uma pequena altura de DR é tipicamente observada em tumores de pequenas dimensões (volume tumoral variando de 0,0059 mm3 a 0,07mm3, com volume médio de 0,027 ± 0,005mm3).
A altura média da DR é encontrada em tumores pequenos e médios (volume tumoral variando de 0,015 mm3 a 0,15 mm3, com volume médio de 0,056 ± 0,016mm3).
Uma grande altura da DR está associada a uma ampla faixa de volumes tumorais de até 0,36mm3.
OBS: A faixa de tamanhos esperados dos tumores foi obtida a partir dos resultados anteriores e dividida em três grupos de tumores pequenos, médios e grandes.
7. Procedimentos pós-operatórios
- Aplicar ofloxacina oftálmica 0,3% topicamente.
- Reverter a anestesia injetando cloridrato de atipamezol (3 mg/kg) por via subcutânea.
- Injetar buprenorfina por via subcutânea (0,05 mg/kg de peso corporal) duas vezes ao dia durante 3 dias para reduzir a dor e o sofrimento dos animais.
- Aos 5 dias após a injeção das células do melanoma, avalie o tamanho do tumor seguindo os passos abaixo.
- Anestesiar os camundongos conforme descrito na etapa 2.1. Aplicar tropicamida (0,5%).
- Examine os olhos por meio de exames longitudinais e sagitais de OCT e use um software de segmentação/análise de OCT para medir o volume e a localização do tumor.
- Calcular o volume tumoral usando a fórmula24: V = a*b*c*6/π (a, b e c = comprimento, largura e altura, respectivamente).
- Examinar o tamanho do tumor a cada 2-3 dias, conforme descrito nas etapas 7.4.1-7.4.3.
Observação : o procedimento deve ser otimizado se usando diferentes cepas de mouse ou linhas de célula.
Resultados
Os olhos foram examinados via OCT imediatamente após a injeção das células B16LS9. Descolamento local de retina foi observado após a injeção. Os camundongos exibiram três padrões de RD: focal (Figura 2, painel superior), vazamento para o vítreo (Figura 2, painel médio) e RD estendida (Figura 2, painel inferior). A DR estendida é provavelmente causada por danos causados pela injeção. Houve associação entre o padrão de DR imediatamente após a injeção e a localização dos tumores 5-7 dias após a injeção. Como demonstrado na Figura 2, a DR focal estava associada ao crescimento de células tumorais limitado à coroide. Entretanto, a observação de células no vítreo após injeção em animais com DR focal indicou crescimento tumoral na cavidade vítrea, além da coroide. Finalmente, quando RD estendida, ou DR em múltiplos locais, foi observada após a injeção, os tumores estavam dispersos por toda a coroide e vítreo após 5 dias. Estudos prévios demonstraram que a caracterização dos tumores pela OCT correlacionou-se plenamente com o examehistológico21.

Figura 2: Predição baseada em OCT do crescimento tumoral após injeção de células subcoroidais. Um total de 7 × 104 células B16LS9 em 2 μL de PBS foram injetadas no espaço subcoróide dos olhos de camundongos. O local da injeção foi visualizado por OCT e fundo de olho imediatamente após a injeção das células (esquerda). Linhas tracejadas denotam a detecção de RD focal (superior), material celular no vítreo (meio) e RD estendida (inferior). À direita, linhas tracejadas indicam a massa tumoral 5 dias após a injeção. Essa figura é adaptada de Zaks et al.21. Clique aqui para ver uma versão maior desta figura.
A variedade de tamanhos de tumor induzidos neste modelo pode ser dividida em pequeno, médio e grande (Figura 3). A altura da DR após a injeção foi associada ao tamanho do tumor aos 5 dias pós-injeção, medido pelos exames de OCT horizontal e vertical (Figura 4). As alturas das DR associadas ao tamanho dos tumores são mostradas na Tabela 1.
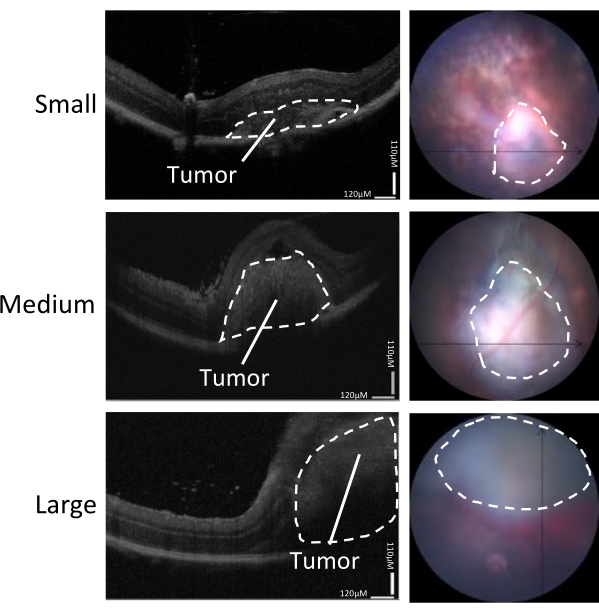
Figura 3: Determinação do tamanho do tumor. O crescimento tumoral foi avaliado por OCT (esquerda) e câmera em tempo real do fundo de olho (direita) 5-7 dias após a inoculação. São mostradas imagens representativas de tumores pequenos, médios e grandes. Essa figura é adaptada de Zaks et al.21. Clique aqui para ver uma versão maior desta figura.
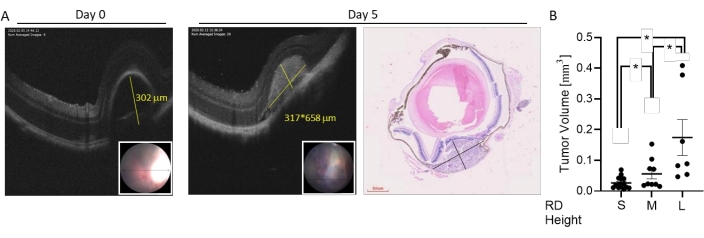
Figura 4: Classificação do tamanho do tumor com base em imagens ao vivo da OCT. Os tumores foram induzidos por injeção subcoroidal de 7 × 104 células B16LS9. O crescimento do tumor foi avaliado em imagens de OCT ao vivo imediatamente e 5 dias após a injeção. (A) Uma medida representativa da OCT da altura da DR após a injeção (dia 0, esquerda, linha amarela indica altura), altura e largura do tumor em um exame horizontal da OCT (dia 5, meio, linhas amarelas indicam altura e largura) e uma seção ocular corada por H&E (direita). Inset: imagem de fundo de olho da área de DR. (B) A variedade de tamanhos de tumor induzidos foi dividida em três grupos. As medidas de volume tumoral de camundongos que apresentaram DR pequena (S, n = 15), média (M, n = 9) ou grande (L, n = 7) imediatamente após a injeção celular são representadas. *p < 0,05. Essa figura é adaptada de Zaks et al.21. Clique aqui para ver uma versão maior desta figura.
| RD altura | Volume tumoral |
| <300 μm (pequeno) | 0,0059 mm 3 a 0,07 mm 3 (média 0,027 ± 0,005 mm3) |
| 300-400 μm (médio) | 0,015 mm 3 a 0,15 mm 3 (média 0,056 ± 0,016 mm3) |
| > 400 μm (grande) | 0,05 mm 3 a 0,36 mm 3 (média 0,017 ± 0,06 mm3) |
Tabela 1: As alturas de DR associadas com o tamanho do tumor.
Discussão
O melanoma uveal é uma doença devastadora para a qual novas abordagens terapêuticas são extremamente necessárias. No entanto, a pesquisa sobre melanoma uveal e potenciais tratamentos é limitada pelos desafios técnicos dos modelos animais de melanoma uveal 1,25. Os tumores oculares, que são induzidos pela injeção intraocular de células cancerosas, são altamente variáveis em localização e tamanho, provavelmente devido às pequenas dimensões do olho de camundongo. Tal variabilidade é um obstáculo para a avaliação abrangente da progressão tumoral. A abordagem experimental aqui descrita permite avaliar a localização intraocular do tumor e o tamanho previsto imediatamente após a injeção de células de melanoma B16LS9 subcoroidal, com base em imagens de OCT aovivo21. Ao longo dos anos, o desenvolvimento de técnicas de imagem ao vivo proporcionou vantagens na pesquisa do câncer, permitindo acompanhar a progressão do tumor ao longo dos experimentos, não apenas em desfechos pré-definidos. Tais métodos incluem, por exemplo, imagens bioluminescentes utilizando células repórteres, que permitem monitorar a localização de tumores e metástases em animais vivos, incluindo a identificação de tumores oculares16. Outro método sofisticado é a imagem fotoacústica, que permite a obtenção de imagens de alta resolução das células e a distinção entre células de melanoma e célulassaudáveis26,27. No entanto, a vantagem distinta da OCT é a capacidade de identificar a localização intraocular dos tumores e avaliar seu tamanho em animais vivos.
O protocolo aqui descrito descreve a inoculação intraocular de células de melanoma através da formação de uma peritomia e um trato para o espaço subcoroidal, seguida da inserção suave de uma agulha romba na ponta do trato e injeção de células. Isso elimina a punção excessiva e direciona o local da inoculação celular. A injeção induz o descolamento de retina, que reflete a localização e o tamanho do tumor que será desenvolvido. Nossas observações sugerem que tumores formados na posição de uma DR local tendem a ser focais, e seu tamanho corresponde à altura da DR após a injeção. Em contraste, múltiplas DRs, ou a detecção de células no vítreo após a injeção, tipicamente resultam em tumoresdispersos21.
É plausível que a DR focal reflita que a injeção compactou a maioria das células em um determinado local, permitindo a formação de um tumor localizado. Por outro lado, múltiplos sítios de DR implicam que a injeção atingiu vários locais através da retina, aumentando a probabilidade de que células tumorais foram implantadas em vários locais e formaram tumores dispersos.
Avaliar a localização e o tamanho previsto do tumor no início da injeção é particularmente importante ao avaliar a progressão tumoral, como examinar o efeito de fatores específicos ou tratamentos potenciais. A determinação precoce pode permitir a inclusão de um grupo de estudo homogêneo, aumentando a reprodutibilidade do modelo, melhorando a acurácia do estudo e economizando tempo e custos valiosos. Além disso, como as imagens de OCT de tumores intraoculares fornecem informações precisas sobre a localização e o tamanho dos tumores em animais vivos, camundongos podem ser monitorados para experimentos de longo prazo, por exemplo, para avaliar metástases. Outra dificuldade em modelos de melanoma em camundongos é que a pigmentação de camundongos, como em camundongos C57BL/6, muitas vezes restringe a análise de tumores pigmentados. Portanto, outra vantagem da OCT é que ela é independente da pigmentação e pode ser aplicada em camundongos pigmentados ou lesões.
Deve-se notar que vários parâmetros, como a cepa do camundongo, linhagem celular ou técnica de injeção, podem afetar a iniciação e o crescimento do tumor. Portanto, recomenda-se a otimização do modelo para cepas ou células específicas. Deve-se considerar também que a catarata secundária pode se desenvolver ao longo do tempo1, limitando a capacidade de uso da OCT. Embora seja improvável que isso ocorra no curto espaço de tempo aqui descrito, deve-se considerar aumentar o tamanho do grupo se realizar experimentos mais longos para permitir a exclusão de olhos com catarata.
Em resumo, o protocolo descrito utiliza um modelo comum de melanoma B16LS9, avaliado por OCT vivo, para desenvolver um modelo reprodutível para avaliar tumores de coroide em animais vivos. Esta abordagem pode ser utilizada para estudos futuros que investiguem os mecanismos subjacentes do melanoma uveal, novos modelos experimentais e potenciais novas terapias.
Divulgações
Marcovich A.L.: Steba Biotech (P), Yeda Weizmann (P), EyeYon Medical (C, P), Mor Isum (P). (C) = Consultor; (P) = Patente. Todos os outros autores não têm interesses concorrentes.
Agradecimentos
Este estudo foi parcialmente financiado pelo subsídio 1304/20 da Israel Science Foundation (ISF), Israel, para Arie Marcovich. Agradecemos a Shahar Ish-Shalom e Ady Yosipovich, do Departamento de Patologia do Kaplan Medical Center, Rehovot, Israel, pela análise histológica.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 μL glass syringe (Hamilton Co., Bonaduz, Switzerland) | Hamilton | 721711 | |
| 30 G needles | BD Microbalance | 2025-01 | |
| Atipamezole hydrochloride | Orion Phrma | ||
| B16LS9 cells | from Hans Grossniklaus USA | ||
| Buprenorphine | richter pharma | 102047 | |
| C57BL/6 female mice | Envigo | ||
| Essential vitamin mixture | satorius | 01-025-1A | |
| Fetal bovine serum | rhenium | 10270106 | |
| HEPES | satorius | 03-025-1B | |
| Hydroxyethylcellulose 1.4% eye drops | Fisher Pharmaceutical | 390862 | |
| InSight OCT segmentation software | Phoenix Micron, Inc | ||
| Ketamine | bremer pharma GMBH (medimarket) | 17889 | |
| L-glutamine | satorius | 03-020-1B | |
| Medetomidine | zoetis (vetmarket) | 102532 | |
| Ofloxacin 0.3% eye drops | allergan | E92170 | |
| Optical coherence tomography | Phoenix Micron, Inc | ||
| Oxybuprocaine 0.4% | Fisher Pharmaceutical | 393050 | |
| Penicillin-streptomycin-amphoteracin | satorius | 03-033-1B | |
| Phosphate buffered saline (PBS) | satorius | 02-023-1a | |
| RPMI cell media | satorius | 01-104-1A | |
| Sodium pyruvate | satorius | 03-042-1B | |
| Surgical microscope | Zeiss | OPMI-6 CFC | |
| Tropicamide 0.5% | Fisher Pharmaceutical | 390723 |
Referências
- Jager, M. J., et al. Uveal melanoma. Nature Reviews Disease Primers. 6 (1), 1-25 (2020).
- Bustamante, P., Piquet, L., Landreville, S., Burnier, J. V. Uveal melanoma pathobiology: Metastasis to the liver. Seminars in Cancer Biology. 71, 65-85 (2021).
- Damato, B. Ocular treatment of choroidal melanoma in relation to the prevention of metastatic death-A personal view. Progress in Retinal and Eye Research. 66, 187-199 (2018).
- Jouhi, S., et al. The small fatal choroidal melanoma study. A survey by the European Ophthalmic Oncology Group. American Journal of Ophthalmology. 202, 100-108 (2019).
- Cao, J., Jager, M. J. Animal eye models for uveal melanoma. Ocular Oncology and Pathology. 1 (3), 141-150 (2015).
- Uner, O. E., Gandrakota, N., Azarcon, C. P., Grossniklaus, H. E. Animal models of uveal melanoma. Annals of Eye Science. 7, 21-30 (2022).
- Yang, H., Dithmar, S., Grossniklaus, H. E. Interferon alpha 2b decreases hepatic micrometastasis in a murine model of ocular melanoma by activation of intrinsic hepatic natural killer cells. Investigative Ophthalmology & Visual Science. 45 (7), 2056-2064 (2004).
- Yang, H., Grossniklaus, H. E. Combined immunologic and anti-angiogenic therapy reduces hepatic micrometastases in a murine ocular melanoma model. Current Eye Research. 31 (6), 557-562 (2006).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Diaz, C. E., Rusciano, D., Dithmar, S., Grossniklaus, H. E. B16LS9 melanoma cells spread to the liver from the murine ocular posterior compartment (PC). Current Eye Research. 18 (2), 125-129 (1999).
- Rusciano, D., Lorenzoni, P., Burger, M. M. Murine models of liver metastasis. Invasion & Metastasis. 14 (1-6), 349-361 (1994).
- Ashur-Fabian, O., et al. Tetrac delayed the onset of ocular melanoma in an orthotopic mouse model. Frontiers in Endocrinology. 12, 632335 (2019).
- Elia, G., et al. Mechanisms regulating c-met overexpression in liver-metastatic B16-LS9 melanoma cells. Journal of Cellular Biochemistry. 81 (3), 477-487 (2001).
- Harning, R., Szalay, Z. Ocular metastasis of in vivo and in vitro derived syngeneic murine melanoma. Investigative Ophthalmology & Visual Science. 28 (9), 1599-1604 (1987).
- Ezra-Elia, R., et al. Can an in vivo imaging system be used to determine localization and biodistribution of AAV5-mediated gene expression following subretinal and intravitreal delivery in mice. Experimental Eye Research. 176, 227-234 (2018).
- Notting, I. C., et al. Whole-body bioluminescent imaging of human uveal melanoma in a new mouse model of local tumor growth and metastasis. Investigative Ophthalmology & Visual Science. 46 (5), 1581-1587 (2005).
- Yang, H., et al. In-vivo xenograft murine human uveal melanoma model develops hepatic micrometastases. Melanoma Research. 18 (2), 95-103 (2008).
- Murthy, R. K., Haji, S., Sambhav, K., Grover, S., Chalam, K. V. Clinical applications of spectral domain optical coherence tomography in retinal diseases. Biomedical Journal. 39 (2), 107-120 (2016).
- Drexler, W., et al. Ultrahigh-resolution ophthalmic optical coherence tomography. Nature Medicine. 7 (4), 502-507 (2001).
- Ochakovski, G. A., Fischer, M. D. Phenotyping of mouse models with OCT. Methods in Molecular Biology. 1834, 285-291 (2019).
- Zaks, O., et al. In-vivo imaging for assessing tumor growth in mouse models of ocular melanoma. Experimental Eye Research. 204, 108431 (2021).
- Brar, V. S. American Academy of Ophthalmology 2022-2023 BCSC. 2. Fundamentals and principles of ophthalmology. , (2022).
- Duker, J. S., Waheed, N. K., Goldman, D. . Handbook of Retinal OCT: Optical Coherence Tomography, 2nd Edition. , (2021).
- Tomayko, M. M., Reynolds, C. P. Determination of subcutaneous tumor size in athymic (nude) mice. Cancer Chemotherapy and Pharmacology. 24 (3), 148-154 (1989).
- Richards, J. R., Yoo, J. H., Shin, D., Odelberg, S. J. Mouse models of uveal melanoma: Strengths, weaknesses, and future directions. Pigment Cell & Melanoma Research. 33 (2), 264 (2020).
- Chen, R., et al. Photoacoustic molecular imaging-escorted adipose photodynamic-browning synergy for fighting obesity with virus-like complexes. Nature Nanotechnology. 16 (4), 455-465 (2021).
- Yu, Q., et al. Label-free visualization of early cancer hepatic micrometastasis and intraoperative image-guided surgery by photoacoustic imaging. Journal of Nuclear Medicine. 61 (7), 1079-1085 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados