Method Article
Модифицированная хирургическая модель нейропатической боли у мышей при повреждении щадящего нерва
* Эти авторы внесли равный вклад
В этой статье
Резюме
Модифицированная хирургия представляет собой упрощенный метод для модели повреждения нерва мышью или крысой, который требует только одной перевязки и одного разреза для повреждения как общих малоберцовых, так и икроножных нервов.
Аннотация
Повреждение пощадного нерва (SNI) — это животная модель, которая имитирует основные симптомы повреждения периферических нервов для изучения молекулярного и клеточного механизма нейропатической боли у мышей и крыс. В настоящее время существует два типа модели SNI: один для разрезания и перевязки общего малоберцового и большеберцового нервов с интактным икроножным нервом, который определяется как SNI в этом исследовании, а другой для разрезания и перевязки общего малоберцового и икроножного нервов с интактным большеберцовым нервом, который в этом исследовании определяется как SNIt. Поскольку икроножный нерв является чисто сенсорным, в то время как большеберцовый нерв содержит как моторные, так и сенсорные волокна, модель SNIt имеет гораздо меньший двигательный дефицит, чем модель SNI. В традиционной модели мыши SNIt общий малоберцовый и икроножный нервы разрезаются и перевязываются отдельно. Здесь описан модифицированный метод хирургии SNIt для повреждения как общих малоберцовых, так и икроножных нервов с помощью всего одной перевязки и одного разреза с более коротким временем процедуры, что легче выполнить и снижает потенциальный риск растяжения седалищного или большеберцового нервов, а также вызывает такую же механическую гиперчувствительность, как и традиционная модель SNIt.
Введение
Нейропатическая боль, вызванная повреждением нерва после операции или травмы, имеет значительное экономическое бремя, которое ухудшает качество жизни. Для изучения молекулярного и клеточного механизма развития седалищного нерва было успешно разработано множество моделей повреждения нервов, включая лигирование спинномозгового нерва (SNL)1, хроническое сужительное повреждение (CCI)2 седалищного нерва, частичное лигирование седалищного нерва (pSNL)3, транзакцию седалищного нерва (SNT)4 и повреждение щадящего нерва (SNI)5,6,7,8. нейропатическая боль 6,7,8,9,10. Тем не менее, каждая хирургическая модель имеет свои преимущества и ограничения, поэтому особое внимание следует уделить изучению и разработке хирургических моделей.
Модель SNI у грызунов вызывает долгосрочную гиперчувствительность к механической стимуляции. Тем не менее, это несколько сбивает с толку, потому что существуют две разные модели SNI. Первоначальная модель SNI была разработана в лаборатории Вулфа, в которой были повреждены общий малоберцовый и большеберцовый нервы, в результате чего икроножный нерв остался нетронутым 5,6. Вторая модель SNI была разработана в лаборатории Басбаума, в которой были повреждены общий малоберцовый и икроножный нервы, в результате чего большеберцовый нерв остался нетронутым 7,8. Первоначальная модель Вульфа здесь определена как SNI, потому что икроножный нерв остается нетронутым, а модель Басбаума здесь определена как SNIt, потому что большеберцовый нерв остается нетронутым. Поскольку икроножный нерв является чисто сенсорным, в то время как большеберцовый нерв содержит как моторные, так и сенсорные волокна, модель SNIt имеет гораздо меньший двигательный дефицит, чем модель SNI. Однако, в отличие от модели SNIs, у мышей в модели SNIt не развивается тепловая гиперчувствительность, но механическая гиперчувствительность развивается в обеих моделях. Несмотря на то, что модель SNIt является относительно простой процедурой, она требует перевязки икроножного и общего малоберцовых нервов отдельно с потенциальным риском растяжения седалищного или большеберцового нервов 6,7,8,9.
Общие малоберцовый, большеберцовый и икроножный нервы представляют собой три ветви седалищного нерва и могут быть четко идентифицированы на верхнем крае икроножной мышцы (рис. 1): большеберцовый нерв проходит под икроножной мышцей, а общий малоберцовый (головная сторона) и икроножный нерв (каудальная сторона) находятся над икроножной мышцей11. Основываясь на его анатомических особенностях, была разработана модифицированная хирургическая процедура мыши для перевязки общих малоберцовых и икроножных нервов вместе с одной лигацией нерва и одним перерезанием нерва, что приводит к сокращению времени процедуры.
протокол
Эксперименты на животных были одобрены Институциональным комитетом по уходу за животными и их использованию и проводились в соответствии с Руководством NIH по уходу и использованию лабораторных животных. В данном исследовании использовались взрослые мыши C57BL/6 с массой тела 20-30 г. Оценка фон Фрея проводилась в период с 13:00 до 15:00.
1. Анестезия и подготовка мышей
- Поместите мышь в пластиковую камеру, заполненную 2% изофлураном вО2 со скоростью потока 1,0 л/мин, до полного обезболивания.
- Нанесите на глаза офтальмологическую мазь с помощью ватного аппликатора.
- Поместите морду мыши в гибкий носовой конус с потоком изофлурана 2% на протяжении всей хирургической процедуры.
- Поместите мышь в правильное боковое положение. Держите левую ногу вверх, сгибая колено, и закрепите ее клейкой лентой.
- Удалите волосы в области бедер и колен с помощью электробритвы и крема для удаления волос. Продезинфицируйте кожу 2% хлоргексидином и 70% спиртом.
- Обеспечьте достаточную глубину анестезии перед операцией, проверив отсутствие реакции на щипковый стимул на задней конечности или хвосте с помощью пинцета в стандартной комплектации. Обеспечьте тепловую поддержку мыши.
Примечание: До и после выполнения модели SNIt не использовались местные анестетики или НПВП, поскольку местный анестетик и НПВП значительно снижают нейропатическое болевое поведение после SNIt12.
2. Модифицированная хирургия SNIt
- Сделайте скальпелем разрез длиной 1 см, начиная с первой 1/3 горизонтальной линии, пересекающей колено под углом примерно 30° от вертикальной линии (рисунок 2А).
- После отделения разреза кожи под двуглавой мышцей бедра (BFM) можно визуализировать две белые линии, при этом медиальная (цефаладная) толстая линия является бедренной костью, а боковая (каудальная) тонкая линия — седалищным нервом (рис. 2B).
- Тупым образом рассеките BFM вдоль каудальной белой линии изогнутыми микрощипцами и микроножницами, чтобы обнажить седалищный нерв. Избегайте повреждения кровеносных сосудов при тупом рассечении. Если произошло случайное повреждение сосуда, используйте стерильные ватные тампоны для впитывания крови и приложите надлежащее давление, чтобы остановить кровотечение.
- Дифференцируйте три ветви седалищного нерва на верхнем крае икроножной мышцы. Большеберцовый нерв имеет наибольший диаметр, проходящий под икроножной мышцей, в то время как икроножные нервы (латеральные, наименьшего диаметра) и общий малоберцовый нерв (медиальный) проходят над икроножной мышцей (рис. 2C и рис. 3A).
- В зависимости от того, как рассекается и вскрывается BFM, визуализируйте общий малоберцовый нерв как латеральный (рисунок 2C) или медиальный (рисунок 3A) по отношению к большеберцовому нерву.
- Отделите общий малоберцовый и икроножный нервы от соседних тканей с помощью изогнутых микрощипцов.
- Перевязать общие малоберцовый и икроножный нервы вместе с помощью шва 6-0, так как оба нерва проходят над икроножной мышцей, а большеберцовый нерв проходит под икроножной мышцей (Рисунок 2D и Рисунок 3B,C). Наблюдайте за сокращением конечности после тугой лигатуры. При традиционном методе перевязка общих малоберцовых и икроножных нервов проводится отдельно.
- Разрежьте нерв в дистальном отделе в пределах 2-4 мм от перевязки с помощью микроножниц. Следите за тем, чтобы большеберцовый нерв оставался нетронутым в течение всей процедуры. При традиционном методе перережьте общие малоберцовые и икроножные нервы в дистальной части в пределах 2-4 мм от лигирования и удалите участок длиной 2 мм отдельно.
- Закройте мышечный слой шелковым швом 6-0, а разрез кожи - зажимами для раны.
- После операции верните мышей в помещение для животных до полного восстановления после анестезии. Ежедневно проверяйте наличие неповрежденных разрезов, нормального приема пищи, потребления воды, общего состояния тела, регулярных движений и ухода за собой. Снимите зажимы для раны через 7-14 дней после операции.
3. Оценка фон Фрея для механического порога
- Акклиматизируйте мышей в течение 6 дней к условиям испытательной комнаты и тестовым материалам для проведения оценки по фон Фрею. Поместите мышей в прозрачные пластиковые цилиндры на приподнятую сетку из проволочной сетки на 1 час привыкания. Поместите белую бумагу между каждым цилиндром, чтобы предотвратить какие-либо визуальные подсказки от каждого испытуемого животного.
- В течение этого периода проводите привыкание каждые 2 дня и измеряйте базовую линию мононитей фон Фрея под серединой подошвенной задней лапы после последнего привыкания.
- Выполните оценку по методу фон Фрея с помощью слепого тестера. Стимулируйте середину подошвенной части задней лапы нитями фон Фрея, используя парадигму «вверх-вниз»13. Нанесите нить фон Фрея на подошвенную поверхность перпендикулярно приложенной силой, чтобы вызвать легкое скручивание.
- Проверяйте положительные реакции, такие как внезапное отдергивание лапы, внезапное вздрагивание или внезапное облизывание лапы. Прикладывайте следующий раздражитель с интервалом в 5 с, чтобы избежать влияния предыдущего раздражителя.
- Подтвердите механический порог на лапу, проведя в среднем 3 сеанса.
- Основываясь на 50% пороге отведения задней лапы, определенном методом вверх-вниз, используйте метод процентной реакции с нитью 0,16 г для дальнейшей оценки разницы.
- Запишите процент положительных реакций после 10 стимулов по 0,16 г нити, нанесенных на середину подошвенной части задней лапы, независимо от ответов.
- Выполняйте оценку по методу фон Фрея в 1-й день до операции и после операции в 1, 3, 5, 7 и 14 дни.
4. Статистический анализ
- Вывод нормально распределенных непрерывных данных в виде среднего ± стандартной погрешности среднего (SEM). Анализируйте непрерывные данные с помощью 2-хвостового t-критерия или двустороннего повторного измерения ANOVA. Обрабатывайте все данные с помощью программного обеспечения для статистического анализа, со статистической значимостью на уровне p < 0,05.
Результаты
Сравнение времени процедуры между модифицированными и традиционными методами.
Время процедуры от начала разреза кожи до конца смыкания кожи регистрировалось у 5 мышей при модифицированном подходе и у 5 мышей при традиционном подходе соответственно. Для получения результатов, имеющих статистическую значимость, использовалось минимальное количество животных. По сравнению с контролем по традиционному подходу 7,14 для выполнения SNIt, модифицированный подход занимал почти вдвое меньше времени процедуры (236,2 ± 28,6 с против 422,6 ± 53,8 с, p=0,0156; Рисунок 4).
Сравнение механической гиперчувствительности между двумя методами.
Различий в оценке по методу фон Фрея (ручной) в обеих группах на исходном уровне не наблюдалось (1,05 ± 0,10 г против 0,96 ± 0,13 г, p=0,9405). По сравнению с традиционным методом (n=9), модифицированный метод (n=14) индуцировал аналогичную механическую гиперчувствительность на ипсилатеральной стороне с 1-го дня после операции до 14-го дня после операции (0,33 ± 0,09 г против 0,32 ± 0,05 г, p>0,9999, в 1-е сутки после операции; 0,19 ± 0,02 г против 0,27 ± 0,06 г, p=0,9485 в 3-е сутки; 0,20 ± 0,06 г против 0,15 ± 0,05 г, p=0,9979, на 5-е сутки после операции; 0,13 ± 0,02 г против 0,15 ± 0,03 г, p>0,9999, на 7-е сутки после операции; и 0,14 ± 0,02 г против 0,19 ± 0,03 г, p=0,9937, на 14-е сутки после операции; Рисунок 5А).
По сравнению с процентным ответом между традиционным (n=5) и модифицированным методом (n=5), аналогичная механическая гиперчувствительность наблюдалась на ипсилатеральной стороне с исходного уровня (4,00% ± 2,45% против 6,00% ± 2,45%, p>0,9999) до 1-го дня после операции (20,00% ± 3,16% против 12,00% ± 3,74%, p=0,8987), 3-го дня (30,00% ± 5,48% против 32,00% ± 4,90%, p>0,9999), 5-го дня (36,00% ± 9,27% против 30,00% ± 5,48%, p=0.9730), день 7 (32.00% ± 8.00% против 36.00% ± 4.00%, p=0.9968) и день 14 (38.00% ± 5.83% против 36.00% ± 7.48%, p>0.9999; Рисунок 5В).
Отсутствие нейронного соединения между дистальным отделом и оставшейся культей на 14-е сутки после операции.
Поскольку регенерация аксонов протекает со скоростью 1-3 мм/сутки15, следует учитывать, есть ли регенерация нервов на 14-е сутки после операции. На 14-е сутки после операции модифицированным мышам SNI перфузировали внутрисердечно 0,1 моль/л фосфат-буферного физиологического раствора с последующим вводом 10% фиксатора формалина, буферизованного фосфатами, а также рассекали и обнажали место перевязки нервов. Не наблюдалось нейронного пересоединения между дистальным отделом и оставшимися культями (рисунок 3D).

Рисунок 1. Иллюстрация 3 ветвей седалищного нерва, которые разделены по верхнему краю икроножной мышцы (ГМ) в области колена. Большеберцовый нерв проходит под ГМ-мышцей, а общий малоберцовый нерв и икроножный нерв проходят над ГМ-мышцей. 1: седалищный нерв; 2: большеберцовый нерв; 3: общий малоберцовый нерв; 4: икроножный нерв. Сокращения: BFM = двуглавая мышца бедра; GM = икроножная мышца. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2. Иллюстрация хирургической процедуры на модифицированных мышах SNI. (A) В боковом положении левая нога находится вверх с сгибанием колена. Желтая горизонтальная линия (1) указывает на горизонтальную линию, пересекающую уровень колена, а желтая пунктирная стрелка (2) указывает на разрез. (B) После разреза кожи можно визуализировать две белые линии под двуглавой мышцей бедра (BFM). Бедренная кость находится под головным (3), а седалищный нерв – под хвостовым (4). (C) После тщательного вскрытия BFM можно визуализировать седалищный нерв (5) и три его ветви: большеберцовый (6), общий малоберцовый (7) и икроножный (8) нервы. (D) Общий малоберцовый (7) и икроножный (8) нервы были перевязаны вместе. 1: горизонтальная линия, пересекающая колено; 2: разрез на разрезе; 3: бедренная кость снизу; 4: седалищный нерв снизу; 5: седалищный нерв; 6: большеберцовый нерв; 7: общий малоберцовый нерв; 8: испорчатый нерв; 9: Белая изогнутая линия указывает на колено. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
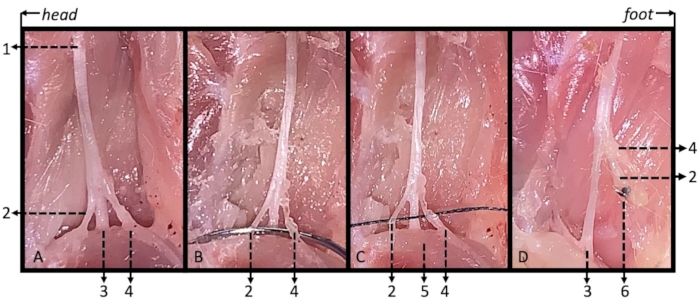
Рисунок 3. Иллюстрация седалищного, большеберцового, сурального и общего малоберцового нервов с лигированием модифицированного SNI у мышей с интракардиальной перфузией. (А) Седалищный нерв (1) и три его ветви: большеберцовый нерв (2), проходящий под икроножной мышцей (5), и общий малоберцовый (3) и икроножный (4) нервы, проходящие над икроножной мышцей. (B) Пересечение иглы швом под общими малоберцовыми и икроножными нервами вместе. (C) Нейлоновый шов 6-0 был использован для перевязки общих малоберцовых и икроножных нервов. (D) На 14-й день после операции не наблюдалось восстановления связи между дистальным отделом и оставшейся культей нерва. 1: седалищный нерв; 2: общий малоберцовый нерв 3: большеберцовый нерв; 4: искорный нерв; 5: икроножная мышца; 6: лигирование. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
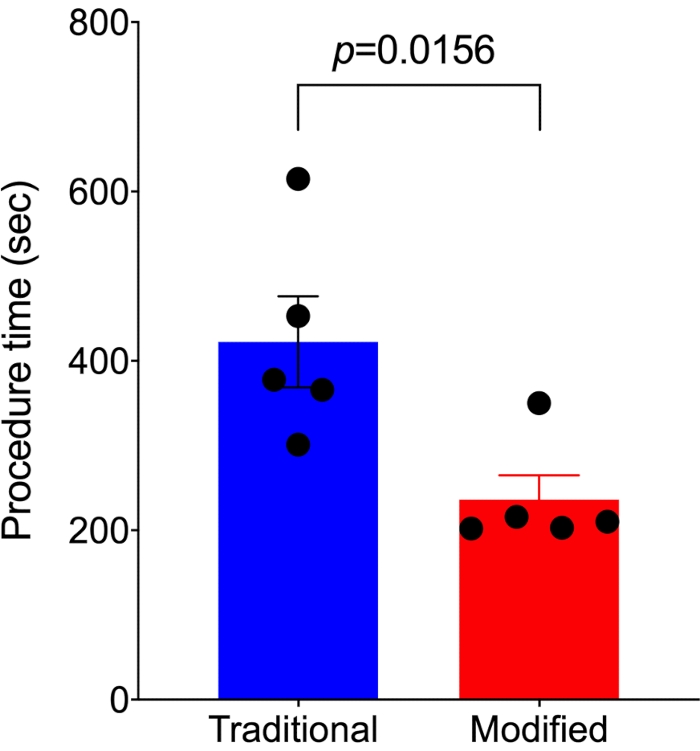
Рисунок 4. Модифицированный метод выполняется быстрее, чем традиционный метод SNI. По сравнению с традиционным методом SNI (n=5), модифицированный метод (n=5) требует гораздо меньше времени для выполнения процедуры. Анализ проводился с использованием непарного t-критерия, и данные представлены в виде среднего значения ± SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5. Оценка фон Фрея механической отзывчивости в традиционных и модифицированных моделях SNI. (A) Модифицированные модели SNI (n=9) и традиционные модели SNI (n=14) индуцировали аналогичную механическую гиперчувствительность на ипсилатеральной стороне в течение 14-дневного наблюдения. (B) Модифицированные модели SNI (n=5) и традиционные SNI (n=5) получили одинаковые процентные ответы на ипсилатеральной стороне в течение 14-дневного наблюдения. Анализ проводили с использованием двустороннего ANOVA с помощью теста множественных сравнений Сидака. Данные представлены в виде среднего значения ± SEM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
По сравнению с традиционным методом SNIt мыши, который лигирует общий малоберцовый нерв и икроножный нерв отдельно 6,7,8,9, модифицированная модель SNIt имеет три преимущества: (1) она имеет меньший риск сокращения или растяжения седалищного или большеберцового нервов; (2) Нет необходимости удалять культи дистального нерва после перерезания нерва, потому что путем перевязки общего малоберцового нерва и икроножного нерва вместе, культи дистального нерва анатомически отделяются от проксимальных культей. Действительно, анатомическое вскрытие показало, что через 14 дней после модификации SNIt регенерация нервов не наблюдалась; (3) Процедура намного проще в выполнении и занимает гораздо более короткое время.
При выполнении модифицированного SNIt очень важно делать разрезы кожи низко примерно на уровне колена, а не высоко в бедре возле бедра. Это связано с тем, что общие малоберцовые, большеберцовые и икроножные нервы не ответвляются от седалищного нерва в области высокого бедра, что затрудняет разделение трех ветвей. В противоположность этому, на верхнем крае икроножной мышцы в районе колена три ветви икроножного нерва проходят отдельно и легко визуализируются и идентифицируются как большеберцовый нерв, проходящий под икроножной мышцей, и общий малоберцовый нерв на черепной стороне и икроножный нерв на каудальной стороне, проходящий над икроножной мышцей11. Интересно, что, хотя общий малоберцовый нерв находится медиально большеберцовому нерву в области бедра, он обычно пересекает большеберцовый нерв, чтобы приблизиться к икроножному нерву на верхнем крае икроножной мышцы в области колена в боковом положении в боковом положении с сгибанием колена, что облегчает лигирование общих малоберцовых и икроножных нервов вместе. Важно отметить, что большеберцовый нерв остается неповрежденным без контакта или растяжения, когда общие малоберцовые и икроножные нервы перевязываются над икроножной мышцей. Кроме того, при расслоении БФМ для обнажения под нервами важно избегать повреждения кровеносных сосудов (латеральной проксимальной коленной артерии, подколенной артерии, дистальной каудальной бедренной артерии и т.д.), расположенных над икроножной мышцей16.
Несмотря на то, что эта модифицированная модель SNIt успешно развивает нейропатическую боль, необходимо признать некоторые ограничения. Из-за повреждения общего малоберцового нерва это может привести к двигательной дисфункции с заметно вытянутой задней ногой17. Другой вариант, область механической гиперчувствительности иннервируется интактным нервом, а не поврежденным нервом, но нейропатическая боль часто вызвана поражением или заболеванием периферической или центральной нервной системы при клиническомлечении боли. Таким образом, необходимы дальнейшие исследования для разработки нейропатической модели боли.
Таким образом, этот модифицированный метод SNIt у мышей представляет собой упрощенную процедуру SNI с одним перевязкой нерва и одним перерезанием нерва без какого-либо удаления нервных культей. Это гораздо легче выполнить при создании механической гиперчувствительности, вызванной повреждением нерва, со снижением риска повреждения седалищного или большеберцового нервов.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Z.G. поддерживается NINDS R01NS100801.
Материалы
| Name | Company | Catalog Number | Comments |
| 6-0 suture | Henry Schein | 9007482 | Nerve ligation and close the muscular layer |
| Iris Scissors | Integra Miltex | 12460598 | Cut muscle and fascia |
| Mayo dissecting scissors | Fisherbrand | 895120 | Cut skin incision |
| Micro forcep | Fisherbrand | 16100110 | Blunt dissection biceps femoris muscle |
| Micro Scissors | Excelta | 17467496 | Cut nerve |
| Microdissection Forceps | Fisherbrand | 16100123 | Separate the common peroneal and the sural nerves from the neighboring tissues |
| Needle Holder | Fisherbrand | 8966 | Hold 6-0 needle |
| Prism software | Graph Pad | version 8.0 | Statistical analysis software |
| Wound clips | Roboz Surgical | NC1878744 | Close skin incision |
Ссылки
- Chung, J. M., Kim, H. K., Chung, K. Segmental spinal nerve ligation model of neuropathic pain. Methods in Molecular Medicine. 99, 35-45 (2004).
- Vissers, K., Adriaensen, H., De Coster, R., De Deyne, C., Meert, T. F. A chronic-constriction injury of the sciatic nerve reduces bilaterally the responsiveness to formalin in rats: a behavioral and hormonal evaluation. Anesthesia and Analgesia. 97 (2), 520-525 (2003).
- Malmberg, A. B., Basbaum, A. I. Partial sciatic nerve injury in the mouse as a model of neuropathic pain: behavioral and neuroanatomical correlates. Pain. 76 (1-2), 215-222 (1998).
- Moore, K. A., et al. Partial peripheral nerve injury promotes a selective loss of GABAergic inhibition in the superficial dorsal horn of the spinal cord. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 22 (15), 6724-6731 (2002).
- Decosterd, I., Woolf, C. J. Spared nerve injury: an animal model of persistent peripheral neuropathic pain. Pain. 87 (2), 149-158 (2000).
- Cichon, J., Sun, L., Yang, G. Spared Nerve Injury Model of Neuropathic Pain in Mice. Bio-Protocol. 8 (6), 2777 (2018).
- Shields, S. D., Eckert, W. A., Basbaum, A. I. Spared nerve injury model of neuropathic pain in the mouse: a behavioral and anatomic analysis. The Journal of Pain. 4 (8), 465-470 (2003).
- Guan, Z., et al. Injured sensory neuron-derived CSF1 induces microglial proliferation and DAP12-dependent pain. Nature Neuroscience. 19 (1), 94-101 (2016).
- Richner, M., Bjerrum, O. J., Nykjaer, A., Vaegter, C. B. The spared nerve injury (SNI) model of induced mechanical allodynia in mice. Journal of Visualized Experiments: JoVE. (54), e3092 (2011).
- Challa, S. R. Surgical animal models of neuropathic pain: Pros and Cons. The International Journal of Neuroscience. 125 (3), 170-174 (2015).
- Kosaka, Y., et al. Development and persistence of neuropathic pain through microglial activation and KCC2 decreasing after mouse tibial nerve injury. Brain Research. 1733, 146718 (2020).
- Parisien, M., Lima, L. V., Dagostino, C., El-Hachem, N., Drury, G. L., Grant, A. V., Huising, J., Verma, V., Meloto, C. B., Silva, J. R., Dutra, G. C. S., Markova, T., Dang, H., Tessier, P. A., Slade, G. D., Nackley, A. G., Ghasemlou, N., Mogil, J. S., Allegri, M., Diatchenko, L. Acute inflammatory response via neutrophil activation protects against the development of chronic pain. Sci Transl Med. 14 (644), eabj9954 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Bourquin, A. F., et al. Assessment and analysis of mechanical allodynia-like behavior induced by spared nerve injury (SNI) in the mouse. Pain. 122 (1-2), 1-14 (2006).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. The Ochsner Journal. 13 (1), 100-108 (2013).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 8 (12), 84047 (2013).
- Omori, Y., et al. A mouse model of sural nerve injury-induced neuropathy: gabapentin inhibits pain-related behaviors and the hyperactivity of wide-dynamic range neurons in the dorsal horn. Journal of Pharmacological Sciences. 109 (4), 532-539 (2009).
- Colloca, L., et al. Neuropathic pain. Nature Reviews. Disease Primers. 3, 17002 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены