Method Article
마우스의 신경병증성 통증에 대한 수정된 보존 신경 손상 수술 모델
* 이 저자들은 동등하게 기여했습니다
요약
수정된 수술은 생쥐 또는 쥐 보존 신경 손상 모델에 대한 단순화된 방법으로, 일반 비골 신경과 천성 신경을 모두 손상시키기 위해 한 번의 결찰과 한 번의 절개만으로 됩니다.
초록
SNI(Spared Nerve Injury)는 생쥐와 생쥐에서 신경병증성 통증의 분자 및 세포 메커니즘을 연구하기 위해 말초 신경 손상의 주요 증상을 모방한 동물 모델입니다. 현재 SNI 모델에는 두 가지 유형이 있는데, 하나는 본 연구에서 SNI로 정의된 온전한 경골 신경으로 총비골 및 경골 신경을 절단하고 결찰하는 것이고, 다른 하나는 본 연구에서 SNIt로 정의된 온전한 경골 신경으로 총비골 신경과 경골 신경을 절단하고 결찰하는 것입니다. 경골 신경은 운동 섬유와 감각 섬유를 모두 포함하는 반면 경골 신경은 순전히 감각 신경이기 때문에 SNIt 모델은 SNI 모델보다 운동 결핍이 훨씬 적습니다. 전통적인 SNIt 마우스 모델에서는 총비골신경과 비골신경을 별도로 절단하고 결찰합니다. 여기에서는 한 번의 결찰과 한 번의 절제만으로 일반 비골 신경과 천골 신경을 모두 손상시키는 수정된 SNIt 수술 방법을 설명하며, 이는 시술이 더 쉽고 좌골 또는 경골 신경이 늘어날 수 있는 잠재적 위험을 줄이며 전통적인 SNIt 모델과 유사한 기계적 과민증을 생성합니다.
서문
수술 또는 외상 후 신경 손상으로 인한 신경병증성 통증은 삶의 질을 저해하는 상당한 경제적 부담을 수반합니다. 척추 신경 결찰술(spinal nerve ligation, SNL)1, 좌골 신경에 대한 만성 수축 손상(chronic constriction injury, CCI)2, 부분 좌골 신경 결찰술(partial sciatic nerve ligation, pSNL)3, 좌골 신경 거래(sciatic nerve transaction, SNT)4 및 예비 신경 손상(spared nerve injury, SNI)5,6,7,8을 포함한 다양한 신경 손상 모델이 성공적으로 개발되었으며, 쥐와 생쥐의 분자 및 세포 메커니즘을 연구하기 위해 말초 신경 손상의 주요 증상을 모방하기 위해 성공적으로 개발되었습니다. 신경병증성 통증 6,7,8,9,10. 그러나, 각 수술 모델에는 장점과 한계가 있으므로, 수술 모델을 탐색하고 개발하는 데 특별한 주의를 기울여야 한다10.
설치류 SNI 모델은 기계적 자극에 대해 장기적으로 과민증을 일으킵니다. 그러나 두 가지 다른 SNI 모델이 있기 때문에 다소 혼란스럽습니다. 초기 SNI 모델은 Woolf의 실험실에서 개발되었으며, 총골 비골 신경과 경골 신경이 손상되어 경골 신경이 손상되지 않았습니다 5,6. 두 번째 SNI 모델은 Basbaum의 실험실에서 개발되었는데, 총비골 신경과 천성 신경이 손상되어 경골 신경이 손상되지 않았습니다 7,8. 초기 Woolf의 모델은 sural nerve가 손상되지 않았기 때문에 여기에서 SNI로 정의되고, Basbaum의 모델은 경골 신경이 손상되지 않았기 때문에 여기에서 SNIt로 정의됩니다. 경골 신경은 운동 섬유와 감각 섬유를 모두 포함하는 반면 경골 신경은 순전히 감각 신경이기 때문에 SNIt 모델은 SNI 모델보다 운동 결핍이 훨씬 적습니다. 그러나 SNIs 모델과 달리 SNIt 모델의 마우스는 열적 과민증이 발생하지 않지만 기계적 과민증은 두 모델 모두에서 발생합니다. SNIt 모델은 비교적 쉬운 절차이지만 좌골 신경 또는 경골 신경이 늘어날 수 있는 잠재적 위험과 함께 귀 신경과 일반 비골 신경의 결찰이 별도로 필요합니다 6,7,8,9.
총비골신경(common peroneal, tibial, sural nerves)은 좌골신경의 세 가지로 비복근(gastrocnemius muscle)의 상부 가장자리에서 명확하게 확인할 수 있다(그림 1): 경골신경은 비복근 아래에 있고, 총비골신경(두부 쪽)과 구신경(꼬리 쪽)은 비복근 위에 있다11. 해부학적 특징을 바탕으로 일반 비골 신경과 비골 신경을 결합하고 한 번의 신경 결찰과 한 번의 신경 절단으로 수술 시간을 단축하는 수정된 마우스 SNIt 수술 절차를 개발했습니다.
프로토콜
동물 실험은 UCSF Institutional Animal Care and Use Committee의 승인을 받았으며 NIH Guide for the Care and Use of Laboratory Animals에 따라 수행되었습니다. 이 연구에서는 20-30g 무게의 성인 C57BL/6 마우스를 사용했습니다. von Frey 평가는 오후 1:00에서 오후 3:00 사이에 수행되었습니다.
1. 마취 및 마우스 준비
- 완전히 마취될 때까지 1.0L/min의 유속으로 O2 의 2% 이소플루란으로 채워진 플라스틱 챔버에 마우스를 넣습니다.
- 솜털 어플리케이터를 사용하여 안과 연고로 눈을 가립니다.
- 수술 절차 전반에 걸쳐 2%의 이소플루란 흐름이 있는 유연한 코콘에 쥐의 주둥이를 놓습니다.
- 마우스를 오른쪽 측면 위치에 놓습니다. 무릎 굴곡으로 왼쪽 다리를 위로 유지하고 접착 테이프로 고정합니다.
- 허벅지와 무릎 주위의 털을 전기 면도기와 제모 크림으로 제거합니다. 2% 클로르헥시딘과 70% 알코올로 피부를 소독합니다.
- 핀셋을 표준으로 사용하여 뒷다리나 꼬리의 꼬집음 자극에 대한 반응이 없는지 테스트하여 수술 전에 충분한 마취 깊이를 보장합니다. 마우스에 열 지원을 제공합니다.
참고: 국소 마취제와 NSAID는 SNIt12 이후 신경병증성 통증 행동을 현저히 감소시키기 때문에 SNIt 모델을 수행하기 전과 후에 국소 마취 또는 NSAID를 사용하지 않았습니다.
2. 수정된 SNIt 수술
- 메스로 수직선에서 약 30° 각도로 무릎을 가로지르는 수평선의 첫 1/3에서 시작하여 1cm 절개를 자릅니다(그림 2A).
- 피부 절개 후 이두박근(BFM) 아래에 두 개의 흰색 선을 시각화할 수 있으며, 내측(두부) 두꺼운 선은 대퇴골, 외측(꼬리)은 좌골 신경입니다(그림 2B).
- 구부러진 마이크로 집게와 마이크로 가위로 꼬리 흰색 선을 따라 BFM을 무딘 절개하여 좌골 신경을 노출시킵니다. 둔기 박리 중 혈관 손상을 피하십시오. 우발적인 혈관 손상이 발생한 경우 멸균 면봉을 사용하여 혈액을 흡수하고 적절한 압력을 가하여 출혈을 멈추십시오.
- 비복근의 위쪽 가장자리에 있는 좌골 신경에서 세 가지를 구별합니다. 경골 신경은 가장 큰 직경이 비복근 아래를 통과하는 신경이며, 비뇨신경(측면, 가장 작은 직경)과 일반 비골 신경(내측)은 비복근 위에 있습니다(그림 2C 및 그림 3A).
- BFM을 절개하고 개방하는 방법에 따라 일반 비골 신경을 경골 신경의 측면(그림 2C) 또는 내측(그림 3A)으로 시각화합니다.
- 곡선 마이크로 집게를 사용하여 일반 비골 신경과 구강 신경을 인접 조직에서 분리합니다.
- 비골 신경과 경골 신경을 6-0 봉합사로 함께 결찰합니다. 두 신경은 모두 비복근 위를 달리지만 경골 신경은 비복근 아래를 통과합니다(그림 2D 및 그림 3B,C). 단단한 합자를 따라 팔다리가 수축하는 것을 관찰하십시오. 전통적인 방법의 경우, 총비골 신경과 귀 신경을 따로 결찰합니다.
- 마이크로 가위로 결찰 후 2-4mm 이내의 원위 부분의 신경을 자릅니다. 전체 절차 동안 경골 신경이 건드리지 않았는지 확인하십시오. 전통적인 방법의 경우 결찰 후 2-4mm 이내의 원위 부분의 총비골 및 구강 신경을 절단하고 2mm 절편을 별도로 제거합니다.
- 6-0 실크 봉합사로 근육층을 봉합하고 상처 클립으로 피부 절개 부위를 닫습니다.
- 수술 후 마취에서 완전히 회복될 때까지 생쥐를 동물실로 돌려보냅니다. 온전한 절개 부위, 정상적인 음식 섭취량, 수분 섭취량, 전반적인 신체 상태, 규칙적인 움직임 및 몸단장을 매일 확인하십시오. 수술 후 7-14일 후에 상처 클립을 제거합니다.
3. 기계적 임계값에 대한 von Frey 평가
- von-Frey 평가를 수행하기 위해 6일 동안 마우스를 시험실 환경 및 시험 재료에 적응시킵니다. 1시간 동안 습관화하기 위해 높은 철망 그리드에 있는 투명한 플라스틱 실린더에 쥐를 놓습니다. 각 실험 동물의 시각적 단서를 방지하기 위해 각 실린더 사이에 흰색 종이를 놓습니다.
- 이 기간 동안 2일마다 습관화를 수행하고 마지막 습관화 후 뒷발의 발바닥 중간 아래에서 von Frey 모노필라멘트의 기준선을 측정합니다.
- 블라인드 테스터로 von Frey 평가를 수행합니다. 업-다운 패러다임13을 사용하여 von Frey 필라멘트로 뒷발의 발바닥 중앙을 자극합니다. von Frey 필라멘트를 발바닥 표면에 수직으로 힘을 가하여 약간의 말리기를 일으킵니다.
- 갑작스런 발 후퇴, 갑작스런 움찔거림 또는 갑작스러운 발 핥기와 같은 긍정적인 반응을 확인합니다. 이전 자극의 영향을 피하기 위해 5초 간격으로 다음 자극을 가합니다.
- 평균 3 세션을 수행하여 발당 기계적 임계값을 확인합니다.
- 업다운법으로 결정된 50%의 뒷발 철수 임계값을 기준으로 0.16g 필라멘트의 퍼센트 응답법을 사용하여 차이를 더욱 평가합니다.
- 반응에 관계없이 뒷발의 발바닥 중앙에 0.16g 필라멘트를 10회 자극한 후 긍정적인 반응의 백분율을 기록합니다.
- 수술 전 1일차와 수술 후 1일, 3일, 5일, 7일, 14일에 von Frey 평가를 수행합니다.
4. 통계 분석
- 정규 분포된 계량형 데이터를 평균의 평균 ± 표준 오차(SEM)로 보고합니다. 2-측 t-검정 또는 이원 반복 측정 ANOVA를 사용하여 연속형 데이터를 분석합니다. 통계적 유의성을 p < 0.05 수준으로 통계 분석 소프트웨어를 사용하여 모든 데이터를 처리합니다.
결과
수정된 방법과 기존 방법 간의 절차 시간 비교.
피부를 절단하는 시작부터 피부를 닫는 끝까지의 시술 시간은 수정된 접근법을 사용한 5마리의 마우스와 전통적인 접근법을 사용한 5마리의 마우스에서 각각 기록되었습니다. 통계적으로 유의한 결과를 얻기 위해 최소한의 동물을 사용했습니다. SNIt를 수행하기 위한 전통적인 접근법 7,14의 제어와 비교하여, 수정된 접근법은 시술 시간의 거의 절반을 소요했다(236.2 ± 28.6초 대 422.6초 ± 53.8초, p=0.0156; 그림 4).
두 방법 간의 기계적 과민증 비교.
기준선에서 두 그룹에서 von Frey 평가(수동)의 차이가 관찰되지 않았습니다(1.05 ± 0.10g 대 0.96 ± 0.13g, p=0.9405). 기존 방법(n=9)과 비교하여 수정된 방법(n=14)은 수술 후 1일째부터 수술 후 14일째까지 동측에서 유사한 기계적 과민증을 유발했습니다(0.33 ± 0.09 g 대 0.32 ± 0.05 g, p>0.9999, 수술 후 3일째; 수술 후 3일째에 0.19 ± 0.02 g 대 0.27 ± 0.06 g, p=0.9485; 0.20 ± 0.06 g vs. 0.15 ± 0.05 g, p=0.9979, 수술 후 5일째; 0.13 ± 0.02 g 대 0.15 ± 0.03 g, p>0.9999, 수술 후 7일째; 및 수술 후 14일째에 0.14 ± 0.02 g 대 0.19 ± 0.03 g, p=0.9937; 그림 5A).
전통적 방법(n=5)과 수정된 방법(n=5) 간의 백분율 반응과 비교했을 때, 기준선(4.00% ± 2.45% vs. 6.00% ± 2.45%, p>0.9999)부터 수술 후 1일차(20.00% ± 3.16% vs. 12.00% ± 3.74%, p=0.8987), 3일차(30.00% ± 5.48% vs. 32.00% ± 4.90%, p>0.9999), 5일차(36.00% ± 9.27% vs. 30.00% ± 5.48%, p=0.9730), 7일차(32.00% ± 8.00% vs. 36.00% ± 4.00%, p=0.9968), 14일차(38.00% ± 5.83% vs. 36.00% ± 7.48%, p>0.9999; 그림 5B).
수술 후 14일째에 원위부와 남은 그루터기 사이에 신경 재연결이 없음.
축삭 재생은 1-3 mm/d15의 속도로 진행되기 때문에 수술 후 14일째에 신경 재생이 있는지 여부를 고려해야 한다. 수술 후 14일째에 변형된 SNI 마우스에 0.1mol/L 인산염 완충 식염수를 심장 내 관류한 후 인산 완충 10% 포르말린 고정제를 투여하고 신경 결찰 부위를 절제하고 노출시켰습니다. 원위부와 남아있는 그루터기 사이의 신경 재연결은 관찰되지 않았다(그림 3D).

그림 1. 무릎 부위 주위의 비복근(GM)의 상부 가장자리에서 분리된 좌골 신경의 3개 가지에 대한 그림. 경골 신경은 GM 근육 아래를 달리고 일반 비골 신경과 청 신경은 GM 근육 위를 운행합니다. 1 : 좌골 신경; 2 : 경골 신경; 3 : 일반적인 비골 신경; 4 : 귀 신경. 약어: BFM = 대퇴 이두근; GM = 비복근. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2. 변형된 SNI 마우스의 수술 절차 그림. (A) 측면 위치에서 왼쪽 다리는 무릎을 구부리고 위쪽으로 향합니다. 노란색 수평선(1)은 무릎 높이를 가로지르는 수평선, 노란색 점선(2)은 절개 부위를 나타냅니다. (B) 피부 절개 후 대퇴이두근(BFM) 아래에 두 개의 흰색 선을 시각화할 수 있습니다. 대퇴골은 두부 1(3) 아래에 있고 좌골 신경은 꼬리 1(4) 아래에 있습니다. (C) BFM을 주의 깊게 해부한 후 좌골 신경(5)과 그 세 가지, 즉 경골(6), 총비골(7) 및 경골(8) 신경을 시각화할 수 있습니다. (D) 총신경(7)과 경골신경(8)을 함께 결찰하였다. 1 : 수평선 교차 무릎; 2 : 절단 절개; 3 : 아래의 대퇴골; 4 : 아래 좌골 신경; 5 : 좌골 신경; 6 : 경골 신경; 7 : 일반적인 비골 신경; 8 : 귀 신경; 9: 흰색 곡선은 무릎을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
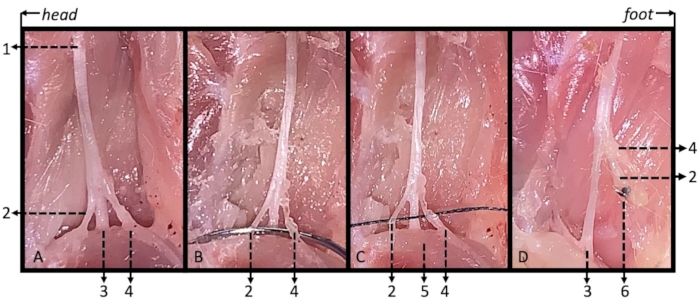
그림 3. 좌골 신경, 경골, 수랄 및 일반 비골 신경과 심장 내 관류 마우스에서 수정된 SNI 결찰의 그림. (A) 좌골 신경(1)과 그 세 가지: 비복근(5) 아래를 지나는 경골 신경(2), 비복근 위를 지나는 총비골 신경(3) 및 구신경(4). (B) 일반 비골 신경과 경막 신경 아래를 함께 가로지르는 봉합 바늘. (C) 6-0 나일론 봉합사를 사용하여 총비골 신경과 비골 신경을 함께 결찰했습니다. (D) 수술 후 14일째에 원위 신경 그루터기와 남아 신경 그루터기 사이의 재연결이 관찰되지 않았습니다. 1 : 좌골 신경; 2 : 총비골 신경 3 : 경골 신경; 4 : 귀 신경; 5 : 비복근; 6 : 결찰. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
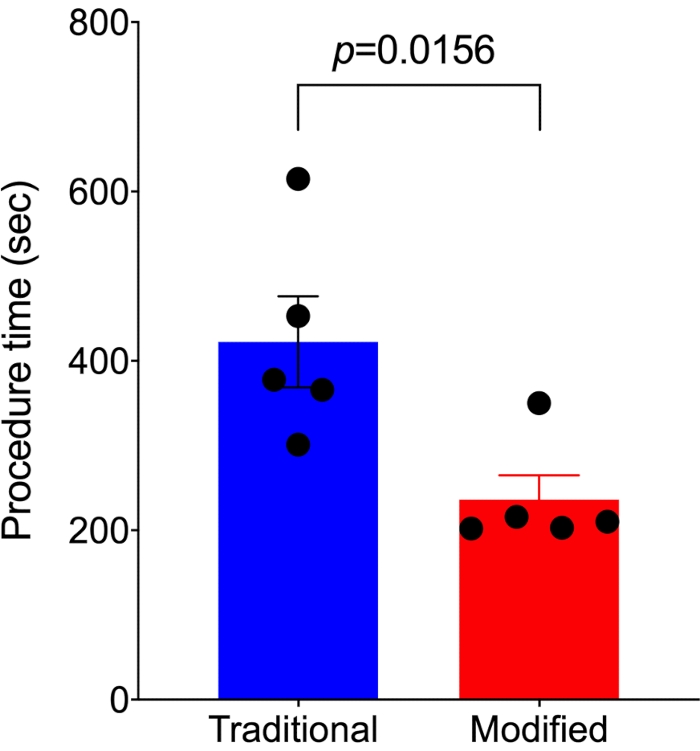
그림 4. 수정된 방법은 기존 SNI 방법보다 더 빠르게 수행할 수 있습니다. 기존 SNI 방법(n=5)과 비교하여 수정된 방법(n=5)은 수행하는 데 훨씬 적은 절차 시간이 필요합니다. 분석은 쌍을 이루지 않은 t-검정을 사용하여 수행되었으며 데이터는 평균 ± SEM으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. von Frey의 기존 및 수정된 SNI 모델의 기계적 응답성 평가. (A) 수정된 SNI(n=9) 및 기존 SNI(n=14) 모델은 14일간의 추적 관찰에서 동측 측에서 유사한 기계적 과민증을 유발했습니다. (B) 수정된 SNI(n=5) 및 기존 SNI(n=5) 모델은 14일간의 추적 관찰에서 동측 측에서 유사한 퍼센트 반응을 얻었습니다. 분석은 Sidak의 다중 비교 테스트와 함께 양원 분산 분석을 사용하여 수행되었습니다. 데이터는 SEM± 평균으로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
일반 비골 신경과 비골 신경을 별도로결찰하는 전통적인 마우스 SNIt 방법과 비교하여 6,7,8,9, 수정 된 SNIt 모델은 세 가지 장점이 있습니다 : (1) 좌골 신경 또는 경골 신경을 수축하거나 늘릴 위험이 적습니다. (2) 신경절단 후 원위신경 그루터기를 제거할 필요가 없는데, 이는 총비골신경과 초신경을 함께 결찰함으로써 원위신경 그루터기가 근위 그루터기와 해부학적으로 분리되기 때문입니다. 실제로, 해부학적 해부학은 수정된 SNIt 후 14일 동안 신경 재생이 관찰되지 않았음을 보여주었습니다. (3) 훨씬 짧은 시술 시간으로 시술을 훨씬 쉽게 할 수 있습니다.
수정된 마우스 SNIt를 수행할 때 피부 절개 부위를 엉덩이 근처의 허벅지 높이가 아닌 무릎 높이에서 낮게 만드는 것이 중요합니다. 이는 총비골 신경, 경골 신경, 경골 신경이 허벅지 높은 부위의 좌골 신경에서 분기되지 않았기 때문에 세 가지를 분리하기가 어렵기 때문입니다. 이와는 대조적으로, 무릎 부위 근처의 비복근의 상부 가장자리에서는 좌골 신경의 세 가지가 개별적으로 가로지르며, 비복근 아래를 지나는 경골 신경, 비복근 위를 달리는 뇌 쪽의 일반 비골 신경과 꼬리 쪽의 비골 신경으로 쉽게 시각화되고 식별된다11. 흥미롭게도, 총비골 신경은 허벅지 부위의 경골 신경의 내측에 있지만, 일반적으로 경골 신경을 교차하여 무릎 굴곡으로 측면 위치에서 무릎 부위의 비복근의 상부 가장자리에 있는 경골 신경에 더 가까워지기 때문에 일반 비골 신경과 경골 신경을 함께 결찰하는 것이 더 쉽습니다. 중요한 것은 경골 신경이 비복근 위에 결찰되어 있을 때 경골 신경이 접촉하거나 늘어나지 않고 그대로 유지된다는 것입니다. 또한, BFM을 절개하여 신경 아래를 노출시킬 때, 비복근 위에 위치한 혈관(외측 근위 원위동맥, 오금동맥, 원위 꼬리 대퇴 동맥 등)의 손상을 피하는 것이 중요하다16.
이 수정된 SNIt 모델이 신경병증성 통증을 성공적으로 발생시키지만, 몇 가지 제한 사항을 인정해야 합니다. 총비골 신경의 손상으로 인해, 이는 뒷다리가 현저하게 확장된 운동 기능 장애를 일으킬 수 있다17. 또 다른 예로, 기계적 과민성 부위는 손상된 신경이 아닌 온전한 신경에 의해 신경이 분포되어 있지만, 신경병증성 통증은 임상적 통증관리에서 말초신경계 또는 중추신경계의 병변 또는 질환에 의해 발생하는 경우가 많다18. 따라서 신경병증성 통증 모델의 개발에 대한 추가 연구가 필요합니다.
요약하면, 이 수정된 마우스 SNIt 방법은 신경 그루터기를 제거하지 않고 한 번의 신경 결찰과 한 번의 신경 절단만으로 간단한 SNI 절차입니다. 좌골 신경 또는 경골 신경 손상의 위험을 줄이면서 신경 손상으로 인한 기계적 과민증을 생성하는 것이 훨씬 쉽습니다.
공개
저자는 상충되는 이해관계가 없음을 선언합니다.
감사의 말
Z.G.는 NINDS R01NS100801에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| 6-0 suture | Henry Schein | 9007482 | Nerve ligation and close the muscular layer |
| Iris Scissors | Integra Miltex | 12460598 | Cut muscle and fascia |
| Mayo dissecting scissors | Fisherbrand | 895120 | Cut skin incision |
| Micro forcep | Fisherbrand | 16100110 | Blunt dissection biceps femoris muscle |
| Micro Scissors | Excelta | 17467496 | Cut nerve |
| Microdissection Forceps | Fisherbrand | 16100123 | Separate the common peroneal and the sural nerves from the neighboring tissues |
| Needle Holder | Fisherbrand | 8966 | Hold 6-0 needle |
| Prism software | Graph Pad | version 8.0 | Statistical analysis software |
| Wound clips | Roboz Surgical | NC1878744 | Close skin incision |
참고문헌
- Chung, J. M., Kim, H. K., Chung, K. Segmental spinal nerve ligation model of neuropathic pain. Methods in Molecular Medicine. 99, 35-45 (2004).
- Vissers, K., Adriaensen, H., De Coster, R., De Deyne, C., Meert, T. F. A chronic-constriction injury of the sciatic nerve reduces bilaterally the responsiveness to formalin in rats: a behavioral and hormonal evaluation. Anesthesia and Analgesia. 97 (2), 520-525 (2003).
- Malmberg, A. B., Basbaum, A. I. Partial sciatic nerve injury in the mouse as a model of neuropathic pain: behavioral and neuroanatomical correlates. Pain. 76 (1-2), 215-222 (1998).
- Moore, K. A., et al. Partial peripheral nerve injury promotes a selective loss of GABAergic inhibition in the superficial dorsal horn of the spinal cord. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 22 (15), 6724-6731 (2002).
- Decosterd, I., Woolf, C. J. Spared nerve injury: an animal model of persistent peripheral neuropathic pain. Pain. 87 (2), 149-158 (2000).
- Cichon, J., Sun, L., Yang, G. Spared Nerve Injury Model of Neuropathic Pain in Mice. Bio-Protocol. 8 (6), 2777 (2018).
- Shields, S. D., Eckert, W. A., Basbaum, A. I. Spared nerve injury model of neuropathic pain in the mouse: a behavioral and anatomic analysis. The Journal of Pain. 4 (8), 465-470 (2003).
- Guan, Z., et al. Injured sensory neuron-derived CSF1 induces microglial proliferation and DAP12-dependent pain. Nature Neuroscience. 19 (1), 94-101 (2016).
- Richner, M., Bjerrum, O. J., Nykjaer, A., Vaegter, C. B. The spared nerve injury (SNI) model of induced mechanical allodynia in mice. Journal of Visualized Experiments: JoVE. (54), e3092 (2011).
- Challa, S. R. Surgical animal models of neuropathic pain: Pros and Cons. The International Journal of Neuroscience. 125 (3), 170-174 (2015).
- Kosaka, Y., et al. Development and persistence of neuropathic pain through microglial activation and KCC2 decreasing after mouse tibial nerve injury. Brain Research. 1733, 146718 (2020).
- Parisien, M., Lima, L. V., Dagostino, C., El-Hachem, N., Drury, G. L., Grant, A. V., Huising, J., Verma, V., Meloto, C. B., Silva, J. R., Dutra, G. C. S., Markova, T., Dang, H., Tessier, P. A., Slade, G. D., Nackley, A. G., Ghasemlou, N., Mogil, J. S., Allegri, M., Diatchenko, L. Acute inflammatory response via neutrophil activation protects against the development of chronic pain. Sci Transl Med. 14 (644), eabj9954 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Bourquin, A. F., et al. Assessment and analysis of mechanical allodynia-like behavior induced by spared nerve injury (SNI) in the mouse. Pain. 122 (1-2), 1-14 (2006).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. The Ochsner Journal. 13 (1), 100-108 (2013).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 8 (12), 84047 (2013).
- Omori, Y., et al. A mouse model of sural nerve injury-induced neuropathy: gabapentin inhibits pain-related behaviors and the hyperactivity of wide-dynamic range neurons in the dorsal horn. Journal of Pharmacological Sciences. 109 (4), 532-539 (2009).
- Colloca, L., et al. Neuropathic pain. Nature Reviews. Disease Primers. 3, 17002 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유