Method Article
Modèle modifié de chirurgie de lésion nerveuse épargnée de douleur neuropathique chez la souris
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La chirurgie modifiée est une méthode simplifiée pour le modèle de lésion nerveuse épargnée par la souris ou le rat qui ne nécessite qu’une seule ligature et une incision pour blesser les nerfs péroniers et suraux communs.
Résumé
Les lésions nerveuses épargnées (SNI) sont un modèle animal qui imite les symptômes cardinaux des lésions nerveuses périphériques pour l’étude du mécanisme moléculaire et cellulaire de la douleur neuropathique chez les souris et les rats. À l’heure actuelle, il existe deux types de modèles SNI, l’un pour couper et ligaturer les nerfs péronier commun et tibial avec un nerf sural intact, qui est défini comme SNI dans cette étude, et l’autre pour couper et ligaturer les nerfs péroniers communs et les nerfs suraux avec un nerf tibial intact, qui est défini comme SNIt dans cette étude. Parce que le nerf sural est purement sensoriel alors que le nerf tibial contient à la fois des fibres motrices et sensorielles, le modèle SNIt a beaucoup moins de déficit moteur que le modèle SNI. Dans le modèle murin traditionnel SNIt, les nerfs péronier commun et sural sont coupés et ligaturés séparément. Ici, une méthode chirurgicale SNIt modifiée est décrite pour endommager les nerfs péroniers et suraux communs avec une seule ligature et une coupure avec une durée de procédure plus courte, ce qui est plus facile à réaliser et réduit le risque potentiel d’étirement des nerfs sciatique ou tibial, et produit une hypersensibilité mécanique similaire à celle du modèle SNIt traditionnel.
Introduction
La douleur neuropathique induite par une lésion nerveuse à la suite d’une intervention chirurgicale ou d’un traumatisme a un fardeau économique important qui nuit à la qualité de vie. Une foule de modèles de lésions nerveuses, y compris la ligature du nerf spinal (SNL)1, la lésion de constriction chronique (CCI)2 au nerf sciatique, la ligature partielle du nerf sciatique (pSNL)3, la transaction du nerf sciatique (SNT)4 et les lésions nerveuses épargnées (SNI)5,6,7,8, ont été développés avec succès pour imiter les symptômes cardinaux des lésions nerveuses périphériques chez les rats et les souris afin d’étudier le mécanisme moléculaire et cellulaire de la Douleur neuropathique 6,7,8,9,10. Cependant, chaque modèle chirurgical a ses avantages et ses limites, c’est pourquoi une attention particulière doit être accordée à l’exploration et au développement des modèles chirurgicaux10.
Le modèle SNI de rongeur produit une hypersensibilité à long terme à la stimulation mécanique. Cependant, c’est un peu déroutant car il existe deux modèles SNI différents. Le modèle initial de SNI a été développé dans le laboratoire de Woolf, dans lequel les nerfs péroniers communs et tibiaux ont été blessés, laissant le nerf sural intact 5,6. Le deuxième modèle SNI a été développé dans le laboratoire de Basbaum, dans lequel les nerfs péronier commun et sural ont été blessés, laissant le nerf tibial intact 7,8. Le modèle initial de Woolf est défini ici comme SNIs parce que le nerf sural est laissé intact, et le modèle de Basbaum est défini comme SNIt ici parce que le nerf tibial est laissé intact. Parce que le nerf sural est purement sensoriel alors que le nerf tibial contient à la fois des fibres motrices et sensorielles, le modèle SNIt a beaucoup moins de déficit moteur que le modèle SNI. Cependant, contrairement au modèle SNIs, les souris du modèle SNIt ne développent pas d’hypersensibilité thermique, mais une hypersensibilité mécanique se développe dans les deux modèles. Bien que le modèle SNIt soit une procédure relativement facile, il nécessite la ligature des nerfs sural et péronier commun séparément, avec le risque potentiel d’étirer les nerfs sciatiques ou tibiaux 6,7,8,9.
Les nerfs péroniers, tibiaux et suraux communs sont trois branches du nerf sciatique et peuvent être clairement identifiés sur le bord supérieur du muscle gastrocnémien (Figure 1) : le nerf tibial passe sous le muscle gastrocnémien, et le nerf péronier commun (côté céphalade) et le nerf sural (côté caudal) sont au-dessus du muscle gastrocnémien11. Sur la base de ses caractéristiques anatomiques, une procédure chirurgicale modifiée a été mise au point pour ligaturer les nerfs péroniers et suraux communs avec une seule ligature nerveuse et une seule incision nerveuse, ce qui raccourcit la durée de la procédure.
Protocole
Les expériences sur les animaux ont été approuvées par le comité institutionnel de l’UCSF sur le soin et l’utilisation des animaux et ont été menées conformément au Guide des NIH pour le soin et l’utilisation des animaux de laboratoire. Des souris C57BL/6 adultes pesant de 20 à 30 g ont été utilisées dans cette étude. L’évaluation von Frey a été réalisée entre 13h00 et 15h00.
1. Anesthésie et préparation de la souris
- Placez une souris dans une chambre en plastique remplie de 2 % d’isoflurane dans O2 à un débit de 1,0 L/min jusqu’à ce qu’elle soit complètement anesthésiée.
- Couvrez les yeux avec une pommade ophtalmique à l’aide d’un applicateur en coton.
- Placez le museau de la souris dans un cône nasal flexible avec un flux d’isoflurane de 2 % tout au long de l’intervention chirurgicale.
- Placez la souris dans une position latérale droite. Gardez la jambe gauche vers le haut avec la flexion du genou et fixez-la avec du ruban adhésif.
- Enlevez les poils autour de la cuisse et du genou avec un rasoir électrique et une crème dépilatoire. Désinfectez la peau avec 2% de chlorhexidine et 70% d’alcool.
- Assurez-vous que la profondeur de l’anesthésie est suffisante avant la chirurgie en testant l’absence de réponse au stimulus de pincement sur le membre postérieur ou la queue à l’aide d’une pince à épiler. Fournir un support thermique à la souris.
REMARQUE : Aucun anesthésique local ou AINS n’a été utilisé avant et après la réalisation du modèle SNIt, car l’anesthésique local et les AINS réduisent considérablement le comportement de douleur neuropathique après SNIt12.
2. Chirurgie SNIt modifiée
- Découpez une incision de 1 cm en commençant par le premier 1/3 de la ligne horizontale traversant le genou avec un angle d’environ 30° par rapport à la ligne verticale à l’aide d’un scalpel (Figure 2A).
- Deux lignes blanches peuvent être visualisées sous le muscle biceps fémoral (BFM) après séparation de l’incision cutanée, avec la ligne épaisse médiale (céphalade) comme le fémur et la ligne mince latérale (caudale) comme le nerf sciatique (Figure 2B).
- Dissèquez BFM le long de la ligne blanche caudale à l’aide de micro-pinces incurvées et de micro-ciseaux pour exposer le nerf sciatique. Évitez d’endommager les vaisseaux sanguins lors de la dissection contondante. En cas de lésions vasculaires accidentelles, utilisez des cotons-tiges stériles pour absorber le sang et appliquez une pression appropriée pour arrêter le saignement.
- Différenciez les trois branches du nerf sciatique sur le bord supérieur du muscle gastrocnémien. Le nerf tibial est celui dont le diamètre est le plus grand passant sous le muscle gastrocnémien, tandis que les nerfs suraux (latéraux, le plus petit diamètre) et le nerf péronier commun (médial) passent au-dessus du muscle gastrocnémien (Figure 2C et Figure 3A).
- Selon la façon dont la BFM est disséquée et ouverte, visualisez le nerf péronier commun comme latéral (Figure 2C) ou médial (Figure 3A) au nerf tibial.
- Séparez les nerfs péronier commun et sural des tissus voisins à l’aide d’une micro-pince courbe.
- Lister les nerfs péroniers et suraux communs avec une suture 6-0, car les deux nerfs passent au-dessus du muscle gastrocnémien, mais le nerf tibial passe sous le muscle gastrocnémien (Figure 2D et Figure 3B, C). Observez la contraction du membre après la ligature serrée. Pour la méthode traditionnelle, ligaturez séparément les nerfs péronier et sural communs.
- Coupez le nerf à une partie distale à moins de 2-4 mm de la ligature avec une paire de micro-ciseaux. Assurez-vous que le nerf tibial reste intact pendant toute la procédure. Pour la méthode traditionnelle, coupez les nerfs péroniers et suraux communs au niveau de la partie distale dans un rayon de 2 à 4 mm de la ligature et retirez une section de 2 mm, séparément.
- Fermez la couche musculaire avec une suture en soie 6-0 et l’incision cutanée avec des pinces à plaie.
- Après la chirurgie, retournez les souris dans la salle des animaux jusqu’à ce qu’elles se remettent complètement de l’anesthésie. Vérifiez quotidiennement s’il y a des incisions intactes, un apport alimentaire normal, une consommation d’eau, un état corporel général, des mouvements réguliers et un toilettage. Retirez les clips de la plaie 7 à 14 jours après l’opération.
3. Évaluation de von Frey pour le seuil mécanique
- Acclimatez les souris pendant 6 jours à l’environnement de la salle d’essai et au matériel d’essai pour effectuer l’évaluation von-Frey. Placez les souris dans des cylindres en plastique transparent sur une grille en treillis métallique surélevée pour 1 h d’habituation. Placez des papiers blancs entre chaque cylindre pour éviter tout repère visuel de chaque animal d’essai.
- Pendant cette période, effectuez une habituation tous les 2 jours et mesurez la base des monofilaments de von Frey sous le milieu plantaire de la patte arrière après la dernière habituation.
- Effectuez l’évaluation de von Frey à l’aide d’un testeur à l’aveugle. Stimulez le milieu plantaire de la patte arrière avec des filaments de von Frey en utilisant le paradigme haut-bas13. Appliquez le filament von Frey sur la surface plantaire perpendiculairement avec la force appliquée pour provoquer une légère courbure.
- Vérifiez les réponses positives telles que le retrait soudain de la patte, le tressaillement soudain ou le léchage soudain de la patte. Exercez le stimulus suivant à un intervalle de 5 s pour éviter l’influence du stimulus précédent.
- Confirmer le seuil mécanique par patte en prenant en moyenne 3 séances.
- Sur la base du seuil de retrait de 50 % de la patte arrière décidé par la méthode haut-bas, utilisez la méthode de réponse en pourcentage avec un filament de 0,16 g pour évaluer davantage la différence.
- Noter le pourcentage de réponses positives après 10 stimuli de filament de 0,16 g appliqués sur le milieu plantaire de la patte arrière, quelles que soient les réponses.
- Effectuez les évaluations von Frey le jour 1 avant l’opération et les jours 1, 3, 5, 7 et 14 après l’opération.
4. Analyse statistique
- Rapportez les données continues normalement distribuées sous forme de moyenne ±'erreur type de la moyenne (SEM). Analysez les données continues à l’aide d’un test t bilatéral ou d’une ANOVA à mesures répétées à deux voies. Traiter toutes les données à l’aide d’un logiciel d’analyse statistique, avec une signification statistique au niveau de p < 0,05.
Résultats
La comparaison du temps de procédure entre les méthodes modifiées et traditionnelles.
Le temps de procédure entre le début de la coupe de la peau et la fin de la fermeture de la peau a été enregistré chez 5 souris avec l’approche modifiée et 5 souris avec l’approche traditionnelle, respectivement. Un nombre minimal d’animaux a été utilisé pour obtenir des résultats statistiquement significatifs. Par rapport au contrôle de l’approche traditionnelle 7,14 pour effectuer SNIt, l’approche modifiée a pris près de la moitié du temps de procédure (236,2 ± 28,6 s contre 422,6 ± 53,8 s, p = 0,0156 ; Figure 4).
La comparaison de l’hypersensibilité mécanique entre les deux méthodes.
Aucune différence dans l’évaluation de von Frey ( manuelle ) n’a été observée dans les deux groupes au départ (1,05 ± 0,10 g vs 0,96 ± 0,13 g, p = 0,9405). Par rapport à la méthode traditionnelle (n = 9), la méthode modifiée (n = 14) a induit une hypersensibilité mécanique similaire du côté ipsilatéral du jour 1 postopératoire au jour 14 postopératoire (0,33 ± 0,09 g vs 0,32 ± 0,05 g, p>0,9999, au jour 1 postopératoire ; 0,19 ± 0,02 g vs 0,27 ± 0,06 g, p = 0,9485 , au 3e jour postopératoire ; 0,20 ± 0,06 g vs 0,15 ± 0,05 g, p = 0,9979, au jour 5 postopératoire ; 0,13 ± 0,02 g vs 0,15 ± 0,03 g, p>0,9999, au 7e jour postopératoire ; et 0,14 ± 0,02 g contre 0,19 ± 0,03 g, p = 0,9937, au 14e jour postopératoire ; Figure 5A).
Par rapport au pourcentage de réponse entre la méthode traditionnelle (n = 5) et la méthode modifiée (n = 5), une hypersensibilité mécanique similaire a été observée du côté ipsilatéral du début de l’étude (4,00 % ± 2,45 % ± 2,45 %, p >0,9999) au jour 1 postopératoire (20,00 % ± 3,16 % ± 3,74 %, p = 0,8987), au jour 3 (30,00 % ± 5,48 % ± 4,90 %, p >0,9999), au jour 5 (36,00 % ± 9,27 % ± 5,48 %, p = 0,9730), le jour 7 (32,00 % ± 8,00 % contre 36,00 % ± 4,00 %, p = 0,9968) et le jour 14 (38,00 % ± 5,83 % contre 36,00 % ± 7,48 %, p >0,9999 ; Figure 5B).
Pas de reconnexion neurale entre le moignon distal et le moignon restant au 14e jour postopératoire.
Étant donné que la régénération axonale se déroule à un taux de 1 à 3 mm/j15, il faut tenir compte de la question de savoir s’il y a régénération nerveuse au 14e jour postopératoire. Le 14e jour postopératoire, les souris SNI modifiées ont été perfusées par voie intracardiale avec une solution saline tamponnée au phosphate de 0,1 mol/L, suivie d’un fixateur de formol à 10 % tamponné au phosphate, et le site de ligature nerveuse a été disséqué et exposé. Aucune reconnexion neurale n’a été observée entre les moignons distaux et les moignons restants (figure 3D).

Graphique 1. Illustration des 3 branches du nerf sciatique qui sont séparées au bord supérieur du muscle gastrocnémien (GM) autour de la région du genou. Le nerf tibial passe sous le muscle GM, et le nerf péronier commun et le nerf sural passent au-dessus du muscle GM. 1 : nerf sciatique ; 2 : nerf tibial ; 3 : nerf péronier commun ; 4 : Nerf sural. Abréviations : BFM = muscle biceps fémoral ; GM = muscle gastrocnémien. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 2. Illustration d’une intervention chirurgicale chez des souris SNI modifiées. (A) En position latérale, la jambe gauche est à l’envers avec flexion du genou. La ligne horizontale jaune (1) indique la ligne horizontale traversant le niveau du genou, et la flèche pointillée jaune (2) indique l’incision. (B) Suite à une incision cutanée, deux lignes blanches peuvent être visualisées sous le muscle biceps fémoral (BFM). Le fémur se trouve sous celui des céphales (3) et le nerf sciatique est sous celui de la caudale (4). (C) Après une dissection minutieuse de la BFM, le nerf sciatique (5) et ses trois branches peuvent être visualisés : le nerf tibial (6), le péronier commun (7) et le nerf sural (8). (D) Les nerfs péronier commun (7) et sural (8) ont été ligaturés ensemble. 1 : ligne horizontale traversant le genou ; 2 : incision coupée ; 3 : fémur sur le dessous ; 4 : nerf sciatique sur le dessous ; 5 : nerf sciatique ; 6 : nerf tibial ; 7 : nerf péronier commun ; 8 : nerf sural ; 9 : la ligne courbe blanche indique le genou. Veuillez cliquer ici pour voir une version agrandie de cette figure.
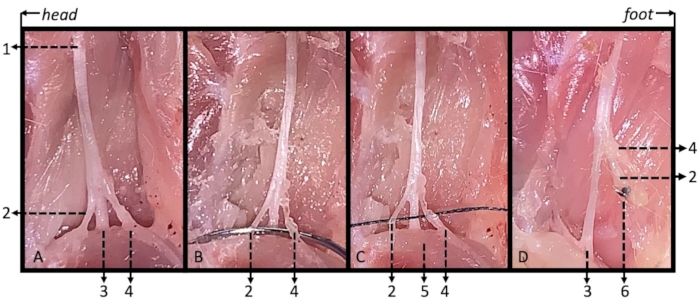
Graphique 3. Illustration des nerfs sciatique, tibial, sural et péronier commun avec la ligature de SNI modifiés chez des souris perfusées par voie intracardique. (A) Le nerf sciatique (1) et ses trois branches : le nerf tibial (2) passant sous le muscle gastrocnémien (5), et les nerfs péroniers communs (3) et suraux (4) passant au-dessus du muscle gastrocnémien. (B) Croisement de l’aiguille de suture sous les nerfs péronier et sural communs. (C) Une suture en nylon 6-0 a été utilisée pour la ligature des nerfs péronier et sural communs. (D) Aucune reconnexion entre le moignon nerveux distal et le moignon nerveux restant au 14e jour postopératoire n’a été observée. 1 : nerf sciatique ; 2 : nerf péronier commun 3 : nerf tibial ; 4 : nerf sural ; 5 : muscle gastrocnémien ; 6 : Ligature. Veuillez cliquer ici pour voir une version agrandie de cette figure.
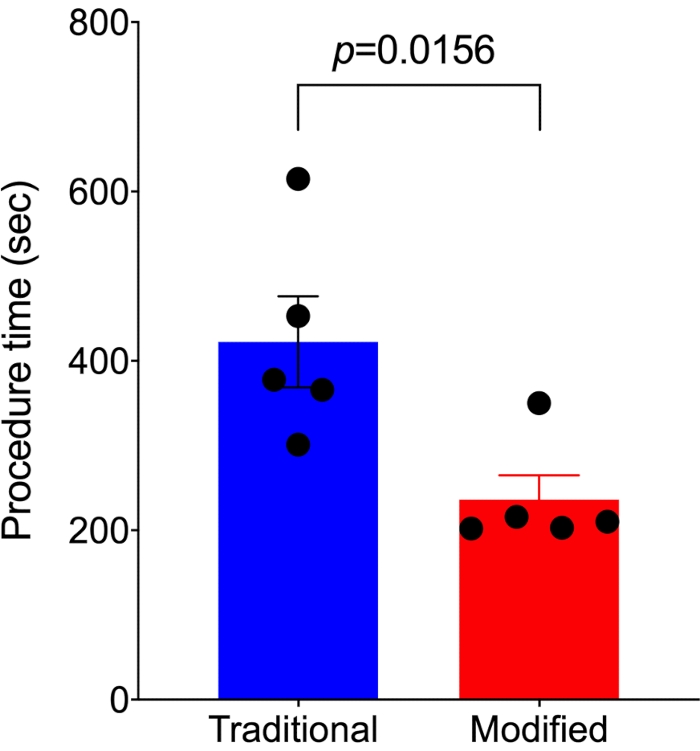
Graphique 4. La méthode modifiée est plus rapide que la méthode SNI traditionnelle. Par rapport à la méthode SNI traditionnelle (n=5), la méthode modifiée (n=5) nécessite beaucoup moins de temps de procédure. Les analyses ont été effectuées à l’aide d’un test t non apparié, et les données sont présentées sous forme de MEB ± moyenne. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Graphique 5. Évaluation von Frey de la réactivité mécanique dans les modèles SNI traditionnels et modifiés. (A) Les modèles SNI modifiés (n = 9) et SNI traditionnels (n = 14) ont induit une hypersensibilité mécanique similaire du côté ipsilatéral lors du suivi de 14 jours. (B) Les modèles SNI modifiés (n = 5) et SNI traditionnels (n = 5) ont obtenu des réponses en pourcentage similaires du côté ipsilatéral lors d’un suivi de 14 jours. Les analyses ont été effectuées à l’aide de l’ANOVA à deux facteurs avec le test de comparaisons multiples de Sidak. Les données sont présentées sous forme de ± moyenne SEM. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Par rapport à la méthode SNIt traditionnelle de souris qui ligature séparément le nerf péronier commun et le nerf sural 6,7,8,9, le modèle SNIt modifié présente trois avantages : (1) il présente moins de risque de contracter ou d’étirer les nerfs sciatiques ou tibiaux ; (2) Il n’est pas nécessaire d’enlever les moignons du nerf distal après une coupe nerveuse, car en ligaturant le nerf péronier commun et le nerf sural ensemble, les moignons du nerf distal sont anatomiquement séparés des moignons proximaux. En effet, la dissection anatomique a démontré qu’aucune régénération nerveuse n’a été observée 14 jours après une SNIt modifiée ; (3) La procédure est beaucoup plus facile à réaliser avec un temps de procédure beaucoup plus court.
Il est essentiel de faire des incisions cutanées basses autour du niveau du genou, plutôt qu’en haut de la cuisse près de la hanche, lors de l’exécution du SNIt modifié chez la souris. En effet, les nerfs péronier, tibial et sural communs ne se sont pas ramifiés à partir du nerf sciatique dans la région haute de la cuisse, ce qui rend difficile la séparation des trois branches. En revanche, sur le bord supérieur du muscle gastrocnémien près de la région du genou, les trois branches du nerf sciatique se déplacent séparément et sont facilement visualisées et identifiées, comme le nerf tibial passant sous le muscle gastrocnémien, et le nerf péronier commun du côté crânien et le nerf sural du côté caudal passant au-dessus du muscle gastrocnémien11. Fait intéressant, bien que le nerf péronier commun soit médial au nerf tibial au niveau de la cuisse, il traverse généralement le nerf tibial pour se rapprocher du nerf sural au bord supérieur du muscle gastrocnémien dans la région du genou en position latérale avec flexion du genou, ce qui facilite la ligature des nerfs péronier et sural communs. Il est important de noter que le nerf tibial reste intact sans contact ni étirement lorsque les nerfs péroniers et suraux communs sont ligaturés au-dessus du muscle gastrocnémien. De plus, lors de la dissection de la BFM pour exposer sous les nerfs, il est important d’éviter d’endommager les vaisseaux sanguins (artère géniculaire proximale latérale, artère poplitée, artère fémorale caudale distale, etc.) situés au-dessus du muscle gastrocnémien16.
Bien que ce modèle SNIt modifié développe avec succès une douleur neuropathique, certaines limites sont nécessaires pour être admises. En raison de lésions du nerf péronier commun, cela pourrait produire un dysfonctionnement moteur avec une patte arrière nettement allongée17. Une autre partie, la zone d’hypersensibilité mécanique, est innervée par un nerf intact plutôt que par un nerf blessé, mais la douleur neuropathique est souvent causée par une lésion ou une maladie du système nerveux périphérique ou central dans la gestion clinique de la douleur18. Par conséquent, d’autres études doivent être explorées dans le développement du modèle de douleur neuropathique.
En résumé, cette méthode SNIt modifiée chez la souris est une procédure SNI simplifiée avec une seule ligature nerveuse et une seule coupe nerveuse sans aucune ablation des moignons nerveux. Il est beaucoup plus facile de produire une hypersensibilité mécanique induite par une lésion nerveuse, avec un risque réduit de lésions des nerfs sciatiques ou tibiaux.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Z.G. est soutenu par NINDS R01NS100801.
matériels
| Name | Company | Catalog Number | Comments |
| 6-0 suture | Henry Schein | 9007482 | Nerve ligation and close the muscular layer |
| Iris Scissors | Integra Miltex | 12460598 | Cut muscle and fascia |
| Mayo dissecting scissors | Fisherbrand | 895120 | Cut skin incision |
| Micro forcep | Fisherbrand | 16100110 | Blunt dissection biceps femoris muscle |
| Micro Scissors | Excelta | 17467496 | Cut nerve |
| Microdissection Forceps | Fisherbrand | 16100123 | Separate the common peroneal and the sural nerves from the neighboring tissues |
| Needle Holder | Fisherbrand | 8966 | Hold 6-0 needle |
| Prism software | Graph Pad | version 8.0 | Statistical analysis software |
| Wound clips | Roboz Surgical | NC1878744 | Close skin incision |
Références
- Chung, J. M., Kim, H. K., Chung, K. Segmental spinal nerve ligation model of neuropathic pain. Methods in Molecular Medicine. 99, 35-45 (2004).
- Vissers, K., Adriaensen, H., De Coster, R., De Deyne, C., Meert, T. F. A chronic-constriction injury of the sciatic nerve reduces bilaterally the responsiveness to formalin in rats: a behavioral and hormonal evaluation. Anesthesia and Analgesia. 97 (2), 520-525 (2003).
- Malmberg, A. B., Basbaum, A. I. Partial sciatic nerve injury in the mouse as a model of neuropathic pain: behavioral and neuroanatomical correlates. Pain. 76 (1-2), 215-222 (1998).
- Moore, K. A., et al. Partial peripheral nerve injury promotes a selective loss of GABAergic inhibition in the superficial dorsal horn of the spinal cord. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 22 (15), 6724-6731 (2002).
- Decosterd, I., Woolf, C. J. Spared nerve injury: an animal model of persistent peripheral neuropathic pain. Pain. 87 (2), 149-158 (2000).
- Cichon, J., Sun, L., Yang, G. Spared Nerve Injury Model of Neuropathic Pain in Mice. Bio-Protocol. 8 (6), 2777 (2018).
- Shields, S. D., Eckert, W. A., Basbaum, A. I. Spared nerve injury model of neuropathic pain in the mouse: a behavioral and anatomic analysis. The Journal of Pain. 4 (8), 465-470 (2003).
- Guan, Z., et al. Injured sensory neuron-derived CSF1 induces microglial proliferation and DAP12-dependent pain. Nature Neuroscience. 19 (1), 94-101 (2016).
- Richner, M., Bjerrum, O. J., Nykjaer, A., Vaegter, C. B. The spared nerve injury (SNI) model of induced mechanical allodynia in mice. Journal of Visualized Experiments: JoVE. (54), e3092 (2011).
- Challa, S. R. Surgical animal models of neuropathic pain: Pros and Cons. The International Journal of Neuroscience. 125 (3), 170-174 (2015).
- Kosaka, Y., et al. Development and persistence of neuropathic pain through microglial activation and KCC2 decreasing after mouse tibial nerve injury. Brain Research. 1733, 146718 (2020).
- Parisien, M., Lima, L. V., Dagostino, C., El-Hachem, N., Drury, G. L., Grant, A. V., Huising, J., Verma, V., Meloto, C. B., Silva, J. R., Dutra, G. C. S., Markova, T., Dang, H., Tessier, P. A., Slade, G. D., Nackley, A. G., Ghasemlou, N., Mogil, J. S., Allegri, M., Diatchenko, L. Acute inflammatory response via neutrophil activation protects against the development of chronic pain. Sci Transl Med. 14 (644), eabj9954 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Bourquin, A. F., et al. Assessment and analysis of mechanical allodynia-like behavior induced by spared nerve injury (SNI) in the mouse. Pain. 122 (1-2), 1-14 (2006).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. The Ochsner Journal. 13 (1), 100-108 (2013).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 8 (12), 84047 (2013).
- Omori, Y., et al. A mouse model of sural nerve injury-induced neuropathy: gabapentin inhibits pain-related behaviors and the hyperactivity of wide-dynamic range neurons in the dorsal horn. Journal of Pharmacological Sciences. 109 (4), 532-539 (2009).
- Colloca, L., et al. Neuropathic pain. Nature Reviews. Disease Primers. 3, 17002 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon