Method Article
Modelo modificado de cirugía de lesión nerviosa preservada del dolor neuropático en ratones
* Estos autores han contribuido por igual
En este artículo
Resumen
La cirugía modificada es un método simplificado para el modelo de lesión nerviosa sin nervios en ratones o ratas que requiere solo una ligadura y un corte para lesionar los nervios peroneo y sural comunes.
Resumen
La lesión nerviosa salvada (SNI) es un modelo animal que imita los síntomas cardinales de la lesión nerviosa periférica para estudiar el mecanismo molecular y celular del dolor neuropático en ratones y ratas. Actualmente, existen dos tipos de modelo de SNI, uno para cortar y ligar el nervio peroneo común y los nervios tibiales con el nervio sural intacto, que se define como SNIs en este estudio, y otro para cortar y ligar el nervio peroneo común y el nervio sural con el nervio tibial intacto, que se define como SNIt en este estudio. Debido a que el nervio sural es puramente sensorial, mientras que el nervio tibial contiene fibras motoras y sensoriales, el modelo SNIt tiene un déficit motor mucho menor que el modelo SNI. En el modelo tradicional de ratón SNIt, los nervios peroneo común y sural se cortan y ligan por separado. Aquí se describe un método de cirugía SNIt modificado para dañar los nervios peroneo y sural comunes con una sola ligadura y un corte con un tiempo de procedimiento más corto, lo que es más fácil de realizar y reduce el riesgo potencial de estiramiento de los nervios ciático o tibial, y produce una hipersensibilidad mecánica similar al modelo SNIt tradicional.
Introducción
El dolor neuropático inducido por una lesión nerviosa después de una cirugía o un traumatismo tiene una carga económica significativa que afecta la calidad de vida. Se desarrollaron con éxito una gran cantidad de modelos de lesión nerviosa, incluyendo la ligadura del nervio espinal (SNL)1, la lesión crónica por constricción (ICC)2 del nervio ciático, la ligadura parcial del nervio ciático (pSNL)3, la transacción del nervio ciático (SNT)4 y la lesión del nervio preservado (SNI)5,6,7,8, para imitar los síntomas cardinales de la lesión de los nervios periféricos en ratas y ratones para estudiar el mecanismo molecular y celular de la lesión. Dolor neuropático 6,7,8,9,10. Sin embargo, cada modelo quirúrgico tiene sus beneficios y limitaciones, por lo que se debe prestar especial atención a la exploración y desarrollo de los modelos quirúrgicos10.
El modelo SNI en roedores produce hipersensibilidad a largo plazo a la estimulación mecánica. Sin embargo, es algo confuso porque hay dos modelos diferentes de SNI. El modelo inicial de SNI se desarrolló en el laboratorio de Woolf, en el que se lesionaron los nervios peroneo común y tibial, dejando intacto el nervio sural 5,6. El segundo modelo de SNI se desarrolló en el laboratorio de Basbaum, en el que se lesionaron los nervios peroneo común y sural, dejando intacto el nervio tibial 7,8. El modelo inicial de Woolf se define como SNIs aquí porque el nervio sural se deja intacto, y el modelo de Basbaum se define como SNIt aquí porque el nervio tibial se deja intacto. Debido a que el nervio sural es puramente sensorial, mientras que el nervio tibial contiene fibras motoras y sensoriales, el modelo SNIt tiene un déficit motor mucho menor que el modelo SNI. Sin embargo, a diferencia del modelo SNIs, los ratones en el modelo SNIt no desarrollan hipersensibilidad térmica, pero se desarrolla hipersensibilidad mecánica en ambos modelos. A pesar de que el modelo SNIt es un procedimiento relativamente fácil, requiere la ligadura de los nervios sural y peroneo común por separado, con el riesgo potencial de estiramiento de los nervios ciático o tibial 6,7,8,9.
Los nervios peroneo, tibial y sural comunes son tres ramas del nervio ciático y se pueden identificar claramente en el borde superior del músculo gastrocnemio (Figura 1): el nervio tibial pasa por debajo del músculo gastrocnemio, y el nervio peroneo común (lado cefálico) y el nervio sural (lado caudal) están por encima del músculo gastrocnemio11. Sobre la base de sus características anatómicas, se desarrolló un procedimiento de cirugía SNIt modificado en ratones para ligar los nervios peroneo y sural comunes junto con una sola ligadura de nervios y una corte de nervio, lo que resulta en un tiempo de procedimiento más corto.
Protocolo
Los experimentos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la UCSF y se llevaron a cabo de acuerdo con la Guía de los NIH para el Cuidado y Uso de Animales de Laboratorio. En este estudio se utilizaron ratones adultos C57BL/6 con un peso de 20-30 g. La evaluación de von Frey se realizó entre las 13:00 y las 15:00 horas.
1. Anestesia y preparación con ratones
- Coloque un ratón en una cámara de plástico llena de isoflurano al 2% enO2 a un caudal de 1,0 L/min hasta que esté completamente anestesiado.
- Cubra los ojos con ungüento oftálmico con un aplicador de algodón.
- Coloque el hocico del ratón en un cono nasal flexible con un flujo de isoflurano al 2% durante todo el procedimiento quirúrgico.
- Coloque el ratón en una posición lateral derecha. Mantén la pierna izquierda levantada con flexión de rodilla y asegúrala con cinta adhesiva.
- Elimine el vello alrededor del área del muslo y la rodilla con una afeitadora eléctrica y crema depilatoria. Desinfectar la piel con clorhexidina al 2% y alcohol al 70%.
- Asegúrese de que la anestesia tenga suficiente profundidad antes de la cirugía probando la ausencia de respuesta al estímulo de pellizco en la extremidad posterior o la cola con pinzas como estándar. Proporcionar soporte térmico al ratón.
NOTA: No se utilizó anestésico local ni AINE antes y después de realizar el modelo SNIt porque el anestésico local y el AINE reducen significativamente el comportamiento de dolor neuropático después del SNIt12.
2. Cirugía SNIt modificada
- Realice una incisión de 1 cm comenzando en el primer 1/3 de la línea horizontal que cruza la rodilla con un ángulo de aproximadamente 30° con respecto a la línea vertical con un bisturí (Figura 2A).
- Se pueden visualizar dos líneas blancas debajo del músculo bíceps femoral (BFM) después de separar la incisión en la piel, con la línea gruesa medial (cefálica) como fémur y la línea delgada lateral (caudal) como nervio ciático (Figura 2B).
- Diseccione BFM sin roto a lo largo de la línea blanca caudal con micropinzas curvas y micro tijeras para exponer el nervio ciático. Evite dañar los vasos sanguíneos durante la disección contundente. Si se produce un daño accidental en los vasos, use hisopos estériles de algodón para absorber la sangre y aplique la presión adecuada para detener el sangrado.
- Diferencia las tres ramas del nervio ciático en el borde superior del músculo gastrocnemio. El nervio tibial es el de mayor diámetro que pasa por debajo del músculo gastrocnemio, mientras que los nervios surales (lateral, el de menor diámetro) y el nervio peroneo común (medial) discurren por encima del músculo gastrocnemio (Figura 2C y Figura 3A).
- Dependiendo de cómo se diseccione y abra el BFM, visualice el nervio peroneo común como lateral (Figura 2C) o medial (Figura 3A) al nervio tibial.
- Separe los nervios peroneo común y sural de los tejidos vecinos utilizando micropinzas curvas.
- Ligue los nervios peroneo y sural comunes junto con una sutura 6-0, ya que ambos nervios corren por encima del músculo gastrocnemio, pero el nervio tibial pasa por debajo del músculo gastrocnemio (Figura 2D y Figura 3B,C). Observe la contracción de la extremidad después de la ligadura apretada. Para el método tradicional, ligar los nervios peroneo y sural comunes por separado.
- Cortar el nervio en una parte distal dentro de los 2-4 mm de la ligadura con un par de microtijeras. Asegúrese de que el nervio tibial permanezca intacto durante todo el procedimiento. Para el método tradicional, corte los nervios peroneo y sural comunes en la parte distal dentro de los 2-4 mm de la ligadura y retire una sección de 2 mm, por separado.
- Cierre la capa muscular con una sutura de seda 6-0 y la incisión cutánea con clips para heridas.
- Después de la cirugía, regrese los ratones a la sala de animales hasta que se recuperen por completo de la anestesia. Revise diariamente las incisiones intactas, la ingesta normal de alimentos, el consumo de agua, la condición corporal general, los movimientos regulares y el aseo. Retire los clips de la herida de 7 a 14 días después de la cirugía.
3. Evaluación de von Frey para el umbral mecánico
- Aclimatar a los ratones durante 6 días al entorno de la sala de pruebas y a los materiales de prueba para realizar la evaluación von-Frey. Coloque los ratones en cilindros de plástico transparente sobre una rejilla de malla de alambre elevada durante 1 h de habituación. Coloque papel blanco entre cada cilindro para evitar cualquier señal visual de cada animal de prueba.
- Durante este período, realice la habituación cada 2 días y mida la línea de base de los monofilamentos de von Frey debajo de la planta media de la pata trasera después de la última habituación.
- Realice la evaluación de von Frey con un probador ciego. Estimular la planta media de la pata trasera con filamentos de von Frey utilizando el paradigma arriba-abajo13. Aplique el filamento von Frey a la superficie plantar perpendicularmente con la fuerza aplicada para causar un ligero enroscamiento.
- Verifique las respuestas positivas como la retirada repentina de la pata, el estremecimiento repentino o el lamido repentino de la pata. Ejerza el siguiente estímulo en un intervalo de 5 s para evitar la influencia del estímulo anterior.
- Confirme el umbral mecánico por pata tomando un promedio de 3 sesiones.
- Sobre la base del umbral de retirada del 50% de las patas traseras decidido por el método de arriba hacia abajo, utilice el método de porcentaje de respuesta con filamento de 0,16 g para evaluar más a fondo la diferencia.
- Registre el porcentaje de las respuestas positivas después de 10 estímulos de filamento de 0,16 g aplicados a la planta media de la pata trasera, independientemente de las respuestas.
- Realice las evaluaciones de von Frey el día 1 antes de la cirugía y después de la cirugía los días 1, 3, 5, 7 y 14.
4. Análisis estadístico
- Reporte datos continuos normalmente distribuidos como media ± error estándar de la media (SEM). Analice los datos continuos con la prueba t de 2 colas o el ANOVA de medidas repetidas de dos vías. Procesar todos los datos utilizando software de análisis estadístico, con significación estadística a nivel de p < 0,05.
Resultados
La comparación del tiempo de procedimiento entre los métodos modificados y los tradicionales.
El tiempo del procedimiento desde el inicio del corte de la piel hasta el final del cierre de la piel se registró en 5 ratones con el abordaje modificado y 5 ratones con el abordaje tradicional, respectivamente. Se utilizó un número mínimo de animales para obtener resultados con significación estadística. En comparación con el control del abordaje tradicional 7,14 para realizar SNIt, el abordaje modificado requirió casi la mitad del tiempo del procedimiento (236,2 ± 28,6 s vs. 422,6 ± 53,8 s, p=0,0156; Figura 4).
La comparación de la hipersensibilidad mecánica entre los dos métodos.
No se observaron diferencias en la evaluación de von Frey (manual) en los dos grupos al inicio del estudio (1,05 ± 0,10 g vs. 0,96 ± 0,13 g, p=0,9405). En comparación con el método tradicional (n=9), el método modificado (n=14) indujo una hipersensibilidad mecánica similar en el lado ipsilateral desde el día postoperatorio 1 hasta el día postoperatorio 14 (0,33 ± 0,09 g vs. 0,32 ± 0,05 g, p>0,9999, en el día postoperatorio 1; 0,19 ± 0,02 g vs. 0,27 ± 0,06 g, p=0,9485 , en el día postoperatorio 3; 0,20 ± 0,06 g vs. 0,15 ± 0,05 g, p=0,9979, al 5º día postoperatorio; 0,13 ± 0,02 g vs. 0,15 ± 0,03 g, p>0,9999, en el día 7 postoperatorio; y 0,14 ± 0,02 g vs. 0,19 ± 0,03 g, p=0,9937, al día postoperatorio 14; Figura 5A).
En comparación con el porcentaje de respuesta entre el método tradicional (n=5) y el modificado (n=5), se observó una hipersensibilidad mecánica similar en el lado ipsilateral desde el inicio (4,00% ± 2,45% vs. 6,00% ± 2,45%, p>0,9999) hasta el día postoperatorio 1 (20,00% ± 3,16% vs. 12,00% ± 3,74%, p=0,8987), día 3 (30,00% ± 5,48% vs. 32,00% ± 4,90%, p>0,9999), día 5 (36,00% ± 9,27% vs. 30,00% ± 5,48%, p=0,9730), día 7 (32,00% ± 8,00% vs. 36,00% ± 4,00%, p=0,9968), y día 14 (38,00% ± 5,83% vs. 36,00% ± 7,48%, p>0,9999; Figura 5B).
No hay reconexión neural entre el muñón distal y el remanente en el día postoperatorio 14.
Debido a que la regeneración axonal se produce a una velocidad de 1-3 mm/d15, se debe tener en cuenta si hay regeneración nerviosa en el día postoperatorio 14. En el día postoperatorio 14, los ratones SNI modificados se perfundieron intracardíacamente con solución salina tamponada con fosfato 0,1 mol/L seguida de un fijador de formalina al 10% tamponado con fosfato, y el sitio de ligadura del nervio fue diseccionado y expuesto. No se observó ninguna reconexión neuronal entre los muñones distales y los restantes (Figura 3D).

Figura 1. Ilustración de las 3 ramas del nervio ciático que están separadas en el borde superior del músculo gastrocnemio (GM) alrededor de la zona de la rodilla. El nervio tibial corre por debajo del músculo transgénico, y el nervio peroneo común y el nervio sural corren por encima del músculo transgénico. 1: nervio ciático; 2: nervio tibial; 3: nervio peroneo común; 4: nervio sural. Abreviaturas: BFM = músculo bíceps femoral; GM = músculo gastrocnemio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Ilustración de un procedimiento quirúrgico en ratones SNI modificados. (A) En posición lateral, la pierna izquierda está boca arriba con flexión de rodilla. La línea horizontal amarilla (1) indica la línea horizontal que cruza el nivel de la rodilla, y la flecha discontinua amarilla (2) indica la incisión. (B) Después de una incisión en la piel, se pueden visualizar dos líneas blancas debajo del músculo bíceps femoral (BFM). El fémur está debajo del fémur cefálico (3), y el nervio ciático está debajo del caudal (4). (C) Después de una disección cuidadosa de BFM, se puede visualizar el nervio ciático (5) y sus tres ramas: los nervios tibial (6), peroneo común (7) y sural (8). (D) Los nervios peroneo común (7) y sural (8) estaban ligados entre sí. 1: línea horizontal que cruza la rodilla; 2: incisión de corte; 3: fémur en la parte inferior; 4: nervio ciático en la parte inferior; 5: nervio ciático; 6: nervio tibial; 7: nervio peroneo común; 8: nervio sural; 9: La línea curva blanca indica la rodilla. Haga clic aquí para ver una versión más grande de esta figura.
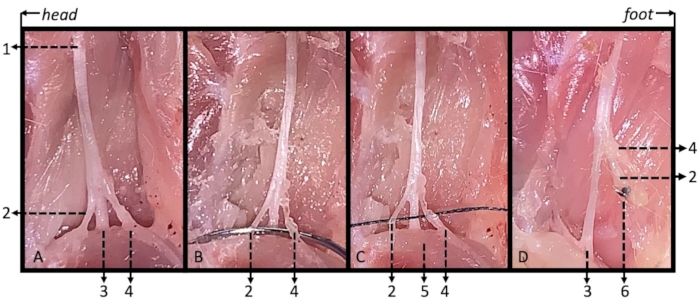
Figura 3. Ilustración de los nervios ciático, tibial, sural y peroneo común con la ligadura de SNI modificado en ratones perfundidos intracardíacamente. (A) El nervio ciático (1) y sus tres ramas: el nervio tibial (2) que pasa por debajo del músculo gastrocnemio (5), y los nervios peroneo común (3) y sural (4) que corren por encima del músculo gastrocnemio. (B) Cruce de la aguja de sutura debajo de los nervios peroneo y sural comunes juntos. (C) Se utilizó una sutura de nylon 6-0 para la ligadura de los nervios peroneo y sural comunes juntos. (D) No se observó reconexión entre el muñón nervioso distal y el remanente en el día postoperatorio 14. 1: nervio ciático; 2: nervio peroneo común 3: nervio tibial; 4: nervio sural; 5: músculo gastrocnemio; 6: Ligadura. Haga clic aquí para ver una versión más grande de esta figura.
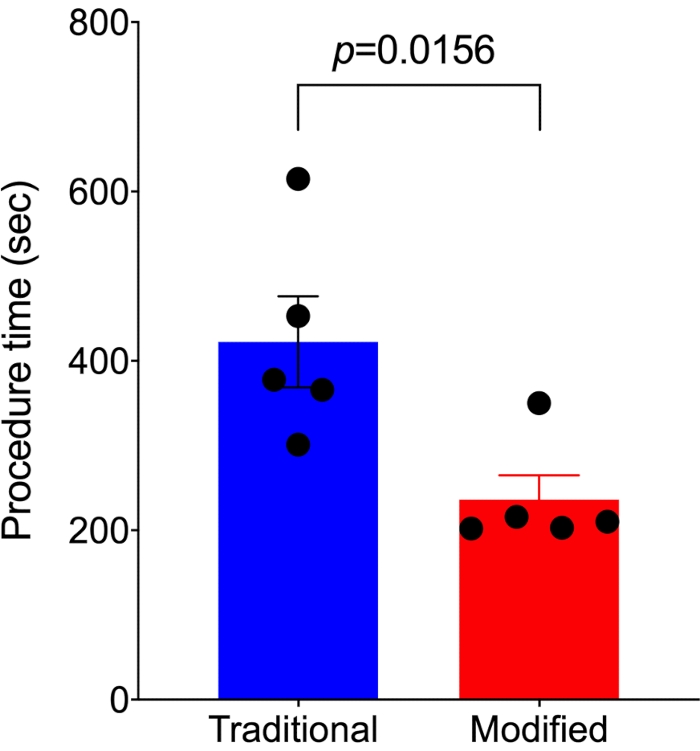
Figura 4. El método modificado es más rápido que el método SNI tradicional. En comparación con el método SNI tradicional (n = 5), el método modificado (n = 5) requiere mucho menos tiempo de procedimiento para realizarse. Los análisis se realizaron utilizando una prueba t no apareada, y los datos se presentan como media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. Evaluación de von Frey de la capacidad de respuesta mecánica en modelos SNI tradicionales y modificados. (A) Los modelos de SNI modificado (n = 9) y SNI tradicional (n = 14) indujeron una hipersensibilidad mecánica similar en el lado ipsilateral en el seguimiento de 14 días. (B) Los modelos de SNI modificado (n = 5) y SNI tradicional (n = 5) adquirieron respuestas porcentuales similares en el lado ipsilateral en un seguimiento de 14 días. Los análisis se realizaron utilizando ANOVA de dos vías con la prueba de comparaciones múltiples de Sidak. Los datos se presentan como media ± SEM. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En comparación con el método SNIt tradicional de ratón que liga el nervio peroneo común y el nervio sural por separado 6,7,8,9, el modelo SNIt modificado tiene tres ventajas: (1) tiene menos riesgo de contraer o estirar los nervios ciático o tibial; (2) No es necesario extirpar los muñones del nervio distal después del corte del nervio porque al ligar el nervio peroneo común y el nervio sural, los muñones del nervio distal se separan anatómicamente de los muñones proximales. De hecho, la disección de la anatomía demostró que no se observó regeneración nerviosa 14 días después de la SNIt modificada; (3) el procedimiento es mucho más fácil de realizar con un tiempo de procedimiento mucho más corto.
Es fundamental hacer incisiones en la piel a la altura de la rodilla, en lugar de en la parte alta del muslo, cerca de la cadera, cuando se realiza la SNIt modificada en ratón. Esto se debe a que los nervios peroneo, tibial y sural comunes no se han ramificado del nervio ciático en el área superior del muslo, lo que dificulta la separación de las tres ramas. Por el contrario, en el borde superior del músculo gastrocnemio, cerca del área de la rodilla, las tres ramas del nervio ciático atraviesan por separado y son fácilmente visualizables e identificables, como el nervio tibial que pasa por debajo del músculo gastrocnemio, y el nervio peroneo común en el lado craneal y el nervio sural en el lado caudal que corre por encima del músculo gastrocnemio11. Curiosamente, aunque el nervio peroneo común es medial al nervio tibial en el área del muslo, generalmente cruza el nervio tibial para acercarse al nervio sural en el borde superior del músculo gastrocnemio en el área de la rodilla en la posición lateral con flexión de la rodilla, lo que facilita la ligadura de los nervios peroneo y sural comunes. Es importante destacar que el nervio tibial permanece intacto sin entrar en contacto ni estirarse cuando los nervios peroneo y sural comunes se ligan por encima del músculo gastrocnemio. Además, al diseccionar BFM para exponer debajo de los nervios, es importante evitar dañar los vasos sanguíneos (arteria genicular proximal lateral, arteria poplítea, arteria femoral caudal distal, etc.) ubicados por encima del músculo gastrocnemio16.
A pesar de que este modelo SNIt modificado desarrolla con éxito el dolor neuropático, se necesitan algunas limitaciones para ser admitido. Debido al daño en el nervio peroneo común, esto podría producir disfunción motora con pata trasera marcadamente extendida17. Por otro lado, el área hipersensible mecánica está inervada por un nervio intacto en lugar de un nervio lesionado, pero el dolor neuropático suele ser causado por la lesión o enfermedad del sistema nervioso periférico o central en el manejo clínico del dolor18. Por lo tanto, es necesario explorar más estudios en el desarrollo del modelo de dolor neuropático.
En resumen, este método SNIt modificado en ratón es un procedimiento SNI simplificado con una sola ligadura de nervios y un corte de nervios sin ninguna extirpación de los muñones nerviosos. Es mucho más fácil de realizar en la producción de hipersensibilidad mecánica inducida por lesiones nerviosas, con un riesgo reducido de daño de los nervios ciático o tibial.
Divulgaciones
Los autores declaran no tener intereses contrapuestos.
Agradecimientos
Z.G. cuenta con el apoyo de NINDS R01NS100801.
Materiales
| Name | Company | Catalog Number | Comments |
| 6-0 suture | Henry Schein | 9007482 | Nerve ligation and close the muscular layer |
| Iris Scissors | Integra Miltex | 12460598 | Cut muscle and fascia |
| Mayo dissecting scissors | Fisherbrand | 895120 | Cut skin incision |
| Micro forcep | Fisherbrand | 16100110 | Blunt dissection biceps femoris muscle |
| Micro Scissors | Excelta | 17467496 | Cut nerve |
| Microdissection Forceps | Fisherbrand | 16100123 | Separate the common peroneal and the sural nerves from the neighboring tissues |
| Needle Holder | Fisherbrand | 8966 | Hold 6-0 needle |
| Prism software | Graph Pad | version 8.0 | Statistical analysis software |
| Wound clips | Roboz Surgical | NC1878744 | Close skin incision |
Referencias
- Chung, J. M., Kim, H. K., Chung, K. Segmental spinal nerve ligation model of neuropathic pain. Methods in Molecular Medicine. 99, 35-45 (2004).
- Vissers, K., Adriaensen, H., De Coster, R., De Deyne, C., Meert, T. F. A chronic-constriction injury of the sciatic nerve reduces bilaterally the responsiveness to formalin in rats: a behavioral and hormonal evaluation. Anesthesia and Analgesia. 97 (2), 520-525 (2003).
- Malmberg, A. B., Basbaum, A. I. Partial sciatic nerve injury in the mouse as a model of neuropathic pain: behavioral and neuroanatomical correlates. Pain. 76 (1-2), 215-222 (1998).
- Moore, K. A., et al. Partial peripheral nerve injury promotes a selective loss of GABAergic inhibition in the superficial dorsal horn of the spinal cord. The Journal of Neuroscience: the official journal of the Society for Neuroscience. 22 (15), 6724-6731 (2002).
- Decosterd, I., Woolf, C. J. Spared nerve injury: an animal model of persistent peripheral neuropathic pain. Pain. 87 (2), 149-158 (2000).
- Cichon, J., Sun, L., Yang, G. Spared Nerve Injury Model of Neuropathic Pain in Mice. Bio-Protocol. 8 (6), 2777 (2018).
- Shields, S. D., Eckert, W. A., Basbaum, A. I. Spared nerve injury model of neuropathic pain in the mouse: a behavioral and anatomic analysis. The Journal of Pain. 4 (8), 465-470 (2003).
- Guan, Z., et al. Injured sensory neuron-derived CSF1 induces microglial proliferation and DAP12-dependent pain. Nature Neuroscience. 19 (1), 94-101 (2016).
- Richner, M., Bjerrum, O. J., Nykjaer, A., Vaegter, C. B. The spared nerve injury (SNI) model of induced mechanical allodynia in mice. Journal of Visualized Experiments: JoVE. (54), e3092 (2011).
- Challa, S. R. Surgical animal models of neuropathic pain: Pros and Cons. The International Journal of Neuroscience. 125 (3), 170-174 (2015).
- Kosaka, Y., et al. Development and persistence of neuropathic pain through microglial activation and KCC2 decreasing after mouse tibial nerve injury. Brain Research. 1733, 146718 (2020).
- Parisien, M., Lima, L. V., Dagostino, C., El-Hachem, N., Drury, G. L., Grant, A. V., Huising, J., Verma, V., Meloto, C. B., Silva, J. R., Dutra, G. C. S., Markova, T., Dang, H., Tessier, P. A., Slade, G. D., Nackley, A. G., Ghasemlou, N., Mogil, J. S., Allegri, M., Diatchenko, L. Acute inflammatory response via neutrophil activation protects against the development of chronic pain. Sci Transl Med. 14 (644), eabj9954 (2022).
- Chaplan, S. R., Bach, F. W., Pogrel, J. W., Chung, J. M., Yaksh, T. L. Quantitative assessment of tactile allodynia in the rat paw. Journal of Neuroscience Methods. 53 (1), 55-63 (1994).
- Bourquin, A. F., et al. Assessment and analysis of mechanical allodynia-like behavior induced by spared nerve injury (SNI) in the mouse. Pain. 122 (1-2), 1-14 (2006).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. The Ochsner Journal. 13 (1), 100-108 (2013).
- Kochi, T., et al. Characterization of the arterial anatomy of the murine hindlimb: functional role in the design and understanding of ischemia models. PLoS One. 8 (12), 84047 (2013).
- Omori, Y., et al. A mouse model of sural nerve injury-induced neuropathy: gabapentin inhibits pain-related behaviors and the hyperactivity of wide-dynamic range neurons in the dorsal horn. Journal of Pharmacological Sciences. 109 (4), 532-539 (2009).
- Colloca, L., et al. Neuropathic pain. Nature Reviews. Disease Primers. 3, 17002 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados