Method Article
Визуализация воспалительных каспаз, индуцированных близостью в макрофагах, полученных из моноцитов человека
В этой статье
Резюме
Этот протокол описывает рабочий процесс получения макрофагов, полученных из моноцитов (MDM) из образцов крови человека, простой метод эффективного введения воспалительной каспазы бимолекулярной флуоресцентной комплементации (BiFC) в MDM человека без ущерба для жизнеспособности и поведения клеток, а также основанный на визуализации подход к измерению активации воспалительной каспазы в живых клетках.
Аннотация
Воспалительные каспазы включают каспазу-1, -4, -5, -11 и -12 и относятся к подгруппе инициаторных каспаз. Каспаза-1 необходима для обеспечения правильной регуляции воспалительной сигнализации и активируется бесконтактно-индуцированной димеризацией после рекрутирования в воспаленные. Каспаза-1 в изобилии присутствует в моноцитарной клеточной линии и индуцирует созревание провоспалительных цитокинов интерлейкина (IL)-1β и IL-18 до активных секретируемых молекул. Другие воспалительные каспазы, каспаза-4 и -5 (и их мышиный гомолог каспаза-11) способствуют высвобождению IL-1β, индуцируя пироптоз. Caspase Bimolecular Fluorescence Complementation (BiFC) - это инструмент, используемый для измерения воспалительной близости, вызванной каспазой, в качестве показания активации каспазы. Продомен каспазы-1, -4 или -5, который содержит область, которая связывается с воспалением, сливается с нефлуоресцентными фрагментами желтого флуоресцентного белка Venus (Venus-N [VN] или Venus-C [VC]), которые связываются с реформой флуоресцентного комплекса Венеры, когда каспазы подвергаются индуцированной близости. Этот протокол описывает, как вводить эти репортеры в первичные человеческие моноцитарные макрофаги (MDM) с использованием нуклеофекции, обрабатывать клетки, чтобы индуцировать воспалительную активацию каспазы, и измерять активацию каспазы с помощью флуоресценции и конфокальной микроскопии. Преимущество такого подхода заключается в том, что его можно использовать для выявления компонентов, требований и локализации комплекса активации воспалительной каспазы в живых клетках. Тем не менее, необходимо учитывать тщательный контроль, чтобы избежать ущерба жизнеспособности и поведению клеток. Этот метод является мощным инструментом для анализа динамических взаимодействий каспазы на уровне воспалительных сигналов, а также для опроса воспалительных сигнальных каскадов в живых МДМ и моноцитах, полученных из образцов крови человека.
Введение
Каспазы представляют собой семейство цистеиновых аспартатных протеаз, которые могут быть сгруппированы в инициирующие каспазы и каспазы палача. Каспазы палача включают каспазу-3, -6 и -7. Они естественным образом обнаруживаются в клетках в виде димеров и расщепляются инициаторами каспаз для выполнения апоптоза1. К каспазам-инициаторам относятся человеческие каспазы-1, -2, -4, -5, -8, -9, -10 и -12. Они обнаруживаются в виде неактивных зимогенов (прокаспасов), которые активируются бесконтактно-индуцированной димеризацией и стабилизируются автопротеолитическим расщеплением 2,3. Воспалительные каспазы являются подмножеством инициирующих каспаз2 и охватывают каспазу-1, -4, -5 и -12 у людей и каспазу-1, -11 и -12 у мыши 4,5. Вместо апоптотической роли, они играют центральную роль в воспалении. Они опосредуют протеолитическую обработку и секрецию про-интерлейкина (IL)-1β и про-IL-18 6,7, которые являются первыми цитокинами, высвобождаемыми в ответ на патогенные захватчики 8,9. Caspase-1 активируется при наборе на его платформу активации; большой молекулярно-массовый белковый комплекс, называемый инфламмасомой (рисунок 1А)10. Димеризация каспазы-4, -5 и -11 происходит независимо от этих платформ через неканонический воспалительный путь11,12.
Канонические инфламмасомы представляют собой цитозольные многомерные белковые комплексы, которые состоят из белка датчика воспаления, адапторного белка ASC (апоптоз-ассоциированный спекоподобный белок, содержащий CARD) и эффекторного белка каспазы-110. Наиболее хорошо изученными каноническими инфламмасомами являются NOD-подобное семейство рецепторов, содержащее пириновый домен (NLRP), NLRP1 и NLRP3, семейство NLR, содержащее CARD (NLRC), NLRC4 и отсутствующее в меланоме 2 (AIM2). Каждый из них содержит пириновый домен, CARD или оба домена. Домен CARD опосредует взаимодействие между CARD-содержащими каспазами и их восходящими активаторами. Поэтому молекула каркаса ASC, которая состоит из N-концевого пиринового домена (PYD) и мотива C-концевой CARD 13,14, необходима для рекрутирования каспазы-1 в воспалительные модели NLRP110, NLRP315 и AIM216.
Каждая инфламмасома названа в честь своего уникального сенсорного белка, который распознает различные провоспалительные стимулы (рисунок 1B). Активаторы этого пути называются каноническими стимулами. Инфламмасомы служат датчиками микробных компонентов и тканевого стресса и собираются, чтобы вызвать сильную воспалительную реакцию путем активации воспалительных каспаз17. Сборка инфламмасом инициирует активацию каспазы-1 для опосредования созревания и секреции ее основных субстратов pro-IL-1β и pro-IL-18. Этот процесс происходит с помощью двухэтапного механизма. Во-первых, прайминговый стимул повышает экспрессию определенных белков инфламмасомы и про-IL-1β путем активации пути NF-κB. Во-вторых, внутриклеточный (канонический) стимул индуцирует сборку и набор прокаспазы-1 6,7.
Каспаза-4 и каспаза-5 являются человеческими ортологами мышиной каспазы-1111. Они активируются инфламмасомно-независимым образом внутриклеточным липополисахаридом (ЛПС), молекулой, обнаруженной во внешней мембране грамотрицательныхбактерий 18,19,20, и внеклеточным гемом, продуктом гемолиза эритроцитов21. Было высказано предположение, что ЛПС связывается непосредственно с мотивом CARD этих белков и индуцирует их олигомеризацию20. Активация каспазы-4 или каспазы-5 способствует высвобождению IL-1β путем индуцирования воспалительной формы гибели клеток, называемой пироптозом, путем расщепления порообразующего белка гасдермина D (GSDMD)18,19. Кроме того, отток ионов калия, образующийся в результате каспазы-4 и GSDMD-опосредованной пироптотической смерти, индуцирует активацию воспалительной системы NLRP3 и последующую активацию каспазы-122,23. Поэтому каспаза-4, -5 и -11 считаются внутриклеточными датчиками для ЛПС, которые способны индуцировать пироптоз и активацию каспазы-1 в ответ на специфические стимулы11,24.

Рисунок 1: Анализ воспалительных каспаз и каспазо-бимолекулярной флуоресцентной комплементации (BiFC). (A) Диаграмма, показывающая систему каспазы-BiFC, где два продомена каспазы-1 (C1-pro), связанные с каждым нефлуоресцентным фрагментом Венеры (Venus-C или Venus-N), набираются на платформу активации NLRP3, заставляя Венеру пересворачиваться и флуоресцентировать. Этот комплекс появляется в виде зеленого пятна под микроскопом и служит считыванием для воспалительной близости, вызванной каспазой, что является первым шагом в активации инициатора каспазы. (B) Схема, показывающая доменную организацию компонентов воспаления и воспалительных каспаз. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Измерение активации конкретных инициирующих каспаз затруднено, и существует не так много методов, доступных для этого с помощью подходов к визуализации. Caspase Bimolecular Fluorescence Complementation (BiFC) может быть использована для визуализации воспалительной активации каспазы непосредственно в живых клетках (Рисунок 1A)25. Этот метод был недавно адаптирован для использования в макрофагах человека, полученных из моноцитов (MDM)21. Caspase BiFC измеряет первый шаг в воспалительной активации каспазы, индуцированной близостью для облегчения димеризации. Использована экспрессия плазмид, кодирующих CARD-содержащий каспазный продомен, слитый с нефлуоресцентными фрагментами фотостабильного желтого флуоресцентного белка Venus (Venus-C [VC]) и Venus-N [VN]). Когда два продомена каспазы набираются на их платформу активации или подвергаются индуцированной близости, две половины Венеры приближаются в непосредственной близости и вынуждены переворачиваться и флуоресцентировать (см. Рисунок 1A, B). Это обеспечивает считывание в режиме реального времени специфической активации воспалительной каспазы.
Человеческий МДМ обильно экспрессирует гены воспаления и рецепторы распознавания образов, которые идентифицируют сигналы опасности и патогенные продукты. Это обеспечивает идеальный тип клеток для опроса воспалительных путей каспазы. Кроме того, они могут быть получены из периферической крови и даже из образцов пациентов для оценки активации воспалительной каспазы в определенном болезненном состоянии. Этот протокол описывает, как вводить репортеры каспазы BiFC в MDM с использованием нуклеофекции, метода трансфекции на основе электропорации, как обрабатывать клетки для индуцирования активации воспалительной каспазы и как визуализировать активные комплексы каспазы с использованием подходов микроскопии. Кроме того, эта методология может быть адаптирована для определения молекулярного состава этих комплексов, субклеточной локализации, кинетики и размера этих высокоупорядоченных структур 25,26,27.
протокол
Этот протокол следует руководящим принципам комитета по этике исследований человека Медицинского колледжа Бейлора по манипулированию человеческими образцами. Образцы крови обрабатываются в соответствии с институциональными руководящими принципами безопасности для образцов человека. Образцы крови получают в региональном банке крови, где они собираются с помощью раствора цитратфосфат декстрозы (CPD). Однако кровь, собранная с другими антикоагулянтами, такими как гепарин натрия, гепарин лития или ЭДТА, также может быть использована для этого протокола28,29.
1. Выделение моноцитов человека и дифференцировка в макрофаги
- Получите антикоагулянтированную кровь от деидентифицированных здоровых людей в региональном банке крови и изолируйте мононуклеарные клетки периферической крови (PBMCs), как указано ниже.
ПРИМЕЧАНИЕ: Выполните все шаги в ламинарной проточной вытяжке культуры тканей. Используйте только стерильные трубки и надевайте перчатки. Добавьте 10% отбеливателя ко всем продуктам, связанным с кровью, при утилизации. Стерильный PBS (1x) или DPBS (без Ca2+ и Мг2+) может использоваться взаимозаменяемо.- Подготовьте буфер разбавления: Добавьте 1x стерильный PBS с 2% FBS и 0,5 мМ ЭДТА.
- Подготовьте культуральную среду: добавьте среду RPMI-1640 с FBS (10% (v/v)), глутамаксом (2 мМ) и пенициллином/ стрептомицином (50 I.U./50 мкг/мл)
- Предварительно охладите работающий буфер (Таблица материалов) в соответствии с протоколом производителя.
- Разбавьте цельную кровь двумя объемами разбавляющего буфера. Используя серологический пипет, переведите 15 мл антикоагулянтной крови в пробирку объемом 50 мл, содержащую 30 мл буфера разведения. Осторожно перемешайте путем инверсии.
- На каждые 10 мл цельной крови или 30 мл разбавленной крови добавляют 15 мл среды градиента плотности в пустую пробирку объемом 50 мл.
- Слой среды градиента плотности со стадии 1.1.5 на 30 мл разбавленной крови медленно и неуклонно с использованием серологического пипета объемом 25 мл. Держите наконечник пипетки прижатым к стенке трубки и трубки под наклонным углом.
- Аккуратно переложите трубки на центрифугу с качающимся ковшом. Избегайте нарушения двух фаз. Центрифугирование трубок при 400 х g при комнатной температуре (RT) в течение 25 мин с ускорением и замедлением, установленными на минимальное значение.
- Аккуратно снимите верхний (прозрачный) плазменный слой с помощью пипетки объемом 10 мл и утилизируйте в емкость с отбеливателем (10%).
- Собрать межфазный (белый) слой мононуклеарных клеток периферической крови (НБМК, рисунок 2) пипеткой объемом 10 мл и перенести в свежую трубку объемом 50 мл. Соедините белый слой из разных трубок одного и того же донора в трубку объемом 50 мл до 30 мл.
- Доведите каждый тюбик до общего объема 50 мл с буфером разбавления со стадии 1.1.1 и центрифугой при 300 х г и 4 °C в течение 10 мин. Удалите супернатант пипеткой объемом 10 мл и утилизируйте его в контейнер с отбеливателем (10%).
- Повторно суспендируйте каждую ячейку гранулы в 1 мл предварительно охлажденного рабочего буфера с шага 1.1.3 с помощью микропипетки p1000. Объедините клеточные суспензии от того же донора в новой пробирке объемом 15 мл. Доведите объем каждой трубки до 15 мл с предварительно охлажденным рабочим буфером и хорошо перемешайте путем инверсии.
- Возьмите 20 мкл аликвоты клеточной суспензии со стадии 1.1.11 и подготовьте разведение 1:100 с использованием 1x стерильного PBS. Определите номер ячейки с помощью гемоцитометра.
- Центрифугируют клеточную суспензию со стадии 1.1.11 при 300 х г и 4 °C в течение 10 мин и удаляют супернатант пипеткой объемом 10 мл. При необходимости используйте микропипетку p200, чтобы полностью удалить супернатант.
- Повторно суспендируйте изолированные НБМК в 80 мкл предварительно охлажденного MACS-буфера для каждого 1 x 107 ячеек, добавляя максимум 800 мкл буфера.
- Добавьте 20 мкл античеловеческих CD14 MicroBeads на каждый 1 х 107 клеток или до 100 мкл на образец крови (~ 100 мл неразбавленной крови). Хорошо перемешать путем инверсии и поместить на трубчатый ротатор на 20 мин с непрерывным перемешиванием при 4 °C.
- Извлеките образцы из ротатора трубки, добавьте 10 мл предварительно охлажденного рабочего буфера в каждую трубку и центрифугу при 300 x g (ускорение = 5, замедление = 5) и 4 °C в течение 10 мин.
- Удалите супернатант пипеткой объемом 10 мл и повторно суспендируйте до 1 х 108 ячеек в 500 мкл предварительно охлажденного рабочего буфера (2 х 108/мл).
- Выполните изоляцию CD14-положительных ячеек методом сортировки магнитных элементов с помощью ручной или автоматизированной системы (Таблица материалов) в соответствии с инструкциями производителя.
- Возьмите 20 мкл аликвоты клеточной суспензии со стадии 1.1.18 после CD14-положительного отбора и приготовьте разведение 1:100 с использованием 1x стерильного PBS. Определите номер ячейки, подсчитав клетки на гемоцитометре.
- Центрифугируйте CD14-положительные клетки при 300 х г и RT в течение 10 мин. Удалите супернатант с помощью пипетки 10 мл или вакуумной системы.
- Повторное суспендирование клеточной гранулы со стадии 1.1.20 в предварительно подогретой питательной среде со стадии 1.1.2 до конечной плотности клеток 1 х 107 клеток/мл.
- Засейте выделенные CD14-положительные моноциты при плотности клеток 5 х 106 клеток.
- На чашку для культивирования тканей объемом 10 см добавляют 10 мл питательной среды со стадии 1.1.2, дополненную гранулоцитарно-макрофаговым колониестимулирующим фактором 50 нг/мл (GM-CSF).
- Добавьте 0,5 мл клеточной суспензии со стадии 1.1.21 к культуральной среде по каплям и осторожно закрутите пластину. Инкубировать клетки в инкубаторе культуры увлажненной ткани (37 °C, 5% CO2) в течение ночи.
- На следующий день аспирируйте среду, используя вакуумную систему, чтобы удалить клетки, которые не прикреплялись в течение ночи. Добавьте 10 мл свежей питательной среды, дополненной GM-CSF (50 нг/мл), и инкубируйте клетки в инкубаторе культуры увлажненной ткани (37 °C, 5% CO2) в течение 7 дней, чтобы обеспечить полную дифференцировку (см. Рисунок 3A для появления моноцитов CD14+ на различных стадиях дифференцировки в GM-CSF). Обменивайте культуральную среду каждые 2-3 дня и каждый раз добавляйте свежую ГМ-ликвор (50 нг/мл).

Рисунок 2: Схематический обзор экспериментального рабочего процесса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Приготовление компонентов электропорации
ПРИМЕЧАНИЕ: Этот протокол предназначен для 10 мкл-неонового наконечника (Таблица материалов). Для каждой трансфекции используйте 1-2 х 105 клеток. Рекомендуется сеять трансфектированные клетки на 48-луночную пластину или 8-луночную камерную чашку (10 мкл-трансфектированных клеток на лунку). Вместо PBS можно использовать 1x стерильный DPBS (без Ca2+ и Mg 2+).
- На 7-й день готовят среду без антибиотиков, добавляя rpmI-1640 среду с FBS (10 % (v / v)) и глутамаксом (2 мМ).
- Поместите безмывороточную среду RPMI-1640, трипсин-ЭДТА (0,25%) раствор, 1x стерильный PBS (без Ca2+ и Mg2+) и полную питательную среду со стадии 1.1.2 на водяную баню 37 °C.
- При использовании посуды со стеклянным дном (для конфокальной микроскопии) покрывают посуду поли-D-лизином гидробромидом.
- Покрыть 8 хорошо камерных блюд 200 мкл поли-D-лизина гидробромида (0,1 мг/мл в 1x стерильном PBS) и инкубировать в течение 5 мин при РТ.
- Аспирировать раствор поли-D-лизина и промыть стекло один раз 1x стерильным PBS. Аспирируйте PBS и переходите к шагу 2.4.
- Добавьте 200 мкл среды без антибиотиков на лунку 48-луночной пластины или 8 хорошо камерной чашки и предварительно инкубируйте в инкубаторе увлажненной культуры тканей (37 °C, 5% CO2) до готовности к покрытию трансфектированных клеток.
3. Подготовка ячеек к электропорации
ПРИМЕЧАНИЕ: Выход МДМ из 10 см тарелки в конце 7-дневного периода дифференцировки составляет примерно 1,5 х 106 клеток. Вместо PBS можно использовать 1x стерильный DPBS (без Ca2+ и Mg 2+). Этот протокол был оптимизирован таким образом, что большинство макрофагов отделяются от пластины с поддержанием жизнеспособности и целостности клеток. МДМ трудно отсоединить от пластин клеточной культуры. Поэтому может потребоваться выполнить шаги 3.2 и 3.3 дважды, чтобы диссоциировать клетки. Убедитесь, что каждое время инкубации с трипсином-ЭДТА (0,25%) не превышает 5 мин.
- Аспирировать среду из полностью дифференцированных макрофагов на посуде 10 см и промыть клеточный монослой теплой безымянной средой RPMI-1640. Обязательно полностью удалите среду.
- Собирают клетки, добавляя 2 мл теплого раствора трипсина-ЭДТА (0,25%) на чашку 10 см и инкубируют в инкубаторе культуры увлажненной ткани (37 °C, 5% CO2) в течение 5 мин.
- Завершите отсоединение клетки, осторожно пипетировав раствор трипсина-ЭДТА (0,25%) вверх и вниз по всей площади тарелки с помощью микропипетки p1000. Перенесите клеточную суспензию в коническую трубку объемом 15 мл, содержащую 5 мл теплой полной питательной среды со стадии 1.1.2.
- Поднесите блюдо к яркому полевому микроскопу и проверьте на отслоение клеток в различных полях зрения. Если все еще прикреплено значительное количество клеток, повторите шаги 3.2-3.3.
- Центрифугируют клеточную суспензию при 250 х г в течение 5 мин при РТ.
- Аспирировать среду и повторно суспендировать клетки в 10 мл 1x стерильного PBS, предварительно нагретого до 37 °C. Возьмите аликвоту 20 мкл для определения номера клеток с помощью гемоцитометра.
- Возьмите 1-2 х 105 клеток на предполагаемую трансфекцию и поместите в пробирку объемом 15 мл. Доведите до конечного объема 15 мл с предварительно нагретым 1x стерильным PBS. Центрифуга при 250 х г в течение 5 мин при РТ.
- Аспирировать PBS и центрифугу еще раз в течение 1 мин при 250 х г. Удалите все остатки PBS из гранулы ячейки с помощью микропипетки p200.
4. Нуклеофекция компонентов caspase BiFC в макрофаги моноцитового происхождения человека
ПРИМЕЧАНИЕ: Этот раздел протокола выполняется с использованием системы неоновой трансфекции (Таблица материалов). Этот протокол описывает шаги по трансфекции 1-2 x 105 клеток с использованием неонового наконечника объемом 10 мкл (Таблица материалов). При использовании неонового наконечника объемом 100 мкл соответственно увеличьте масштаб. Избегайте воздействия на клетки буфера ресуспенсии R в течение более 15 минут, так как это может снизить жизнеспособность клеток и эффективность трансфекции.
- Разбавьте репортерную плазмиду (т.е. mCherry или dsRedmito при 100 нг/мкл) в воде без нуклеазы или 0,5x TE-буфере для визуализации трансфектированных клеток.
- Разбавляют плазмиды Caspase BiFC до соответствующей концентрации в воде без нуклеазы или 0,5x TE-буфере, чтобы общий объем плазмид не превышал 30% от общего трансфекционного объема 10 мкл (т.е. 300 нг/мкл C1 Pro-VC и 300 нг/мкл C1 Pro-VN).
- Готовят 1,5 мл стерильной микротрубки на предполагаемую трансфекцию и добавляют соответствующее количество репортерной плазмиды (т.е. 50 нг или 0,5 мкл) и плазмид Caspase BiFC (т.е. 300 нг или 1 мкл C1 Pro-VC и 300 нг или 1 мкл фрагмента C1 Pro-VN). Держите микротрубки в капоте в любое время.
- Поместите пипетку, устройство, наконечники, электропорационные трубки и пипетку в стерильный ламинарный вытяжной.
ПРИМЕЧАНИЕ: Пипеточная станция, устройство, наконечники, электропорационные трубки и пипетка включены в систему неоновой трансфекции. - Подключите разъем высокого напряжения и датчика на пипетке к задним портам устройства в соответствии с инструкциями производителя. Держите станцию пипетки близко к устройству.
- Подключите кабель питания к заднему входу переменного тока и перейдите к подключению устройства к электрической розетке. Нажмите выключатель питания, чтобы включить устройство.
- Введите параметры трансфекции на экране запуска, отображаемом при включении и соответствующем подключении устройства. Нажмите на Voltage, введите 1000 и нажмите Done , чтобы установить напряжение на 1000 В. Нажмите на Width, введите 40 и нажмите Done , чтобы установить длительность импульса на 40 мс. Наконец, нажмите на # Импульсы, введите 2 и нажмите Готово , чтобы установить число электрических импульсов равным 2.
- Возьмите одну из электропорационных трубок (входит в комплект) и заполните ее 3 мл электролитического буфера E (для наконечников 10 мкл и прилагается в комплекте) на RT. Вставьте электропорационную трубку в держатель пипетки на пипетке. Убедитесь, что электрод на боковой стороне трубки обращен внутрь и что при вставке трубки слышен звук щелчка.
- Возьмите гранулу ячейки со стадии 3.8 и добавьте 10 мкл предварительно нагретого ресуспенсионного R-буфера (входит в комплект) на каждые 1-2 х 105 клеток. Аккуратно перемешайте с микропипеткой p20. Добавьте 10 мкл клеточной суспензии в каждую трубку, установленную на этапе 4.3, и аккуратно перемешайте с микропипеткой p20.
- Возьмите пипетку и вставьте наконечник, нажав кнопку Push до второй остановки. Убедитесь, что зажим полностью поднимает крепежный шток поршня в наконечнике и что в верхней головке пипетки не наблюдается зазора.
- Чтобы аспирировать образец, нажмите кнопку push на пипетке до первой остановки и окунитесь в первую трубку, содержащую смесь ДНК клетки и плазмиды. Медленно аспирируйте смесь в кончик пипетки.
ПРИМЕЧАНИЕ: Избегайте пузырьков воздуха, так как они могут вызвать дугу во время электропорации, и при обнаружении устройством могут предотвратить доставку электрического импульса. Если наблюдаются пузырьки воздуха, отпустите содержимое в трубку и попробуйте аспирировать снова. - Вставьте пипетку с образцом очень осторожно в держатель пипетки. Убедитесь, что пипетка щелкает и что она правильно размещена.
- Нажмите кнопку Пуск на сенсорном экране и подождите, пока не подадутся электрические импульсы. Сообщение на экране будет означать завершение.
- Медленно извлеките пипетку со станции и немедленно добавьте трансфектированную клеточную суспензию в соответствующий колодец с предварительно нагретой средой без антибиотиков с этапа 2.4, медленно нажав кнопку до первой остановки.
ПРИМЕЧАНИЕ: Этот наконечник может быть повторно использован до трех раз для одной и той же плазмиды; в противном случае выбросьте его в контейнер для биологически опасных отходов, нажав кнопку Push до второй остановки. - Повторите шаги 4.10-4.14 для каждой трубки, содержащей смесь ДНК клетки/плазмиды.
- Аккуратно раскачивают пластину трансфектированными клетками и инкубируют в течение 1-3 ч в инкубаторе культуры увлажненной ткани (37 °C, 5% CO2).
- Добавьте к каждой лунке 200 мкл предварительно подогретой питательной среды (полной среды) со стадии 1.1.2. Поместите блюдо в инкубатор культуры увлажненной ткани (37 °C, 5% CO2) снова. Подождите не менее 24 ч для экспрессии генов.
- На следующий день осмотрите жизнеспособность клеток и эффективность трансфекции с помощью эпифлуоресцентного микроскопа.
- Включите эпифлуоресцентный микроскоп и блок источника флуоресцентного света в соответствии с инструкциями производителя и поместите чашку для культивирования на ступень микроскопа.
- Выберите объектив 10x или 20x и фильтр 568 нм (RFP).
- Чтобы оценить жизнеспособность ячейки, нажмите кнопку Transmission Light LED (TL), чтобы визуализировать все ячейки в выбранном поле. Глядя в окуляр микроскопа, поверните ручку фокусировки до тех пор, пока клетки не будут замечены, и проверьте прикрепление клеток в выбранном поле.
ПРИМЕЧАНИЕ: Полностью прикрепленные клетки представляют жизнеспособные клетки, в то время как плавающие клетки представляют собой нежизнеспособные клетки. Если слияние лунки высокое, наличие неприсоединенных клеток может быть результатом переоценки количества клеток, а не результатом низкой жизнеспособности. Однако низкая сливаемость, сопровождаемая высоким содержанием плавающих клеток, означает низкую жизнеспособность, которая может возникнуть в результате дуги во время электропорации, плазмидной токсичности или чрезмерного воздействия на реуспензионный R-буфер. Не используйте колодцы, которые отображают последнее поведение. - Чтобы оценить эффективность трансфекции, сосредоточьтесь на ячейках в выбранном поле при проходящего свете, как описано выше. Подсчитайте общее количество ячеек в выбранном поле. Выключив индикатор пропускаемого света (TL), нажмите кнопку «Отраженный свет» (RL), чтобы включить его.
- Тонко сосредоточьтесь на репортерной флуоресценции гена (красных клетках) и подсчитайте общее количество красных флуоресцентных клеток. Повторите эти шаги (4.18.4-4.18.5) по крайней мере еще для двух полей на скважину.
5. Лечение трансфектированного сбора данных MDM и caspase BiFC
ПРИМЕЧАНИЕ: Если планируется визуализировать клетки с помощью эпифлуоресцентного или конфокального микроскопа, рекомендуется лечение qVD-OPh (20 мкМ) в течение 1 ч до лечения выбранным стимулом для предотвращения каспазозависимой гибели клеток (преимущественно апоптоза). Это используется в визуализации, чтобы предотвратить взлет клеток из-за апоптоза, что делает их очень трудными для изображения, когда они выходят из фокальной плоскости. Обратите внимание, что набор каспазы в платформу активации и связанную с ней каспазу BiFC не зависит от каталитической активности каспазы, и, следовательно, ингибирование каспазы не повлияет на этот этап.
- Обрабатывают выбранным стимулом примерно через 24 ч после трансфекции и инкубируют столько, сколько необходимо для каждого препарата.
- Готовят среду визуализации, дополняя культуральную среду со стадии 1.1.2 гепесом (20 мМ, рН 7,2-7,5) и 2-меркаптоэтанолом (55 мкМ).
- Добавьте желаемую концентрацию стимула в предварительно нагретую среду визуализации и аккуратно перемешайте.
- Осторожно удалите среду из клеток микропипеткой p1000 и добавьте 500 мкл стимулирующего раствора со стадии 5.1.2 вниз по боковой стороне лунки.
- Чтобы запустить необработанные контрольные скважины, добавьте среду визуализации без стимула.
- Инкубируют клетки в инкубаторе культуры увлажненной ткани (37 °C, 5% CO2) до тех пор, пока это показано для каждой обработки.
- Визуализируйте клетки с помощью эпифлуоресценции или конфокального микроскопа.
- Включите микроскоп и источник флуоресцентного света, следуя инструкциям производителя.
- Выберите объектив 10x или 20x и поместите чашку культуры на ступень микроскопа.
- Используя окуляр микроскопа, найдите клетки под фильтром 568 нм и сосредоточьтесь на клетках, экспрессирующих репортер dsRedmito/mCherry (красные клетки).
- Подсчитайте все красные ячейки в поле зрения и запишите число.
- Находясь в том же поле зрения, перейдите на фильтр 488 или 512 (GFP или YFP), перейдите к подсчету количества красных клеток, которые также являются зелеными (Венера-положительные или BiFC-положительные) и запишите число.
- Подсчитайте не менее 100 dsRedmito/mCherry-положительных ячеек как минимум из трех отдельных полей зрения.
- Рассчитайте процент венеро-положительных трансфектированных клеток на поле зрения и усредните результирующие проценты для каждого лечения (колодца), чтобы получить стандартное отклонение.
- Изображение клеток с помощью эпифлуоресцентного или конфокального микроскопа
ПРИМЕЧАНИЕ: Для получения конфокальных изображений с использованием 20-кратного объектива или большего увеличения клетки должны быть покрыты стеклянными тарелками, если микроскоп не оснащен длиннопроходным объективом.- Выполните шаги 5.2.1-5.2.3. При использовании конфокального микроскопа с масляным объективом 40x, 60x или 63x поместите каплю масла на объектив.
- Визуализируйте живое изображение ячеек на экране компьютера, полученное камерой. Используйте эпифлуоресцентный источник света для флуоресцентных изображений или переключите источник света на лазеры для конфокальных изображений.
- Тонкая настройка фокуса и положения ячеек с помощью джойстика управления и колеса фокусировки.
- Установите процент мощности лазера и время экспозиции для лазеров 512 нм или 488 нм (YFP или GFP) и 568 нм (RFP) таким образом, чтобы сигнал на изображении выглядел хорошо и не достигал насыщения.
- Включите запись в реальном времени и изучите полученное изображение. Убедитесь, что для каждого флюора в гистограммах дисплея для обоих каналов виден отдельный пик.
- При необходимости отрегулируйте мощность лазера и время экспозиции. Держите эти значения как можно ниже, сохраняя при этом возможность обнаруживать как флуоресцентные сигналы (RFP, так и GFP / YFP).
- При визуализации живого изображения ячеек сделайте несколько репрезентативных изображений поля, содержащего одну или несколько ячеек, экспрессирующих репортер mCherry/dsRedmito для каждого колодца пластины, и сохраните данные.
Результаты
Схема, показанная на рисунке 2, дает обзор того, как получить, трансфектировать и изобразить МДМ человека. После инкубации выбранных моноцитов CD14+ с GM-CSF в течение 7 дней морфология клеток изменяется в течение периода дифференцировки (рисунок 3A), переходя от сферических суспензионных клеток к веретенообразным и полностью присоединенным (дни 3 и 4), и, наконец, к большему распространению клеток при полной дифференцировке (день 7). Полностью дифференцированные клетки затем отделяются от пластины и трансфектируются парами Caspase BiFC (VC и VN) вместе с репортерной плазмидой (например, dsRedmito, плазмидой, кодирующей красный флуоресцентный белок, нацеленный на митохондрии), которая используется для маркировки трансфектированных клеток (рисунок 3B) и используется для оценки эффективности трансфекции через 24 ч. Рисунки 3B-D показать пример результатов BiFC с использованием трансфектированных клеток caspase-1 pro BiFC, обработанных в течение 20 ч нигерицином (5 мкМ), известным провоспалительным стимулом, который запускает сборку инфламмасомы NLRP330,31. Необработанные клетки не показывают флуоресценции Венеры (рисунок 3B), а в клетках, обработанных нигерицином, каспаза-1 BiFC появляется в виде одного пунктуума с типичной формой пятнышек ASC 32,33,25 (рисунок 3C). На рисунке 3D показан пример количественного определения Венеросоположительного МДМ. Самый высокий процент каспазы-1 BiFC наблюдается в группе лечения ЛПС + нигерицин (рисунок 3D). Этот результат согласуется с активацией канонической воспаленной, где для активации капазы-1 требуется как сигнал прайминга (LPS), так и внутриклеточный сигнал (nigericin).
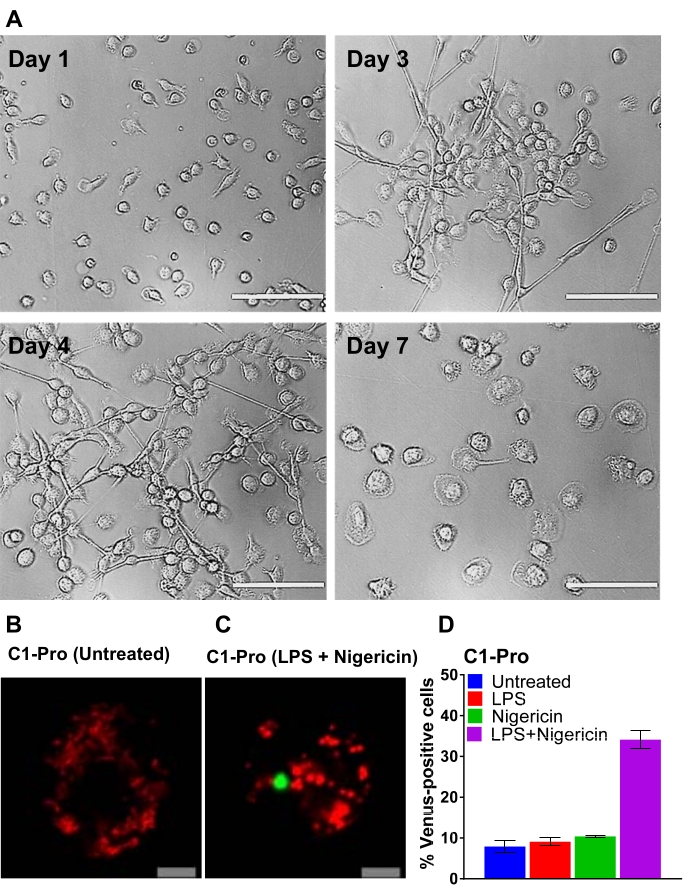
Рисунок 3: Дифференциация CD14-моноцитов и трансфекция МДМ человека. (А) Репрезентативные изображения яркого поля моноцитов CD14+ из периферической крови, подвергшейся воздействию GM-CSF в 1, 3, 4 и 7 дни дифференцировки (шкала бара, 100 мкм). (Б-С) Человеческие МДМ были трансфектированы парами каспазы-1 pro BiFC и трансфекционным репортером dsRedmito (50 нг, красный). Через 24 ч клетки грунтовали с лпс и без него (100 нг/мл) в течение 3 ч и обрабатывали нигерицином (5 мкМ) в среде визуализации в течение 20 ч. Показаны репрезентативные конфокальные изображения необработанных и обработанных нигерицином клеток (шкала бара, 10 мкм). BiFC показан зеленым цветом. (D) Клетки из (C) оценивали по проценту dsRedmito-положительных клеток (красных, трансфектированных клеток), которые были венеросоположительными (зеленый, каспаза-1 BiFC комплекс) через 20 ч. Полосы ошибок представляют собой SD по крайней мере двух независимых счетчиков на скважину. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Пример титрования плазмид показан на рисунке 4, где трансфектируется все большее количество каждой плазмиды BiFC. Это позволяет подобрать оптимальную дозу плазмиды, в результате чего получается специфический сигнал и минимальный фон. На рисунке 4A показаны результаты трансфекции МДМ человека с увеличением концентрации пар каспазы-1, -4 и -5 про BiFC (VC и VN), обработанных гемом, высокопровоспалительной молекулой, которая является результатом разрушения эритроцитов34. Самый высокий процент венеросположительных клеток для пар Caspase-1, -4 и -5 pro BiFC составляет 400 нг, 500 нг и 1000 нг трансфектированной плазмиды соответственно. Однако использование наибольшего количества плазмиды также сопряжено с риском увеличения неспецифического фона (рисунок 4B). Например, трансфекция 1000 нг пары caspase-5 pro BiFC приводит к почти 40% неспецифического фона. Поэтому использование более низкого количества 700 нг считается оптимальным для этой плазмидной пары (рисунок 4B). На фиг.4С показаны репрезентативные конфокальные изображения, полученные с 20-кратным объективом поля клеток через 24 ч после трансфекции. На этом изображении видно, что необработанные трансфектированные клетки жизнеспособны на основе появления митохондрий (митохондрии в мертвых клетках сильно фрагментированы) и морфологии клеток (апоптотические клетки сморщены). После лечения гемом комплекс каспазы-1 проявляется в виде одной зеленой пункции, аналогичной той, которая индуцируется нигерицином на рисунке 3С, и его появление сопровождалось усадкой клеток.
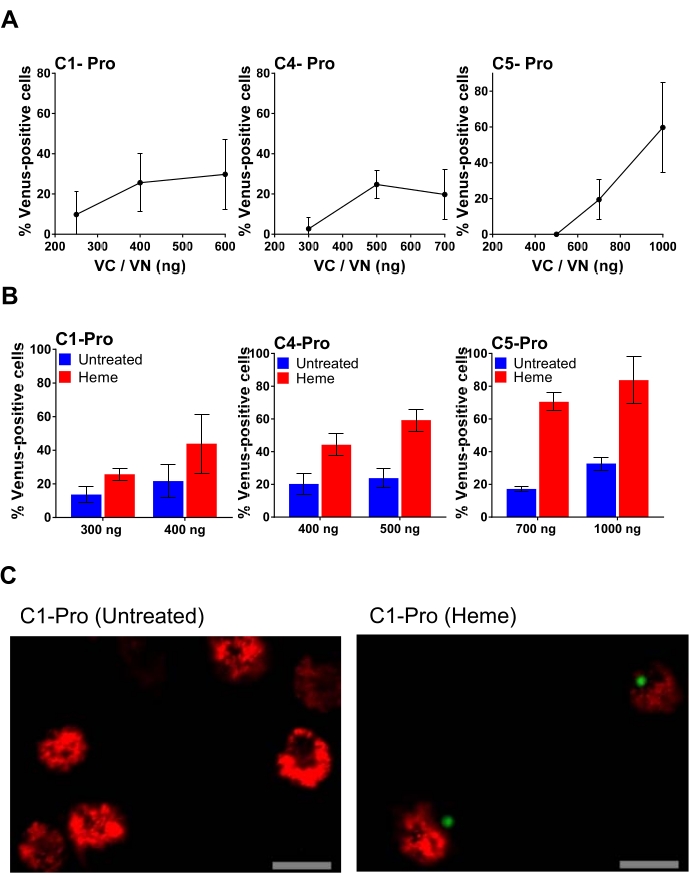
Рисунок 4: МДМ человека трансфектирован различным количеством воспалительной каспазы про пары BiFC. (А) Титрование каспазы-1 про; каспаза-4 про; или каспаза-5 про пары BiFC. Человеческие МДМ трансфектировали указанными количествами пары каспазы pro BiFC с dsRedmito в качестве трансфекционного репортера (50 нг) и инкубировали в течение ночи. На следующий день культуральную среду удаляли из всех лунок, а клетки обрабатывали гемом и без него (50 мкМ) в 0,1% среде FBS. Через 1 ч во все скважины добавляли равное количество полной среды, чтобы восстановить концентрацию FBS до 5% и предотвратить гибель клеток гемом. После общей продолжительности лечения в течение 20 ч клетки оценивали на процент dsRedmito-положительных трансфектированных клеток, которые были венеросоположительными, определяемыми как минимум из 300 клеток на лунку. Полосы погрешностей представляют собой SD не менее трех независимых счетчиков на скважину. (B) МДМ человека были трансфицированы отдельными количествами каспазы-1 pro; каспаза-4 про; или пары caspase-5 pro BiFC, наряду с dsRedmito (50 нг) в качестве репортера для трансфекции. Через 24 ч после трансфекции клетки обрабатывали гемом или без него (50 мкМ) в 0,1% FBS. Через 1 ч FBS восстанавливали до 5% для ингибирования внеклеточного гема. Клетки оценивали по проценту dsRedmito-положительных клеток (красных, трансфектированных клеток), которые были венеросоположительными (зеленый, каспазный комплекс BiFC) через 20 ч, определяемых из минимума 300 клеток на лунку. Результаты представлены в процентах Венеросположительных клеток. Полосы погрешностей представляют собой SD не менее трех независимых счетчиков на скважину. (C) Репрезентативные конфокальные изображения, полученные с помощью 20-кратного объектива поля клеток через 24 ч после трансфекции и обработанные гемом и без него, как описано в пункте (В). Красный: дсРедмито-положительные клетки; Зеленый: Венероположительные клетки; Шкала, 20 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Этот протокол описывает рабочий процесс получения макрофагов из моноцитов, выделенных из образцов крови человека, и метод эффективного введения воспалительной каспазы Репортеров BiFC в МДМ человека без ущерба для жизнеспособности и поведения клеток.
Этот протокол использует методBiFC 35 для маркировки воспалительных каспаз в домене набора каспазы (CARD) с нефлуоресцентными фрагментами расщепленного флуоресцентного белка Венеры. Воспалительные каспазы кодируют каталитический домен, состоящий из большой (p20) и маленькой (p10) субъединицы, и сохраненный мотив белково-белкового взаимодействия, называемый CARD на их N-конце илипродомене 36 (рисунок 1B). Набор воспалительных каспаз на их платформы активации зависит от неповрежденной КАРТЫ. Для этого подхода генерируются две конструкции продомена каспазы (кодирующие мотив CARD), каждая из которых связана с нефлуоресцентными фрагментами фотостабильного желтого белка Venus (Venus-C [VC]) и Venus-N [VN]) вместе с флуоресцентным трансфекционным репортером, чтобы обеспечить визуализацию клеток до или в отсутствие активации caspase Репортера BiFC. Флуоресценция наблюдается только тогда, когда взаимодействующие белки находятся в достаточно близкой близости, что позволило бы димеризацию и активацию (см. Рисунок 1А). Эффективность этого процесса может быть количественно определена с помощью стандартной эпифлуоресценции или конфокального микроскопа. В сочетании с одноклеточной визуализацией этот протокол позволяет визуализировать асинхронные события, которые могут быть неразличимыми в массовых популяциях, и в зависимости от разрешения изображений могут быть использованы для определения размера и локализации комплекса BiFC, связанного с каждой каспазой.
Этот протокол может быть адаптирован к ряду белков, которые активируются олигомеризацией, и его применимость не ограничивается методологиями микроскопии. Этот подход также позволяет исследовать дифференциальные требования к сборке воспалительных каспаз. Например, siRNA может быть использована для идентификации исходных компонентов / требований для специфической активации воспалительной каспазы. Зонды caspase-BiFC и олиго siRNA (используемые для подавления белка-мишени) могут быть трансфектированы одновременно в MDM. Это может идентифицировать потенциальных белковых партнеров или основные компоненты каждой платформы активации. Например, олиго siRNA, нацеленное на молекулу адаптера ASC, которая необходима для сборки воспалительных сред NLRP1, NLRP3 и AIM2, было использовано, чтобы показать, что индуцированная гемом активация каспазы-1 требует этих канонических инфламмасом, в то время как каспаза-4 и -5 не21. Эта методология также может быть адаптирована к покадровой микроскопии, поэтому кинетика активации воспалительной каспазы может быть определена в отдельных клетках. Используя такой подход, можно оценить, когда происходит димеризация каспазы, точно определив время появления начала BiFC относительно времени, когда клетка подвергается гибели, путем мониторинга потери флуоресценции трансфекционного репортера (mCherry) в качестве индикатора лизиса клеток. Существует несколько способов получения и анализа данных Caspase BiFC; выбор будет зависеть от вопроса, на который необходимо ответить, а также от типа микроскопа и программного обеспечения. Например, данные об одной точке времени, используемые для определения эффективности активации, а также покадрового анализа, могут быть особенно эффективными, если доступна функция автоматического сбора, предоставляемая некоторым программным обеспечением микроскопа. Это позволяет проводить объективную визуализацию, так как заранее определенные положения массивов приобретаются из каждой скважины многоскважинной пластины. Изображения могут быть количественно оценены как визуальным осмотром, так и с помощью автоматизированного программного обеспечения для визуализации, такого как CellProfiler, ImageJ или MATLAB, для повышения точности и объективности.
Исследование путей каспазы в первичных клетках имеет важное значение для полного понимания физиологических ролей этих белков. Кроме того, поскольку каспаза-4 и каспаза-5 заменяются одной каспазой-11 у мышей, возможность оценки клеток человека имеет важное значение. Однако из-за низкой эффективности трансфекции и токсичности, связанных со многими системами доставки в первичных клетках, может быть трудно максимизировать использование доступных репортеров на основе плазмид. Протокол воспалительной каспазы BiFC описывает простой метод трансфекции MDM из периферической крови пациентов или здоровых субъектов, уменьшая количество клеток, необходимых для трансфекции. Это позволяет исследователям проводить более сложные эксперименты с драгоценными клетками, такими как макрофаги, без ущерба для жизнеспособности и клеточных свойств. Возможность использования образцов пациентов обеспечивает основное преимущество в том, что можно оценить активацию воспалительной каспазы в конкретных болезненных состояниях. Действительно, с некоторыми незначительными оптимизациями этот протокол может быть легко адаптирован к другим мышиным или человеческим первичным клеткам.
Этот протокол использует основанный на электропорации подход к трансфектированию MDM. Неоновая система особенно выгодна, поскольку она не индуцирует ответ IFN-γ в MDM, который может нарушить специфический иммунный ответ клеток37. Это мелкомасштабная электропорационная система, которая использует трансфекционный объем 10 мкл с высокой плотностью клеток, чтобы обеспечить эффективную передачу экзогенной ДНК большому количеству клеток. Он создает временные поры в клеточной мембране, так что плазмиды могут быстро проходить, избегая позднего эндоцитоза, который происходит во время химической трансфекции и который может вызвать деградацию плазмиды. В этом протоколе используется буферная формула на основе органических кислот (буфер R), которая вводит минимальную клеточную токсичность по сравнению с другими буферами с ионами хлорида38. Небольшой объем и конструкция камеры наконечника пипетки помогают генерировать однородное электрическое поле для поддержания физиологических условий, что приводит к высоким показателям выживаемости. Эффективность трансфекции и выживаемость клеток сильно зависят от химического состава буфера, плотности клеток, силы импульса и концентрации плазмиды39. Поэтому важно оптимизировать эти условия для каждого типа клеток и введенных плазмид. В MDM более низкие напряжения с большей длительностью импульса доставляли плазмиды более эффективно, сохраняя при этом жизнеспособность и здоровье клеток. Следовательно, настройки, используемые для этого протокола, составляли 1000 В и 2 импульса 40 мс, что приводило к эффективности трансфекции между 40-60% с жизнеспособностью клеток выше 90% на основе способности клеток повторно прикрепляться к пластине после трансфекции. Хотя этот протокол оптимизирован для МДМ человека, изменение настроек напряжения от 500 В до 1700 В, увеличение количества импульсов с 1 до 3 и тестирование длины импульсов в диапазоне от 10 до 40 мс могут сбалансировать эффективность трансфекции и жизнеспособность клеток в дополнительных типах ячеек и экспериментальных условиях.
Существует несколько важных соображений для оптимального использования техники BiFC. 1) Важно, чтобы пользователь определил оптимальное количество каждой плазмиды каспазы, которая будет введена, так как это может варьироваться для разных белков и типов клеток. Это необходимо для обеспечения максимальной чувствительности и специфичности анализа. Рекомендуется провести пилотное титрование плазмид Caspase BiFC (фрагментов VC и VN) между 200 нг и 1000 нг, как показано на рисунках 4A-B. Оптимальный диапазон вводимых плазмид отличается для каждой отдельной каспазы, а значит, они должны быть индивидуально оценены. Выберите количество плазмиды, которое обеспечивает самый высокий специфический сигнал с минимальным фоном. В идеале уровень фона должен быть менее 10%, но до 20% можно использовать, если конкретный сигнал высокий. Также важно избегать суровых условий и чрезмерных манипуляций с этими клетками во время дифференцировки, трансфекции и лечения. Это также может привести к спонтанной активации и высоким фоновым уровням активации каспазы, которые могут скрывать конкретные результаты, поскольку активация иммунных клеток, таких как моноциты или макрофаги, является естественным процессом, где они могут приобретать провоспалительные функции40. При использовании клеток пациента может быть трудно контролировать некоторые врожденные изменения в уровнях активации инфламмасом и генетического фона, которые могут сенсибилизировать или десенсибилизировать их к стимулам и изменениям в их местной микросреде. Например, функция макрофагов может быть затронута у людей с ослабленным иммунитетом или лиц, борющихся с инфекцией, поскольку этот тип клеток играет важные гомеостатические функции и участвует в контроле воспаления, среди других функций. Эти генетические и экологические факторы необходимо учитывать при определении того, является ли высокий фон неспецифическим или биологическим эффектом. Использование близко подобранных здоровых контрольных групп (например, подобранных по полу и возрасту) может помочь оценить биологическую значимость высокого фонового уровня каспазы BiFC. 2) Крайне важно, чтобы фрагменты VC и VN вводились в равных количествах, поскольку неравная экспрессия одного фрагмента Венеры может привести к набору на платформу на более высоких частотах и маскировке полного флуоресцентного сигнала, что приведет к ложноотрицательному результату. Поэтому целостность и концентрация каждой отдельной плазмиды должны быть проверены перед каждой трансфекцией, чтобы избежать введения различных количеств фрагментов VC и VN. 3) Поскольку этот подход основан на экзогенном выражении репортеров каспазы, следует включить дополнительные средства контроля за специфичностью. Конструкции Caspase-BiFC, содержащие одноточечные мутации, которые нарушают связывание между каспазой и ее платформой активации или глушение одного из компонентов платформы активации с использованием siRNA, могут быть использованы для подтверждения того, что флуоресцентный сигнал обусловлен специфическим связыванием каспазы с инфламмасомой. Этот контрольный эксперимент должен привести к снижению уровня Венеро-положительных клеток. 4) Экспрессия конструкций Caspase BiFC может вызвать или повлиять на последующие события, такие как гибель клеток. Чтобы обойти это, для репортеров BiFC рекомендуются неферментативные версии каспазы, такие как продомен каспазы или полноразмерная каспаза, где каталитический остаток цистеина мутирует и инактивируется. Для дальнейшего контроля за этим контрольные нетрансфектные обработанные и необработанные скважины должны быть включены в эксперимент и должны демонстрировать поведение, аналогичное поведению трансфектированных скважин. 5) Эндогенная активность каспазы может повлиять на показания BiFC. Чтобы контролировать это, можно экспрессировать репортер каспазы в клетках, дефицитных для исследуемой каспазы, ожидая, что эффективность BiFC будет такой же.
Одним из основных недостатков этого подхода является то, что он измеряет не активацию каспазы как таковую, а индуцированную стадию близости, необходимую для активации. Это тонкое, но важное различие. По замыслу, продомен не содержит каталитических доменов каспазы, которые фактически димеризируются. Поэтому перефокусировка и флуоресценция фрагментов Венеры действуют как прокси для димеризации каспазы, поскольку они могут пересворачиваться только в том случае, если каспазы находятся достаточно близко для димеризации. Таким образом, BiFC специально измеряет индуцированную близость. Возможно, что посттрансляционные модификации в каталитических доменах могут препятствовать димеризации, не влияя на сигнал BiFC. Например, каспаза-2 фосфорилируется на своем каталитическом домене, и это препятствует димеризации, не препятствуя набору каспазы-2 в ее активационную платформу41. Следовательно, наблюдения с использованием подхода BiFC должны быть дополнены функциональными исследованиями, чтобы подтвердить, что наблюдаемая флуоресценция является репрезентативной для активации каспазы. Несмотря на этот недостаток, если включить элементы управления, обсуждаемые здесь, измерение индуцированной близости с помощью caspase BiFC может обеспечить точное представление конкретной активации каспазы.
В заключение, каспаза BiFC является мощным инструментом для анализа динамических взаимодействий каспазы на уровне инфламмасом. Этот протокол позволяет исследовать воспалительные каскады передачи сигналов каспазы в живых иммунных клетках. Этот подход не только обеспечивает технику для конкретного и точного измерения первого этапа активации каспазы, но, применяясь к первичным иммунным клеткам, может выявить свойства воспалительных каспаз, которые не могут быть идентифицированы с помощью обычных методов.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Мы благодарим членов лаборатории LBH в прошлом и настоящем, которые внесли свой вклад в разработку этой техники. Эта лаборатория поддерживается NIH/NIDDK T32DK060445 (BEB), NIH/NIDDK F32DK121479 (BEB), NIH/NIGMS R01GM121389 (LBH). Рисунок 2 был нарисован с помощью программного обеспечения Biorender.
Материалы
| Name | Company | Catalog Number | Comments |
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
Ссылки
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1867 (6), 118688(2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761(2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97(1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813(2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316(2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502(2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What's the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены