Method Article
炎症性半月酶诱导的人单核细胞来源巨噬细胞邻近性的可视化
摘要
该协议描述了从人血液样本中获取单核细胞来源巨噬细胞(MDM)的工作流程,一种在不损害细胞活力和行为的情况下将炎症半胱天冬酶双分子荧光互补(BiFC)报告基因有效引入人MDM的简单方法,以及一种基于成像的方法来测量活细胞中的炎症半胱天冬酶活化。
摘要
炎症性半胱天冬酶包括半胱天冬酶-1、-4、-5、-11 和 -12,属于引发者半胱天冬酶的亚组。半胱天冬酶-1是确保炎症信号传导正确调节所必需的,并且在募集到炎症小体后通过接近诱导的二聚化激活。半胱天冬酶-1在单核细胞谱系中含量丰富,并诱导促炎细胞因子白细胞介素(IL)-1β和IL-18向活性分泌分子成熟。其他炎症性半胱天冬酶,半胱天冬酶-4和-5(及其小鼠同源半胱天冬酶-11)通过诱导焦磷酸化来促进IL-1β的释放。半胱天冬酶双分子荧光互补(BiFC)是一种用于测量炎症性半胱天冬酶诱导的接近度作为半胱天冬酶活化的读数的工具。半胱天冬酶-1,-4或-5原结构域,其中包含与炎症小体结合的区域,与黄色荧光蛋白Venus(Venus-N [VN]或Venus-C [VC])的非荧光片段融合,当半胱天冬酶发生诱导接近时,这些片段与荧光金星复合物结合以重整荧光金星复合物。该协议描述了如何使用细胞核感染将这些报告基因引入原代人单核细胞来源的巨噬细胞(MDM),处理细胞以诱导炎症性半胱天冬酶活化,并使用荧光和共聚焦显微镜测量半胱天冬酶活化。这种方法的优点是它可用于鉴定活细胞中炎症性半胱天冬酶活化复合物的组分,要求和定位。然而,需要考虑仔细的控制,以避免损害细胞活力和行为。该技术是一种强大的工具,用于分析炎症小体水平的动态半胱天冬酶相互作用,以及询问活MDM和来自人类血液样本的单核细胞中的炎症信号级联。
引言
半胱天冬酶是半胱氨酸天冬氨酸蛋白酶的一个家族,可以分为引发子半胱天冬酶和刽子手半胱天冬酶。刽子手半挂酶包括半胱天冬酶-3、-6和-7。它们以二聚体的形式天然存在于细胞中,并被引发剂半胱天冬酶切割以执行细胞凋亡1。引发剂半胱天冬酶包括人半胱天冬酶-1、-2、-4、-5、-8、-9、-10和-12。它们被发现为无活性酶原(前半胱天冬酶),通过接近诱导的二聚化激活,并通过自体蛋白水解裂解2,3稳定。炎症性半胱天冬酶是引发子半胱天冬酶2 的一个子集,包括人类中的半胱天冬酶-1、-4、-5 和 -12,以及小鼠4、5 中的半胱天冬酶-1、-11 和 -12。它们不是凋亡作用,而是在炎症中起核心作用。它们介导蛋白水解处理和促白细胞介素(IL)-1β和亲IL-186,7的分泌,这是响应致病性入侵者释放的第一批细胞因子8,9。半叶酶-1在其激活平台募集时被激活;称为炎症小体的大分子量蛋白质复合物(图1A)10。半胱天冬酶-4、-5 和 -11 的二聚化通过非规范的炎性小体途径11,12 独立于这些平台发生。
典型炎性粒体是胞质多聚体蛋白复合物,由炎性粒体传感器蛋白、适应蛋白ASC(含有CARD的凋亡相关斑点样蛋白)和效应蛋白半胱天冬酶-110组成。研究最充分的规范炎小体是含有pyrin结构域(NLRP),NLRP1和NLRP3的NOD样受体家族,含有CARD(NLRC),NLRC4的NLR家族以及黑色素瘤2(AIM2)中不存在的。它们各自包含一个pyrin域,一个CARD或两个域。CARD域介导含CARD的半链酶与其上游激活剂之间的相互作用。因此,由N端pyrin结构域(PYD)和C端CARD基序13,14组成的支架分子ASC是将半胱天冬酶-1募集到NLRP110,NLRP315和AIM216 炎性小体所必需的。
每个炎症小体都以其独特的传感器蛋白命名,该传感器蛋白可识别不同的促炎刺激(图1B)。该途径的激活剂被称为规范刺激。炎症小体充当微生物成分和组织应激的传感器,并通过激活炎症半胱天冬酶17来组装以触发强大的炎症反应。炎症小体组装启动半胱天冬酶-1活化以介导其主要底物pro-IL-1β和pro-IL-18的成熟和分泌。此过程通过两步机制进行。首先,启动刺激通过激活NF-κB途径上调某些炎症小体蛋白和pro-IL-1β的表达。其次,细胞内(规范)刺激诱导炎症小体组装和前卡星酶-16,7的募集。
半胱天冬酶-4和半胱天冬酶-5是小鼠半胱天冬酶-11 11的人类同源物。它们通过细胞内脂多糖(LPS)以炎症小体独立的方式被激活,LPS是在革兰氏阴性细菌18,19,20的外膜中发现的分子,以及细胞外血红素,红细胞溶血21的产物。已经提出LPS直接与这些蛋白质的CARD基序结合并诱导其寡聚化20。半胱天冬酶-4或半胱天冬酶-5的活化通过裂解形成孔隙蛋白gasdermin D(GSDMD)18,19诱导称为焦磷酸化的炎症形式的细胞死亡来促进IL-1β的释放。此外,由半胱天冬酶-4和GSDMD介导的热融性死亡引起的钾离子外排诱导NLRP3炎症小体的活化和随后的半胱天冬酶-122,23的活化。因此,半胱天冬酶-4、-5 和 -11 被认为是 LPS 的细胞内传感器,它们能够诱导焦磷酸化和半胱天冬酶-1 激活以响应特定的刺激11,24。

图1:炎症半胱天冬酶和半胱天冬酶 - 双分子荧光互补(BiFC)测定。 (A)显示半胱天冬酶-BiFC系统的图表,其中与金星的每个非荧光片段(Venus-C或Venus-N)相连的两个半胱天冬酶-1蛋白结构域(C1-pro)被招募到NLRP3激活平台,迫使金星重新折叠并发出荧光。该复合物在显微镜下显示为绿点,并用作炎症性半胱天冬酶诱导的接近的读数,这是引发半胱天冬酶激活的第一步。(B)显示炎症小体成分和炎症性半胱天冬酶的结构域组织的示意图。 请点击此处查看此图的大图。
测量特异性引发剂半胱天冬酶活化是困难的,并且通过成像方法没有多少方法可以做到这一点。半胱天冬酶双分子荧光互补(BiFC)可用于直接在活细胞中可视化炎症半胱天冬酶活化(图1A)25。该技术最近已被改编用于人单核细胞来源的巨噬细胞(MDM)21。半胱天冬酶BiFC测量炎症性半胱天冬酶活化的第一步,诱导接近以促进二聚化。使用编码含CARD的半胱天冬酶pro结构域的质粒的表达,这些质粒融合到光稳定黄色荧光蛋白Venus(Venus-C [VC])和Venus-N [VN])的非荧光片段中。当两个半胱天冬酶前跨域被招募到它们的激活平台或经历诱导的接近时,金星的两半被靠近并被迫重新折叠和发出荧光(见 图1A,B)。这提供了特定炎症性半胱天冬酶激活的实时读数。
人类MDM大量表达炎症小体基因和模式识别受体,识别危险信号和病原体产物。这为炎症半胱天冬酶途径的询问提供了理想的细胞类型。此外,它们可以来自外周血,甚至来自患者样本,以评估特定疾病状态下的炎症性半胱天冬酶激活。该协议描述了如何使用核感染,一种基于电穿孔的转染方法将BiFC半胱天冬酶报告基因引入MDM,如何处理细胞以诱导炎症性半胱天冬酶活化,以及如何使用显微镜方法可视化活性半胱天冬酶复合物。此外,该方法可以适于确定这些复合物的分子组成,亚细胞定位,动力学和这些高度有序结构的大小25,26,27。
研究方案
该协议遵循贝勒医学院人类研究伦理委员会关于操纵人类样本的指导方针。血液样本的处理遵循人体样本的机构安全指南。血液样本在区域血库获得,在那里用柠檬酸磷酸葡萄糖(CPD)溶液收集。然而,用其他抗凝剂如肝素钠,锂肝素或EDTA收集的血液也可用于该方案28,29。
1.人单核细胞的分离和分化成巨噬细胞
- 从区域血库的去识别健康个体处获取抗凝血,并分离外周血单核细胞(PBMC),如下所示。
注意:在组织培养层流罩中执行所有步骤。仅使用无菌管并戴上手套。处理时,在所有与血液相关的产品中添加10%的漂白剂。无菌 PBS (1x) 或 DPBS(无 Ca2+ 和镁2+) 可以互换使用。- 准备稀释缓冲液:补充1x无菌PBS与2%FBS和0.5mM EDTA。
- 制备培养基:补充RPMI-1640培养基FBS(10%(v / v)),谷氨酸(2mM)和青霉素/链霉素(50 I.U./ 50μg/ mL)
- 根据制造商的协议预冷电泳缓冲液(材料表)。
- 用两体积的稀释缓冲液稀释全血。使用血清学移液管,将15 mL抗凝血液转移到含有30 mL稀释缓冲液的50 mL管中。通过反转轻轻混合。
- 对于每10 mL全血或30mL稀释血液,向50 mL空管中加入15mL密度梯度培养基。
- 使用25 mL血清学移液管将步骤1.1.5中的密度梯度培养基与30mL稀释的血液缓慢而稳定地分层。将移液管的尖端保持在管壁上,并将管子以倾斜的角度固定。
- 小心地将管子转移到摆动桶式离心机中。避免干扰这两个阶段。在室温(RT)下以400× g 离心管25分钟,并将加速和减速设置为最小值。
- 使用10 mL移液管小心地去除顶部(透明)等离子体层,并丢弃在含有漂白剂(10%)的容器中。
- 用10mL移液管收集外周血单核细胞(PBMC, 图2)的相间(白色)层,并转移到新鲜的50mL管中。将来自同一供体不同试管的白色层组合在一个 50 mL 的试管中,最高可达 30 mL。
- 用步骤1.1.1中的稀释缓冲液将每管置于50mL的总体积中,并在300× g 和4°C下离心10分钟。用10mL移液管除去上清液,并将其置于含有漂白剂(10%)的容器中。
- 使用p1000微量移液管将每个细胞沉淀重悬于步骤1.1.3的预冷电泳缓冲液中。将来自同一供体的细胞悬浮液合并到新的15 mL管中。使用预冷的电泳缓冲液将每根管的体积降至15 mL,并通过倒置充分混合。
- 从步骤1.1.11取20μL等分试样的细胞悬浮液,并使用1x无菌PBS制备1:100稀释液。使用血细胞计数器确定细胞数量。
- 将步骤1.1.11中的细胞悬浮液在300× g 和4°C下离心10分钟,并用10mL移液管除去上清液。如有必要,使用p200微量移液管完全除去上清液。
- 将分离的PBMC重悬于80μL预冷MACS电泳缓冲液中,用于每1 x 107 个细胞,最多加起来800μL缓冲液。
- 每1×107 个细胞添加20μL抗人CD14微珠,或每个血液样品最多100μL(约100mL未稀释的血液)。通过倒置充分混合,并置于管旋转器上20分钟,在4°C下连续混合。
- 从管旋转器中取出样品,向每个管中加入10mL预冷的电泳缓冲液,并以300× g (加速度= 5,减速= 5)和4°C离心10分钟。
- 用10 mL移液管除去上清液,并将多达1 x 108 个细胞重悬于500μL预冷的电泳缓冲液(2 x 108 / mL)中。
- 根据制造商的说明,使用手动或自动系统(材料表)通过磁性细胞分选来分离CD14阳性细胞。
- CD14阳性选择后,从步骤1.1.18取20μL等分试样的细胞悬浮液,并使用1x无菌PBS制备1:100稀释液。通过在血细胞计数器上计数细胞来确定细胞数。
- 将CD14阳性细胞以300× g 离心并室温10分钟。使用10 mL移液管或真空系统除去上清液。
- 将步骤1.1.20中的细胞沉淀重悬于步骤1.1.2的预热培养基中至最终细胞密度为1×107 个细胞/ mL。
- 将分离的CD14阳性单核细胞以5×106 细胞的细胞密度接种。
- 在10cm组织培养皿上,加入步骤1.1.2中的10mL培养基,并补充50ng / mL粒细胞 - 巨噬细胞集落刺激因子(GM-CSF)。
- 将步骤1.1.21中的0.5mL细胞悬浮液滴加到培养基中,轻轻旋转板。将细胞在加湿的组织培养箱(37°C,5%CO 2)中孵育过夜。
- 第二天,使用真空系统吸出培养基,以除去未附着过夜的细胞。加入10mL补充GM-CSF的新鲜培养基(50ng / mL)并将细胞在加湿组织培养箱(37°C,5%CO2)中孵育7天,以允许完全分化(参见 图3A 了解GM-CSF中不同分化阶段CD14 +单核细胞的外观)。每2-3天更换一次培养基,每次补充新鲜的GM-CSF(50ng / mL)。

图 2:实验工作流程的示意图。请单击此处查看此图的大图。
2. 电穿孔组分的制备
注:本实验方案设计用于 10 μL 氖灯吸头(材料表)。对于每次转染,使用1-2 x 105 个细胞。建议将转染细胞接种在48孔板或8孔室培养皿上(每孔10μL转染细胞)。1x无菌DPBS(不含Ca2 + 和Mg2 +)可用于代替PBS。
- 在第7天,通过用FBS(10%(v / v))和谷氨酸(2mM)补充RPMI-1640培养基来制备无抗生素培养基。
- 将无血清RPMI-1640培养基,胰蛋白酶-EDTA(0.25%)溶液,1x无菌PBS(不含Ca2 + 和Mg2 +)和步骤1.1.2的完全培养基置于37°C水浴中。
- 如果使用玻璃底培养皿(用于共聚焦显微镜检查),请用聚-D-赖氨酸氢溴酸盐涂覆培养皿。
- 用200μL聚-D-赖氨酸氢溴酸盐(0.1mg / mL在1x无菌PBS中)涂覆8个室好的培养皿,并在室温下孵育5分钟。
- 吸出聚-D-赖氨酸溶液,并用1x无菌PBS洗涤玻璃一次。吸出PBS并继续执行步骤2.4。
- 在48孔板或8个孔室培养皿中,每孔加入200μL无抗生素培养基,并在加湿的组织培养箱(37°C,5%CO2)中预孵育,直到准备好接种转染的细胞。
3. 电穿孔电池的制备
注意:在7天分化期结束时,来自10cm培养皿的MDM的产量约为1.5 x 106 个细胞。1x无菌DPBS(不含Ca2 + 和Mg2 +)可用于代替PBS。该方案经过优化,使得大多数巨噬细胞从平板中分离出来,以维持细胞活力和完整性。MDM很难从细胞培养板中分离出来。因此,可能需要执行步骤3.2和3.3两次以解离细胞。确保胰蛋白酶-EDTA(0.25%)的每次孵育时间不超过5分钟。
- 在10cm培养皿上从完全分化的巨噬细胞中抽吸培养基,并用温热的无血清RPMI-1640培养基洗涤细胞单层。确保完全取出培养基。
- 通过每10cm培养皿加入2mL温胰蛋白酶- EDTA(0.25%)溶液来收获细胞,并在加湿组织培养箱(37°C,5%CO2)中孵育5分钟。
- 通过使用p1000微量移液管在整个培养皿区域上下轻轻移液胰蛋白酶-EDTA(0.25%)溶液来完成细胞分离。将细胞悬浮液转移到含有步骤1.1.2中的5mL温完全培养基的15mL锥形管中。
- 将培养皿带到明场显微镜,并检查各种视野中的细胞分离。如果仍有相当数量的细胞附着,请重复步骤3.2-3.3。
- 在室温下以250× g 离心细胞悬浮液5分钟。
- 吸出培养基并将细胞重悬于10mL预热至37°C的1x无菌PBS中。 取20μL等分试样,使用血细胞计数器测定细胞数。
- 每次预期的转染物取1-2×105 个细胞,并放入15毫升管中。使用预热的 1x 无菌 PBS,最终体积为 15 mL。在室温下以250× g 离心5分钟。
- 吸出PBS,并在250× g下再次离心1分钟。使用p200微量移液管从细胞沉淀中除去任何残留的PBS。
4. 半胱天冬酶BiFC成分在人单核来源巨噬细胞中的核效应
注:本实验方案的这一部分是使用氖灯转染系统(材料表)执行的。本实验方案概述了使用10μL氖头转染1-2 x 105 细胞的步骤(材料表)。如果使用 100 μL 氖灯吸头,请相应地放大。避免将细胞暴露于重悬缓冲液R中超过15分钟,因为这可能会降低细胞活力和转染效率。
- 将报告质粒(即mCherry或ds Redmito,100ng / μL)在无核酸酶水或0.5x TE缓冲液中稀释,以可视化转染的细胞。
- 将半胱天冬酶BiFC质粒在无核酸酶水或0.5倍TE缓冲液中稀释至适当浓度,使质粒的总体积不超过10μL总转染体积的30%(即300ng / μL的C1 Pro-VC和300ng / μL的C1 Pro-VN)。
- 每次预期转染制备1.5mL无菌微管,并加入适量的报告质粒(即50ng或0.5μL)和半胱天冬酶BiFC质粒(即300ng或1μLC1 Pro-VC和300ng或1μLC1 Pro-VN片段)。始终将微管保持在引擎盖中。
- 将移液器站、设备、吸头、电穿孔管和移液器放在无菌层流罩中。
注:移液器站、设备、吸头、电穿孔管和移液器都包含在Neon转染系统中。 - 按照制造商的说明,将移液器站上的高压和传感器连接器连接到设备上的后部端口。使移液器站靠近设备。
- 将电源线连接到后面的交流电源插座,然后继续将设备连接到电源插座。按电源开关打开设备。
- 在设备打开并正确连接时显示的启动屏幕中输入转染参数。按 "电压",输入 1000,然后按 "完成" 将电压设置为 1000 V。按" 宽度",输入 40,然后按 "完成" 将脉冲持续时间设置为 40 毫秒。最后,按 #脉冲,输入2,然后按 完成 将电脉冲数设置为2。
- 取其中一个电穿孔管(试剂盒中提供),并在室温处用3 mL电解缓冲液E(对于10μL吸头,在试剂盒中提供)填充它。将电穿孔管插入移液器站上的移液器支架中。确保管子侧面的电极朝内,并且在插入管子时听到咔嗒声。
- 取步骤3.8中的细胞沉淀,并为每个1-2×105 个细胞加入10μL预热的重悬R缓冲液(在试剂盒中提供)。与 p20 微量移液管轻轻混合。向步骤4.3中设置的每个试管中加入10μL细胞悬浮液,并与p20微量移液管轻轻混合。
- 拿起移液器,按下 按钮 插入吸头到第二个停止点。确保夹具完全拾取尖端中活塞的安装杆,并且在移液器的顶部头上没有观察到间隙。
- 要吸出样品,请按移液器 上的按钮到 第一个停止点,然后浸入含有细胞/质粒DNA混合物的第一个管中。将混合物缓慢吸入移液器吸头。
注意:避免气泡,因为它们会在电穿孔过程中引起电弧,如果设备检测到,可能会阻止电脉冲的传递。如果观察到气泡,请将内容物释放到管中,然后再次尝试吸气。 - 将带有样品的移液器非常小心地插入移液器支架中。确保移液器咔嗒声,并且已正确放置。
- 按触摸屏上的 "开始 ",然后等待电脉冲发出。屏幕上的消息将指示完成。
- 从工作站中缓慢取出移液器,然后通过缓慢按下按钮到第一个停止处,立即将转染的细胞悬浮液加入步骤2.4中预热的无抗生素培养基中的相应孔中。
注意:对于同一质粒,该尖端最多可重复使用三次;否则,通过 按下按钮将其 丢弃到生物危害废物容器中,直到第二个停止。 - 对含有细胞/质粒DNA混合物的每个试管重复步骤4.10-4.14。
- 用转染的细胞轻轻摇动板,并在加湿的组织培养箱(37°C,5%CO 2)中孵育1-3小时。
- 从步骤1.1.2向每个孔中加入200μL预热培养基(完整培养基)。再次将培养皿置于加湿的组织培养箱(37°C,5%CO2)中。等待至少24小时进行基因表达。
- 第二天,使用落射荧光显微镜检查细胞活力和转染效率。
- 按照制造商的说明打开落射荧光显微镜和荧光光源盒,并将培养皿放在显微镜载物台上。
- 选择 10x 或 20x 物镜和 568 nm (RFP) 滤光片。
- 要估计细胞活力,请按 透射光LED(TL) 按钮以可视化所选区域中的所有细胞。在观察显微镜目镜时,转动焦点旋钮直到观察到细胞并检查所选区域中的细胞附着。
注意:完全附着的细胞代表活细胞,而浮动细胞代表无活细胞。如果孔的汇合度很高,则非附着细胞的存在可能是高估细胞数量的结果,而不是低活力的结果。然而,低汇合度伴有高含量的浮细胞意味着低活力,这可能是由于电穿孔过程中的电弧,质粒毒性或过度暴露于重悬R缓冲液引起的。不要使用显示后一种行为的孔。 - 要估计转染效率,如上所述,在透射光下聚焦于所选场中的细胞。计算所选字段中的单元格总数。关闭 透射光 LED (TL) 后,按 反射光 LED 按钮 (RL) 打开。
- 精细聚焦报告基因荧光(红细胞)并计数红色荧光细胞的总数。对每孔至少两个油田重复这些步骤(4.18.4-4.18.5)。
5. 转染MDM和半胱天冬酶BiFC数据采集的处理
注意:如果计划使用落射荧光或共聚焦显微镜对细胞进行成像,建议在用所选刺激物治疗1小时之前用qVD-OPh(20μM)处理,以防止半胱天冬酶依赖性细胞死亡(主要是细胞凋亡)。这用于成像以防止细胞由于细胞凋亡而升空,使它们在移出焦平面时很难成像。需要注意的是,半胱天冬酶募集到活化平台和相关的半胱天冬酶BiFC不依赖于半胱天冬酶的催化活性,因此,半胱天冬酶的抑制不会影响这一步骤。
- 转染后约24小时用选定的刺激物治疗,并根据需要孵育每种药物。
- 通过将步骤1.1.2中的培养基与Hepes(20mM,pH 7.2-7.5)和2-巯基乙醇(55μM)补充来制备成像培养基。
- 将所需浓度的刺激物加入预热的成像培养基中,轻轻混合。
- 用p1000微量移液管小心地从细胞中取出培养基,并从步骤5.1.2中向下加入500μL刺激溶液。
- 要运行未经处理的对照孔,请添加没有刺激的成像介质。
- 将细胞在加湿的组织培养箱(37°C,5%CO2)中孵育,只要每次处理需要。
- 使用落射荧光或共聚焦显微镜观察细胞。
- 按照制造商的说明打开显微镜和荧光光源。
- 选择10x或20x物镜,并将培养皿放在显微镜载物台上。
- 使用显微镜目镜,在568nm滤光片下找到细胞,并聚焦在表达dsRedmito / mCherry报告基因(红细胞)的细胞上。
- 计算视野中的所有红细胞并记录数字。
- 在同一视野中,更改为488或512过滤器(GFP或YFP),继续计算同样为绿色(Venus阳性或BiFC阳性)的红色细胞的数量并记录该数字。
- 从至少三个单独的视野中计数至少100 dsRedmito/mCherry阳性细胞。
- 计算每个视野中维纳斯阳性转染细胞的百分比,并平均每次治疗(孔)的结果百分比,以获得标准偏差。
- 使用落射荧光或共聚焦显微镜对细胞进行成像
注意:要使用20倍物镜或更大放大倍率获取共聚焦图像,除非显微镜配备长通物镜,否则应将细胞镀在玻璃培养皿上。- 按照步骤 5.2.1-5.2.3 进行操作。如果使用40x,60x或63x油物镜的共聚焦显微镜,请在物镜上滴一滴油。
- 可视化计算机屏幕上由相机获取的细胞的实时图像。使用落射荧光光源拍摄荧光图像,或将光源切换到激光器进行共聚焦图像。
- 使用操纵杆控制和对焦轮微调单元的焦点和位置。
- 设置 512 nm 或 488 nm(YFP 或 GFP)和 568 nm (RFP) 激光器的激光功率百分比和曝光时间,以便图像中的信号看起来不错且不会达到饱和度。
- 打开实时捕获并检查生成的图像。确保在两个通道的显示直方图中,每个氟都可以看到不同的峰值。
- 根据需要调整激光功率和曝光时间。将这些值保持在尽可能低的水平,同时仍然能够同时检测荧光信号(RFP和GFP /YFP)。
- 在可视化细胞的实时图像时,为板的每个孔拍摄包含一个或多个表达mCherry / dsRedmito报告基因的场的多个代表性图像并保存数据。
结果
图2所示的方案概述了如何获得,转染和成像人MDM.在选定的CD14 +单核细胞与GM-CSF孵育7天后,细胞形态在分化期间发生变化(图3A),从球形悬浮细胞到旋转和完全附着(第3天和第4天), 最后,在完全分化时(第7天)进行更多的扩散细胞。然后将完全分化的细胞从平板中分离出来,并用半胱天冬酶BiFC对(VC和VN)以及报告质粒(例如,dsRedmito,一种编码靶向线粒体的红色荧光蛋白的质粒)转染,用于标记转染细胞(图3B),并用于评估24小时后转染的效率。 显示了使用半胱天冬酶-1 pro BiFC转染细胞用尼日利亚霉素(5μM)处理20小时的BiFC结果示例,尼日利亚红素是一种已知的促炎刺激物,可触发NLRP3炎症小体30,31的组装。未经处理的细胞没有金星荧光(图3B),并且在尼日利亚霉素处理的细胞中,半胱天冬酶-1 BiFC表现为单个点,具有ASC斑点32,33,25的典型形状(图3C)。图3D显示了金星阳性MDM定量的一个例子,在LPS +尼日利亚霉素治疗组中观察到最高百分比的半胱天冬酶-1 BiFC(图3D)。该结果与规范炎小体的激活一致,其中启动信号(LPS)和细胞内信号(nigericin)都需要激活capase-1。
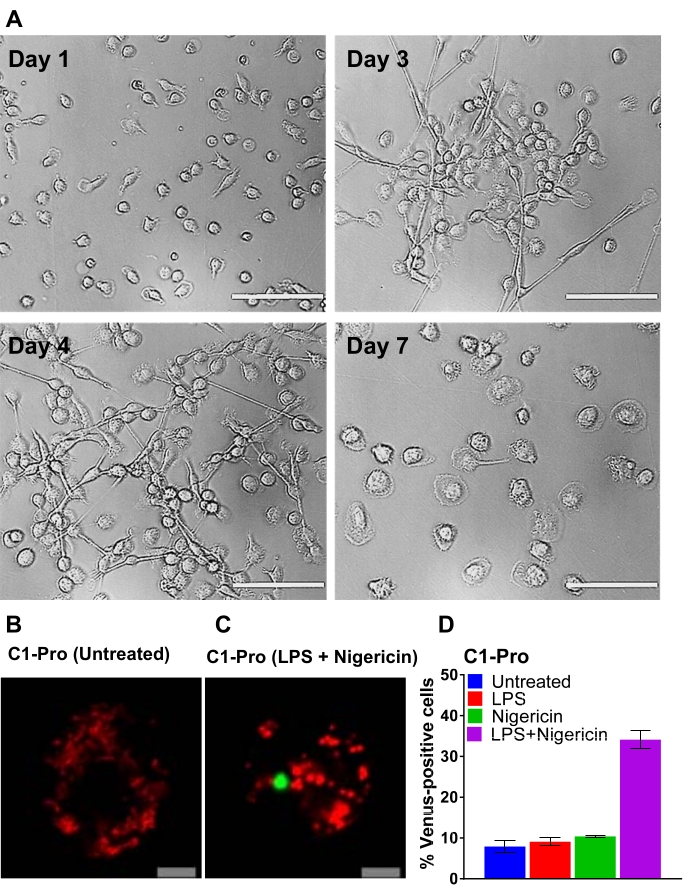
图3:CD14-单核细胞的分化和人MDM的转染(A)在分化的第1,3,4和7天暴露于GM-CSF的外周血CD14 +单核细胞的代表性明场图像(比例尺,100μm)。(B-C)用半胱天冬酶-1亲BiFC对和转染报告基因dsRedmito(50 ng,红色)转染人MDM。24 h后,用和不使用LPS(100ng / mL)启动细胞3小时,并在成像培养基中用尼日利亚霉素(5μM)处理20小时。显示了未处理和尼日利亚霉素处理的细胞的代表性共聚焦图像(比例尺,10μm)。BiFC 以绿色显示。(D)在20小时评估来自(C)的细胞的金星阳性(绿色,半胱天冬酶-1 BiFC复合物)的dsRedmito阳性细胞(红色,转染细胞)的百分比。误差线表示每孔至少两个独立计数的 SD。请点击此处查看此图的大图。
质粒滴定的一个例子如图 4所示,其中转染每个BiFC质粒的量增加。这允许选择质粒的最佳剂量,从而产生特定的信号和最小的背景。 图4A 显示了用血红素处理的人MDM转染的半胱天冬酶-1,-4和-5亲BiFC对(VC和VN)浓度增加的结果,血红素是一种由红细胞破坏引起的高度促炎分子34。半胱天冬酶-1、-4 和 -5 pro BiFC 对的 Venus 阳性细胞比例最高,分别来自转染质粒的 400 ng、500 ng 和 1000 ng。然而,使用最大量的质粒也存在增加非特异性背景的风险(图4B)。例如,转染1000 ng的半胱天冬酶-5亲双FC对会导致近40%的非特异性背景。因此,使用较低的700 ng量被认为是该质粒对的最佳选择(图4B)。在 图4C中,显示了转染后24小时用细胞场的20倍物镜获得的代表性共聚焦图像。在这张图片中,人们可以看到未经处理的转染细胞是基于线粒体的外观(死细胞中的线粒体高度碎片化)和细胞的形态(凋亡细胞萎缩)而存活的。用血红素处理后,半胱天冬酶-1复合物表现为类似于 图3C中由nigericin诱导的单个绿色点,其外观伴随着细胞收缩。
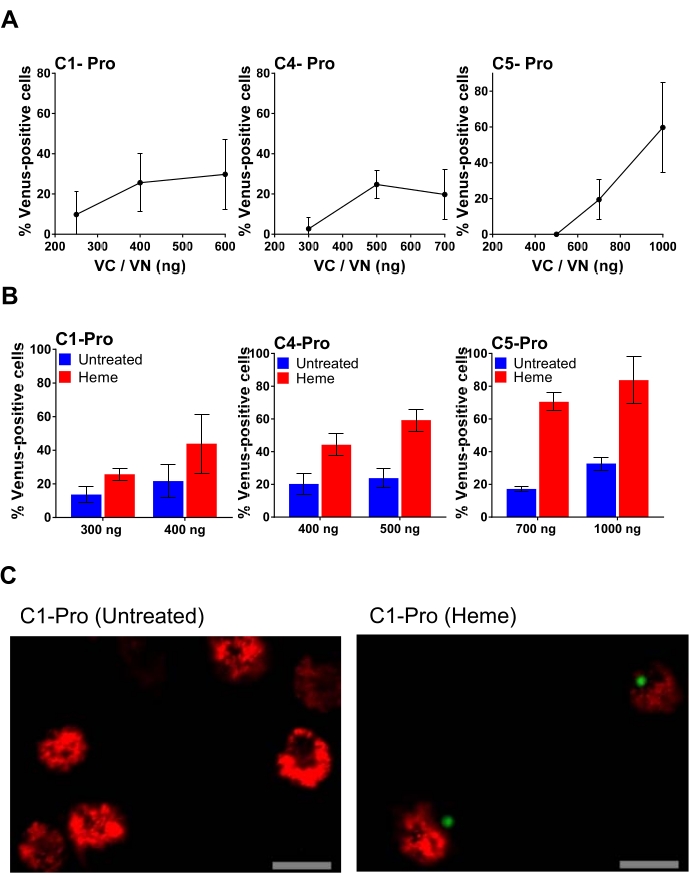
图4:用不同量的炎症性半胱天冬酶pro BiFC对转染的人MDM。半胱天冬酶-4亲;或半胱天冬酶-5亲双FC对。将人MDM与指示量的半胱天冬酶pro BiFC对进行转染,dsRedmito作为转染报告基因(50ng)并孵育过夜。第二天,从所有孔中取出培养基,并在0.1%FBS培养基中用血红素和不含血红素(50μM)处理细胞。1小时后,向所有孔中加入等量的完全培养基以将FBS浓度重构至5%,并防止血红素杀死细胞。在总处理20小时后,评估dsRedmito阳性转染细胞的百分比,这些细胞是Venus阳性,从每孔至少300个细胞中测定。误差线表示每孔至少三个独立计数的 SD。(B)用选定量的半胱天冬酶-1亲转染人MDM;半胱天冬酶-4亲;或半胱天冬酶-5亲双FC对,以及dsRedmito(50 ng)作为转染报告基因。转染后24小时,在0.1%FBS中用或不用血红素(50μM)处理细胞。1小时后,将FBS重组为5%以抑制细胞外血红素。在20小时评估dsRedmito阳性细胞(红色,转染细胞)的百分比,这些细胞在20小时内从每孔至少300个细胞中测定为Venus阳性(绿色,半星叶酶BiFC复合物)。结果表示为百分比金星阳性细胞。误差线表示每孔至少三个独立计数的 SD。(C)在转染后24小时用细胞场的20倍物镜获得的代表性共聚焦图像,并如(B)所述用血红素处理和不使用血红素处理。红色:ds红细胞阳性细胞;绿色:金星阳性细胞;比例尺,20 μm。请点击此处查看此图的大图。
讨论
该协议描述了从从人血液样本中分离的单核细胞中获取巨噬细胞的工作流程,以及一种在不影响细胞活力和行为的情况下将炎症性半胱天冬酶BiFC报告基因有效地引入人MDM的方法。
该协议利用BiFC技术35 用分裂荧光蛋白Venus的非荧光片段标记半胱天冬酶募集结构域(CARD)处的炎症半胱天冬酶。炎症性半胱天冬酶编码由大(p20)和小(p10)亚基组成的催化结构域,以及在其N端或prodomain36 处称为CARD的保守蛋白质 - 蛋白质相互作用基序(图1B)。炎症性半胱天冬酶招募到其激活平台取决于完整的CARD。对于这种方法,生成两个半胱天冬酶prodomain构建体(编码CARD基序),每个构建体都与光稳定黄色蛋白Venus(Venus-C [VC])和Venus-N [VN])的非荧光片段以及荧光转染报告基因一起链接,以允许在半胱天冬酶BiFC报告基因激活之前或没有激活的情况下可视化细胞。只有当相互作用的蛋白质足够接近并允许二聚化和活化时,才观察到荧光(见 图1A)。该过程的效率可以使用标准落射荧光或共聚焦显微镜进行量化。结合单细胞成像,该协议允许可视化在体群中可能无法区分的异步事件,并且根据图像的分辨率,可用于确定与每个半胱天冬酶相关的BiFC复合物的大小和定位。
该方案可以适应通过寡聚激活的一系列蛋白质,其适用性不仅限于显微镜方法。这种方法还允许研究炎症性半胱天冬酶组装的差异需求。例如,siRNA可用于鉴定特定炎症性半胱天冬酶活化的上游成分/需求。半胱天冬酶-BiFC探针和siRNA寡核苷酸(用于沉默靶蛋白)可以同时转染到MDM中。这可以识别潜在的蛋白质伴侣或每个激活平台的基本成分。例如,靶向ASC适配器分子的siRNA寡核苷酸是组装NLRP1,NLRP3和AIM2炎性粒体所必需的,用于表明血红素诱导的半胱天冬酶-1的活化需要这些规范的炎症小体,而半胱天冬酶-4和-5则不是21。这种方法也可以适应延时显微镜,因此可以在单细胞中测定炎症半胱天冬酶活化的动力学。使用这种方法,可以通过监测转染报告基因(mCherry)的荧光损失作为细胞裂解的指示,精确检测BiFC发作的时间相对于细胞经历死亡的时间来评估半胱天冬酶二聚化何时发生。有多种方法可以获取和分析半胱天冬酶BiFC数据;选择将取决于要回答的问题以及可用的显微镜和软件的类型。例如,如果某些显微镜软件提供的自动采集功能可用,则用于确定激活效率的单时点数据以及延时分析可能特别有效。这允许客观成像,因为从多孔板的每个孔中获取预定位置阵列。可以通过视觉检测和使用自动成像软件(如CellProfiler,ImageJ或MATLAB)对图像进行定量,以提高准确性和客观性。
研究原代细胞中的半胱天冬酶途径对于充分了解这些蛋白质的生理作用至关重要。此外,由于半胱天冬酶-4和半胱天冬酶-5在小鼠中被单个半胱天冬酶-11取代,因此能够评估人体细胞至关重要。然而,由于转染效率低且与原代细胞中的许多递送系统相关的毒性,因此很难最大限度地利用可用的基于质粒的报告基因。炎症性半胱天冬酶BiFC方案描述了一种从患者或健康受试者的外周血转染MDM的简单方法,减少了每次转染所需的细胞数量。这使得研究人员能够对巨噬细胞等珍贵细胞进行更复杂的实验,而不会影响细胞活力和细胞特性。使用患者样本的能力提供了能够在特定疾病状态下评估炎症性半胱天冬酶激活的主要优势。事实上,通过一些小的优化,该方案可以很容易地适应其他小鼠或人类原代细胞。
该方案使用基于电穿孔的方法转染MDM.Neon系统特别有利,因为它不会在MDM中诱导IFN-γ反应,这可能会破坏细胞37的特异性免疫反应。这是一种小规模电穿孔系统,使用具有高细胞密度的10μL转染体积,能够有效地将外源DNA转移到大量细胞中。它在细胞膜上产生临时孔,使质粒可以快速通过,避免在化学转染过程中发生的晚期内吞作用,并可能引发质粒降解。该协议使用基于有机酸的缓冲液制剂(缓冲液R),与其他具有氯离子38的缓冲液相比,引入的细胞毒性最小。小体积和移液器吸头室的设计有助于产生均匀的电场,以保持生理条件,从而实现高存活率。转染效率和细胞存活率高度依赖于缓冲液的化学成分、细胞密度、脉冲强度和质粒浓度39。因此,必须针对引入的每种细胞类型和质粒优化这些条件。在MDM中,较低的电压和较长的脉冲持续时间可以更有效地输送质粒,同时保持细胞的活力和健康。因此,该方案使用的设置是1000 V和2个40 ms脉冲,根据细胞在转染后重新附着在板上的能力,转染效率在40-60%之间,细胞活力高于90%。虽然该方案针对人类MDM进行了优化,但将电压设置从500 V更改为1700 V,将脉冲数从1增加到3,测试脉冲长度范围为10至40 ms,可以在其他细胞类型和实验环境中平衡转染效率和细胞活力。
最佳使用双FC技术有几个重要的考虑因素。1)重要的是,用户确定要引入的每个半胱天冬酶质粒的最佳量,因为这可能因不同的蛋白质和细胞类型而异。这是确保测定的最大灵敏度和特异性所必需的。建议在200 ng和1000 ng之间对半胱天冬酶BiFC质粒(VC和VN片段)进行先导滴定,如图4A-B所示。引入的质粒的最佳范围因每个单独的半胱天冬酶而异,因此,必须单独评估它们。选择以最少的背景提供最高比信号的质粒量。理想情况下,背景电平应小于10%,但如果特定信号高,则最多可以使用20%。在分化、转染和治疗过程中避免恶劣条件和过度操作这些细胞也至关重要。这也可以导致自发激活,并且高背景水平的半胱天冬酶激活可以掩盖特定结果,因为免疫细胞如单核细胞或巨噬细胞的激活是一个自然过程,在那里它们可以获得促炎功能40。如果使用患者细胞,则可能很难控制炎症小体激活水平和遗传背景的某些固有差异,这些差异可以使它们对局部微环境中的刺激和变化敏感或脱敏。例如,巨噬细胞功能可能在免疫功能低下的个体或抵抗感染的个体中受到影响,因为这种类型的细胞具有重要的稳态功能,并参与控制炎症等功能。在确定高背景是非特异性还是生物效应时,需要考虑这些遗传和环境因素。使用紧密匹配的健康对照(例如,性别和年龄匹配)可以帮助评估高背景水平的半链酶BiFC的生物学意义。2)以等量引入VC和VN片段至关重要,因为一个Venus片段的不相等表达可能导致以更高的频率招募到平台并掩盖完整的荧光信号,产生假阴性结果。因此,在每次转染之前,应验证每个质粒的完整性和浓度,以避免引入不同量的VC和VN片段。3)由于这种方法基于半胱天冬酶报告基因的外源性表达,因此应包括额外的特异性对照。半胱天冬酶-BiFC构建体含有单点突变,这些突变破坏了半胱天冬酶与其激活平台之间的结合,或者使用siRNA沉默了激活平台的一种成分,可用于确认荧光信号是由于半胱天冬酶与炎症小体的特异性结合。这种对照实验应该导致金星阳性细胞水平的降低。4)半胱天冬酶BiFC构建体的表达可能引发或影响下游事件,如细胞死亡。为了规避这种情况,建议双FC报告者使用半胱天冬酶的非酶版本,例如半胱天冬酶前结构域或全长半胱天冬酶,其中催化半胱氨酸残基发生突变和失活。为了进一步控制这一点,应将未转染处理和未处理的对照孔包括在实验中,并应表现出与转染孔相似的行为。5)内源性半胱天冬酶活性可能会影响BiFC读数。为了控制这一点,人们可以在缺乏所研究的半胱天冬酶的细胞中表达半胱天冬酶报告基因,并期望BiFC效率是相同的。
这种方法的主要缺点之一是它不测量半胱天冬酶活 化本身, 而是测量活化发生所需的诱导接近步骤。这是一个微妙但重要的区别。根据设计,prodomain不包含实际二聚的半胱天冬酶的催化结构域。因此,金星碎片的重折叠和荧光充当半胱天冬酶二聚化的代表,因为它们只有在半胱天冬酶足够接近二聚时才能重折叠。因此,BiFC专门测量诱导接近。催化结构域中的翻译后修饰可能会阻碍二聚化而不影响BiFC信号。例如,半胱天冬酶-2在其催化结构域上被磷酸化,这阻碍了二聚化而不阻止半胱天冬酶-2招募到其活化平台41。因此,使用BiFC方法的观察必须与功能研究相辅相成,以确认观察到的荧光是半胱天冬酶活化的代表。尽管有这个缺点,但如果包括这里讨论的对照,则半胱天冬酶BiFC诱导接近的测量可以提供特定半胱天冬酶活化的准确表示。
总之,半胱天冬酶BiFC是分析炎症小体水平动态半胱天冬酶相互作用的有力工具。该协议允许询问活免疫细胞中的炎症半胱天冬酶信号级联。这种方法不仅提供了一种技术来特异性和准确地测量半胱天冬酶激活的第一步,而且通过应用于原代免疫细胞,有可能揭示使用常规方法无法识别的炎症性半胱天冬酶的特性。
披露声明
作者声明,他们没有相互竞争的经济利益。
致谢
我们感谢LBH实验室过去和现在的成员,他们为这项技术的发展做出了贡献。该实验室由NIH / NIDDK T32DK060445(BEB),NIH / NIDDK F32DK121479(BEB),NIH / NIGMS R01GM121389(LBH)提供支持。图2是使用Biorender软件绘制的。
材料
| Name | Company | Catalog Number | Comments |
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
参考文献
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1867 (6), 118688(2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761(2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97(1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813(2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316(2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502(2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What's the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。