Method Article
הדמיה של קספאזות דלקתיות המושרות קרבה במקרופאגים שמקורם במונוציטים אנושיים
In This Article
Summary
פרוטוקול זה מתאר את זרימת העבודה להשגת מקרופאגים שמקורם במונוציטים (MDM) מדגימות דם אנושיות, שיטה פשוטה להחדרה יעילה של כתבי השלמה פלואורסצנטית דו-עינית (BiFC) של קספאזה דלקתית ל-MDM אנושי מבלי להתפשר על הכדאיות וההתנהגות של התאים, וגישה מבוססת הדמיה למדידת הפעלת קספאזה דלקתית בתאים חיים.
Abstract
קספאזות דלקתיות כוללות קספאזה-1, -4, -5, -11 ו -12 ושייכות לתת-קבוצה של קספאזות יוזמות. Caspase-1 נדרש להבטיח ויסות נכון של איתות דלקתי ומופעל על ידי דימריזציה הנגרמת על ידי קרבה לאחר גיוס לדלקת. קספאז-1 מצוי בשפע בשושלת התאים המונוציטית וגורם להבשלה של הציטוקינים הפרו-דלקתיים אינטרלוקין (IL)-1β ו-IL-18 למולקולות מופרשות פעילות. הקספאזות הדלקתיות האחרות, קספאזה-4 ו--5 -(וההומלוגיה שלהן מורין קספאזה-11) מקדמות את שחרור IL-1β על ידי גרימת פירופטוזיס. השלמה פלואורסצנטית דו-מולקולרית של קספאזה (BiFC) היא כלי המשמש למדידת קרבה הנגרמת על ידי קספאזה דלקתית כקריאה של הפעלת קספאזה. הקספאזה-1, -4 או -5 פרודומיין, המכילה את האזור הנקשר לדלקת, מתמזגת עם שברים לא פלואורסצנטיים של החלבון הפלואורסצנטי הצהוב נוגה (Venus-N [VN] או Venus-C [VC]) הקשורים לרפורמה בקומפלקס נוגה הפלואורסצנטי כאשר הקספאזות עוברות קרבה מושרית. פרוטוקול זה מתאר כיצד להכניס את הכתבים האלה למקרופאגים ראשוניים שמקורם במונוציטים אנושיים (MDM) באמצעות נוקליאופקציה, לטפל בתאים כדי לגרום להפעלת קספאזה דלקתית ולמדוד את הפעלת הקספאזה באמצעות פלואורסצנציה ומיקרוסקופיה קונפוקלית. היתרון של גישה זו הוא שניתן להשתמש בה כדי לזהות את המרכיבים, הדרישות והלוקליזציה של קומפלקס הפעלת הקספאז הדלקתי בתאים חיים. עם זאת, יש לשקול בקרות זהירות כדי למנוע פגיעה בכדאיות ובהתנהגות של התאים. טכניקה זו היא כלי רב עוצמה לניתוח של אינטראקציות קספאז דינמיות ברמה הדלקתית, כמו גם לחקירת מפלי האיתות הדלקתיים ב- MDM חי ובמונוציטים שמקורם בדגימות דם אנושיות.
Introduction
הקספאזות הן משפחה של פרוטאזות ציסטאין אספרטט שניתן לקבץ לתוך קספאזות יוממות וקספאזות תליין. קספאזות תליין כוללות קספאזה-3, -6 ו -7. הם נמצאים באופן טבעי בתאים כדימרים ונבקעים על ידי הקספאזות היוזמות לביצוע אפופטוזיס1. קספאזות יוזמות כוללות קספאזה אנושית-1, -2, -4, -5, -8, -9, -10 ו -12. הם נמצאים כזימוגנים לא פעילים (פרו-קספאזות) המופעלים על ידי דימריזציה הנגרמת על ידי קרבה ומיוצבים על ידי ביקוע פרוטאוליטי אוטומטי 2,3. הקספאזות הדלקתיות הן תת-קבוצה של הקספאזות היוזם2 וכוללות את קספאזה-1, -4, -5 ו-12- בבני אדם, ואת קספאזה-1, -11 ו--12 בעכבר 4,5. במקום תפקיד אפופטוטי, הם ממלאים תפקיד מרכזי בדלקת. הם מתווכים עיבוד פרוטאוליטי והפרשת פרו-אינטרלוקין (IL)-1β ופרו-IL-18 6,7, שהם הציטוקינים הראשונים ששוחררו בתגובה לפולשים פתוגניים 8,9. Caspase-1 מופעלת עם גיוס לפלטפורמת ההפעלה שלה; קומפלקס חלבונים גדול במשקל מולקולרי המכונה הדלקת (איור 1A)10. דימריזציה של קספאזה-4, -5 ו--11- מתרחשת באופן בלתי תלוי בפלטפורמות אלה באמצעות מסלול דלקתי לא קנוני11,12.
דלקת קנונית היא קומפלקסים של חלבונים רב-מתכתיים ציטוזוליים המורכבים מחלבון חיישן מודלק, חלבון המתאם ASC (חלבון דמוי כתם הקשור לאפופטוזיס המכיל CARD), והחלבון המשפיע קספאזה-110. האינפלמזומים הקאנוניים הנחקרים ביותר הם משפחת הקולטנים דמויי ה-NOD המכילים תחום פירין (NLRP), NLRP1 ו-NLRP3, משפחת ה-NLR המכילה כרטיס (NLRC), NLRC4, וההיעדרות במלנומה 2 (AIM2). כל אחד מהם מכיל תחום פירין, כרטיס או שני התחומים. תחום ה-CARD מתווך את האינטראקציה בין קספאזות המכילות כרטיס לבין המפעילים שלהן במעלה הזרם. לכן, מולקולת הפיגום ASC, המורכבת מתחום פירין N-terminal (PYD) וממוטיב C-terminal CARD13,14, נדרשת לגיוס של קספאזה-1 לדלקת NLRP110, NLRP315 ו-AIM216.
כל דלקת נקראת על שם חלבון החיישנים הייחודי שלה שמזהה גירויים פרו-דלקתיים מובהקים (איור 1B). מפעילים של מסלול זה נקראים גירויים קנוניים. דלקות משמשות כחיישנים למרכיבים מיקרוביאליים ולמתח ברקמות, ומורכבות כדי לעורר תגובה דלקתית חזקה באמצעות הפעלה של הקספאזות הדלקתיות17. הרכבה דלקתית יוזמת הפעלת caspase-1 כדי לתווך התבגרות והפרשת המצעים העיקריים שלה pro-IL-1β ו- pro-IL-18. תהליך זה מתרחש באמצעות מנגנון דו-שלבי. ראשית, גירוי ראשוני מעלה את הביטוי של חלבונים דלקתיים מסוימים ופרו-IL-1β באמצעות הפעלה של מסלול NF-κB. שנית, גירוי תוך-תאי (קנוני) משרה הרכבה וגיוס של פרוקספאזה-1 6,7.
קספאזה-4 וקספאזה-5 הם האורתולוגים האנושיים של מורין קספאזה-1111 11. הם מופעלים באופן בלתי תלוי בדלקת על ידי ליפופוליסכריד תוך-תאי (LPS), מולקולה שנמצאת בקרום החיצוני של חיידקים גראם שליליים 18,19,20, ועל ידי heme חוץ-תאי, תוצר של המוליזה של תאי דם אדומים21. הוצע כי LPS נקשר ישירות למוטיב CARD של חלבונים אלה ומשרה את האוליגומריזציה שלהם20. הפעלה של קספאזה-4 או קספאזה-5 מקדמת שחרור IL-1β על ידי גרימת צורה דלקתית של מוות תאי הנקראת פירופטוזיס באמצעות מחשוף של החלבון יוצר הנקבוביות gasdermin D (GSDMD)18,19. בנוסף, השטף של יוני אשלגן הנובע ממוות פירופטוטי בתיווך קספאזה-4 ו-GSDMD גורם להפעלה של דלקת NLRP3 והפעלה לאחר מכן של קספאזה-122,23. לכן, caspase-4, -5 ו--11 נחשבים לחיישנים תוך-תאיים עבור LPS המסוגלים לגרום לפירופטוזיס והפעלת קספאזה-1 בתגובה לגירויים ספציפיים11,24.

איור 1: קספאזות דלקתיות ובדיקת השלמה פלואורסצנטית של קספאזה-בימולקולרית (BiFC). (A) דיאגרמה המציגה את מערכת הקספאזה-BiFC, שבה שני פרודומיינים של קספאזה-1 (C1-pro) המקושרים לכל מקטע שאינו פלואורסצנטי של נוגה (Venus-C או Venus-N) מגויסים לפלטפורמת ההפעלה NLRP3, מה שמאלץ את נוגה לחזור ולפלואורסצנט. קומפלקס זה מופיע כנקודה ירוקה מתחת למיקרוסקופ ומשמש כקריאה לקרבה דלקתית המושרה על ידי קספאזה, שהיא הצעד הראשון בהפעלת קספאזה יזומה. (B) סכמטי המציג את ארגון התחום של רכיבים דלקתיים וקספאזות דלקתיות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
מדידת הפעלת קספאזות יוזמות ספציפיות היא קשה, ואין הרבה שיטות זמינות לעשות זאת על ידי גישות הדמיה. ניתן להשתמש בהשלמת פלואורסצנציה דו-מולקולרית של קספאזה (BiFC) כדי לדמיין הפעלת קספאזה דלקתית ישירות בתאים חיים (איור 1A)25. טכניקה זו הותאמה לאחרונה לשימוש במקרופאג'ים שמקורם במונוציטים אנושיים (MDM)21. Caspase BiFC מודד את הצעד הראשון בהפעלת קספאזה דלקתית, קרבה מושרית כדי להקל על דימריזציה. נעשה שימוש בביטוי של פלסמידים המקודדים את ה-caspase prodomain המכיל CARD, שהתמזגו עם שברים שאינם פלואורסצנטיים של החלבון הפלואורסצנטי הצהוב הניתן לצילום נוגה (Venus-C [VC]) ו-Venus-N [VN]). כאשר שני הפרודומים של הקספאזה מגויסים לפלטפורמת ההפעלה שלהם או עוברים קרבה מושרית, שני חצאי נוגה מובאים בסמיכות ונאלצים להתאושש ולהפלואורס (ראו איור 1A,B). זה מספק קריאה בזמן אמת של הפעלת קספאזה דלקתית ספציפית.
MDM אנושי מבטא בשפע גנים דלקתיים וקולטנים לזיהוי דפוסים המזהים אותות סכנה ומוצרים פתוגנים. זה מספק סוג תא אידיאלי לחקירת מסלולי קספאזה דלקתיים. בנוסף, הם יכולים להיות נגזרים מדם היקפי ואפילו מדגימות חולים כדי להעריך הפעלת קספאזה דלקתית במצב מחלה מסוים. פרוטוקול זה מתאר כיצד להכניס את כתבי הקספאזה של BiFC ל-MDM באמצעות נוקליאופקציה, שיטת טרנספקציה מבוססת אלקטרופורציה, כיצד לטפל בתאים כדי לגרום להפעלת קספאזה דלקתית, וכיצד לדמיין את קומפלקסי הקספאזה הפעילים באמצעות גישות מיקרוסקופיה. בנוסף, ניתן להתאים מתודולוגיה זו כדי לקבוע את ההרכב המולקולרי של קומפלקסים אלה, לוקליזציה תת-תאית, קינטיקה וגודלם של מבנים מסודרים אלה 25,26,27.
Protocol
פרוטוקול זה תואם את ההנחיות של ועדת האתיקה של המחקר האנושי של מכללת ביילור לרפואה למניפולציה של דגימות אנושיות. דגימות הדם מטופלות בהתאם להנחיות הבטיחות המוסדיות לדגימות אנושיות. דגימות דם מתקבלות בבנק דם אזורי, שם הן נאספות עם תמיסת ציטראט פוספט דקסטרוז (CPD). עם זאת, דם שנאסף עם נוגדי קרישה אחרים כמו נתרן הפרין, ליתיום הפרין, או EDTA יכול לשמש גם עבור פרוטוקול זה28,29.
1. בידוד מונוציטים אנושיים והתמיינות למקרופאגים
- השג דם נוגד קרישה מאנשים בריאים שאינם מזוהים בבנק דם אזורי ובודד תאים חד-גרעיניים בדם היקפי (PBMCs) כפי שמצוין להלן.
הערה: בצע את כל השלבים במכסה זרימה למינרי של תרבית רקמה. השתמשו בצינורות סטריליים בלבד ולבשו כפפות. הוסיפו 10% אקונומיקה לכל המוצרים הקשורים לדם בעת השלכתם. PBS סטרילי (1x) או DPBS (ללא Ca2+ ומ"ג2+) ניתן להשתמש לסירוגין.- הכינו את מאגר הדילול: תוסיפו 1x PBS סטרילי עם 2% FBS ו-0.5 mM EDTA.
- הכינו את מדיום התרבית: תוסף RPMI-1640 בינוני עם FBS (10% (v/v)), גלוטמקס (2 mM) ופניצילין/סטרפטומיצין (50 I.U./50 מיקרוגרם/מ"ל)
- Precool את מאגר הריצה (טבלת חומרים) על פי פרוטוקול היצרן.
- לדלל דם שלם עם שני כרכים של מאגר דילול. באמצעות פיפטה סרולוגית, מעבירים 15 מ"ל של הדם נוגד הקרישה לצינור 50 מ"ל המכיל 30 מ"ל של מאגר הדילול. מערבבים בעדינות על ידי היפוך.
- עבור כל 10 מ"ל של דם שלם או 30 מ"ל של דם מדולל, להוסיף 15 מ"ל של מדיום שיפוע הצפיפות לצינור ריק של 50 מ"ל.
- שכבה את מדיום שיפוע הצפיפות משלב 1.1.5 עם 30 מ"ל של דם מדולל לאט ובהתמדה באמצעות פיפטה סרולוגית של 25 מ"ל. שמור את קצה הפיפטה על דופן הצינור והצינור בזווית מוטה.
- העבר בזהירות את הצינורות לצנטריפוגה של דלי מתנדנד. הימנעו מלהפריע לשני השלבים. צנטריפוגה של הצינורות ב-400 x גרם בטמפרטורת החדר (RT) למשך 25 דקות עם האצה והאטה המוגדרות לערך המינימלי.
- יש להסיר בזהירות את שכבת הפלזמה העליונה (השקופה) באמצעות פיפטה של 10 מ"ל ולהשליך למיכל עם אקונומיקה (10%).
- אספו את השכבה האינטרפאזית (הלבנה) של תאים חד-גרעיניים בדם היקפי (PBMCs, איור 2) עם פיפטה של 10 מ"ל והעבירו לצינור טרי של 50 מ"ל. שלב את השכבה הלבנה מצינורות שונים של אותו תורם בצינור 50 מ"ל עד 30 מ"ל.
- הביאו כל צינור לנפח כולל של 50 מ"ל עם חיץ הדילול משלב 1.1.1 והצנטריפוגה ב-300 x גרם ו-4 מעלות צלזיוס למשך 10 דקות. מוציאים את הסופרנטנט עם פיפטה של 10 מ"ל ומשליכים אותו למיכל עם אקונומיקה (10%).
- בצעו החייאה של כל כדור תא ב-1 מ"ל של מאגר הריצה המקורר מראש משלב 1.1.3 באמצעות מיקרו-פיפט p1000. שלבו את מתלי התאים מאותו תורם בצינור חדש של 15 מ"ל. הביאו את הנפח של כל צינור ל-15 מ"ל עם מאגר ריצה מקורר מראש וערבבו היטב על ידי היפוך.
- קח 20 μL aliquot של תרחיף התא משלב 1.1.11 ולהכין דילול 1:100 באמצעות 1x PBS סטרילי. קבע את מספר התא באמצעות המוציטומטר.
- צנטריפוגה את מתלה התא משלב 1.1.11 ב 300 x g ו 4 °C למשך 10 דקות ולהסיר את supernatant עם pipet 10 מ"ל. במידת הצורך, השתמש במיקרופיפט p200 כדי להסיר את הסופרנטנט לחלוטין.
- בצעו שימוש חוזר במחשבים המבודדים ב-80 μL של מאגר ריצה MACS מקורר מראש עבור כל אחד מ-1 x 107 תאים, והוסיפו עד למקסימום של 800 μL של המאגר.
- הוסף 20 μL של CD14 MicroBeads אנטי-אנושיים לכל אחד 1 x 107 תאים או עד 100 μL לכל דגימת דם (~ 100 מ"ל של דם לא מדולות). ערבבו היטב על ידי היפוך והניחו על סיבוב צינור למשך 20 דקות עם ערבוב רציף בטמפרטורה של 4 מעלות צלזיוס.
- הסר את הדגימות ממסובב הצינור, הוסף 10 מ"ל של מאגר ריצה מקורר מראש לכל צינור, וצנטריפוגה ב- 300 x g (תאוצה = 5, האטה = 5) ו- 4 ° C למשך 10 דקות.
- הסר את ה-supernatant עם פיפטה של 10 מ"ל ובצע החייאה של עד 1 x 108 תאים ב-500 μL של מאגר ריצה מקורר מראש (2 x 108/mL).
- בצע את הבידוד של תאים חיוביים ל-CD14 על-ידי מיון תאים מגנטיים באמצעות מערכת ידנית או אוטומטית (טבלת חומרים) בהתאם להוראות היצרן.
- קח 20 μL aliquot של תרחיף התא משלב 1.1.18 לאחר בחירה חיובית CD14 והכן דילול 1:100 באמצעות 1x PBS סטרילי. קבע את מספר התא על-ידי ספירת התאים בהמוציטומטר.
- צנטריפוגה של התאים החיוביים ל-CD14 ב-300 x g ו-RT למשך 10 דקות. הסר את הסופרנטנט באמצעות פיפט 10 מ"ל או מערכת ואקום.
- בצעו החייאה של גלולת התא משלב 1.1.20 בתווך תרבית שחומם מראש משלב 1.1.2 ועד לצפיפות תאים סופית של 1 x 107 תאים/מ"ל.
- זרעו את המונוציטים המבודדים החיוביים ל-CD14 בצפיפות תאים של 5 x 106 תאים.
- בצלחת תרבית רקמה של 10 ס"מ, הוסיפו 10 מ"ל של מדיום תרבית משלב 1.1.2 בתוספת 50 ננוגרנוציטים-מקרופאגים-גורם מגרה מושבה (GM-CSF).
- הוסיפו 0.5 מ"ל של מתלי התא משלב 1.1.21 למדיום התרבית באופן טיפתי וסובבו בעדינות את הצלחת. דגירה של תאים באינקובטור תרבית רקמה לח (37 °C (37 °C (37 °C, 5% CO2) במהלך הלילה.
- למחרת, שאפו למדיום באמצעות מערכת ואקום כדי להסיר תאים שלא התחברו במשך הלילה. הוסיפו 10 מ"ל של תרבית טרייה עם תוספת GM-CSF (50 ננוגרים/מ"ל) ותאי דגירה באינקובטור תרביות רקמה לח (37 מעלות צלזיוס, 5% CO2) למשך 7 ימים כדי לאפשר התמיינות מלאה (ראו איור 3A להופעת מונוציטים מסוג CD14+ בשלבים שונים של התמיינות ב-GM-CSF). החליפו את מדיום התרבות כל 2-3 ימים והשלימה עם GM-CSF טרי (50 ננוגרם/מ"ל) בכל פעם.

איור 2: סקירה סכמטית של זרימת העבודה הניסויית.אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. הכנת רכיבי אלקטרופורציה
הערה: פרוטוקול זה מיועד לקצה של 10 μL-Neon (טבלת חומרים). עבור כל טרנספקציה, השתמש ב- 1-2 x 105 תאים. מומלץ לזרוע תאים שעברו טרנספקציה על צלחת של 48 בארות או על צלחת בעלת 8 תאים (10 תאים שעברו טרנספקטציה של μL לבאר). ניתן להשתמש ב-1x DPBS סטרילי (ללא Ca2+ ו-Mg2+) במקום PBS.
- ביום ה-7, הכינו מדיום ללא אנטיביוטיקה על ידי תוסף RPMI-1640 בינוני עם FBS (10% (v/v)) וגלוטמקס (2 mM).
- יש להניח תמיסת RPMI-1640 בינונית ללא סרום, תמיסת טריפסין-EDTA (0.25%), 1x PBS סטרילי (ללא Ca2+ ו-Mg2+), ומדיום תרבית מלא משלב 1.1.2 באמבט מים של 37 מעלות צלזיוס.
- אם משתמשים בכלים עם תחתית זכוכית (למיקרוסקופיה קונפוקלית) מצפים את הכלים בפולי-D-ליזין הידרוברומיד.
- מצפים 8 צלחת עם 200 μL של פולי-D-ליזין הידרוברומיד (0.1 מ"ג/מ"ל ב-1x PBS סטרילי) ומדגרים למשך 5 דקות ב-RT.
- לשאוף את תמיסת הפולי-D-ליזין ולשטוף את הכוס פעם אחת עם 1x PBS סטרילי. שאפו את ה-PBS והמשיכו עם שלב 2.4.
- הוסיפו 200 μL של מדיום ללא אנטיביוטיקה לכל באר של צלחת הבאר 48 או 8 צלחת עם תאים היטב ודגירה מוקדמת באינקובטור תרביות רקמה לחות (37 °C ,5% CO2) עד שיהיה מוכן לצלוח את התאים שעברו טרנספקטציה.
3. הכנת תאים לאלקטרופורציה
הערה: התפוקה של MDM מצלחת של 10 ס"מ בסוף תקופת ההתמיינות בת 7 הימים היא בערך 1.5 x 106 תאים. ניתן להשתמש ב-1x DPBS סטרילי (ללא Ca2+ ו-Mg2+) במקום PBS. פרוטוקול זה הותאם כך שרוב המקרופאגים מנותקים מהצלחת עם שמירה על הכדאיות והשלמות של התא. קשה לנתק MDM מלוחות תרבית תאים. לכן, ייתכן שיהיה צורך לבצע שלבים 3.2 ו 3.3 פעמיים כדי לנתק את התאים. ודא שכל זמן דגירה עם טריפסין-EDTA (0.25%) לא יעלה על 5 דקות.
- שאפו את המדיה מקרופאגים מובחנים לחלוטין על כלים בקוטר 10 ס"מ ושטפו את חד שכבת התאים במדיום RPMI-1640 חם ללא סרום. הקפידו להסיר לחלוטין את המדיום.
- קוצרים את התאים על ידי הוספת 2 מ"ל של תמיסת טריפסין-EDTA חמה (0.25%) לכל מנה של 10 ס"מ ודגירה באינקובטור תרביות רקמה לח (37 מעלות צלזיוס, 5% CO2) למשך 5 דקות.
- השלם את ניתוק התא על ידי צנרת עדינה של תמיסת טריפסין-EDTA (0.25%) למעלה ולמטה על פני כל אזור המנה באמצעות מיקרופיפט p1000. העבר את מתלי התא לצינור חרוטי של 15 מ"ל המכיל 5 מ"ל של מדיום תרבית מלאה חמה משלב 1.1.2.
- קחו את המנה למיקרוסקופ שדה בהיר ובדקו אם יש ניתוק תאים בתחומי ראייה שונים. אם יש כמות ניכרת של תאים שעדיין מחוברים, חזור על שלבים 3.2-3.3.
- צנטריפוגה את מתלה התא ב 250 x g למשך 5 דקות ב- RT.
- לשאוף את המדיום ולהחיות את התאים ב 10 מ"ל של 1x PBS סטרילי מחומם מראש ל 37 מעלות צלזיוס. קח 20 μL aliquot כדי לקבוע את מספר התא באמצעות המוציטומטר.
- קח 1-2 x 105 תאים לכל טרנספקציה מיועדת והנח בצינור 15 מ"ל. הביאו לנפח סופי של 15 מ"ל עם PBS סטרילי מחומם מראש 1x. צנטריפוגה ב 250 x g במשך 5 דקות ב RT.
- שאפו ל-PBS ולצנטריפוגה פעם נוספת במשך דקה אחת ב-250 x גרם. הסר כל PBS שיורי מכדור התא באמצעות מיקרופיפט p200.
4. נוקלאופציה של רכיבי BiFC קספאזה למקרופאגים שמקורם במונוציטים אנושיים
הערה: חלק זה של הפרוטוקול מבוצע באמצעות מערכת העברת ניאון (טבלת חומרים). פרוטוקול זה מתאר את השלבים להעתקה של תאים בגודל 1-2 x 1010 5 באמצעות קצה ניאון של 10 מיקרול (טבלת חומרים). אם משתמשים בקצה ניאון של 100 μL, הגדל את קנה המידה בהתאם. הימנעו מחשיפת תאים למאגר החייאה R למשך יותר מ-15 דקות, מכיוון שהדבר עלול להפחית את כדאיות התאים ואת יעילות הטרנספקציה.
- דיללו את הפלסמיד של הכתב (כלומר, mCherry או dsRedmito ב-100 ng/μL) במים נטולי נוקלאז או ב-0.5x TE buffer כדי לדמיין את התאים שעברו טרנספקטציה.
- דיללו את הפלסמידים של Caspase BiFC לריכוז מתאים במים נטולי נוקלאזות או במאגר TE של 0.5x, כך שהנפח הכולל של הפלסמידים לא יעלה על 30% מנפח הטרנספקציה הכולל של 10 μL (כלומר, 300 ng/μL של C1 Pro-VC ו-300 ng/μL של C1 Pro-VN).
- הכן מיקרו-צינורית סטרילית של 1.5 מ"ל לכל טרנספקציה מיועדת והוסף את הכמות המתאימה של פלסמיד כתב (כלומר, 50 ננוגרם או 0.5 μL) ופלסמידי BiFC של קספאזה (כלומר, 300 ננוגרם או 1 μL של C1 Pro-VC ו- 300 ng או 1 μL של שבר C1 Pro-VN). שמור את המיקרו-צינוריות במכסה המנוע בכל עת.
- מניחים את תחנת הפיפטה, המכשיר, הקצוות, צינורות האלקטרופורציה והפיפטה במכסה מנוע זרימה למינרי סטרילי.
הערה: תחנת הפיפטה, המכשיר, הטיפים, צינורות האלקטרופורציה והפיפטה כלולים במערכת הניאון טרנספקציה. - חבר את מחבר המתח הגבוה והחיישן בתחנת הפיפטה ליציאות האחוריות בהתקן בהתאם להוראות היצרן. שמור את תחנת הפיפטה קרוב למכשיר.
- חבר את כבל החשמל לכניסת החשמל האחורית והמשך לחבר את ההתקן לשקע החשמל. לחץ על מתג ההפעלה כדי להפעיל את ההתקן.
- הזן את הפרמטרים של Transfection במסך ההפעלה המוצג כאשר ההתקן מופעל ומחובר כראוי. לחץ על מתח, הזן 1000 ולחץ על בוצע כדי להגדיר את המתח ל- 1000 V. לחץ על רוחב, הזן 40 ולחץ על בוצע כדי להגדיר את משך הדופק ל- 40 אלפיות השנייה. לבסוף, לחץ על # פולסים, הזן 2 ולחץ על בוצע כדי להגדיר את מספר הפולסים החשמליים ל -2.
- קח את אחד מצינורות האלקטרופורציה (המסופקים בערכה) ומלא אותו ב-3 מ"ל של חיץ אלקטרוליטי E (עבור 10 μL טיפים ומסופקים בערכה) ב- RT. הכנס את צינור האלקטרופורציה למחזיק הפיפטה בתחנת הפיפטה. ודא כי האלקטרודה בצד הצינור פונה פנימה וכי צליל לחיצה נשמע כאשר הצינור מוכנס.
- קח את גלולת התא משלב 3.8 והוסף 10 μL של חיץ R של החייאה שחוממה מראש (מסופק בערכה) עבור כל 1-2 x 105 תאים. יש לערבב בעדינות עם מיקרופיפט p20. הוסיפו 10 μL של תרחיף התא לכל צינור המוגדר בשלב 4.3 וערבבו בעדינות עם מיקרופיפט p20.
- קח את הפיפטה והוסף קצה על ידי לחיצה על לחצן הלחיצה לתחנה השנייה. יש לוודא שהמהדק מרים לחלוטין את גזע ההרכבה של הבוכנה בקצה וכי לא נצפה רווח בראש העליון של הפיפטה.
- כדי לשאוף לדגימה, לחצו על כפתור הלחיצה בפיפטה לתחנה הראשונה וטבלו בצינור הראשון המכיל את תערובת הדנ"א של התאים/פלסמידים. לאט לאט שואפים את התערובת לתוך קצה הפיפטה.
הערה: הימנעו מבועות אוויר מכיוון שהן עלולות לגרום לקשת במהלך אלקטרופורציה, ואם המכשיר מזהה אותן, הן יכולות למנוע את אספקת הדופק החשמלי. אם נצפות בועות אוויר, שחררו את התוכן לתוך הצינור ונסו לשאוף שוב. - הכנס את הפיפטה עם הדגימה בזהירות רבה לתוך מחזיק הפיפטה. ודא שהפיפטה לוחצת ושהיא ממוקמת כראוי.
- לחץ על התחל במסך המגע והמתן עד שהפולסים החשמליים יימסרו. הודעה על המסך תציין השלמה.
- הסר באיטיות את הפיפטה מהתחנה ומיד הוסף את מתלה התאים המותמר לתוך הבאר המתאימה עם מדיום נטול אנטיביוטיקה שחומם מראש משלב 2.4 על ידי לחיצה איטית על כפתור הלחיצה לתחנה הראשונה.
הערה: ניתן לעשות שימוש חוזר בטיפ זה עד שלוש פעמים עבור אותו פלסמיד; אחרת, השליכו אותו למיכל פסולת ביו-האזרד על ידי לחיצה על כפתור הלחיצה לתחנה השנייה. - חזור על שלבים 4.10-4.14 עבור כל צינור המכיל תערובת DNA של תא/פלסמיד.
- מטלטלים בעדינות את הצלחת עם תאים שעברו טרנספקציה ודגירה במשך 1-3 שעות באינקובטור תרביות רקמה לח (37 מעלות צלזיוס, 5% CO2).
- הוסיפו לכל באר 200 μL של מדיום תרבית מחומם מראש (מדיום שלם) משלב 1.1.2. מניחים את המנה באינקובטור תרביות הרקמה הלח (37 מעלות צלזיוס, 5% CO2) שוב. אפשר לפחות 24 שעות לביטוי גנים.
- למחרת, בדקו את הכדאיות של התא ואת יעילות הטרנספקציה באמצעות מיקרוסקופ אפיפלואורסצנטי.
- הפעילו את מיקרוסקופ האפיפלואורסצנציה ואת תיבת מקור האור הפלואורסצנטי בהתאם להוראות היצרן והניחו את צלחת התרבית על במת המיקרוסקופ.
- בחר את המטרה 10x או 20x ואת המסנן 568 ננומטר (RFP).
- כדי להעריך את כדאיות התאים, לחץ על לחצן נורית LED של אור משודר (TL) כדי להציג באופן חזותי את כל התאים בשדה שנבחר. תוך כדי התבוננות בעינית המיקרוסקופ, סובבו את ידית המיקוד עד שהתאים נצפים ובדקו אם יש חיבור תאים בשדה שנבחר.
הערה: תאים מחוברים במלואם מייצגים את התאים בני הקיימא בעוד שתאים צפים מייצגים תאים שאינם בני קיימא. אם המפגש של הבאר הוא גבוה, נוכחותם של תאים שאינם מחוברים יכולה להיות תוצאה של הערכת יתר של מספר התא ולא תוצאה של כדאיות נמוכה. עם זאת, מפגש נמוך המלווה בתכולה גבוהה של תאים צפים מסמל כדאיות נמוכה שעלולה לנבוע מקשת במהלך אלקטרופורציה, רעילות פלסמיד או חשיפת יתר לחיץ R בהחייאה. אין להשתמש בבארות המציגות את ההתנהגות האחרונה. - כדי להעריך את יעילות הטרנספקציה, התמקדו בתאים בשדה שנבחר תחת אור מועבר כמתואר לעיל. ספירת המספר הכולל של התאים בשדה שנבחר. כאשר נורית האור המשודרת (TL) כבויה, לחצו על הלחצן 'אור מוחזר LED' (RL) כדי להפעיל.
- התמקדו בגנים המדווחים פלואורסצנציה (תאים אדומים) וספרו את המספר הכולל של תאים פלואורסצנטיים אדומים. חזור על שלבים אלה (4.18.4-4.18.5) עבור לפחות שני שדות נוספים בכל באר.
5. טיפול ברכישת נתונים של MDM ו- Caspase BiFC שעברו טרנספקציה ו- Caspase BiFC
הערה: אם מתכננים לדמות את התאים באמצעות אפיפלואורסצנציה או מיקרוסקופ קונפוקלי, מומלץ לטפל ב-qVD-OPh (20 μM) במשך שעה טיפול קודם בגירוי שנבחר כדי למנוע מוות של תאים תלויי קספזה (בעיקר אפופטוזיס). זה משמש בהדמיה כדי למנוע מתאים להתרומם עקב אפופטוזיס, מה שהופך אותם קשים מאוד לדמיון כשהם זזים מחוץ למישור המוקד. שים לב כי גיוס caspase לפלטפורמת ההפעלה ואת הקספאזה הקשורה BiFC אינו תלוי בפעילות הקטליטית של הקספאזה, וכתוצאה מכך, עיכוב caspase לא ישפיע על שלב זה.
- יש לטפל בגירוי שנבחר כ-24 שעות לאחר הטרנספקציה ולדגום כל עוד יש צורך בכל תרופה.
- הכן את מדיום ההדמיה על ידי השלמת מדיום תרבית משלב 1.1.2 עם Hepes (20 mM, pH 7.2-7.5) ו- 2-mercaptoethanol (55 μM).
- מוסיפים את ריכוז הגירוי הרצוי למדיום ההדמיה המחומם מראש ומערבבים בעדינות.
- הסר את המדיה מהתאים בזהירות עם מיקרופיפט p1000 והוסף 500 μL של תמיסת הגירוי משלב 5.1.2 בצד הבאר.
- כדי להפעיל בארות בקרה לא מטופלות, הוסיפו מדיום הדמיה ללא הגירוי.
- דגירה של התאים בחממת תרבית רקמה לחה (37 °C , 5% CO2) למשך זמן רב ככל שצוין עבור כל טיפול.
- דמיינו את התאים באמצעות אפיפלואורסצנציה או מיקרוסקופ קונפוקלי.
- הפעל את המיקרוסקופ ואת מקור האור הפלואורסצנטי, בהתאם להוראות היצרן.
- בחר את המטרה של 10x או 20x והנח את צלחת התרבית על במת המיקרוסקופ.
- באמצעות עינית המיקרוסקופ, מצאו תאים מתחת למסנן 568 ננומטר והתמקדו בתאים המבטאים את כתב dsRedmito/mCherry (תאים אדומים).
- ספרו את כל התאים האדומים בשדה הראייה ותעדו את המספר.
- בעוד באותו שדה ראייה, שנה למסנן 488 או 512 (GFP או YFP), המשך לספור את מספר התאים האדומים שהם גם ירוקים (חיובי לוונוס או חיובי BiFC) ולרשום את המספר.
- ספרו לפחות 100 dsRedmito/mCherry - תאים חיוביים ממינימום של שלושה שדות ראייה בודדים.
- חשב את אחוז התאים החיוביים לוונוס לכל שדה ראייה וממוצע את האחוזים המתקבלים עבור כל טיפול (טוב) כדי לקבל את סטיית התקן.
- דמיינו את התאים באמצעות אפיפלואורסצנציה או מיקרוסקופ קונפוקלי
הערה: כדי להשיג תמונות קונפוקליות באמצעות מטרה של פי 20 או הגדלה גדולה יותר, תאים צריכים להיות מצופים על צלחות זכוכית, אלא אם כן המיקרוסקופ מצויד במטרת מעבר ארוכה.- בצע את השלבים 5.2.1-5.2.3. אם משתמשים במיקרוסקופ קונפוקלי עם מטרת השמן 40x, 60x או 63x, הניחו טיפת שמן על המטרה.
- דמיינו את התמונה החיה של התאים על מסך המחשב כפי שנרכשו על ידי המצלמה. השתמש במקור האור האפיפלואורסצנטי לתמונות פלואורסצנטיות או העבר את מקור האור ללייזרים לתמונות קונפוקליות.
- כוונו את המיקוד והמיקום של התאים באמצעות השליטה והמיקוד של הג'ויסטיק.
- הגדר את אחוז ההספק וזמן החשיפה של לייזר עבור לייזרים של 512 ננומטר או 488 ננומטר (YFP או GFP) ו- 568 ננומטר (RFP) כך שהאות בתמונה ייראה טוב ולא יגיע לרוויה.
- הפעל את הצילום החי ובחן את התמונה המתקבלת. ודא כי שיא מובהק נראה עבור כל פלואור בהיסטוגרמות התצוגה עבור שני הערוצים.
- התאם את עוצמת הלייזר ואת זמן החשיפה לפי הצורך. שמור על ערכים אלה נמוכים ככל האפשר ועדיין תוכל לזהות הן אותות פלואורסצנטיים (RFP והן GFP/YFP).
- תוך כדי הדמיה של התמונה החיה של התאים, צלם מספר תמונות מייצגות של שדה המכיל תא אחד או יותר המבטאים את כתב mCherry/dsRedmito עבור כל באר של הצלחת ושמור את הנתונים.
תוצאות
הסכימה המוצגת באיור 2 נותנת סקירה כללית של אופן ההשגה, ההחלפה והתמונה של MDM אנושי. לאחר הדגירה של המונוציטים שנבחרו ב-CD14+ עם GM-CSF למשך 7 ימים, המורפולוגיה של התא משתנה במהלך תקופת ההתמיינות (איור 3A), ועוברת מתאי השעיה כדוריים למצוברים בצורה קוצנית ומלאה (ימים 3 ו-4), ולבסוף לתאים מתפשטים יותר כאשר הם מתמיינים באופן מלא (יום 7). לאחר מכן, תאים מתמיינים לחלוטין מנותקים מהצלחת ומתבצעים טרנספקטציה עם זוגות ה-BiFC של הקספאזה (VC ו-VN) יחד עם הפלסמיד המדווח (לדוגמה, dsRedmito, פלסמיד המקודד חלבון פלואורסצנטי אדום המיועד למיטוכונדריה), המשמש לתיוג התאים שעברו טרנספקציה (איור 3B) ומשמש להערכת היעילות של הטרנספקציה לאחר 24 שעות. הראה דוגמה של תוצאות BiFC באמצעות תאים טרנספקטים של caspase-1 pro BiFC שטופלו במשך 20 שעות עם ניז'ריצין (5 μM), גירוי פרו-דלקתי ידוע המפעיל את ההרכבה של דלקת NLRP330,31. תאים שלא טופלו אינם מראים פלואורסצנציה של נוגה (איור 3B), ובתאים שטופלו בניגריצין, caspase-1 BiFC מופיע כפונקטום יחיד עם הצורה האופיינית של כתמי ASC 32,33,25 (איור 3C). איור 3D מראה דוגמה לכמות של MDM חיובי לוונוס. האחוז הגבוה ביותר של קספאזה-1 BiFC נראה בקבוצת הטיפול ב-LPS + ניז'ריסין (איור 3D). תוצאה זו עולה בקנה אחד עם הפעלה של דלקת קנונית, שבה נדרשות גם אות פרימה (LPS) וגם אות תוך-תאי (ניז'ריצין) להפעלה של capase-1.
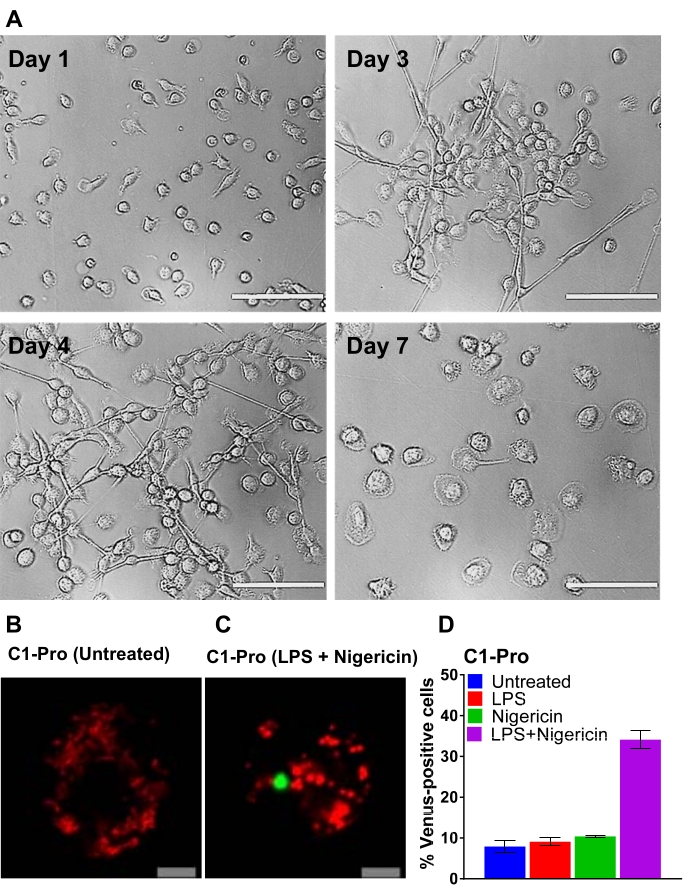
איור 3: הבחנה של CD14-מונוציטים וטרנספקציה של MDM אנושי. (A) תמונות שדה בהיר מייצגות של CD14+ מונוציטים מדם היקפי שנחשפו ל-GM-CSF בימים 1, 3, 4 ו-7 של התמיינות (סרגל קנה מידה, 100 מיקרומטר). (ב-ג) MDM אנושי הועתקו עם זוגות caspase-1 pro BiFC וכתב הטרנספקציה dsRedmito (50 ng, אדום). 24 שעות לאחר מכן, התאים הוכנסו עם ובלי LPS (100 ננוגרם/מ"ל) במשך 3 שעות וטופלו בניגריצין (5 מיקרומטר) במדיום הדמיה במשך 20 שעות. מוצגות תמונות קונפוקליות מייצגות של תאים לא מטופלים ומטופלים בניגריצין (סרגל קנה מידה, 10 מיקרומטר). ה-BiFC מוצג בירוק. (D) תאים מ-(C) הוערכו עבור אחוז התאים החיוביים ל-dsRedmito (תאים אדומים, טרנספקטו) שהיו חיוביים לוונוס (ירוק, קומפלקס Caspase-1 BiFC) ב-20 שעות. פסי שגיאה מייצגים SD של לפחות שתי ספירות בלתי תלויות לכל באר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
דוגמה לטיטרציה של פלסמיד מוצגת באיור 4, שבו כמויות הולכות וגדלות של כל פלסמיד BiFC עוברות טרנספקטציה. זה מאפשר את הבחירה של המינון האופטימלי של פלסמיד, וכתוצאה מכך אות מסוים ורקע מינימלי. איור 4A מראה את התוצאות של MDM אנושי שעבר טרנספקטציה עם ריכוזים הולכים וגדלים של זוגות caspase-1, -4 ו--5 pro BiFC (VC ו-VN) שטופלו ב-heme, מולקולה פרו-דלקתית מאוד שנובעת מהרס תאי דם אדומים34. האחוז הגבוה ביותר של תאים חיוביים לוונוס עבור זוגות קספאזה-1, -4 ו--5 pro BiFC נובע מ-400 ננוגרם, 500 ננוגרם ו-1,000 ננוגרם של פלסמיד שעבר טרנספקט, בהתאמה. עם זאת, השימוש בכמות הגבוהה ביותר של פלסמיד מסתכן גם בהגדלת הרקע הלא ספציפי (איור 4B). לדוגמה, טרנספקציה של 1000 ng של זוג caspase-5 pro BiFC גורמת לכמעט 40% רקע לא ספציפי. לכן, השימוש בכמות הנמוכה יותר של 700 ננוגרם נחשב אופטימלי עבור זוג הפלסמידים הזה (איור 4B). באיור 4C, מוצגות תמונות קונפוקליות מייצגות המתקבלות עם מטרה של פי 20 של שדה של תאים 24 שעות לאחר הטרנספקציה. בתמונה זו ניתן לראות כי התאים הלא מטופלים הם בני קיימא בהתבסס על הופעת המיטוכונדריה (המיטוכונדריה בתאים מתים מקוטעים מאוד) והמורפולוגיה של התאים (תאים אפופטוטיים מכווצים). לאחר הטיפול ב-heme, קומפלקס הקספאזה-1 מופיע כנקב ירוק יחיד הדומה לזה המושרה על ידי ניז'ריצין באיור 3C, והופעתו לוותה בהתכווצות תאים.
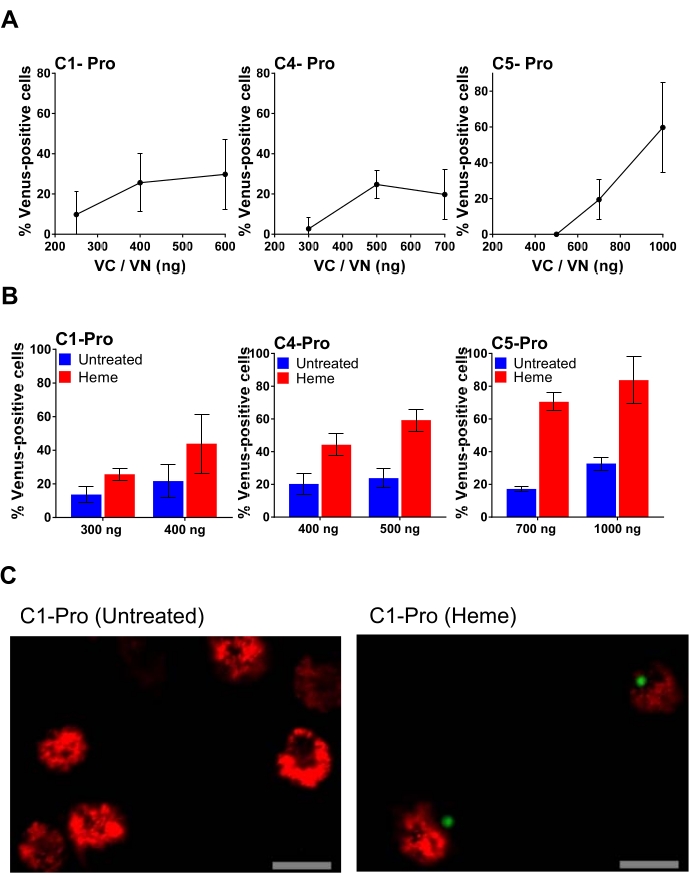
איור 4: MDM אנושי שעבר טרנספורמציה עם כמויות שונות של זוגות Caspase pro BiFC דלקתיים. caspase-4 pro; או caspase-5 pro BiFC זוגות. MDM אנושי הועתקו עם הכמויות המצוינות של זוגות caspase pro BiFC עם dsRedmito ככתב טרנספקציה (50 ng) והודגמו במהלך הלילה. למחרת, מדיום התרבית הוסר מכל הבארות, ותאים טופלו עם ובלי heme (50 μM) במדיום 0.1% FBS. לאחר שעה אחת, נוספה כמות שווה של מדיום שלם לכל הבארות כדי לשחזר את ריכוז ה-FBS ל-5% ולמנוע מהם להרוג את התאים. לאחר טיפול כולל של 20 שעות, התאים הוערכו עבור אחוז התאים הטרנספקטו החיוביים ל-dsRedmito שהיו חיוביים לוונוס, שנקבעו ממינימום של 300 תאים לבאר. פסי שגיאה מייצגים SD של לפחות שלוש ספירות בלתי תלויות לכל באר. (B) MDM אנושי הועתק עם כמויות נבחרות של קספאזה-1 pro; caspase-4 pro; או caspase-5 pro BiFC זוגות, יחד עם dsRedmito (50 ng) ככתב עבור transfection. 24 שעות לאחר הטרנספקציה, תאים טופלו עם או בלי heme (50 μM) ב 0.1% FBS. לאחר שעה אחת, FBS הורכב מחדש ל-5% כדי לעכב heme חוץ-תאי. התאים הוערכו עבור אחוז התאים החיוביים ל-dsRedmito (תאים אדומים שעברו טרנספקטציה) שהיו חיוביים לוונוס (ירוק, קומפלקס BiFC של קספאזה) ב-20 שעות שנקבע ממינימום של 300 תאים לכל באר. התוצאות מיוצגות כאחוז תאים חיוביים לוונוס. פסי שגיאה מייצגים SD של לפחות שלוש ספירות בלתי תלויות לכל באר. (C) תמונות קונפוקליות מייצגות שהתקבלו במטרה של פי 20 משדה של תאים 24 שעות לאחר הטרנספקציה וטופלו באמצעות ובלי heme כמתואר ב-(B). אדום: תאים חיוביים dsRedmito; ירוק: תאים חיוביים לוונוס; סרגל קנה מידה, 20 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
פרוטוקול זה מתאר את זרימת העבודה להשגת מקרופאגים ממונוציטים שבודדו מדגימות דם אנושיות ושיטה להחדרה יעילה של כתבי ה-BiFC של הקספאזה הדלקתית לתוך MDM אנושי מבלי להתפשר על הכדאיות וההתנהגות של התאים.
פרוטוקול זה מנצל את טכניקת BiFC35 כדי לתייג את הקספאזות הדלקתיות בתחום גיוס הקספאזות (CARD) בשברים שאינם פלואורסצנטיים של החלבון הפלואורסצנטי המפוצל נוגה. קספאזות דלקתיות מקודדות תחום קטליטי המורכב מתת-יחידה גדולה (עמ' 20) וקטנה (עמ' 10), ומוטיב אינטראקציה של חלבון-חלבון משומר המכונה CARD ב-N-terminus או בפרודומיין36 (איור 1B). גיוס קספאזות דלקתיות לפלטפורמות ההפעלה שלהם תלוי בכרטיס שלם. עבור גישה זו, נוצרים שני מבנים של קפסולת פרודומיין (המקודדים את מוטיב ה-CARD), שכל אחד מהם קשור למקטעים הלא-פלואורסצנטיים של החלבון הצהוב הניתן לצילום נוגה (Venus-C [VC]) ו-Venus-N [VN]) יחד עם כתב טרנספקציה פלואורסצנטי כדי לאפשר הדמיה של התאים לפני או בהיעדר הפעלה של כתב ה-BiFC של caspase. פלואורסצנציה נצפית רק כאשר חלבונים מתקשרים מגיעים לקרבה מספקת שתאפשר דימריזציה והפעלה (ראו איור 1A). ניתן לכמת את היעילות של תהליך זה באמצעות אפיפלואורסצנציה סטנדרטית או מיקרוסקופ קונפוקלי. בשילוב עם הדמיה של תא יחיד, פרוטוקול זה מאפשר הדמיה של אירועים אסינכרוניים שעשויים להיות בלתי ניתנים להבחנה באוכלוסיות בתפזורת, ובהתאם לרזולוציה של התמונות, ניתן להשתמש בהם כדי לקבוע את הגודל והלוקליזציה של קומפלקס BiFC המשויך לכל קספאזה.
פרוטוקול זה יכול להיות מותאם למגוון חלבונים המופעלים על ידי אוליגומריזציה, ותחולתו אינה מוגבלת למתודולוגיות מיקרוסקופיה. גישה זו מאפשרת גם חקירה של דרישות דיפרנציאליות להרכבת קספאזות דלקתיות. לדוגמה, ניתן להשתמש ב-siRNA כדי לזהות רכיבים/דרישות במעלה הזרם להפעלת קספאזה דלקתית ספציפית. ניתן להמיר את בדיקות הקספאזה-BiFC ואת ה-siRNA oligo (המשמש להשתקת חלבון מטרה) בו-זמנית ל-MDM. זה יכול לזהות שותפי חלבון פוטנציאליים או מרכיבים חיוניים בכל פלטפורמת הפעלה. לדוגמה, נעשה שימוש ב-siRNA oligo המכוון למולקולת מתאם ה-ASC, הנדרשת להרכבה של הדלקת NLRP1, NLRP3 ו-AIM2, כדי להראות שהפעלת הקספאזה המושרה על-ידי heme של caspase-1 דרשה את הדלקתות הקאנוניות הללו, בעוד ש-caspase-4 ו--5-לא21. מתודולוגיה זו יכולה להיות מותאמת גם למיקרוסקופיה של קיטועי זמן, כך שניתן לקבוע את הקינטיקה של הפעלת הקספאזה הדלקתית בתאים בודדים. באמצעות גישה כזו, ניתן להעריך מתי מתרחשת דימריזציה של קספאזה על ידי זיהוי מדויק של תזמון הופעת הופעת הופעת ה- BiFC ביחס לזמן שבו התא עובר מוות על ידי ניטור אובדן הפלואורסצנציה של כתב הטרנספקציה (mCherry) כאינדיקציה לתזה של התא. ישנן מספר דרכים לרכוש ולנתח את נתוני ה- BiFC של caspase; הבחירה תהיה תלויה בשאלה שיש לענות עליה ובסוג המיקרוסקופ והתוכנה הזמינים. לדוגמה, נתוני נקודות חד-פעמיות המשמשים לקביעת יעילות ההפעלה, כמו גם ניתוח קיטועי זמן, יכולים להיות יעילים במיוחד אם קיימת תכונה לרכישה אוטומטית המסופקת על-ידי תוכנת מיקרוסקופ כלשהי. זה מאפשר הדמיה אובייקטיבית, שכן מערכי מיקום קבועים מראש נרכשים מכל באר של צלחת מרובת בארות. ניתן למדוד תמונות הן על ידי בדיקה חזותית והן על ידי שימוש בתוכנות הדמיה אוטומטיות כמו CellProfiler, ImageJ או MATLAB כדי להגביר את הדיוק והאובייקטיביות.
חקירת מסלולי קספאזה בתאים ראשוניים חיונית כדי להבין באופן מלא את התפקידים הפיזיולוגיים של חלבונים אלה. בנוסף, מכיוון שקספאזה-4 וקספאז-5 מוחלפים על ידי קספאזה-11 יחיד בעכברים, היכולת להעריך תאים אנושיים היא חיונית. עם זאת, בשל יעילות טרנספקציה נמוכה ורעילות הקשורה למערכות אספקה רבות בתאים ראשוניים, זה יכול להיות קשה למקסם את השימוש בכתבים זמינים מבוססי פלסמיד. פרוטוקול Caspase BiFC הדלקתי מתאר שיטה פשוטה להעתקת MDM מדם היקפי של חולים או נבדקים בריאים, ובכך להפחית את מספר התאים הנדרשים לכל טרנספקציה. זה מאפשר לחוקרים לבצע ניסויים מורכבים יותר עם תאים יקרים כמו מקרופאגים מבלי להתפשר על הכדאיות של התא ועל תכונות התאים. היכולת להשתמש בדגימות מטופלים מספקת יתרון גדול ביכולת להעריך הפעלת קספאזה דלקתית במצבי מחלה ספציפיים. ואכן, עם כמה אופטימיזציות קלות, פרוטוקול זה יכול להיות מותאם בקלות לתאים ראשוניים אחרים של מורין או אנושיים.
פרוטוקול זה משתמש בגישה מבוססת אלקטרופורציה כדי לבצע טרנספקט MDM. מערכת הניאון היא יתרון במיוחד מכיוון שהיא אינה משרה תגובה γ IFN ב-MDM, מה שעלול לשבש את התגובה החיסונית הספציפית של התאים37. זוהי מערכת אלקטרופורציה בקנה מידה קטן המשתמשת בנפח טרנספקציה של 10 μL עם צפיפות תאים גבוהה כדי לאפשר העברה יעילה של דנ"א אקסוגני למספר רב של תאים. הוא יוצר נקבוביות זמניות בקרום התא, כך שפלסמידים יכולים לעבור במהירות, תוך הימנעות מאנדוציטוזה מאוחרת המתרחשת במהלך טרנספקציה כימית ויכולה לגרום לפירוק פלסמידים. פרוטוקול זה משתמש בפורמולציה של מאגר אורגני מבוסס חומצה (buffer R) המציגה רעילות מינימלית של התא בהשוואה למאגרים אחרים עם יוני כלוריד38. הנפח הקטן והעיצוב של תא קצה הפיפטה מסייעים ביצירת שדה חשמלי אחיד לשמירה על תנאים פיזיולוגיים וכתוצאה מכך שיעורי הישרדות גבוהים. יעילות הטרנספקציה והישרדות התא תלויים מאוד בהרכב הכימי של החיץ, בצפיפות התאים, בעוצמת הדופק ובריכוז הפלסמיד39. לכן, חיוני לייעל את התנאים הללו עבור כל סוג תא ופלסמיד שהוכנסו. ב-MDM, מתחים נמוכים יותר עם משכי דופק ארוכים יותר העבירו פלסמידים בצורה יעילה יותר תוך שמירה על תאים בני קיימא ובריאים. כתוצאה מכך, ההגדרות ששימשו לפרוטוקול זה היו 1000 וולט ו-2 פולסים של 40 אלפיות השנייה שהביאו ליעילות טרנספקציה בין 40-60% כאשר כדאיות התאים גבוהה מ-90% בהתבסס על יכולתם של התאים להיצמד מחדש לצלחת לאחר הטרנספקציה. בעוד שפרוטוקול זה ממוטב ל-MDM אנושי, שינוי הגדרות המתח מ-500 וולט ל-1700 וולט, הגדלת מספר הפולסים מ-1 ל-3, ובדיקת אורך הפולסים הנעה בין 10 ל-40 אלפיות השנייה יכולה לאזן בין יעילות הטרנספקציה לכדאיות התאים בסוגי תאים נוספים ובמסגרות ניסיוניות נוספות.
ישנם מספר שיקולים חשובים להעסקה אופטימלית של טכניקת BiFC. 1) חשוב שהמשתמש יקבע את הכמות האופטימלית של כל פלסמיד קספאזה שיוצג, שכן הדבר עשוי להשתנות עבור חלבונים וסוגי תאים שונים. זה נדרש כדי להבטיח רגישות מקסימלית וספציפיות של הבדיקה. מומלץ להריץ טיטרציה ניסיונית של הפלסמידים של Caspase BiFC (שברי VC ו-VN) בין 200 ננוגרם ל-1000 ננוגרם כפי שמוצג באיורים 4A-B. הטווח האופטימלי של פלסמיד שהוכנס שונה עבור כל קספאזה בודדת, ולכן, יש להעריך אותם בנפרד. בחר כמות פלסמיד המספקת את האות הספציפי הגבוה ביותר עם רקע מינימלי. באופן אידיאלי, רמת הרקע צריכה להיות פחות מ -10%, אך ניתן להשתמש בעד 20% אם האות הספציפי גבוה. זה גם קריטי כדי למנוע תנאים קשים ומניפולציה מוגזמת של תאים אלה במהלך התמיינות, transfection, וטיפול. זה יכול גם לגרום להפעלה ספונטנית, ורמות רקע גבוהות של הפעלת קספאז שיכולות לטשטש את התוצאות הספציפיות שכן הפעלת תאי חיסון כגון מונוציטים או מקרופאגים היא תהליך טבעי, שבו הם יכולים לרכוש פונקציות פרו-דלקתיות40. אם משתמשים בתאי חולה, זה יכול להיות קשה לשלוט על שונות מובנית כלשהי ברמות של הפעלת הדלקת ורקע גנטי שיכולים לחוש או לגרום להם לרגישות לגירויים ולשינויים במיקרו-סביבה המקומית שלהם. לדוגמה, תפקוד המקרופאג' יכול להיות מושפע אצל אנשים הסובלים מפגיעה חיסונית או אנשים הנלחמים בזיהום, שכן סוג זה של תאים ממלא פונקציות הומאוסטטיות חשובות ומעורבים בשליטה על דלקת, בין שאר הפונקציות. יש לקחת בחשבון גורמים גנטיים וסביבתיים אלה כאשר קובעים אם רקע גבוה אינו ספציפי או השפעה ביולוגית. שימוש בבקרות בריאות המותאמות היטב (למשל, מותאמות למין וגיל) יכול לעזור להעריך את המשמעות הביולוגית של רמת רקע גבוהה של Caspase BiFC. 2) זה קריטי כי מקטעי VC ו- VN מוצגים בכמויות שוות מכיוון שביטוי לא שוויוני של שבר נוגה אחד עלול לגרום לגיוס לפלטפורמה בתדרים גבוהים יותר ולהסוות את האות הפלואורסצנטי המלא, מה שיוצר תוצאה שלילית כוזבת. לכן, יש לאמת את השלמות והריכוז של כל פלסמיד בודד לפני כל טרנספקציה כדי להימנע מהכנסת כמויות שונות של שברי ה- VC וה- VN. 3) מכיוון שגישה זו מבוססת על הביטוי האקסוגני של כתבי הקספאזה, יש לכלול בקרות נוספות לספציפיות. מבני Caspase-BiFC המכילים מוטציות נקודתיות בודדות המשבשות את הקישור בין הקספאזה לפלטפורמת ההפעלה שלו או השתקה של אחד מרכיבי פלטפורמת ההפעלה באמצעות siRNA יכולים לשמש כדי לאשר שהאות הפלואורסצנטי נובע מקשר ספציפי של הקספאזה לדלקת. ניסוי בקרה זה אמור לגרום לירידה ברמות של תאים חיוביים לוונוס. 4) ביטוי של מבני ה-BiFC של הקספאזה יכול לגרום או להשפיע על אירועים במורד הזרם כגון מוות תאי. כדי לעקוף זאת, גרסאות לא אנזימטיות של הקספאזה מומלצות לכתבי BiFC, כגון הפרודומין של הקספאזה או הקספאזה באורך מלא שבו שאריות הציסטאין הקטליטיות עוברות מוטציה ומושבתות. כדי לשלוט בכך עוד יותר, יש לכלול בניסוי בארות לא מטופלות ולא מטופלות של שליטה שאינן מטופלות, ועליהן להראות התנהגות דומה לזו של הבארות שעברו טרנספקציה. 5) פעילות כספית אנדוגנית עשויה להשפיע על קריאת BiFC. כדי לשלוט בכך, ניתן לבטא את כתב הקספאז בתאים החסרים עבור הקספאזה הנחקרת מתוך ציפייה שיעילות BiFC תהיה זהה.
אחד החסרונות העיקריים של גישה זו הוא שהיא אינה מודדת את הפעלת הקספאזה כשלעצמה, אלא את שלב הקרבה המושרה הנדרש כדי שההפעלה תתרחש. זוהי הבחנה עדינה אך חשובה. על פי התכנון, הפרודומיין אינו מכיל את התחומים הקטליטיים של הקספאזה שלמעשה מתעמעמים. לכן, ה-refolding וה-fluorescence של שברי נוגה פועלים כפרוקסי לדימריזציה של קספאזה, שכן הם יכולים להתאושש רק אם הקספאזות קרובות מספיק כדי לעמעם. לפיכך, ה- BiFC מודד באופן ספציפי את הקרבה המושרה. ייתכן ששינויים פוסט-טרנסלציוניים בתחומים הקטליטיים עלולים לעכב דימריזציה מבלי להשפיע על אות ה-BiFC. לדוגמה, caspase-2 הוא phosphorylated על התחום הקטליטי שלה, וזה מעכב דימריזציה מבלי למנוע גיוס של caspase-2 לפלטפורמת ההפעלה שלה41. לפיכך, יש להשלים תצפיות המשתמשות בגישת BiFC עם מחקרים פונקציונליים כדי לאשר כי הפלואורסצנציה שנצפתה מייצגת את הפעלת הקספאזה. למרות חיסרון זה, אם הבקרות הנדונות כאן נכללות, מדידת הקרבה המושרה על ידי caspase BiFC יכולה לספק ייצוג מדויק של הפעלת קספאזה ספציפית.
לסיכום, caspase BiFC הוא כלי רב עוצמה לניתוח של אינטראקציות קספאז דינמיות ברמה הדלקתית. פרוטוקול זה מאפשר לחקור את מפלי האיתות הדלקתיים של קספאזה בתאי חיסון חיים. גישה זו לא רק מספקת טכניקה למדידה ספציפית ומדויקת של הצעד הראשון בהפעלת קספאזה, אלא, על ידי יישום על תאי חיסון ראשוניים, יש לה פוטנציאל לחשוף תכונות של קספאזות דלקתיות שלא ניתן היה לזהותן בשיטות קונבנציונליות.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
אנו מודים לחברי המעבדה של LBH בעבר ובהווה שתרמו לפיתוח טכניקה זו. מעבדה זו נתמכת על ידי NIH/NIDDK T32DK060445 (BEB), NIH/NIDDK F32DK12DK121479 (BEB), NIH/NIGMS R01GM121389 (LBH). איור 2 צויר באמצעות תוכנת Biorender.
Materials
| Name | Company | Catalog Number | Comments |
| 48 well tissue culture2:34 plates | Genesee Scientific | 25-108 | |
| 10 cm Tissue Culture Dishes | VWR | 25382-166 | |
| 2 Mercaptoethanol 1000x | Thermo Fisher Scientific | 21985023 | |
| 8 well chambered coverglass with 1.5 HP coverglass | Cellvis | c8-1.5H-N | |
| AutoMACS columns | Miltenyi (Biotec) | 130-021-101 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Separator | Miltenyi (Biotec) | 130-092-545 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Pro Washing Solution | Miltenyi (Biotec) | 130-092-987 | For automated separation using AutoMACS Pro Separator only |
| AutoMACS Rinsing Solution | Miltenyi (Biotec) | 130-091-222 | For automated separation using AutoMACS Pro Separator only |
| AutoMacs running buffer | Miltenyi (Biotec) | 130-091-221 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| Axio Observer Z1 motorized inverted microscope equipped with a CSU-X1A 5000 spinning disk unit | Zeiss | Any confocal microscope equipped with a laser module fitted with laser lines of 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| AxioObserver A1, Research Grade Inverted Microscope | Zeiss | Any epifluorescence microscope with fluorescence filters capable of exciting 568 nm (RFP) and 488 or 512 nm (GFP or YFP) wavelengths can be used | |
| CD14+ MICROBEADS | Miltenyi (Biotec) | 130-050-201 | For manual or automated separation using QuadroMACS or AutoMACS pro Separator |
| DPBS without calcium chloride and magnesium chloride | Sigma | D8537-6x500ML | |
| DsRed mito plasmid | Clontech | 632421 | Similar plasmids that can be used as fluorescent reporters can be found on Addgene |
| Fetal Bovine Serum | Thermo Fisher Scientific | 10437028 | |
| Ficoll-Paque PLUS 6 x 100 mL | Sigma | GE17-1440-02 | |
| GlutaMAX Supplement (100x) | Thermo Fisher Scientific | 35050079 | |
| GM-CSF | Thermo Fisher Scientific | PHC2011 | |
| Hemin BioXtra, from Porcine, ≥96.0% (HPLC) | Sigma | 51280-1G | |
| HEPES | Thermo Fisher Scientific | 15630106 | |
| Inflammatory caspase BiFC plasmids | Available by request from LBH lab | ||
| LPS-EB Ultrapure | Invivogen | TLRL-3PELPS | |
| LS Columns | Miltenyi (Biotec) | 130-042-401 | For manual separation using QuadroMACS Separator only |
| MACS 15 mL Tube Rack | Miltenyi (Biotec) | 130-091-052 | For manual separation using QuadroMACS Separator only |
| MACS MultiStand | Miltenyi (Biotec) | 130-042-303 | For manual separation using QuadroMACS Separator only |
| mCherry plasmid | Yungpeng Wang Lab | Similar plasmids that can be used as fluorescent reporters can be found on Addgene | |
| Neon Transfection System | Thermo Fisher Scientific | MPK5000 | Includes Neon electroporation device, pipette and pipette station |
| Neon Transfection System 10 µL Kit | Thermo Fisher Scientific | MPK1096 | Includes resuspension buffer R, resuspension buffer T, electrolytic buffer E, 96 x 10 µL Neon tips and Neon electroporation tubes |
| Nigericin sodium salt, ready made solution | Sigma | SML1779-1ML | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140122 | |
| Poly-D-Lysine Hydrobromide | Sigma | P7280-5mg | |
| QuadroMACS Separator | Miltenyi (Biotec) | 130-090-976 | For manual separation using QuadroMACS Separator only |
| qVD-OPh | Fisher (ApexBio) | 50-101-3172 | |
| RPMI 1640 Medium | Thermo Fisher Scientific | 11875119 | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher Scientific | 25200072 | |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher Scientific | 15575020 | |
| Zeiss Zen 2.6 (blue edition) software | Zeiss | Any software used to operate the confocal microscope of choice |
References
- Boatright, K. M., et al. A unified model for apical caspase activation. Molecular Cell. 11 (2), 529-541 (2003).
- Pop, C., Salvesen, G. S. Human caspases: activation, specificity, and regulation. Journal of Biological Chemistry. 284 (33), 21777-21781 (2009).
- Boice, A., Bouchier-Hayes, L. Targeting apoptotic caspases in cancer. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1867 (6), 118688(2020).
- Bolívar, B. E., Vogel, T. P., Bouchier-Hayes, L. Inflammatory caspase regulation: maintaining balance between inflammation and cell death in health and disease. The FEBS Journal. 286 (14), 2628-2644 (2019).
- Martinon, F., Tschopp, J. Inflammatory caspases: linking an intracellular innate immune system to autoinflammatory diseases. Cell. 117 (5), 561-574 (2004).
- Lamkanfi, M., Vishva, M. D. Mechanisms and functions of inflammasomes. Cell. 157 (5), 1013-1022 (2014).
- Viganò, E., et al. Human caspase-4 and caspase-5 regulate the one-step noncanonical inflammasome activation in monocytes. Nature Communications. 6, 8761(2015).
- Cerretti, D. P., et al. Molecular cloning of the interleukin-1 beta converting enzyme. Science. 256 (5053), 97(1992).
- van de Veerdonk, F. L., Netea, M. G., Dinarello, C. A., Joosten, L. A. Inflammasome activation and IL-1β and IL-18 processing during infection. Trends in Immunology. 32 (3), 110-116 (2011).
- Martinon, F., Burns, K., Tschopp, J. The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Molecular Cell. 10 (2), 417-426 (2002).
- Kayagaki, N., et al. Noncanonical inflammasome activation targets caspase-11. Nature. 479 (7371), 117-121 (2011).
- Kayagaki, N., et al. Noncanonical inflammasome activation by intracellular LPS independent of TLR4. Science. 341 (6151), 1246-1249 (2013).
- Masumoto, J., et al. ASC, a novel 22-kDa protein, aggregates during apoptosis of human promyelocytic leukemia HL-60 cells. The Journal of Biological Chemistry. 274 (48), 33835-33838 (1999).
- Bertin, J., DiStefano, P. S. The PYRIN domain: a novel motif found in apoptosis and inflammation proteins. Cell Death and Differentiation. 7 (12), 1273-1274 (2000).
- Agostini, L., et al. NALP3 forms an IL-1beta-processing inflammasome with increased activity in Muckle-Wells autoinflammatory disorder. Immunity. 20 (3), 319-325 (2004).
- Bürckstümmer, T., et al. An orthogonal proteomic-genomic screen identifies AIM2 as a cytoplasmic DNA sensor for the inflammasome. Nature Immunology. 10 (3), 266-272 (2009).
- Latz, E., Xiao, T. S., Stutz, A. Activation and regulation of the inflammasomes. Nature Reviews Immunology. 13 (6), 397-411 (2013).
- Kayagaki, N., et al. Caspase-11 cleaves gasdermin D for noncanonical inflammasome signalling. Nature. 526 (7575), 666-671 (2015).
- Shi, J., et al. Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature. 526 (7575), 660-665 (2015).
- Shi, J., et al. Inflammatory caspases are innate immune receptors for intracellular LPS. Nature. 514 (7521), 187-192 (2014).
- Bolívar, B. E., et al. Noncanonical Roles of Caspase-4 and Caspase-5 in Heme-Driven IL-1β Release and Cell Death. The Journal of Immunology. 206 (8), 1878-1889 (2021).
- Schmid-Burgk, J. L., et al. Caspase-4 mediates noncanonical activation of the NLRP3 inflammasome in human myeloid cells. European Journal of Immunology. 45 (10), 2911-2917 (2015).
- Baker, P. J., et al. NLRP3 inflammasome activation downstream of cytoplasmic LPS recognition by both caspase-4 and caspase-5. European Journal of Immunology. 45 (10), 2918-2926 (2015).
- Cullen, S. P., Kearney, C. J., Clancy, D. M., Martin, S. J. Diverse activators of the NLRP3 inflammasome promote IL-1β secretion by triggering necrosis. Cell Reports. 11 (10), 1535-1548 (2015).
- Sanders, M. G., et al. Single-cell imaging of inflammatory caspase dimerization reveals differential recruitment to inflammasomes. Cell Death & Disease. 6, 1813(2015).
- Charendoff, C. I., Bouchier-Hayes, L. Lighting up the pathways to caspase activation using bimolecular fluorescence complementation. Journal of Visualized Experiments: JoVE. (133), e57316(2018).
- Bouchier-Hayes, L., et al. Characterization of cytoplasmic caspase-2 activation by induced proximity. Molecular Cell. 35 (6), 830-840 (2009).
- Riedhammer, C., Halbritter, D., Weissert, R. Peripheral blood mononuclear cells: Isolation, Freezing, thawing, and culture. Methods in Molecular Biology. 1304, 53-61 (2016).
- Betsou, F., Gaignaux, A., Ammerlaan, W., Norris, P. J., Stone, M. Biospecimen science of blood for peripheral blood mononuclear cell (PBMC) functional applications. Current Pathobiology Reports. 7 (2), 17-27 (2019).
- Perregaux, D., et al. IL-1 beta maturation: evidence that mature cytokine formation can be induced specifically by nigericin. The Journal of Immunology. 149 (4), 1294-1303 (1992).
- Cheneval, D., et al. Increased mature interleukin-1β (IL-1β) secretion from THP-1 cells induced by nigericin is a result of activation of p45 IL-1β-converting enzyme processing. Journal of Biological Chemistry. 273 (28), 17846-17851 (1998).
- Fernandes-Alnemri, T., et al. The pyroptosome: a supramolecular assembly of ASC dimers mediating inflammatory cell death via caspase-1 activation. Cell Death and Differentiation. 14 (9), 1590-1604 (2007).
- Lu, A., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Muller-Eberhard, U., Javid, J., Liem, H. H., Hanstein, A., Hanna, M. Brief report: Plasma concentrations of hemopexin, haptoglobin and heme in patients with various hemolytic diseases. Blood. 32 (5), 811-815 (1968).
- Shyu, Y. J., Liu, H., Deng, X., Hu, C. D. Identification of new fluorescent protein fragments for bimolecular fluorescence complementation analysis under physiological conditions. Biotechniques. 40 (1), 61-66 (2006).
- Thornberry, N. A., et al. A novel heterodimeric cysteine protease is required for interleukin-1βprocessing in monocytes. Nature. 356 (6372), 768-774 (1992).
- Jensen, K., Anderson, J. A., Glass, E. J. Comparison of small interfering RNA (siRNA) delivery into bovine monocyte-derived macrophages by transfection and electroporation. Veterinary Immunology and Immunopathology. 158 (3-4), 224-232 (2014).
- Tada, Y., Sakamoto, M., Fujimura, T. Efficient gene introduction into rice by electroporation and analysis of transgenic plants: use of electroporation buffer lacking chloride ions. Theoretical and Applied Genetics. 80 (4), 475-480 (1990).
- Bhowmik, P., et al. Targeted mutagenesis in wheat microspores using CRISPR/Cas9. Scientific Reports. 8 (1), 6502(2018).
- Sansom, D. M., Manzotti, C. N., Zheng, Y. What's the difference between CD80 and CD86. Trends in Immunology. 24 (6), 314-319 (2003).
- Kurokawa, M., Kornbluth, S. Caspases and kinases in a death grip. Cell. 138 (5), 838-854 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved