Method Article
Метод цифровой капельной ПЦР для количественной оценки эффективности трансдукции AAV в мышиной сетчатке
В этой статье
Резюме
Этот протокол представляет, как количественно оценить эффективность трансдукции AAV в сетчатке мыши с использованием цифровой капельной ПЦР (dd-PCR) вместе с мелкомасштабным производством AAV, интравитреальной инъекцией, визуализацией сетчатки и выделением геномной ДНК сетчатки.
Аннотация
Многие лаборатории клеточной биологии сетчатки в настоящее время регулярно используют аденоассоциированные вирусы (AAV) для редактирования генов и регуляторных приложений. Эффективность трансдукции AAV обычно имеет решающее значение, что влияет на общие экспериментальные результаты. Одним из основных факторов, определяющих эффективность трансдукции, является серотип или вариант вектора AAV. В настоящее время доступны различные искусственные серотипы и варианты AAV с различным сродством к рецепторам клеточной поверхности хозяина. Для генной терапии сетчатки это приводит к различной степени эффективности трансдукции для различных типов клеток сетчатки. Кроме того, способ инъекции и качество производства AAV могут также влиять на эффективность трансдукции AAV сетчатки. Поэтому важно сравнивать эффективность различных вариантов, партий и методологий. Метод цифровой капельной ПЦР (dd-PCR) с высокой точностью количественно определяет нуклеиновые кислоты и позволяет выполнять абсолютную количественную оценку заданной мишени без какого-либо стандарта или эталона. Используя dd-PCR, также возможно оценить эффективность трансдукции AAV путем абсолютной количественной оценки числа копий генома AAV в инъекционной сетчатке. Здесь мы предоставляем простой метод количественной оценки скорости трансдукции AAV в клетках сетчатки с использованием dd-PCR. С незначительными изменениями эта методология также может быть основой для количественной оценки числа копий митохондриальной ДНК, а также для оценки эффективности редактирования оснований, критически важного для нескольких заболеваний сетчатки и применения генной терапии.
Введение
Аденоассоциированные вирусы (AAV) в настоящее время широко используются для различных исследований генной терапии сетчатки. AAV обеспечивают безопасный и эффективный способ доставки генов с меньшей иммуногенностью и меньшим количеством интеграций генома. Проникновение AAV в клетку-мишень происходит через эндоцитоз, который требует связывания рецепторов и корецепторов на поверхности клетки1,2. Поэтому эффективность трансдукции AAV для различных типов клеток зависит главным образом от капсида и его взаимодействия с рецепторами клетки-хозяина. AAV имеют серотипы, и каждый серотип может иметь различные клеточные / тканевые тропизмы и эффективность трансдукции. Существуют также искусственные серотипы и варианты AAV, генерируемые химической модификацией капсида вируса, производством гибридных капсидов, введением пептидов, перетасовкой капсидов, направленной эволюцией и рациональным мутагенезом3. Даже незначительные изменения в аминокислотной последовательности или структуре капсидов могут влиять на взаимодействие с факторами клетки-хозяина и приводить к различным тропизмам4. В дополнение к вариантам капсида, другие факторы, такие как маршрут инъекции и вариация производства AAV от партии к партии, могут влиять на эффективность трансдукции AAV в нейронной сетчатке. Поэтому необходимы надежные методы сравнения скоростей трансдукции для разных вариантов.
Большинство методов определения эффективности трансдукции AAV основаны на экспрессии репортерных генов. К ним относятся флуоресцентная визуализация, иммуногистохимия, вестерн-блот или гистохимический анализ репортерного генного продукта5,6,7. Однако из-за ограничения размера AAV не всегда возможно включить репортерные гены для мониторинга эффективности трансдукции. Использование сильных промоторов, таких как гибридный усилитель ЦМВ / куриный бета-актин или посттранскрипционный регуляторный элемент гепатита Вудчака (WPRE) в качестве последовательности стабилизатора мРНК, еще больше усложняет проблему размера8. Поэтому также будет полезно определить скорость трансдукции вводимых AAV с более прямой методологией.
Цифровая капельная ПЦР (dd-PCR) является мощным методом количественной оценки целевой ДНК из мельчайших количеств образцов. Технология dd-PCR зависит от инкапсуляции целевой ДНК и реакционной смеси ПЦР каплями масла. Каждая реакция dd-PCR содержит тысячи капель. Каждая капля обрабатывается и анализируется как независимаяреакция ПЦР 9. Анализ капель позволяет рассчитать абсолютное число копий молекул-мишеней ДНК в любом образце простым использованием алгоритма Пуассона. Поскольку эффективность трансдукции AAV коррелирует с числом копий геномов AAV в нейронной сетчатке, мы использовали метод dd-PCR для количественной оценки геномов AAV.
Здесь мы описываем методологию dd-PCR для расчета эффективности трансдукции векторов AAV из геномной ДНК сетчатки6,10. Во-первых, AAV, которые экспрессируют tdTomato reporter, были сгенерированы с использованием протокола малого масштаба и титрованы методом11dd-PCR. Во-вторых, AAV были интравитреально введены в нейронную сетчатку. Чтобы продемонстрировать эффективность трансдукции, мы сначала количественно оценили экспрессию tdTomato с помощью флуоресцентной микроскопии и программного обеспечения ImageJ. За этим последовала изоляция геномной ДНК для количественной оценки геномов AAV в инъекционных сетчатках с использованием dd-PCR. Сравнение уровней экспрессии tdTomato с трансдуцированными геномами AAV, количественно оцененными с помощью dd-PCR, показало, что метод dd-PCR точно количественно определил эффективность трансдукции векторов AAV. Наши протоколы продемонстрировали подробное описание методологии на основе dd-PCR для количественной оценки эффективности трансдукции AAV. В этом протоколе мы также показываем абсолютное количество геномов AAV, которые трансдуцируются после интравитреальных инъекций, просто используя фактор разбавления после выделения геномной ДНК и результатов dd-PCR. В целом, этот протокол обеспечивает мощный метод, который будет альтернативой репортерной экспрессии для количественной оценки эффективности трансдукции векторов AAV в сетчатке.
протокол
Все экспериментальные протоколы были приняты комитетом по этике Университета Сабанчи, и эксперименты проводились в соответствии с заявлением «Ассоциации исследований в области зрения и офтальмологии» для использования животных в исследованиях.
1. Мелкосерийное производство ААВ12
- Культивирование клеток HEK293T с использованием пластин размером 15 см в полном объеме 10 мл DMEM/10% FBS до 70-80% конфлюзии.
- Готовят трансфекционную смесь с 20 мкг вспомогательной плазмиды (pHGT1-Adeno1), 7 мкг капсидной плазмиды и 7 мкг вектора AAV2-CBA-tdTomato-WPRE и 136 мкл раствора PEI (1 мг/мл) в 5 мл DMEM.
- Добавьте 5 мл приготовленной трансфекционной смеси в чашку для клеточной культуры, содержащую 10 мл культуральной среды, и инкубируйте трансфектированные клетки в течение 48-60 ч при 37 °C.
- Собирают среду через 48-60 ч после трансфекции и переваривают ее ДНКазой I в конечной концентрации 250 Ед/мл в течение 30 мин при 37 °C.
- Центрифугируйте переваренную среду при 4000 х г,4 °C в течение 30 мин, а затем фильтруйте ее шприцевым фильтром 0,22 мкм в предварительно смачиваемую регенерированную целлюлозную мембрану на 100 кДа.
- Центрифугируют регенерированную целлюлозную мембрану при 4000 х г,4 °C в течение 30 мин и выбрасывают среду.
- Промывайте и центрифугируйте регенерированную целлюлозную мембрану PBS, содержащей 0,001% Pluronic F-68 три раза при 4000 х г,4 °C в течение 30 мин. Отбрасывайте PBS на каждом шаге.
- Соберите концентрированные AAV из верхней части регенерированной целлюлозной мембраны и аликвоты для дальнейшего использования.
- Переварить 5 мкл свежеприготовленного AAV с ДНКазой I (0,2U/мкл) в течение 15 мин при 37 °C для титрования. Затем следует инкубация через 10 мин при 95 °C как для инактивации ДНКазы I, так и для разложения вирусных капсидов.
- Приготовьте 10-кратное последовательное разведение из переваренных AAV с использованием 0,05% Pluronic F-68. Для титрования используются праймеры AAV2-ITR и WPRE(таблица 1). Титры рассчитывались путем умножения результатов дд-ПЦР на коэффициенты разбавления. Результаты были преобразованы в копию генома / мл (GC / mL).
ПРИМЕЧАНИЕ: Ожидается, что концентрации ААВ для мелкомасштабного производства ААВ составят около 1х 10 12 ГК/мл. Этот протокол неприменим для штаммов AAV, которые не эффективно высвобождают AAV в носители, такие как AAV213.
2. Интравитреальная инъекция ААВ
-
Подготовка оборудования
- Перед началом приготовления микрошприца 10 мкл с тупой иглой 36 г. Смойте пять раз с 70% EtOH, пять раз в ddH2O и, наконец, пять раз с PBS.
- Загрузите соответствующее количество AAV в микрошприц для каждой инъекции.
- Подготовьте хирургическую иглу (шов, шелк, 6/0), ленту, щипцы и ножницы.
-
Интравитреальная инъекция
- Нанесите 1 каплю 0,5% тропикамида и 2,5% фенилэфрина гидрохлорида (например, Mydfrin), содержащие глазные капли, перед анестезией для расширения зрачков.
- Анестезируйте мышей изофлураном 5% (1 л/мин) и продолжайте принимать 1,5% изофлурана (1 л/мин) во время процедуры. Для первой индукции используется небольшая изофлурановая камера.
- Проверьте глубину анестезии по потере корректирующего рефлекса, рефлекса отмены и реакции защемления хвоста.
- Наносите 0,3% тобрамицин и 0,1% дексаметазона стерильный офтальмологический раствор на каждый глаз перед процедурой инъекции. Применение глазных капель предотвращает сухость и оказывает противовоспалительное и антибактериальное действие.
- Используйте хирургический крючок для стабилизации верхнего века. Слегка оттяните назад, чтобы обнажить дорсальную часть глаза. Прикрепите крючок к скамейке, чтобы удерживать его в нужном положении.
- Удалите конъюнктиву (менее 1мм2)изогнутыми ножницами радужной оболочки, чтобы обнажить склеру глаза под рассекающим микроскопом. Используйте свежий и стерильный инсулиновый шприц (30 г) для пункции склеры.
- Введите иглу микрошприца через тот же прокол с помощью микроманипулятора. Поместите кончик иглы за линзой в середину наглазника.
- Введите 1 мкл AAV2/BP2 и AAV2/PHP. S-векторы, имеющие концентрации 1,63x 10 12 ГК/мл и 1,7х 10 12 ГК/мл, медленно проникают в стекловидное тело глаза. Регулировка громкости впрыска осуществляется вручную. Оставьте иглу на месте на 1 мин и медленно выньте иглу.
- Отпустите веко и нанесите на глаза противовоспалительный и антибактериальный гель, содержащий 0,3% тобрамицина и 0,1% дексаметазона. Контролируйте и оценивайте мышей в последующие дни в соответствии с оценочным листом с точки зрения внешнего вида (яркие глаза, ухоженная шерсть, сгорбление), поведения (активность, иммобилизация, членовредительство) и массы тела по шкале от 0 до 3. Каждое условие имеет оценку от 0 до 3, а общий балл 3 или выше является критерием прекращения.
- Поместите животных в клетку после выздоровления.
3. Флуоресценция и визуализация глазного дна
- Процедите мышь и расширьте зрачок, поместив капли 0,5% тропикамида и 2,5% фенилэфрина гидрохлорида в каждый глаз.
- Обезболить животное с помощью вышеуказанной процедуры изофлураном. Оцените глубину анестезии тщательно, зажав лапы.
- Поместите мышь на стадию визуализации и проверьте правильное расширение, проверив через камеру глазного дна. Нанесите местный гель (0,2% карбомер 980) на поверхность глаз, чтобы защитить глаза от обезвоживания под анестезией и использовать его в качестве соединительного геля для визуализации.
- Манипулируйте стадией визуализации, чтобы выровняться с носовой частью объектива. Отрегулируйте рабочую область по мере необходимости, чтобы центрировать глаз мыши. Как только глаз будет центрирован, медленно перемещайте объектив, пока он не вступит в контакт с глазом.
- Выполняйте визуализацию глазного дна и флуоресценции на обоих глазах для наблюдения за экспрессией tdTomato через 1 неделю и 2 недели после интравитреальной инъекции(рисунок 3B)14. Сделайте снимки глазного дна и флуоресценции при одинаковых настройках для сравнения репортерного выражения.
4. Изоляция сетчатки
- Усыпление животных после визуализации глазного дна и флуоресцентной визуализации путем вдыханияCO2 для сбора сетчатки через 2 недели.
- Переместите глазное яблоко вперед с помощью щипцов сплиттера 13,5 см.
- Удалите хрусталик вместе с оставшимся стекловидным телом, оказав мягкое давление щипцами.
- Отрежьте соединение глазного яблока с зрительным нервом с помощью прецизионных изогнутых щипцов и аккуратно сожмите сетчатку такими же изогнутыми щипцами.
- Перенесите рассеченные сетчатки в микроцентрифужную трубку.
- Заморозьте сетчатку, поместив трубки в жидкий азот.
5. Выделение геномной ДНК тканей
- Изолируйте геномную ДНК с помощью коммерциализированного набора тканевой геномной ДНК на основе протеиназы K.
- Переваривайте сетчатку при 55 °C, 200 х г в течение 30 мин с протеиназой К, которая уже поставляется в комплекте.
- Выполните этап инкубации РНКазы, этап промывки с буфером промывки I и II и, наконец, этап элюирования в соответствии с протоколом производителя.
- Добавьте дополнительный шаг отжима после последней промывки, чтобы удалить остаточный этанол.
- Измерьте концентрацию геномной ДНК и храните образцы при -20 °C.
6. Капельный цифровой ПЦР-анализ образцов сетчатки мышей для количественной оценки вирусных геномов
- Разбавляйте геномные ДНК из введенных сетчаток в 0,05% растворе Pluronic F-68 для достижения конечной концентрации 1 нг/мкл для каждого образца.
- Выполняют отдельные реакции для WPRE и 18S с использованием целевых специфических праймеров с конечной концентрацией 125 нМ для каждой грунтовки.
- Выполните генерацию капель в 20 мкл реакционной смеси ПЦР, включая 1 нг геномной ДНК, праймеры 125 нМ и 2-кратный эвагриновый супермикс.
- Загрузите образец смеси в среднюю часть картриджа для генерации капель.
- После того, как загрузка образца в картридж была произведена, добавьте 70 мкл масла для генерации капель в нижний ряд картриджа.
- Положите прокладку поверх картриджа и поместите ее в генератор капель. Убедитесь, что между прокладкой и картриджем нет зазора.
- Осторожно возьмите примерно 40 мкл капель, которые образуются в верхней лунке. Добавьте капельный раствор в полуоклинковую 96-луночную реакционную пластину ПЦР.
- Запечатайте пластину ПЦР с помощью герметика ПЦР-пластины с помощью алюминиевой уплотнительной пленки.
- Поместите пластину ПЦР в 96-луночный термогерметичный термоциклер. Использовать протокол ПЦР; 95 °C в течение 5 мин, 40 циклов 95 °C в течение 30 с, 60 °C в течение 1 мин, 4 °C в течение 5 мин, 90 °C в течение 5 мин и 4 °C в течение 4 °C бесконечное удержание. Применяйте скорость рампы 2 °C/s при каждом цикле, чтобы убедиться, что капли достигают правильной температуры для каждого шага во время цикла
- Поместите пластину ПЦР в считыватель капель для количественной оценки капель с помощью программного обеспечения dd-PCR. Шаблон настраивается с использованием специальных настроек для evagreen.
- Анализируйте данные с помощью 1-D графика с каждым образцом для интенсивности флуоресценции по отношению к числу капель. Пороговое значение устроено таким образом, что капли выше порогового значения присваиваются как положительные, а ниже — как отрицательные. За этим следует применение алгоритма Пуассона для определения начальной концентрации целевой ДНК в единицах копий/мкл. Отношение WPRE к 18S рассчитывается для измерения эффективности трансдукции AAV.
Результаты
Мелкомасштабное производство AAV является быстрым и эффективным методом, который обеспечивает векторы для интравитреальных инъекций(рисунок 1). Мелкомасштабное производство AAV обычно дает титры в диапазоне 1 x 1012 ГК/мл, что достаточно для обнаружения репортерной экспрессии в сетчатке(рисунок 2). Титрование AAV с помощью dd-PCR дает стабильные результаты. Обычно используются специфические праймеры ITR2 и WPRE, и начальная концентрация каждой молекулы-мишени была рассчитана с помощью программного обеспечения dd-PCR путем моделирования в виде распределения Пуассона. Расчеты были завершены путем умножения коэффициентов разбавления и преобразованы в копию генома на мл. AAV, которые производятся для этого протокола, имели титры 1,63 x10 12 ГК/мл и 1,7x 1012 ГК/мл для AAV2/BP2 и AAV2/PHP.S7,15соответственно. Для сравнения для обоих штаммов использовались идентичные конструкции выражений tdTomato. Мы ввели примерно равные титры AAV для количественной оценки эффективности трансдукции AAV. После инъекции 1 мкл из вышеупомянутых концентраций AAV животных визуализировали через 1 неделю и 2 недели. Система визуализации глазного дна и флуоресценции использовалась как для AAV2/BP2, так и для AAV2/PHP. S введенные сетчатки, генерирующие аналогичные репортерные профили экспрессии, за исключением сетчатки No 1(рисунок 3A,B). Выражение TdTomato было количественно определено с использованием программного обеспечения ImageJ для среднего значения серого (средняя интенсивность флуоресценции) для перекрестного сравнения эффективности трансдукции и репортерного выражения(рисунок 3A,B). Это в основном сумма значений серого цвета всех пикселей в выделенной области, деленная на количество пикселей16. Флуоресцентные изображения сетчатки No1 показали только небольшую область экспрессии tdTomato, скорее всего, из-за обратного потока или утечки после интравитреальных инъекций. В соответствии с этим открытием, интенсивность флуоресценции сетчатки No 1 составила 0,9, что было самым низким по сравнению со всеми сетчатками, которые были интравитреально введены и изображены. Средняя интенсивность флуоресценции составляла от 4 до 11. Это показало, что количественная оценка флуоресцентных изображений экспрессии tdTomato была успешной и коррелировала с изображениями, которые были показаны(рисунок 3A,B).
После визуализации сетчатки геномная ДНК была выделена из введенных сетчаток в 2-недельный момент времени. dd-PCR проводили с использованием праймеров WPRE для количественной оценки генома AAV. Мышь 18S использовалась для нормализации геномов AAV до генома мыши(рисунок 3C)17. В соответствии со средней интенсивностью флуоресценции и изображениями, сетчатка No 1 имела очень низкое число копий генома AAV относительно 18S, что в 0,011 раза ниже по сравнению с сетчаткой No 2. Кроме того, сетчатки No 2, 3, 4 и 5 дают аналогичные различия в уровне складок. Различия в складках по сравнению с сетчаткой No 2 для сетчатки No 3, 4 и 5 составили 1,75, 0,55 и 0,99 соответственно. Среди них сетчатка No 3 дала самую высокую интенсивность флуоресценции и номер копии генома AAV. Это уже показало, что количественная оценка трансдуцированных геномов AAV с помощью dd-PCR коррелирует с интенсивностью флуоресценции и, следовательно, с наблюдаемой экспрессией tdTomato. Метод dd-PCR также позволил нам сделать абсолютную количественную оценку трансдуцированных AAV. Абсолютная количественная оценка общего генома AAV на сетчатку была рассчитана просто путем умножения общего числа, идентифицированного из dd-PCR, и коэффициента разбавления для геномной ДНК. Это дало аналогичные результаты по сравнению с 18S нормализованной эффективностью трансдукции генома AAV (рисунок 3D).

Рисунок 1:Блок-схема экспериментальных процедур. За мелкомасштабным производством AAV следует титрование AAV на основе dd-PCR. AAV интравитреально вводятся во взрослую сетчатку. Наблюдение за животными проводилось с использованием глазного дна и флуоресцентной системы визуализации для анализа экспрессии репортера. Снимки глазного дна и флуоресцентные изображения были сделаны в 1-недельные и 2-недельные временные точки. Геномная ДНК выделяется из введенных сетчаток для анализа с помощью dd-PCR для количественной оценки общего генома AAV, который присутствует в введенных сетчатках. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2:Титрование AAV с использованием метода dd-PCR. (A)Метод Dd-PCR выигрывает от инкапсулированных реакций ПЦР внутри капли. После реакции ПЦР с использованием эвагреновой химии были проанализированы положительные и отрицательные капли для гена-мишени для определения абсолютного количества МИА ДНК в растворе. (красные коробки в зеленых каплях). (B)Репрезентативные данные dd-PCR для титрования AAV. Несколько партий AAV были титрованы с использованием праймеров ITR2. Положительные и отрицательные капли разделяются выше и ниже порога (фиолетовая линия). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
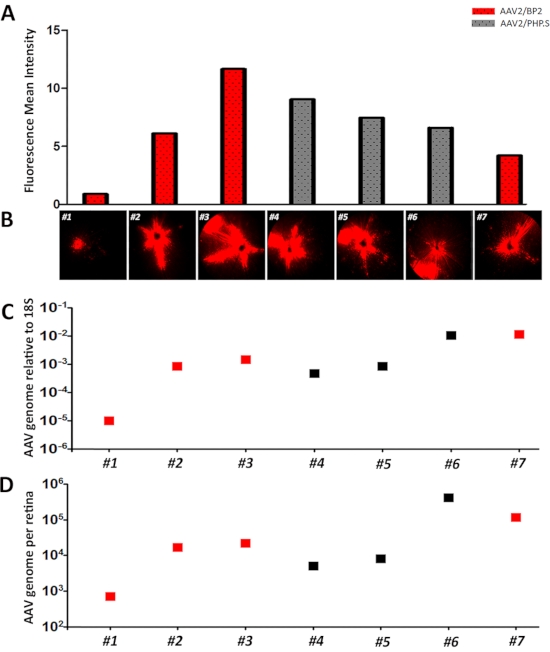
Рисунок 3:Количественная оценка трансдуцированных геномов AAV в сетчатке с помощью dd-PCR. 16-недельным животным дикого типа интравитреально вводили AAV2/BP2 и AAV2/PHP. S-векторы, имеющие концентрации 1,63х 10 12 ГК/мл и 1,7 х10 12 ГК/мл, соответственно. Оба AAV имели одинаковую конструкцию экспрессии tdTomato, а объем инъекции для всех AAV составлял 1 мкл. Инъекционные сетчатки (1-7) наблюдали с помощью визуализации глазного дна и флуоресцентной визуализации. Полученные изображения были количественно определены с помощью программного обеспечения Image J. Несмотря на разницу капсидов, все животные имели среднее значение интенсивности флуоресценции(среднее значение серогоцвета) в диапазоне от 4 до 11, за исключением сетчатки No 1, которая имела самую низкую интенсивность, 0,9, и слабую экспрессию tdTomato. Красными и серыми столбцами являются AAV2/BP2 и AAV2/PHP. S вводится сетчатке соответственно(A-B). dd-PCR проводили с использованием праймеров WPRE для генома AAV и праймера 18S для нормализации в 2-недельный момент времени. Сетчатка No 1 также показала заметно более низкие номера копий AAV на 18S копий(C). Общие геномы AAV на сетчатку также были рассчитаны с использованием числа копий WPRE и коэффициента разбавления для геномной изоляции ДНК(D). Красный и серый квадраты — это AAV2/BP2 и AAV2/PHP. S вводится сетчатке соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Грунтовки ddPCR | |
| ИТР2 Ф | GGAACCCCTAGTGATGGAGTT |
| ITR2 R | CGGCCTCAGTGAGCGA |
| WPRE F | GGCTGTTGGGCACTGACAA |
| WPRE R | CCAAGGAAAGGACGATGATTTC |
| 18С Ф | GGCCGTTCTTAGTTGGTGGTGGA |
| 18С Р | CCCGGACATCTAAGGGCATC |
Таблица 1: последовательности праймеров dd-PCR. Последовательности прямых и обратных праймеров для WPRE, ITR2 и мыши 18S.
Обсуждение
В этом протоколе мы сгенерировали два вектора AAV, которые имеют разные капсидные белки, а затем титровали их соответствующим образом. Одним из наиболее важных шагов этого протокола является получение достаточного количества AAV, которые дадут обнаруживаемую репортерную экспрессию после трансдукции12,13.
Титрование AAV также является важным фактором для корректировки дозировок AAV для интравитреальных инъекций. Как только эти важные критерии будут достигнуты, можно будет количественно оценить эффективность трансдукции AAV с помощью методологии dd-PCR.
Многие лаборатории используют количественный метод ПЦР (qPCR) для титрования AAV. Метод абсолютной количественной оценки на основе qPCR требует стандартной кривой, которая имеет разбавления известных количеств целевой ДНК18. Однако dd-PCR не требует стандартной кривой, поскольку она непосредственно количественно определяет общее количество молекул-мишеней в данном образце путем обнаружения положительных капель, которые имеют, по крайней мере, одну копию целевой ДНК. Поскольку dd-PCR является анализом конечной точки и не требует стандартной кривой, проблемы эффективности, возникшие во время реакции qPCR, вызывают меньшее беспокойство для dd-PCR, такие как низкоэффективные ПЦР или качество стандартных кривых 9. Методология dd-PCR может быть применена к образцам, которые уже подготовлены для qPCR. Как уже упоминалось в разделе «Методы титрования AAV», dd-PCR требует разбавленных образцов. Это критический шаг, поскольку концентрация образца должна быть скорректирована таким образом, чтобы было достаточно отрицательных капель для выполнения алгоритма Пуассона. Другими словами, невозможно выполнить реакцию dd-PCR с образцами со слишком высокими концентрациями целевой ДНК, которые не дают отрицательных капель.
Как для измерения титрования AAV, так и для измерения эффективности трансдукции можно использовать различные целевые наборы. Для титрования AAV мы в основном используем специальные грунтовки AAV2 ITR из-за магистрали AAV2 в наших конструкциях. Также возможно использование WPRE и других генно-специфических мишеней в зависимости от проанализированной конструкции AAV.
Чтобы оценить эффективность трансдукции AAV в нейронной сетчатке, мы применили метод dd-PCR с использованием целых образцов сетчатки для количественной оценки общего количества геномов AAV на сетчатку. Мы оценили точность методологии с помощью вектора AAV, который выражает репортер tdTomato. Сравнение результатов дд-ПЦР с уровнями экспрессии tdTomato коррелировало, за исключением двух выбросов. Сетчатки No 6 и No 7 дали избыточные копии генома AAV, несмотря на то, что показали аналогичную интенсивность флуоресценции по сравнению с сетчаткой No 2,3 4 или 5. Это может быть связано с тем, что эти сетчатки имеют более высокие скорости трансдукции с ограниченными уровнями экспрессии или могут быть частично связаны с устойчивыми частицами AAV или векторной ДНК в стекловидном теле или нейронах сетчатки19,20. В целом, это был единственный ограничивающий фактор для нашего метода и может быть легко идентифицирован среди других образцов. Мы также количественно оценили общее количество геномов AAV на сетчатку, что было одной из сильных сторон этой методологии. Это позволяет сравнивать данные между различными лабораториями и партиями животных. Таким образом, этот метод может быть легко применен для оценки эффективности трансдукции нового серотипа, варианта или пакета для векторов AAV, которые не имеют репортерного выражения, и помочь нам перекрестно сравнить данные при разных настройках. Это критически важно для векторов AAV, которые не допускают выражения репортера из-за ограничений размера.
Этот метод также обеспечивает основу для других типов чувствительных анализов, которые используют целевую ДНК. Используя идентичные протоколы, мы можем количественно оценить количество копий митохондриального генома с помощью соответствующих праймеров. Дальнейшие улучшения также возможны, включая диссоциацию сетчатки и этапы сортировки проточной цитометрии для количественной оценки целевой ДНК либо в отдельных клетках, либо в партиях клеток. Кроме того, также возможно оценить эффективность коррекции редактирования оснований с помощью этого метода21,22,который также имеет решающее значение для ряда заболеваний сетчатки и генной терапии.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить Oezkan Keles, Josephine Jüttner и профессора Botond Roska, Институт молекулярной и клинической офтальмологии Базеля, Complex Viruss Platform за их помощь и поддержку в производстве AAV. Мы также хотели бы поблагодарить профессора Джин Беннетт, Медицинскую школу Перельмана, Университет Пенсильвании за штамм AAV8 / BP2. Работа с животными выполняется на животноводческом объекте Технического университета Гебзе. За это мы благодарим Лейлу Дикметас и профессора Уйгара Халиса Тазебая за техническую помощь и поддержку животноводства. Мы также хотели бы поблагодарить д-ра Фатьму Оздемир за ее комментарии к рукописи. Эта работа поддерживается TUBITAK, грантами No 118C226 и 121N275 и грантом sabanci University Integration.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-Well Semi-Skirted ddPCR plates | BioRad | 12001925 | ddPCR |
| Amicon Filter | Millipore | UFC910096 | AAV |
| C1000 TOUCH 96 DEEP WELLS | BioRad | 1851197 | ddPCR |
| C57BL/6JRj mice strain | Janvier | C57BL/6JRj | Mice |
| DG8 gaskets | BioRad | 1863009 | ddPCR |
| DG8 Cartridges | BioRad | 1864008 | ddPCR |
| DMEM | Lonza | BE12-604Q | AAV |
| DPBS | PAN BIOTECH | L 1825 | AAV |
| Droplet generation oil eva green | BioRad | 1864006 | ddPCR |
| Droplet reader oil | BioRad | 1863004 | ddPCR |
| FBS | PAN BIOTECH | p30-3306 | AAV |
| Foil seals for PX1 PCR Plate sealer | BioRad | 1814040 | ddPCR |
| Insulin Syringes | BD Medical | 320933 | Intravitreal injection |
| Isoflurane | ADEKA ILAC SANAYI VE TICARET | N01AB06 | anesthetic |
| Microinjector MM33 | World Precision Instruments | 82-42-101-0000 | Intravitreal injection |
| Micron IV | Phoenix Research Labs | Micron IV | Microscopy system based on 3-CCD color camera, frame grabber, and off-the-shelf software enables researchers to image mouse retinas. |
| Mydfrin (%2.5 phenylephrine hydrochloride) | Alcon | S01FB01 | pupil dilation |
| Nanofil Syringe 10 μl | World Precision Instruments | NANOFIL | Intravitreal injection |
| Needle RN G36, 25 mm, PST 2 | World Precision Instruments | NF36BL-2 | Intravitreal injection |
| PEI-MAX | Polyscience | 24765-1 | AAV |
| Penicillin-Streptomycin | PAN BIOTECH | P06-07100 | AAV |
| Plasmid pHGT1-Adeno1 | PlasmidFactory | PF1236 | AAV |
| Pluronic F-68 | Gibco | 24040032 | AAV |
| PX1 PCR Plate Sealer system | BioRad | 1814000 | ddPCR |
| QX200 ddPCR EvaGreen Supermix | BioRad | 1864034 | ddPCR |
| QX200 Droplet Reader/QX200 Droplet Generator | BioRad | 1864001 | ddPCR |
| SPLITTER FORCEP WATCHER MAKER - LENGTH = 13.5 CM | endostall medical | EJN-160-0155 | Retina isolation |
| Steril Syringe Filter | AISIMO | ASF33PS22S | AAV |
| Tissue Genomic DNA Kit | EcoSpin | E1070 | gDNA isolation |
| Tobradex (0.3% tobramycin / 0.1% dexamethasone) | Alcon | S01CA01 | anti-inflammatory / antibiotic |
| Tropamid (% 0.5 tropicamide) | Bilim Ilac Sanayi ve Ticaret AS. | S01FA06 | pupil dilation |
| Turbonuclease | Accelagen | N0103L | AAV |
| Viscotears (carbomer 2 mg/g) | Bausch+Lomb | S01XA20 | lubricant eye drop |
Ссылки
- Herrmann, A. K., Grimm, D. High-throughput dissection of AAV-host interactions: The fast and the curious. Journal of Molecular Biology. 430 (17), 2626-2640 (2018).
- Pillay, S., Carette, J. E. Host determinants of adeno-associated viral vector entry. Current Opinion in Virology. 24, 124-131 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV tropism in the nervous system with natural and engineered capsids. Methods in Molecular Biology. 1382, 133-149 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods in Molecular Biology. 807, 47-92 (2011).
- Han, I. C., et al. Retinal tropism and transduction of adeno-associated virus varies by serotype and route of delivery (intravitreal, subretinal, or suprachoroidal) in rats. Human Gene Therapy. 31 (23-24), 1288-1299 (2020).
- Muraine, L., et al. Transduction efficiency of adeno-associated virus serotypes after local injection in mouse and human skeletal muscle. Human Gene Therapy. 31 (3-4), 233-240 (2020).
- Cronin, T., et al. Efficient transduction and optogenetic stimulation of retinal bipolar cells by a synthetic adeno-associated virus capsid and promoter. EMBO Molecular Medicine. 6 (9), 1175-1190 (2014).
- Higashimoto, T., et al. The woodchuck hepatitis virus post-transcriptional regulatory element reduces readthrough transcription from retroviral vectors. Gene Therapy. 14 (17), 1298-1304 (2007).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Annals in Chemistry. 84 (2), 1003-1011 (2012).
- Albayrak, C., et al. Digital quantification of proteins and mrna in single mammalian cells. Molecular Cell. 61 (6), 914-924 (2016).
- Lock, M., Alvira, M. R., Chen, S. J., Wilson, J. M. Absolute determination of single-stranded and self-complementary adeno-associated viral vector genome titers by droplet digital PCR. Hum Gene Therapy Methods. 25 (2), 115-125 (2014).
- Juttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Barben, M., Schori, C., Samardzija, M., Grimm, C. Targeting Hif1a rescues cone degeneration and prevents subretinal neovascularization in a model of chronic hypoxia. Molecular Neurodegeneration. 13 (1), 12(2018).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Guiet, R., Burri, O., Seitz, A. Open source tools for biological image analysis. Methods Molecular Biology. 2040, 23-37 (2019).
- Parks, M. M., et al. Variant ribosomal RNA alleles are conserved and exhibit tissue-specific expression. Science Advances. 4 (2), (2018).
- Aurnhammer, C., et al. Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Human Gene Therapy Methods. 23 (1), 18-28 (2012).
- Maclachlan, T. K., et al. Preclinical safety evaluation of AAV2-sFLT01- a gene therapy for age-related macular degeneration. Molecular Therapy. 19 (2), 326-334 (2011).
- Stieger, K., et al. Detection of intact rAAV particles up to 6 years after successful gene transfer in the retina of dogs and primates. Molecular Therapy. 17 (3), 516-523 (2009).
- Gyorgy, B., et al. Allele-specific gene editing prevents deafness in a model of dominant progressive hearing loss. Nature Medicine. 25 (7), 1123-1130 (2019).
- Cox, D. B. T., et al. RNA editing with CRISPR-Cas13. Science. 358 (6366), 1019-1027 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены