Method Article
طريقة ثنائي الفينيل متعدد الكلور الرقمية القطيرات للقياس الكمي لكفاءة نقل AAV في شبكية العين مورين
In This Article
Summary
يقدم هذا البروتوكول كيفية قياس كفاءة نقل AAV في شبكية العين الماوس باستخدام PCR قطرة رقمية (dd-PCR) جنبا إلى جنب مع إنتاج AAV على نطاق صغير، والحقن داخلفيتريال، والتصوير الشبكي، وعزل الحمض النووي الجينومي الشبكية.
Abstract
تستخدم العديد من مختبرات بيولوجيا خلايا الشبكية الآن الفيروسات المرتبطة بال أدينو بشكل روتيني (AAVs) لتحرير الجينات والتطبيقات التنظيمية. عادة ما تكون كفاءة نقل AAV حاسمة ، مما يؤثر على النتائج التجريبية الإجمالية. أحد المحددات الرئيسية لكفاءة النقل هو النمط المصلي أو المتغير لمتجه AAV. حاليا، مختلف الأنماط المصلية AAV الاصطناعية والمتغيرات متوفرة مع تقارب مختلفة لاستضافة مستقبلات سطح الخلية. بالنسبة للعلاج الجيني الشبكي، يؤدي ذلك إلى درجات متفاوتة من كفاءة النقل لأنواع مختلفة من خلايا الشبكية. بالإضافة إلى ذلك، قد يؤثر مسار الحقن وجودة إنتاج AAV أيضا على كفاءة نقل AAV الشبكية. لذلك، من الضروري مقارنة كفاءة المتغيرات المختلفة، الدفعات والمنهجيات. تحدد طريقة ثنائي الفينيل متعدد الكلور (dd-PCR) الرقمية الأحماض النووية بدقة عالية وتسمح بإجراء قياس كمي مطلق لهدف معين دون أي معيار أو مرجع. باستخدام DD-PCR، فمن الممكن أيضا لتقييم كفاءة النقل من AAVs عن طريق القياس الكمي المطلق للأرقام نسخة الجينوم AAV داخل شبكية العين عن طريق الحقن. هنا، نقدم طريقة مباشرة لتحديد معدل نقل AAVs في خلايا الشبكية باستخدام dd-PCR. مع تعديلات طفيفة، يمكن أن تكون هذه المنهجية أيضا الأساس لعدد نسخة القياس الكمي للحمض النووي الميتوكوندريا، فضلا عن تقييم كفاءة التحرير قاعدة، حاسمة لعدة أمراض الشبكية وتطبيقات العلاج الجيني.
Introduction
تستخدم الفيروسات المرتبطة بالأدينو (AAVs) الآن بشكل شائع لمجموعة متنوعة من دراسات العلاج الجيني الشبكي. توفر AAVs طريقة آمنة وفعالة لتسليم الجينات مع انخفاض المناعة وتقليل تكامل الجينوم. AAV الدخول إلى الخلية المستهدفة يحدث من خلال الغدد الصماء، الأمر الذي يتطلب ربط المستقبلات والمستقبلات المشتركة على سطح الخلية1،2. لذلك ، تعتمد كفاءة نقل AAVs لأنواع الخلايا المختلفة بشكل رئيسي على الكابسيد وتفاعلاته مع مستقبلات الخلايا المضيفة. AAVs لها أنماط مصلية ويمكن أن يكون كل نوع مصلي متميزة التروبينات الخلوية / الأنسجة وكفاءة النقل. وهناك أيضا الأنماط المصلية AAV الاصطناعية والمتغيرات الناتجة عن التعديل الكيميائي للفيروس capsid، وإنتاج capsids الهجين، إدراج الببتيد، خلط capsid، تطور موجه، و mutagenesis العقلاني3. حتى التغييرات الطفيفة في تسلسل الأحماض الأمينية أو هيكل capsid يمكن أن يكون لها تأثير على التفاعلات مع عوامل الخلية المضيفة ويؤدي إلى تروبزم مختلفة4. بالإضافة إلى المتغيرات capsid، عوامل أخرى مثل مسار الحقن والاختلاف دفعة إلى دفعة من إنتاج AAV يمكن أن تؤثر على كفاءة النقل من AAVs في شبكية العين العصبية. ولذلك، من الضروري استخدام أساليب موثوقة لمقارنة معدلات النقل لمختلف المتغيرات.
تعتمد غالبية طرق تحديد كفاءة نقل AAV على التعبير الجيني للمراسل. وتشمل هذه التصوير الفلوري، الكيمياء المناعية، لطخة الغربية، أو التحليل الهستوشيائي للمنتج الجيني مراسل5،6،7. ومع ذلك ، بسبب ضيق حجم AAVs ، فإنه ليس من الممكن دائما تضمين جينات المراسل لمراقبة كفاءة النقل. استخدام المروجين قوية مثل محسن CMV الهجين / الدجاج بيتا أكتين أو وودتشاك التهاب الكبد بعد النسخ العنصر التنظيمي (WPRE) لتسلسل مثبت مرنا يزيد من تعقيد مشكلة حجم8. لذلك، سيكون من المفيد أيضا تحديد معدل نقل مركبات AAVs المحقونة بمنهجية أكثر مباشرة.
قطرات رقمية PCR (dd-PCR) هو تقنية قوية لقياس الحمض النووي المستهدف من كميات دقيقة من العينات. تعتمد تقنية dd-PCR على تغليف خليط تفاعل الحمض النووي وPCR المستهدف بواسطة قطرات الزيت. كل رد فعل DD-PCR يحتوي على الآلاف من قطرات. تتم معالجة كل قطرة وتحليلها كرد فعل PCR مستقل9. تحليل قطرات تمكن من حساب عدد النسخ المطلق من جزيئات الحمض النووي الهدف في أي عينة ببساطة باستخدام خوارزمية بواسون. منذ ترتبط كفاءة النقل من AAVs مع عدد نسخة من الجينوم AAV في شبكية العين العصبية، استخدمنا طريقة DD-PCR لقياس الجينوم AAV.
هنا، ونحن نصف منهجية DD-PCR لحساب كفاءة نقل ناقلات AAV من الحمض النووي الجينومالشبكية 6،10. أولا، تم إنشاء AAVs التي تعبر عن مراسل tdTomato باستخدام بروتوكول نطاق صغير، و titered بواسطة DD-PCR طريقة11. ثانيا، تم حقن AAVs داخل الشبكية العصبية. لإثبات كفاءة النقل ، قمنا أولا بقياس تعبير tdTomato باستخدام المجهر الفلوري وبرامج ImageJ. وأعقب ذلك عزل الحمض النووي الجينومي للقياس الكمي لجينوم AAV في شبكية العين المحقونة باستخدام DD-PCR. وأظهرت مقارنة مستويات التعبير tdTomato مع الجينوم AAV المنقولة التي تم قياسها كميا من قبل DD-PCR أن طريقة dd-PCR بدقة كميا كفاءة النقل من ناقلات AAV. أظهرت بروتوكولاتنا وصفا مفصلا لمنهجية تستند إلى DD-PCR لقياس كفاءة نقل AAV. في هذا البروتوكول، نعرض أيضا العدد المطلق لجينوم AAV الذي يتم نقله بعد الحقن داخلفيتريال ببساطة باستخدام عامل التخفيف بعد عزل الحمض النووي الجينومي ونتائج DD-PCR. بشكل عام، يوفر هذا البروتوكول طريقة قوية، والتي ستكون بديلا للتعبير عن المراسل لتحديد كفاءة النقل من ناقلات AAV في شبكية العين.
Protocol
تم قبول جميع البروتوكولات التجريبية من قبل لجنة الأخلاقيات بجامعة سابانشي وأجريت التجارب وفقا لبيان "جمعية البحث في الرؤية وطب العيون" لاستخدام الحيوانات في البحوث
1. صغيرة الحجم إنتاج AAV12
- ثقافة خلايا HEK293T باستخدام لوحات 15 سم في كامل 10 مل من DMEM/10٪ FBS حتى 70-80٪ التقاء.
- إعداد خليط العدوى مع 20 ميكروغرام من البلازميد المساعد (pHGT1-Adeno1)، 7 ميكروغرام من البلازميد capsid و 7 ميكروغرام من AAV2-CBA-tdTomato-WPRE ناقلات و 136 ميكرولتر من محلول PEI (1 ملغم / مل) في 5 مل من DMEM.
- أضف خليط العدوى المعد 5 مل إلى طبق زراعة الخلايا الذي يحتوي على 10 مل من الوسائط الثقافية واحتضان الخلايا المصابة لمدة 48-60 ساعة عند 37 درجة مئوية.
- جمع وسائل الإعلام في 48-60 ساعة بعد العدوى وهضمه مع DNase I في تركيز النهائي من 250 U/ مل لمدة 30 دقيقة في 37 درجة مئوية.
- الطرد المركزي وسائل الإعلام المهضومة في 4000 س غ، 4 درجة مئوية لمدة 30 دقيقة ومن ثم تصفية مع مرشح حقنة 0.22 ميكرومتر في غشاء السليلوز المجددة قبل الرطب لمدة 100 كيلودا.
- الطرد المركزي غشاء السليلوز المجددة في 4000 x ز،4 درجة مئوية لمدة 30 دقيقة وتجاهل وسائل الإعلام.
- غسل والطرد المركزي غشاء السليلوز المجددة مع برنامج تلفزيوني يحتوي على 0.001٪ Pluronic F-68 ثلاث مرات في 4000 × ز،4 درجة مئوية لمدة 30 دقيقة. تجاهل برنامج تلفزيوني في كل خطوة.
- جمع AAVs المركزة من الجزء العلوي من غشاء السليلوز المجددة وaliquot لمزيد من الاستخدامات.
- هضم 5 ميكرولتر من AAV الطازجة مع DNase I (0.2U/μl) لمدة 15 دقيقة في 37 درجة مئوية للترجيل. ويتبع ذلك 10 دقيقة في الحضانة 95 درجة مئوية لكل من تعطيل DNase I وإضعاف capsids الفيروسية.
- إعداد تخفيف المسلسل 10 أضعاف من AAVs هضم باستخدام 0.05٪ Pluronic F-68. استخدام AAV2-ITR وWPRE التمهيدية ل المعايرة (الجدول 1). تم حساب المعايرة بضرب نتائج DD-PCR بعوامل التخفيف. تم تحويل النتائج إلى نسخة الجينوم / مل (GC / مل).
ملاحظة: من المتوقع أن تكون تركيزات AAV لإنتاج AAV على نطاق صغير حوالي 1 × 1012 GC / mL. هذا البروتوكول لا ينطبق على سلالات AAV التي لا تطلق بكفاءة AAVs في وسائل الإعلام مثل AAV213.
2. الحقن داخلفيتريال من AAV
-
إعداد المعدات
- قبل البدء، قم بإعداد 10 ميكرو لتر microsyringe مع إبرة حادة 36 G. شطف خمس مرات مع 70٪ EtOH، خمس مرات في DDH2O، وأخيرا خمس مرات مع برنامج تلفزيوني.
- تحميل الكمية المناسبة من AAV في microsyringe لكل حقنة.
- إعداد الإبرة الجراحية (خياطة، الحرير، 6/0)، الشريط، ملقط، ومقص.
-
الحقن داخل الفيتريال
- تطبيق 1 قطرة من 0.5٪ تروبيكاميد و 2.5٪ هيدروكلوريد الفينيليفرين (على سبيل المثال، Mydfrin) التي تحتوي على قطرة العين قبل التخدير لتوسيع التلاميذ.
- تخدير الفئران مع isoflurane 5٪ (1 لتر / دقيقة) وتستمر مع 1.5٪ isoflurane (1 لتر / دقيقة) أثناء الإجراء. يتم استخدام غرفة isoflurane صغيرة للتحريض الأول.
- تحقق من عمق التخدير عن طريق فقدان حق منعكس، منعكس الانسحاب، واستجابة قرصة الذيل.
- تطبيق 0.3٪ tobramycin و 0.1٪ ديكساميثازون محلول العيون العقيمة لكل عين قبل إجراء الحقن. تطبيق قطرة العين يمنع الجفاف ويمارس تأثيرات مضادة للالتهابات ومضادة للبكتيريا.
- استخدم الخطاف الجراحي لتثبيت الجفن العلوي. سحب قليلا إلى الوراء لفضح الجزء الظهري من العين. الشريط هوك إلى مقاعد البدلاء لعقد في الموقف.
- إزالة الملتحمة (أقل من 1 مم2)مع مقص القزحية المنحنية لفضح تصلب العين تحت المجهر تشريح. استخدم حقنة الأنسولين الطازجة والمعقمة (30 جم) لثقب الصلبة.
- أدخل إبرة الحقن المجهري من خلال نفس الثقب باستخدام ميكرومانيبولاتور. ضع طرف الإبرة خلف العدسة في منتصف العدسة.
- حقن 1 ميكرولتر من AAV2/BP2 وAV2/PHP. ناقلات S وجود تركيزات 1.63 × 1012 GC / مل و 1.7 ×10 12 GC / مل ببطء في الجسم الزجاجي للعين. يتم التحكم في مستوى الصوت بالحقن يدويا. اترك الإبرة في مكانها لمدة دقيقة واحدة وسحب الإبرة ببطء.
- الإفراج عن الجفن وتطبيق المضادة للالتهابات ومضادة للبكتيريا العلاج هلام الموضعية التي تحتوي على 0.3٪ tobramycin و 0.1٪ ديكساميثازون إلى eyecup. رصد وتقييم الفئران في الأيام التالية وفقا لصحيفة النتيجة من حيث المظهر (عيون مشرقة، معطف مهيأ، حدس)، والسلوك (النشاط، والشلل، وتشويه الذات)، ووزن الجسم على مقياس من 0 إلى 3. كل شرط لديه درجة من 0-3 ومجموع درجة 3 أو أكثر هو معيار الإنهاء.
- ضع الحيوانات في القفص بعد الشفاء.
3. فلورسينس والتصوير fundus
- سلالة الماوس وتمدد التلميذ عن طريق وضع قطرات من 0.5٪ تروبيكاميد و 2.5٪ هيدروكلوريد الفينيليفرين في كل عين.
- تخدير الحيوان مع الإجراء أعلاه مع ايزوفلوران. تقييم عمق التخدير بعناية عن طريق قرص الكفوف.
- ضع الماوس على مرحلة التصوير وتحقق من التمدد المناسب عن طريق التحقق من خلال كاميرا fundus. تطبيق هلام موضعي (0.2٪ كاربومير 980) على سطح العينين لحماية العينين من الجفاف تحت التخدير واستخدامه كجل اقتران للتصوير.
- التلاعب في مرحلة التصوير لتصطف مع قطعة الأنف من الهدف. ضبط المرحلة حسب الحاجة إلى مركز العين الماوس. بمجرد أن يتم توسيط العين ، تحرك الهدف ببطء حتى يتصل بالعين.
- إجراء التصوير fundus وفلورسينس على كلتا العينين لمتابعة التعبير tdTomato في 1 أسبوع و 2 أسابيع بعد الحقن داخلفيتريال (الشكل 3B)14. خذ صور الفلوروس والفلورسين في إعدادات متطابقة للمقارنة بين تعبير المراسل.
4. عزل الشبكية
- قتل الحيوانات بعد التصوير fundus وفلورسينس عن طريقاستنشاق ثاني أكسيد الكربون لجمع شبكية العين في 2 نقطة زمنية أسابيع.
- تحويل مقلة العين إلى الأمام مع مساعدة من ملقط مقسم 13.5 سم.
- إزالة العدسة جنبا إلى جنب مع بقايا الزجاجية عن طريق تطبيق ضغط لطيف مع ملقط.
- قطع اتصال مقلة العين إلى العصب البصري مع ملقط منحني الدقة والضغط بلطف شبكية العين مع نفس ملقط منحني.
- نقل شبكية العين تشريح إلى أنبوب الطرد المركزي الدقيق.
- المفاجئة تجميد شبكية العين عن طريق وضع الأنابيب في النيتروجين السائل.
5. عزل الحمض النووي الجينومي الأنسجة
- عزل الحمض النووي الجينومي مع مجموعة الحمض النووي الجينومي الأنسجة القائمة على البروتين K تسويقها.
- هضم شبكية العين في 55 درجة مئوية، 200 × ز لمدة 30 دقيقة مع بروتيناز K، والتي يتم توفيرها بالفعل في عدة.
- تنفيذ خطوة حضانة RNase، وغسل الخطوات مع غسل العازلة الأول والثاني، وأخيرا خطوة elution وفقا لبروتوكول الشركة المصنعة.
- إضافة خطوة تدور اضافية بعد غسل الماضي لإزالة الإيثانول المتبقية.
- قياس تركيز الحمض النووي الجينومي وتخزين العينات في -20 درجة مئوية.
6. قطرة تحليل PCR الرقمية لعينات شبكية العين الماوس للقياس الكمي للجينوم الفيروسي
- تمييع DNAs الجينوم من شبكية العين عن طريق الحقن في 0.05٪ محلول Pluronic F-68 للوصول إلى تركيز نهائي من 1 نانوغرام / ميكرولتر لكل عينة.
- إجراء ردود فعل منفصلة ل WPRE و 18S باستخدام التمهيديات المحددة الهدف مع تركيز نهائي من 125 nM لكل التمهيدي.
- أداء توليد قطرة في 20 ميكرولتر من مزيج تفاعل PCR بما في ذلك 1 نانوغرام من الحمض النووي الجينومي، 125 nM التمهيديات، و 2x evagreen supermix.
- قم بتحميل مزيج العينة في الجزء الأوسط من الخرطوشة لتوليد القطيرات.
- بعد تحميل العينة إلى خرطوشة تم القيام به، إضافة 70 ميكرولتر من النفط توليد قطرة في الصف السفلي من خرطوشة.
- وضع طوقا على رأس خرطوشة ووضعها في مولد قطرة. تأكد من عدم وجود فجوة بين طوقا وخرطوشة.
- تأخذ بلطف ما يقرب من 40 ميكرولتر من قطرات التي يتم إنشاؤها في البئر العلوي. أضف محلول القطيرات إلى لوحة تفاعل PCR شبه المتنورة 96 جيدا.
- ختم لوحة PCR مع جهاز السداد لوحة PCR باستخدام رقائق ختم الألومنيوم.
- ضع لوحة PCR في دورة حرارية محكمة الإغلاق حراريا ذات 96 بئرا. استخدم بروتوكول PCR; 95 درجة مئوية لمدة 5 دقائق، 40 دورة من 95 درجة مئوية لمدة 30 s، 60 درجة مئوية لمدة 1 دقيقة، 4 درجة مئوية لمدة 5 دقائق، 90 درجة مئوية لمدة 5 دقائق و 4 درجة مئوية عقد لانهائي. تطبيق 2 درجة مئوية / ثانية معدل المنحدر في كل دورة لضمان أن قطرات تصل إلى درجة الحرارة الصحيحة لكل خطوة أثناء ركوب الدراجات
- ضع لوحة PCR في قارئ القطرات لتحديد قطرات باستخدام برنامج DD-PCR. يتم إعداد قالب باستخدام إعدادات معينة ل evagreen.
- تحليل البيانات باستخدام رسم بياني مؤامرة 1-D مع كل عينة لكثافة الفلورية مقابل عدد قطرات. يتم ترتيب قيمة العتبة بحيث يتم تعيين قطرات فوق العتبة على أنها موجبة والقطرات أدناه على أنها سالبة. ويتبع ذلك تطبيق خوارزمية بواسون لتحديد تركيز الحمض النووي المستهدف في وحدات من النسخ/الميكروغرل. يتم حساب نسبة WPRE مقابل 18S لقياس كفاءة نقل AAV.
النتائج
إنتاج AAV على نطاق صغير هو طريقة سريعة وفعالة توفر ناقلات للحقن داخلفيتريال(الشكل 1). إنتاج AAV على نطاق صغير يعطي عادة titers ضمن نطاق 1 × 1012 GC / مل وهو ما يكفي للكشف عن التعبير مراسل في شبكية العين (الشكل 2). Titering من AAV باستخدام DD-PCR يعطي نتائج متسقة. وتستخدم بشكل روتيني ITR2 وWPRE التمهيديات محددة وتم حساب تركيز البداية من كل جزيء الهدف مع برنامج DD-PCR عن طريق النمذجة للتوزيع Poisson. وقد استكملت الحسابات بضرب عوامل التخفيف وحولت إلى نسخة جينوم لكل مل. AAVs التي يتم إنتاجها لهذا البروتوكول كان titers من 1.63 × 1012 GC / مل و 1.7x 1012 GC / مل لAV2/BP2 وAV2/PHP.S7،15، على التوالي. للمقارنة، استخدمت بنى التعبير tdTomato متطابقة لكلا السلالات. حقننا ما يقرب من titers متساوية من AAV للقياس الكمي لكفاءة نقل AAV. بعد حقن 1 ميكرولتر من التركيزات المذكورة أعلاه من AAVs ، تم تصوير الحيوانات في 1 أسبوع و 2 نقطة زمنية الأسبوع. تم استخدام نظام التصوير fundus وفلورسينس لكل من AAV2/BP2 وAV2/PHP. S حقن شبكية العين توليد ملامح التعبير مراسل مماثلة باستثناء شبكية العين # 1 (الشكل 3A, B). تم قياس التعبير TdTomato كميا باستخدام برنامج ImageJ لمتوسط القيمة الرمادية (متوسط كثافة الفلورسينس) من أجل مقارنة كفاءة النقل والتعبير الصحفي(الشكل 3A، B). هذا هو أساسا مجموع القيم الرمادية لجميع بكسل في التحديد مقسوما على عدد بكسل16. وأظهرت الصور الفلورية من شبكية العين # 1 سوى مساحة صغيرة من التعبير tdTomato، على الأرجح بسبب التدفق الخلفي أو التسرب بعد الحقن داخلفيتريال. واتساقا مع هذه النتيجة، كانت كثافة الفلورية في شبكية العين رقم 1 0.9 وهي أدنى نسبة مقارنة بجميع شبكية العين التي تم حقنها داخل العين وصورتها. وكان متوسط كثافة الفلورسينس بين 4-11. وأظهر هذا أن القياس الكمي للصور الفلورية للتعبير tdTomato كان ناجحا ومترابطا مع الصور التي تم عرضها(الشكل 3A، B).
بعد تصوير شبكية العين، تم عزل الحمض النووي الجينومي من شبكية العين المحقونة في نقطة زمنية 2 أسابيع. تم إجراء dd-PCR باستخدام التهيئة WPRE للقياس الكمي الجينوم AAV. الفأر 18S كان يستخدم لتطبيع الجينوم AAV لجينوم الماوس (الشكل 3C)17. بما يتفق مع متوسط كثافة الفلورية والصور ، كان شبكية العين رقم 1 عدد نسخة الجينوم AAV منخفضة جدا بالنسبة إلى 18S ، 0.011 أضعاف أقل مقارنة شبكية العين # 2. وعلاوة على ذلك، شبكية العين # 2، 3، 4، و 5 تعطي اختلافات مستوى أضعاف مماثلة. وكانت الاختلافات أضعاف مقارنة شبكية العين # 2 لشبكية العين # 3 ، 4 ، و 5 1.75 ، 0.55 ، و 0.99 ، على التوالي. من بين تلك ، شبكية العين # 3 على حد سواء أعطى أعلى كثافة الفلورسنت ورقم نسخة الجينوم AAV. وقد أظهر ذلك بالفعل أن القياس الكمي لجينوم AAV المنقول مع dd-PCR يرتبط بكثافة الفلورسينس وبالتالي بتعبير tdTomato الذي يتم ملاحظته. كما سمحت لنا طريقة DD-PCR بإجراء تحديد كمي مطلق للمركبات المضادة للفيروسات الهلوسة المنقولة. تم حساب القياس الكمي المطلق لمجموع جينوم AAV لكل شبكية العين ببساطة عن طريق ضرب العدد الإجمالي المحدد من DD-PCR وعامل التخفيف للحمض النووي الجينومي. هذا أسفر عن نتائج مماثلة مقارنة مع 18S تطبيع كفاءة نقل الجينوم AAV (الشكل 3D).

الشكل 1: مخطط تدفق الإجراءات التجريبية. ويتبع إنتاج AAV على نطاق صغير من قبل dd-PCR المستندة إلى AAV titering. يتم حقن AAVs داخل الشبكية للبالغين. تم إجراء متابعة الحيوانات باستخدام نظام التصوير بالفلورسنت والفلورسنت من أجل تحليل تعبير المراسل. تم التقاط صور فوندوس والفلورسنت في 1 أسبوع و 2 أسابيع نقاط زمنية. يتم عزل الحمض النووي الجينومي من شبكية العين المحقونة للتحليل مع DD-PCR لتحديد إجمالي جينوم AAV الموجود في شبكية العين المحقونة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: AAV titering باستخدام طريقة DD-PCR. (A) DD-PCR طريقة يستفيد من ردود الفعل PCR مغلفة داخل قطرة. بعد تفاعل PCR باستخدام كيمياء evagreen ، تم تحليل قطرات إيجابية وسلبية للجين المستهدف لتحديد العدد المطلق ل DNAs المستهدفة داخل الحل. (مربعات حمراء في قطرات خضراء). (ب) بيانات DD-PCR التمثيلية ل AAV titering. تم تأليه عدة دفعات من AAVs باستخدام التمهيديات ITR2. يتم فصل قطرات إيجابية وسلبية فوق وتحت عتبة (الخط الأرجواني). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
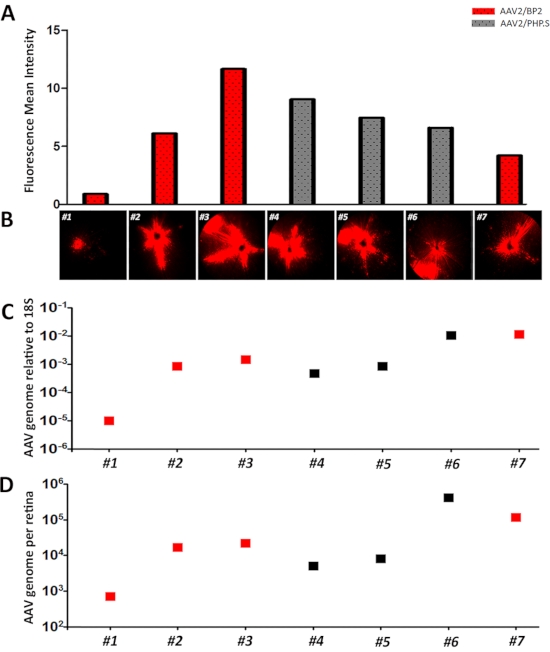
الشكل 3:تم حقنكمية الجينوم AAV المنقولة في شبكية العين عن طريق DD-PCR. الحيوانات البرية نوع 16 أسبوعا داخلفيتريال مع AAV2/BP2 وAV2/PHP. S ناقلات وجود تركيزات 1.63 × 1012 GC / مل و 1.7x 1012 GC / مل ، على التوالي. وكان كل من AAVs بناء التعبير tdTomato متطابقة وحجم الحقن لجميع AAVs كان 1 ميكرولتر. تم متابعة شبكية العين عن طريق الحقن (1-7) مع التصوير fundus والفلورسينس. تم قياس الصور التي يتم التقاطها كميا باستخدام برنامج Image J. على الرغم من الفرق capsid، وكان جميع الحيوانات مضان متوسط قيمة كثافة(متوسط قيمة رمادية) تتراوح بين 4 إلى 11 باستثناء شبكية العين # 1 التي كان أقل كثافة، 0.9، وضعف التعبير tdTomato. الأعمدة الحمراء والرمادية هي AAV2/BP2 وAV2/PHP. S حقن شبكية العين, على التوالي (A-B). تم تنفيذ DD-PCR باستخدام التمهيديات WPRE لجينوم AAV والتمهيدي 18S للتطبيع في نقطة زمنية 2 أسبوع. الشبكية # 1 كما أظهرت أرقام نسخة AAV أقل بشكل مميز لكل 18S نسخ (ج). كما تم حساب إجمالي جينوم AAV لكل شبكية العين باستخدام رقم نسخة WPRE وعامل التخفيف لعزل الحمض النووي الجينومي(D). المربعات الحمراء والرمادية هي AAV2/BP2 وAV2/PHP. S حقن شبكية العين، على التوالي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| دي بي سي آر التمهيديات | |
| ITR2 F | غاغاكاتاغاتغاتغات |
| ITR2 R | لجنة التنسيق مع حكومة غاغغاغا |
| WPRE F | GGCTGGGGغكاكتاكا |
| WPRE R | CCAجاجاغاغاغاتساتك |
| 18S واو | جي جي سي جي تي تاتغاغغغا |
| 18S R | سيكغاكاكاتاغاغكاتك |
الجدول 1: تسلسلات التمهيدي dd-PCR. تسلسلات التمهيديات الأمامية والعكسية ل WPRE و ITR2 و Mouse 18S.
Discussion
في هذا البروتوكول، قمنا بتوليد ناقلين للطائرات بدون طيار لديهما بروتينات كابسيد مختلفة ثم قمنا بتكرارها وفقا لذلك. واحدة من أهم الخطوات في هذا البروتوكول هو إنتاج كميات كافية من AAVs التي سوف تسفر عن التعبير مراسل يمكن الكشف عنها بعد النقل12،13.
تأليه AAVs هو أيضا عامل مهم لضبط جرعات من AAV للحقن داخلفيتريال. وبمجرد تحقيق هذه المعايير الهامة، من الممكن تحديد كفاءة نقل مركبات الكربون الكلورية الهجائي بواسطة منهجية DD-PCR.
تستخدم العديد من المختبرات طريقة PCR الكمية (qPCR) لتكتيتر AAV. qPCR القائم على طريقة القياس الكمي المطلق يتطلب منحنى القياسية التي تمييع كميات معروفة من الحمض النووي الهدف18. ومع ذلك، لا يتطلب dd-PCR منحنى قياسي لأنه يحدد بشكل مباشر العدد الإجمالي للجزيئات المستهدفة داخل عينة معينة من خلال الكشف عن القطرات الإيجابية التي تحتوي على نسخة واحدة على الأقل من الحمض النووي المستهدف. منذ dd-PCR هو تحليل نقطة النهاية وليس هناك حاجة إلى منحنى قياسي، ومشاكل الكفاءة التي وقعت خلال رد فعل qPCR هي أقل قلقا لDD-PCR مثل PCRs منخفضة الكفاءة أو نوعية المنحنيات القياسية 9. ويمكن تطبيق منهجية DD-PCR على العينات التي تم إعدادها بالفعل لqPCR. كما ذكر بالفعل في قسم الطرق لتترينج AAV ، يتطلب dd-PCR عينات مخففة. هذه خطوة حاسمة حيث يجب تعديل تركيز العينة بطريقة أن هناك قطرات سلبية كافية لأداء خوارزمية بواسون. وبعبارة أخرى، فإنه ليس من الممكن لأداء رد فعل DD-PCR مع عينات مع تركيزات عالية جدا من الحمض النووي المستهدفة التي لا تسفر عن قطرات سلبية.
بالنسبة لكل من قياس كفاءة التأليه والتشتيت AAV، يمكن استخدام مجموعات أهداف مختلفة. بالنسبة إلى AAV titering ، نستخدم بشكل رئيسي مبرمجات AAV2 ITR المحددة بسبب العمود الفقري AAV2 في بنياتنا. ومن الممكن أيضا استخدام WPRE وغيرها من الأهداف الخاصة بالجينات اعتمادا على بناء AAV الذي تم تحليله.
لتقييم كفاءة نقل AAVs في شبكية العين العصبية، طبقنا طريقة dd-PCR باستخدام عينات شبكية العين بأكملها لتحديد الكمية الإجمالية لجينوم AAV لكل شبكية العين. لقد قمنا بتقييم دقة المنهجية باستخدام ناقل AAV يعبر عن مراسل tdTomato. مقارنة نتائج DD-PCR مع مستويات التعبير tdTomato مترابطة باستثناء القيم المتطرفة اثنين. الشبكية # 6 و # 7 أسفرت عن نسخ الجينوم AAV الزائدة على الرغم من إظهار كثافة مضان مماثلة بالمقارنة مع شبكية العين # 2،3 4 أو 5. قد يكون هذا لأن هذه الشبكية لديها معدلات نقل أعلى مع مستويات التعبير محدودة أو قد تكون مرتبطة جزئيا إلى جزيئات AAV دائمة أو الحمض النووي ناقلات داخل شبكية العين الزجاجية أو العصبية19,20. وعموما، كان هذا هو العامل الوحيد المقيد لطريقتنا ويمكن التعرف عليه بسهولة من بين عينات أخرى. كما قمنا بقياس العدد الإجمالي لجينوم AAV لكل شبكية العين التي كانت واحدة من نقاط القوة في هذه المنهجية. وهذا يسمح بالمقارنة بين البيانات بين مختلف المختبرات ودفعات من الحيوانات. لذلك ، يمكن تطبيق هذه الطريقة بسهولة لتقييم كفاءة النقل لنوع مصلي جديد أو متغير أو دفعة إلى تباين دفعي لنواقل AAV التي ليس لها تعبير مراسل وتساعدنا على مقارنة البيانات في بيئات مختلفة. وهذا أمر بالغ الأهمية بالنسبة لمتجهات AAV التي لا تسمح بالتعبير عن المراسل بسبب قيود الحجم.
توفر هذه الطريقة أيضا أساسا لأنواع أخرى من المقايسات الحساسة التي تستخدم الحمض النووي المستهدف. باستخدام بروتوكولات متطابقة، يمكننا تحديد أرقام نسخ الجينوم الميتوكوندريا مع التمهيديات المناسبة. ومن الممكن أيضا إدخال تحسينات أخرى بما في ذلك انفصال الشبكية وخطوات فرز قياس التدفق الخلوي لتحديد الحمض النووي المستهدف في خلايا واحدة أو دفعات من الخلايا. وعلاوة على ذلك، فمن الممكن أيضا لتقييم كفاءة تصحيح التحرير قاعدة باستخدام هذه الطريقة21،22، وهو أمر بالغ الأهمية أيضا لعدة أمراض الشبكية والعلاجات الجينية.
Disclosures
وليس لدى صاحبي البلاغ ما يكشفان عنه.
Acknowledgements
نود أن نشكر أويزكان كيليس وجوزفين جوتنر والبروفيسور بونتند روسكا، معهد بازل لطب العيون الجزيئي والسريري، منصة الفيروسات المعقدة لمساعدتهم ودعمهم لإنتاج AAV. كما نود أن نشكر البروفيسور جان بينيت، كلية بيرلمان للطب، جامعة بنسلفانيا على سلالة AAV8/BP2. يتم تنفيذ الأعمال الحيوانية في منشأة الحيوانات في جامعة Gebze التقنية. ولهذا نشكر ليلى ديكميتاس والبروفيسور أويغار هاليس تازباي على المساعدة التقنية والدعم تربية الحيوانات. كما نود أن نشكر الدكتورة فاطمة أوزدمير على تعليقاتها على المخطوطة. ويدعم هذا العمل من قبل TUBITAK، أرقام المنح 118C226 و 121N275، ومنحة الاندماج جامعة سابانشي.
Materials
| Name | Company | Catalog Number | Comments |
| 96-Well Semi-Skirted ddPCR plates | BioRad | 12001925 | ddPCR |
| Amicon Filter | Millipore | UFC910096 | AAV |
| C1000 TOUCH 96 DEEP WELLS | BioRad | 1851197 | ddPCR |
| C57BL/6JRj mice strain | Janvier | C57BL/6JRj | Mice |
| DG8 gaskets | BioRad | 1863009 | ddPCR |
| DG8 Cartridges | BioRad | 1864008 | ddPCR |
| DMEM | Lonza | BE12-604Q | AAV |
| DPBS | PAN BIOTECH | L 1825 | AAV |
| Droplet generation oil eva green | BioRad | 1864006 | ddPCR |
| Droplet reader oil | BioRad | 1863004 | ddPCR |
| FBS | PAN BIOTECH | p30-3306 | AAV |
| Foil seals for PX1 PCR Plate sealer | BioRad | 1814040 | ddPCR |
| Insulin Syringes | BD Medical | 320933 | Intravitreal injection |
| Isoflurane | ADEKA ILAC SANAYI VE TICARET | N01AB06 | anesthetic |
| Microinjector MM33 | World Precision Instruments | 82-42-101-0000 | Intravitreal injection |
| Micron IV | Phoenix Research Labs | Micron IV | Microscopy system based on 3-CCD color camera, frame grabber, and off-the-shelf software enables researchers to image mouse retinas. |
| Mydfrin (%2.5 phenylephrine hydrochloride) | Alcon | S01FB01 | pupil dilation |
| Nanofil Syringe 10 μl | World Precision Instruments | NANOFIL | Intravitreal injection |
| Needle RN G36, 25 mm, PST 2 | World Precision Instruments | NF36BL-2 | Intravitreal injection |
| PEI-MAX | Polyscience | 24765-1 | AAV |
| Penicillin-Streptomycin | PAN BIOTECH | P06-07100 | AAV |
| Plasmid pHGT1-Adeno1 | PlasmidFactory | PF1236 | AAV |
| Pluronic F-68 | Gibco | 24040032 | AAV |
| PX1 PCR Plate Sealer system | BioRad | 1814000 | ddPCR |
| QX200 ddPCR EvaGreen Supermix | BioRad | 1864034 | ddPCR |
| QX200 Droplet Reader/QX200 Droplet Generator | BioRad | 1864001 | ddPCR |
| SPLITTER FORCEP WATCHER MAKER - LENGTH = 13.5 CM | endostall medical | EJN-160-0155 | Retina isolation |
| Steril Syringe Filter | AISIMO | ASF33PS22S | AAV |
| Tissue Genomic DNA Kit | EcoSpin | E1070 | gDNA isolation |
| Tobradex (0.3% tobramycin / 0.1% dexamethasone) | Alcon | S01CA01 | anti-inflammatory / antibiotic |
| Tropamid (% 0.5 tropicamide) | Bilim Ilac Sanayi ve Ticaret AS. | S01FA06 | pupil dilation |
| Turbonuclease | Accelagen | N0103L | AAV |
| Viscotears (carbomer 2 mg/g) | Bausch+Lomb | S01XA20 | lubricant eye drop |
References
- Herrmann, A. K., Grimm, D. High-throughput dissection of AAV-host interactions: The fast and the curious. Journal of Molecular Biology. 430 (17), 2626-2640 (2018).
- Pillay, S., Carette, J. E. Host determinants of adeno-associated viral vector entry. Current Opinion in Virology. 24, 124-131 (2017).
- Castle, M. J., Turunen, H. T., Vandenberghe, L. H., Wolfe, J. H. Controlling AAV tropism in the nervous system with natural and engineered capsids. Methods in Molecular Biology. 1382, 133-149 (2016).
- Agbandje-McKenna, M., Kleinschmidt, J. AAV capsid structure and cell interactions. Methods in Molecular Biology. 807, 47-92 (2011).
- Han, I. C., et al. Retinal tropism and transduction of adeno-associated virus varies by serotype and route of delivery (intravitreal, subretinal, or suprachoroidal) in rats. Human Gene Therapy. 31 (23-24), 1288-1299 (2020).
- Muraine, L., et al. Transduction efficiency of adeno-associated virus serotypes after local injection in mouse and human skeletal muscle. Human Gene Therapy. 31 (3-4), 233-240 (2020).
- Cronin, T., et al. Efficient transduction and optogenetic stimulation of retinal bipolar cells by a synthetic adeno-associated virus capsid and promoter. EMBO Molecular Medicine. 6 (9), 1175-1190 (2014).
- Higashimoto, T., et al. The woodchuck hepatitis virus post-transcriptional regulatory element reduces readthrough transcription from retroviral vectors. Gene Therapy. 14 (17), 1298-1304 (2007).
- Pinheiro, L. B., et al. Evaluation of a droplet digital polymerase chain reaction format for DNA copy number quantification. Annals in Chemistry. 84 (2), 1003-1011 (2012).
- Albayrak, C., et al. Digital quantification of proteins and mrna in single mammalian cells. Molecular Cell. 61 (6), 914-924 (2016).
- Lock, M., Alvira, M. R., Chen, S. J., Wilson, J. M. Absolute determination of single-stranded and self-complementary adeno-associated viral vector genome titers by droplet digital PCR. Hum Gene Therapy Methods. 25 (2), 115-125 (2014).
- Juttner, J., et al. Targeting neuronal and glial cell types with synthetic promoter AAVs in mice, non-human primates and humans. Nature Neuroscience. 22 (8), 1345-1356 (2019).
- Vandenberghe, L. H., et al. Efficient serotype-dependent release of functional vector into the culture medium during adeno-associated virus manufacturing. Human Gene Therapy. 21 (10), 1251-1257 (2010).
- Barben, M., Schori, C., Samardzija, M., Grimm, C. Targeting Hif1a rescues cone degeneration and prevents subretinal neovascularization in a model of chronic hypoxia. Molecular Neurodegeneration. 13 (1), 12(2018).
- Chan, K. Y., et al. Engineered AAVs for efficient noninvasive gene delivery to the central and peripheral nervous systems. Nature Neuroscience. 20 (8), 1172-1179 (2017).
- Guiet, R., Burri, O., Seitz, A. Open source tools for biological image analysis. Methods Molecular Biology. 2040, 23-37 (2019).
- Parks, M. M., et al. Variant ribosomal RNA alleles are conserved and exhibit tissue-specific expression. Science Advances. 4 (2), (2018).
- Aurnhammer, C., et al. Universal real-time PCR for the detection and quantification of adeno-associated virus serotype 2-derived inverted terminal repeat sequences. Human Gene Therapy Methods. 23 (1), 18-28 (2012).
- Maclachlan, T. K., et al. Preclinical safety evaluation of AAV2-sFLT01- a gene therapy for age-related macular degeneration. Molecular Therapy. 19 (2), 326-334 (2011).
- Stieger, K., et al. Detection of intact rAAV particles up to 6 years after successful gene transfer in the retina of dogs and primates. Molecular Therapy. 17 (3), 516-523 (2009).
- Gyorgy, B., et al. Allele-specific gene editing prevents deafness in a model of dominant progressive hearing loss. Nature Medicine. 25 (7), 1123-1130 (2019).
- Cox, D. B. T., et al. RNA editing with CRISPR-Cas13. Science. 358 (6366), 1019-1027 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved