Method Article
Исследование мигреноподобного поведения с использованием легкого отвращения у мышей
В этой статье
Резюме
Грызуны не могут сообщать о симптомах мигрени. Здесь мы описываем управляемую тестовую парадигму (анализы светлого/темного и открытого поля) для измерения легкого отвращения, одного из наиболее распространенных и надоедливых симптомов у пациентов с мигренью.
Аннотация
Мигрень является сложным неврологическим расстройством, характеризующимся головной болью и сенсорными аномалиями, такими как гиперчувствительность к свету, наблюдаемая как светобоязнь. Хотя невозможно подтвердить, что мышь испытывает мигрень, легкое отвращение может быть использовано в качестве поведенческого суррогата симптома мигрени светобоязни. Чтобы проверить отвращение к свету, мы используем анализ света / темноты для измерения времени, которое мыши свободно выбирают для проведения в светлой или темной среде. Анализ был усовершенствован путем введения двух критических модификаций: предварительного воздействия на камеру перед запуском процедуры испытания и регулируемого освещения камеры, позволяющего использовать диапазон интенсивности света от 55 люкс до 27 000 люкс. Поскольку выбор проводить больше времени в темноте также свидетельствует о тревоге, мы также используем светонезависимый тест на беспокойство, анализ открытого поля, чтобы отличить беспокойство от светоаверсивного поведения. Здесь мы описываем модифицированную тестовую парадигму для анализов света/тьмы и открытого поля. Применение этих анализов описано для внутрибрюшинной инъекции пептида, связанного с геном кальцитонина (CGRP), в двух штаммах мышей и для исследований оптогенетической стимуляции мозга.
Введение
Мигрень является распространенным неврологическим заболеванием, затрагивающим примерно 17% американцев1, и является второй по значимости причиной инвалидности во всем мире2,3. Пациенты испытывают головную боль, которая длится 4-72 часа, сопровождающуюся, по крайней мере, одним из следующих симптомов: тошнота и / или рвота или светобоязнь и фонофобия4. Недавние достижения в разработке антител к пептидам, связанным с геном кальцитонина (CGRP), которые в настоящее время одобрены FDA, начали новую эру для лечения мигрени5,6,7. Эти антитела блокируют либо CGRP, либо его рецептор и предотвращают симптомы мигрени примерно у 50% пациентов с мигренью7. В течение прошлого года два низкомолекулярных антагониста рецептора CGRP также были одобрены FDA для абортивного лечения мигрени, и еще два находятся в стадии разработки8. Несмотря на этот терапевтический прогресс, механизмы, с помощью которых происходят приступы мигрени, все еще остаются неуловимыми. Например, сайты действия CGRP неизвестны. Эффективность терапевтических антител, которые заметно не пересекают гематоэнцефалический барьер, предполагает, что CGRP действует на периферические участки, такие как мозговые оболочки и / или тройничные ганглии. Однако нельзя исключать центральных действий на обходные органы, у которых отсутствует гематоэнцефалический барьер9. По крайней мере, для светобоязни мы думаем, что это менее вероятно, учитывая наши результаты со световым отвращением с использованием трансгенных мышей nestin / hRAMP1, у которых hRAMP1 чрезмерно экспрессируется в нервной ткани10. Понимание механизмов патофизиологии мигрени предоставит новые возможности для развития терапии мигрени.
Доклинические животные модели имеют решающее значение для понимания механизмов заболевания и разработки новых лекарств. Тем не менее, оценка мигрени у животных является сложной задачей, поскольку животные не могут устно сообщать о своих ощущениях боли. Учитывая тот факт, что 80-90% пациентов с мигренью проявляют светобоязнь11, легкое отвращение считается показателем мигрени на животных моделях. Это привело к необходимости разработки анализа для оценки отвращения к свету у мышей.
Анализ светлый/темный содержит светлую зону и темную зону. Он широко используется для измерения тревоги у мышей на основе их спонтанного исследования новых сред, которому противостоит их врожденное отвращение к свету12. Некоторые исследования устанавливают 1/3 камеры в качестве темной зоны, в то время как другие устанавливают 1/2 камеры в качестве темной зоны. Прежняя настройка часто используется для обнаружения тревоги13. Хотя мы изначально выбрали одинаковые светлые / темные камеры, мы не сравнивали два относительных размера. Мы можем отметить, что общий размер обеих камер не является основным фактором, поскольку первоначальный испытательный бокс14 был значительно больше, чем последующий аппарат15, но результаты были по существу одинаковыми.
Двумя критическими модификациями этого анализа света/темноты для оценки отвращения к свету были: условие тестирования и интенсивность света (рисунок 1). Во-первых, мышей предварительно подвергают воздействию светло-темной камеры, чтобы уменьшить исследовательский драйв16 (рисунок 1A). Необходимость и время предварительной экспозиции зависят от штаммов и моделей мышей. Мышам дикого типа C57BL/6J обычно требуется два предварительных воздействия10, в то время как для мышей CD1 достаточно только одного предварительного воздействия17. Таким образом, светоносное поведение может быть разоблачено в этих двух штаммах мыши. Во-вторых, освещение камеры было адаптировано для включения регулируемого диапазона интенсивности света от тусклого (55 люкс) до яркого (27 000 люкс), где 55 люкс сравнимы с темным пасмурным днем, а 27 000 люкс сравнимы с ярким солнечным днем в тени10. Мы обнаружили, что требуемая интенсивность света варьируется в зависимости от штамма и генетической модели. По этой причине люди должны сначала оценить минимальную интенсивность света для своей экспериментальной парадигмы.
Даже с этими модификациями анализа, которые могут выявить светоносный фенотип, необходимо проверить тревожное поведение, чтобы различать отвращение к свету из-за одного только света и из-за тревоги. Анализ в открытом поле — это традиционный способ измерения тревоги, основанный на спонтанном исследовании новых сред. Он отличается от анализа света / темноты тем, что исследовательскому драйву противостоит врожденное отвращение к незащищенным открытым пространствам. Как центр, так и края камеры находятся на свету, поэтому анализ открытого поля является светонезависимым анализом тревоги. Таким образом, сочетание анализа светлого/темного и открытого поля позволяет нам различать отвращение к свету из-за избегания света и общее увеличение тревоги.
CGRP является многофункциональным нейропептидом, который регулирует расширение сосудов, ноцицепцию и воспаление18. Широко выражен в периферической и центральной нервной системах. Он играет важную роль в патофизиологии мигрени18. Однако механизм, лежащий в основе действия CGRP при мигрени, неясен. Используя анализы светлого/темного и открытого поля с этой модифицированной тестовой парадигмой, мы смогли идентифицировать светоаверсивное поведение у мышей после периферийного 10,16 (рисунок 2) и центрального введения CGRP14,15,16,19. В дополнение к нейропептидам, идентификация областей мозга, участвующих в неприятии света, также важна для понимания патофизиологии мигрени. Задние таламические ядра представляют собой интегративную область мозга для обработки боли и света19, а таламус активируется во время мигрени20. Таким образом, мы нацелились на задние таламические ядра, введя в эту область аденоассоциированный вирус (AAV), содержащий каналродопсин-2 (ChR2) или eYFP. Объединив этот оптогенетический подход с этими двумя анализами, мы продемонстрировали, что оптическая стимуляция ChR2-экспрессирующих нейронов в задних таламических ядрах вызывает отвращение к свету19 (рисунок 3). В этом эксперименте, учитывая драматическое влияние на вызванное отвращение к свету у этих оптогенетически манипулируемых мышей, предварительное воздействие камеры было пропущено.
протокол
Процедуры для животных были одобрены Комитетом по уходу и использованию животных Университета Айовы и выполнены в соответствии со стандартами, установленными Национальными институтами здравоохранения.
1. Анализ света/темноты
- Установка аппарата светлой/темной камеры (см. Таблицу материалов). Все оборудование в этом разделе находится в коммерческом доступе.
- На полке поместите звукопоглощающую кабину (внутренняя часть: 59,7 x 38 x 35,6 см в Ш x В x Г), содержащую выдвижной ящик для легкого доступа к камере и темную вставку.
- Подключите блок питания постоянного тока и блок питания с регулируемым постоянным током к звукопоглощающей кабине.
- Поместите прозрачную бесшовную камеру открытого поля (27,31 x 27,31 x 20,32 см в Д x Ш x В) на выдвижной ящик кабины.
- Поместите черную инфракрасную (ИК)-прозрачную пластиковую темную вставку (28,7 X 15 X 20,6 см Д x Ш x В) в камеру открытого поля. Убедитесь, что камера разделена на две зоны одинакового размера: темную зону и светлую зону.
- Подключите три комплекта 16-лучевых ИК-массивов на осях X, Y и Z камеры открытого поля к ИК-контроллеру USB с помощью кабелей.
- Подключите ИК-контроллер USB к компьютеру.
- Установите на компьютер программное обеспечение для отслеживания, которое может записывать и собирать данные о местоположении и активности мыши.
- Для настройки световой панели сначала снимите светодиодную (LED) световую панель (27,70 x 27,70 см в Д х Ш; 360 светодиодов, цвет с балансом дневного света, 5600K, распространение луча 60 °) из ее первоначального корпуса.
- Соберите панель освещения со светодиодным драйвером, радиатором и блоком питания. Несколько светодиодных панелей могут быть подключены к одному источнику питания, радиатору и светодиодному драйверу для достижения равномерного управления световой панелью.
- Постройте индивидуальную акриловую платформу (29,77 x 27,70 x 8,10 см в Д х Ш х В), состоящую из 7 одинаковых полок с интервалом 0,53 см (рисунок 1B). Постоянно прикрепляйте индивидуальную акриловую полку к потолку внутри кабины над камерой.
- Вставьте светодиодную панель в прорезь между двумя нижними полками. Отрегулируйте световую панель на разную высоту (рисунок 1B, C), если это необходимо (например, при использовании оптогенетических мышей. Подробности обсуждаются в разделе 3).
- Включите радиатор, светодиодный драйвер и блок питания. Убедитесь, что светодиодный драйвер может диктовать интенсивность светодиодного света, измеряя интенсивность света на полу камеры, и убедитесь, что пол освещен равномерно.
- Процедура поведенческого теста
ПРИМЕЧАНИЕ: Мыши размещаются на 12-часовом световом цикле. Все поведенческие эксперименты проводятся во время светового цикла. Используются мыши, в том числе как самцы, так и самки, в возрасте 10-20 недель. В этом протоколе наивные мыши дикого типа CD1 и C57BL/6J испытывают два предварительных воздействия на светло-темную камеру с последующим воздействием с лечением и воздействием после обработки. Существует трехдневный интервал между каждым воздействием, чтобы позволить мышам восстановиться (день 1, 4, 7 и 10, как описано ниже и на рисунке 1A). Тем не менее, мыши CD1 не требуют 2-й предварительной экспозиции и могут быть протестированы при тусклом свете.- На 1-й день (предварительная обработка 1) включите прибор для анализа света/темноты и установите интенсивность света на 27 000 люкс.
- Откройте программное обеспечение для отслеживания и настройте новый протокол. В параметре Новый протокол установите для параметра Длительность значение 30 мин. В параметре Новый анализ установите для параметра Корзины данных по длительности значение 300 с.
- В параметре Новая зона выберите Предварительно определенные зоны. Выберите 2 , а затем Горизонтальная. Проверьте, разделена ли камера на две зоны одинакового размера горизонтально для записи.
- Приучайте мышей к испытательной комнате за 1 ч до тестирования. Во время привыкания держите свет в комнате включенным, чтобы не нарушить циркадный ритм мыши. Убедитесь, что все оборудование для анализа света / темноты включено, что позволяет мышам полностью акклиматизироваться в среде испытательной комнаты.
- Выберите Получить данные. Введите идентификаторы мыши. Запустите протокол.
- Вытащите ящик за пределы звукопоглощающей кабины, чтобы получить доступ к светло-темной камере и темной вставке. Осторожно поднимите мышь за основание хвоста, поместите ее в световую зону камеры и протолкните ящик внутрь кабинки. Убедитесь, что программное обеспечение немедленно обнаруживает мышь и начинает записывать активность.
- Подождите, пока запись автоматически прекратится через 30 минут. Верните мышь в ее домашнюю клетку.
- Очистите камеру и темную вставку с помощью спиртово-бактерицидных одноразовых салфеток, содержащих 55,0% изопропилового спирта, 0,25% алкил C12-18 диметилэтилбензиламмония и 0,25% алкила C12-18 диметилбензилхлорида аммония в качестве антимикробных активных ингредиентов для искоренения любых обонятельных сигналов, оставленных предыдущей мышью.
- На 4-й день (предварительная обработка 2) повторите шаги 1.2.1-1.2.8.
- На 7 день (день лечения) повторите шаги 1.2.1 и 1.2.4. После привыкания вводят CGRP (0,1 мг/кг, 10 мкл/г в зависимости от массы тела мыши, внутрибрюшинную инъекцию (т.п.)), наклоняя голову мыши вперед и вводя в нижний правый квадрант. Верните мышь в домашнюю клетку.
- Через 30 минут запустите протокол и запустите мышь в светлой/темной камере, как указано в шагах 1.2.5-1.2.7. Время восстановления в домашних клетках после инъекций может быть сокращено или удлинено в зависимости от лечения21.
- Очистите камеру и темную вставку, как описано на этапе 1.2.8.
- На 10-й день (день после лечения) повторите шаги с 1.2.1 по 1.2.8. Эксперимент может быть приостановлен на шаге 1.2.13 перед началом анализа в открытом поле.
2. Анализ в открытом грунте
- Настройка аппарата
- Установка камеры открытого поля: Используйте ту же звукопоглощающую кабину и камеру открытого поля, используемую в анализе света / темноты, без использования темной вставки.
- Настройка светлой панели: используйте ту же настройку, которая используется в анализе света / темноты. Убедитесь, что интенсивность света такая же, как и при анализе света/темноты.
- Процедура поведенческого теста
- Включите аппарат. Установите интенсивность света на 27 000 люкс.
- Откройте программное обеспечение для отслеживания.
- Настройте новый протокол, такой же, как используется в анализе света/темноты, за исключением настроек новой зоны . Выберите 1 , а затем Центр в настройках новой зоны . Установите периферию на расстоянии 3,97 см от периметра, а центр на 19,05 × 19,05 см.
- Приучите мышей к испытательной комнате, как описано на этапе 1.2.4.
- Вводят CGRP (0,1 мг/кг, 10 мкл/г в зависимости от массы тела мыши, т.е.), наклоняя голову мыши вперед и вводя в нижний правый квадрант. Верните мышь в домашнюю клетку.
- Через 30 минут запустите протокол. Вытащите выдвижной ящик за пределы звукопоглощающей кабины и аккуратно поместите мышь в середину камеры открытого поля. Протолкните ящик внутрь кабинки.
- Отслеживайте поведение в течение 30 мин. Затем верните мышей в их домашние клетки.
- Очистите устройство, как описано на этапе 1.2.8.
3. Модифицированный светлый/темный анализ для оптогенетических мышей
- Настройка аппарата
- Внесите две модификации в темную вставку.
- Измените отверстие темной вставки до 5,08 x 5,08 см (Ш x В) с небольшой щелью 0,95 x 10,16 см (Ш X В) между верхом и отверстием темной вставки (рисунок 1D вверху слева).
ПРИМЕЧАНИЕ: Эта модификация позволяет мыши без труда перейти в темную зону, когда волоконно-оптическая канюля на головке мыши прикреплена к патч-корду. - Вытяните верхнюю часть темной вставки на светлую область в виде треугольного крыльца (H = 6,5 см) (рисунок 1D вверху справа и внизу слева). Вырежьте круглое отверстие (D = 1,7 см) из крыльца и вставьте держатель в отверстие, чтобы разместить и стабилизировать вращающееся соединение, которое соединяет лазер и волоконно-оптические патч-корды (рисунок 1D вверху слева и внизу слева).
ПРИМЕЧАНИЕ: Изменения приводят к небольшому изменению интенсивности света, достигающего пола темной зоны (17 люкс с модификациями против 14 люкс без модификаций, измеренных в заднем правом углу темной зоны под 27 000 люкс).
- Измените отверстие темной вставки до 5,08 x 5,08 см (Ш x В) с небольшой щелью 0,95 x 10,16 см (Ш X В) между верхом и отверстием темной вставки (рисунок 1D вверху слева).
- Вставьте поворотное соединение в держатель на темной вставке.
- Подключите волоконно-оптический патч-корд диаметром 30,5 см к ротационному соединению. Убедитесь, что поворотный шарнир может вращаться плавно, так что патч-корд может вращаться без затруднений, когда мышь пересекает камеру.
- Для остальной части установки используйте ту же установку оборудования, которая используется в разделе 1 (анализ светлый/темный).
- Внесите две модификации в темную вставку.
- Процедура поведенческого теста
ПРИМЕЧАНИЕ: В отличие от мышей дикого типа, оптогенетические мыши не получают предварительного воздействия (предварительная обработка 1 и 2).- В день тестирования вставьте светодиодную панель во второй самый нижний слот (28,23 см от пола развала), чтобы освободить место для подключения патч-корда. Включите прибор для анализа света/темноты и установите интенсивность света на 55 люкс.
- Используйте ту же настройку протокола, что и в разделах 1.2.2 и 1.2.3, за исключением того, что в параметре «Новый анализ» для параметра «Корзины данных по длительности» установлено значение 60 с, чтобы оно соответствовало протоколу лазерной стимуляции на шаге 3.2.3.
- Включите кнопку питания лазера. Установите контроллер лазерных импульсов на стимуляцию в течение 1 мин, затем 1 мин без стимуляции в течение 30 мин.
- Приучайте мышей к комнате для тестирования с включенным светом в течение 1 ч до начала тестирования.
- Запустите протокол. Вытащите выдвижной ящик за пределы звукопоглощающей кабины, чтобы получить доступ к светлой/темной камере и темной вставке.
- Осторожно удерживайте мышь и соедините канюлю с оптическим волокном на головке мыши с волоконно-оптическим патч-кордом через брачный рукав (рисунок 1D внизу справа). Осторожно поместите мышь в зону освещения и протолкните ящик внутрь кабинки. Убедитесь, что протокол начнет записывать поведение мыши автоматически.
- Через 1 мин включите импульсный контроллер, а затем поверните отказоустойчивый ключ в положение ВКЛ. Убедитесь, что лазерная стимуляция целевой области мозга происходит каждые две минуты.
- Через 30 минут, когда протокол автоматически останавливается, поверните отказоустойчивый ключ в положение OFF. Затем выключите импульсный контроллер.
- Разъедините мышь и волоконно-оптический патч-корд. Верните мышь в домашнюю клетку.
- Очистите камеру и темную вставку, как описано на этапе 1.2.8.
4. Модифицированный анализ открытого поля для оптогенетических мышей
- Настройка аппарата
- Стабилизируйте поворотное соединение над камерой с помощью подставки и зажима (рисунок 1Е).
- Подключите волоконно-оптический патч-корд длиной 50 см к ротационному соединению. Проверьте, может ли поворотный шарнир плавно вращаться.
- Установите поворотный шарнир на соответствующую высоту на подставке: убедитесь, что волоконно-оптический патч-корд может только достичь каждого угла камеры, что поможет избежать любых помех движению мыши.
- Для остальной части установки используйте ту же установку устройства, что и в разделе 1 (светлый/темный анализ), но без темной вставки.
- Процедура поведенческого теста
- Включите прибор для анализа света/темноты и установите интенсивность света на 55 люкс.
- Используйте ту же настройку протокола, что и в модифицированном анализе света/темноты (раздел 3), за исключением настроек новой зоны . Выберите 1 , следующий по центру , в настройках новой зоны . Установите периферию на расстоянии 3,97 см от периметра, а центр на 19,05 × 19,05 см.
- Включите кнопку питания лазера. Установите лазерный импульсный контроллер для стимуляции в течение 1 мин с последующим 1 мин без стимуляции в течение 30 мин.
- Выполнить привыкание и остальную часть испытания, как описано на этапах 3.2.4-3.2.10, за исключением двух изменений в шаге 3.2.6: осторожно поместить мышь в середину камеры вместо зоны освещения; держите выдвижной ящик за пределами кабины благодаря патч-корду, соединяющемуся с головкой мыши.
Результаты
Эта парадигма поведенческого теста предназначена для проверки светоаверсивного поведения. Это может быть выполнено с использованием как наивных мышей дикого типа, так и оптогенетических мышей для исследования отвращения к свету в режиме реального времени во время стимуляции целевой популяции нейронов.
Эта процедура была использована для изучения влияния периферического лечения CGRP у мышей CD1 и C57BL/6J10,16 и оптической стимуляции нейронов в задних таламических ядрах у мышей C57BL/6J19 на светоносное поведение. Мыши, включая как самцов, так и самок, в возрасте 10-20 недель, были использованы в экспериментах (рисунок 2A, рисунок 2B-D и рисунок 3). Результаты показали, что i.p. инъекция CGRP значительно уменьшала продолжительность времени, проведенного в светлой зоне в анализе света/темноты у мышей CD1 (Рисунок 2A) и C57BL/6J (Рисунок 2B), но не влияла на время, проведенное мышами в центре в анализе в открытом поле у мышей CD1 (данные не показаны) и C57BL/6J (Рисунок 2D)10, 16. Это говорит о том, что периферический CGRP вызывает легкое отвращение, но не общую тревогу. Лечение CGRP также увеличивало количество времени, в течение которого мыши отдыхали в темной зоне, но не в светлой зоне как у CD1 (данные не показаны), так и у мышей C57BL/6J (рисунок 2C).
Для оптогенетического протокола мы нацелились на кальмодулинкиназу II альфа (CaMKIIa)-экспрессирующие нейроны в задних таламических ядрах путем инъекции AAV2-CaMKIIa-hChR2(E123A)-eYFP или контрольного вируса AAV2-CaMKIIa-eYFP19. Тогда же в задние таламические ядра была имплантирована волоконно-оптическая канюля. Через три недели после инъекции, чтобы обеспечить достаточное время для экспрессии ChR2, мы выполнили оптическую стимуляцию нейронов в задних таламических ядрах и отметили соответствующее уменьшение продолжительности пребывания мышей в светлой зоне в светло-темном анализе у мышей, которым вводили ChR2, по сравнению с контрольными мышами, которым вводили вирус (eYFP) (рисунок 3A). Не было отмечено никакой разницы во времени в центре в анализе открытого поля между ChR2 и контрольными мышами eYFP (рисунок 3C), что свидетельствует о светоносной реакции, которая не была вызвана исключительно тревогой19. Кроме того, было отмечено увеличение времени отдыха в темной зоне, но не в светлой зоне (рисунок 3В). Такие же результаты были получены при использовании 55 люкс и 27 000 люкс (рисунок 3). Процедура 55 люкс была включена, потому что пациенты с мигренью чувствительны даже к тусклому свету.

Рисунок 1: Временная шкала и аппарат для анализа света/темноты. (A) Временная шкала парадигмы тестирования: После двух предварительных воздействий в светло-темную камеру (Pre 1 и Pre 2) мышам вводят CGRP (0,1 мг/кг, т.п.) с последующим измерением после обработки (Post). По крайней мере, через день после анализа света / темноты мышам снова дают CGRP (0,1 мг / кг, т.е.) и проводят в открытом поле. Предварительно: предварительная обработка; Tx: лечение; Пост: постобработка (B) Светодиодная панель удерживается в верхней части камеры акриловой полкой и освещает область испытаний. Высоту световой панели можно регулировать с помощью пазов на разной высоте. (C) Светлая/темная камера содержит темную вставку с небольшим отверстием. Светодиодная панель находится над камерой. (D) Вид спереди, сбоку и сверху модифицированной темной вставки. Отверстие в темной вставке расширено небольшой щелью для движения патч-корда (вверху слева). Верхняя часть темной вставки простирается над светлой областью в виде треугольного крыльца с держателем для вращающегося соединения (вверху справа и внизу слева). Волоконно-оптический патч-корд подключается к волоконно-оптической канюле через брачный рукав (внизу справа). (E) Модифицированный анализ открытого поля. Подставка и зажим удерживают вращательное соединение. Камера вытягивается в переднюю часть кабины с открытыми дверями, чтобы обеспечить свободное движение мыши с патч-кордом, прикрепленным к головке мыши. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Периферическое введение CGRP вызывает отвращение к свету при ярком свете у двух штаммов мышей дикого типа. Мышей CD1 и C57/BL6J тестировали в соответствии с временной шкалой, описанной на рисунке 1A. (A) Время, проведенное мышами CD1 в зоне освещения с интервалом 5 мин в течение 30 мин (27 000 люкс). Время в световых данных отображается с течением времени во время теста (левая панель) и как среднее время на 5-минутный интервал для отдельных мышей (правая панель). В каждый момент времени проводились сопоставления между транспортным средством и CGRP, а также между Tx и Pre2 или Post, как указано в скобках. (Veh, n=19; 0,1 мг/кг CGRP, n=19) (B) Время, проведенное мышами C57BL/6J в световой зоне за 5-минутный интервал более 30 мин (27 000 люкс). Время в световых данных показано во времени во время теста (левая панель) и как среднее время на 5-минутный интервал для отдельных мышей (правая панель) (Veh, n=42; 0,1 мг/кг CGRP, n=44). (C) Мыши из панели B также были проанализированы на поведение покоя в темной и светлой зонах во время анализа света / темноты. (D) Мыши из группы B были впоследствии протестированы в открытом грунте. Процент времени, проведенного в центре камеры с интервалом 5 мин в течение 30 мин после обработки транспортным средством или CGRP (0,1 мг/кг, т.п.) (Veh, n=9; 0,1 мг/кг CGRP, n=9). Процент времени в центре данных отображается с течением времени во время теста (левая панель) и как средний процент времени в центре на 5-минутный интервал для отдельных мышей (правая панель). Для всех панелей показано среднее ±SEM, *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001. Эта цифра изменена из Mason et al. 201710. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
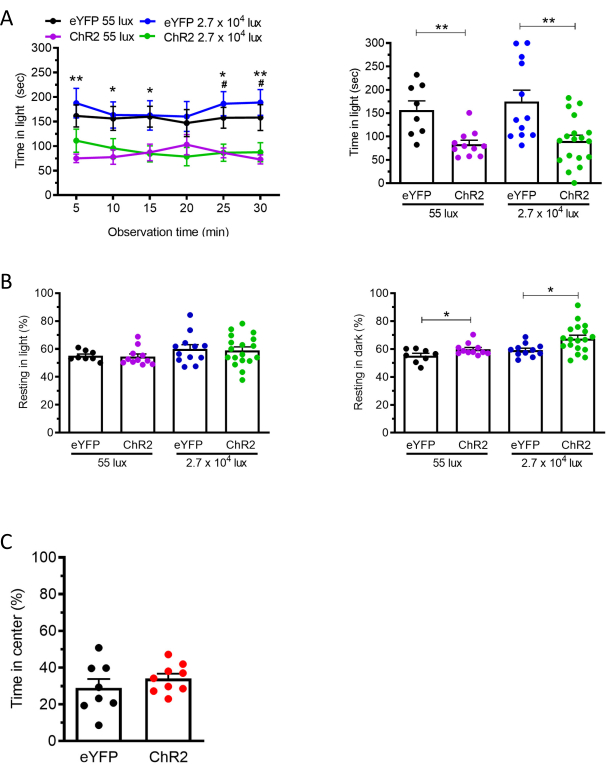
Рисунок 3: Оптическая стимуляция CaMKIIa-экспрессирующих нейронов в задних таламических ядрах индуцирует отвращение к свету как при тусклом, так и при ярком свете. (A) Задние таламические ядра мышей C57BL/6J, которым вводили AAV, кодирующие либо ChR2, либо eYFP (при 55 люксах: eYFP n = 8, ChR2 n = 11; при 27 000 люкс: eYFP n = 12, ChR2 n = 18) стимулировали синим лазером (473 нм, 20 Гц, длительность импульса 5 мс, 10 мВт/мм2). Левая панель показывает время, проведенное мышами в световой зоне с интервалом 5 мин с интервалом более 30 мин при 55 или 27 000 люкс. В каждый момент времени проводились сравнения между группами eYFP и ChR2. Правая панель показывает среднее время на 5-минутный интервал для отдельных мышей. (B) Мыши из панели A также были проанализированы на поведение покоя в светлой (левая панель) и темной (правая панель) зонах во время анализа света / темноты. (C) Мыши из группы А были впоследствии испытаны в анализе в открытом поле. Средний процент времени, проведенного в центре камеры открытого поля с интервалом 5 мин свыше 30 мин (лазер: 473 нм, 20 Гц, длительность импульса 5 мс, 10 мВт/мм2). (eYFP n = 8, ChR2 n = 9). Для всех панелей показано среднее±SEM, *p<0.05, **p<0.01, ***p<0.001, ****p<0.0001. Эта цифра изменена с Sowers et al. 202019. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Анализ светлый/темный широко используется для оценки тревожного поведения12. Анализ опирается на врожденное отвращение мышей к свету и их стремление исследовать при помещении в новую среду (зону света). Однако, как мы сообщаем здесь, этот анализ также может быть использован для оценки светоаверсивного поведения.
Крайне важно учитывать количество и необходимость предварительного воздействия до тестирования. Это зависит от штамма мыши или модели. Например, в нашем протоколе анализа света / темноты наивные мыши дикого типа CD1 и C57BL / 6J предварительно подвергаются предварительному воздействию светлой / темной камеры дважды перед прохождением процедуры тестирования лечения, в то время как оптогенетические мыши не подвергаются предварительному воздействию. В недавней публикации сообщалось, что одной предварительной экспозиции достаточно для того, чтобы мыши CD1 проявляли легкое отвращение после введения i.p. CGRP17. Следовательно, значимость параметра новизны уменьшится с приходом дня лечения10,16. Предварительные воздействия могут разоблачать светоаперсивные фенотипы, уменьшая исследовательский драйв и, таким образом, изменяя баланс между исследованием и отвращением. В некоторых случаях предварительная экспозиция не требуется. Например, у генетически измененных мышей с повышенными рецепторами CGRP в нервной системе предварительная экспозиция не была необходима14. Аналогичным образом, с оптогенетически манипулируемыми мышами, у которых CaMKIIa-экспрессирующие нейроны в задних таламических ядрах были нацелены на оптическую стимуляцию, предварительное воздействие не было необходимым, по-видимому, потому, что светоаверсивный ответ был настолько устойчивым при прямой стимуляции мозга19. Таким образом, количество и необходимость предварительного воздействия на камеру должны быть тщательно учтены при использовании различных штаммов или моделей мышей. Действительно, чрезмерное воздействие мышей в камеру может снизить исследовательское поведение. Это приведет к тому, что мыши преимущественно будут занимать темную зону, независимо от лечения, что снизит способность наблюдать светоаверсивный ответ. И наоборот, недостаточная предварительная экспозиция анализа может привести к исследовательскому поведению, маскирующему потенциальное светоощущающее поведение.
Воздействие после лечения служит для определения того, полностью ли мышь оправилась от инъекции CGRP, введенной за 2 дня до этого. Это важно перед запуском анализа в открытом поле или любого другого анализа, чтобы подтвердить, что нет эффекта длительного лечения, который повлияет на будущие поведенческие тесты.
Мы выбрали 30-минутную продолжительность протокола, основанную на предыдущих наблюдениях10. Мы тестировали мышей в светло-темном анализе в течение 10 мин15, 20 мин16 и 30 мин10 отдельно. CGRP уменьшал количество времени, проведенного мышами на свете между 0-30 мин, но после 30 мин контрольные мыши предпочитали проводить больше времени в темноте по сравнению с 0-30 мин, что приводило к решению тестировать в течение 30 мин. Аналогичным образом, продолжительность тестирования может быть скорректирована со ссылкой на кривую времени отклика для различных моделей мыши. Следует отметить, что удлинение времени воздействия на свето-темную камеру может снизить мотивацию к исследованию светлой зоны.
Мы проанализировали множество различных параметров для оценки поведения животных. Одной из существенных особенностей анализа света / темноты является измерение времени, которое мышь проводит в светлой зоне, непосредственно отражая отвращение к свету. Процент времени, затраченного на отдых, количество вертикальных разрывов луча (для измерения активности выращивания) в светлых или темных зонах и количество переходов между двумя зонами используются для оценки подвижности. Время отдыха и вертикальные разрывы луча нормируются к времени, проведенному в каждой зоне, чтобы избежать ложных выводов относительно движения. Мы включаем в анализы всех мышей, за исключением: мышей, которые остаются в светлой зоне в течение всех 30 минут тестирования, мышей, которые проводят более 90% времени, отдыхая в общей сложности (как в светлых, так и в темных зонах), и статистических выбросах (>3 SD от среднего). Количество мышей, которые исключены, как правило, составляет менее 1%. Для анализа в открытом поле процент времени в центре является основным измерением, используемым для оценки тревожного поведения.
В модифицированном светло-темном анализе позиционирование волоконно-оптической канюли в некоторых областях мозга может значительно ограничить движение мыши и, в некоторых случаях, помешать мыши достичь темной зоны. Следовательно, вход в темную зону будет отрицательно усилен и после нескольких попыток мышь может проявить выученное предпочтение к свету, даже оставаясь в светлой зоне в течение всего периода тестирования. Это можно исправить, изменив размер и форму отверстия в темной вставке. Например, когда волоконно-оптические канюли были установлены в мозжечке мышей дикого типа C57BL/6J, мыши испытывали трудности с пересечением отверстия темной вставки. После изменения ширины отверстия до 6,10 см вместо 5,08 см мыши смогли свободно пересекать отверстие.
Волоконно-оптический патч-корд длиной 30,5 см используется в модифицированном анализе света / темноты, основанном на размере камеры открытого поля, что позволяет мыши свободно перемещаться. Более короткая длина шнура не позволит мыши перемещаться по углам, в то время как более длинный кабель может запутаться и затруднить движение. Длина волоконно-оптического патч-корда, используемого для модифицированного анализа открытого поля, составляет 50 см. Длина не такая строгая, как в светло-темном анализе, так как высота поворотного соединения может быть отрегулирована в соответствии с длиной волоконно-оптического патч-кабеля, гарантируя, что мышь сможет просто добраться до углов камеры.
Основываясь на анализе мощности, 10-12 мышей в группе необходимы для мышей CD1 и C57BL / 6J с i.p. CGRP и для оптогенетических мышей C57BL / 6J для обнаружения значительного отвращения к свету. Тем не менее, размер группы C57BL/6J был значительно больше, чем размер группы CD1 (рисунок 2A, B), потому что мыши C57BL/6J не реагировали на CGRP в подмножестве тестов10, что означает, что было проведено несколько тестов для учета этой высокой изменчивости светоносного поведения у этих мышей. В частности, два эксперимента были объединены для мышей CD1 и четыре эксперимента были объединены для мышей C57BL/6J с i.p. CGRP (рисунок 2A,B)10. Причина этой изменчивости неизвестна, но люди также демонстрируют изменчивость в своих реакциях на CGRP и свет. Внутривенная (т.в.ч.) инъекция CGRP индуцировала приступы мигрени примерно у 63 ~ 75% пациентов с мигренью, причем 70 ~ 90% пациентов, у которых наблюдались приступы мигрени, проявляли светобоязнь22,23,24,25. В целом, анализ имеет значительную изменчивость и в дополнение к количеству мышей, важно провести по крайней мере два, а предпочтительно три полностью независимых эксперимента с различными когортами мышей.
Подстилка не требуется в светло-темной камере, и экспериментатор не обязан предварительно обрабатывать или приучать мышей. В качестве меры предосторожности две процедуры предварительного воздействия служат цели акклиматизации мышей к обонятельным и физическим сигналам экспериментатора; однако Ueno H. et al. продемонстрировали, что нет никакой разницы во времени в свете в анализе света / темноты или времени в центре в анализе в открытом поле между мышами после повторной обработки и мышами без обработки26.
Анализ в открытом поле может оценить вклад тревоги в светло-аверсивный фенотип. Существуют и другие хорошо подтвержденные анализы, связанные с тревогой, такие как лабиринт с повышенным нулем и с повышенным плюсом лабиринт27; однако анализ открытого поля является наиболее процедурно значимым средством контроля для протокола свет/темнота, поскольку для обоих анализов используется одна и та же испытательная камера. Тем не менее, оценка тревоги может быть усилена путем использования нескольких анализов или путем измерения нескольких параметров в одном тесте, учитывая, что тревога является сложным и многогранным поведением. Важно отметить, что даже если в анализе открытого поля нет фенотипа тревоги, это не исключает тревожного компонента светоносного фенотипа. Например, свет может вызывать реакцию тревоги. Анализ в открытом поле только показывает, что тревога сама по себе не управляет реакцией на свет. В то время как анксиолитический препарат, такой как бензодиазепам, может быть использован в этом анализе, такой подход будет иметь осложнения, например, анксиолитические препараты влияют на локомоцию. Вместо этого мы решили использовать клинические препараты против мигрени, включая суматриптан, чтобы подтвердить мигреноподобный статус светоаверсивного фенотипа. Суматриптан успешно обратил вспять CGRP-индуцированное легкое отвращение у мышей CD1 и C57BL/6J10.
В отличие от модифицированного светло-темного анализа, камера на выдвижном ящике находится за пределами кабины с дверцами кабины, открытыми в модифицированном анализе открытого поля из-за патч-корда, соединяющегося с головой мыши. Вместо 55 люкс свет комнаты достигает пола камеры при ~1000 люкс. Несмотря на то, что интенсивность света отличается, анализ открытого поля является светонезависимым тестом. В частности, увеличение интенсивности света с 55 до 27 000 люкс в анализе в открытом поле привело к тенденции уменьшения времени в центре у мышей C57BL / 6J, предполагая, что интенсивность света может влиять на поведение мыши28. Однако разница между контрольной и экспериментальной группами не была существенной ни под 55, ни под 27 000 люкс28. Кроме того, разница в интенсивности света между 55 и 1000 люкс гораздо более тонкая, чем между 55 и 27 000 люкс. Беспроводная оптогенетика может решить эту проблему, поскольку не будет патч-корда, что позволит протолкнуть камеру открытого поля внутрь звукопоглощающей кабины.
Кроме того, патч-корд по-прежнему ограничивает движение мыши, несмотря на выбор оптимальной длины. В будущем беспроводная оптогенетика будет предлагать неинвазивную альтернативу кабельным оптогенетическим методам.
Следует отметить, что мы использовали острую инъекцию CGRP, которая только частично воспроизводит длительное высвобождение CGRP, которое сопровождает приступы мигрени. В то время как мы вводили CGRP мышам для моделирования мигрени на основе предпосылки, что уровни CGRP в плазме были увеличены29 и что i.v CGRP индуцировал приступы мигрени у пациентов с мигренью22,23,24,25,30, это не будет воспроизводить состояние у пациента, где CGRP поддерживается на высоких уровнях в течение относительно длительного времени (измерения пациента были проведены в среднем через 3 часа после начала мигрени29 ), а также не воспроизводит хроническую мигрень, где уровни, как сообщается, повышены даже между приступами31. Более того, другие медиаторы, вызванные болью, не были проверены в нашей парадигме.
Группа Могила модифицировала возвышенный плюс лабиринт для измерения отвращения к свету у мышей, причем закрытые руки освещались ярким светом, а открытые объятия оставались темными32. Стандартный повышенный плюс лабиринт часто использовался для обнаружения тревожного поведения у животных. Этот анализ основан на конфликте между врожденным желанием мыши исследовать новую среду и помещением в компрометирующее положение в открытых незащищенных рукавах лабиринта. В модифицированном протоколе мыши вынуждены выбирать между закрытыми руками, которые освещаются ярким светом, и открытыми незащищенными руками, которые темные. Предпочтение первому предполагает, что тревога преобладает над легким отвращением, в то время как предпочтение второму предполагает, что легкое отвращение имеет приоритет над тревогой. Группа Могила также провела стандартный повышенный плюс лабиринт для оценки тревожного поведения32. Цель та же, что и проведение анализа в открытом поле в нашем протоколе. Мыши-мутанты Cacna1a, семейная модель гемиплегической мигрени, демонстрировали светобоязнь, когда сомкнутые руки были яркими. Напротив, тревожное поведение не было обнаружено, когда проводился стандартный повышенный плюс лабиринт32. У крыс, используя как модифицированный приподнятый плюс лабиринт, так и свето-темный анализ, было продемонстрировано, что нитроглицерин (НТГ) способен вызывать светобоязнь33,34, которая была спасена суматриптаном34. В стандартной обстановке с повышенным плюс лабиринтом, где свет отсутствует в закрытых руках, NTG индуцировал тревожное поведение у крыс34, предполагая, что вызванное NTG отвращение к свету сопровождается тревогой. Насколько нам известно, нет никаких публикаций, использующих анализ свет/темнота и модифицированный возвышенный лабиринт в одной и той же мышиной модели. В целом, как модифицированный приподнятый плюс лабиринт, так и анализ свет/темнота, предложенный в этом протоколе, были продемонстрированы как эффективные меры светоаверсивного поведения у мышей.
Мы используем светодиодную панель дневного света с цветом дневного света (5600K), с разбросом луча затопления 60 °, не давая тени на высоте ~ 30 см от пола камеры при 55 люкс или 27 000 люкс. Другие исследования, изучающие отвращение к свету, использовали анализ света / темноты с различными модификациями. Например, в исследованиях использовались различные интенсивности света для зоны света, варьирующиеся от сотен до тысяч люкс35,36,37; использованный свет на разных длинах волн (например, синий и желтый)38; или используются различные температуры света (холодный и теплый)39. Следует соблюдать осторожность в отношении тепла, производимого светом, поскольку оно может влиять на температуру темной и светлой зон и мешать поведению мышей, потенциально вызывая предпочтение определенной зоне. Кроме того, также важно использовать свет с хорошим углом обзора, чтобы избежать тени на полу камеры. Интенсивность света также важна для теста. 25 000 -27 000 люкс примерно эквивалентно яркому дневному свету. Проводя анализ света/темноты с такой высокой интенсивностью света, можно усилить эффект лечения; тем не менее, важно учитывать повреждение сетчатки40 и негативное влияние такой высокой интенсивности света на готовность мыши выходить на свет. В некоторых исследованиях сообщалось, что мышиные глаза, подвергшиеся воздействию прямого света41, и мыши, подвергшиеся воздействию яркого света в течение нескольких часов (например, 30 000 люкс в течение 4 часов 42), испытывали повреждение сетчатки. В светло-темном анализе есть темная зона, в которой мышь может убежать от яркого света, если мышь того пожелает. Кроме того, предыдущие исследования показали, что мыши в контрольной группе (мыши C57BL / 6J) проводили аналогичное количество времени в зоне освещения под 55, 1000 и 27 000 люкс28. Для мышей CD1 контрольная группа провела около 1/3 времени на свету под 27 000 люкс10, а неопубликованные данные показали аналогичные результаты при 55 люксах. Это говорит о том, что свет 27 000 люкс сам по себе не вызывает беспокойства у мышей CD1 и C57BL / 6J. Тем не менее, следует соблюдать осторожность при выборе более высокой интенсивности света.
Наряду с различиями в настройке света, исследователи выбрали различные подходы к анализу данных о свете / темноте. При оценке отвращения к свету в расчет включается количество времени, проведенного в световой зоне с выключенным светом (или при освещении красным светом светлой зоны, учитывая, что глаза мышей менее восприимчивы к красному свету). Например, индекс отвращения = (время в свете0 люкс в светостейшем люксе) / время в свете0 люкс был использован группой Горина для оценки отвращения к свету43. Здесь включены условия «выключенного света» или «красного света», чтобы подтвердить, что избегание световой зоны обусловлено присутствием света, а не простым предпочтением места. Мы провели эту процедуру с i.p. инъекцией CGRP и обнаружили, что мыши, получающие CGRP, не имели предпочтения места с выключенным светом в светлой зоне, подтверждая, что CGRP-индуцированное отвращение зависит от света16. Наконец, группа Горина использовала время, проведенное мышами на периферии светлой зоны в анализе свет/темнота, в качестве меры тревоги36. Мы используем традиционный тест на беспокойство, анализ в открытом поле. Независимо от того, какой метод анализа выбран, следует отметить, что вклад тревоги в отвращение к свету нельзя игнорировать. Этот протокол пытается разделить тревожное и светоносное поведение, используя анализы света / темноты и открытого поля в тандеме.
Этот протокол предназначен для использования анализов светло-темного и открытого поля для обнаружения светоаверсивного поведения у мышей. Это обеспечивает полезный инструмент для идентификации механизмов нейронных цепей и областей мозга, вызывающих светобоязнь. Тестовая парадигма может быть специфичной для мигрени или может быть расширена на другие расстройства, связанные со светобоязнью. Что касается мигрени, мы протестировали два других нейропептида, связанных с патогенезом мигрени: гипофиз аденилатциклазы-активирующий полипептид (PACAP) и вазоактивный кишечный пептид (VIP). Было продемонстрировано, что PACAP и VIP вызывают отвращение к свету у мышей CD17,21. Помимо мигрени, светобоязнь также является симптомом многих других расстройств, включая брадиопсию, острую травму глаза или воспаление, черепно-мозговые синдромы, болезнь Лайма, альбинизм и конусную дистрофию36. Таким образом, эта тестовая парадигма предоставляет инструмент для исследования механизмов, лежащих в основе расстройств, связанных со светобоязнью. Более того, сочетание оптогенетических методов с традиционными фармакологическими подходами, несомненно, поможет в разработке новых терапевтических средств для расстройств, связанных со светобоязнью.
Раскрытие информации
Авторы не имеют конфликта интересов, о которых можно было бы сообщить.
Благодарности
Эта работа была поддержана грантами NIH NS R01 NS075599 и RF1 NS113839. Содержание не отражает точку зрения VA или правительства Соединенных Штатов.
Материалы
| Name | Company | Catalog Number | Comments |
| Activity monitor | Med Assoc. Inc | Software tracking mouse behavior | |
| Customized acrylic shelf | For adjusting the height of the LED panel | ||
| Dark box insert | Med Assoc. Inc | ENV-511 | |
| DC power supply | Med Assoc. Inc | SG-500T | |
| DC regulated power supply | Med Assoc. Inc | SG-506 | |
| Fiber-optic cannula | Doric | MFC_200/ 240-0.22_4.5mm_ZF1.25_FLT | |
| Germicidal disposable wipes | Sani-Cloth | SKU # Q55172 | |
| Heat Sink | Wakefield | 490-6K | Connecting to LED panel |
| IR controller power cable | Med Assoc. Inc | SG-520USB-1 | |
| IR USB controller | Med Assoc. Inc | ENV-520USB | |
| Mating sleeve | Doric | SLEEVE_ZR_1.25 | |
| Modified LED light panel | Genaray Spectro | SP-E-360D | Daylight-balanced color (5600K) |
| Power supply | MEAN WELL USA | SP-320-12 | Connecting to LED panel |
| Seamless open field chamber | Med Assoc. Inc | ENV-510S | |
| Sound-attenuating cubicle | Med Assoc. Inc | ENV-022MD-027 | |
| Stand and clamp | |||
| Three 16-beam IR arrays | Med Assoc. Inc | ENV-256 |
Ссылки
- Loder, S., Sheikh, H. U., Loder, E. The prevalence, burden, and treatment of severe, frequent, and migraine headaches in US minority populations: statistics from National Survey studies. Headache. 55 (2), 214-228 (2015).
- Collaborators, G. B. D. H. Global, regional, and national burden of migraine and tension-type headache, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 954-976 (2018).
- GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 392 (10159), 1789-1858 (2018).
- international headache society. Headache classification committee of the international headache society (IHS). The international classification of headache disorders, 3rd edition. Cephalalgia. 38 (1), 1(2018).
- Edvinsson, L., Haanes, K. A., Warfvinge, K., Krause, D. N. CGRP as the target of new migraine therapies - successful translation from bench to clinic. Nature Reviews Neurology. 14 (6), 338-350 (2018).
- Rapoport, A. M., McAllister, P. The headache pipeline: Excitement and uncertainty. Headache. 60 (1), 190-199 (2020).
- Maasumi, K., Michael, R. L., Rapoport, A. M. CGRP and Migraine: The role of blocking calcitonin gene-related peptide ligand and receptor in the management of Migraine. Drugs. 78 (9), 913-928 (2018).
- Caronna, E., Starling, A. J. Update on calcitonin gene-related peptide antagonism in the treatment of migraine. Neurologic Clinics. 39 (1), 1-19 (2021).
- Eftekhari, S., Edvinsson, L. Possible sites of action of the new calcitonin gene-related peptide receptor antagonists. Therapeutic Advances in Neurological Disorders. 3 (6), 369-378 (2010).
- Mason, B. N., et al. Induction of migraine-like photophobic behavior in mice by both peripheral and central cgrp mechanisms. Journal of Neuroscience. 37 (1), 204-216 (2017).
- Russell, M. B., Rasmussen, B. K., Fenger, K., Olesen, J. Migraine without aura and migraine with aura are distinct clinical entities: A study of four hundred and eighty-four male and female migraineurs from the general population. Cephalalgia. 16 (4), 239-245 (1996).
- Crawley, J. N. Exploratory behavior models of anxiety in mice. Neuroscience and Biobehavioral Reviews. 9 (1), 37-44 (1985).
- Crawley, J., Goodwin, F. K. Preliminary report of a simple animal behavior model for the anxiolytic effects of benzodiazepines. Pharmacology, Biochemistry and Behavior. 13 (2), 167-170 (1980).
- Recober, A., et al. Role of calcitonin gene-related peptide in light-aversive behavior: implications for migraine. Journal of Neuroscience. 29 (27), 8798-8804 (2009).
- Recober, A., Kaiser, E. A., Kuburas, A., Russo, A. F. Induction of multiple photophobic behaviors in a transgenic mouse sensitized to CGRP. Neuropharmacology. 58 (1), 156-165 (2010).
- Kaiser, E. A., Kuburas, A., Recober, A., Russo, A. F. Modulation of CGRP-induced light aversion in wild-type mice by a 5-HT(1B/D) agonist. Journal of Neuroscience. 32 (44), 15439-15449 (2012).
- Kuburas, A., et al. PACAP induces light aversion in mice by an inheritable mechanism independent of CGRP. Journal of Neuroscience. , (2021).
- Russo, A. F. Calcitonin gene-related peptide (CGRP): a new target for migraine. Annual Review of Pharmacology and Toxicology. 55, 533-552 (2015).
- Sowers, L. P., et al. Stimulation of Posterior Thalamic Nuclei Induces Photophobic Behavior in Mice. Headache. 60 (9), 1961-1981 (2020).
- Afridi, S. K., et al. A positron emission tomographic study in spontaneous migraine. Archives of Neurology. 62 (8), 1270-1275 (2005).
- Mason, B. N., et al. Vascular actions of peripheral CGRP in migraine-like photophobia in mice. Cephalalgia. 40 (14), 1585-1604 (2020).
- Guo, S., Vollesen, A. L. H., Olesen, J., Ashina, M. Premonitory and nonheadache symptoms induced by CGRP and PACAP38 in patients with migraine. Pain. 157 (12), 2773-2781 (2016).
- Christensen, C. E., et al. Migraine induction with calcitonin gene-related peptide in patients from erenumab trials. Journal of Headache and Pain. 19 (1), 105(2018).
- Younis, S., et al. Investigation of distinct molecular pathways in migraine induction using calcitonin gene-related peptide and sildenafil. Cephalalgia. 39 (14), 1776-1788 (2019).
- Asghar, M. S., et al. Evidence for a vascular factor in migraine. Annals of Neurology. 69 (4), 635-645 (2011).
- Ueno, H., et al. Effects of repetitive gentle handling of male C57BL/6NCrl mice on comparative behavioural test results. Scientific Reports. 10 (1), 3509(2020).
- Campos, A. C., Fogaca, M. V., Aguiar, D. C., Guimaraes, F. S. Animal models of anxiety disorders and stress. Revista Brasileira De Psiquiatria. 35, 101-111 (2013).
- Kuburas, A., Thompson, S., Artemyev, N. O., Kardon, R. H., Russo, A. F. Photophobia and abnormally sustained pupil responses in a mouse model of bradyopsia. Investigative Ophthalmology and Visual Science. 55 (10), 6878-6885 (2014).
- Goadsby, P. J., Edvinsson, L., Ekman, R. Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Annals of Neurology. 28 (2), 183-187 (1990).
- Lassen, L. H., et al. CGRP may play a causative role in migraine. Cephalalgia. 22 (1), 54-61 (2002).
- Cernuda-Morollon, E., et al. Interictal increase of CGRP levels in peripheral blood as a biomarker for chronic migraine. Neurology. 81 (14), 1191-1196 (2013).
- Chanda, M. L., et al. Behavioral evidence for photophobia and stress-related ipsilateral head pain in transgenic Cacna1a mutant mice. Pain. 154 (8), 1254-1262 (2013).
- Mahmoudi, J., et al. Cerebrolysin attenuates hyperalgesia, photophobia, and neuroinflammation in a nitroglycerin-induced migraine model in rats. Brain Research Bulletin. 140, 197-204 (2018).
- Farajdokht, F., Babri, S., Karimi, P., Mohaddes, G. Ghrelin attenuates hyperalgesia and light aversion-induced by nitroglycerin in male rats. Neuroscience Letters. 630, 30-37 (2016).
- Jacob, W., et al. Endocannabinoids render exploratory behaviour largely independent of the test aversiveness: Role of glutamatergic transmission. Genes, Brain, and Behavior. 8 (7), 685-698 (2009).
- Thiels, E., Hoffman, E. K., Gorin, M. B. A reliable behavioral assay for the assessment of sustained photophobia in mice. Current Eye Research. 33 (5), 483-491 (2008).
- Ramachandran, R., et al. Role of Toll-like receptor 4 signaling in mast cell-mediated migraine pain pathway. Molecular Pain. 15, 1744806919867842(2019).
- Marek, V., et al. Implication of Melanopsin and Trigeminal Neural Pathways in Blue Light Photosensitivity in vivo. Frontiers in Neuroscience. 13, 497(2019).
- Christensen, S. L. T., Petersen, S., Sorensen, D. B., Olesena, J., Jansen-Olesen, I. Infusion of low dose glyceryl trinitrate has no consistent effect on burrowing behavior, running wheel activity and light sensitivity in female rats. Journal of Pharmacological and Toxicological Methods. 80, 43-50 (2016).
- De Vera Mudry, M. C., Kronenberg, S., Komatsu, S., Aguirre, G. D. Blinded by the light: retinal phototoxicity in the context of safety studies. Toxicologic Pathology. 41 (6), 813-825 (2013).
- White, D. A., Fritz, J. J., Hauswirth, W. W., Kaushal, S., Lewin, A. S. Increased sensitivity to light-induced damage in a mouse model of autosomal dominant retinal disease. Investigative Ophthalmology and Visual Science. 48 (5), 1942-1951 (2007).
- Song, D., et al. Retinal pre-conditioning by CD59a knockout protects against light-induced photoreceptor degeneration. PloS One. 11 (11), 0166348(2016).
- Matynia, A., et al. Light aversion and corneal mechanical sensitivity are altered by intrinscally photosensitive retinal ganglion cells in a mouse model of corneal surface damage. Experimental Eye Research. 137, 57-62 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены