Method Article
マウスの光嫌悪を用いた片頭痛様行動の調査
要約
げっ歯類は片頭痛の症状を報告することができません。ここでは、片頭痛患者で最も一般的で厄介な症状の1つである光の嫌悪感を測定するための管理可能なテストパラダイム(明暗およびオープンフィールドアッセイ)について説明します。
要約
片頭痛は、光恐怖症として観察される光に対する過敏症などの頭痛および感覚異常を特徴とする複雑な神経学的障害である。マウスが片頭痛を経験していることを確認することは不可能ですが、光嫌悪は、羞及症の片頭痛症状の行動代理として使用することができます。光の嫌悪感をテストするために、我々は明暗アッセイを利用して、マウスが明るい環境または暗い環境のいずれかで自由に過ごす時間を測定します。アッセイは、試験手順を実行する前のチャンバーへの事前暴露と調整可能なチャンバー照明の2つの重要な変更を導入することによって洗練されており、55ルクスから27,000ルクスまでの光強度の範囲の使用が可能です。暗闇の中でより多くの時間を過ごすという選択も不安の指標であるため、我々はまた、不安と光嫌悪行動を区別するために、光に依存しない不安テスト、オープンフィールドアッセイを利用する。ここでは、明暗およびオープンフィールドアッセイの修正テストパラダイムについて説明します。これらのアッセイの適用は、2匹のマウス系統におけるカルシトニン遺伝子関連ペプチド(CGRP)の腹腔内注射および光遺伝学的脳刺激研究のために記載されている。
概要
片頭痛は、アメリカ人の約17%が罹患している一般的な神経学的疾患であり1、世界の障害の2番目に多い原因です2,3。患者は、吐き気および/または嘔吐、または羞及およびフォノフォビアの少なくとも1つの症状を伴う4〜72時間持続する頭痛を経験する4。現在FDAの承認を受けているカルシトニン遺伝子関連ペプチド(CGRP)抗体の開発における最近の進歩は、片頭痛治療のための新しい時代を始めました5,6,7。これらの抗体はCGRPまたはその受容体のいずれかをブロックし、片頭痛患者の約50%で片頭痛症状を予防します7。過去1年以内に、CGRP受容体の2つの小分子アンタゴニストも片頭痛の中絶治療のためにFDAの承認を受けており、さらに2つがパイプラインにあります8。この治療の進歩にもかかわらず、片頭痛発作が起こるメカニズムは依然としてとらえどころのないままである。例えば、CGRP作用の部位は知られていない。血液脳関門を著しく通過しない抗体医薬の有効性は、CGRPが髄膜および/または三叉神経節などの末梢部位で作用することを示唆する。しかし、血液脳関門を持たない心室周囲器官の中枢作用を排除することはできません9。少なくとも光恐怖症については、hRAMP1が神経組織で過剰発現しているトランスジェニックネスチン/hRAMP1マウスを用いた光嫌悪の結果を考えると、これは起こりにくいと考えています10。片頭痛病態生理学のメカニズムを理解することは、片頭痛治療薬の開発に新しい道を提供するでしょう。
前臨床動物モデルは、疾患メカニズムの理解と新薬の開発に不可欠です。しかし、動物は痛みの感覚を口頭で報告することができないため、動物の片頭痛評価は困難です。片頭痛患者の80〜90%が光恐怖症11を示すという事実を考えると、光嫌悪は動物モデルにおける片頭痛の指標であると考えられている。これは、マウスにおける光嫌悪を評価するためのアッセイを開発する必要性につながった。
明暗アッセイには、明ゾーンと暗ゾーンが含まれています。これは、光に対する生来の嫌悪感によって打ち消される新しい環境の自発的な探索に基づいて、マウスの不安を測定するために広く使用されています12。いくつかの研究は、チャンバーの1/3をダークゾーンとして設定し、他の研究ではチャンバーの1/2をダークゾーンとして設定する。前者の設定は、不安を検出するためによく使用されます13。当初は同じサイズの明暗室を選択しましたが、2つの相対的なサイズは比較していません。最初のテストボックス14 は後続の装置15よりもかなり大きかったが、結果は本質的に同じであったため、両方のチャンバの全体的なサイズは大きな要因ではないとコメントすることができる。
光の嫌悪感を評価するためのこの明暗アッセイの2つの重要な変更は、試験条件と光強度でした(図1)。まず、マウスを明暗チャンバーに事前に曝露して、探索的駆動16 を減少させます(図1A)。事前暴露の必要性と時間は、マウスの系統とモデルに依存します。野生型C57BL/6Jマウスは通常、2回の事前ばく露が必要ですが10、CD1マウスでは1回の事前ばく露で十分です17。このようにして、光嫌悪的な挙動は、これら2つのマウス系統においてマスクを解除することができる。第2に、チャンバー照明は、薄暗い(55ルクス)から明るい(27,000ルクス)までの光強度の調整可能な範囲を含むように適合されており、55ルクスは暗い曇りの日に匹敵し、27,000ルクスは日陰の明るい晴れた日に匹敵する10。我々は、必要な光強度が株および遺伝子モデルによって異なることを見出した。このため、個人はまず実験パラダイムの最小光強度を評価する必要があります。
光嫌悪表現型を明らかにする可能性のあるアッセイにこれらの修正があっても、光単独による光嫌悪と不安による光嫌悪を区別するために、不安様行動を試験する必要がある。オープンフィールドアッセイは、新しい環境の自発的な探索に基づいて不安を測定する伝統的な方法です。これは、探索的衝動が保護されていないオープンスペースへの生来の嫌悪感によって打ち消されるという点で、明暗アッセイとは異なります。チャンバーの中心と縁の両方が光の中にあるので、オープンフィールドアッセイは光に依存しない不安アッセイです。したがって、明暗アッセイとオープンフィールドアッセイの組み合わせにより、光の回避による光の回避と不安の全体的な増加を区別することができます。
CGRPは、血管拡張、侵害受容、および炎症を調節する多機能神経ペプチドである18。それは末梢および中枢神経系において広く発現される。片頭痛の病態生理学において重要な役割を果たしています18。しかしながら、片頭痛におけるCGRP作用の根底にあるメカニズムは不明である。この修正された試験パラダイムを用いた明暗およびオープンフィールドアッセイを利用することにより、末梢10,16(図2)および中央14,15,16,19 CGRP投与後のマウスにおける光嫌悪行動を特定することができた。神経ペプチドに加えて、光嫌悪に関与する脳領域の同定も片頭痛の病態生理学を理解する上で重要である。視床後核は、疼痛と光処理のための統合的な脳領域であり19、視床は片頭痛の間に活性化される20。そこで、チャネルロドプシン-2(ChR2)またはeYFPを含むアデノ随伴ウイルス(AAV)をこの領域に注入することにより、視床後核を標的とした。この光遺伝学的アプローチをこれら2つのアッセイと組み合わせることにより、視床後核におけるChR2発現ニューロンの光刺激が光嫌悪を誘発することを実証した19(図3)。この実験では、これらの光遺伝学的に操作されたマウスの誘発された光嫌悪に対する劇的な影響を考慮して、チャンバーへの事前曝露はスキップされた。
プロトコル
動物の処置は、アイオワ大学動物ケアおよび使用委員会によって承認され、国立衛生研究所によって設定された基準に準拠して実施された。
1. 明暗アッセイ
- 明暗チャンバー装置( 材料表を参照)のセットアップ。このセクションのすべての機器は市販されています。
- 棚の上に、チャンバーとダークインサートに簡単にアクセスできる引き出し付きのサウンド減衰キュービクル(内部:幅 x 高さ x 奥行きで59.7 x 38 x 35.6 cm)を置きます。
- DC 電源モジュールと DC 安定化電源モジュールをサウンド減衰キュービクルに接続します。
- 透明なシームレスオープンフィールドチャンバー(長さ x 幅 x 高さで27.31 x 27.31 x 20.32 cm)をキュービクルの引き出しに置きます。
- 黒色の赤外線(IR)透明プラスチックダークインサート(長さ x 幅 x 高さで28.7 X 15 X 20.6 cm)をオープンフィールドチャンバーに置きます。チャンバーが等しいサイズの2つのゾーン(ダークゾーンとライトゾーン)に分割されていることを確認します。
- オープンフィールドチャンバーのX、Y、Z軸上の3組の16ビームIRアレイをケーブルでIR USBコントローラに接続します。
- IR USBコントローラをコンピュータに接続します。
- マウスの位置とアクティビティを記録および収集できるコンピュータにトラッキングソフトウェアをインストールします。
- ライトパネルのセットアップでは、まず発光ダイオード(LED)ライトパネル(長さ27.70 x 幅27.70 cm、360個のLED、昼光バランスカラー、5600K、60°フラッドビームスプレッド)を元のハウジングから取り外します。
- LEDドライバ、ヒートシンク、および電源ユニットを使用してライトパネルを組み立てます。複数のLEDライトパネルを1つの電源、ヒートシンク、およびLEDドライバに接続して、均一なライトパネル制御を実現できます。
- カスタマイズされたアクリルプラットフォーム(長さ x 幅 x 高さで29.77 x 27.70 x 8.10 cm)を構築し、0.53 cm間隔で7つの同一の棚を構成します(図1B)。カスタマイズされたアクリル棚をチャンバーの上のキュービクル内の天井に恒久的に貼り付けます。
- LED ライトパネルを下の 2 つの棚の間のスロットに挿入します。必要に応じて(例えば、光遺伝学的マウスを使用する場合)、ライトパネルを異なる高さに調整する(図1B、C。詳細については、セクション 3 で説明します)。
- ヒートシンク、LEDドライバ、および電源ユニットの電源を入れます。LEDドライバがチャンバ床の光強度を測定することによってLED光強度を指示できることを確認し、床が均等に点灯していることを確認します。
- 行動テスト手順
注:マウスは12時間の光サイクルで飼育されています。すべての行動実験は、光サイクル中に実行されます。生後10〜20週齢の雄および雌の両方を含むマウスが使用される。このプロトコールでは、ナイーブ野生型CD1およびC57BL/6Jマウスは、明暗チャンバーへの2回の事前曝露を経験し、続いて治療による曝露および治療後曝露を経験する。マウスが回復できるように、各曝露の間には3日間の間隔がある(下記および 図1Aのように1日目、4日目、7日目および10日目)。しかしながら、CD1マウスは、2回目の 事前曝露を必要とせず、薄暗い光下で試験することができる。- 1日目(前処理1)に、明暗アッセイ装置をオンにし、光強度を27,000ルクスに設定します。
- トラッキングソフトウェアを開き、新しいプロトコルを設定します。 [新しいプロトコル ] 設定で、[ 期間] を 30 分に設定します。 [新しい分析 ] 設定で、[ 期間別データ箱] を 300 秒に設定します。
- [新しいゾーン] 設定で、[定義済みゾーン] を選択します。[2] を選択し、[水平] を選択します。チャンバーが録音のために水平方向に2つの等しいサイズのゾーンに分割されているかどうかを確認します。
- 試験前にマウスを試験室に1時間慣れさせる。慣れている間は、マウスの概日リズムを乱さないように部屋の明かりをつけたままにしてください。明暗アッセイ用のすべての機器の電源がオンになっていることを確認し、マウスが試験室環境に完全に順応できるようにします。
- [データ集録]を選択します。マウス ID を入力します。プロトコルを開始します。
- ドロワーを音響減衰キュービクルの外側に引いて、明暗室と暗インサートにアクセスします。マウスを尾の付け根のそばで静かに拾い上げ、チャンバーのライトゾーンに置き、引き出しをキュービクルの内側に押し込みます。ソフトウェアがマウスをすぐに検出し、アクティビティの記録を開始することを確認します。
- 30分後に録音が自動的に停止するのを待ちます。マウスをホームケージに戻します。
- 55.0%イソプロピルアルコール、0.25%アルキルC12-18ジメチルエチルベンジルアンモニウム、および0.25%アルキルC12-18ジメチルベンジルアンモニウムクロリドを抗菌活性成分として含むアルコール臭性殺菌使い捨てワイプを使用してチャンバーとダークインサートを清掃し、前のマウスによって残された嗅覚の合図を根絶します。
- 4日目(前処理2)に、ステップ1.2.1から1.2.8を繰り返します。
- 7日目(治療日)に、ステップ1.2.1と1.2.4を繰り返します。馴化後、CGRP(0.1mg/kg、マウス体重に基づく10μl/g、腹腔内注射(i.p.))を投与し、マウスの頭を前方に傾け、右下の象限に注射する。マウスをホームケージに戻します。
- 30 分後、プロトコルを起動し、手順 1.2.5 ~ 1.2.7 で説明したように、明暗室でマウスを実行します。注射後のホームケージでの回復時間は、治療に応じて短縮または延長することができます21。
- チャンバーと暗いインサートを、ステップ 1.2.8 の説明に従ってクリーニングします。
- 10日目(治療後日)に、ステップ1.2.1から1.2.8を繰り返します。実験は、オープンフィールドアッセイを開始する前に、ステップ1.2.13で一時停止することができる。
2. オープンフィールドアッセイ
- 装置のセットアップ
- オープンフィールドチャンバーのセットアップ:ダークインサートを使用せずに、明暗アッセイで使用されるのと同じ音減衰キュービクルとオープンフィールドチャンバーを使用します。
- ライトパネルのセットアップ: ライト/ダークアッセイで使用したのと同じセットアップを使用します。光の強度が明暗アッセイで使用したものと同じであることを確認します。
- 行動テスト手順
- 装置の電源を入れます。ライト強度を 27,000 ルクスに設定します。
- トラッキングソフトウェアを開きます。
- 新しいプロトコルを設定します。これは、新しいゾーン設定を除き、明暗アッセイで使用されるプロトコルと同じです。[新しいゾーン] 設定で 1 を選択し、その後に [中央] を選択します。周囲を周囲から 3.97 cm に、中心を 19.05 cm × 19.05 cm に設定します。
- ステップ 1.2.4 で説明したように、マウスを試験室に慣れさせる。
- CGRP(0.1 mg/kg、マウス体重に基づいて10 μl/g)を投与し、マウスの頭を前方に傾け、右下の象限に注射する。マウスをホームケージに戻します。
- 30 分後、プロトコルを開始します。引き出し引き出しを音減衰キュービクルの外側に引き出し、マウスをオープンフィールドチャンバーの中央にそっと置きます。引き出しをキュービクルの内側に押し込みます。
- 30 分間の動作を追跡します。その後、マウスを自宅のケージに戻します。
- 手順 1.2.8 の説明に従って装置をクリーニングします。
3. 光遺伝学的マウスに対する修正明暗アッセイ
- 装置のセットアップ
- 濃い色のインサートに 2 つの変更を加えます。
- ダークインサートの開口部を5.08 x 5.08 cm(幅 x 高さ)に変更し、上部とダークインサートの開口部の間に0.95 x 10.16 cm(幅 x 高さ)の小さなスリットを付けます(図1D 左上)。
メモ: この変更により、マウスヘッドの光ファイバーカニューレがパッチコードに取り付けられている場合、マウスは問題なくダークゾーンに行くことができます。 - 暗いインサートの上部を明るい部分の上に三角形のポーチ(H=6.5 cm)として伸ばします(図1D の右上と左下)。ポーチから円形の穴(D=1.7 cm)を切り出し、ホルダーを穴に挿入して、レーザーと光ファイバーパッチコードを接続する回転ジョイントを配置して安定させます(図1D 左上と左下)。
注:変更により、ダークゾーンの床に到達する光強度の小さな変化が生じます(変更なしで17ルクス対変更なしの14ルクス、27,000ルクス下のダークゾーンの右後隅で測定)。
- ダークインサートの開口部を5.08 x 5.08 cm(幅 x 高さ)に変更し、上部とダークインサートの開口部の間に0.95 x 10.16 cm(幅 x 高さ)の小さなスリットを付けます(図1D 左上)。
- ロータリージョイントをダークインサートのホルダーに挿入します。
- 30.5cmの光ファイバーパッチコードをロータリージョイントに接続します。マウスがチャンバーを横切るときにパッチコードが問題なく回転できるように、回転ジョイントがスムーズに回転できることを確認します。
- 残りのセットアップでは、セクション 1 (明暗アッセイ) で使用したのと同じ装置セットアップを使用します。
- 濃い色のインサートに 2 つの変更を加えます。
- 行動テスト手順
注:野生型マウスとは異なり、光遺伝学的マウスは事前曝露を受けない(前処理1および2)。- テスト当日は、LEDライトパネルを2番目に低いスロット(キャンバーの床から28.23 cm)に挿入して、パッチコードを接続するためのスペースを確保します。明暗アッセイ装置をオンにし、光強度を55ルクスに設定します。
- 1.2.2 および 1.2.3 と同じプロトコル設定を使用しますが、ステップ 3.2.3 のレーザー刺激プロトコルと一致するように、[新しい解析] 設定で [期間別データ ビン] が 60 秒に設定されている点が異なります。
- レーザー電源ボタンをオンにします。レーザーパルスコントローラを1分間刺激し、その後30分間刺激せずに1分間刺激するように設定します。
- 試験前に1時間、照明を点けた状態でマウスを試験室に慣れさせる。
- プロトコルを開始します。引き出し引き出しを音減衰キュービクルの外側に引き出して、明暗室と暗インサートにアクセスします。
- マウスを静かに拘束し、マウスヘッドの光ファイバーカニューレを嵌合スリーブを介して光ファイバーパッチコードに結合します(図1D 右下)。マウスをライトゾーンにそっと置き、引き出しをキュービクルの内側に押し込みます。プロトコルがマウスの動作を自動的に記録し始めることを確認します。
- 1 分後にパルス コントローラーの電源を入れ、フェイルセーフ キーを ON にします。標的脳領域のレーザー刺激が1分おきに発生していることを確認してください。
- プロトコルが自動的に停止する 30 分後、フェイルセーフ キーを OFF にします。次に、パルスコントローラをオフにします。
- マウスと光ファイバーパッチコードの結合を解除します。マウスをホームケージに戻します。
- チャンバーと暗いインサートを、ステップ 1.2.8 の説明に従ってクリーニングします。
4. 光遺伝学的マウスに対する改変オープンフィールドアッセイ
- 装置のセットアップ
- スタンドとクランプを使用してチャンバの上の回転ジョイントを安定させます(図1E)。
- 長さ50cmの光ファイバーパッチコードを回転ジョイントに接続します。回転ジョイントがスムーズに回転できるかどうかを確認します。
- 回転ジョイントをスタンドの適切な高さに設定する:光ファイバパッチコードがチャンバーの隅々までしか届かないようにして、マウスの動きとの干渉を避けるのに役立ちます。
- 残りのセットアップでは、セクション1(明暗アッセイ)で使用したのと同じ装置セットアップを使用しますが、暗挿入は使用しないでください。
- 行動テスト手順
- 明暗アッセイ装置をオンにし、光強度を55ルクスに設定します。
- 新しいゾーン設定を除き、修正された明暗アッセイ(セクション3)と同じプロトコル設定を使用します。[新しいゾーン設定] で [中央] で 1 つから [次へ] を選択します。周囲を周囲から 3.97 cm に、中心を 19.05 cm × 19.05 cm に設定します。
- レーザー電源ボタンをオンにします。レーザーパルスコントローラを1分間刺激し、その後30分間刺激せずに1分間刺激するように設定します。
- 手順 3.2.4 ~ 3.2.10 の説明に従って、慣れと残りのテストを実行しますが、手順 3.2.6 への 2 つの変更を除きます: マウスをライトゾーンではなくチャンバーの中央にそっと配置します。引き出しドロワーは、パッチコードがマウスの頭に接続されているため、キュービクルの外側に置いてください。
結果
この動作テストパラダイムは、光嫌悪的な動作をテストするように設計されています。ナイーブ野生型マウスおよび光遺伝学的マウスの両方を用いて、標的ニューロン集団の刺激中にリアルタイムで光嫌悪を調査するために行うことができる。
この手順は、CD1およびC57BL/6Jマウスにおける末梢CGRP治療10,16およびC57BL/6Jマウスにおける視床後核におけるニューロンの光刺激19が光嫌悪行動に及ぼす影響を研究するために用いられてきた。生後10〜20週齢の雄および雌の両方を含むマウスを実験に使用した(図2A、図2B−D、および図3)。その結果、CGRPのi.p.注射は、CD1(図2A)およびC57BL/6J(図2B)マウスにおける明/暗アッセイにおいて明ゾーンで費やされる時間の持続時間を有意に減少させたが、CD1(データ示さず)およびC57BL/6Jマウス(図2D)におけるオープンフィールドアッセイにおいてマウスが中心で費やされた時間には影響しなかったことを明らかにした10。16。これは、末梢CGRPが軽い嫌悪感を誘発するが、一般的な不安を誘発しないことを示唆している。CGRPによる治療はまた、CD1(データ示さず)およびC57BL/6Jマウス(図2C)の両方で、マウスが暗ゾーンでは休んだが明ゾーンでは休まなかった時間量を増加させた。
光遺伝学的プロトコールでは、AAV2-CaMKIIa-hChR2(E123A)-eYFPまたは対照ウイルスAAV2-CaMKIIa-eYFP19を注射することにより、視床後核におけるカルモジュリンキナーゼIIα(CaMKIIa)発現ニューロンを標的とした。同時に、光ファイバーカニューレを後視床核に移植した。ChR2発現に十分な時間を与えるために注射の3週間後、我々は視床後核のニューロンの光刺激を行い、対照ウイルス注射マウス(eYFP)と比較して、ChR2注射マウスの明暗アッセイにおいて明域で過ごした期間の対応する減少を認めた(図3A)。ChR2と対照eYFPマウスとの間のオープンフィールドアッセイにおける中心の時間に顕著な差はなく(図3C)、不安のみによって引き起こされたわけではない光嫌悪応答を示す19。さらに、明ゾーンではそうではないが、ダークゾーンでの休息時間の増加も認められた(図3B)。55ルクスおよび27,000ルクスを使用した場合も同様の結果が得られた(図3)。55ルクスの手順は、片頭痛患者が薄暗い光に対しても敏感であるため、含まれていました。

(A)試験パラダイムのタイムライン:明暗チャンバーへの2回の事前暴露(Pre 1およびPre 2)の後、マウスにCGRP(0.1mg / kg、i.p.)を投与し、続いて治療後の測定(Post)を行う。明暗アッセイの少なくとも1日後に、マウスにCGRP(0.1mg/kg、i.p.)を再び投与し、オープンフィールドアッセイで実行します。前: 前処理;Tx:治療;後:後処理(B)LEDパネルは、アクリル棚によってチャンバの上部に保持され、テスト領域を照らす。ライトパネルの高さは、異なる高さのスロットを使用して調整できます。(C)明暗チャンバーには、小さな開口部を有する暗いインサートが含まれています。LEDライトパネルはチャンバーの上にあります。(D) 修正されたダークインサートの前面図、側面図、および上面図。暗いインサートの開口部は、パッチコード(左上)の動きのために小さなスリットで延長されています。ダークインサートの上部は、回転ジョイント用のホルダー(右上と左下)を備えた三角形のポーチとして明るい領域に広がっています。光ファイバパッチコードは、嵌合スリーブ(右下)を介して光ファイバカニューレに接続されています。(e)改変オープンフィールドアッセイ。スタンドとクランプは回転ジョイントを保持します。チャンバーは、ドアを開いたままキュービクルの前面に引き出され、マウスヘッドに取り付けられたパッチコードでマウスが自由に動くことができるようにします。この図の拡大版を表示するには、ここをクリックしてください。

図2:末梢CGRP投与は、野生型マウスの2系統において明るい光の中で光嫌悪を呼び起こす。 CD1およびC57/BL6Jマウスを、 図1Aに記載されたタイムラインに従って試験した。(a)CD1マウスが30分(27,000ルクス)にわたる5分間隔当たりの明度ゾーンで過ごした時間。光中データは、試験中の経時的データ(左パネル)および個々のマウスについての5分間隔当たりの平均時間(右パネル)として示される。各時点での車両とCGRPの比較、および括弧で示すようにTxとPre2またはPostの間で比較が行われました。 (Veh, n=19; 0.1 mg/kg CGRP, n=19)(B)C57BL/6Jマウスが30分(27,000ルクス)にわたって5分間隔あたりライトゾーンで過ごした時間。光中のデータは、試験中の経時的データ(左パネル)および個々のマウスの5分間隔当たりの平均時間(右パネル)として示されている(Veh、n=42;0.1mg/kg CGRP、n=44)。(C)パネルBのマウスも、明暗アッセイ中の暗所および明域での安静時行動について分析した。(d)パネルB由来のマウスを、続いて、オープンフィールドアッセイにおいて試験した。ビヒクルまたはCGRPによる治療後30分以上5分間隔でチャンバーの中心で過ごした時間の割合(0.1mg/kg、i.p.(Veh, n=9; 0.1 mg/kg CGRP, n=9).中央データにおける時間の割合は、試験中の経時的(左パネル)および個々のマウスの5分間隔当たりの中央における時間の平均百分率(右パネル)として示される。すべてのパネルについて、平均±SEM は *p<0.05、**p<0.01、***p<0.001、****p<0.0001 と表示されます。この図は、Mason et al. 201710から修正されたものである。 この図の拡大版を表示するには、ここをクリックしてください。
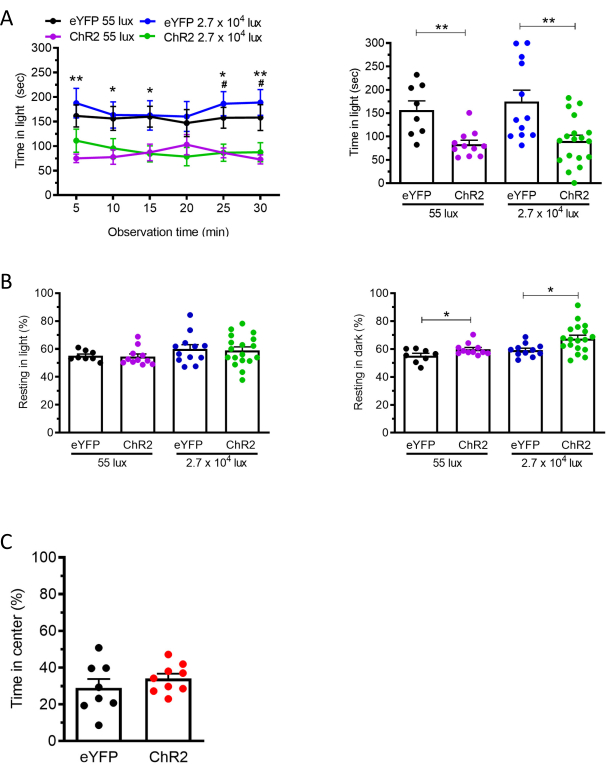
図3:視床後核におけるCaMKIIa発現ニューロンの光刺激は、薄暗い光と明るい光の両方で光嫌悪を誘発する。 (A)ChR2またはeYFPのいずれかをコードするAAVを注射したC57BL/6Jマウスの視床後核(55ルクス:eYFP n = 8、ChR2 n = 11;27,000ルクス:eYFP n = 12、ChR2 n = 18)を青色レーザー(473nm、 20 Hz、5 ミリ秒のパルス幅、10 mW/mm2)。左パネルは、マウスが55または27,000ルクスで30分にわたって5分間隔あたりライトゾーンで過ごした時間を示す。各時点でeYFP群とChR2群とを比較した。右パネルは、個々のマウスについての5分間隔当たりの平均時間を示す。(B)パネルAのマウスは、明暗アッセイ中の明(左パネル)および暗(右パネル)ゾーンにおける安静時行動についても分析した。(c)パネルA由来のマウスを、続いて、オープンフィールドアッセイにおいて試験した。30分間にわたって5分間隔あたりのオープンフィールドチャンバの中心で費やされた時間の平均割合(レーザー:473nm、20Hz、5msパルス幅、10mW/mm2)。(eYFP n = 8、ChR2 n = 9)。すべてのパネルについて、平均±SEM は *p<0.05、**p<0.01、***p<0.001、****p<0.0001 と表示されます。この図は、Sowers et al. 202019から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
明暗アッセイは、不安に似た行動を評価するために広く使用されています12。このアッセイは、マウスの光に対する生来の嫌悪感と、新しい環境(ライトゾーン)に置かれたときの探索への衝動に依存しています。しかし、ここで報告するように、このアッセイは光嫌悪挙動を評価するためにも使用できます。
試験前に事前暴露の数と必要性を考慮することが重要です。これは、マウスの系統またはモデルによって異なります。例えば、我々の明暗アッセイプロトコルでは、ナイーブ野生型CD1およびC57BL/6Jマウスは、治療試験手順を受ける前に明暗チャンバーに2回前曝露されるが、光遺伝学的マウスは事前曝露を受けない。最近の出版物は、CD1マウスがi.p. CGRP投与後に光嫌悪を示すには、1回の事前暴露で十分であると報告した17。その結果、新規性パラメータの重要性は、治療日の到来時に減少します10,16。事前露光は、探索的衝動を減少させ、したがって探索と嫌悪のバランスを変えることによって、光嫌悪表現型のマスクを外すことができる。場合によっては、事前露光は必要ありません。例えば、神経系のCGRP受容体が増加した遺伝子改変マウスでは、事前ばく露は必要なかった14。同様に、視床後核のCaMKIIa発現ニューロンを光刺激の標的とした光遺伝学的に操作されたマウスでは、おそらく脳の直接刺激時に光嫌悪応答が非常に強固であったため、事前露光は必要なかった19。したがって、チャンバーへの事前暴露の数および必要性は、異なるマウス系統またはモデルを使用する場合に慎重に考慮されなければならない。実際、チャンバーへのマウスの過剰曝露は、探索的行動を減少させる可能性がある。これは、マウスが治療に関係なくダークゾーンを優先的に占有することにつながり、その中で光嫌悪応答を観察する能力を低下させる。逆に、アッセイへの不十分な事前曝露は、潜在的な光嫌悪挙動をマスキングする探索的挙動をもたらし得る。
治療後曝露は、マウスが2日前に投与されたCGRP注射から完全に回復したかどうかを識別するのに役立つ。これは、オープンフィールドアッセイまたは他のアッセイを実行する前に、将来の行動試験に影響を与える長期の治療効果が存在しないことを確認するために不可欠です。
以前の観察に基づいて30分のプロトコル期間を選択しました10。我々は、10分15、20分16および30分10の明暗アッセイでマウスを別々に試験した。CGRPは、マウスが0〜30分の間に光の中で過ごす時間の量を減少させたが、30分を過ぎると、対照マウスは0〜30分と比較して暗闇でより多くの時間を費やすことを好んだため、30分間試験する決定につながった。同様の方法で、テスト期間は、異なるマウスモデルの時間応答曲線を参照して調整できます。明暗室への露光時間を長くすると、光ゾーンを探索するモチベーションが低下する可能性があることに留意すべきである。
我々は、動物の行動を評価するために多くの異なるパラメータを分析した。明暗アッセイの重要な特徴の1つは、マウスが光ゾーンで過ごし、光の嫌悪感を直接反射する時間を測定することです。休息に費やされた時間の割合、明ゾーンまたは暗ゾーンでの垂直ビームブレークの数(飼育活動を測定するため)、および2つのゾーン間の遷移の数を使用して、運動性を評価する。休息時間と垂直ビームブレークは、動きに関する誤った結論を避けるために、各ゾーンで費やされた時間に正規化されます。分析には、試験の30分間にわたってライトゾーンにとどまっているマウス、合計で休息時間の90%以上を費やしているマウス(明ゾーンとダークゾーンの両方)、統計的外れ値(平均から>3 SD)を除くすべてのマウスが含まれます。除外されるマウスの数は、一般に1%未満である。オープンフィールドアッセイでは、中心にある時間の割合が不安様行動を評価するために使用される主な測定値です。
修正された明暗アッセイでは、一部の脳領域における光ファイバーカニューレの位置がマウスの動きを大幅に制限し、場合によってはマウスがダークゾーンに到達するのを妨げる可能性がある。その結果、ダークゾーンへの進入は否定的に強化され、複数回試行した後、マウスはテスト期間全体を通してライトゾーンにとどまることさえ、光に対する学習された好みを示すことがあります。これは、暗挿入物における開口部のサイズおよび形状を変更することによって整流することができる。一例として、野生型C57BL/6Jマウスの小脳に光ファイバーカニューレを設置した場合、マウスはダークインサートの開口部を横切るのが困難であった。開口部の幅を5.08cmではなく6.10cmに変更した後、マウスは開口部を自由に横断することができた。
30.5cmの光ファイバーパッチコードは、オープンフィールドチャンバーのサイズに基づいて修正された明暗アッセイで使用され、マウスが自由に動くことを可能にします。コードの長さを短くするとマウスが角に動かなくなり、長いケーブルはもつれて動きを妨げる可能性があります。修飾オープンフィールドアッセイに使用される光ファイバーパッチコードの長さは50cmである。回転ジョイントの高さは光ファイバパッチケーブルの長さに応じて調整できるため、長さは明暗アッセイほど厳密ではなく、マウスがチャンバーの角にちょうど到達できるようにします。
検出力分析に基づくと、i.p. CGRPを有するCD1およびC57BL/6Jマウス、および有意な光転位を検出するための光遺伝学的C57BL/6Jマウスには、1群あたり10〜12匹のマウスが必要である。しかし、C57BL/6Jマウスは、試験のサブセットにおいてCGRPに反応しなかったため、C57BL/6J群のサイズはCD1群サイズよりもかなり大きかった(図2A,B)10、つまり、これらのマウスにおける光嫌悪行動におけるこの高い変動性を説明するために複数の試験が実施されたことを意味する。具体的には、CD1マウスに対して2つの実験を組み合わせ、C57BL/6Jマウスについてi.p. CGRPを用いて4つの実験を組み合わせました(図2A、B)10。この変動性の理由は不明ですが、人間もCGRPと光に対する応答にばらつきを示します。CGRPの静脈内(すなわち)注射は、片頭痛患者の約63〜75%において片頭痛発作を誘発し、片頭痛発作を示した患者の70〜90%が光恐怖症を示す22、23、24、25。全体として、アッセイはかなりの変動性を有し、マウスの数に加えて、マウスの異なるコホートを用いて少なくとも2つおよび好ましくは3つの完全に独立した実験を行うことが不可欠である。
明るい/暗いチャンバーでは寝具は必要なく、実験者はマウスを事前に処理したり慣れさせたりする必要はありません。予防措置として、2つの曝露前手順は、マウスを実験者の嗅覚および物理的合図に順応させる目的に役立つ。しかし、Ueno H. et al.は、明暗アッセイにおける光の時間、またはオープンフィールドアッセイにおける中心の時間に、取り扱いを繰り返した後のマウスと取り扱いのないマウスとの間に差がないことを実証した26。
オープンフィールドアッセイは、光嫌悪表現型に対する不安の寄与を評価することができる。上昇したゼロ迷路や上昇したプラス迷路27など、他の十分に検証された不安関連のアッセイがあります。ただし、オープンフィールドアッセイは、両方のアッセイに同じ試験チャンバが使用されるため、明暗プロトコルに最も手続き的に関連性の高いコントロールです。それでも、不安の評価は、複数のアッセイを利用するか、不安が複雑で多面的な行動であることを考えると、単一のテストで複数のパラメータを測定することによって強化することができます。重要なことに、オープンフィールドアッセイにおいて不安表現型がない場合でも、これは光嫌悪表現型に対する不安成分を排除しない。例えば、光が不安反応を引き起こしているかもしれません。オープンフィールドアッセイは、不安だけでは光に対する応答を駆動していないことを示しているだけです。ベンゾジアゼパムなどの抗不安薬がこのアッセイで使用されるかもしれないが、そのようなアプローチは合併症、例えば抗不安薬が移動運動に影響を与えるであろう。代わりに、スマトリプタンを含む臨床的抗片頭痛薬を使用して、光嫌悪表現型の片頭痛様状態を検証することを選択しました。スマトリプタンは、CD1マウスとC57BL/6Jマウスの両方でCGRP誘発性の光嫌悪を逆転させることに成功した10。
修正明暗アッセイとは異なり、プルアウト引き出しのチャンバーはキュービクルの外側にあり、パッチコードがマウスの頭部に接続されているため、修正オープンフィールドアッセイではキュービクルドアが開いています。55ルクスの代わりに、部屋の光は〜1000ルクスでチャンバーの床に到達します。光強度は異なりますが、オープンフィールドアッセイは光に依存しない試験です。詳細には、オープンフィールドアッセイで光強度を55ルクスから27,000ルクスに増加させたところ、C57BL/6Jマウスでは中心の時間の減少傾向がもたらされ、光強度がマウスの行動に影響を与える可能性があることが示唆された28。しかし、対照群と実験群の差は、55ルクスでも27,000ルクスでも有意ではなかった28。さらに、55 ~ 1000 ルクスの光強度の差は、55 ~ 27,000 ルクスよりもはるかに微妙です。ワイヤレスオプトジェネティクスは、パッチコードがないため、オープンフィールドチャンバーを音減衰キュービクルの内側に押し込むことができるため、この問題を解決することができます。
さらに、パッチコードは、最適な長さを選択してもマウスの動きを制限します。将来的には、ワイヤレス光遺伝学は、ケーブルベースの光遺伝学技術に代わる非侵襲的な代替手段を提供するでしょう。
我々はCGRPの急性注射を使用したことに留意すべきであるが、これは片頭痛発作に伴うCGRP放出の延長を部分的にしか再現しない。血漿CGRPレベルが上昇し29、すなわちCGRPが片頭痛患者に片頭痛発作を誘発したという前提に基づいて片頭痛をモデル化するためにCGRPをマウスに注射したが22,23,24,25,30、これはCGRPが比較的長期間高レベルに維持されている患者の状態を再現しない(患者の測定は片頭痛開始後中央値3時間で行われた)29)、また、発作の間でさえもレベルが上昇すると報告されている慢性片頭痛を再現するものでもありません31。さらに、他の疼痛誘発メディエーターは、我々のパラダイムではテストされていない。
Mogilグループは、マウスの光の嫌悪感を測定するために、上昇したプラス迷路を修正し、閉じた腕は明るい光で照らされ、開いた腕は暗いままです32。標準的な上昇プラス迷路は、動物の不安関連行動を検出するためにしばしば使用されてきました。このアッセイは、新しい環境を探索したいというマウスの生来の欲求と、開いた無防備な迷路アームの妥協的な位置に置かれることとの間の葛藤に基づいています。修正されたプロトコルでは、マウスは、明るい光で照らされた閉じた腕と、暗い開いた保護されていない腕との間で選択することを余儀なくされる。前者への嗜好は不安が軽い嫌悪感を覆すことを示唆しているが、後者への好みは軽い嫌悪感が不安よりも優先されることを示唆している。Mogilグループはまた、不安に似た行動を評価するために、標準的な上昇プラス迷路を実施しました32。目的は、我々のプロトコールでオープンフィールドアッセイを実施するのと同じである。家族性片麻痺性片頭痛モデルであるCacna1a変異マウスは、閉じた腕が明るいときに光恐怖症を示した。対照的に、不安様行動は、標準上昇プラス迷路を実施したときには検出されなかった32。ラットでは、改変された上昇プラス迷路と明暗アッセイの両方を使用することによって、ニトログリセリン(NTG)が光恐怖症を誘発できることが実証されました33,34、スマトリプタン34によって救助されました。閉じた腕の中に光が存在しない標準的な上昇プラス迷路設定では、NTGはラットに不安様行動を誘発し34、NTG誘発光嫌悪が不安を伴うことを示唆している。我々の知る限り、同じマウスモデルで明暗アッセイと修正された上昇迷路を使用した出版物はない。全体として、このプロトコルで提案された修正された上昇プラス迷路および明暗アッセイの両方が、マウスにおける光嫌悪行動の効果的な尺度として実証されている。
昼光バランスの取れた色(5600K)の昼光LEDパネルを使用し、60°の洪水ビームが広がり、55ルクスまたは27,000ルクスのいずれかでチャンバーの床から約30cmの高さに影を落とすことはありません。光の嫌悪感を調査する他の研究では、さまざまな修正を加えた明暗アッセイを利用しています。例えば、研究は、数百から数千のルクス35,36,37の範囲の光ゾーンに異なる光強度を使用している。異なる波長(例えば、青色および黄色)で光を使用する38。または異なる温度の光(寒さと暖かさ)を使用しました39。光によって生成される熱は、暗いゾーンと明るいゾーンの温度に影響を与え、マウスの行動を妨げ、特定のゾーンへの嗜好を引き起こす可能性があるため、注意が必要です。また、チャンバーの床に影を避けるために、良好な視野角の光を使用することも重要です。光の強度もテストにとって重要です。25,000-27,000ルクスは明るい昼光にほぼ相当します。このような高い光強度で明暗アッセイを行うことで、治療効果を増幅することができる。しかし、網膜の損傷40と、このような高い光強度がマウスの光に入る意欲に及ぼす悪影響を考慮することが不可欠です。いくつかの研究では、直接光に曝されたマウスの目41と数時間(例えば、4時間30,000ルクス42)に曝されたマウスが網膜損傷を経験したと報告されています。明暗アッセイでは、マウスが望むならば、マウスが明るい光から逃れるための暗いゾーンがあります。さらに、以前の研究では、対照群のマウス(C57BL/6Jマウス)が、55、1000および27,000ルクス未満の明部で同様の時間を費やしていたことが判明しました28。CD1マウスの場合、対照群は時間の約1/3を27,000ルクス以下の光の中で過ごし10、未発表のデータは55ルクスで同様の結果を示していた。これは、27,000ルクスの光だけではCD1およびC57BL/6Jマウスを苦痛にしないことを示唆している。それにもかかわらず、より高い光強度を選択するときは注意が必要です。
明暗データを分析する際に、明暗設定の違いに加えて、研究者はさまざまなアプローチを選択しました。光の嫌悪感を評価する場合、ライトがオフの状態でライトゾーンで費やされた時間(または、マウスの目が赤色光に対する受容性が低いことを考えると、ライトゾーンの赤色光照明)が計算に含まれます。例えば、光嫌悪指数=(light0ルクスの時間-lighttest luxの時間)/light0ルクスの時間)/光の嫌悪感を評価するためにGorinグループによって使用されました43。ここでは、「消灯」または「赤色光」条件は、ライトゾーンの回避が、単純な場所の好みとは対照的に、光が存在することを条件とすることを確認するために含まれる。CGRPのi.p.注射でこの手順を行ったところ、CGRPを受けたマウスは、光ゾーンで光を消した場所を選好しないことを発見し、CGRP誘発性嫌悪感が光依存性であることを確認した16。最後に、Gorin群は、マウスが明暗アッセイの明域の周辺で過ごした時間を不安の尺度として使用した36。私たちは、不安のための伝統的なテスト、オープンフィールドアッセイを利用しています。どの分析方法を選択しても、不安が光の嫌悪感に寄与することは無視できないことに注意する必要があります。このプロトコルは、明暗および露場アッセイを並行して利用することによって、不安様および光嫌悪的な行動を分割することを試みる。
このプロトコルは、マウスにおける光嫌悪行動を検出するための明暗およびオープンフィールドアッセイの使用に対処する。これは、光恐怖症を引き起こす神経回路および脳領域のメカニズムを同定するための有用なツールを提供する。テストパラダイムは、片頭痛特異的であるか、または光恐怖症を含む他の障害に拡張され得る。片頭痛に関して、我々は片頭痛の病因に関連する2つの他の神経ペプチド、すなわち下垂体アデニル酸シクラーゼ活性化ポリペプチド(PACAP)および血管活性腸ペプチド(VIP)を試験した。PACAPおよびVIPは、CD1マウスにおいて光嫌悪を誘導することが実証された17、21。片頭痛に加えて、光恐怖症は、徐脈、急性眼損傷または炎症、外傷性脳症候群、ライム病、白皮症および円錐体ジストロフィーを含む他の多くの障害の症状でもある36。したがって、このテストパラダイムは、光恐怖症関連障害の根底にあるメカニズムを調査するためのツールを提供する。さらに、光遺伝学的方法と従来の薬理学的アプローチを組み合わせることは、間違いなく光恐怖症関連疾患に対する新規治療薬の開発に役立つであろう。
開示事項
著者は報告すべき利益相反はありません。
謝辞
この作業は、NIH NS R01 NS075599およびRF1 NS113839からの助成金によって支援されました。コンテンツは、VAまたは米国政府の見解を表すものではありません。
資料
| Name | Company | Catalog Number | Comments |
| Activity monitor | Med Assoc. Inc | Software tracking mouse behavior | |
| Customized acrylic shelf | For adjusting the height of the LED panel | ||
| Dark box insert | Med Assoc. Inc | ENV-511 | |
| DC power supply | Med Assoc. Inc | SG-500T | |
| DC regulated power supply | Med Assoc. Inc | SG-506 | |
| Fiber-optic cannula | Doric | MFC_200/ 240-0.22_4.5mm_ZF1.25_FLT | |
| Germicidal disposable wipes | Sani-Cloth | SKU # Q55172 | |
| Heat Sink | Wakefield | 490-6K | Connecting to LED panel |
| IR controller power cable | Med Assoc. Inc | SG-520USB-1 | |
| IR USB controller | Med Assoc. Inc | ENV-520USB | |
| Mating sleeve | Doric | SLEEVE_ZR_1.25 | |
| Modified LED light panel | Genaray Spectro | SP-E-360D | Daylight-balanced color (5600K) |
| Power supply | MEAN WELL USA | SP-320-12 | Connecting to LED panel |
| Seamless open field chamber | Med Assoc. Inc | ENV-510S | |
| Sound-attenuating cubicle | Med Assoc. Inc | ENV-022MD-027 | |
| Stand and clamp | |||
| Three 16-beam IR arrays | Med Assoc. Inc | ENV-256 |
参考文献
- Loder, S., Sheikh, H. U., Loder, E. The prevalence, burden, and treatment of severe, frequent, and migraine headaches in US minority populations: statistics from National Survey studies. Headache. 55 (2), 214-228 (2015).
- Collaborators, G. B. D. H. Global, regional, and national burden of migraine and tension-type headache, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 954-976 (2018).
- GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 392 (10159), 1789-1858 (2018).
- international headache society. Headache classification committee of the international headache society (IHS). The international classification of headache disorders, 3rd edition. Cephalalgia. 38 (1), 1(2018).
- Edvinsson, L., Haanes, K. A., Warfvinge, K., Krause, D. N. CGRP as the target of new migraine therapies - successful translation from bench to clinic. Nature Reviews Neurology. 14 (6), 338-350 (2018).
- Rapoport, A. M., McAllister, P. The headache pipeline: Excitement and uncertainty. Headache. 60 (1), 190-199 (2020).
- Maasumi, K., Michael, R. L., Rapoport, A. M. CGRP and Migraine: The role of blocking calcitonin gene-related peptide ligand and receptor in the management of Migraine. Drugs. 78 (9), 913-928 (2018).
- Caronna, E., Starling, A. J. Update on calcitonin gene-related peptide antagonism in the treatment of migraine. Neurologic Clinics. 39 (1), 1-19 (2021).
- Eftekhari, S., Edvinsson, L. Possible sites of action of the new calcitonin gene-related peptide receptor antagonists. Therapeutic Advances in Neurological Disorders. 3 (6), 369-378 (2010).
- Mason, B. N., et al. Induction of migraine-like photophobic behavior in mice by both peripheral and central cgrp mechanisms. Journal of Neuroscience. 37 (1), 204-216 (2017).
- Russell, M. B., Rasmussen, B. K., Fenger, K., Olesen, J. Migraine without aura and migraine with aura are distinct clinical entities: A study of four hundred and eighty-four male and female migraineurs from the general population. Cephalalgia. 16 (4), 239-245 (1996).
- Crawley, J. N. Exploratory behavior models of anxiety in mice. Neuroscience and Biobehavioral Reviews. 9 (1), 37-44 (1985).
- Crawley, J., Goodwin, F. K. Preliminary report of a simple animal behavior model for the anxiolytic effects of benzodiazepines. Pharmacology, Biochemistry and Behavior. 13 (2), 167-170 (1980).
- Recober, A., et al. Role of calcitonin gene-related peptide in light-aversive behavior: implications for migraine. Journal of Neuroscience. 29 (27), 8798-8804 (2009).
- Recober, A., Kaiser, E. A., Kuburas, A., Russo, A. F. Induction of multiple photophobic behaviors in a transgenic mouse sensitized to CGRP. Neuropharmacology. 58 (1), 156-165 (2010).
- Kaiser, E. A., Kuburas, A., Recober, A., Russo, A. F. Modulation of CGRP-induced light aversion in wild-type mice by a 5-HT(1B/D) agonist. Journal of Neuroscience. 32 (44), 15439-15449 (2012).
- Kuburas, A., et al. PACAP induces light aversion in mice by an inheritable mechanism independent of CGRP. Journal of Neuroscience. , (2021).
- Russo, A. F. Calcitonin gene-related peptide (CGRP): a new target for migraine. Annual Review of Pharmacology and Toxicology. 55, 533-552 (2015).
- Sowers, L. P., et al. Stimulation of Posterior Thalamic Nuclei Induces Photophobic Behavior in Mice. Headache. 60 (9), 1961-1981 (2020).
- Afridi, S. K., et al. A positron emission tomographic study in spontaneous migraine. Archives of Neurology. 62 (8), 1270-1275 (2005).
- Mason, B. N., et al. Vascular actions of peripheral CGRP in migraine-like photophobia in mice. Cephalalgia. 40 (14), 1585-1604 (2020).
- Guo, S., Vollesen, A. L. H., Olesen, J., Ashina, M. Premonitory and nonheadache symptoms induced by CGRP and PACAP38 in patients with migraine. Pain. 157 (12), 2773-2781 (2016).
- Christensen, C. E., et al. Migraine induction with calcitonin gene-related peptide in patients from erenumab trials. Journal of Headache and Pain. 19 (1), 105(2018).
- Younis, S., et al. Investigation of distinct molecular pathways in migraine induction using calcitonin gene-related peptide and sildenafil. Cephalalgia. 39 (14), 1776-1788 (2019).
- Asghar, M. S., et al. Evidence for a vascular factor in migraine. Annals of Neurology. 69 (4), 635-645 (2011).
- Ueno, H., et al. Effects of repetitive gentle handling of male C57BL/6NCrl mice on comparative behavioural test results. Scientific Reports. 10 (1), 3509(2020).
- Campos, A. C., Fogaca, M. V., Aguiar, D. C., Guimaraes, F. S. Animal models of anxiety disorders and stress. Revista Brasileira De Psiquiatria. 35, 101-111 (2013).
- Kuburas, A., Thompson, S., Artemyev, N. O., Kardon, R. H., Russo, A. F. Photophobia and abnormally sustained pupil responses in a mouse model of bradyopsia. Investigative Ophthalmology and Visual Science. 55 (10), 6878-6885 (2014).
- Goadsby, P. J., Edvinsson, L., Ekman, R. Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Annals of Neurology. 28 (2), 183-187 (1990).
- Lassen, L. H., et al. CGRP may play a causative role in migraine. Cephalalgia. 22 (1), 54-61 (2002).
- Cernuda-Morollon, E., et al. Interictal increase of CGRP levels in peripheral blood as a biomarker for chronic migraine. Neurology. 81 (14), 1191-1196 (2013).
- Chanda, M. L., et al. Behavioral evidence for photophobia and stress-related ipsilateral head pain in transgenic Cacna1a mutant mice. Pain. 154 (8), 1254-1262 (2013).
- Mahmoudi, J., et al. Cerebrolysin attenuates hyperalgesia, photophobia, and neuroinflammation in a nitroglycerin-induced migraine model in rats. Brain Research Bulletin. 140, 197-204 (2018).
- Farajdokht, F., Babri, S., Karimi, P., Mohaddes, G. Ghrelin attenuates hyperalgesia and light aversion-induced by nitroglycerin in male rats. Neuroscience Letters. 630, 30-37 (2016).
- Jacob, W., et al. Endocannabinoids render exploratory behaviour largely independent of the test aversiveness: Role of glutamatergic transmission. Genes, Brain, and Behavior. 8 (7), 685-698 (2009).
- Thiels, E., Hoffman, E. K., Gorin, M. B. A reliable behavioral assay for the assessment of sustained photophobia in mice. Current Eye Research. 33 (5), 483-491 (2008).
- Ramachandran, R., et al. Role of Toll-like receptor 4 signaling in mast cell-mediated migraine pain pathway. Molecular Pain. 15, 1744806919867842(2019).
- Marek, V., et al. Implication of Melanopsin and Trigeminal Neural Pathways in Blue Light Photosensitivity in vivo. Frontiers in Neuroscience. 13, 497(2019).
- Christensen, S. L. T., Petersen, S., Sorensen, D. B., Olesena, J., Jansen-Olesen, I. Infusion of low dose glyceryl trinitrate has no consistent effect on burrowing behavior, running wheel activity and light sensitivity in female rats. Journal of Pharmacological and Toxicological Methods. 80, 43-50 (2016).
- De Vera Mudry, M. C., Kronenberg, S., Komatsu, S., Aguirre, G. D. Blinded by the light: retinal phototoxicity in the context of safety studies. Toxicologic Pathology. 41 (6), 813-825 (2013).
- White, D. A., Fritz, J. J., Hauswirth, W. W., Kaushal, S., Lewin, A. S. Increased sensitivity to light-induced damage in a mouse model of autosomal dominant retinal disease. Investigative Ophthalmology and Visual Science. 48 (5), 1942-1951 (2007).
- Song, D., et al. Retinal pre-conditioning by CD59a knockout protects against light-induced photoreceptor degeneration. PloS One. 11 (11), 0166348(2016).
- Matynia, A., et al. Light aversion and corneal mechanical sensitivity are altered by intrinscally photosensitive retinal ganglion cells in a mouse model of corneal surface damage. Experimental Eye Research. 137, 57-62 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved