Method Article
Investigando comportamento semelhante à enxaqueca usando aversão à luz em camundongos
Neste Artigo
Resumo
Roedores não são capazes de relatar sintomas de enxaqueca. Aqui, descrevemos um paradigma de teste gerenciável (ensaios de campo claro/escuro e aberto) para medir a aversão à luz, um dos sintomas mais comuns e incômodos em pacientes com enxaquecas.
Resumo
A enxaqueca é uma doença neurológica complexa caracterizada por dor de cabeça e anormalidades sensoriais, como a hipersensibilidade à luz, observada como fotofobia. Embora seja impossível confirmar que um rato está tendo enxaqueca, a aversão à luz pode ser usada como substituto comportamental para o sintoma de enxaqueca da fotofobia. Para testar a aversão à luz, utilizamos o ensaio claro/escuro para medir o tempo que os ratos optam livremente por passar em um ambiente claro ou escuro. O ensaio foi refinado introduzindo duas modificações críticas: pré-exposições à câmara antes de executar o procedimento de teste e iluminação de câmara ajustável, permitindo o uso de uma gama de intensidades de luz de 55 lux a 27.000 lux. Como a escolha de passar mais tempo no escuro também é um indicativo de ansiedade, também utilizamos um teste de ansiedade independente da luz, o ensaio de campo aberto, para distinguir a ansiedade do comportamento leve e aversivo. Aqui, descrevemos um paradigma de teste modificado para os ensaios de campo claro/escuro e aberto. A aplicação desses ensaios é descrita para injeção intraperitoneal de peptídeo relacionado ao gene de calcitonina (CGRP) em duas cepas de camundongos e para estudos de estimulação cerebral optogenética.
Introdução
A enxaqueca é uma doença neurológica prevalente, afetando aproximadamente 17% dos americanos1 e é a segunda principal causa de incapacidade globalmente 2,3. Os pacientes experimentam dor de cabeça que dura de 4 a 72 horas acompanhadas de pelo menos um dos seguintes sintomas: náusea e/ou vômito, ou fotofobia e fonofobia4. Os recentes avanços no desenvolvimento de anticorpos de peptídeos relacionados com genes de calcitonina (CGRP) que agora são aprovados pela FDA iniciaram uma nova era para o tratamento da enxaqueca5,6,7. Esses anticorpos bloqueiam o CGRP ou seu receptor e previnem sintomas de enxaqueca em aproximadamente 50% dos pacientes com enxaqueca7. No último ano, dois antagonistas de pequenas moléculas do receptor CGRP também foram aprovados pela FDA para tratamento abortivo de enxaqueca, e mais dois estão no pipeline8. Apesar desse progresso terapêutico, os mecanismos pelos quais ocorrem os ataques de enxaqueca ainda permanecem evasivos. Por exemplo, os sites de ação CGRP não são conhecidos. A eficácia de anticorpos terapêuticos que não atravessam consideravelmente a barreira hematoencefálica sugere que o CGRP age em locais periféricos, como os meninges e/ou gânglios trigeminais. No entanto, não podemos descartar ações centrais em órgãos circunviculares, que não possuem uma barreira hemencefálica9. Pelo menos para fotofobia, achamos que isso é menos provável dado nossos resultados com aversão leve usando camundongos nestin/hRAMP1 transgênicos nos quais o hRAMP1 é superexpresso no tecido nervoso10. A compreensão dos mecanismos da fisiopatologia da enxaqueca fornecerá novos caminhos para o desenvolvimento da terapêutica da enxaqueca.
Modelos animais pré-clínicos são fundamentais para a compreensão dos mecanismos da doença e o desenvolvimento de novas drogas. No entanto, a avaliação da enxaqueca em animais é desafiadora, uma vez que os animais não podem relatar verbalmente suas sensações de dor. Dado o fato de que 80-90% dos pacientes com enxaqueca apresentam fotofobia11, a aversão à luz é considerada um indicador de enxaqueca em modelos animais. Isso levou à necessidade de desenvolver um ensaio para avaliar a aversão à luz em camundongos.
O ensaio claro/escuro contém uma zona de luz e uma zona escura. É amplamente utilizado para medir a ansiedade em camundongos com base em sua exploração espontânea de novos ambientes que é combatido por sua aversão inata à luz12. Alguns estudos definem 1/3 da câmara como a zona escura, enquanto outros definem 1/2 da câmara como a zona escura. O primeiro ambiente é frequentemente usado para detectar ansiedade13. Embora inicialmente tenhamos escolhido câmaras claras/escuras de tamanho igual, não comparamos os dois tamanhos relativos. Podemos comentar que o tamanho geral de ambas as câmaras não é um fator importante, uma vez que a caixa de testes iniciais14 foi consideravelmente maior do que o aparelho subsequente15, mas os resultados foram essencialmente os mesmos.
Duas modificações críticas neste ensaio claro/escuro para avaliar a aversão à luz foram: a condição de teste e a intensidade da luz (Figura 1). Primeiro, os camundongos são pré-expostos à câmara clara/escura para reduzir a unidade exploratória16 (Figura 1A). A necessidade e os tempos de pré-exposições dependem de cepas e modelos do rato. Os camundongos Wildtype C57BL/6J geralmente requerem duas pré-exposições10, enquanto apenas uma pré-exposição para camundongos CD1 é suficiente17. Desta forma, o comportamento aversivo da luz pode ser desmascarado nessas duas cepas de camundongos. Em segundo lugar, a iluminação da câmara foi adaptada para incluir uma gama ajustável de intensidades de luz de dim (55 lux) a brilhante (27.000 lux) onde 55 lux é comparável a um dia nublado escuro, e 27.000 lux é comparável a um dia ensolarado e ensolarado na sombra10. Descobrimos que a intensidade de luz necessária varia de acordo com a cepa e o modelo genético. Por essa razão, os indivíduos devem primeiro avaliar a intensidade mínima da luz para seu paradigma experimental.
Mesmo com essas modificações no ensaio, que podem revelar um fenótipo leve e aversivo, é necessário testar comportamentos semelhantes à ansiedade para distinguir entre a aversão à luz devido à luz apenas versus devido à ansiedade. O ensaio de campo aberto é uma forma tradicional de medir a ansiedade com base na exploração espontânea de novos ambientes. Difere do ensaio claro/escuro, pois a unidade exploratória é combatida pela aversão inata a espaços abertos desprotegidos. Tanto o centro quanto as bordas da câmara estão na luz, então o ensaio de campo aberto é um ensaio de ansiedade levemente independente. Assim, a combinação dos ensaios de campo claro/escuro e aberto nos permite distinguir entre a aversão à luz devido à prevenção da luz versus um aumento geral da ansiedade.
CGRP é um neuropeptídeo multifuncional que regula vasodilatação, nocicepção e inflamação18. É amplamente expressa nos sistemas nervosos periférico e central. Desempenha um papel importante na fisiopatologia da enxaqueca18. No entanto, o mecanismo subjacente à ação cgrp na enxaqueca não é claro. Utilizando os ensaios de campo claro/escuro e aberto com este paradigma de teste modificado, conseguimos identificar o comportamento aversivo em camundongos após a administração periférica 10,16 (Figura 2) e central14,15,16,19 CGRP. Além dos neuropeptídeos, a identificação de regiões cerebrais envolvidas na aversão à luz também é importante na compreensão da fisiopatologia da enxaqueca. Os núcleos talámicos posteriores são uma região cerebral integrativa para dor e processamento de luz19, e o tálamo é ativado durante a enxaqueca20. Assim, direcionamos núcleos tálammicos posteriores injetando vírus associado ao adeno (AAV) contendo canalrhodopsina-2 (ChR2) ou eYFP nesta região. Combinando essa abordagem optogenética com esses dois ensaios, demonstramos que a estimulação óptica de neurônios expressos de ChR2 nos núcleos talâmicos posteriores induziu a aversão à luz19 (Figura 3). Neste experimento, dado o efeito dramático sobre a aversão à luz evocada nesses ratos optogeneticamente manipulados, pré-exposições à câmara foram ignoradas.
Protocolo
Os procedimentos animais foram aprovados pelo Comitê de Cuidados e Uso de Animais da Universidade de Iowa e realizados em conformidade com as normas estabelecidas pelos Institutos Nacionais de Saúde.
1. Ensaio claro/escuro
- Aparato de câmara clara/escura (ver Tabela de Materiais) configuração. Todos os equipamentos desta seção estão disponíveis comercialmente.
- Em uma prateleira, coloque o cubículo atenuante de som (interior: 59,7 x 38 x 35,6 cm em W x H x D) contendo uma gaveta de retirada para fácil acesso à câmara e inserção escura.
- Conecte a fonte de alimentação DC e uma fonte de alimentação regulamentada por DC ao cubículo atenuante de som.
- Coloque a câmara de campo aberto transparente (27,31 x 27,31 x 20,32 cm em L x W x H) na gaveta de retirada do cubículo.
- Coloque a pastilha escura de plástico transparente (28,7 X 15 X 20,6 cm em L x W x H) na câmara de campo aberto. Certifique-se de que a câmara está dividida em duas zonas de tamanho igual: uma zona escura e uma zona de luz.
- Conecte três conjuntos de matrizes ir de 16 feixes nos eixos X, Y e Z da câmara de campo aberto ao controlador USB IR através de cabos.
- Conecte o controlador USB IR a um computador.
- Instale o software de rastreamento no computador que pode gravar e coletar a localização e a atividade do mouse.
- Para a configuração do painel de luz, remova primeiro o painel de luz emissor de luz (LED) (27,70 x 27,70 cm em L x W; 360 LEDs, cor balanceada à luz, 5600K, 60° spread de feixe de inundação) de sua carcaça original.
- Monte o painel de luz com o driver LED, o dissipador de calor e a fonte de alimentação. Vários painéis de luz LED podem ser conectados a uma fonte de alimentação, dissipador de calor e driver LED para obter um controle uniforme do painel de luz.
- Construa uma plataforma de acrílico personalizada (29,77 x 27,70 x 8,10 cm em L x W x H) composta por 7 prateleiras idênticas a intervalos de 0,53 cm (Figura 1B). Fixar permanentemente a prateleira de acrílico personalizada ao teto dentro do cubículo acima da câmara.
- Insira o painel de luz LED no slot entre as duas prateleiras inferiores. Ajuste o painel de luz para diferentes alturas (Figura 1B,C), se necessário (por exemplo, se usar camundongos optogenéticos. Os detalhes são discutidos na Seção 3).
- Ligue o dissipador de calor, o driver led e a fonte de alimentação. Confirme que o driver led pode ditar a intensidade da luz LED medindo a intensidade da luz no chão da câmara e confirmar que o piso está iluminado uniformemente.
- Procedimento de teste comportamental
NOTA: Os ratos estão alojados em um ciclo de luz de 12 h. Todos os experimentos comportamentais são realizados durante o ciclo de luz. São utilizados camundongos, incluindo machos e fêmeas, com idade entre 10 e 20 semanas de idade. Neste protocolo, os camundongos ingênuos do tipo selvagem CD1 e C57BL/6J experimentam duas pré-exposições à câmara clara/escura seguidas de exposição com tratamento e exposição pós-tratamento. Há um intervalo de três dias entre cada exposição para permitir que os camundongos se recuperem (Dia 1, 4, 7 e 10, conforme descrito abaixo e Figura 1A). No entanto, os camundongos CD1 não requerem a 2ª pré-exposição e podem ser testados em luz fraca.- No primeiro dia (pré-tratamento 1), ligue o aparelho de ensaio claro/escuro e afina a intensidade da luz para 27.000 lux.
- Abra o software de rastreamento e configure um novo protocolo. Na configuração Novo Protocolo , defina a Duração para 30 min. Na configuração Nova análise , defina Caixas de Dados por Duração até 300 s.
- Na configuração Nova zona , escolha Zonas Pré-Definidas. Escolha 2 e depois Horizontal. Verifique se a câmara está dividida em duas zonas de tamanho igual para gravação.
- Habituar ratos à sala de testes por 1h antes do teste. Durante a habituação, mantenha a luz do quarto acesa para não interromper o ritmo circadiano do rato. Certifique-se de que todos os equipamentos para o ensaio claro/escuro estão ligados, permitindo que os ratos se aclimatem totalmente ao ambiente da sala de testes.
- Selecione Adquirir dados. Digite as IDs do mouse. Inicie o protocolo.
- Puxe a gaveta para fora do cubículo atenuante de som para acessar a câmara clara/escura e a pastilha escura. Pegue suavemente o mouse pela base da cauda, coloque-o na zona de luz da câmara e empurre a gaveta para dentro do cubículo. Certifique-se de que o software detecta o mouse imediatamente e comece a registrar a atividade.
- Aguarde que a gravação pare automaticamente depois de 30 minutos. Devolva o rato para sua gaiola.
- Limpe a câmara e a inserção escura usando lenços descartáveis germicidal de álcool-odor contendo 55,0% de álcool isopropílico, 0,25% alquil C12-18 dimethyl ethyl etilbenzyl amônio, e 0,25% alquil C12-18 cloreto de amônio dimetil benzil como ingredientes ativos antimicrobinais para erradicar quaisquer pistas olfativas deixadas pelo camundongo anterior.
- No dia 4 (pré-tratamento 2), repetimos as etapas 1.2.1 a 1.2.8.
- No dia 7 (dia do tratamento), repita a etapa 1.2.1 e 1.2.4. Após a habituação, administre CGRP (0,1 mg/kg, 10 μl/g com base no peso do corpo do rato, injeção intraperitoneal (i.p.)), inclinando a cabeça do mouse para frente e injetando no quadrante inferior direito. Devolva o rato para a jaula.
- Após 30 min, inicie o protocolo e execute o mouse na câmara clara/escura, conforme mencionado nas etapas 1.2.5 a 1.2.7. O tempo de recuperação em gaiolas domésticas após as injeções pode ser encurtado ou alongado dependendo do tratamento21.
- Limpe a câmara e a pastilha escura conforme descrito na etapa 1.2.8.
- No dia 10 (dia pós-tratamento), repetimos as etapas 1.2.1 a 1.2.8. O experimento pode ser pausado na etapa 1.2.13 antes de iniciar o ensaio de campo aberto.
2. Ensaio de campo aberto
- A configuração do aparelho
- Configuração da câmara de campo aberto: Use o mesmo cubículo atenuante de som e câmara de campo aberto usado no ensaio claro/escuro, sem usar a pastilha escura.
- Configuração do painel de luz: Use a mesma configuração usada no ensaio claro/escuro. Certifique-se de que a intensidade da luz é a mesma usada no ensaio claro/escuro.
- Procedimento de teste comportamental
- Ligue o aparelho. Coloque a intensidade da luz para 27.000 lux.
- Abra o software de rastreamento.
- Configure um novo protocolo, o mesmo que é usado no ensaio claro/escuro, exceto para as configurações da Nova Zona . Escolha 1 seguido pelo Centro nas configurações Da Nova Zona . Coloque a periferia a 3,97 cm do perímetro e o centro como 19,05 × 19,05 cm.
- Habituar ratos à sala de testes conforme descrito na etapa 1.2.4.
- Administrar CGRP (0,1 mg/kg, 10 μl/g com base no peso do corpo do rato, i.p.), inclinando a cabeça do mouse para a frente e injetando no quadrante inferior direito. Devolva o rato para a jaula.
- Depois de 30 min, inicie o protocolo. Puxe a gaveta de puxar para fora do cubículo atenuante de som e coloque suavemente o mouse no meio da câmara de campo aberto. Empurre a gaveta para dentro do cubículo.
- Comportamento de pista por 30 minutos. Então devolva ratos para suas gaiolas.
- Limpe o aparelho conforme descrito na etapa 1.2.8.
3. Ensaio claro/escuro modificado para camundongos optogenéticos
- A configuração do aparelho
- Faça duas modificações na pastilha escura.
- Modifique a abertura da pastilha escura para 5,08 x 5,08 cm (W x H) com uma pequena fenda 0,95 x 10,16 cm (W X H) entre a parte superior e a abertura da inserção escura (Figura 1D superior esquerda).
NOTA: Esta modificação permite que um mouse vá para a zona escura sem dificuldade quando a cânula de fibra óptica na cabeça do mouse é anexada ao cabo de remendo. - Estenda a parte superior da inserção escura sobre a área de luz como varanda triangular (H=6,5 cm) (Figura 1D superior direito e inferior esquerdo). Corte um orifício circular (D=1,7 cm) da varanda e insira um suporte no orifício para colocar e estabilize a articulação rotativa, que conecta o laser e os cabos de remendo de fibra óptica (Figura 1D superior esquerdo e inferior esquerdo).
NOTA: As modificações resultam em pequena mudança na intensidade da luz atingindo o piso da zona escura (17 lux com modificações vs 14 lux sem modificações, medida no canto direito traseiro da zona escura abaixo de 27.000 lux).
- Modifique a abertura da pastilha escura para 5,08 x 5,08 cm (W x H) com uma pequena fenda 0,95 x 10,16 cm (W X H) entre a parte superior e a abertura da inserção escura (Figura 1D superior esquerda).
- Insira a junta rotativa no suporte na pastilha escura.
- Conecte o cabo de remendo de fibra óptica de 30,5 cm à junta rotativa. Confirme se a junta rotativa pode girar suavemente para que o cabo de remendo possa girar sem dificuldade à medida que o mouse atravessa a câmara.
- Para o resto da configuração, use a mesma configuração do aparelho usada na seção 1 (ensaio claro/escuro).
- Faça duas modificações na pastilha escura.
- Procedimento de teste comportamental
NOTA: Ao contrário dos camundongos do tipo selvagem, os camundongos optogenéticos não recebem pré-exposições (pré-tratamento 1 e 2).- No dia do teste, insira o painel de luz LED no segundo slot mais baixo (28,23 cm do assoalho do camber) para permitir espaço para conectar o cabo de remendo. Ligue o aparelho de ensaio claro/escuro e coloque a intensidade da luz em 55 lux.
- Use a mesma configuração de protocolo que em 1.2.2 e 1.2.3 exceto que as caixas de dados por duração são definidas como 60 s na configuração Nova Análise para ser congruente com o protocolo de estimulação a laser na Etapa 3.2.3.
- Ligue o botão laser. Defina o controlador de pulso laser para estimular por 1 min seguido de 1 min sem estimulação acima de 30 minutos.
- Habituar ratos à sala de testes com a luz acesa por 1h antes do teste.
- Inicie o protocolo. Puxe a gaveta de puxar para fora do cubículo atenuante de som para acessar a câmara clara/escura e a pastilha escura.
- Contenha suavemente o mouse e junte a cânula de fibra óptica na cabeça do mouse ao cabo de remendo de fibra óptica através de uma manga de acasalamento (Figura 1D inferior direito). Coloque o mouse suavemente na zona de luz e empurre a gaveta para dentro do cubículo. Certifique-se de que o protocolo começará a registrar o comportamento do mouse automaticamente.
- Em 1 min, ligue o controlador de pulso e, em seguida, gire a tecla failsafe para ON. Certifique-se de que a estimulação a laser da região cerebral alvo esteja ocorrendo a cada dois minutos.
- Depois de 30 min quando o protocolo parar automaticamente, gire a tecla failsafe para OFF. Em seguida, desligue o controlador de pulso.
- Desacoplar o mouse e o cabo de remendo de fibra óptica. Devolva o rato para a jaula.
- Limpe a câmara e a pastilha escura conforme descrito na etapa 1.2.8.
4. Ensaio de campo aberto modificado para camundongos optogenéticos
- A configuração do aparelho
- Estabilize a junta rotativa acima da câmara usando um suporte e um grampo (Figura 1E).
- Conecte o cabo de remendo de fibra óptica com um comprimento de 50 cm à junta rotativa. Verifique se a junta rotativa pode girar suavemente.
- Coloque a junta rotativa na altura apropriada no suporte: certifique-se de que o cabo de remendo de fibra óptica só pode atingir todos os cantos da câmara, o que ajudará a evitar qualquer interferência com o movimento do mouse.
- Para o resto da configuração, use a mesma configuração do aparelho usada na seção 1 (ensaio claro/escuro), mas sem a inserção escura.
- Procedimento de teste comportamental
- Ligue o aparelho de ensaio claro/escuro e coloque a intensidade da luz em 55 lux.
- Use a mesma configuração de protocolo que na análise de luz/escuridão modificada (seção 3) exceto nas configurações da Nova Zona . Escolha 1 seguindo por Central nas configurações da Nova Zona . Coloque a periferia a 3,97 cm do perímetro e o centro como 19,05 × 19,05 cm.
- Ligue o botão laser. Defina o controlador de pulso laser para estimular por 1 min seguido de 1 min sem estimulação acima de 30 min.
- Realize a habituação e o resto do teste conforme descrito nas etapas 3.2.4 a 3.2.10, exceto por duas alterações na etapa 3.2.6: coloque o mouse suavemente no meio da câmara em vez da zona de luz; mantenha a gaveta de puxar fora do cubículo devido ao cabo de remendo que se conecta à cabeça do mouse.
Resultados
Este paradigma de teste comportamental foi projetado para testar o comportamento aversivo da luz. Pode ser realizado usando camundongos selvagens ingênuos e camundongos optogenéticos para investigar a aversão à luz em tempo real durante a estimulação de uma população neuronal direcionada.
Este procedimento tem sido utilizado para estudar o efeito do tratamento periférico de CGRP em camundongos CD1 e C57BL/6J10,16 e estimulação óptica de neurônios nos núcleos tálamo posteriores em camundongos C57BL/6J19 em comportamento leve-aversivo. Camundongos, incluindo machos e fêmeas, com idade entre 10 e 20 semanas de idade, foram utilizados nos experimentos (Figura 2A, Figura 2B-D e Figura 3). Os resultados revelaram que a injeção i.p. de CGRP diminuiu significativamente a duração do tempo gasto na zona de luz no ensaio claro/escuro em camundongos CD1 (Figura 2A) e C57BL/6J (Figura 2B), mas não afetaram o tempo que os ratos passaram no centro no ensaio de campo aberto em camundongos CD1 (dados não mostrados) e camundongos C57BL/6J (Figura 2D)10, 16 anos. Isso sugere que o CGRP periférico induz a aversão à luz, mas não a ansiedade geral. O tratamento com CGRP também aumentou a quantidade de tempo que os ratos descansavam na zona escura, mas não na zona de luz tanto em camundongos CD1 (dados não mostrados) quanto em camundongos C57BL/6J (Figura 2C).
Para o protocolo optogenético, visamos os neurônios calmodulin quinase II alpha (CaMKIIa) nos núcleos talámicos posteriores, injetando AAV2-CaMKIIa-hChR2(E123A)-eYFP ou o vírus de controle AAV2-CaMKIIa-eYFP19. Ao mesmo tempo, uma cânula de fibra óptica foi implantada nos núcleos tálamômicos posteriores. Três semanas após a injeção para permitir tempo suficiente para a expressão chr2, realizamos estimulação óptica de neurônios nos núcleos talâmicos posteriores e notamos uma diminuição correspondente na duração que os camundongos passaram na zona de luz no ensaio claro/escuro em camundongos injetados por ChR2 em comparação com os camundongos injetados por vírus (eYFP) (Figura 3A). Não houve diferença notável no tempo no centro do ensaio de campo aberto entre chr2 e controle eYFP mouses (Figura 3C), indicativo de uma resposta leve-aversiva que não foi apenas impulsionada pela ansiedade19. Além disso, também foi observado um aumento no tempo de descanso na zona escura, mas não na zona de luz (Figura 3B). Os mesmos resultados foram obtidos quando utilizando 55 lux e 27.000 lux (Figura 3). O procedimento de 55-lux foi incluído porque os pacientes com enxaqueca são sensíveis até mesmo à luz fraca.

Figura 1: A linha do tempo e o aparelho do ensaio claro/escuro. (A) Linha do tempo do paradigma de teste: Após duas pré-exposições à câmara clara/escura (Pré 1 e Pré 2), os camundongos são administrados CGRP (0,1 mg/kg, i.p.) seguido de uma medição pós-tratamento (Post). Pelo menos um dia após o ensaio claro/escuro, os ratos recebem CGRP (0,1 mg/kg, i.p.) novamente e são executados no ensaio de campo aberto. Pré: pré-tratamento; Tx: tratamento; Post: pós-tratamento (B) O painel LED é mantido na parte superior da câmara por uma prateleira de acrílico e ilumina a área de teste. A altura do painel de luz pode ser ajustada usando ranhuras em diferentes alturas. (C) A câmara clara/escura contém uma pastilha escura com uma pequena abertura. Um painel de luz LED está acima da câmara. (D) Vistas dianteiras, laterais e superiores da inserção escura modificada. A abertura na pastilha escura é estendida com uma pequena fenda para o movimento do cabo de remendo (superior esquerdo). A parte superior da inserção escura estende-se sobre a área de luz como uma varanda triangular com suporte para a articulação rotatória (superior direito e inferior esquerdo). O cabo de remendo de fibra óptica é conectado à cânula de fibra óptica através de uma manga de acasalamento (inferior direito). (E) O ensaio de campo aberto modificado. O suporte e o grampo seguram a articulação rotativa. A câmara é puxada para a frente do cubículo com as portas abertas para permitir a livre circulação do mouse com o cabo de remendo preso à cabeça do mouse. Clique aqui para ver uma versão maior desta figura.

Figura 2: A administração periférica de CGRP evoca a aversão à luz leve em luz brilhante em duas cepas de ratos de tipo selvagem. Os camundongos CD1 e C57/BL6J foram testados de acordo com a linha do tempo descrita na Figura 1A. (A) O tempo que os ratos CD1 passaram na zona de luz por intervalo de 5 minutos ao longo de 30 min (27.000 lux). O tempo de luz é mostrado ao longo do tempo durante o teste (painel esquerdo) e como o tempo médio por intervalo de 5 minutos para ratos individuais (painel direito). Foram feitas comparações entre veículo e CGRP em cada ponto de tempo, e entre Tx e Pre2 ou Post, conforme indicado por suportes. (Veh, n=19; 0,1 mg/kg CGRP, n=19) (B) Tempo que os ratos C57BL/6J passaram na zona de luz por intervalo de 5 minutos ao longo de 30 min (27.000 lux). Os dados de tempo de luz são mostrados ao longo do tempo durante o teste (painel esquerdo) e como o tempo médio por intervalo de 5 minutos para ratos individuais (painel direito) (Veh, n=42; 0,1 mg/kg CGRP, n=44). (C) Os camundongos do painel B também foram analisados para comportamento de repouso nas zonas escura e clara durante o ensaio claro/escuro. (D) Os camundongos do painel B foram posteriormente testados no ensaio de campo aberto. O percentual de tempo gasto no centro da câmara por intervalo de 5 minutos ao longo de 30 minutos após o tratamento com veículo ou CGRP (0,1 mg/kg, i.p.) (Veh, n=9; 0,1 mg/kg CGRP, n=9). A porcentagem de tempo nos dados do centro é mostrada ao longo do tempo durante o teste (painel esquerdo) e como a porcentagem média do tempo no centro por intervalo de 5 minutos para ratos individuais (painel direito). Para todos os painéis, média±SEM é mostrado, *p<0,05, **p<0.01, ***p<0.001, ****p<0.0001. Este número é modificado a partir de Mason et al. 201710. Clique aqui para ver uma versão maior desta figura.
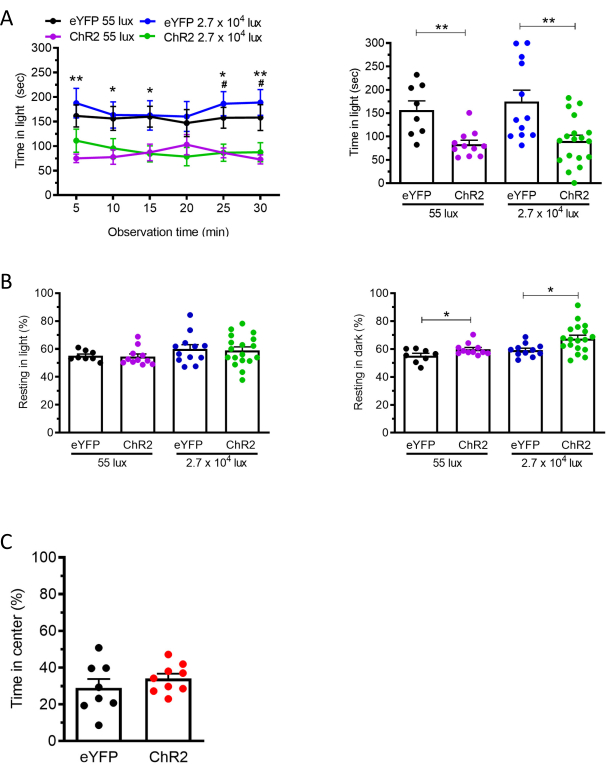
Figura 3: Estimulação óptica de neurônios expressos de CaMKIIa nos núcleos talâmicos posteriores induz a aversão à luz em luz fraca e brilhante. (A) Núcleos tálmicos posteriores de camundongos C57BL/6J injetados com codificação AAV ou ChR2 ou eYFP (a 55 lux: eYFP n = 8, ChR2 n = 11; a 27.000 lux: eYFP n = 12, ChR2 n = 18) foram estimulados por laser azul (473 nm, 20 Hz, 5 ms de largura de pulso, 10 mW/mm2). O painel esquerdo mostra o tempo que os ratos passaram na zona de luz por intervalo de 5 minutos ao longo de 30 min a 55 ou 27.000 lux. Foram feitas comparações entre os grupos eYFP e ChR2 em cada ponto de tempo. O painel direito mostra o tempo médio por intervalo de 5 minutos para ratos individuais. (B) Os camundongos do painel A também foram analisados para comportamento de descanso nas zonas de luz (painel esquerdo) e escuro (painel direito) durante o ensaio claro/escuro. (C) Os camundongos do painel A foram posteriormente testados no ensaio de campo aberto. Percentual médio do tempo gasto no centro da câmara de campo aberto por intervalo de 5 minutos ao longo de 30 min (Laser: 473 nm, 20 Hz, 5 ms de largura de pulso, 10 mW/mm2). (eYFP n = 8, ChR2 n = 9). Para todos os painéis, média±SEM é mostrado, *p<0,05, **p<0.01, ***p<0.001, ****p<0.0001. Esse valor é modificado a partir de Sowers et al. 202019. Clique aqui para ver uma versão maior desta figura.
Discussão
O ensaio claro/escuro é amplamente utilizado para avaliar comportamentos semelhantes à ansiedade12. O ensaio conta com a aversão inata dos ratos à luz e sua vontade de explorar quando colocados em um novo ambiente (zona de luz). No entanto, como relatamos aqui, este ensaio também pode ser usado para avaliar o comportamento aversivo da luz também.
É fundamental considerar o número e a necessidade de pré-exposições antes dos testes. Isso depende da tensão do mouse ou modelo. Por exemplo, em nosso protocolo de ensaio claro/escuro, ratos ingênuos do tipo selvagem CD1 e C57BL/6J são pré-expostos à câmara clara/escura duas vezes antes de serem submetidos ao procedimento de teste de tratamento, enquanto os camundongos optogenéticos não são submetidos à pré-exposição. Uma publicação recente informou que uma pré-exposição é suficiente para que os ratos CD1 exibam a aversão à luz após a administração do CGRP i.p.17. Consequentemente, a significância do parâmetro da novidade terá diminuído na chegada do dia do tratamento 10,16. As pré-exposições podem desmascarar fenótipos leves aversivos reduzindo o impulso exploratório e, assim, alterando o equilíbrio entre exploração e aversão. Em alguns casos, a pré-exposição não é necessária. Por exemplo, com camundongos geneticamente alterados com receptores CGRP aumentados no sistema nervoso, a pré-exposição não foi necessária14. Da mesma forma, com camundongos optogeneticamente manipulados, nos quais os neurônios expressos de CaMKIIa nos núcleos talâmicos posteriores foram direcionados para estimulação óptica, a pré-exposição não era necessária, presumivelmente porque a resposta leve-aversiva era tão robusta na estimulação direta do cérebro19. Assim, o número e a necessidade de pré-exposições à câmara devem ser cuidadosamente considerados ao usar diferentes cepas ou modelos de camundongos. De fato, a superexposição dos ratos à câmara pode reduzir o comportamento exploratório. Isso levará os camundongos a ocupar preferencialmente a zona escura, independentemente do tratamento, reduzindo a capacidade de observar uma resposta leve e aversiva. Por outro lado, a pré-exposição insuficiente ao ensaio pode levar a comportamento exploratório mascarando comportamentos potenciais de luz aversiva.
Uma exposição pós-tratamento serve para identificar se um rato se recuperou totalmente da injeção CGRP administrada 2 dias antes. Isso é essencial antes de executar o ensaio de campo aberto ou qualquer outro ensaio para confirmar que não há nenhum efeito de tratamento prolongado que afetará futuros testes comportamentais.
Optamos por uma duração de protocolo de 30 minutos com base em observações anteriores10. Testamos camundongos no ensaio claro/escuro para 10 min15, 20 min16 e 30 min10 separadamente. O CGRP diminuiu a quantidade de tempo que os ratos passavam na luz entre 0-30 min, mas depois de 30 minutos os ratos de controle preferiram passar mais tempo no escuro em comparação com 0-30 min, levando à decisão de testar por 30 minutos. Da mesma forma, a duração do teste pode ser ajustada com referência à curva de resposta ao tempo para diferentes modelos de mouse. Deve-se notar que o alongamento do tempo de exposição à câmara clara/escura pode reduzir a motivação para explorar a zona de luz.
Analisamos muitos parâmetros diferentes para avaliar o comportamento animal. Uma característica essencial do ensaio claro/escuro é a medição do tempo que um mouse passa na zona de luz, refletindo diretamente a aversão à luz. Percentual de tempo gasto descansando, o número de quebras verticais de feixe (para medir a atividade de criação) em zonas claras ou escuras, e o número de transições entre as duas zonas são usados para avaliar a motilidade. O tempo de descanso e as quebras verticais do feixe são normalizados ao tempo gasto em cada zona, a fim de evitar falsas conclusões sobre o movimento. Incluímos todos os camundongos nas análises, exceto: camundongos que permanecem na zona de luz durante todo os 30 minutos de testes, camundongos que passam mais de 90% do tempo descansando no total (zonas claras e escuras) e outliers estatísticos (>3 SDs da média). O número de camundongos excluídos é geralmente inferior a 1%. Para o ensaio de campo aberto, a porcentagem de tempo no centro é a principal medida usada para avaliar o comportamento semelhante à ansiedade.
No ensaio claro/escuro modificado, o posicionamento da cânula de fibra óptica em algumas regiões cerebrais pode restringir muito o movimento do rato e, em alguns casos, impedir que o rato atinja a zona escura. Consequentemente, a entrada na zona escura será reforçada negativamente e, após múltiplas tentativas, o mouse pode mostrar uma preferência aprendida pela luz, mesmo permanecendo na zona de luz durante todo o período de teste. Isso pode ser corrigido modificando o tamanho e a forma da abertura na pastilha escura. Como exemplo, quando a cânula de fibra óptica foi instalada no cerebelo de camundongos wildtype C57BL/6J, os camundongos tiveram dificuldade em atravessar a abertura da pastilha escura. Depois de alterar a largura da abertura para 6,10 cm em vez de 5,08 cm, os ratos foram capazes de atravessar a abertura livremente.
Um cabo de remendo de fibra óptica de 30,5 cm é usado no ensaio claro/escuro modificado, com base no tamanho da câmara de campo aberto, permitindo que o mouse se mova livremente. Um comprimento mais curto do cabo impedirá que um rato se mova para os cantos, enquanto um cabo mais longo pode emaranhar e dificultar o movimento. O comprimento do cabo de remendo de fibra óptica usado para o ensaio de campo aberto modificado é de 50 cm. O comprimento não é tão rigoroso quanto no ensaio claro/escuro, uma vez que a altura da articulação rotativa pode ser ajustada de acordo com o comprimento do cabo de remendo de fibra óptica, garantindo que o mouse seja capaz de apenas alcançar os cantos da câmara.
Com base em análises de energia, 10-12 ratos por grupo são necessários para camundongos CD1 e C57BL/6J com CGRP i.p. e para ratos optogenéticos C57BL/6J para detectar aversão significativa à luz. No entanto, o tamanho do grupo C57BL/6J foi consideravelmente maior do que o tamanho do grupo CD1 (Figura 2A,B) porque os camundongos C57BL/6J não respondiam ao CGRP em um subconjunto dos testes10, o que significa que foram realizados múltiplos testes para explicar essa alta variabilidade no comportamento leve-aversivo nesses camundongos. Especificamente, dois experimentos foram combinados para os camundongos CD1 e quatro experimentos foram combinados para camundongos C57BL/6J com CGRP i.p. (Figura 2A,B)10. A razão para essa variabilidade não é conhecida, mas os seres humanos também mostram variabilidade em suas respostas ao CGRP e à luz. A injeção intravenosa (i.v.) de ataques de enxaqueca induzida por CGRP em cerca de 63~75% dos pacientes com enxaqueca, com 70~90% dos pacientes que apresentaram ataques de enxaqueca exibindo fotofobia22,23,24,25. Ao todo, o ensaio tem considerável variabilidade e, além do número de camundongos, é essencial fazer pelo menos dois e, de preferência, três experimentos totalmente independentes com diferentes coortes de camundongos.
A cama não é necessária na câmara clara/escura e o experimentador não é obrigado a pré-manusear ou habituar os ratos. Como medida de precaução, os dois procedimentos de pré-exposição servem ao propósito de aclimatar os camundongos às pistas olfativas e físicas do experimentador; no entanto, Ueno H. et al. demonstraram que não há diferença de tempo à luz no ensaio claro/escuro ou no tempo no centro no ensaio de campo aberto entre camundongos após manuseio repetido e camundongos sem manuseio26.
O ensaio de campo aberto pode avaliar a contribuição da ansiedade para um fenótipo leve e aversivo. Existem outros ensaios bem validados relacionados à ansiedade, como o labirinto zero elevado e o elevado labirinto plus27; no entanto, o ensaio de campo aberto é o controle mais relevante processualmente para o protocolo claro/escuro, uma vez que a mesma câmara de teste é usada para ambos os ensaios. Mesmo assim, uma avaliação da ansiedade pode ser reforçada utilizando múltiplos ensaios ou medindo múltiplos parâmetros em um único teste, dado que a ansiedade é um comportamento complicado e multifacetado. É importante ressaltar que, mesmo que não haja fenótipo de ansiedade no ensaio de campo aberto, isso não exclui um componente de ansiedade para o fenótipo leve-aversivo. Por exemplo, a luz pode estar desencadeando uma resposta de ansiedade. O ensaio de campo aberto só indica que a ansiedade por si só não está conduzindo a resposta à luz. Enquanto uma droga ansiolítica, como benzodiazepame, pode ser usada neste ensaio, tal abordagem teria complicações, por exemplo, drogas ansiolíticas afetam a locomoção. Em vez disso, optamos por usar medicamentos clínicos anti-enxaqueca, incluindo sumatriptano, para validar o estado de enxaqueca do fenótipo leve-aversivo. O Sumatriptan reverteu com sucesso a aversão à luz induzida pelo CGRP em camundongos CD1 e C57BL/6J10.
Ao contrário do ensaio claro/escuro modificado, a câmara na gaveta de retirada está fora do cubículo com portas de cubículo abertas no ensaio de campo aberto modificado devido ao cabo de remendo que se conecta à cabeça do mouse. Em vez de 55 lux, a luz do quarto atinge o chão da câmara em ~1000 lux. Mesmo que a intensidade da luz seja diferente, o ensaio de campo aberto é um teste independente da luz. Em detalhes, o aumento da intensidade da luz de 55 para 27.000 lux no ensaio de campo aberto resultou em uma tendência de diminuição do tempo no centro em camundongos C57BL/6J, sugerindo que a intensidade da luz pode influenciar o comportamento do rato28. No entanto, a diferença entre o controle e os grupos experimentais não foi significativa sob 55 nem 27.000 lux28. Além disso, a diferença na intensidade da luz entre 55 e 1000 lux é muito mais sutil do que entre 55 e 27.000 lux. A optogenética sem fio pode resolver este problema, pois não haveria cabo de remendo, permitindo que a câmara de campo aberto fosse empurrada para dentro do cubículo atenuante de som.
Além disso, o cabo de remendo ainda limita o movimento do mouse, apesar de selecionar um comprimento ideal. No futuro, a optogenética sem fio oferecerá uma alternativa não invasiva às técnicas optogenéticas baseadas em cabo.
Deve-se notar que usamos injeção aguda de CGRP, que só replica em parte a liberação de CGRP prolongada que acompanha os ataques de enxaqueca. Enquanto injetamos CGRP em camundongos para modelar enxaqueca com base na premissa de que os níveis de CGRP plasmá plasma foram aumentados29 e que i.v CGRP induziu ataques de enxaqueca em pacientes com enxaqueca22,23,24,25,30, isso não irá replicar a condição no paciente onde o CGRP é mantido em níveis elevados por um tempo relativamente longo (as medidas dos pacientes foram tomadas em uma mediana 3 horas após o início da enxaqueca29 ), nem replica enxaqueca crônica onde os níveis são relatados como elevados mesmo entre os ataques31. Além disso, outros mediadores induzidos pela dor não foram testados em nosso paradigma.
O grupo mogil modificou o labirinto mais elevado para medir a aversão à luz em camundongos, com os braços fechados sendo iluminados pela luz brilhante e os braços abertos permanecendo escuro32. O padrão elevado mais labirinto tem sido frequentemente usado para detectar comportamentos relacionados à ansiedade em animais. Este ensaio é baseado no conflito entre o desejo inato de um rato de explorar um novo ambiente e ser colocado em uma posição comprometedora nos braços abertos desprotegidos do labirinto. No protocolo modificado, os ratos são forçados a selecionar entre os braços fechados, que são iluminados com luz brilhante, e os braços abertos desprotegidos, que são escuros. A preferência pelo primeiro sugere que a ansiedade anula a aversão à luz, enquanto a preferência por este último sugere que a aversão à luz prevalece sobre a ansiedade. O grupo mogil também realizou um padrão elevado mais labirinto para avaliar o comportamento de ansiedade32. O objetivo é o mesmo que conduzir o ensaio de campo aberto em nosso protocolo. Cacna1a mutante camundongos, um modelo de enxaqueca hemplégica familiar, mostrou fotofobia quando os braços fechados estavam brilhantes. Em contraste, o comportamento semelhante à ansiedade não foi detectado quando o padrão elevado mais labirinto foi realizado32. Em ratos, utilizando tanto o labirinto mais elevado modificado quanto o ensaio claro/escuro, foi demonstrado que a nitroglicerina (NTG) foi capaz de induzir a fotofobia33,34, que foi resgatada por sumatriptan34. No ajuste de labirinto elevado e elevado, onde a luz está ausente dentro dos braços fechados, o NTG induziu o comportamento de ansiedade em ratos34, sugerindo que a aversão à luz induzida pelo NTG é acompanhada de ansiedade. Pelo que sabemos, não há publicações usando o ensaio claro/escuro e o labirinto elevado modificado no mesmo modelo de mouse. Em suma, tanto o labirinto mais elevado modificado quanto o ensaio claro/escuro proposto neste protocolo foram demonstrados como medidas eficazes de comportamento leve-aversivo em camundongos.
Utilizamos o painel led diurno com uma cor balanceada à luz do dia (5600K), com um feixe de inundação de 60°, não rendendo sombra a uma altura de ~30 cm do chão da câmara em 55 lux ou 27.000 lux. Outros estudos que investigam a aversão à luz utilizaram o ensaio claro/escuro com modificações variadas. Por exemplo, estudos têm usado diferentes intensidades de luz para a zona de luz, variando de centenas a milhares de lux35,36,37; luz usada em diferentes comprimentos de onda (por exemplo, azul e amarelo)38; ou usou diferentes temperaturas de luz (fria e quente)39. Deve-se ter cuidado para o calor produzido pela luz, pois pode afetar a temperatura das zonas escura e clara e interferir no comportamento dos camundongos, potencialmente causando uma preferência a uma zona específica. Além disso, também é importante usar a luz com um bom ângulo de visão para evitar sombra no chão da câmara. A intensidade da luz também é importante para o teste. 25.000 -27.000 lux é aproximadamente equivalente à luz do dia brilhante. Ao conduzir o ensaio claro/escuro em uma intensidade de luz tão alta, é possível amplificar o efeito do tratamento; no entanto, é essencial considerar o dano da retina40 e o efeito negativo de uma intensidade de luz tão alta na vontade de um rato de entrar em luz. Alguns estudos relataram que os olhos de rato expostos à luz direta41 e camundongos expostos à luz brilhante por várias horas (por exemplo, 30.000 lux por 4 horas42) sofreram danos na retina. No ensaio claro/escuro, há uma zona escura para o mouse escapar da luz brilhante se o mouse desejar. Além disso, estudos anteriores descobriram que os camundongos do grupo controle (camundongos C57BL/6J) passaram um tempo semelhante na zona de luz abaixo de 55, 1000 e 27.000 lux28. Para os ratos CD1, o grupo controle passou cerca de 1/3 do tempo sob a luz abaixo de 27.000 lux10 e dados inéditos mostraram resultados semelhantes em 55 lux. Sugere que 27.000 lux light por si só não faz com que os ratos CD1 e C57BL/6J se afligiram. No entanto, deve-se ter cuidado ao optar por uma intensidade de luz mais alta.
Ao lado das diferenças no ajuste da luz, os pesquisadores optaram por uma variedade de abordagens na análise dos dados claros/escuros. Ao avaliar a aversão à luz, a quantidade de tempo gasto na zona de luz com a luz desligada (ou com iluminação de luz vermelha da zona de luz, dado que os olhos dos ratos são menos receptivos à luz vermelha) estão incluídos no cálculo. Por exemplo, índice de aversão= (tempo em luz0 lux-time em lux mais leve)/ tempo em light0 lux foi usado pelo grupo Gorin para avaliar a aversão à luz43. Aqui, as condições de "luz desligada" ou "luz vermelha" são incluídas para confirmar que a prevenção da zona de luz está condicionada à luz estar presente em oposição à simples preferência de lugar. Realizamos este procedimento com injeção i.p. de CGRP e descobrimos que os camundongos que recebem CGRP não tinham preferência de local com luz desligada na zona de luz, confirmando que a aversão induzida pelo CGRP é dependente da luz16. Por fim, o grupo Gorin usou o tempo que os ratos passavam na periferia da zona de luz no ensaio claro/escuro como medida de ansiedade36. Utilizamos um teste tradicional para ansiedade, o ensaio de campo aberto. Não importa qual método de análise seja escolhido, deve-se notar que a contribuição da ansiedade para a aversão à luz não pode ser ignorada. Este protocolo tenta dividir o comportamento aversivo da ansiedade e da luz, utilizando os ensaios de campo claro/escuro e aberto em conjunto.
Este protocolo aborda o uso dos ensaios de campo claro/escuro e aberto para a detecção de comportamentos leves e aversivos em camundongos. Isso fornece uma ferramenta útil para identificar os mecanismos de circuitos neurais e regiões cerebrais que conduzem a fotofobia. O paradigma do teste pode ser específico para enxaqueca ou pode ser expandido para outros transtornos envolvendo fotofobia. Com relação à enxaqueca, testamos dois outros neuropeptídeos associados à patogênese da enxaqueca: polipeptídeo ativador de ciclamato pituitário (PACAP) e peptídeo intestinal vasoativo (VIP). PACAP e VIP foram demonstrados para induzir a aversão à luz em mice17,21 CD1. Além da enxaqueca, a fotofobia também é um sintoma de muitos outros distúrbios, incluindo bradiopsia, lesão ocular aguda ou inflamação, síndromes cerebrais traumáticas, doença de Lyme, albinismo e distrofia do cone36. Assim, esse paradigma de teste fornece uma ferramenta para investigar mecanismos subjacentes a distúrbios relacionados à fotofobia. Além disso, a combinação de métodos optogenéticos com abordagens farmacológicas convencionais, sem dúvida, auxiliará no desenvolvimento de novas terapêuticas para distúrbios relacionados à fotofobia.
Divulgações
Os autores não têm conflitos de interesse para relatar.
Agradecimentos
Este trabalho foi apoiado por subvenções do NIH NS R01 NS075599 e RF1 NS113839. Os conteúdos não representam as opiniões da VA ou do Governo dos Estados Unidos.
Materiais
| Name | Company | Catalog Number | Comments |
| Activity monitor | Med Assoc. Inc | Software tracking mouse behavior | |
| Customized acrylic shelf | For adjusting the height of the LED panel | ||
| Dark box insert | Med Assoc. Inc | ENV-511 | |
| DC power supply | Med Assoc. Inc | SG-500T | |
| DC regulated power supply | Med Assoc. Inc | SG-506 | |
| Fiber-optic cannula | Doric | MFC_200/ 240-0.22_4.5mm_ZF1.25_FLT | |
| Germicidal disposable wipes | Sani-Cloth | SKU # Q55172 | |
| Heat Sink | Wakefield | 490-6K | Connecting to LED panel |
| IR controller power cable | Med Assoc. Inc | SG-520USB-1 | |
| IR USB controller | Med Assoc. Inc | ENV-520USB | |
| Mating sleeve | Doric | SLEEVE_ZR_1.25 | |
| Modified LED light panel | Genaray Spectro | SP-E-360D | Daylight-balanced color (5600K) |
| Power supply | MEAN WELL USA | SP-320-12 | Connecting to LED panel |
| Seamless open field chamber | Med Assoc. Inc | ENV-510S | |
| Sound-attenuating cubicle | Med Assoc. Inc | ENV-022MD-027 | |
| Stand and clamp | |||
| Three 16-beam IR arrays | Med Assoc. Inc | ENV-256 |
Referências
- Loder, S., Sheikh, H. U., Loder, E. The prevalence, burden, and treatment of severe, frequent, and migraine headaches in US minority populations: statistics from National Survey studies. Headache. 55 (2), 214-228 (2015).
- Collaborators, G. B. D. H. Global, regional, and national burden of migraine and tension-type headache, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurology. 17 (11), 954-976 (2018).
- GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 392 (10159), 1789-1858 (2018).
- international headache society. Headache classification committee of the international headache society (IHS). The international classification of headache disorders, 3rd edition. Cephalalgia. 38 (1), 1(2018).
- Edvinsson, L., Haanes, K. A., Warfvinge, K., Krause, D. N. CGRP as the target of new migraine therapies - successful translation from bench to clinic. Nature Reviews Neurology. 14 (6), 338-350 (2018).
- Rapoport, A. M., McAllister, P. The headache pipeline: Excitement and uncertainty. Headache. 60 (1), 190-199 (2020).
- Maasumi, K., Michael, R. L., Rapoport, A. M. CGRP and Migraine: The role of blocking calcitonin gene-related peptide ligand and receptor in the management of Migraine. Drugs. 78 (9), 913-928 (2018).
- Caronna, E., Starling, A. J. Update on calcitonin gene-related peptide antagonism in the treatment of migraine. Neurologic Clinics. 39 (1), 1-19 (2021).
- Eftekhari, S., Edvinsson, L. Possible sites of action of the new calcitonin gene-related peptide receptor antagonists. Therapeutic Advances in Neurological Disorders. 3 (6), 369-378 (2010).
- Mason, B. N., et al. Induction of migraine-like photophobic behavior in mice by both peripheral and central cgrp mechanisms. Journal of Neuroscience. 37 (1), 204-216 (2017).
- Russell, M. B., Rasmussen, B. K., Fenger, K., Olesen, J. Migraine without aura and migraine with aura are distinct clinical entities: A study of four hundred and eighty-four male and female migraineurs from the general population. Cephalalgia. 16 (4), 239-245 (1996).
- Crawley, J. N. Exploratory behavior models of anxiety in mice. Neuroscience and Biobehavioral Reviews. 9 (1), 37-44 (1985).
- Crawley, J., Goodwin, F. K. Preliminary report of a simple animal behavior model for the anxiolytic effects of benzodiazepines. Pharmacology, Biochemistry and Behavior. 13 (2), 167-170 (1980).
- Recober, A., et al. Role of calcitonin gene-related peptide in light-aversive behavior: implications for migraine. Journal of Neuroscience. 29 (27), 8798-8804 (2009).
- Recober, A., Kaiser, E. A., Kuburas, A., Russo, A. F. Induction of multiple photophobic behaviors in a transgenic mouse sensitized to CGRP. Neuropharmacology. 58 (1), 156-165 (2010).
- Kaiser, E. A., Kuburas, A., Recober, A., Russo, A. F. Modulation of CGRP-induced light aversion in wild-type mice by a 5-HT(1B/D) agonist. Journal of Neuroscience. 32 (44), 15439-15449 (2012).
- Kuburas, A., et al. PACAP induces light aversion in mice by an inheritable mechanism independent of CGRP. Journal of Neuroscience. , (2021).
- Russo, A. F. Calcitonin gene-related peptide (CGRP): a new target for migraine. Annual Review of Pharmacology and Toxicology. 55, 533-552 (2015).
- Sowers, L. P., et al. Stimulation of Posterior Thalamic Nuclei Induces Photophobic Behavior in Mice. Headache. 60 (9), 1961-1981 (2020).
- Afridi, S. K., et al. A positron emission tomographic study in spontaneous migraine. Archives of Neurology. 62 (8), 1270-1275 (2005).
- Mason, B. N., et al. Vascular actions of peripheral CGRP in migraine-like photophobia in mice. Cephalalgia. 40 (14), 1585-1604 (2020).
- Guo, S., Vollesen, A. L. H., Olesen, J., Ashina, M. Premonitory and nonheadache symptoms induced by CGRP and PACAP38 in patients with migraine. Pain. 157 (12), 2773-2781 (2016).
- Christensen, C. E., et al. Migraine induction with calcitonin gene-related peptide in patients from erenumab trials. Journal of Headache and Pain. 19 (1), 105(2018).
- Younis, S., et al. Investigation of distinct molecular pathways in migraine induction using calcitonin gene-related peptide and sildenafil. Cephalalgia. 39 (14), 1776-1788 (2019).
- Asghar, M. S., et al. Evidence for a vascular factor in migraine. Annals of Neurology. 69 (4), 635-645 (2011).
- Ueno, H., et al. Effects of repetitive gentle handling of male C57BL/6NCrl mice on comparative behavioural test results. Scientific Reports. 10 (1), 3509(2020).
- Campos, A. C., Fogaca, M. V., Aguiar, D. C., Guimaraes, F. S. Animal models of anxiety disorders and stress. Revista Brasileira De Psiquiatria. 35, 101-111 (2013).
- Kuburas, A., Thompson, S., Artemyev, N. O., Kardon, R. H., Russo, A. F. Photophobia and abnormally sustained pupil responses in a mouse model of bradyopsia. Investigative Ophthalmology and Visual Science. 55 (10), 6878-6885 (2014).
- Goadsby, P. J., Edvinsson, L., Ekman, R. Vasoactive peptide release in the extracerebral circulation of humans during migraine headache. Annals of Neurology. 28 (2), 183-187 (1990).
- Lassen, L. H., et al. CGRP may play a causative role in migraine. Cephalalgia. 22 (1), 54-61 (2002).
- Cernuda-Morollon, E., et al. Interictal increase of CGRP levels in peripheral blood as a biomarker for chronic migraine. Neurology. 81 (14), 1191-1196 (2013).
- Chanda, M. L., et al. Behavioral evidence for photophobia and stress-related ipsilateral head pain in transgenic Cacna1a mutant mice. Pain. 154 (8), 1254-1262 (2013).
- Mahmoudi, J., et al. Cerebrolysin attenuates hyperalgesia, photophobia, and neuroinflammation in a nitroglycerin-induced migraine model in rats. Brain Research Bulletin. 140, 197-204 (2018).
- Farajdokht, F., Babri, S., Karimi, P., Mohaddes, G. Ghrelin attenuates hyperalgesia and light aversion-induced by nitroglycerin in male rats. Neuroscience Letters. 630, 30-37 (2016).
- Jacob, W., et al. Endocannabinoids render exploratory behaviour largely independent of the test aversiveness: Role of glutamatergic transmission. Genes, Brain, and Behavior. 8 (7), 685-698 (2009).
- Thiels, E., Hoffman, E. K., Gorin, M. B. A reliable behavioral assay for the assessment of sustained photophobia in mice. Current Eye Research. 33 (5), 483-491 (2008).
- Ramachandran, R., et al. Role of Toll-like receptor 4 signaling in mast cell-mediated migraine pain pathway. Molecular Pain. 15, 1744806919867842(2019).
- Marek, V., et al. Implication of Melanopsin and Trigeminal Neural Pathways in Blue Light Photosensitivity in vivo. Frontiers in Neuroscience. 13, 497(2019).
- Christensen, S. L. T., Petersen, S., Sorensen, D. B., Olesena, J., Jansen-Olesen, I. Infusion of low dose glyceryl trinitrate has no consistent effect on burrowing behavior, running wheel activity and light sensitivity in female rats. Journal of Pharmacological and Toxicological Methods. 80, 43-50 (2016).
- De Vera Mudry, M. C., Kronenberg, S., Komatsu, S., Aguirre, G. D. Blinded by the light: retinal phototoxicity in the context of safety studies. Toxicologic Pathology. 41 (6), 813-825 (2013).
- White, D. A., Fritz, J. J., Hauswirth, W. W., Kaushal, S., Lewin, A. S. Increased sensitivity to light-induced damage in a mouse model of autosomal dominant retinal disease. Investigative Ophthalmology and Visual Science. 48 (5), 1942-1951 (2007).
- Song, D., et al. Retinal pre-conditioning by CD59a knockout protects against light-induced photoreceptor degeneration. PloS One. 11 (11), 0166348(2016).
- Matynia, A., et al. Light aversion and corneal mechanical sensitivity are altered by intrinscally photosensitive retinal ganglion cells in a mouse model of corneal surface damage. Experimental Eye Research. 137, 57-62 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados