Method Article
Вопросы сбора, обработки и хранения для исследования биомаркеров мочи
В этой статье
Резюме
Этот протокол направлен на то, чтобы предоставить рекомендации по сбору, обработке и хранению образцов мочи для исследований биомаркеров инфекций мочевыводящих путей.
Аннотация
Существует несколько белков мочевого пузыря, которые являются многообещающими в качестве новых маркеров инфекций мочевыводящих путей. Идентификация нового биомаркера, который имеет большую прогностическую точность по сравнению с существующими методами диагностики, может значительно улучшить способность пациентов с инфекциями мочевыводящих путей. Тем не менее, сбор, обработка и хранение образцов могут потенциально повлиять на результаты исследований биомаркеров. Понимание влияния каждого из этих этапов на исследования биомаркеров необходимо для информирования будущих высококачественных исследований в этой области, а также для критического обзора других исследований в этой области. В этом исследовании представлен обзор литературы о влиянии каждого этапа обработки образцов мочи и сообщается о влиянии различных состояний на белки мочи. Протокол будет сосредоточен на методах сбора, времени и температуре хранения, методах обработки, использовании реагентов и долгосрочном замораживании стабильности биомаркеров. Основное внимание будет уделено белкам, но кратко обсудят другие материалы, которые могут быть использованы в исследованиях биомаркеров. При этом этот протокол предоставит руководство для будущих исследователей, которое поможет в планировании исследований биомаркеров мочевого пузыря.
Введение
Инфекции мочевыводящих путей (ИМП) являются одной из наиболее распространенных бактериальных инфекций как у детей, так и у взрослых1. В то время как диагностика ИМП в некоторых популяциях может быть несложной, она может быть более сложной в других, например, у пациентов с нейропатическим мочевым пузырем2. Возможность точной диагностики ИМП поможет улучшить усилия по контролю антибиотиков за счет сокращения использования ненужных антибиотиков и потенциально поможет в ранней диагностике ИМП, тем самым снижая риск заболеваемости. Учитывая распространенность ИМП, существует значительный интерес к улучшению ведения этой распространенной инфекции.
В литературе появляется все больше новых биомаркеров, которые демонстрируют многообещающую способность диагностировать ИМП 3,4,5,6,7. Тем не менее, существует несколько факторов, связанных с обработкой образцов мочи, которые могут изменить результаты. Эти факторы варьируются от методов сбора, температуры и продолжительности краткосрочного и долгосрочного хранения, методов обработки, использования реагентов и циклов замораживания-размораживания8. Понимание того, как изменения в каждом из них могут повлиять на показания биомаркеров, необходимо как для критической интерпретации исследований в литературе, так и для разработки высококачественных исследований, ориентированных на биомаркеры мочи.
Здесь представлен повествовательный обзор литературы о влиянии каждого фактора, включая методы сбора, краткосрочную и долгосрочную температуру и продолжительность хранения, использование реагентов и влияние циклов замораживания-размораживания, на белки, которые могут быть полезны в качестве биомаркеров мочи, и дают рекомендации по оптимальной обработке на основе этого обзора литературы. Этот протокол будет сосредоточен на белковых биомаркерах, измеренных с помощью вестерн-блоттинга или ИФА.
протокол
Этот протокол соответствует руководящим принципам комитета по этике исследований на людях учреждения. Убедитесь, что одобрение получено от институционального наблюдательного совета (IRB) до сбора и использования биологических образцов для исследований.
1. Сбор
- Возьмите образец мочи в стерильную чашку для образцов. Определите тип образца мочи, а также конкретные критерии включения и исключения на основе конкретного дизайна исследования. Для исследований ИМП используйте либо метод «чистой уловки», либо катетеризацию, чтобы избежать загрязнения промежности.
- Чтобы получить чистый образец мочи, попросите участников протереть периуретральную область салфеткой, опорожнить небольшое количество мочи в унитаз, а затем помочиться в чашку для образца.
- Проинструктируйте женщин использовать пальцы для раздвигания половых губ, а мужчин — втягивать крайнюю плоть (если применимо) перед мочеиспусканием, чтобы избежать загрязнения.
- Запишите время сбора.
- Соберите соответствующие клинические данные от каждого участника, в соответствии с индивидуальным дизайном исследования и вопросом исследования.
- Рассмотрите возможность проведения анализа мочи или мочевого щупа для каждого образца перед обработкой и хранением, если эти данные ненадежно доступны из электронной медицинской карты.
2. Обработка и хранение проб
- Немедленно обработайте образцы. Если это невозможно, храните образец при температуре 4 °C до 24 часов.
- Если образцы нельзя хранить при температуре 4 °C или необходимо хранить при 4 °C дольше 24 часов, добавьте в образцы 0,2 М борной кислоты или 10 мМNaN3 . Убедитесь, что такие реагенты совместимы с запланированными последующими применениями.
- Запишите продолжительность времени, в течение которого образцы проводят при температуре 4 °C.
- Центрифугируйте образцы при давлении 1000-1500 x g в течение 10-20 минут. Центрифугирование не обязательно должно осуществляться при температуре 4 °C.
- Соберите надосадочную жидкость и распределите ее по отдельным микроцентрифужным пробиркам.
- Наклейте на пробирки несколько четких идентификаторов (например, дату и идентификацию образца (ID)). Рассмотрите возможность использования сгенерированных компьютером штрихкодов, специально разработанных для хранения биологических образцов при температуре -80 °C. Если это невозможно, убедитесь, что ручка, используемая для маркировки образцов, является водостойкой.
- Пометьте каждую морозильную камеру так, чтобы у каждого места был определенный код. Для этого пронумеруйте каждый столбец отдельной буквой, а каждую строку — номером. Это позволит создавать карты или другие руководства для удобного определения местоположения образцов.
- Немедленно заморозьте образцы при температуре -80 °C. Запишите время заморозки.
- Разморозьте образцы на водяной бане при температуре 37 °C в день измерения, чтобы свести к минимуму ненужное хранение при комнатной температуре или 4 °C.
- Запишите время и количество дополнительных циклов замораживания-оттаивания для каждой аликвоты.
3. Анализ
- При использовании имеющихся в продаже ИФА следует следовать инструкциям производителя.
- Запустите образцы в двух экземплярах.
- Определите ожидаемую концентрацию интересующего белка, чтобы убедиться, что уровни белка в образцах находятся в пределах диапазона, указанного в наборе. Если ожидаемый уровень белка превышает верхнюю норму, разведите пробы.
- После того, как будут получены данные с помощью планшетного ридера (ИФА) или вестерн-блоттинга, определите концентрацию каждого биомаркера в образце вручную (не рекомендуется) или с помощью любого программного обеспечения.
- Проанализируйте результаты. Анализ данных зависит от индивидуального дизайна исследования.
- Рассмотрите возможность корректировки значений биомаркеров с учетом концентрации мочи.
Примечание: Традиционно, исследователи биомаркеров использовали креатинин мочи в качестве метода нормализации, особенно у участников с нормальной функцией почек, чтобы учесть концентрацию мочи. Тем не менее, другие сообщают, что нормализация не влияет на результаты4. Чтобы преодолеть это препятствие, некоторые исследователи сообщают как о нормализованных, так и о ненормализованных результатах. - Рекомендуется указывать в опубликованных рукописях диапазоны времени от сбора до замораживания, а также продолжительность времени при температуре 4 °C перед обработкой, чтобы можно было интерпретировать результаты в контексте обработки образцов (рис. 1)
4. Влияние различных условий хранения на нейтрофильный желатиназа-ассоциированный липокалин (NGAL).
- Добавьте в свежую мочу 2 нг/мл рекомбинантного NGAL.
- Аликвотируйте мочу и подвергайте ее различным условиям обработки и хранения.
- Центрифугируйте мочу при 1000-1500 х г в течение 10-20 минут. Центрифугирование не обязательно должно осуществляться при температуре 4 °C. Хранить при различных условиях (20 °C, 4 °C, -20 °C) в течение 24 часов, 48 часов или 72 часов.
- Храните аликвоту образца при температуре -80 °C для сравнения.
- После поддержания образцов в различных условиях, как указано в шаге 4.2.1, измерьте уровни NGAL в образцах с помощью имеющегося в продаже набора ELISA, который включает в себя элементы управления в соответствии с инструкциями производителя.
Результаты
Центрифугирование оказало небольшое влияние на уровень NGAL. Центрифугированные пробы, хранившиеся при температуре -80 °C, имели более низкие уровни NGAL, чем нецентрифугированные образцы (2,17 нг/мл ± 0,32 нг/мл, 2,77 нг/мл ± 0,21 нг/мл). Циклы замораживания также оказывали влияние на уровни NGAL после третьего цикла замораживания-оттаивания. (Рисунок 2). Из изученных условий (центрифугирование, циклы замораживания-оттаивания и температура хранения) наибольшее влияние на уровень NGAL оказала температура хранения. Хранение при -80 °C сразу после отбора проб было наиболее стабильным методом консервации проб. Наблюдались различия в уровнях NGAL в зависимости от других условий хранения, при этом образцы хранились при комнатной температуре (20 °C) с наибольшим изменением уровней. (Рисунок 3)
В совокупности эти результаты показывают, как измеренные уровни белка могут варьироваться в зависимости от метода обработки образца, подчеркивая не только важность последовательного и надежного протокола для воспроизводимых результатов, но и необходимость оценки анализируемых здесь параметров для отдельных биомаркеров.
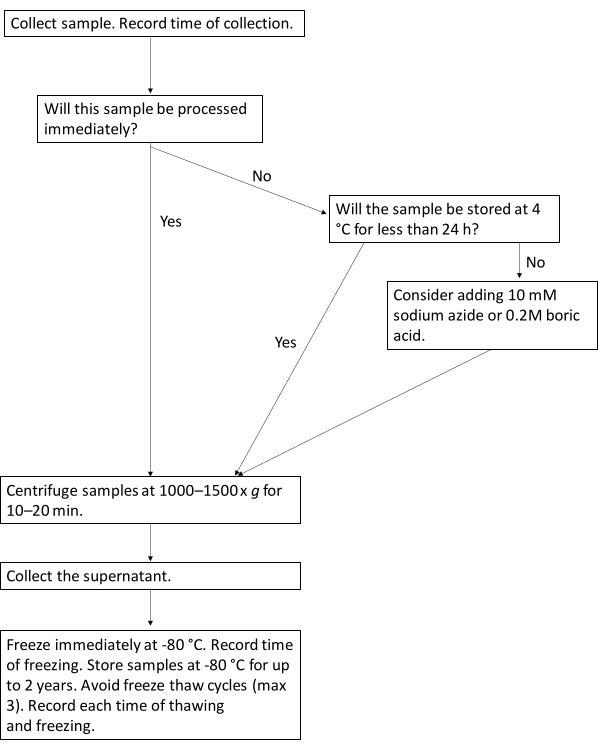
Рисунок 1: Протокольный рабочий процесс для оптимальной обработки биомаркеров мочи. Эта блок-схема иллюстрирует предлагаемый рабочий процесс обработки образцов мочи на биомаркеры мочи. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Концентрации NGAL в моче в образцах, подвергнутых циклам замораживания-оттаивания. Концентрация NGAL в моче снижается после третьего цикла замораживания-оттаивания. Полосы погрешностей представляют собой стандартное отклонение. Всего было проанализировано 8 образцов, выполненных в двух экземплярах для всех 4 условий цикла замораживания-оттаивания. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Концентрации NGAL в моче при различных условиях хранения. Образцы мочи, содержащие рекомбинантный NGAL, хранили при температуре 20 °C, 4 °C, -20 °C в течение 24 ч, 48 ч или 72 ч. Образцы также были немедленно заморожены при температуре -80 °C для сравнения. Концентрации NGAL в моче имеют небольшую степень вариации в зависимости от температуры замерзания и продолжительности. Полосы погрешностей представляют собой стандартное отклонение. Всего было проанализировано 20 образцов, выполненных в двух экземплярах для всех 10 временных и температурных режимов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Важность получения последовательных и воспроизводимых результатов не ограничивается успехом отдельных исследований, но также позволяет лучше сравнивать результаты в рамках литературы9. Различия между исследованиями по ключевым процедурным этапам могут привести к необратимой систематической ошибке, которая может повлиять на сигналы биомаркеров и их интерпретацию, что может быть причиной расхождений междунесколькими исследованиями. Это демонстрирует необходимость создания более стандартизированного подхода к обработке образцов мочи для исследований биомаркеров.
Дизайн большинства исследований биомаркеров мочи будет диктовать время и метод сбора мочи. Однако при измерении биомаркеров нечувствительным ко времени методом мы рекомендуем избегать первого утреннего образца. В то время как образцы мочи, взятые в первое утро, считаются наиболее информативными из-за их концентрированной природы, эти образцы не идеальны для измерения биомаркеров мочи, поскольку они восприимчивы к бактериальному и эпителиальному бактериальному загрязнению. Это особенно верно в отношении образцов женской мочи: сравнение женской первой мочи с образцами в середине потока демонстрирует значительно различающиеся пропорции белков11. Таким образом, второй утренний или случайный образец мочи в середине потока лучше подходит для изучениябелковых биомаркеров. Метод сбора мочи также обычно продиктован дизайном исследования. Мы рекомендуем использовать либо чистую мочу, либо катетеризированные образцы. Остаточная моча, первоначально собранная для рутинных клинических целей, часто используется в исследованиях ИМП и является общепринятым методом сбора образцов. Однако, в то время как чистый защелка является простой процедурой, катетеризация уретры является инвазивной. Катетеризированный забор мочи должен выполняться только теми, кто прошел соответствующую подготовку и проводится с одобрения местного IRB. Мы рекомендуем сотрудничать с клиницистами, прошедшими соответствующую подготовку, для получения катетеризированных образцов мочи или использования остаточной мочи, первоначально собранной для оказания рутинной клинической помощи.
Образцы должны быть обработаны сразу, чтобы сохранить целостность любых маркеров, представляющих интерес. Однако часто это не представляется возможным; Поэтому возникает необходимость изучить влияние условий хранения, включая продолжительность и температуру, на стабильность образца. В целом, хранение при комнатной температуре должно быть сведено к минимуму, поскольку хорошо известно, что длительное хранение образцов при комнатной температуре для биомаркеров, таких как NGAL, может привести к деградации13. В то время как некоторые исследования показали, что 24 часа хранения при комнатной температуре (25 °C) оказывают минимальное влияние на концентрацию биомаркеров, включая NGAL и KIM-114,15, другие определили, что значительная деградация действительно начинает происходить в течение этого периода времени. Было обнаружено, что биомаркер мочи IL-18 особенно чувствителен к кратковременному хранению при температуре 25 °C14,15. По возможности образцы следует хранить в кратковременном режиме при температуре 4 °C. При 4 °C NGAL и KIM-1, IL-18, L-FABP и цистатин С демонстрируют высокую стабильность в течение 24 ч8 и до 48 ч15. Однако через 48 ч при 4 °C KIM-1 начинает значительно деградировать16. Наконец, если кратковременное хранение образцов при комнатной температуре превышает 8 ч или если хранение при 4 °C превышает 16 ч, азид натрия или борная кислота следует рассматривать в качестве консерванта для подавления чрезмерного роста бактерий и контаминации.
Продолжительность длительного хранения является еще одним важным фактором. Хранение образцов при температуре -80 °C приводит к значительно улучшенной стабильности белков мочи по сравнению с хранением при температуре -20 °C, что приводит к значительной вариабельности деградации белков, таких как NGAL14,13. При температуре -80 °C образцы могут надежно храниться не менее 6 месяцев16 и до 2 лет10. Одно исследование показало, что уровень белка имел небольшое, но значительное снижение через 5 лет при -80 °C8, что позволяет предположить, что образцы следует анализировать до 5 лет. При длительном хранении образцов циклы замораживания-размораживания должны быть сведены к минимуму до трех и менее10,11. Было обнаружено, что превышение трех циклов замораживания-оттаивания приводит к изменению образца мочи17, что также подтверждается представленными здесь данными. Следует отметить, что для биомаркеров, не имеющих документально подтвержденной стабильности в литературе, мы рекомендуем исследователям рассмотреть возможность проведения пилотного исследования стабильности перед планированием хранения образцов при любой температуре, отличной от -80 °C.
Существует отсутствие консенсуса по поводу использования реагентов для стабильности белка. Ингибиторы протеазы не требуются для образцов мочи при относительном недостатке протеаз в моче. Это подтверждается данными, демонстрирующими отсутствие различий в типах или количествах белков между образцами мочи, хранящимися как с ингибиторами протеазы, так и без них. 18 Кроме того, добавление ингибитора протеазы не приводило к изменению уровня NGAL, KIM-1 или NAG10 в моче. Хотя в некоторых исследованиях использовались ингибиторы протеазы, их использование не стандартизировано в более широкой литературе по биомаркерам мочи. К другим реагентам относятся реагенты для предотвращения избыточного бактериального роста, такие как азид натрия и борная кислота. Несмотря на то, что они традиционно не используются в литературе по биомаркерам ИМП, их следует рассматривать на основе механизма биомаркера, представляющего интерес. Для биомаркеров, уровни которых связаны со степенью бактериурии, использование этих реагентов может быть предпочтительным. Другая ситуация, в которой эти реагенты могут быть рассмотрены, - это когда моча не может храниться при температуре 4°С менее 24 ч или должна храниться при комнатной температуре в течение длительного периода времени до обработки. Хотя это обычно не используется в литературе по биомаркерам ИМП, если чрезмерный рост бактерий вызывает беспокойство и оптимальные условия хранения невозможны, в образцы можно добавить азид натрия или борную кислоту. 19
Центрифугирование является важным этапом для минимизации загрязнения образца мочи белками других клеток (например, эритроцитами, лейкоцитами, эпителиальными клетками). После сбора проб пробы следует центрифугировать или быстро отфильтровать. В литературе высказывается предположение, что клетки в моче могут начать лизироваться в течение 20-30 минут после сбора образца, что может привести к искажению измерения белка12. Несмотря на то, что быстрое центрифугирование часто невозможно, исследователи должны признать потенциал альтернативных источников белков в моче. Учитывая, что пиурия часто встречается при ИМП, это важное соображение для исследователей, сосредоточенных на биомаркерах мочи при ИМП. Образцы не следует замораживать до центрифугирования. Действительно, замораживание образца, даже при предварительном центрифугировании, может привести к образованию осадка, состоящего в основном из дегидрата оксалата кальция и аморфных кристаллов кальция при размораживании. В образцах, замороженных при температуре -20 °C в течение ночи, Saetun et al. продемонстрировали, что эти осадки могут вызывать связанное с этим снижение уровня белка в моче20. Еще одно соображение, поддерживающее рекомендацию не замораживать нецентрифугированную мочу, заключается в том, что потенциальный лизис клеток в нецентрифугированном образце может еще больше исказить результаты.
После центрифугирования следующим этапом является аликвотирование образцов. Соответствующее количество аликвот мочи, подлежащей замораживанию, зависит от индивидуального дизайна исследования. Аликвотирование в несколько пробирок позволяет свести к минимуму циклы замораживания-оттаивания на более позднем этапе. Объем аликвот зависит от предполагаемых последующих применений. Для большинства ИФА или вестерн-блоттинга используется небольшое количество мочи, и поэтому для каждой аликвоты обычно достаточно минимум 0,5 мл. Тем не менее, для непредвзятых методологий, таких как масс-спектрометрия, необходимы гораздо большие объемы мочи. Мы рекомендуем определить минимальное количество мочи, необходимое для запланированных экспериментов, чтобы обеспечить достаточные объемы.
В этом протоколе были опущены конкретные детали, связанные с измерением конкретных биомаркеров мочи, поскольку это сильно зависит от индивидуального дизайна исследования. Тем не менее, большинство из этих биомаркеров можно измерить с помощью ИФА. Первый общий этап ИФА включает покрытие 96-луночного планшета антителом. Многие наборы поставляются с уже выполненным этим шагом, но другие требуют, чтобы исследователи выполнили этот шаг. После покрытия планшета антителами следующим шагом является добавление стандартов, образцов и контрольных материалов. Большинство наборов будут содержать стандарты для использования в ИФА. Важно следовать инструкциям набора по подготовке стандартов, чтобы обеспечить создание правильной стандартной кривой. Рекомендуется использовать отрицательный контроль. Следующим шагом является добавление антитела для обнаружения с последующим добавлением фермента конъюгата. Последним шагом является добавление субстрата, за которым часто следует стоп-буфер. На этом этапе ИФА готов к считыванию с помощью 96-луночного планшетного ридера. Следуйте инструкциям производителя о том, как правильно настроить считыватель пластин для рассматриваемого ИФА. Это особенно актуально при интерпретации конечных результатов. Важно отметить соответствующее распределение ожидаемой стандартной кривой из инструкции производителя, так как это повлияет как на подгонку кривой, так и на точность результатов. Обратите внимание на R2 стандартной кривой. Это означает, насколько хорошо кривая соответствует стандартам. НизкийR2, ниже 0,90, указывает на неточное пипетирование, что ставит под сомнение точность результатов ИФА. Затем стандартная кривая может быть использована для определения концентрации биомаркера на основе абсорбции, полученной от планшетного считывателя.
Наш протокол аналогичен другим в литературе, посвященной белкам мочи,21 со многими опубликованными исследованиями биомаркеров мочи с использованием аналогичных протоколов 6,23,24,25,26. Исследователи варьировали этот протокол, используя ингибитор протеазы26 или фильтрацию образца мочи, а не центрифугирование, чтобы адаптировать протокол к условиям без такого оборудования 4,28. Основным ограничением для создания единого стандартного протокола является то, что различные биомаркеры имеют разные свойства, что может повлиять на соображения обработки. Кроме того, последующие приложения различаются в зависимости от дизайна исследования, что также может повлиять на обработку. Мы выделили шаги в этом протоколе, чтобы сообщить исследователям о местах, где может потребоваться рассмотрение с учетом специфики их исследовательского дизайна. Наконец, этот протокол составлен с акцентом на биомаркеры белка мочи, часто исследуемые в исследованиях ИМП. Выборки, собранные с помощью непредвзятых методологий, таких как масс-спектрометрия, могут потребовать дополнительных соображений28. Кроме того, другие новые биомаркеры, такие как РНК-маркеры, потребуют отдельного протокола для оптимальной обработки и хранения. В других документах содержатся протоколы, касающиеся рекомендаций по выборке для исследований уробиома29.
Раскрытие информации
Ни у одного из авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Никакого внешнего финансирования для этой работы получено не было. Для получения данных в данной работе использовались институциональные средства.
Материалы
| Name | Company | Catalog Number | Comments |
| Boric acid | Sigma-Aldrich | B6768 | To be considered for samples that cannot be rapidly processed and frozen |
| Freezer boxes | Fisher Scientific | 03-395-464 | |
| Microcentrifuge tubes | Thomas scientific | 1149X93 | |
| NGAL ELISA Kit | R&D Systems | DLCN20 | Used to create representative results |
| Pipette and tips | Dependent on pipette size and volume of fluid. | ||
| Sodium azide | Sigma-Aldrich | S2002 | To be considered for samples that cannot be rapidly processed and frozen |
| Urine collection cups | Thermo Scientific | 3122B03ORG | Sterile cups not required unless needed for other studies |
Ссылки
- Foxman, B. Epidemiology of urinary tract infections: Incidence, morbidity, and economic costs. American Journal of Medicine. 113, 1 SUPPL. 1 5-13 (2002).
- Forster, C. S., Pohl, H. Diagnosis of urinary tract infection in the neuropathic bladder: Changing the paradigm to include the microbiome. Topics in Spinal Cord Injury Rehabilitation. 25 (3), (2019).
- Gadalla, A. A. H., et al. Identification of clinical and urine biomarkers for uncomplicated urinary tract infection using machine learning algorithms. Scientific Reports. 9 (1), (2019).
- Shaikh, N., et al. Biomarkers that differentiate false positive urinalyses from true urinary tract infection. Pediatric Nephrology. 35 (2), 321-329 (2020).
- Renata, Y., Jassar, H., Katz, R., Hochberg, A., Nir, R. -R., Klein-Kremer, A. Urinary concentration of cytokines in children with acute pyelonephritis. European journal of Pediatrics. 172 (6), 769-774 (2013).
- Forster, C. S., Haffey, W. D., Bennett, M., Greis, K. D., Devarajan, P. Identification of urinary CD44 and Prosaposin as specific biomarkers of urinary tract infections in children with neurogenic bladders. Biomarker Insights. 14, (2019).
- Bitsori, M., et al. Urine IL-8 concentrations in infectious and non-infectious urinary tract conditions. Pediatric Nephrology. 26 (11), Berlin, Germany. 2003-2007 (2011).
- Schuh, M. P., et al. Long-term Stability of urinary biomarkers of acute kidney injury in children. American Journal of Kidney Diseases. 67 (1), 56-61 (2016).
- Hepburn, S., et al. An analysis of the impact of pre-analytical factors on the urine proteome: Sample processing time, temperature, and proteolysis. Proteomics - Clinical Applications. 9 (5-6), 507-521 (2015).
- Han, W. K., Wagener, G., Zhu, Y., Wang, S., Lee, H. T. Urinary biomarkers in the early detection of acute kidney injury after cardiac surgery. Clinical Journal of the American Society of Nephrology. 4 (5), 873-882 (2009).
- Schaub, S., et al. Urine protein profiling with surface-enhanced laser-desorption/ionization time-of-flight mass spectrometry. Kidney International. 65 (1), 323-332 (2004).
- Thongboonkerd, V. Practical points in urinary proteomics. Journal of Proteome Research. 6 (10), 3881-3890 (2007).
- Grenier, F. C., et al. Evaluation of the ARCHITECT urine NGAL assay: Assay performance, specimen handling requirements and biological variability. Clinical Biochemistry. 43 (6), 615-620 (2010).
- Liu, K. D., et al. Storage time and urine biomarker levels in the ASSESS-AKI study. PLoS ONE. 11 (10), 1-9 (2016).
- Parikh, C. R., et al. Urine stability studies for novel biomarkers of acute kidney injury. American Journal of Kidney Diseases. 63 (4), 567-572 (2014).
- Van De Vrie, M., Deegens, J. K., Van Der Vlag, J., Hilbrands, L. B. Effect of long-term storage of urine samples on measurement of kidney injury molecule 1 (KIM-1) and neutrophil gelatinase-associated lipocalin (NGAL). American Journal of Kidney Diseases. 63 (4), 573-576 (2014).
- Hubel, A., Aksan, A., Skubitz, A. P. N., Wendt, C., Zhong, X. State of the art in preservation of fluid biospecimens. Biopreservation and Biobanking. 9 (3), 237-244 (2011).
- Havanapan, P. O., Thongboonkerd, V. Are protease inhibitors required for gel-based proteomics of kidney and urine. Journal of Proteome Research. 8 (6), 3109-3117 (2009).
- Thongboonkerd, V., Saetun, P. Bacterial overgrowth affects urinary proteome analysis: Recommendation for centrifugation, temperature, duration, and the use of preservatives during sample collection. Journal of Proteome Research. 6 (11), 4173-4181 (2007).
- Saetun, P., Semangoen, T., Thongboonkerd, V. Characterizations of urinary sediments precipitated after freezing and their effects on urinary protein and chemical analyses. American Journal of Physiology - Renal Physiology. 296 (6), 1346-1354 (2009).
- Project, H. K. Standard Protocol for Urine Collection and Storage. , (2021).
- Nickolas, T. L., et al. Diagnostic and prognostic stratification in the emergency department using urinary biomarkers of nephron damage: a multicenter prospective cohort study. Journal of the American College of Cardiology. 59 (3), 246-255 (2012).
- Forster, C. S., Loechtenfeldt, A. M., Shah, S. S., Goldstein, S. Urine neutrophil gelatinase-associated lipocalin in girls with recurrent urinary tract infections. Pediatric Nephrology. , 1-8 (2020).
- Forster, C. S., et al. Predictive ability of NGAL in identifying urinary tract infection in children with neurogenic bladders. Pediatric Nephrology. 33 (8), Berlin, Germany. 1365-1374 (2018).
- Forster, C., et al. Urinary NGAL deficiency in children with recurrent urinary tract infections. Journal of Pediatric Urology. 32, 1077-1080 (2017).
- Gupta, S., Preece, J., Haynes, A., Becknell, B., Ching, C. Differentiating asymptomatic bacteriuria from urinary tract infection in the pediatric neurogenic bladder population: NGAL as a promising biomarker. Topics in Spinal Cord Injury Rehabilitation. 25 (3), 214-221 (2019).
- Shaikh, N., et al. Host and bacterial markers that differ in children with cystitis and pyelonephritis. Journal of Pediatrics. 209, 146-153 (2019).
- Harpole, M., Davis, J., Espina, V. Current state of the art for enhancing urine biomarker discovery. Expert Review of Proteomics. 13 (6), 609-626 (2016).
- Jung, C. E., et al. Benchmarking urine storage and collection conditions for evaluating the female urinary microbiome. Scientific Reports. 9 (1), 13409(2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены
Мы используем файлы cookie для улучшения качества работы на нашем веб-сайте.
Продолжая пользоваться нашим веб-сайтом или нажимая кнопку «Продолжить», вы соглашаетесь принять наши файлы cookie.