Method Article
Considerazioni sulla raccolta, l'elaborazione e la conservazione per la ricerca sui biomarcatori urinari
In questo articolo
Riepilogo
Questo protocollo mira a fornire considerazioni per la raccolta, l'elaborazione e la conservazione dei campioni di urina per gli studi sui biomarcatori di infezione del tratto urinario.
Abstract
Ci sono diverse proteine urinarie che si mostrano promettenti come nuovi marcatori di infezioni del tratto urinario. L'identificazione di un nuovo biomarcatore che ha una maggiore accuratezza predittiva rispetto agli attuali metodi diagnostici ha il potenziale per migliorare notevolmente la capacità di gestire i pazienti con infezioni del tratto urinario. Tuttavia, la raccolta, l'elaborazione e la conservazione dei campioni possono potenzialmente influire sui risultati della ricerca sui biomarcatori. Comprendere gli effetti di ciascuna di queste fasi sugli studi sui biomarcatori è necessario per informare la ricerca futura e di alta qualità in questo settore, nonché per rivedere criticamente altri studi in questo settore. Qui, lo studio esamina la letteratura relativa agli effetti di ciascuna fase dell'elaborazione del campione di urina e riporta gli effetti di varie condizioni sulle proteine urinarie. Il protocollo si concentrerà sulle tecniche di raccolta, sul tempo e sulla temperatura di conservazione, sulle tecniche di lavorazione, sull'uso dei reagenti e sul congelamento a lungo termine sulla stabilità dei biomarcatori. Si concentrerà sulle proteine, ma discuterà brevemente altri materiali che possono essere utilizzati nella ricerca sui biomarcatori. In tal modo, questo protocollo fornirà una guida ai futuri ricercatori per assistere nella progettazione di studi sui biomarcatori urinari.
Introduzione
Le infezioni del tratto urinario (UTI) sono una delle infezioni batteriche più comuni sia nei bambini che negli adulti1. Mentre la diagnosi di infezione delle vie urinarie in alcune popolazioni può essere semplice, può essere più complessa in altre, come quelle con vescica neuropatica2. La capacità di diagnosticare con precisione le infezioni delle vie urinarie contribuirà a migliorare gli sforzi di gestione degli antibiotici diminuendo l'uso di antibiotici non necessari e potenzialmente aiuterà nella diagnosi precoce delle infezioni delle vie urinarie, diminuendo così il rischio di morbilità. Data la prevalenza delle infezioni delle vie urinarie, vi è un notevole interesse a migliorare la gestione di questa comune infezione.
C'è un numero crescente di nuovi biomarcatori all'interno della letteratura che mostrano risultati promettenti nella loro capacità di diagnosticare UTI 3,4,5,6,7. Tuttavia, ci sono diversi fattori associati all'elaborazione dei campioni di urina che hanno il potenziale per alterare i risultati. Questi fattori vanno dai metodi di raccolta, alla temperatura e alla durata della conservazione a breve e lungo termine, alle tecniche di lavorazione, all'uso dei reagenti e ai cicli di congelamento-scongelamento8. Comprendere in che modo i cambiamenti in ciascuno di questi possono influenzare le letture dei biomarcatori è necessario sia per interpretare criticamente la ricerca all'interno della letteratura, sia per progettare studi di alta qualità incentrati sui biomarcatori delle urine.
Qui, viene fornita una revisione narrativa della letteratura sugli effetti di ciascun fattore, comprese le tecniche di raccolta, la temperatura e la durata di conservazione a breve e lungo termine, l'uso di reagenti e l'effetto dei cicli di congelamento-scongelamento, sulle proteine che possono avere utilità come biomarcatori urinari e fornisce raccomandazioni per un'elaborazione ottimale sulla base di questa revisione della letteratura. Questo protocollo si concentrerà sui biomarcatori proteici misurati utilizzando western blot o ELISA.
Protocollo
Questo protocollo segue le linee guida del comitato etico per la ricerca umana dell'istituto. Assicurarsi che l'approvazione sia ottenuta dal comitato di revisione istituzionale (IRB) prima della raccolta e dell'utilizzo di campioni biologici per la ricerca.
1. Raccolta
- Ottenere il campione di urina in una tazza per campioni sterile. Decidere il tipo di campione di urina, nonché i criteri specifici di inclusione ed esclusione, in base allo specifico disegno dello studio. Per gli studi sulle infezioni delle vie urinarie, utilizzare il metodo clean-catch o il cateterismo per evitare la contaminazione perineale.
- Per ottenere un campione di urina pulito, istruire i partecipanti a pulire l'area periuretrale con un asciugamano, svuotare una piccola quantità nella toilette e quindi urinare nella tazza del campione.
- Istruisci le donne a usare le dita per allargare le labbra e agli uomini a ritrarre il prepuzio (se applicabile) prima della minzione per evitare la contaminazione.
- Registrare l'orario di raccolta.
- Raccogliere i dati clinici pertinenti da ciascun partecipante, come richiesto dal disegno dello studio individuale e dalla domanda di ricerca.
- Prendere in considerazione l'esecuzione di un'analisi delle urine o di un'astina di livello delle urine su ciascun campione prima dell'elaborazione e della conservazione se questi dati non sono disponibili in modo affidabile dalla cartella clinica elettronica.
2. Elaborazione e conservazione dei campioni
- Elaborare immediatamente i campioni. Se ciò non è possibile, conservare il campione a 4 °C per un massimo di 24 ore.
- Se i campioni non possono essere conservati a 4 °C o devono essere conservati a 4 °C per più di 24 ore, aggiungere ai campioni 0,2 M di acido borico o 10 mM di NaN3 . Verificare che tali reagenti siano compatibili con le applicazioni a valle pianificate.
- Registrare la durata del tempo di permanenza dei campioni a 4 °C.
- Centrifugare i campioni a 1000-1500 x g per 10-20 minuti. La centrifugazione non deve essere necessariamente a 4 °C.
- Raccogliere il surnatante e aliquotarlo in provette da microcentrifuga separate.
- Etichettare le provette con più identificatori chiari (come la data e l'identificazione del campione (ID)). Prendere in considerazione l'utilizzo di codici a barre generati al computer appositamente progettati per la conservazione di campioni biologici a -80 °C. Se non disponibile, assicurarsi che la penna utilizzata per etichettare i campioni sia resistente all'acqua.
- Etichettare ogni scatola del congelatore in modo che ogni posizione abbia un codice specifico. Per questo, numera ogni colonna con una lettera diversa e ogni riga con un numero. Ciò consentirà la creazione di mappe o altre guide per una facile localizzazione dei campioni.
- Congelare immediatamente i campioni a -80 °C. Registra il tempo di congelamento.
- Scongelare i campioni in un bagno d'acqua a 37 °C il giorno della misurazione per ridurre al minimo la conservazione non necessaria a temperatura ambiente o a 4 °C.
- Registrare i tempi e il numero di cicli di congelamento-disgelo aggiuntivi per ogni aliquota.
3. Analisi
- Quando si utilizzano ELISA disponibili in commercio, seguire le istruzioni del produttore.
- Eseguire gli esempi in duplicato.
- Identificare la concentrazione prevista della proteina di interesse per garantire che i livelli proteici nei campioni rientrino nell'intervallo del kit. Se il livello previsto di proteine supera lo standard superiore, diluire i campioni.
- Dopo aver ottenuto i dati dal lettore di piastre (ELISA) o dal western blot, determinare la concentrazione di ciascun biomarcatore nel campione manualmente (non consigliato) o utilizzando qualsiasi software.
- Analizza i risultati. L'analisi dei dati dipende dal disegno dello studio individuale.
- Prendere in considerazione la possibilità di regolare i valori dei biomarcatori per tenere conto della concentrazione nelle urine.
NOTA: Tradizionalmente, i ricercatori di biomarcatori hanno utilizzato la creatinina urinaria come metodo di normalizzazione, specialmente nei partecipanti con funzionalità renale normale, per tenere conto della concentrazione urinaria. Tuttavia, altri riferiscono che la normalizzazione non fa la differenza nei risultati4. Per superare questo ostacolo, alcuni ricercatori riportano risultati sia normalizzati che non normalizzati. - Raccomandare di riportare intervalli di tempo che vanno dalla raccolta al congelamento, nonché la durata del tempo a 4 °C prima dell'elaborazione nei manoscritti pubblicati per consentire l'interpretazione dei risultati nel contesto dell'elaborazione del campione (Figura 1)
4. Effetto di varie condizioni di conservazione sulla lipocalina associata alla gelatinasi neutrofila (NGAL).
- Aumentare l'urina fresca con 2 ng/mL di NGAL ricombinante.
- Aliquotare l'urina e sottoporla a diverse condizioni di lavorazione e conservazione.
- Centrifugare l'urina a 1000-1500 x g per 10-20 minuti. La centrifugazione non deve essere necessariamente a 4 °C. Conservare in condizioni diverse (20 °C, 4 °C, -20 °C) per 24 ore, 48 ore o 72 ore.
- Conservare l'aliquota del campione a -80 °C per il confronto.
- Dopo aver mantenuto i campioni nelle diverse condizioni di cui al punto 4.2.1, misurare i livelli di NGAL nei campioni utilizzando un kit ELISA disponibile in commercio che include i controlli secondo le istruzioni del produttore.
Risultati
La centrifugazione ha avuto un piccolo impatto sui livelli di NGAL. I campioni centrifugati conservati a -80 °C avevano livelli inferiori di NGAL rispetto ai campioni non centrifugati (2,17 ng/mL ± 0,32 ng/mL, 2,77 ng/mL ± 0,21 ng/mL). I cicli di congelamento hanno avuto un impatto anche sui livelli di NGAL dopo il terzo ciclo di congelamento-disgelo. (Figura 2). Tra le condizioni studiate (centrifugazione, cicli di gelo-disgelo e temperatura di stoccaggio), la temperatura di stoccaggio ha avuto il maggiore impatto sui livelli di NGAL. La conservazione a -80 °C subito dopo la raccolta del campione era il metodo più stabile di conservazione del campione. È stata osservata una variazione dei livelli di NGAL con ciascuna delle altre condizioni di conservazione, con i campioni conservati a temperatura ambiente (20 °C) con la maggiore variazione dei livelli. (Figura 3)
Nel loro insieme, questi risultati indicano come i livelli di proteine misurati possano variare in base al metodo di elaborazione del campione, sottolineando non solo l'importanza di un protocollo coerente e affidabile per risultati riproducibili, ma anche la necessità di valutare i parametri analizzati qui per i singoli biomarcatori.
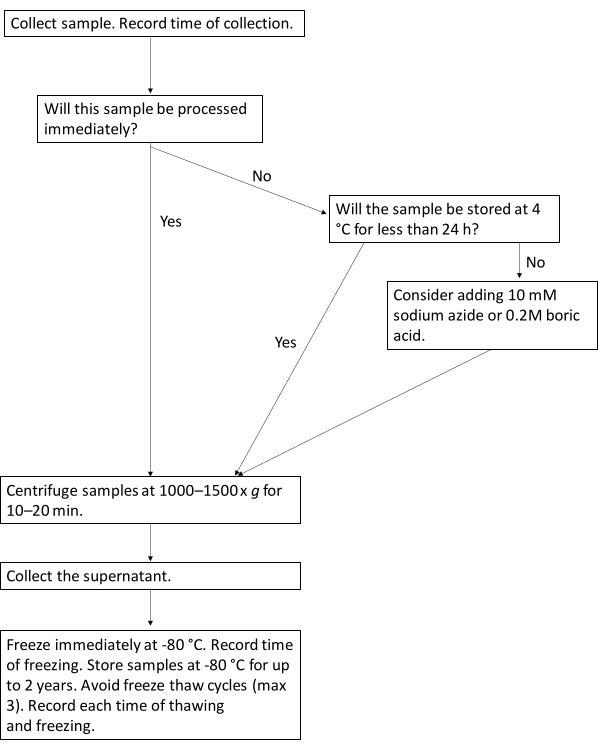
Figura 1: Flusso di lavoro del protocollo per l'elaborazione ottimale dei biomarcatori urinari. Questo diagramma di flusso illustra il flusso di lavoro suggerito per l'elaborazione di campioni di urina per i biomarcatori delle urine. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Concentrazioni di NGAL nelle urine in campioni sottoposti a cicli di congelamento-scongelamento. Le concentrazioni di NGAL nelle urine diminuiscono dopo il terzo ciclo di gelo-scongelamento. Le barre di errore rappresentano la deviazione standard. Sono stati analizzati un totale di 8 campioni, eseguiti in duplicato per tutte e 4 le condizioni del ciclo di gelo-disgelo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Concentrazioni di NGAL nelle urine in varie condizioni di conservazione. I campioni di urina addizionati con NGAL ricombinante sono stati conservati a 20 °C, 4 °C, -20 °C per 24 ore, 48 ore o 72 ore. I campioni sono stati inoltre immediatamente congelati a -80 °C per il confronto. Le concentrazioni di NGAL nelle urine hanno un piccolo grado di variazione in base alla temperatura di congelamento e alla durata. Le barre di errore rappresentano la deviazione standard. Sono stati analizzati un totale di 20 campioni, eseguiti in duplicato per tutte le 10 condizioni di tempo e temperatura. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
L'importanza di produrre risultati coerenti e riproducibili non si limita al successo dei singoli studi, ma consentirà anche un migliore confronto dei risultati all'interno della letteratura9. La variazione tra gli studi nelle fasi procedurali chiave può introdurre distorsioni irreversibili che possono influenzare i segnali dei biomarcatori e la loro interpretazione, che possono essere responsabili di discrepanze tra diversi studi10. Ciò dimostra la necessità di stabilire un approccio più standardizzato all'elaborazione dei campioni di urina per gli studi sui biomarcatori.
Il disegno della maggior parte degli studi sui biomarcatori urinari determinerà il tempo e il metodo di raccolta delle urine. Tuttavia, quando si misurano i biomarcatori con un metodo non sensibile al tempo, si consiglia di evitare un campione del primo mattino. Sebbene si ritenga che i campioni di urina del primo mattino forniscano il profilo urinario più ricco di informazioni a causa della loro natura concentrata, questi campioni non sono ideali per misurare i biomarcatori urinari in quanto sono suscettibili alla contaminazione batterica e delle cellule epiteliali. Questo è particolarmente vero per i campioni di urina femminile: il confronto tra le urine femminili del primo vuoto e i campioni del flusso intermedio dimostra proporzioni significativamente diverse di proteine11. Pertanto, un secondo campione di urina mattutino o casuale a metà flusso è più adatto per lo studio dei biomarcatori proteici12. Anche il metodo di raccolta delle urine è solitamente dettato dal disegno dello studio. Si consiglia l'uso di urine pulite o di campioni cateterizzati. L'urina residua inizialmente raccolta per scopi clinici di routine viene spesso utilizzata negli studi sulle infezioni delle vie urinarie ed è un metodo accettato di raccolta dei campioni. Tuttavia, mentre il clean catch è una procedura semplice, il cateterismo uretrale è invasivo. La raccolta delle urine cateterizzata deve essere eseguita solo da coloro che sono stati adeguatamente addestrati a farlo e fatti con l'approvazione dell'IRB locale. Si consiglia di collaborare con medici con una formazione adeguata per ottenere campioni di urina cateterizzati o l'utilizzo dell'urina residua inizialmente raccolta per le cure cliniche di routine.
I campioni devono essere elaborati immediatamente per preservare l'integrità di eventuali marcatori di interesse. Tuttavia, questo spesso non è possibile; Pertanto, diventa necessario esaminare l'effetto delle condizioni di conservazione, compresa la durata e la temperatura, sulla stabilità del campione. In generale, la conservazione a temperatura ambiente dovrebbe essere ridotta al minimo, poiché è stato ben fondato che la conservazione prolungata del campione a temperatura ambiente per biomarcatori come NGAL può provocare degradazione13. Mentre alcuni studi hanno rilevato che 24 ore di conservazione a temperatura ambiente (25 °C) hanno un impatto minimo sulla concentrazione di biomarcatori, tra cui NGAL e KIM-114,15, altri hanno determinato che una degradazione significativa inizia effettivamente a verificarsi entroquesto lasso di tempo. È stato riscontrato che il biomarcatore urinario IL-18 è particolarmente sensibile alla conservazione a breve termine a 25 °C14,15. Quando possibile, i campioni dovrebbero invece essere conservati a breve termine a 4 °C. A 4 °C, NGAL e KIM-1, IL-18, L-FABP e cistatina C mostrano un'elevata stabilità per 24 ore8 e fino a 48 ore15. Tuttavia, dopo 48 ore a 4 °C, KIM-1 inizia a degradarsi significativamente16. Infine, se la conservazione a breve termine di campioni a temperatura ambiente supera le 8 ore o se la conservazione a 4 °C supera le 16 ore, l'azoturo di sodio o l'acido borico devono essere considerati come conservanti per inibire la proliferazione batterica e la contaminazione12.
La durata della conservazione a lungo termine è un'altra considerazione importante. La conservazione dei campioni a -80 °C porta a una stabilità significativamente migliorata delle proteine urinarie rispetto alla conservazione a -20 °C, il che si traduce in una significativa variabilità della degradazione in proteine come NGAL14,13. A -80 °C, i campioni possono essere conservati in modo affidabile per almeno 6 mesi16 e fino a 2 anni10. Uno studio ha rilevato che i livelli di proteine hanno avuto una piccola ma significativa diminuzione dopo 5 anni a -80 °C8, suggerendo che i campioni dovrebbero essere analizzati prima di 5 anni. Durante la conservazione a lungo termine dei campioni, i cicli di congelamento-disgelo devono essere ridotti al minimo a tre o meno10,11. È stato riscontrato che il superamento di tre cicli di congelamento-disgelo altera il campione di urina17, il che è confermato anche dai dati qui presentati. Da notare che, per i biomarcatori senza stabilità documentata all'interno della letteratura, raccomandiamo ai ricercatori di prendere in considerazione l'esecuzione di uno studio pilota di stabilità prima di pianificare la conservazione dei campioni a qualsiasi temperatura diversa da -80 °C.
C'è una mancanza di consenso sull'uso di reagenti per la stabilità delle proteine. Gli inibitori della proteasi non sono necessari per i campioni di urina data una relativa mancanza di proteasi nelle urine. Ciò è supportato da dati che dimostrano l'assenza di differenze nei tipi o nelle quantità di proteine tra i campioni di urina conservati con e senza inibitori della proteasi. 18 Inoltre, l'aggiunta di un inibitore della proteasi non ha fatto la differenza nei livelli urinari di NGAL, KIM-1 o NAG10. Sebbene alcuni studi abbiano utilizzato inibitori della proteasi, il loro uso non è standardizzato in tutta la più ampia letteratura sui biomarcatori urinari. Altri reagenti includono quelli per prevenire la crescita eccessiva di batteri, come l'azide di sodio e l'acido borico. Sebbene non sia tradizionalmente utilizzato nella letteratura sui biomarcatori UTI, la considerazione dovrebbe essere presa in considerazione sulla base del meccanismo del biomarcatore di interesse. Per i biomarcatori i cui livelli sono associati al grado di batteriuria, l'uso di questi reagenti può essere preferibile. L'altra situazione in cui questi reagenti possono essere presi in considerazione è quando l'urina non può essere conservata a 4 °C per meno di 24 ore o deve essere conservata a temperatura ambiente per un periodo di tempo prolungato prima del trattamento. Sebbene non sia comunemente utilizzato nella letteratura sui biomarcatori UTI, se la crescita eccessiva dei batteri è un problema e non sono possibili condizioni di conservazione ottimali, è possibile aggiungere sodio azide o acido borico ai campioni. 19
La centrifugazione è un passaggio importante per ridurre al minimo la contaminazione del campione di urina da parte di proteine di altre cellule (ad esempio, globuli rossi, globuli bianchi, cellule epiteliali). I campioni devono essere centrifugati o filtrati rapidamente dopo la raccolta dei campioni. La letteratura suggerisce che le cellule all'interno delle urine possono iniziare a lisare entro 20-30 minuti dalla raccolta del campione, confondendo potenzialmente la misurazione della proteina12. Sebbene la centrifugazione rapida non sia spesso possibile, i ricercatori devono riconoscere il potenziale di fonti alternative di proteine urinarie. Dato che la piuria è comune nelle infezioni delle vie urinarie, questa è una considerazione importante per i ricercatori focalizzati sui biomarcatori urinari nelle infezioni delle vie urinarie. I campioni non devono essere congelati prima della centrifugazione. Infatti, il congelamento del campione, anche con una precedente centrifugazione, può provocare la formazione di un precipitato di ossalato di calcio disidratato e cristalli di calcio amorfi dopo lo scongelamento. In campioni conservati congelati a -20 °C durante la notte, Saetun et al. hanno dimostrato che questi precipitati potrebbero causare una diminuzione associata dei livelli di proteine urinarie20. Un'altra considerazione a sostegno della raccomandazione di non congelare l'urina non centrifugata è che la potenziale lisi delle cellule in un campione non centrifugato può confondere ulteriormente i risultati.
Dopo la centrifugazione, il passo successivo consiste nell'aliquotare i campioni. Il numero appropriato di aliquote di urina da congelare dipende dal disegno individuale dello studio. L'aliquotazione in più tubi consente di ridurre al minimo i cicli di gelo-disgelo in un secondo momento. Il volume delle aliquote dipende dalle applicazioni a valle previste. La maggior parte dei test ELISA o western blot utilizza una piccola quantità di urina, e quindi un minimo di 0,5 ml è solitamente sufficiente per ogni aliquota. Tuttavia, sono necessari volumi di urina molto più grandi per metodologie imparziali, come la spettrometria di massa. Si consiglia di identificare la quantità minima di urina necessaria per gli esperimenti pianificati per garantire volumi sufficienti.
In questo protocollo, sono stati omessi dettagli specifici sulla misurazione di specifici biomarcatori urinari in quanto ciò dipende fortemente dal disegno dello studio individuale. Tuttavia, la maggior parte di questi biomarcatori può essere misurata utilizzando ELISA. La prima fase generale di un ELISA include il rivestimento di una piastra a 96 pozzetti con un anticorpo. Molti kit verranno forniti con questo passaggio già completato, ma altri richiedono che i ricercatori eseguano questo passaggio. Dopo aver rivestito la piastra con anticorpi, il passaggio successivo consiste nell'aggiungere gli standard, i campioni e i controlli. La maggior parte dei kit fornirà gli standard per l'uso nell'ELISA. È importante seguire le istruzioni del kit per la preparazione dello standard per garantire la creazione della curva standard corretta. Si raccomanda l'uso del controllo negativo. Il passo successivo consiste nell'aggiungere l'anticorpo di rilevamento, seguito dall'aggiunta del coniugato enzimatico. Il passaggio finale consiste nell'aggiungere il substrato, spesso seguito da un tampone di arresto. A questo punto, l'ELISA è pronto per essere letto da un lettore di piastre a 96 pozzetti. Seguire le istruzioni del produttore su come configurare in modo appropriato il lettore di piastre per l'ELISA in questione. Ciò è particolarmente rilevante quando si interpretano i risultati finali. È importante annotare in modo appropriato la distribuzione della curva standard prevista dalle istruzioni del produttore, poiché ciò influenzerà sia l'adattamento della curva che l'accuratezza dei risultati. Notare la R2 della curva standard. Questo denota quanto bene la curva si adatta agli standard. Un R2 basso, inferiore a 0,90, suggerisce un pipettaggio impreciso, che mette in discussione l'accuratezza dei risultati dell'ELISA. La curva standard può quindi essere utilizzata per determinare la concentrazione del biomarcatore in base all'assorbanza generata dal lettore di piastre.
Il nostro protocollo è simile ad altri all'interno della letteratura che si concentra sulle proteine urinarie,21 con molti studi pubblicati su biomarcatori urinari che utilizzano protocolli simili 6,23,24,25,26. I ricercatori hanno variato questo protocollo utilizzando un inibitore della proteasi26 o filtrando il campione di urina piuttosto che la centrifugazione per adattare il protocollo alle impostazioni senza tali apparecchiature 4,28. Una delle principali limitazioni alla creazione di un unico protocollo standard è che vari biomarcatori hanno proprietà diverse, che possono influenzare le considerazioni sull'elaborazione. Inoltre, le applicazioni a valle differiscono in base al disegno dello studio, il che può anche influire sull'elaborazione. Abbiamo evidenziato i passaggi di questo protocollo per segnalare ai ricercatori i luoghi in cui potrebbe essere necessaria una considerazione in base alle specifiche del loro progetto di ricerca. Infine, questo protocollo è stato scritto con particolare attenzione ai biomarcatori proteici delle urine spesso studiati negli studi sulle infezioni delle vie urinarie. I campioni raccolti per metodologie imparziali, come la spettrometria di massa, possono richiedere ulteriori considerazioni28. Inoltre, altri nuovi biomarcatori, come i marcatori di RNA, richiederanno un protocollo distinto per l'elaborazione e la conservazione ottimali. I protocolli sono altrove per quanto riguarda le considerazioni sui campioni per gli studi sull'urobioma29.
Divulgazioni
Nessuno degli autori ha conflitti di interesse da rivelare.
Riconoscimenti
Per questo lavoro non è stato ottenuto alcun finanziamento esterno. Per ottenere i dati di questo lavoro sono stati utilizzati fondi istituzionali.
Materiali
| Name | Company | Catalog Number | Comments |
| Boric acid | Sigma-Aldrich | B6768 | To be considered for samples that cannot be rapidly processed and frozen |
| Freezer boxes | Fisher Scientific | 03-395-464 | |
| Microcentrifuge tubes | Thomas scientific | 1149X93 | |
| NGAL ELISA Kit | R&D Systems | DLCN20 | Used to create representative results |
| Pipette and tips | Dependent on pipette size and volume of fluid. | ||
| Sodium azide | Sigma-Aldrich | S2002 | To be considered for samples that cannot be rapidly processed and frozen |
| Urine collection cups | Thermo Scientific | 3122B03ORG | Sterile cups not required unless needed for other studies |
Riferimenti
- Foxman, B. Epidemiology of urinary tract infections: Incidence, morbidity, and economic costs. American Journal of Medicine. 113, 1 SUPPL. 1 5-13 (2002).
- Forster, C. S., Pohl, H. Diagnosis of urinary tract infection in the neuropathic bladder: Changing the paradigm to include the microbiome. Topics in Spinal Cord Injury Rehabilitation. 25 (3), (2019).
- Gadalla, A. A. H., et al. Identification of clinical and urine biomarkers for uncomplicated urinary tract infection using machine learning algorithms. Scientific Reports. 9 (1), (2019).
- Shaikh, N., et al. Biomarkers that differentiate false positive urinalyses from true urinary tract infection. Pediatric Nephrology. 35 (2), 321-329 (2020).
- Renata, Y., Jassar, H., Katz, R., Hochberg, A., Nir, R. -R., Klein-Kremer, A. Urinary concentration of cytokines in children with acute pyelonephritis. European journal of Pediatrics. 172 (6), 769-774 (2013).
- Forster, C. S., Haffey, W. D., Bennett, M., Greis, K. D., Devarajan, P. Identification of urinary CD44 and Prosaposin as specific biomarkers of urinary tract infections in children with neurogenic bladders. Biomarker Insights. 14, (2019).
- Bitsori, M., et al. Urine IL-8 concentrations in infectious and non-infectious urinary tract conditions. Pediatric Nephrology. 26 (11), Berlin, Germany. 2003-2007 (2011).
- Schuh, M. P., et al. Long-term Stability of urinary biomarkers of acute kidney injury in children. American Journal of Kidney Diseases. 67 (1), 56-61 (2016).
- Hepburn, S., et al. An analysis of the impact of pre-analytical factors on the urine proteome: Sample processing time, temperature, and proteolysis. Proteomics - Clinical Applications. 9 (5-6), 507-521 (2015).
- Han, W. K., Wagener, G., Zhu, Y., Wang, S., Lee, H. T. Urinary biomarkers in the early detection of acute kidney injury after cardiac surgery. Clinical Journal of the American Society of Nephrology. 4 (5), 873-882 (2009).
- Schaub, S., et al. Urine protein profiling with surface-enhanced laser-desorption/ionization time-of-flight mass spectrometry. Kidney International. 65 (1), 323-332 (2004).
- Thongboonkerd, V. Practical points in urinary proteomics. Journal of Proteome Research. 6 (10), 3881-3890 (2007).
- Grenier, F. C., et al. Evaluation of the ARCHITECT urine NGAL assay: Assay performance, specimen handling requirements and biological variability. Clinical Biochemistry. 43 (6), 615-620 (2010).
- Liu, K. D., et al. Storage time and urine biomarker levels in the ASSESS-AKI study. PLoS ONE. 11 (10), 1-9 (2016).
- Parikh, C. R., et al. Urine stability studies for novel biomarkers of acute kidney injury. American Journal of Kidney Diseases. 63 (4), 567-572 (2014).
- Van De Vrie, M., Deegens, J. K., Van Der Vlag, J., Hilbrands, L. B. Effect of long-term storage of urine samples on measurement of kidney injury molecule 1 (KIM-1) and neutrophil gelatinase-associated lipocalin (NGAL). American Journal of Kidney Diseases. 63 (4), 573-576 (2014).
- Hubel, A., Aksan, A., Skubitz, A. P. N., Wendt, C., Zhong, X. State of the art in preservation of fluid biospecimens. Biopreservation and Biobanking. 9 (3), 237-244 (2011).
- Havanapan, P. O., Thongboonkerd, V. Are protease inhibitors required for gel-based proteomics of kidney and urine. Journal of Proteome Research. 8 (6), 3109-3117 (2009).
- Thongboonkerd, V., Saetun, P. Bacterial overgrowth affects urinary proteome analysis: Recommendation for centrifugation, temperature, duration, and the use of preservatives during sample collection. Journal of Proteome Research. 6 (11), 4173-4181 (2007).
- Saetun, P., Semangoen, T., Thongboonkerd, V. Characterizations of urinary sediments precipitated after freezing and their effects on urinary protein and chemical analyses. American Journal of Physiology - Renal Physiology. 296 (6), 1346-1354 (2009).
- Project, H. K. Standard Protocol for Urine Collection and Storage. , (2021).
- Nickolas, T. L., et al. Diagnostic and prognostic stratification in the emergency department using urinary biomarkers of nephron damage: a multicenter prospective cohort study. Journal of the American College of Cardiology. 59 (3), 246-255 (2012).
- Forster, C. S., Loechtenfeldt, A. M., Shah, S. S., Goldstein, S. Urine neutrophil gelatinase-associated lipocalin in girls with recurrent urinary tract infections. Pediatric Nephrology. , 1-8 (2020).
- Forster, C. S., et al. Predictive ability of NGAL in identifying urinary tract infection in children with neurogenic bladders. Pediatric Nephrology. 33 (8), Berlin, Germany. 1365-1374 (2018).
- Forster, C., et al. Urinary NGAL deficiency in children with recurrent urinary tract infections. Journal of Pediatric Urology. 32, 1077-1080 (2017).
- Gupta, S., Preece, J., Haynes, A., Becknell, B., Ching, C. Differentiating asymptomatic bacteriuria from urinary tract infection in the pediatric neurogenic bladder population: NGAL as a promising biomarker. Topics in Spinal Cord Injury Rehabilitation. 25 (3), 214-221 (2019).
- Shaikh, N., et al. Host and bacterial markers that differ in children with cystitis and pyelonephritis. Journal of Pediatrics. 209, 146-153 (2019).
- Harpole, M., Davis, J., Espina, V. Current state of the art for enhancing urine biomarker discovery. Expert Review of Proteomics. 13 (6), 609-626 (2016).
- Jung, C. E., et al. Benchmarking urine storage and collection conditions for evaluating the female urinary microbiome. Scientific Reports. 9 (1), 13409(2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon