Method Article
שיקולי איסוף, עיבוד ואחסון למחקר סמנים ביולוגיים בשתן
In This Article
Summary
פרוטוקול זה נועד לספק שיקולים לאיסוף, עיבוד ואחסון דגימות שתן למחקרי סמנים ביולוגיים של זיהום בדרכי השתן.
Abstract
ישנם מספר חלבוני שתן המראים הבטחה כסמנים חדשים לדלקות בדרכי השתן. לזיהוי של סמן ביולוגי חדש בעל דיוק ניבוי גדול יותר בהשוואה לשיטות האבחון הנוכחיות יש פוטנציאל לשפר מאוד את היכולת לנהל חולים עם דלקות בדרכי השתן. עם זאת, איסוף דגימות, עיבוד ואחסון יכולים להשפיע על תוצאות מחקר הסמנים הביולוגיים. הבנת ההשפעות של כל אחד מהשלבים הללו על מחקרי סמנים ביולוגיים נחוצה כדי ליידע מחקר עתידי ואיכותי בתחום זה, כמו גם כדי לסקור באופן ביקורתי מחקרים אחרים בתחום זה. כאן, המחקר סוקר את הספרות לגבי ההשפעות של כל שלב בעיבוד דגימות השתן ומדווח על ההשפעות של מצבים שונים על חלבוני השתן. הפרוטוקול יתמקד בטכניקות איסוף, זמן וטמפרטורת האחסון, טכניקות עיבוד, שימוש בריאגנטים והקפאה ארוכת טווח על יציבות הסמנים הביולוגיים. הוא יתמקד בחלבונים אך ידון בקצרה בחומרים אחרים שעשויים לשמש במחקר סמנים ביולוגיים. בכך, פרוטוקול זה יספק מדריך לחוקרים עתידיים שיסייעו בתכנון מחקרי סמנים ביולוגיים בשתן.
Introduction
דלקות בדרכי השתן (UTI) הן אחד הזיהומים החיידקיים הנפוצים ביותר בקרב ילדים ומבוגריםכאחד. בעוד שהאבחנה של דלקת בדרכי השתן באוכלוסיות מסוימות יכולה להיות לא מסובכת, היא יכולה להיות מורכבת יותר אצל אחרות, כמו אלה עם שלפוחית נוירופתית2. היכולת לאבחן במדויק דלקות בדרכי השתן תסייע בשיפור מאמצי הפיקוח על האנטיביוטיקה על ידי הפחתת השימוש באנטיביוטיקה מיותרת ועשויה לסייע באבחון מוקדם יותר של דלקות בדרכי השתן, ובכך להפחית את הסיכון לתחלואה. בהתחשב בשכיחות של דלקות בדרכי השתן, יש עניין משמעותי בשיפור הטיפול בזיהום שכיח זה.
יש מספר הולך וגדל של סמנים ביולוגיים חדשים בספרות המראים הבטחה ביכולתם לאבחן דלקת בדרכי השתן 3,4,5,6,7. עם זאת, ישנם מספר גורמים הקשורים לעיבוד דגימות שתן שיש להם פוטנציאל לשנות את התוצאות. גורמים אלה נעים בין שיטות איסוף, טמפרטורה ומשך אחסון לטווח קצר וארוך, טכניקות עיבוד, שימוש בריאגנטים ומחזורי הקפאה-הפשרה8. הבנת האופן שבו שינויים בכל אחד מאלה יכולים להשפיע על קריאות סמנים ביולוגיים נחוצה הן כדי לפרש באופן ביקורתי את המחקר בספרות והן כדי לתכנן מחקרים באיכות גבוהה המתמקדים בסמנים ביולוגיים של שתן.
כאן, ניתנת סקירה נרטיבית של הספרות על ההשפעות של כל גורם, כולל טכניקות איסוף, טמפרטורת ומשך אחסון לטווח קצר וארוך, שימוש בריאגנטים והשפעת מחזורי הקפאה-הפשרה, על חלבונים שעשויים להיות שימושיים כסמנים ביולוגיים בשתן ומספקים המלצות לעיבוד אופטימלי על סמך סקירה זו של הספרות. פרוטוקול זה יתמקד בסמנים ביולוגיים של חלבונים הנמדדים באמצעות כתמים מערביים או ELISA.
Protocol
פרוטוקול זה עוקב אחר הנחיות ועדת האתיקה של המחקר האנושי של המוסד. ודא שהאישור מתקבל מוועדת הביקורת המוסדית (IRB) לפני איסוף וניצול דגימות ביולוגיות למחקר.
1. איסוף
- השג דגימת שתן בכוס דגימה סטרילית. החליטו על סוג דגימת השתן, כמו גם קריטריונים ספציפיים להכללה ואי הכללה, על סמך תכנון המחקר הספציפי. עבור מחקרי UTI, השתמש בשיטת התפיסה הנקייה או בצנתור כדי למנוע זיהום פרינאלי.
- כדי לקבל דגימת שתן נקייה, הנחו את המשתתפים לנגב את האזור הפרי-שופכה עם מגבון, לרוקן כמות קטנה לתוך האסלה ולאחר מכן להשתין לתוך כוס הדגימה.
- הנחו נשים להשתמש באצבעותיהן כדי לפזר את השפתיים ולגברים למשוך את העורלה (אם רלוונטי) לפני מתן שתן כדי למנוע זיהום.
- רשום את זמן האיסוף.
- אסוף את הנתונים הקליניים הרלוונטיים מכל משתתף, כנדרש בתכנון המחקר האישי ובשאלת המחקר.
- שקול לבצע בדיקת שתן או מקל שתן על כל דגימה לפני העיבוד והאחסון אם נתונים אלה אינם זמינים באופן מהימן מהרשומה הרפואית האלקטרונית.
2. עיבוד ואחסון דוגמאות
- עבד את הדגימות מיד. אם זה לא אפשרי, אחסן את הדגימה ב-4 מעלות צלזיוס עד 24 שעות.
- אם לא ניתן לאחסן דגימות ב-4 מעלות צלזיוס או שיש צורך לאחסן אותן ב-4 מעלות צלזיוס יותר מ-24 שעות, הוסף 0.2 M חומצה בורית או 10 מ"מ NaN3 לדגימות. בדוק כדי לוודא שריאגנטים כאלה תואמים ליישומים מתוכננים במורד הזרם.
- רשום את משך הזמן שהדגימות שהו ב-4 מעלות צלזיוס.
- צנטריפוגה את הדגימות ב-1000-1500 x גרם למשך 10-20 דקות. צנטריפוגה לא צריכה להיות בטמפרטורה של 4 מעלות צלזיוס.
- אספו את הסופרנטנט והעבירו אותו לצינורות מיקרו-צנטריפוגות נפרדים.
- סמן את הצינורות עם מספר מזהים ברורים (כגון התאריך וזיהוי הדגימה (ID)). שקול להשתמש בברקודים שנוצרו על ידי מחשב שתוכננו במיוחד לאחסון דגימות ביולוגיות בטמפרטורה של -80 מעלות צלזיוס. אם אינו זמין, ודא שהעט המשמש לתיוג דגימות עמיד במים.
- סמן כל קופסת מקפיא כך שלכל מיקום יש קוד ספציפי. לשם כך, מספר כל עמודה באות אחרת וכל שורה במספר. זה יאפשר יצירת מפות או מדריכים אחרים למיקום קל לדוגמא.
- מקפיאים את הדגימות מיד בטמפרטורה של -80 מעלות צלזיוס. רשום את זמן ההקפאה.
- הפשירו את הדגימות באמבט מים של 37 מעלות צלזיוס ביום המדידה כדי למזער אחסון מיותר בטמפרטורת החדר או ב-4 מעלות צלזיוס.
- רשום את הזמנים ומספר מחזורי ההקפאה-הפשרה הנוספים עבור כל ציטוט.
3. ניתוח
- בעת שימוש במכשירי ELISA הזמינים מסחרית, עקוב אחר הוראות היצרן.
- הפעל את הדוגמאות בשכפול.
- זהה את הריכוז הצפוי של החלבון המעניין כדי להבטיח שרמות החלבון בדגימות נופלות בטווח הערכה. אם רמת החלבון הצפויה עולה על הסטנדרט העליון, יש לדלל את הדגימות.
- לאחר קבלת נתונים מקורא הלוחות (ELISA) או הכתם המערבי, קבע את הריכוז של כל סמן ביולוגי בדגימה באופן ידני (לא מומלץ) או באמצעות תוכנה כלשהי.
- נתח את התוצאות. ניתוח הנתונים תלוי בתכנון המחקר האישי.
- שקול להתאים את ערכי הסמנים הביולוגיים כדי לקחת בחשבון את ריכוז השתן.
הערה: באופן מסורתי, חוקרי סמנים ביולוגיים השתמשו בקריאטינין בשתן כשיטה לנורמליזציה, במיוחד אצל משתתפים עם תפקוד כליות תקין, כדי להסביר את ריכוז השתן. עם זאת, אחרים מדווחים כי הנורמליזציה אינה משפיעה על התוצאות4. כדי להתגבר על מכשול זה, חלק מהחוקרים מדווחים על תוצאות מנורמלות ולא מנורמלות. - ממליץ על טווחי דיווח מאיסוף ועד הקפאה, כמו גם משך הזמן ב-4 מעלות צלזיוס לפני העיבוד בכתבי יד שפורסמו כדי לאפשר פירוש של תוצאות בהקשר של עיבוד דגימה (איור 1)
4. השפעת תנאי אחסון שונים על ליפוקלין הקשור לנויטרופילים ג'לטינאז (NGAL).
- ספייק שתן טרי עם 2 ננוגרם/מ"ל של NGAL רקומביננטי.
- יש להצמיד את השתן ולהכפיף אותו לתנאי עיבוד ואחסון שונים.
- צנטריפוגה בשתן בטמפרטורה של 1000-1500 x גרם למשך 10-20 דקות. צנטריפוגה לא צריכה להיות בטמפרטורה של 4 מעלות צלזיוס. יש לאחסן בתנאים שונים (20 מעלות צלזיוס, 4 מעלות צלזיוס, -20 מעלות צלזיוס) למשך 24 שעות, 48 שעות או 72 שעות.
- אחסן את כמות המדגם בטמפרטורה של -80 מעלות צלזיוס להשוואה.
- לאחר שמירה על הדגימות בתנאים השונים כאמור בשלב 4.2.1, יש למדוד את רמות ה-NGAL בדגימות באמצעות ערכת ELISA זמינה מסחרית הכוללת את הבקרות בהתאם להוראות היצרן.
תוצאות
לצנטריפוגה הייתה השפעה קטנה על רמות ה-NGAL. בדגימות צנטריפוגות המאוחסנות בטמפרטורה של -80 מעלות צלזיוס היו רמות נמוכות יותר של NGAL מאשר בדגימות שאינן צנטריפוגות (2.17 ננוגרם/מ"ל ±-0.32 ננוגרם/מ"ל, 2.77 ננוגרם/מ"ל ±-0.21 ננוגרם/מ"ל). למחזורי ההקפאה הייתה השפעה גם על רמות ה-NGAL לאחר מחזור ההקפאה-הפשרה השלישי. (איור 2). מבין התנאים שנחקרו (צנטריפוגה, מחזורי הקפאה-הפשרה וטמפרטורת אחסון), לטמפרטורת האחסון הייתה ההשפעה הגדולה ביותר על רמות ה-NGAL. אחסון בטמפרטורה של -80 מעלות צלזיוס מיד לאחר איסוף הדגימה היה השיטה היציבה ביותר לשימור הדגימה. נצפתה שונות ברמות ה-NGAL עם כל אחד מתנאי האחסון האחרים, כאשר הדגימות מאוחסנות בטמפרטורת החדר (20 מעלות צלזיוס) עם השינוי הגדול ביותר ברמות. (איור 3)
יחד, תוצאות אלה מצביעות על האופן שבו רמות החלבון הנמדדות יכולות להשתנות בהתאם לשיטת עיבוד הדגימה, ומדגישות לא רק את החשיבות של פרוטוקול עקבי ואמין לתוצאות הניתנות לשחזור, אלא גם את הצורך להעריך את הפרמטרים שנותחו כאן עבור סמנים ביולוגיים בודדים.
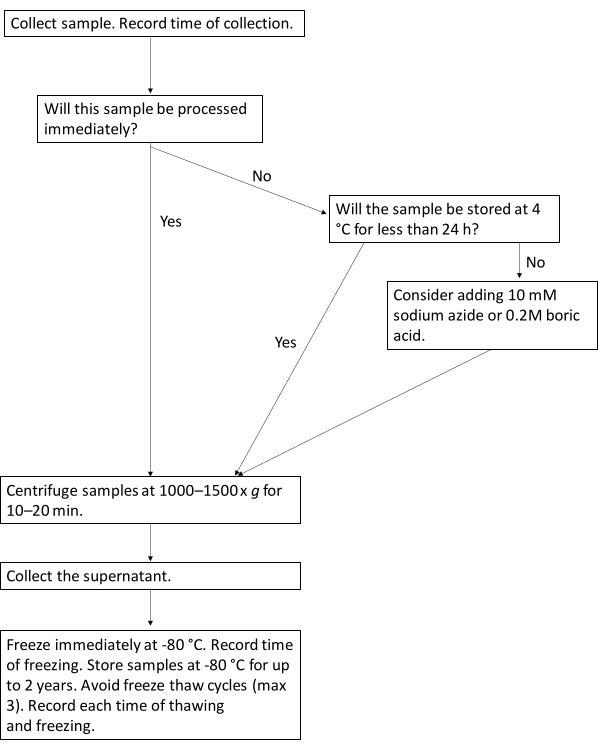
איור 1: זרימת עבודה של פרוטוקול לעיבוד אופטימלי של סמנים ביולוגיים בשתן. תרשים זרימה זה ממחיש את זרימת העבודה המוצעת לעיבוד דגימות שתן עבור סמנים ביולוגיים בשתן. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: ריכוזי NGAL בשתן בדגימות הנתונות למחזורי הקפאה-הפשרה. ריכוזי ה-NGAL בשתן יורדים לאחר מחזור ההקפאה-הפשרה השלישי. קווי שגיאה מייצגים סטיית תקן. בסך הכל נותחו 8 דגימות, שהופעלו בשכפול עבור כל 4 תנאי מחזור ההקפאה-הפשרה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: ריכוזי NGAL בשתן בתנאי אחסון שונים. דגימות שתן עם NGAL רקומביננטי אוחסנו ב-20 מעלות צלזיוס, 4 מעלות צלזיוס, -20 מעלות צלזיוס למשך 24 שעות, 48 שעות או 72 שעות. הדגימות גם הוקפאו מיד ב-80 מעלות צלזיוס לשם השוואה. לריכוזי NGAL בשתן יש מידה קטנה של שונות בהתבסס על טמפרטורת ההקפאה. קווי שגיאה מייצגים סטיית תקן. בסך הכל נותחו 20 דגימות, שהופעלו בכפולות עבור כל 10 תנאי הזמן והטמפרטורה. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
החשיבות של הפקת תוצאות עקביות וניתנות לשחזור אינה מוגבלת להצלחת מחקרים בודדים אלא גם תאפשר השוואה טובה יותר של תוצאות בתוך הספרות9. שונות בין מחקרים בשלבים פרוצדורליים מרכזיים יכולה להציג הטיה בלתי הפיכה שעלולה להשפיע על אותות הסמנים הביולוגיים ועל פרשנותם, מה שעשוי להיות אחראי לאי התאמות בין מספר מחקרים10. זה מדגים את הצורך לבסס גישה סטנדרטית יותר לעיבוד דגימות שתן למחקרי סמנים ביולוגיים.
תכנון המחקר של רוב מחקרי הסמנים הביולוגיים בשתן יכתיב את הזמן והשיטה של איסוף השתן. עם זאת, כאשר מודדים סמנים ביולוגיים בשיטה שאינה רגישה לזמן, אנו ממליצים להימנע מדגימת בוקר ראשונה. בעוד שדגימות שתן בבוקר הראשון נחשבות למספקות את פרופיל השתן העשיר ביותר במידע בשל אופיין המרוכז, דגימות אלו אינן אידיאליות למדידת סמנים ביולוגיים בשתן מכיוון שהן רגישות לזיהום חיידקי ותאי אפיתל. זה נכון במיוחד עבור דגימות שתן של נשים: ההשוואה בין דגימות שתן נקבות ריקות לדגימות אמצע הזרם מדגימה פרופורציות שונות משמעותית של חלבונים11. לפיכך, דגימת שתן שנייה בבוקר או אקראית באמצע הזרם מתאימה יותר לחקר סמנים ביולוגיים של חלבון12. שיטת איסוף השתן מוכתבת בדרך כלל גם על ידי תכנון המחקר. אנו ממליצים להשתמש בשתן נקי או בדגימות צנתור. שאריות שתן שנאספו בתחילה למטרות קליניות שגרתיות משמשות לעתים קרובות במחקרי UTI והיא שיטה מקובלת לאיסוף דגימות. עם זאת, בעוד שהתפס הנקי הוא הליך פשוט, צנתור השופכה הוא פולשני. איסוף שתן בצנתור צריך להתבצע רק על ידי מי שהוכשר כראוי לעשות זאת ונעשה באישור ה-IRB המקומי. אנו ממליצים לשתף פעולה עם רופאים בעלי הכשרה מתאימה להשגת דגימות שתן מצנתרות או ניצול שאריות שתן שנאספו בתחילה לטיפול קליני שגרתי.
יש לעבד דגימות מיד כדי לשמור על שלמותם של כל סמני העניין. עם זאת, לעתים קרובות זה לא אפשרי; לכן, יש צורך לבחון את השפעת תנאי האחסון, כולל משך הזמן והטמפרטורה, על יציבות הדגימה. באופן כללי, יש למזער אחסון בטמפרטורת החדר מכיוון שהוכח היטב שאחסון ממושך של דגימות בטמפרטורת החדר עבור סמנים ביולוגיים כגון NGAL יכול לגרום לפירוק13. בעוד שמחקרים מסוימים מצאו כי ל-24 שעות של אחסון בטמפרטורת החדר (25 מעלות צלזיוס) יש השפעה מינימלית על הריכוז של סמנים ביולוגיים כולל NGAL ו-KIM-114,15, אחרים קבעו כי השפלה משמעותית אכן מתחילה להתרחש במסגרת זמן זו8. הסמן הביולוגי בשתן IL-18 נמצא רגיש במיוחד לאחסון לטווח קצר ב-25 מעלות צלזיוס14,15. במידת האפשר, יש לאחסן דגימות לטווח קצר ב-4 מעלות צלזיוס במקום זאת. ב-4 מעלות צלזיוס, NGAL ו-KIM-1, IL-18, L-FABP וציסטטין C מציגים יציבות גבוהה למשך 24שעות 8 ועד 48 שעות15. עם זאת, לאחר 48 שעות ב-4 מעלות צלזיוס, KIM-1 מתחיל להתפרק באופן משמעותי16. לבסוף, אם אחסון לטווח קצר של דגימות בטמפרטורת החדר עולה על 8 שעות, או אם אחסון ב-4 מעלות צלזיוס עולה על 16 שעות, יש לשקול נתרן אזיד או חומצה בורית כחומר משמר לעיכוב צמיחת יתר וזיהום חיידקים12.
משך האחסון לטווח הארוך הוא שיקול חשוב נוסף. אחסון דגימות ב-80 מעלות צלזיוס מוביל לשיפור משמעותי ביציבות של חלבוני השתן בהשוואה לאחסון ב-20 מעלות צלזיוס, מה שמביא לשונות משמעותית של פירוק בחלבונים כגון NGAL14,13. בטמפרטורה של -80 מעלות צלזיוס, ניתן לאחסן דגימות באופן אמין לפחות 6 חודשים16 ועד שנתיים10. מחקר אחד מצא כי רמות החלבון ירדו לאחר 5 שנים ב-80 מעלות צלזיוס8-, מה שמצביע על כך שיש לנתח דגימות לפני 5 שנים. במהלך אחסון ארוך טווח של דגימות, יש למזער את מחזורי ההקפאה-הפשרה לשלושה או פחות10,11. נמצא כי חריגה משלושה מחזורי הקפאה-הפשרה משנה את דגימת השתן17, מה שאושר גם בנתונים המוצגים כאן. יש לציין כי עבור סמנים ביולוגיים ללא יציבות מתועדת בספרות, אנו ממליצים לחוקרים לשקול ביצוע מחקר יציבות פיילוט לפני תכנון אחסון דגימות בכל טמפרטורה שאינה -80 מעלות צלזיוס.
אין הסכמה סביב השימוש בריאגנטים ליציבות החלבון. מעכבי פרוטאז אינם נחוצים לדגימות שתן בהתחשב במחסור יחסי בפרוטאזות בשתן. זה נתמך על ידי נתונים המדגימים שאין הבדל בסוגים או בכמויות החלבונים בין דגימות שתן המאוחסנות עם ובלי מעכבי פרוטאז. 18 יתר על כן, תוספת של מעכב פרוטאז לא עשתה הבדל ברמות השתן של NGAL, KIM-1 או NAG10. אמנם מחקרים מסוימים השתמשו במעכבי פרוטאז, אבל השימוש בהם אינו מתוקנן בספרות הרחבה יותר של סמנים ביולוגיים בשתן. ריאגנטים אחרים כוללים כאלה למניעת צמיחת יתר של חיידקים, כגון נתרן אזיד וחומצה בורית. למרות שאינו בשימוש מסורתי בספרות הסמנים הביולוגיים של UTI, יש לשקול על בסיס המנגנון של הסמן הביולוגי המעניין. עבור סמנים ביולוגיים שרמותיהם קשורות למידת הבקטריוריה, השימוש בריאגנטים אלה עשוי להיות עדיף. המצב הנוסף שבו ניתן לשקול ריאגנטים אלה הוא כאשר לא ניתן לאחסן שתן בטמפרטורה של 4 מעלות צלזיוס למשך פחות מ-24 שעות, או שיש לאחסן אותו בטמפרטורת החדר למשך תקופה ממושכת לפני העיבוד. למרות שאינו נפוץ בספרות הסמנים הביולוגיים של UTI, אם צמיחת יתר של חיידקים מהווה דאגה ותנאי אחסון אופטימליים אינם אפשריים, ניתן להוסיף נתרן אזיד או חומצה בורית לדגימות. 19
צנטריפוגה היא צעד חשוב כדי למזער את זיהום דגימת השתן על ידי חלבונים מתאים אחרים (למשל, כדוריות דם אדומות, תאי דם לבנים, תאי אפיתל). יש לצנטריפוגה או לסנן דגימות במהירות לאחר איסוף הדגימה. הספרות מצביעה על כך שתאים בתוך השתן יכולים להתחיל ליז תוך 20-30 דקות לאחר איסוף הדגימה, מה שעלול לבלבל את מדידת החלבון12. למרות שצנטריפוגה מהירה אינה אפשרית לעתים קרובות, החוקרים חייבים להכיר בפוטנציאל למקורות חלופיים של חלבוני שתן. בהתחשב בכך שפיוריה שכיחה בדלקות בדרכי השתן, זהו שיקול חשוב עבור חוקרים המתמקדים בסמנים ביולוגיים של שתן בדלקת בדרכי השתן. אין להקפיא דגימות לפני הצנטריפוגה. ואכן, הקפאת הדגימה, אפילו עם צנטריפוגה קודמת, עלולה לגרום להיווצרות משקעים של בעיקר סידן אוקסלט מיובש וגבישי סידן אמורפיים בעת ההפשרה. בדגימות שנשמרו קפואות בטמפרטורה של -20 מעלות צלזיוס למשך הלילה, Saetun et al. הראו כי משקעים אלה עלולים לגרום לירידה קשורה ברמות החלבון בשתן20. שיקול נוסף התומך בהמלצה לא להקפיא שתן לא צנטריפוגה הוא שליזה פוטנציאלית של תאים בדגימה שאינה צנטריפוגה עלולה לבלבל עוד יותר את התוצאות.
לאחר צנטריפוגה, השלב הבא הוא לצטט את הדגימות. המספר המתאים של כמויות שתן להקפאה תלוי בתכנון המחקר האישי. ציטוט למספר צינורות מאפשר למזער את מחזורי ההקפאה-הפשרה בשלב מאוחר יותר. נפח ה-aliquots תלוי ביישומים המיועדים במורד הזרם. רוב ה-ELISA או הכתמים המערביים משתמשים בכמות קטנה של שתן, ולכן מינימום של 0.5 מ"ל בדרך כלל מספיק לכל אליקוט. עם זאת, יש צורך בכמויות גדולות בהרבה של שתן עבור מתודולוגיות בלתי מוטות, כגון ספקטרומטריית מסה. אנו ממליצים לזהות את כמות השתן המינימלית הדרושה לניסויים המתוכננים כדי להבטיח נפחים מספיקים.
בפרוטוקול זה, פרטים ספציפיים סביב מדידת סמנים ביולוגיים ספציפיים בשתן הושארו בחוץ מכיוון שהדבר תלוי מאוד בתכנון המחקר האישי. עם זאת, ניתן למדוד את רוב הסמנים הביולוגיים הללו באמצעות ELISA. השלב הכללי הראשון של ELISA כולל ציפוי צלחת של 96 בארות בנוגדן. ערכות רבות יגיעו עם שלב זה שכבר הושלם, אך אחרות דורשות מהחוקרים לבצע שלב זה. לאחר ציפוי הצלחת בנוגדנים, השלב הבא הוא הוספת התקנים, הדגימות והבקרות. רוב הערכות יספקו סטנדרטים לשימוש ב-ELISA. חשוב לעקוב אחר הוראות הערכה להכנה סטנדרטית כדי להבטיח יצירת העקומה הסטנדרטית הנכונה. מומלץ להשתמש בשליטה שלילית. השלב הבא הוא הוספת נוגדן הזיהוי, ואחריו הוספת האנזים המצומד. השלב האחרון הוא הוספת מצע, ואחריו לרוב מאגר עצירה. בשלב זה, ה-ELISA מוכן לקריאה על ידי קורא צלחות של 96 בארות. עקוב אחר הוראות היצרן כיצד להגדיר כראוי את קורא הלוחות עבור ה-ELISA המדובר. זה רלוונטי במיוחד כאשר מפרשים את התוצאות הסופיות. חשוב לשים לב להתפלגות העקומה הסטנדרטית הצפויה מהוראות היצרן בהתאם, שכן הדבר ישפיע הן על התאמת העקומה והן על דיוק התוצאות. שימו לב ל-R2 של העקומה הסטנדרטית. זה מציין עד כמה העקומה מתאימה לסטנדרטים. R2 נמוך, מתחת ל-0.90, הצביע על פיפטינג לא מדויק, מה שמעמיד בספק את דיוק התוצאות של ELISA. לאחר מכן ניתן להשתמש בעקומה הסטנדרטית כדי לקבוע את ריכוז הסמן הביולוגי על סמך הספיגה שנוצרת מקורא הצלחות.
הפרוטוקול שלנו דומה לפרוטוקול אחר בספרות המתמקדת בחלבוני שתן,21 עם מחקרים רבים שפורסמו על סמנים ביולוגיים בשתן המשתמשים בפרוטוקולים דומים 6,23,24,25,26. חוקרים שינו את הפרוטוקול הזה באמצעות מעכב פרוטאז26 או סינון דגימת השתן במקום צנטריפוגה כדי להתאים את הפרוטוקול להגדרות ללא ציוד כזה 4,28. מגבלה עיקרית ליצירת פרוטוקול סטנדרטי יחיד היא שלסמנים ביולוגיים שונים יש תכונות שונות, שעשויות להשפיע על שיקולי עיבוד. בנוסף, יישומים במורד הזרם שונים בהתאם לעיצוב המחקר, מה שעשוי להשפיע גם על העיבוד. הדגשנו שלבים בפרוטוקול זה כדי לאותת לחוקרים על מקומות שבהם ייתכן שיהיה צורך בשיקול דעת על סמך הפרטים של תכנון המחקר שלהם. לבסוף, פרוטוקול זה נכתב תוך התמקדות בסמנים ביולוגיים של חלבון שתן הנחקרים לעתים קרובות במחקרי UTI. דגימות שנאספו עבור מתודולוגיות בלתי מוטות, כגון ספקטרומטריית מסה, עשויות לדרוש שיקולים נוספים28. יתר על כן, סמנים ביולוגיים חדשים אחרים, כגון סמני RNA, ידרשו פרוטוקול מובהק לעיבוד ואחסון מיטביים. פרוטוקולים נמצאים במקום אחר לגבי שיקולי מדגם למחקרי אורוביום29.
Disclosures
לאף אחד מהמחברים אין ניגודי אינטרסים לחשוף.
Acknowledgements
לא הושג מימון חיצוני לעבודה זו. כספים מוסדיים שימשו להשגת הנתונים בעבודה זו.
Materials
| Name | Company | Catalog Number | Comments |
| Boric acid | Sigma-Aldrich | B6768 | To be considered for samples that cannot be rapidly processed and frozen |
| Freezer boxes | Fisher Scientific | 03-395-464 | |
| Microcentrifuge tubes | Thomas scientific | 1149X93 | |
| NGAL ELISA Kit | R&D Systems | DLCN20 | Used to create representative results |
| Pipette and tips | Dependent on pipette size and volume of fluid. | ||
| Sodium azide | Sigma-Aldrich | S2002 | To be considered for samples that cannot be rapidly processed and frozen |
| Urine collection cups | Thermo Scientific | 3122B03ORG | Sterile cups not required unless needed for other studies |
References
- Foxman, B. Epidemiology of urinary tract infections: Incidence, morbidity, and economic costs. American Journal of Medicine. 113, 5-13 (2002).
- Forster, C. S., Pohl, H. Diagnosis of urinary tract infection in the neuropathic bladder: Changing the paradigm to include the microbiome. Topics in Spinal Cord Injury Rehabilitation. 25 (3), (2019).
- Gadalla, A. A. H., et al. Identification of clinical and urine biomarkers for uncomplicated urinary tract infection using machine learning algorithms. Scientific Reports. 9 (1), (2019).
- Shaikh, N., et al. Biomarkers that differentiate false positive urinalyses from true urinary tract infection. Pediatric Nephrology. 35 (2), 321-329 (2020).
- Renata, Y., Jassar, H., Katz, R., Hochberg, A., Nir, R. -. R., Klein-Kremer, A. Urinary concentration of cytokines in children with acute pyelonephritis. European journal of Pediatrics. 172 (6), 769-774 (2013).
- Forster, C. S., Haffey, W. D., Bennett, M., Greis, K. D., Devarajan, P. Identification of urinary CD44 and Prosaposin as specific biomarkers of urinary tract infections in children with neurogenic bladders. Biomarker Insights. 14, (2019).
- Bitsori, M., et al. Urine IL-8 concentrations in infectious and non-infectious urinary tract conditions. Pediatric Nephrology. 26 (11), 2003-2007 (2011).
- Schuh, M. P., et al. Long-term Stability of urinary biomarkers of acute kidney injury in children. American Journal of Kidney Diseases. 67 (1), 56-61 (2016).
- Hepburn, S., et al. An analysis of the impact of pre-analytical factors on the urine proteome: Sample processing time, temperature, and proteolysis. Proteomics - Clinical Applications. 9 (5-6), 507-521 (2015).
- Han, W. K., Wagener, G., Zhu, Y., Wang, S., Lee, H. T. Urinary biomarkers in the early detection of acute kidney injury after cardiac surgery. Clinical Journal of the American Society of Nephrology. 4 (5), 873-882 (2009).
- Schaub, S., et al. Urine protein profiling with surface-enhanced laser-desorption/ionization time-of-flight mass spectrometry. Kidney International. 65 (1), 323-332 (2004).
- Thongboonkerd, V. Practical points in urinary proteomics. Journal of Proteome Research. 6 (10), 3881-3890 (2007).
- Grenier, F. C., et al. Evaluation of the ARCHITECT urine NGAL assay: Assay performance, specimen handling requirements and biological variability. Clinical Biochemistry. 43 (6), 615-620 (2010).
- Liu, K. D., et al. Storage time and urine biomarker levels in the ASSESS-AKI study. PLoS ONE. 11 (10), 1-9 (2016).
- Parikh, C. R., et al. Urine stability studies for novel biomarkers of acute kidney injury. American Journal of Kidney Diseases. 63 (4), 567-572 (2014).
- Van De Vrie, M., Deegens, J. K., Van Der Vlag, J., Hilbrands, L. B. Effect of long-term storage of urine samples on measurement of kidney injury molecule 1 (KIM-1) and neutrophil gelatinase-associated lipocalin (NGAL). American Journal of Kidney Diseases. 63 (4), 573-576 (2014).
- Hubel, A., Aksan, A., Skubitz, A. P. N., Wendt, C., Zhong, X. State of the art in preservation of fluid biospecimens. Biopreservation and Biobanking. 9 (3), 237-244 (2011).
- Havanapan, P. O., Thongboonkerd, V. Are protease inhibitors required for gel-based proteomics of kidney and urine. Journal of Proteome Research. 8 (6), 3109-3117 (2009).
- Thongboonkerd, V., Saetun, P. Bacterial overgrowth affects urinary proteome analysis: Recommendation for centrifugation, temperature, duration, and the use of preservatives during sample collection. Journal of Proteome Research. 6 (11), 4173-4181 (2007).
- Saetun, P., Semangoen, T., Thongboonkerd, V. Characterizations of urinary sediments precipitated after freezing and their effects on urinary protein and chemical analyses. American Journal of Physiology - Renal Physiology. 296 (6), 1346-1354 (2009).
- Project, H. K. . Standard Protocol for Urine Collection and Storage. , (2021).
- Nickolas, T. L., et al. Diagnostic and prognostic stratification in the emergency department using urinary biomarkers of nephron damage: a multicenter prospective cohort study. Journal of the American College of Cardiology. 59 (3), 246-255 (2012).
- Forster, C. S., Loechtenfeldt, A. M., Shah, S. S., Goldstein, S. Urine neutrophil gelatinase-associated lipocalin in girls with recurrent urinary tract infections. Pediatric Nephrology. , 1-8 (2020).
- Forster, C. S., et al. Predictive ability of NGAL in identifying urinary tract infection in children with neurogenic bladders. Pediatric Nephrology. 33 (8), 1365-1374 (2018).
- Forster, C., et al. Urinary NGAL deficiency in children with recurrent urinary tract infections. Journal of Pediatric Urology. 32, 1077-1080 (2017).
- Gupta, S., Preece, J., Haynes, A., Becknell, B., Ching, C. Differentiating asymptomatic bacteriuria from urinary tract infection in the pediatric neurogenic bladder population: NGAL as a promising biomarker. Topics in Spinal Cord Injury Rehabilitation. 25 (3), 214-221 (2019).
- Shaikh, N., et al. Host and bacterial markers that differ in children with cystitis and pyelonephritis. Journal of Pediatrics. 209, 146-153 (2019).
- Harpole, M., Davis, J., Espina, V. Current state of the art for enhancing urine biomarker discovery. Expert Review of Proteomics. 13 (6), 609-626 (2016).
- Jung, C. E., et al. Benchmarking urine storage and collection conditions for evaluating the female urinary microbiome. Scientific Reports. 9 (1), 13409 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved