Method Article
Проведение точных и точных одномолекулярных измерений FRET с помощью smfBox с открытым исходным кодом
В этой статье
Резюме
В этой статье приведены пошаговые инструкции по проведению полностью скорректированных точных измерений FRET на отдельных, свободно диффузных биомолекулах с использованием недорогого smfBox с открытым исходным кодом, от включения, выравнивания и фокусировки, до сбора и анализа данных.
Аннотация
smfBox - это недавно разработанный экономичный инструмент с открытым исходным кодом для одномолекулярного резонансного переноса энергии Фёрстера (smFRET), который делает измерения на свободно диффундирующих биомолекулах более доступными. Этот обзор включает в себя пошаговый протокол для использования этого прибора для проведения измерений точной эффективности FRET в дуплексных образцах ДНК, включая подробную информацию о подготовке образцов, настройке и выравнивании прибора, сборе данных и полных процедурах анализа. Представленный подход, который включает в себя определение всех поправочных коэффициентов, необходимых для точных измерений расстояний, полученных из FRET, основывается на большом объеме недавней совместной работы в сообществе FRET, которая направлена на создание стандартных протоколов и подходов к анализу. Этот протокол, который легко адаптируется к целому ряду биомолекулярных систем, добавляет к растущим усилиям по демократизации smFRET для более широкого научного сообщества.
Введение
Одномолекулярный резонансный перенос энергии Фёрстера (smFRET) - это метод, который измеряет эффективность FRET между двумя красителями - донором и акцептором - на уровне отдельных молекул. FRET - это фотофизический процесс, возникающий из перекрывающихся энергетических спектров двух красителей: донор возбуждается светом определенной длины волны и передает энергию без излучения акцептору, что приводит к излучению акцептора. Эффективность этого переноса обратно пропорциональна шестой степени расстояния между двумя красителями, поэтому эффективность передачи изменяется в зависимости от расстояния1. Таким образом, эта эффективность FRET может быть использована для определения пространственной информации о молекуле (молекулах)2, к которой прикреплены красители, в диапазоне 3-10 нм. Этот масштаб и тот факт, что изменения в эффективности FRET чувствительны к молекулярным движениям Ангстрема3, делает метод хорошо подходящим для исследования структурной информации о биомолекулах, таких как нуклеиновые кислоты и белки, без осложнений ансамбля в среднем4,5,6. В то время как изменения относительной эффективности FRET могут быть использованы для мониторинга биомолекулярных взаимодействий и конформационной динамики, проливая свет на ключевые клеточные процессы, такие как сворачивание белка (не)сворачивание, транскрипция и репликация и репарация ДНК, абсолютная эффективность FRET была использована для определения точных расстояний для определения биомолекулярной структуры7,8,9,10,11 , преодоление необходимости кристаллизации или замораживания, как это требуется для некоторых других структурных методов4,12.
Эксперименты smFRET чаще всего принимают две формы: конфокальная или флуоресцентная микроскопия полного внутреннего отражения (TIRF). Между обоими подходами молекулярная динамика биомолекул обычно может быть исследована во временных масштабах от пико- до миллисекунд (конфокальные, свободно диффундирующие молекулы) до миллисекунды и часов (TIRF, поверхностные иммобилизованные молекулы). Это связано с различными настройками, задействованными в каждой технике. В микроскопии TIRF молекулы иммобилизуются на поверхности слайда и возбуждаются испаряющейся волной (рисунок 1A). Здесь, однако, основное внимание уделяется конфокальной микроскопии, поскольку это формат smfBox. В конфокальной микроскопии молекулы не обездвиживаются, а вместо этого свободно диффундируют через броуновское движение через конфокальный объем (~ 1 fL), образованный путем фокусировки лазерного луча через линзу с высокой числовой апертурой в пятно на некоторой заданной глубине в растворе (рисунок 1B). Полученное излучение фокусируется обратно через ту же диафрагму и фильтруется через дихроичное зеркало (рисунок 1C для полной схемы). Затем он фокусируется через точечное отверстие, чтобы удалить любой расфокусированный свет и на лавинный фотодиод (APD). Когда APD обнаруживает фотон, он выводит TTL-импульс, время которого может быть записано с пикосекундным разрешением. Время наблюдения этих свободно диффундирующих молекул в непосредственной близости от конфокального объема обычно находится в пределах порядка миллисекунд.
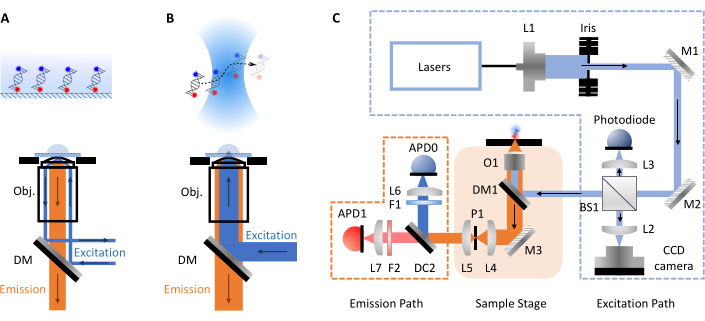
Рисунок 1: Схемы, показывающие принципы микроскопии и настройки smfBox. (A) Принцип флуоресценции полного внутреннего отражения (TIRF): свет возбуждения направляется в край объектива (Obj.) и подвергается полному внутреннему отражению на интерфейсе крышки-буфера, генерируя экспоненциально затухающее поле эванесценции для возбуждения поверхностно присоединенных молекул. (B) Конфокальная микроскопия: свободно диффузные молекулы возбуждаются почти дифракционным ограниченным пятном, сфокусированным в образце. (C) Установка smfBox, используемая в этом протоколе, показывает все ключевые компоненты: лавинные фотодиоды (APD), светоделитель (BS), дихроичные зеркала (DM), фильтры (F), зеркала (M), объектив (O) и точечное отверстие (P). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Совсем недавно методы smFRET включали два цветовых возбуждения, где лазеры, соответствующие длинам волн донора и акцептора возбуждения, чередуются5. Это может быть сделано одним из двух способов, первый путем модуляции непрерывных волновых лазеров на шкале времени КГц, которая известна как переменное лазерное возбуждение (ALEX)13,14. Второй метод чередует быстрые импульсы на шкале времени МГц; это наносекундное ALEX15 или импульсное чередующееся возбуждение (PIE)16. Во всех этих подходах информация от акцепторного лазера приводит к расчету так называемой стехиометрии, которая может различать молекулы с низкой эффективностью FRET и те, у которых отсутствует акцептор (либо через неполную маркировку, либо через фотоотбеливание). Использование PIE/ns-ALEX дополнительно дает доступ к флуоресцентному времени жизни на одномолекулярном уровне, а анизотропии могут быть измерены в сочетании с поляризационной оптикой. Эта комбинация измерений известна как многопараметрическое флуоресцентное обнаружение (MFD)9.
Несмотря на многие преимущества smFRET, он не широко используется за пределами специализированных лабораторий из-за высокой стоимости коммерческих инструментов и отсутствия простых, самостоятельно построенных альтернатив. Растущая тенденция к развитию недорогой микроскопии с открытым исходным кодом имеет место, и в последнее время появились другие платформы, включая Planktonscope17, OpenFlexure Microscope18, Flexiscope19, miCube20, liteTIRF21 и Squid22. В настоящем исследовании описывается протокол использования smfBox, недавно разработанной экономически эффективной конфокальной установки, способной измерять эффективность FRET между двумя красителями на свободно диффундирующих отдельных молекулах. Подробные инструкции по сборке и все необходимое операционное программное обеспечение находятся в свободном доступе по адресу: https://craggslab.github.io/smfBox/ 23. Оптическая компоновка smfBox собрана из легкодоступных компонентов, приобретенных у недорогих и широко доступных производителей, в то время как корпус микроскопа (ответственный за большую часть расходов в стандартной конфокальной установке) был заменен специальной светонепроницаемой анодированной алюминиевой коробкой (позволяющей проводить измерения в условиях окружающего освещения). Эта коробка содержит ключевые оптические компоненты, в том числе дихроику возбуждения, объектив и точечное отверстие, а также механическую лазерную блокировку, что позволяет безопасно работать в качестве лазерного продукта класса I (см. Рисунок 1C для полной схемы). smfBox использует ALEX для проверки стехиометрии красителя и определения точных коэффициентов коррекции FRET. Он управляется с использованием специально написанного программного обеспечения с открытым исходным кодом (smOTTER), которое контролирует все аспекты сбора данных и выводит данные в формате photon-HDF5 с открытым исходным кодом24, совместимом со многими сторонними инструментами анализа. smfBox и протоколы сбора и анализа данных были недавно протестированы на >20 других приборах (как конфокальных, так и TIRF) в многолабораторном слепом исследовании25. Полученная эффективность FRET была в отличном соответствии со всеми другими инструментами, несмотря на то, что smfBox стоил лишь часть цены коммерчески доступных установок.
Здесь описан пошаговый протокол для получения и анализа точной, абсолютной эффективности FRET на свободно диффундирующих дуплексах ДНК с использованием smfBox, на всем пути от включения, через выравнивание и фокусировку, до сбора и анализа данных. Здесь используются три дуплексных ДНК (демонстрирующих высокую, среднюю и низкую эффективность FRET, см. таблицу 1), которые были оценены во всемирном исследовании слепых25; однако способ адаптируется ко многим молекулярным системам, включая белки и другие нуклеиновые кислоты. Есть надежда, что такой подробный протокол, наряду с уже существующими инструкциями по сборке для smfBox23, поможет сделать эту мощную технику еще более доступной для широкого круга лабораторий.
протокол
1. Компоненты включения питания
- Питание от шести вилок (без определенного порядка): Piezoconcept (z-фокус), APD0, APD1, зеленый лазер, красный лазер и фотоприемник.
2. Программное обеспечение 1-Экспериментальная настройка
- Запустите лазерный центр управления.
- Убедитесь, что выбран режим непрерывной волны - переменного постоянного тока (CW-ACC ).
- Включите оба лазера.
- Проверьте/установите мощность лазера.
ПРИМЕЧАНИЕ: Мощность лазера должна быть отрегулирована в соответствии с измерением непосредственно перед дихроичным возбуждением, так как ND-фильтры и делители луча в траектории возбуждения уменьшат мощность лазера от числа, указанного на панели управления лазером. Цифры, приведенные здесь, являются мощностью при дихроичном возбуждении, но мощность на лазерном управлении, которая соответствует этому, должна быть проработана.- Зеленый лазер 220 мкВт (515 нм, 40 мВт)
- μ70 Вт для красного лазера (638 нм, 10 мВт)
- Программное обеспечение для приобретения smOTTER
- Подключите лазеры, детекторы, Z-каскад и камеру. Настройте их правильно (может варьироваться в зависимости от настроек конкретной настройки карты NI).
3. Выравнивание пути выбросов (обычно не требуется)
- Настройка выравнивания
- Пипетка 10 мкл свободного красителя Cy3B (~100 нМ) на микроскоп и фокусировка, как описано в шагах 4.3-4.5 ниже.
ПРИМЕЧАНИЕ: Другой донорский краситель с некоторой утечкой в акцепторный канал также будет работать. - Откройте вкладку «Выравнивание » в smOTTER, уменьшите мощность лазера и измените шкалу оси Y до тех пор, пока с детекторы не увидят показания.
ПРИМЕЧАНИЕ: Цель здесь состоит в том, чтобы увеличить сигнал, поэтому шкалу, возможно, придется снова изменить после увеличения сигнала. - Открутите четыре винта в передней части smfBox и снимите переднюю панель.
- Пипетка 10 мкл свободного красителя Cy3B (~100 нМ) на микроскоп и фокусировка, как описано в шагах 4.3-4.5 ниже.
- Выравнивание точечных отверстий
- Поверните ручку x на позиционере с точечным отверстием во время просмотра сигнала на вкладке Выравнивание, пытаясь увеличить сигнал зеленым и красным цветом.
- Теперь поверните ручку y, чтобы выровнять точечное отверстие в другом направлении.
- Вернитесь к ручке x, чтобы проверить дальнейшее увеличение сигнала.
- Выравнивание объектива с точечным отверстием
- Поверните ручку объектива x в одну сторону, это уменьшит сигнал.
- Поверните ручку pinhole x в том же направлении, чтобы снова увеличить сигнал.
- Если новый максимальный сигнал выше, чем раньше, продолжайте итеративно перемещать точечное отверстие и линзу в этом направлении. Если он ниже, чем раньше, итеративно двигайтесь в противоположном направлении.
- Повторите выше для y.
- Выравнивание объектива APD
- Начиная с зеленого APD, перемещайте ручку x до тех пор, пока зеленый сигнал не достигнет максимума.
- Повторите для ручки y.
- Вернитесь к ручке X, двигайтесь вперед и назад, чтобы найти пороговые точки, где сигнал начинает падать, и оставьте его в положении на полпути между этими двумя точками.
- Повторите для ручки x.
- Повторите описанные выше шаги для красного объектива APD, наблюдая за красным сигналом.
- Поместите переднюю панель обратно на smfBox и замените винты.
ПРИМЕЧАНИЕ: Выполните приведенное выше выравнивание месяцила, и в качестве меры предосторожности, если подозревается, что микроскоп развил ошибку выравнивания между измерениями.
4. Сбор данных измерений
- Для первого образца очистите сцену салфеткой для очистки линз, смоченной в метаноле; аккуратно протрите цель от одного конца до другого.
- Нанесите 3-4 капли погружного масла для микроскопии на центр объектива; пополнять по мере необходимости между образцами.
- Пробоподготовка
- Пипетка 10 мкл образца (сначала используйте сверхчистую воду типа I) по центру чистого покровного стекла.
- Осторожно поместите защитное стекло на объектив, опуская его под углом к маслу, чтобы предотвратить захват пузырьков воздуха между защитным стеклом и объективом.
ПРИМЕЧАНИЕ: При необходимости сдвиньте крышку стекла вокруг, чтобы оттолкнуть пузырьки воздуха в масле от фокусной точки.
- Для проведения экспериментов с переменным лазерным возбуждением (ALEX) настройте лазер в панели рабочих циклов лазера следующим образом.
- Донор (зеленый лазер) 0 выкл., 45 вкл., 55 выкл.
- Акцептор (красный лазер) 50 выкл., 45 вкл., 5 выкл.
- Алекс период (мкс): 100
- Щелкните вкладку Z фокус на ленте; на панели сбора переключите лазеры на Live и запустите камеру; отрегулируйте экспозицию так, чтобы в центре появлялось яркое пятно, окруженное черным.
ПРИМЕЧАНИЕ: Камера улавливает свет, отраженный границей между стеклом и водой между крышкой и образцом, и видимый круг света находится на самом маленьком диаметре, когда фокусная точка находится на этом интерфейсе. Поэтому необходимо начать ниже этого интерфейса, увеличить z-высоту до интерфейса, а затем немного дальше сфокусироваться над крышкой и в измеряемом образце.- Начиная с низкого положения Z, увеличьте высоту до тех пор, пока яркое пятно не достигнет своего минимального размера, затем поднимите высоту дальше до 20 мкм, чтобы сфокусировать лазер над маслом и покрыть стекло и в образце.
- Остановите камеру, как только она окажется в фокусе.
- Чтобы убедиться, что установка была выполнена надлежащим образом, контролируйте следы сверхчистой воды типа I, чтобы не видеть флуоресцентных сигналов; повторное подтверждение чистоты буферов, в которых готовятся образцы.
- Осторожно снимите покровное стекло резиновым пинцетом, чтобы избежать повреждения объектива, затем поместите интересующий образец, подготовленный, как указано выше, на объектив. Пополняйте погружное масло по мере необходимости для поддержания равномерной области контакта между покровным стеклом и объективом (особое внимание уделяется области контакта образца на покровном стекле и фокусной области объектива)
- Концентрация бинго
- Чтобы обеспечить получение одномолекулярных данных, образцы должны быть в концентрации, при которой наблюдается 1-5 всплесков в секунду в живой панели следов smOTTER (это сводит к минимуму вероятность присутствия более одной молекулы в объеме обнаружения одновременно). Проведите измерения, когда будет определена соответствующая концентрация.
- Чтобы предотвратить испарение во время длительных экспериментов, подготовьте герметичную камеру для отбора проб. Прижмите силиконовые изоляторы (отверстие диаметром 8-9 мм) к центру покровного стекла (окрашенного наконечником пипетки). Затем осторожно поместите образец в центр, избегая любого контакта с силиконом. Затем поместите сверху второе покровное стекло и нажмите, чтобы сформировать уплотнение.
- Проверьте живую стехиометрию против гистограммы эффективности FRET (ES), чтобы увидеть, ведет ли образец себя так, как ожидалось, т. Е. Ожидаемая эффективность FRET и разумная стехиометрия (~ 0,5).
- Когда образец будет готов, введите сведения об эксперименте на панели параметров сохранения. Выберите соответствующий каталог и имя файла, щелкнув значок многоточия (файлы, сохраненные в формате hdf5/h5) на панели настроек сохранения.
- Введите информацию о названии образца, деталях образца, метках донора и акцептора, длинах волн возбуждения буфера, донора и акцептора, длинах волн обнаружения и мощности лазера, а также принадлежности к пользователю и пользователю.
- Вернитесь на вкладку динамической трассировки на ленте и на панели сбора введите длину эксперимента (в минутах), выберите соответствующий интервал сохранения, чтобы уменьшить потенциальную потерю данных в случае ошибки. При необходимости выберите Сохранить мощность лазера.
- Нажмите кнопку Пуск , чтобы получить данные.
ПРИМЕЧАНИЕ: Для обеспечения точного определения FRET необходимо измерить по крайней мере два образца, содержащие одни и те же донорские и акцепторные красители, но с достаточно разной эффективностью FRET.
5. Анализ/программное обеспечение 2
- Запустите записную книжку Jupyter с пакетом python FRETBursts (инструкции по установке можно найти здесь: https://craggslab.github.io/smfBox/anasoftware.html)
- Если коррекция на абсолютную эффективность FRET не нужна (т.е. для измерения достаточно только относительных изменений в FRET), запустите jupyter notebook FRET Analysis 1.4 Uncorrected.ipynb. Используйте это для экспорта рисунков или данных в виде csv-файлов для дальнейшего анализа или построения графиков в другом программном обеспечении.
ПРИМЕЧАНИЕ: Каждая записная книжка содержит подробные инструкции, которые помогут пользователю пройти через процедуры анализа. Более подробное обсуждение процедур анализа, включая алгоритмы пакетного поиска, фоновую коррекцию и все параметры коррекции см. в разделе 23,25. - Если необходима коррекция на абсолютную эффективность FRET, начните с расчета параметров перекрестных помех альфа (утечка донорского излучения в акцепторный канал) и дельта (доля прямого возбуждения акцептора при донорском возбуждении).
- Сначала запустите Jupyter корректирующий коэффициент Finder Alpha-Delta.ipynb и определите альфа- и дельта-параметры.
ПРИМЕЧАНИЕ: Если они не согласуются между образцами, у микроскопа может возникнуть проблема выравнивания между измерениями или спектры красителей различаются между образцами. - Если альфа- и дельта-параметры согласованы, запустите блокнот Jupyter Correction Factor Finder Gamma-Beta.ipynb для определения гамма- и бета-параметров (которые учитывают различия в возбуждении и эффективности обнаружения между красителями).
ПРИМЕЧАНИЕ: Если гамма- и бета-график плохо подходят, микроскоп, возможно, разработал проблему выравнивания между измерениями, или квантовые выходы, или коэффициенты вымирания красителей различаются между образцами. - После определения четырех параметров перекрестных помех эти факторы могут быть использованы в записной книжке Jupyter FreT Analysis 1.4 Corrected.ipynb для определения абсолютной эффективности FRET.
- Сначала запустите Jupyter корректирующий коэффициент Finder Alpha-Delta.ipynb и определите альфа- и дельта-параметры.
6. Устранение неполадок
- Если все сигналы низкие или количество на всплеск ниже, чем ожидалось (это зависит от красителя, но для ATTO-550 и ATTO-647N на smfBox типичные значения составляют от 50 до 100 отсчетов в мс во время одномолекулярного всплеска), перестройте smfBox.
- Мост между дважды и одиночно мечеными популяциями на гистограмме ES.
ПРИМЕЧАНИЕ: Это может быть вызвано либо работой при слишком высокой концентрации (исправить это, разбавляя образец), либо фотоотбеливанием, которое может быть вызвано использованием слишком высокой мощности лазера (исправить это, уменьшив мощность лазера). - Если скорость всплеска падает на протяжении всего эксперимента (флуоресцентно меченые молекулы, вероятно, придерживаются стеклянной крышки), используйте повышенную концентрацию BSA для выпрямления.
- Если скорость разрыва увеличивается на протяжении всего эксперимента (образец, вероятно, испаряется), подготовьте герметичную камеру для отбора проб, как описано выше.
- Если сигнал падает до нуля во время выравнивания (программное обеспечение, вероятно, перегружается сигналом от детекторов), уменьшите мощность лазера или используйте более разбавленный образец выравнивания.
- Если Z-фокус показывает концентрические кольца (это может произойти, если на объекте было размещено несколько обшивок), проверьте наличие нескольких обложек на объекте.
- Если образец содержит яркие, длинные всплески промежуточных стехиометрий (вызванных агрегированными молекулами), используйте моющие средства или модифицируйте протоколы очистки образцов.
ПРИМЕЧАНИЕ: Получение чистого буфера может быть проблемой, так как некоторые буферные компоненты часто содержат очень небольшое количество умеренно флуоресцентных загрязняющих веществ, которых достаточно, чтобы представить в виде одноцветных всплесков на временном следе. Если этого слишком много в буфере, то это может совпадать с всплесками образца и изменять эффективность FRET или измеряемую стехиометрию. BSA, в частности, часто может быть проблематичным в этом отношении, поэтому полезно подвергать стандартное решение BSA сильному источнику света для фотоотбеливания загрязняющих веществ.
Результаты
Протокол требует критической оценки экспериментальных условий во время установки (см. шаг протокола 4.8). На этом этапе достигаются первые полученные результаты, определяющие успех или неудачу эксперимента. Положительным результатом было бы иметь от пяти до одного всплеска в секунду (см. Рисунок 2B, C). Отрицательным результатом будет наличие слишком большого количества (рисунок 2A) или слишком малого количества всплесков (рисунок 2D) в течение этого периода времени. На данном этапе по-прежнему возможно исправить эти ошибки: образец со слишком высокой концентрацией нужно просто разбавить; однако, если концентрация слишком низкая, возможно, потребуется подготовить новую пробу (определяющим фактором является то, сохраняется ли возможность при такой низкой концентрации собирать данные в разумные сроки).

Рисунок 2: Снимки экрана из живого следа во время экспериментальной установки, показывающие различные концентрации дважды меченых дуплексных образцов ДНК. (A) слишком высокий, (B) верхний допустимый предел, (C) целевая концентрация, (D) слишком низкий. Количество фотонов (1 мс бункеров) отображается в трех каналах обнаружения; донорская эмиссия после донорского возбуждения (DD), акцепторная эмиссия после возбуждения донора (DA) и акцепторная эмиссия после акцепторного возбуждения (AA). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Статическая одновидовая система обычно требует от 30 до 60 минут измерения для получения необходимых ~ 1000 всплесков, необходимых для надежного анализа данных. Продолжительность времени и количество требуемых всплесков будут увеличиваться с несколькими видами или динамическими системами. Последующий сбор и анализ данных с использованием протокола фигуры экспортируются из записных книжек Jupyter. График чередования (рисунок 3A) должен соответствовать периоду ALEX экспериментальной установки. Временная трассировка (рисунок 3В) используется для качественной оценки разумной концентрации образца. Фоновый график (рисунок 3C) показывает распределение межфотонных периодов задержки с линейным соответствием более длительному времени для оценки фоновой скорости26. Фоновая трассировка (рисунок 3D) может определить, были ли изменения в образце в течение всего эксперимента; в первую очередь это будет связано с испарением в течение более длительного времени приобретения. Гистограммы ES генерируются для всех фотонов (рисунок 3E) и дважды меченых видов (рисунок 3F). Наконец, генерируется гистограмма 1D E (рисунок 3G) с гауссовской подгонкой данных пакета.

Рисунок 3: Пример вывода проанализированных данных, сгенерированных блокнотами Jupyter. (A) График чередования, (B) Трассировка времени, (C) Определение фона, (D) Фоновые частоты, (E) Гистограмма всех фотонов ES, (F) Двухканальная гистограмма ES и (G) 1D E гистограмма. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Имя | Последовательность |
| 1а | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- CTC GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5' | |
| 1б | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- CTC GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5' | |
| 1с | 5'- GAG CTG AAA GTG TCG AGT TTG TTT GAG TGT TTG TCT GG - 3' |
| 3'- CTC GAC TTT CAC AGC TCA AAC AAA CTC ACA AAC AGA CC - 5' |
Таблица 1: Последовательности ДНК, используемые в протоколе. Нуклеотиды выделены синим и красным цветом, представляя собой аминомодифицированные остатки тимина C2, помеченные Atto-550 и Atto-647N, соответственно.
Корректирующий фактор Finder Alpha-Delta: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Корректирующий фактор Finder Gamma-Beta: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Анализ FRET 1.4 Исправлено: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Анализ FRET 1.4 Неисправлен: Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Наиболее важными шагами в протоколе являются выравнивание микроскопа и регулировка концентрации образца до правильного разбавления. Если выравнивание отключено, то может быть недостаточно сигнала для идентификации всплесков и построения гистограмм, а если происходит смещение между образцами, то точная коррекция FRET может не работать из-за изменений в утечке и эффективности обнаружения / возбуждения. Использование соответствующей концентрации также важно, слишком высокая концентрация даст совпадающие всплески, содержащие несколько молекул с потенциально различной эффективностью FRET или маркировку стехиометрий. Слишком низкая концентрация даст слишком мало всплесков для надежного анализа данных.
Протокол, описанный здесь, предназначен для измерения расстояний в статических одиночных видах FRET. Если образец имеет более одного пика в гистограмме эффективности FRET или пики кажутся широкими (что может произойти с динамическими видами), то может потребоваться больше всплесков, чтобы соответствовать гистограммам с той же степенью точности. Для двух хорошо разделенных пиков потребуется примерно в два раза больше данных, но если популяции немного перекрываются, то требуется еще больше данных.
Если две популяции взаимодействуют на временной шкале эксперимента, динамика и кинетика системы потенциально могут быть определены. Такие тесты, как BVA27 и 2CDE28, могут подтвердить, что промежуточные всплески являются динамическими по своей природе, тогда как анализы, включая dPDA29,30 или H2MM31, могут определить скорость взаимопревращения. Ноутбуки Jupyter для BVA и 2CDE доступны на веб-сайте FRETBursts26, а программное обеспечение pam32 на базе MATLab может выполнять анализ BVA, 2CDE и PDA.
Конфокальный одномолекулярный FRET может легко наблюдать состояния гораздо более короткоживущие (~1 мс), чем TIRF; однако короткое время наблюдения, ограниченное диффузией, не дает молекулярной истории и поэтому не может определить более длительное время пребывания или сложные переходные сети так, как это могут сделать поверхностные иммобилизованные эксперименты.
Поскольку протокол измеряет свободно диффундирующие молекулы при очень низкой концентрации, он лучше всего работает при измерении внутримолекулярных расстояний на одной и той же молекуле. Межмолекулярные расстояния между переходно связанными молекулами могут быть измерены при условии, что Kd двух молекул достаточно низок, чтобы комплекс существовал в значительном количестве при низкой рабочей концентрации, требуемой экспериментом (~100 пМ). Если Kd намного выше этого, то будут видны только одиночно меченые молекулы. Эта проблема может быть преодолена с помощью микрофлюидики для смешивания двух меченых компонентов вместе в высокой концентрации, а затем быстрого разбавления и протекания над целью до того, как комплекс диссоциирует33,34.
Измерение эффективности FRET на уровне одной молекулы имеет значительное преимущество перед ансамблевыми методами, поскольку оно информирует о гетерогенных субпопуляциях, которые в ансамблевом эксперименте будут усреднены. Кроме того, одномолекулярный FRET с ALEX дает доступ к точной эффективности FRET, которая может быть преобразована в точные расстояния. Это позволяет определять более подробную структурную информацию, а не просто исследовать относительные изменения расстояния. smfBox обладает всеми этими преимуществами и возможностями, но может быть построен с гораздо меньшим бюджетом, чем сопоставимые коммерчески доступные микроскопы, способные к конфокальному smFRET23.
smfBox представляет собой гораздо более низкий барьер для входа для методов smFRET, позволяя исследователям измерять конформационные изменения и точные расстояния внутри и между белками и нуклеиновыми кислотами7,8,9,10,11,35.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих интересов.
Благодарности
Авторы с благодарностью отмечают следующие источники финансирования: BBSRC (BB/T008032/1); EPSRC (Studentship to B.A.) и MRC (Studentship to A.R.-T.).
Материалы
| Name | Company | Catalog Number | Comments |
| Amino modified oligonucleotide | Eurogentec | N/A | May be ordered from various suppliers or synthesised; amino modification enables labeling with NHS-ester modified dyes |
| Avalanche photodiode (APD) | Excelitas | SPCM-AQRH-14 | Two APDs are required for the smfBox setup |
| Bovine Serum Albumin (BSA) | Merck | A2153 | System dependant; imaging buffer component (0.1 mg/mL in buffer) |
| Compact Laser Combiner | OMICRON | LightHUB-2 | 515 nm (80 mW) and 638 nm (100 mW) lasers |
| Coverglass | VWR | 630-2742 | Thickness: 0.17 ± 0.01 mm, LxW: 22x22 mm |
| Cy3B | Cytiva | PA63101 | 1 mg, PA63100 (5 mg), PA96106 (25 mg) |
| FRETBursts Python Package | N/A | N/A | Open-source python package for burst analysis of freely-diffusing single-molecule FRET data: https://fretbursts.readthedocs.io |
| Imaging Buffer | N/A | System dependant; 5 mM NaCl, 20 mM MgCl2, 5 mM Tris pH 7.5 and 0.1 mg/mL BSA | |
| Immersion Oil | Olympus | IMMOIL-F30CC | |
| Jupyter notebooks | Project Jupyter | N/A | Open-source web application to create and share documents that contain live code, equations, visualizations and text; data analysis notebooks for smfBox can be found in the SI |
| Lens Tissue | ThorLabs | MC-5 | MC-50E is same item in bulk |
| Magnesium Chloride | Merck | M2670 | System dependant; imaging buffer component (20 mM in buffer) |
| MilliQ/Ultrapure water | N/A | ||
| Nanopoistioner | Piezoconcept | FOC300 | Nanopositioner for accurate positioning of microscope objective |
| NHS-ester modified ATTO-550 | ATTO-TEC | AD 550-31 | 1 mg, AD 550-35 (5 mg) |
| NHS-ester modified ATTO-647N | ATTO-TEC | AD 647N-31 | 1 mg, AD 647N-35 (5 mg) |
| Objective lens | Olympus | N1480700 | Olympus objective series from orignal smfBox discontinued; replaced by N5702300 |
| OMICRON Control Center (OCC)- laser control center | OMICRON | N/A | v3.5.34 - OMICRON laser driver software |
| Press-To-Seal silicone isolator | Grace Bio-Labs | 664201 | 8-9 mm Diameter x 1.7 mm Depth |
| smOTTER | N/A | N/A | Open-source acquisition software for the Craggs Lab smfBox: https://github.com/craggslab/smOTTER |
| Sodium Chloride | Merck | S7653 | System dependant; imaging buffer component (5 mM in buffer) |
| Tris base | Merck | 93362 | System dependant; imaging buffer component (5 mM, pH 7.5 in buffer) |
| Type I ultrapure water | Merck | ZIQ7000T0 | Milli-Q® IQ 7000 Ultrapure Water System |
Ссылки
- Forster, T. Intermolecular energy migration and fluorescence. Annals of Physics. 437 (1-2), 55-75 (1948).
- Stryer, L., Haugland, R. P. Energy transfer: a spectroscopic ruler. Proceedings of the National Academy of Sciences. 58 (2), 719-726 (1967).
- Hohlbein, J., et al. Conformational landscapes of DNA polymerase I and mutator derivatives establish fidelity checkpoints for nucleotide insertion. Nature Communications. 4 (1), 2131 (2013).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Förster resonance energy transfer. Science. 359 (6373), (2018).
- Hohlbein, J., Craggs, T. D., Cordes, T. Alternating-laser excitation: single-molecule FRET and beyond. Chemical Society Reviews. 43 (4), 1156-1171 (2014).
- Lerner, E., et al. The FRET-based structural dynamics challenge -- community contributions to consistent and open science practices. arXiv. , (2020).
- Hellenkamp, B., Wortmann, P., Kandzia, F., Zacharias, M., Hugel, T. Multidomain structure and correlated dynamics determined by self-consistent FRET networks. Nature Methods. 14 (2), 174-180 (2017).
- Craggs, T. D., et al. Substrate conformational dynamics facilitate structure-specific recognition of gapped DNA by DNA polymerase. Nucleic Acids Research. 47 (20), 10788-10800 (2019).
- Tsytlonok, M., et al. Dynamic anticipation by Cdk2/Cyclin A-bound p27 mediates signal integration in cell cycle regulation. Nature Communications. 10 (1), 1676 (2019).
- Nagy, J., et al. Complete architecture of the archaeal RNA polymerase open complex from single-molecule FRET and NPS. Nature Communications. 6 (1), 6161 (2015).
- LeBlanc, S. J., et al. Coordinated protein and DNA conformational changes govern mismatch repair initiation by MutS. Nucleic Acids Research. 46 (20), 10782-10795 (2018).
- Segal, M., et al. High-throughput smFRET analysis of freely diffusing nucleic acid molecules and associated proteins. Methods. 169, 21-45 (2019).
- Kapanidis, A. N., et al. Fluorescence-aided molecule sorting: Analysis of structure and interactions by alternating-laser excitation of single molecules. Proceedings of the National Academy of Sciences. 101 (24), 8936-8941 (2004).
- Kapanidis, A. N., et al. Alternating-laser excitation of single molecules. Accounts of Chemical Research. 38 (7), 523-533 (2005).
- Müller, B. K., Zaychikov, E., Brauchle, C., Lamb, D. C. Pulsed interleaved excitation. Biophysical Journal. 89 (5), 3508-3522 (2005).
- Laurence, T. A., Kong, X., Jager, M., Weiss, S. Probing structural heterogeneities and fluctuations of nucleic acids and denatured proteins. Proceedings of the National Academy of Sciences of the United States of America. 102 (48), 17348-17353 (2005).
- Pollina, T., et al. PlanktonScope: Affordable modular imaging platform for citizen oceanography. bioRxiv. , 056978 (2020).
- Collins, J. T., et al. Robotic microscopy for everyone: the OpenFlexure microscope. Biomedical Optics Express. 11 (5), 2447-2460 (2020).
- Courtney, A., Alvey, L. M., Merces, G. O. T., Burke, N., Pickering, M. The Flexiscope: a low cost, flexible, convertible and modular microscope with automated scanning and micromanipulation. Royal Society Open Science. 7 (3), 191949 (2020).
- Martens, K. J. A., et al. Visualisation of dCas9 target search in vivo using an open-microscopy framework. Nature Communications. 10 (1), 3552 (2019).
- Auer, A., et al. Nanometer-scale multiplexed super-resolution imaging with an economic 3D-DNA-PAINT microscope. ChemPhysChem. 19 (22), 3024-3034 (2018).
- Li, H., et al. Squid: Simplifying quantitative imaging platform development and deployment. bioRxiv. , 424613 (2020).
- Ambrose, B., et al. The smfBox is an open-source platform for single-molecule FRET. Nature Communications. 11 (1), 5641 (2020).
- Ingargiola, A., Laurence, T., Boutelle, R., Weiss, S., Michalet, X. Photon-HDF5: An open file format for timestamp-based single-molecule fluorescence experiments. Biophysical Journal. 110 (1), 26-33 (2016).
- Hellenkamp, B., et al. Precision and accuracy of single-molecule FRET measurements-a multi-laboratory benchmark study. Nature Methods. 15 (9), 669-676 (2018).
- Ingargiola, A., Lerner, E., Chung, S., Weiss, S., Michalet, X. FRETBursts: An open source toolkit for analysis of freely-diffusing single-molecule FRET. PLOS One. 11 (8), 0160716 (2016).
- Torella, J. P., Holden, S. J., Santoso, Y., Hohlbein, J., Kapanidis, A. N. Identifying molecular dynamics in single-molecule FRET experiments with burst variance analysis. Biophysical Journal. 100 (6), 1568-1577 (2011).
- Tomov, T. E., et al. Disentangling subpopulations in single-molecule FRET and ALEX experiments with photon distribution analysis. Biophysical Journal. 102 (5), 1163-1173 (2012).
- Santoso, Y., Torella, J. P., Kapanidis, A. N. Characterizing single-molecule FRET dynamics with probability distribution analysis. ChemPhysChem. 11 (10), 2209-2219 (2010).
- Kalinin, S., Valeri, A., Antonik, M., Felekyan, S., Seidel, C. A. M. Detection of structural dynamics by FRET: A photon distribution and fluorescence lifetime analysis of systems with multiple states. The Journal of Physical Chemistry B. 114 (23), 7983-7995 (2010).
- Pirchi, M., et al. Photon-by-photon hidden Markov model analysis for microsecond single-molecule FRET kinetics. The Journal of Physical Chemistry B. 120 (51), 13065-13075 (2016).
- Schrimpf, W., Barth, A., Hendrix, J., Lamb, D. C. PAM: A framework for integrated analysis of imaging, single-molecule, and ensemble fluorescence data. Biophysical Journal. 114 (7), 1518-1528 (2018).
- Zijlstra, N., et al. Rapid microfluidic dilution for single-molecule spectroscopy of low-affinity biomolecular complexes. Angewandte Chemie International Edition. 56 (25), 7126-7129 (2017).
- Hellenkamp, B., Thurn, J., Stadlmeier, M., Hugel, T. Kinetics of transient protein complexes determined via diffusion-independent microfluidic mixing and fluorescence stoichiometry. The Journal of Physical Chemistry B. 122 (49), 11554-11560 (2018).
- Bennet, I. A., et al. Regional conformational flexibility couples substrate specificity and scissile phosphate diester selectivity in human flap endonuclease 1. Nucleic Acids Research. 46 (11), 5618-5633 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены