Method Article
Расширенное управление сердечным ритмом путем применения оптогенетической многосайтовой фотостимуляции в мышечных сердцах
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной работе сообщается о методе управления сердечным ритмом интактных мышей мышей трансгенного каналаrhodopsin-2 (ChR2) с использованием локальной фотостимуляции с микро-светодиодной решеткой и одновременным оптическим картированием эпикардиального мембранного потенциала.
Аннотация
Желудочковые тахиаритмии являются основной причиной смертности и заболеваемости во всем мире. Электрическая дефибрилляция с использованием высокоэнергетических электрических ударов в настоящее время является единственным методом лечения опасной для жизни фибрилляции желудочков. Тем не менее, дефибрилляция может иметь побочные эффекты, включая невыносимую боль, повреждение тканей и ухудшение прогноза, что указывает на значительную медицинскую необходимость в разработке более мягких стратегий управления сердечным ритмом. Помимо энергосберегающих электрических подходов, сердечная оптогенетика была введена в качестве мощного инструмента для воздействия на сердечную деятельность с использованием светочувствительных мембранных ионных каналов и световых импульсов. В настоящем исследовании будет описан надежный и действительный метод успешной фотостимуляции перфузионных неповрежденных мышечных сердец Лангендорфа, основанный на многосайтовом темпе с применением массива микросветодов (микро-LED) размером 3 x 3. Одновременное оптическое картирование волн напряжения эпикардиальной мембраны позволяет исследовать эффекты региональной стимуляции и оценивать вновь индуцированную сердечную деятельность непосредственно на месте. Полученные результаты показывают, что эффективность дефибрилляции сильно зависит от параметров, выбранных для фотостимуляции при сердечной аритмии. Будет продемонстрировано, что освещенная область сердца играет решающую роль для успеха прерывания, а также как может быть достигнут целенаправленный контроль сердечной деятельности во время освещения для изменения паттернов аритмии. Таким образом, данная методика дает возможность оптимизировать манипулирование механизмом на месте на пути к контролю обратной связи сердечного ритма в режиме реального времени и, с учетом специфики региона, новые подходы к снижению потенциального вреда для сердечной системы по сравнению с использованием неспецифических приложений электрошока.
Введение
Ранние исследования пространственно-временной динамики при аритмии показали, что сложные электрические паттерны при фибрилляции сердца управляются вихреобразными вращающимися волнами возбуждения1. Это открытие дало новое представление об основных механизмах аритмии, что затем привело к разработке новых методов лечения электрического терминирования, основанных на многосайтовом возбуждении миокарда 2,3,4. Тем не менее, лечение с использованием стимуляции электрического поля является нелокальным и может иннервировать все окружающие возбудимые клетки, включая мышечную ткань, вызывая повреждение клеток и тканей, а также невыносимую боль. В отличие от электротерапии, оптогенетические подходы обеспечивают специфическую и тканезащитную технику для вызова потенциалов действия кардиомиоцитов с высокой пространственной и временной точностью. Таким образом, оптогенетическая стимуляция имеет потенциал для минимально инвазивного контроля хаотических паттернов активации во время фибрилляции сердца.
Введение светочувствительного канала ионного канала родопсина-2 (ChR2) в возбудимые клетки посредством генетических манипуляций 5,6,7 позволило деполяризовать мембранный потенциал возбудимых клеток с помощью фотостимуляции. Было разработано несколько медицинских приложений, включая активацию нейронных сетей, контроль сердечной деятельности, восстановление зрения и слуха, лечение травм спинного мозга и другие 8,9,10,11,12,13,14. Применение ChR2 в кардиологии имеет значительный потенциал благодаря миллисекундному времени отклика15, что делает его хорошо подходящим для целенаправленного контроля аритмической динамики сердца.
В этом исследовании показана многосайтовая фотостимуляция неповрежденных сердец трансгенной мышиной модели. Таким образом, трансгенная линия мышей альфа-MHC-ChR2 была создана в рамках Седьмой рамочной программы Европейского сообщества FP7/2007-2013 (HEALTH-F2-2009-241526) и любезно предоставлена профессором С. Э. Ленартом. В целом, трансгенные взрослые самцы C57/B6/J, экспрессирующие Cre-рекомбиназу под контролем альфа-MHC, были спаренны для спаривания с женскими B6.Cg-Gt(ROSA)26Sortm27.1(CAG-COP4*H134R/tdTomato)Hye/J. Поскольку сердечная стоп-кассета была удалена во втором поколении, потомство показало стабильную экспрессию MHC-ChR2 и использовалось для поддержания сердечных фоточувствительных колоний. Все эксперименты проводились со взрослыми мышами обоих полов в возрасте 36 – 48 недель. Освещение достигается с помощью микро-светодиодной решетки 3 x 3, изготовленной, как описано в16,17, за исключением того, что корпус на основе кремния и короткие оптические стеклянные волокна не реализованы. Его первое использование в кардиологическом применении обнаружено в18. Линейный микро-светодиодный массив, основанный на аналогичной технологии изготовления, был применен в качестве проникающего зонда для кардиостимуляции19. Микросветодиоды расположены в массиве 3 x 3 с шагом 550 мкм, обеспечивая как высокое пространственное разрешение, так и высокую мощность излучения на очень небольшой площади. Авторы демонстрируют в этой работе универсальную локальную многосайтовую фотостимуляцию, которая может открыть путь для разработки новых методов антиаритмической терапии.
Следующий экспериментальный протокол включает ретроградную перфузию Лангендорфа ex vivo, для которой каннулированная аорта функционирует как перфузионное входное отверстие. Из-за приложенного перфузионного давления и сердечного сокращения перфусат протекает через коронарные артерии, которые ответвляются от аорты. В представленной работе сердце перфузируется с использованием установки постоянного давления, достигаемой путем подъема резервуаров перфусата на высоту 1 м, что эквивалентно 73,2 мм рт.ст., что дает скорость потока 2,633 ± 0,583 мл/мин. Два вида раствора Тирода используются в качестве перфусата во время эксперимента. Раствор Обычного Тирода поддерживает стабильный синусовый ритм, тогда как раствор Low-K+ Tyrode смешивается с Пинацидилом, чтобы обеспечить индукцию аритмии в сердцах мышей. Использование шестиугольной водяной бани позволяет наблюдать за сердцем через шесть различных плоских окон, что позволяет соединять несколько оптических компонентов с меньшим искажением при преломлении.
протокол
Все эксперименты строго соответствовали правилам благополучия животных, в соответствии с немецким законодательством, местными условиями и в соответствии с рекомендациями Федерации европейских ассоциаций лабораторных животных (FELASA). Заявка на одобрение экспериментов на животных была одобрена ответственным органом по защите животных, и обо всех экспериментах было сообщено нашим представителям по защите животных.
1. Подготовка эксперимента и материалы
- Настройка оптического картографирования
ПРИМЕЧАНИЕ: Оптическая установка, а также электрическая установка показаны на рисунке 1. Все компоненты, используемые в оптической и электрической установке, подробно перечислены в Таблице материалов.- Используйте светодиоды 1 и светодиоды 2 для индукции аритмии и резервной дефибрилляции. Выбирайте мощные светодиоды с длиной волны λсинего цвета около 475 нм, что является пиком длины волны возбуждения ChR26. Для дальнейшего сужения оптического спектра используйте полосовой фильтр 470 ± 20 нм.
ПРИМЕЧАНИЕ: В этой работе светодиоды 1 и светодиоды 2 имеют типичный поток излучения от 3,9 до 5,3 Вт, согласно техническому описанию20. - Осветите эпикард для оптического картографирования мощным красным светодиодом (светодиод 3 на рисунке 1), который излучает свет с центральной длиной волны λкрасный = 625 нм и лучистым потоком 700 мВт21. Красный свет фильтруется с помощью полосового фильтра 628 ± 20 нм и отражается дихроичным зеркалом с длинным проходом (DM) с длиной волны отсечки λDM = 685 нм.
- Используйте эмиссионный фильтр с λфильтром-кулачком = 775 ± 70 нм перед объективом камеры, чтобы записывать только флуоресцентное излучение сердечной деятельности. Используйте быстрый объектив, который хорошо подходит для приложений при слабом освещении.
ПРИМЕЧАНИЕ: Частота фибрилляции сердца мыши колеблется от 20 до 35 Гц; поэтому используйте достаточно быструю камеру для записи с частотой от 1 до 2 кГц или даже выше.
- Используйте светодиоды 1 и светодиоды 2 для индукции аритмии и резервной дефибрилляции. Выбирайте мощные светодиоды с длиной волны λсинего цвета около 475 нм, что является пиком длины волны возбуждения ChR26. Для дальнейшего сужения оптического спектра используйте полосовой фильтр 470 ± 20 нм.
- Микро-светодиодный массив
ПРИМЕЧАНИЕ: Микро-светодиодные массивы, применяемые здесь, реализованы с использованием обработки микросистем, как более подробно описано в другом месте16,17.- Спиновое покрытие полиимидным слоем (PI) толщиной 5 мкм на 4-дюймовые кремниевые подложки (односторонние полированные, толщиной 525 мкм).
- Отвержьте этот слой PI при максимальной температуре 450 °C под атмосферой азота. Держите максимальную температуру постоянной в течение 10 минут.
- Нанесение и нанесение рисунка фоторезиста разворота изображения (PR) с использованием ультрафиолетовой (УФ) литографии и напыления 250-нм тонкого платинового слоя (Pt).
- Утолщите эту металлизацию на основе Pt путем гальванического покрытия золотого слоя (Au) толщиной 1 мкм с узорчатым PR, служащим маскирующим слоем.
- Перед спин-покрытием второго слоя PI подвергайте пластину с ее первым слоем PI и металлизацией Au-гальваническим покрытием кислородной плазме, которая химически активирует поверхность слоя PI.
- Отвержьте второй слой PI снова при 450 °C, примените УФ-литографию для создания слоя PR и откройте контактные площадки массива для микро-светодиодных чипов и сопряженной печатной платы (PCB) путем реактивного ионного травления (RIE), используя узорчатый PR в качестве маскирующего слоя.
ПРИМЕЧАНИЕ: На этом этапе процесса RIE рекомендуется применять 200 Вт и 100 Вт в течение 10 и 30 минут соответственно, чтобы определить отверстия контактной площадки, а также внешнюю форму двумерной (2D) микро-светодиодной решетки. - Очистите ПР с помощью растворителей и плазменного травления. Дополнительно утолщайте контактные прокладки путем гальванического покрытия дополнительным слоем золота толщиной 6 мкм.
- Прикрепите микро-светодиодные чипы к контактным площадкам с помощью откидного чип-бондера.
- Активируйте поверхность PI в кислородной плазме и наполните микро-светодиодные чипы клеем без растворителя. Затем отверждают клей в течение 12 ч при 120 °C.
- Чтобы инкапсулировать микро-светодиодные чипы, выполните еще одну плазменную обработку аргоном и нанесите тонкий фторполимерный слой вручную. Предварительно отверждайте этот слой при 80 °C в течение 1 ч.
- Вручную нанесите силикон в качестве конечного слоя инкапсуляции после воздействия микро-светодиодного массива на кислородную плазму, используемую для улучшения адгезии кремния к нижележащему фторполимерному слою. Отвержьте силиконовый слой при 80 °C и 180 °C в течение 1 ч каждый. Эти заключительные этапы отверждения также полностью отверждают слой фторполимера.
- Припаяйте контактные подушечки подложки PI к печатной плате, которая несет ленточные разъемы для соединения массива с внешними приборами. Накройте паяльные прокладки на печатной плате с помощью клея.
- Электрическая установка
- Используйте электроды, подходящие для записи электрокардиограммы (ЭКГ), например, электроды серебра / серебра или монофазные электроды с потенциалом действия (MAP) и усилитель ЭКГ для непрерывного мониторинга электрической активности сердца. Кроме того, используйте соответствующее устройство сбора (AD) для записи всех полученных электрических сигналов.
- Выберите хорошо подходящий драйвер для мощных светодиодов (LED 1, LED 2 и LED 3), который может управлять максимальным током, подаваемым на каждое устройство. Используйте генератор произвольных функций (AFG) для точного управления выходом светодиодных драйверов.
- Используйте многоканальный светодиодный драйвер для управления током, протекающим через массив микро-светодиодов. AFG с несколькими выходами также подходит для этой задачи.
ПРИМЕЧАНИЕ: Желательно выбирать светодиодные драйверы, ограничивающие ток до максимального тока микро-светодиода, иначе диоды могут быть повреждены. Один из примеров многоканального микро-светодиодного драйвера описан в другой работе18. При необходимости AFG или любой другой светодиодный драйвер может быть подключен к компьютеру для удаленного управления настройками микро-светодиодов. В этом случае подключите светодиодный драйвер к компьютеру с помощью выбранного вами протокола связи, например, шины интерфейса общего назначения (GPIB) или последовательного подключения.
2. Экспериментальные процедуры
- Приготовление раствора
- Приготовьте раствор Тирода: 130 мМ NaCl, 4 мМ KCl, 1 мМ MgCl2, 24 мМ NaHCO3, 1,8 мМ CaCl2, 1,2 мМ KH2PO4, 5,6 мМ глюкозы, 0,1% BSA/Альбумина.
- Приготовьте раствор Low-K+ Tyrode: Low-K+ Tyrode производится так же, как и раствор обычного Тирода, за исключением того, что добавляется только половина количества KCl (2 мМ вместо 4 мМ KCl).
ПРИМЕЧАНИЕ: Для эксперимента продолжительностью 3 ч обычно достаточно 2-3 л Тирода Low-K+ (дополнительно смешанного с Блеббистатином (Шаг 2.1.5), если выполняется оптическое отображение) и 1-2 л обычных Тиродов. - Добавьте Пинацидил в раствор тирода Low-K+ , чтобы облегчить процесс индукции аритмии, как описано в22, для получения концентрации 100 мМ. Надевайте защитные лабораторные перчатки при обращении с Пинацидилом.
- Приготовьте 1 мл 50 мкМ DI-4-ANBDQPQ с обычным раствором Тирода. Защитите краситель от света, чтобы предотвратить фотоотбеливание.
- Сделайте 10 мМ раствора Блеббистатина. Для оптического картирования смешайте Блеббистатин с раствором Пинацидила-Тирода 100 мМ (этап 2.1.3) для получения раствора 5 мкМ. Надевайте защитные лабораторные перчатки при обращении с Блеббистатином.
ПРИМЕЧАНИЕ: Держите краситель и раствор Блеббистатина в стороне до начала оптического картирования.
- Перфузия Лангендорфа
ПРИМЕЧАНИЕ: Установка состоит из двух резервуаров для двух решений Tyrode. Они соединены с пузырьковой ловушкой через трубки с трехсторонними петухами. Позже сердце прикрепляется к пузырьковой ловушке с помощью разъема замка Luer, а затем подвешивается на шестиугольной водяной бане. Водяная баня, в свою очередь, соединена с контейнером для отходов для сбора использованного раствора Tyrode.- Очищайте все трубки перед каждым экспериментом полностью деминерализованной водой.
- Аэрировать оба раствора Тирода карбогеном (5%СО2 и 95%О2) в течение 30 мин при комнатной температуре до начала эксперимента. Отрегулируйте значение pH растворов Tyrode до 7,4 с naOH.
- Заполните 500 мл раствора каждого тирода в соответствующий резервуар и деаэрируйте трубки, а также пузырьковую ловушку, пропуская раствор Тирода через перфузионную систему до тех пор, пока в трубках или в пузырьковой ловушке больше не будут видны захваченные пузырьки воздуха.
- Продолжайте аэрировать растворы Тирода в течение всего эксперимента в резервуарах карбогеном, чтобы гарантировать, что рН перфусата остается стабильным позже во время перфузии.
- Нагрейте перфузионную систему до 37 °C с помощью водяного теплового насоса. Поддерживайте постоянную температуру перфузата в пределах водяной бани, используя дополнительный нагревательный элемент, такой как водонепроницаемый нагревательный кабель.
ПРИМЕЧАНИЕ: Во время эксперимента крайне важно пополнить резервуары Тирода, прежде чем они опустеют. В противном случае пузырьки воздуха могут попасть в сердце, что может закупорить сосуды и привести к ишемии.
- Подготовка мыши
- Вводят подкожно 0,1 мл 500 т.е. гепарина за 30 мин до процедуры изоляции сердца.
- Наполните чашку Петри размером 6 см и шприц объемом 2 мл ледяным раствором Тирода. Поместите под стереоскопический микроскоп.
- Выполняют кратковременную анестезию мышей насыщенной изофлурановой средой в течение 2 мин и немедленный вывих шейки матки после этого.
ПРИМЕЧАНИЕ: Для проверки достаточной анестезии абсолютно необходима проверка отрицательного межпалого рефлекса. - Откройте грудную клетку, извлеките сердце, как описано в другом месте23, и поместите его в чашку Петри 6 см с ледяным раствором Тирода. Сердцебиение будет уменьшено из-за перепада температуры.
- Делайте тонкую подготовку под стереоскопическим микроскопом, как описано в другом месте23. Прикрепите аорту к тупой игле и зафиксируйте сосуд шовным материалом.
- В качестве контроля введите ледяной раствор Тирода через иглу в сердце и проверьте, что сердце плотно установлено. Этот шаг также смывает оставшуюся кровь из сердца.
- Перенесите установленное сердце в перфузионную систему. Убедитесь, что перфусат течет, чтобы предотвратить попадание воздуха в сердце, соединяя иглу с пузырьковой ловушкой. Убедитесь, что сердце покрыто раствором Тирода на водяной бане. Этапы 2.3.4, 2.3.5 и 2.3.7 проиллюстрированы на рисунке 2.
- Убедитесь, что сердце начинает биться в течение нескольких минут. Дайте сердцу адаптироваться к перфузионной установке в течение 15-20 минут, затем переключитесь на раствор Тирода с низким K+ с Пинацидилом (Шаг 2.1.3) соответственно раствор с низким K+ Тиродом с Пинацидилом и Блеббистатином (Шаг 2.1.5), если необходимо выполнить оптическое картирование.
- Индукция аритмии и оптическая дефибрилляция
- Поместите один из электродов ЭКГ как можно ближе к поверхности сердца, чтобы обеспечить хорошее качество сигнала. Приостановить второй электрод ЭКГ в растворе тирода. Убедитесь, что приобретенная ЭКГ регистрируется АД по выбору.
- Поместите микро-светодиодный массив на область, представляющую интерес для исследования, например, на левый желудочек.
- Замените перфузию на низкокризисную тирод с пинацидилом и перфузируйте сердце в течение 15-30 минут.
- Чтобы вызвать аритмию, освещают сердце светодиодами 1 и светодиодами 2 поездом от 20 до 50 световых импульсов с частотой find от 25 до 35 Гц, длительностью импульса Wind от 2 до 15 мс и интенсивностью света LIopt_ind 2,8 мВт мм-2.
- Повторяйте процесс до тех пор, пока не будет вызвана аритмия.
ПРИМЕЧАНИЕ: Аритмии легко идентифицировать в сигнале ЭКГ, поскольку частота и морфология сигнала отличаются от нормального синусового ритма. Если аритмия закончится в течение следующих 5 с, классифицируйте ее как самозавершенную и начните новую попытку индукции. - После визуального обнаружения устойчивой аритмии применяют всплеск импульсов с разной шириной Wdef и частотами fdef, используя три, шесть или девять микросветодиодов массива при пульсирующем токе Iимпульс 15 мА, уступая интенсивности света LIμLED = 33,31 ± 2,05 мВт мм-2.
- Если аритмия продолжится после пяти испытаний дефибрилляции на основе микро-светодиодных массивов, классифицируйте попытку как неудачную и начните резервную дефибрилляцию.
- Для резервной дефибрилляции используйте светодиоды 1 и 2, используя те же параметры синхронизации, что и для массива микро-светодиодов.
ПРИМЕЧАНИЕ: Поскольку сердце подвергается ишемическому и метаболическому стрессу в течение всего экспериментального периода, возможно, что попытки прекращения аритмии не увенчались успехом даже при резервной дефибрилляции. Всякий раз, когда это происходит, замените перфузионный раствор на обычный тирод и дайте сердцу восстановиться в течение 5-10 минут. Когда ЭКГ вернется к синусовому ритму, повторите протокол из Шага 2.4.3 еще раз.
- Оптическое картографирование
- Наполните сердце раствором Блеббистатина, приготовленным на этапе 2.1.5, и подождите, пока не произойдет механическое разъединение. Это достигается, когда сердце перестает биться, но сигнал ЭКГ все еще измерим.
ПРИМЕЧАНИЕ: Смешивание раствора Блеббистатина с указанной концентрацией и поддержание сердца перфузированным этим раствором поддерживает механическую активность сердца, не связанную с электрической активностью в течение всего эксперимента. - Дайте краситель напряжения 1 мл DI-4-ANBDQPQ (полученный на этапе 2.1.4) в качестве болюса в пузырьковой ловушке перфузии Лангендорфа. Подождите от 5 до 10 минут, чтобы краситель равномерно перфузировал в сердце.
ПРИМЕЧАНИЕ: Избегайте фотоотбеливания красителя, выключая красный свет всякий раз, когда запись не производится. Если отношение сигнал/шум записи становится слишком малым (полученный сигнал слишком шумный), повторите шаги 2.1.4 и 2.5.2. - Сфокусируйте камеру на поверхности сердца, включите светодиод 3 и примените оптическую мощность 1,27 мВт мм-2 .
- Выключите лабораторный свет и начните запись. Убедитесь, что оптический сигнал получен путем сравнения частоты полученного сигнала с частотой регистрируемой ЭКГ. Это гарантирует, что полученный оптический сигнал связан исключительно с электрической активностью сердца.
ПРИМЕЧАНИЕ: Поскольку флуоресцентный свет, излучаемый красителем, составляет очень много недель, оптическое картирование выполняется в темной комнате. Это позволяет избежать помех сигналу от любых других источников света.
- Наполните сердце раствором Блеббистатина, приготовленным на этапе 2.1.5, и подождите, пока не произойдет механическое разъединение. Это достигается, когда сердце перестает биться, но сигнал ЭКГ все еще измерим.
Результаты
Протокол допускает индукцию желудочковых аритмий в неповрежденных мышиных сердцах с помощью импульсов фотостимуляции, генерируемых светодиодами 1 и СВЕТОДИОДАМИ 2 (рисунок 1) с частотой find от 25 Гц до 35 Гц и длительностью импульса Wind от 2 мс до 10 мс. Обратите внимание, что цель таких быстрых световых импульсов заключается не в том, чтобы захватить сердечный ритм, а в том, чтобы разбалансировать сердечную деятельность, чтобы можно было генерировать неустойчивые электрические волны, которые затем облегчают аритмию. Преимущество индуцирования аритмии светом над индудукцией с помощью электрической стимуляции заключается в том, что на ЭКГ не провоцируются артефакты, обеспечивающие возможность пост-анализа приобретенного сигнала без ограничений и даже оценки электрической реакции сердца при быстром темпе, этот факт также дает возможность наблюдать за поведением сердца во время фотодефибрилляции. Это невозможно с помощью методов электрической индукции или дефибрилляции. Тем не менее, если используемая установка не позволяет использовать внешние мощные светодиоды, например, из-за ограничений места, на сердце может быть помещен дополнительный электрод для стимуляции, чтобы вызвать аритмию, как показано в другом месте 3,22,24.
Как только фибрилляция индуцирована, аритмия должна длиться не менее 5 секунд, чтобы убедиться, что она сохраняется, после чего начинаются попытки дефибрилляции на основе микро-светодиодов. Поскольку основные параметры сердечной аритмии, такие как базовая длина цикла или доминирующая частота, амплитуда и морфология, постоянно меняются, и поскольку на сегодняшний день невозможно предсказать, какие параметры фотодефибриляции обеспечивают наилучший результат, было весьма интересно понять, существует ли связь между частотой, шириной импульса, область фотостимуляции и скорости терминации. Поэтому была протестирована серия экспериментов с различными частотами fdef, количеством микросветодов и длительностью импульса Wdef , и был извлечен показатель успеха для N = 11 мышей, как показано на рисунке 3.
Можно продемонстрировать, что импульсы длительностью от 1 до 20 мс могут дефибрилляции с различными показателями успеха (рисунок 3). Поскольку интенсивность света LIμLED поддерживалась постоянной во время каждого импульса фотостимуляции, как упоминалось в шаге 2.4.6, а частота успеха трех микросветодиодов против девяти заметно ниже, представленные результаты свидетельствуют о том, что площадь, покрытая сердцем, количество микросветодиодов и, следовательно, общий приложенный поток излучения являются решающими факторами в достижении дефибрилляции. Учитывая, что каждый микро-светодиод на массиве является ламбертовским источником света и что они расположены непосредственно на поверхности сердца так, что приблизительное расстояние до ткани равно нулю, можно предположить, что контур излучения освещаемой области на сердце при использовании одного микро-светодиода эквивалентен AμLED = 0,059 мм², как также показано в25 для плоских прямоугольных светодиодов. Кроме того, хотя некоторые фотоны могут покидать микро-светодиоды сбоку от краев, вклад их в общую интенсивность света считается настолько малым, что их эффектом можно пренебречь. Чтобы количественно оценить облученный свет массива, авторы измерили поток излучения от микро-светодиодного массива с помощью коммерческого измерителя мощности и рассчитали интенсивность света, которая достигает сердца, как показано в таблице 1. Из таблицы 1 также можно прочитать, что поток излучения увеличивается с количеством используемых микросветодов, но интенсивность света остается постоянной из-за последствий профиля освещения, упомянутых ранее.
Интересно, что можно также отметить, что успешность девяти светодиодов с Wdef = 1 мс (рисунок 3a) и Wdef = 20 мс (рисунок 3d) на частоте дефибрилляции fdef = 18 Гц и fdef = 20 Гц являются сравнительно высокими. Учитывая, что средняя частота индуцированных аритмий составляет 22,55 ± 4,03 Гц, этот факт может указывать на то, что для мышечных сердец ChR2 частота успеха значительно увеличивается, чем ближе частота темпа к частоте аритмии. Это также показано в численном моделировании26. Однако это не может быть легко обобщено, потому что доминирующая частота сложных аритмий постоянно меняется. Чтобы проиллюстрировать это, на рисунке 4 показаны две различные попытки дефибрилляции с fdef = 14 Гц. В начале сегмента ЭКГ на рисунке 4а) и по морфологии сигнала ЭКГ показана фибрилляция желудочков (ВФ). Когда начинается микро-светодиодная фотостимуляция, фибрилляция превращается в более упорядоченную картину, которая, скорее всего, будет желудочковой тахикардией (VT). Всякий раз, когда микро-светодиодная решетка отключается, исходные хаотические волны VF снова берут верх. Таким образом, аритмия не прекращается. Хотя в этом примере VF не может быть завершен заданными параметрами, он нарушается и может быть изменен на более регулярный шаблон (VT). Рисунок 4b Сегмент 1 показывает, что доминирующая частота 24 Гц немного увеличивается до тех пор, пока не начнется фотостимуляция и VF не превратится в VT в сегменте 2, где доминирующая частота не упадет до 14 Гц. Кроме того, на рисунке 4c показан VT, который может быть завершен тем же fdef , что и на рисунке 4a, но с другим Wdef. Во-первых, микро-светодиодная фотостимуляция изменяет морфологию аритмии, чтобы окончательно прекратить ее с захватом 1: 1 с шагом от19-го импульса и далее. Эти результаты могут означать, что параметры фотодефибрилляции, например Wdef, должны адаптироваться к изменению морфологии аритмии с течением времени. Эксперименты, приведшие к этим результатам, проводились без использования Блеббистатина из-за результирующего изменения продолжительности потенциала действия (APD)27. Поэтому в этих рядах не проводилось оптического картографирования.
Другой набор экспериментов был выполнен для оптического картирования с использованием потенциометрического красителя с красным смещением (шаг 2.1.4). Оптическое картографирование с помощью высокоскоростных камер позволяет наблюдать распространяющиеся волны возбуждения на поверхности сердца во время синусового ритма (рисунок 5) и сложные тахиаритмии28. Поскольку дробное изменение потенциометрического красителя очень низкое, полученные видео были предварительно обработаны с использованием математического языка программирования. Первым шагом по улучшению качества оптических сигналов является удаление шума с помощью гауссовского сглаживающего фильтра со стандартным отклонением σ = 1, за которым следует полосовой фильтр с угловыми частотами fhigh = 0,1 Гц и flow = 70 Гц. Полоса остановок наf high удаляет медленные изменения в сигнале, которые не связаны с синусовой частотой сердца, которая находится между 3 Гц < fсинусом < 8 Гц, в то время как стоп-полоса flow удаляет высокочастотный шум, который захватывается камерой. Важно отметить, что как излучение синего света от светодиода 1, светодиода 2, так и от массива микро-светодиодов может вызвать перекрестные помехи и очень высокий сигнал помех в оптическом отображении. Кроме того, было отмечено, что даже очень узкий полосовой фильтр перед камерой сфильтром-кулачком по длине волны λ, как упоминалось на этапе 1.2.3, не будет отфильтровывать влияние синего света. Это может быть частично вызвано реакцией возбуждения самого красителя. Поэтому будьте очень внимательны при выборе оптики для оптического картографирования. Для средств видеоанализа все кадры, в которых был записан синий свет, должны были быть оставлены так, что во многих случаях невозможно визуализировать сердце во время фотостимуляции, как также упоминалось в другом исследовании29.
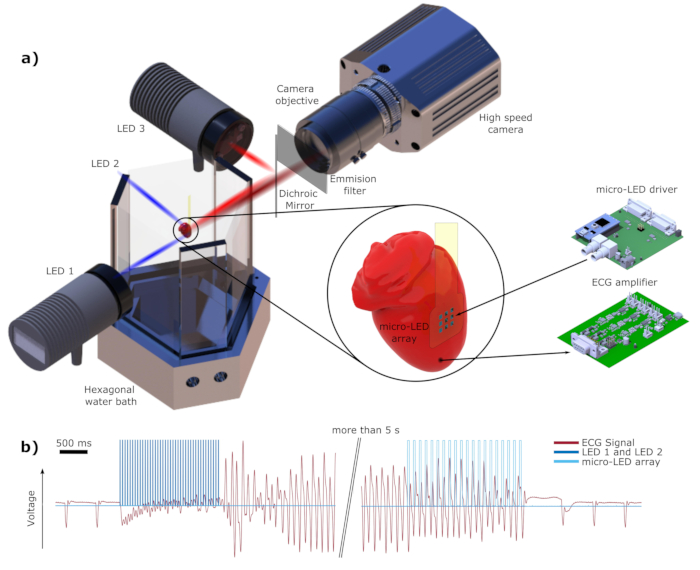
Рисунок 1: Схема электрической и оптической установки. (а) Светодиоды 1 и СВЕТОДИОДы 2 обеспечивают источник синего света, используемый для индукции аритмии и резервной дефибрилляции. Светодиод 3 используется в качестве источника света возбуждения для красителя красного смещения DI-4-ANBDQPQ. Красный свет направляется на сердце с помощью дихроичного зеркала DM. Излучающий свет, показанный темно-красным цветом, записывается высокоскоростной камерой через эмиссионный фильтр, как указано в тексте. Электроды LED 2 и ЭКГ не показаны для простоты. b) один сегмент регистрируемого сигнала ЭКГ, показанный красным цветом. Темно-синим цветом показаны световые импульсы от светодиодов 1 и светодиодов 2 начастоте f ind = 35 Гц и Wind = 4 мс, используемые для индуцирования фибрилляции. Сразу после окончания светового раздражителя может наблюдаться фибрилляция желудочков (VF). Фотостимуляция на основе микро-светодиодов, показанная светло-синим цветом (fdef = 16 Гц, Wdef = 20 мс), успешно завершает аритмию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Подготовка сердца. (а) Открытая грудная клетка мыши, показывающая неповрежденное сердце и окружающие органы. b) эксплантированное сердце, погруженное в ледяной раствор Тирода для дальнейшего приготовления. (c) Сердце мыши правильно прикреплено к тупой игле. d) мышевидное сердце, взвешенное в растворе Тирода. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
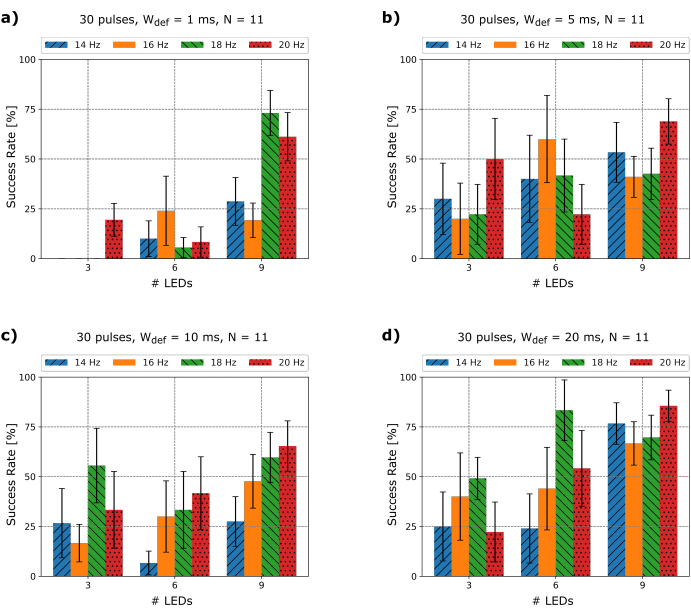
Рисунок 3: Экспериментально извлеченные показатели успеха. Показатели успеха для 30 импульсов фотостимуляции на основе микро-светодиодов с использованием трех, шести и девяти светодиодов при разной длительности импульса Wdef и частотах fdef для N = 11. Полосы ошибок, показанные со стандартной погрешностью среднего значения S.E.M. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Манипулирование сердечным ритмом с помощью фотостимуляции. (а) Сегмент ЭКГ, регистрирующий необозначенную аритмию. b) спектрограмма ЭКГ, показанная на панели а. Спектральная плотность мощности (PSD) сегмента (1) показывает аритмию с доминирующей частотой 24 Гц. Сегмент (2) фотостимуляции с указанными параметрами. Можно наблюдать, что доминирующая частота опускается до 14 Гц. Сегмент (3) Неудачное завершение и возвращение к аритмическому поведению с доминирующей частотой 24 Гц. (в) ЭКГ успешной попытки дефибрилляции. d) спектрограмма успешного прекращения, показанная на панели с. Сегмент (1) показывает желудочковую тахикардию (VT) с доминирующей частотой 23 Гц. Сегмент (2) фотостимуляции с использованием показанных настроек. Сегмент (3) отображает успешное окончание, что приводит к нормальному синусовому ритму с фундаментальной частотой 3,5 Гц и результирующими гармониками. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
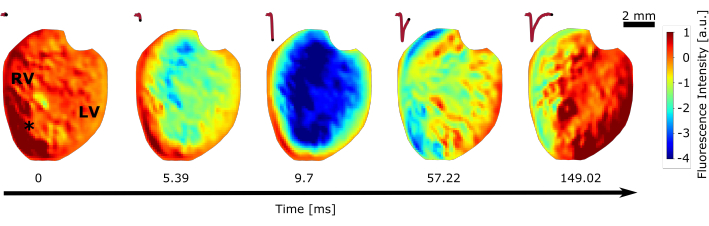
Рисунок 5: Оптическое отображение всего сердца. Показано изменение интенсивности флуоресценции во время одного единственного удара сердца в нормальном синусовом ритме. Сердце было расположено лицом к камере так, чтобы были видны правый и левый желудочки (RV, LV). Звездочка показывает пиксель, при котором был взят потенциал действия, показанный сверху. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Количество микроСВЕТОД | Облученная область Aμled [мм2] | поток излучения φ [мВт] | Интенсивность света LI [мВт мм-2] |
| 3 | 0.178 | 5.9 ± 0.47 | 33.11 ± 2.66 |
| 6 | 0.356 | 11.91 ± 0.84 | 33.42 ± 2.37 |
| 9 | 0.535 | 17.85 ± 0.61 | 33.39 ± 1.14 |
Таблица 1: Измеренный поток излучения микро-светодиодной решетки и соответствующая интенсивность света.
Обсуждение
Успешное лечение сердечных тахиаритмий является ключом к сердечной терапии. Однако биофизические механизмы, лежащие в основе инициирования, увековечения и прекращения аритмии, до конца не изучены. Поэтому кардиологические исследования направлены на оптимизацию электрошоковой терапии в сторону более щадящего прекращения аритмий, тем самым повышая качество жизни пациентовна 28,29,30,31. Низкоэнергетические электрические подходы обещают значительное снижение серьезных побочных эффектов, однако все еще могут вызывать нежелательное мышечное возбуждение. Сердечная оптогенетика может преодолеть это ограничение и обеспечить не только щадящую ткань технику терминации, но и гибкую платформу для исследования специфического для аритмии целенаправленного контроля вихроподобных волн возбуждения в неповрежденном мышином сердце и в клеточных культурах32,33.
Учитывая эту мотивацию, была разработана и внедрена надежная установка фотостимуляции, а также протокол, предлагающий высоко адаптируемую оптическую систему, которая может быть легко расширена до трехмерных панорамных оптических картографических исследований34.
Можно показать, что сердечные аритмии могут быть успешно прекращены с различными показателями успеха в зависимости от параметров, которые выбраны для фотостимуляции, например, освещенная область на сердце. Представленные результаты свидетельствуют о том, что увеличение облученной поверхности рекрутировало критическое количество кардиомиоцитов, гасящих хаотическую активность посредством блока проводимости, как также показано на22. В этом исследовании энергия, необходимая для фотодефибрилляции, составляет E = 10,69 ± 0,37 мДж (с использованием девяти микросветодиодов, 30 импульсов и ширины импульса Wdef = 20 мс). Это оказалось ниже, чем сообщалось ранее в 22,24 с E22 = 228,8 мДж и E24 = 153,6 мДж, где была освещена большая площадь22 или все сердце24 соответственно. Тем не менее, по сравнению с подходом, показанным в 35, где хорошо разграниченная узорчатая область освещается 10 импульсами фотодефибрилляции, в результате чегополучается E 35 = 1,8 мДж, энергия фотодефибрляции в настоящем исследовании заметно выше. В отличие от трех других подходов, показатель успеха более 90% не может быть достигнут с помощью представленного протокола. Одной из возможных причин снижения производительности, несмотря на более высокую энергию фотодефибрилляции, может быть то, что сложность лежащей в основе аритмии не рассматривается. Что касается результатов, представленных в 35, где высокая частота терминации достигается путем освещения небольшой области на сердце и одновременного измерения пространственно-временной динамики аритмии, представленный подход, безусловно, может быть дополнительно улучшен путем рассмотрения обратной связи-управления, которое реагирует с другой картиной микро-светодиодного освещения в зависимости от текущего состояния сердца. Более того, было также продемонстрировано, что, хотя аритмии не всегда могут быть устранены современным методом, внутренняя комплексная динамика может быть нарушена во время фотостимуляции, что приводит к более упорядоченному временному состоянию. Как показано нафиг.36, скорость окончания значительно отличается при обращении к мономорфным (более упорядоченным) и полиморфным (менее упорядоченным) аритмиям. Следовательно, логическим шагом к лучшей скорости дефибрилляции может быть влияние на сердечную динамику во время эпизода VF, превращение аритмии в менее сложную картину и завершение другим набором импульсов, создавая таким образом двухэтапный подход фотостимуляции.
Что касается протокола перфузии, наиболее важные этапы заключаются в правильном извлечении и подготовке сердца, а также в правильной настройке оптики оптического отображения. Включение оптического картирования строго требует правильного подбора спектров красителя, соответствующих источников света возбуждения и хорошо подобранных оптических фильтров для камеры29. В противном случае записанные оптические сигналы могут быть слишком шумными, а также могут содержать перекрестные разговоры фотостимуляции с возбуждением красителя. Поэтому последующий анализ потребует последующей обработки сигналов с помощью нескольких аналитических фильтров и сглаживания изображения, что часто приводит к ухудшению.
Еще одним важным шагом в этом протоколе является правильное и точное размещение микро-светодиодного массива. Поскольку соединительный провод между микро-светодиодным массивом и драйвером очень тонкий и гибкий, иногда бывает сложно гарантировать, что массив будет расположен примерно в одном и том же месте на поверхности сердца для каждого эксперимента. Чтобы облегчить позиционирование и зафиксировать полученное положение микро-светодиодного массива, держатель был разработан и напечатан в 3D, что позволило прикрепить массив к микроманипулятору. Это дает больший контроль над движением массива в решении Tyrode. В зависимости от материала, выбранного для соединительного провода микро-светодиодного массива, использование держателя может не потребоваться.
Кроме того, еще одним важным этапом протокола является добавление препаратов против аритмии, таких как, например, Пинацидил37. Поскольку несколько химических соединений хорошо известны тем, что изменяют физиологическую реакцию сердца, это следует учитывать при анализе и интерпретации результатов. Что касается оптического картирования, то предлагаемый протокол использует Блеббистатин в качестве механического разъединителя. Это имеет преимущество удаления артефактов движения во время записи, но это также может продлить APD27. Чтобы преодолеть этот недостаток, анализ методов отслеживания движения во время записи можно было бы считать38,39. Таким образом, будет сохранено нормальное физиологическое состояние сердца, и можно будет получить качественный сигнал.
Хотя было доказано, что представленный протокол может быть использован для многосайтовой фотодефибрилляции, он все же имеет некоторые ограничения. Было обнаружено, что в некоторых случаях фибрилляция не может быть прекращена фотостимуляцией на основе микро-светодиодов, а только нарушена, что приводит к изменениям частоты. Одна из гипотез заключается в том, что извилистые волны на сердце только смещаются из левого желудочка, восстанавливаясь в других частях сердца. По сравнению с другими методами, такими как глобальное освещение24, настоящий метод предлагает более низкий уровень успеха из-за меньшего покрытия сердца. Тем не менее, мы уверены, что при правильном аппаратном методе распознавания спиральной активности повышение показателя успешности терминации возможно.
В заключение, представленная система фотостимуляции устанавливает мощный экспериментальный инструмент для множественных кардиоверсионных подходов и манипулятивных исследований сердечной аритмии. Знания, полученные в этой системе, будут использоваться для исследования и оценки новых потенциальных (фото) протоколов дефибрилляции на клинически значимых моделях крупных животных.
Раскрытие информации
Авторы не заявляют о каком-либо конфликте интересов.
Благодарности
Авторы хотели бы поблагодарить Марион Кунце и Тину Альтхаус за отличную техническую поддержку во время экспериментов. Исследования, приведшие к результатам, получили финансирование от Седьмой рамочной программы Европейского сообщества FP7/2007-2013 под номером грантового соглашения HEALTH-F2-2009-241526. Поддержку также оказали Немецкий центр сердечно-сосудистых исследований, DZHK e.V. (проект MD28), партнерский сайт Goettingen, Немецкий исследовательский фонд CRC 1002 (проект C03) и Общество Макса Планка. Эта работа была частично поддержана BrainLinks-BrainTools, кластером передового опыта, финансируемым Немецким исследовательским фондом (DFG, номер гранта EXC 1086).
Материалы
| Name | Company | Catalog Number | Comments |
| Chemical Components | |||
| Blebbistatin | TargetMol | T6038 | 10 mM stock solution |
| BSA/Albumin | Sigma-Aldrich | A4919 | |
| Calcium Chloride | Sigma-Aldrich | C1016 | CaCl2 |
| Carbogen | Westfalen | 50 l bottle | |
| DI-4-ANBDQPQ | AAT Bioquest | 21499 | Dye for Optical Mapping |
| Glucose | Sigma-Aldrich | D9434 | C6H12O6 |
| Heparin | LEO Pharma | Heparin-Natrium Leo 25.000 I.E./5 ml, available only on prescription | |
| Hydrochlorid Acid | Merck | 1.09057.1000 | HCl, 1 M stock solution |
| Isoflurane | CP Pharma | 1 ml/ml, available only on prescription | |
| Magnesium Chloride | Merck | 8.14733.0500 | MgCl2 |
| Monopotassium Phosphate | Sigma-Aldrich | 30407 | KH2PO4 |
| Pinacidil monohydrate | Sigma-Aldrich | P154-500mg | 10 mM stock solution |
| Potassium Chloride | Sigma-Aldrich | P5405 | KCl |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | NaHCO3 |
| Sodium Chloride | Sigma-Aldrich | S5886 | NaCl |
| Sodium Hydroxide | Merck | 1.09137.1000 | NaOH, 1 M stock solution |
| Electrical Setup | |||
| Biopac MP150 | Biopac Systems | MP150WSW | data acquisition and analysis system |
| Custom-built ECG, alternative ECG100C | Biopac Systems | ECG100C | Electrocardiogram Amplifier |
| Custom-built water bath heater using heating cable | RMS Heating System | HK-5,0-12 | Heating cable 120W |
| Hexagonal water bath | |||
| LED Driver Power supply | Thorlabs | KPS101 | 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube. |
| LEDD1B LED Driver | Thorlabs | LEDD1B | T-Cube LED Driver, 1200 mA Max Drive Current |
| MAP, ECG Electrode | Hugo Sachs Elektronik | BS4 73-0200 | Mini-ECG Electrode for isoalted hearts |
| micro-LED Driver e.g. AFG | Agilent Instruments | A-2230 | Arbitrary function generator (AFG) |
| Signal Generator | Agilent Instruments | A-2230 | AFG |
| micro-LED Array Components | |||
| Epoxid glue | Epoxy Technology | EPO-TEK 353ND | Two component epoxy |
| Fluoropolymer | Asahi Glass Co. Ltd. | Cytop 809M | Fluoropolymer with high transparency |
| Image reversal photoresist | Merck KGaA | AZ 5214E | Image Reversal Resist for High Resolution |
| LED chip | Cree Inc. | C460TR2227-S2100 | Blue micro-LED |
| Photoresist | Merck KGaA | AZ 9260 | Thick Positive Photoresists |
| Polyimide | UBE Industries Ltd. | U-Varnish S | Polyimide Solution |
| Silicone | NuSil Technology LLC | MED-6215 | Low viscosity silicone elastomer |
| Solvent free adhesive | John P. Kummer GmbH | Epo-Tek 301-2 | Epoxy resin with low viscosity |
| Optical Mapping | |||
| Blue Filter | Chroma Technology Corporation | ET470/40x | Blue excitation filter |
| Camera | Photometrics | Cascade 128+ | High performance EMCCD Camera |
| Camera Objective | Navitar | DO-5095 | Navitar high speed fixed focal length lenses work with CCD and CMOS cameras |
| Dichroic Mirror | Semrock | FF685-Di02-25x36 | 685 nm edge BrightLine® single-edge standard epi-fluorescence dichroic beamsplitter |
| Emmision Filter | Semrock | FF01-775/140-25 | 775/140 nm BrightLine® single-band bandpass filter |
| Heatsink | Advanced Thermal Solutions | ATSEU-077A-C3-R0 | Heat Sinks - LED STAR LED Heatsink, 45mm dia., 68mm, Black/Silver, Unthreaded Baseplate Hardware |
| LED 1 and LED 2 | LED Engin Osram | LZ4-00B208 | High Power LEDs - Single Colour Blue, 460 nm 130 lm, 700mA |
| LED 3 | Thorlabs | M625L3 | 625 nm, 700 mW (Min) Mounted LED, 1000 mA |
| Lenses | LED Engin Osram | LLNF-2T06-H | LED Lighting Lenses Assemblies LZ4 LENS NARROW FLOOD BEAM |
| Photodiode for power meter | Thorlabs | S120VC | Standard Photodiode Power Sensor |
| Power Meter | Thorlabs | PM100D | Compact Power and Energy Meter |
| Red Filter | Semrock | FF02-628/40-25 | BrightLine® single-band bandpass filter |
Ссылки
- Davidenko, J. M., Pertsov, A. V., Salamonsz, R. Stationary and drifting spiral waves of excitation in isolated cardiac muscle. Nature. 355, 349-351 (1992).
- Fenton, F. H., et al. Termination of atrial fibrillation using pulsed low-energy far-field stimulation. Circulation. 120 (6), 467-476 (2009).
- Luther, S., et al. Low-energy control of electrical turbulence in the heart. Nature. 475, 235-239 (2011).
- Pumir, A., et al. Wave emission from heterogeneities opens a way to controlling chaos in the heart. Physical Review Letters. 99, 208101(2007).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 26-29 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7, 897-900 (2010).
- Natasha, G., et al. et al.Channelrhodopsins: visual regeneration and neural activation by a light switch. New Biotechnology. 30 (5), 461-474 (2013).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446, 633-639 (2007).
- Alilain, W. J., et al. Light-induced rescue of breathing after spinal cord injury. Journal of Neuroscience. 28 (46), 11862-11870 (2008).
- Ahmad, A., Ashraf, S., Komai, S. Optogenetics applications for treating spinal cord injury. Asian Spine Journal. 9 (2), 299-305 (2015).
- Dieter, A., Keppeler, D., Moser, T. Towards the optical cochlear implant: Optogenetic approaches for hearing restoration. EMBO Molecular Medicine. 12 (4), e11618(2020).
- Keppeler, D., et al. Multichannel optogenetic stimulation of the auditory pathway using microfabricated LED cochlear implants in rodents. Science Translational Medicine. 12 (553), eabb8086(2020).
- Verhoefen, M. K., Bamann, C., Blöcher, R., Förster, U., Bamberg, E. The photocycle of channelrhodopsin-2: ultrafast reaction dynamics and subsequent reaction steps. ChemPhysChem. 11 (14), 3113-3122 (2010).
- Schwaerzle, M., Elmlinger, P., Paul, O., Ruther, P. Miniaturized tool for optogenetics based on an LED and an optical fiber interfaced by a silicon housing. 36th Annual Internation Conference IEEE Engineering in Medicine and Biology Society, Chicago, IL, , 5252-5255 (2014).
- Schwaerzle, M., Elmlinger, P., Paul, O., Ruther, P. Miniaturized 3 x 3 optical fiber array for optogenetics with integrated 460 nm light sources and flexible electrical interconnection. 28th IEEE Proceedigns. MEMS, Estoril, , 162-165 (2015).
- Diaz-Maue, L., Schwaerzle, M., Ruther, P., Luther, S., Richter, C. Follow the light - From low-energy defibrillation to multi-site photostimulation. 40thAnnual International Conference of IEEE Engineering in Medicine and Biology Society, Honolulu, HI, , 4832-4835 (2018).
- Zgierski-Johnston, C., et al. Cardiac pacing using transmural multi-LED probes in channelrhodopsin-expressing mouse hearts. Progress in Biophysics and Molecular Biology. , 51-61 (2020).
- mouser.de, LED Engin, [Online]. , Available: https://www.mouser.de/datasheet/2/228/5412893-LED_2520Engin_Datasheet_LuxiGen_LZ4-00B208- 1531969.pdf (2020).
- thorlabs.com, thorlabs, [Online]. , Available: https://www.thorlabs.com/_sd.cfm?fileName=25135-S01.pdf&partNumber=M625L3 (2020).
- Bruegmann, T., et al. Optogenetic defibrillation terminates ventricular arrhythmia in mouse hearts and human simulations. Journal of Clinical Investigation. 126 (10), 3894-3904 (2016).
- Richter, C., Christoph, J., Lehnart, S. E., Luther, S. Optogenetic light crafting tools for the control of cardiac arrhythmias. Methods in Molecular Biology. 1408, 293-302 (2016).
- Quiñonez Uribe, R. A., Luther, S., Diaz-Maue, L., Richter, C. Energy-reduced arrhythmia termination using global photostimulation in optogenetic murine hearts. Frontiers in Physiology. 9 (1651), (2018).
- Moreno, I. LED irradiance pattern at short distances. Applied Optics. 59 (1), 190-195 (2020).
- Predicting unpinning success rates for a pinned spiral in an excitable medium. Behrend, A., Bittihn, P., Luther, S. Computing in Cardiology, Belfast, , 345-348 (2010).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11 (464), (2020).
- Christoph, J., et al. Electromechanical vortex filaments during cardiac fibrillation. Nature. 555, 667-672 (2018).
- O'Shea, C. Cardiac optogenetics and optical mapping - Overcoming spectral congestion in all-optical cardiac electrophysiology. Frontiers in Physiology. 10 (182), (2019).
- Aras, K. K., Faye, N. R., Cathey, B., Efimov, I. R. Critical volume of human myocardium necessary to maintain ventricular fibrillation. Circulation: Arrhythmia and Electrophysiology. 11 (11), e006692(2018).
- Trayanova, N., Doshi, A. N., Prakosa, A. How personalized heart modeling can help treatment of lethal arrhythmias: A focus on ventricular tachycardia ablation strategies in post-infarction patients. Wiley Interdisciplinary Reviews in System Biology and Medicine. 12 (3), 1477(2020).
- Bingen, B., et al. Light-induced termination of spiral wave arrhythmias by optogenetic engineering of atrial cardiomyocytes. Cardiovascular Research. 104 (1), 194-205 (2014).
- Burton, R. A. B., et al. Optical control of excitation waves in cardiac tissue. Nature Photonics. 9 (12), 813-816 (2015).
- Dura, M., Schröder-Schetelig, J., Luther, S., Lehnart, S. E. Toward panoramic in situ mapping of action potential propagation in transgenic hearts to investigate initiation and therapeutic control of arrhythmias. Frontiers in Physiology. 5, 337(2014).
- Crocini, C., et al. Optogenetics design of mechanistically-based stimulation patterns for cardiac defibrillation. Science Reports. 6 (35628), (2016).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. European Heart Journal. 38 (27), 2132-2136 (2017).
- Wilde, A. A. K+atp channel opening and arrhythmogenesis. Journal of Cardiovascular Pharmacology. 24 (4), 35-40 (1994).
- Christoph, J., Luther, S. Marker-free tracking for motion artifact compensation and deformation measurements in optical mapping videos of contracting hearts. Frontiers in Physiology. 9 (1483), (2018).
- Christoph, J., Schröder-Schetelig, J., Luther, S. Electromechanical optical mapping. Progress in Biophysics and Molecular Biology. 130(B), 150-169 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены