Method Article
Fortschrittliches Herzrhythmusmanagement durch Anwendung optogenetischer Multi-Site-Photostimulation bei murinen Herzen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Diese Arbeit berichtet über eine Methode zur Kontrolle des Herzrhythmus intakter muriner Herzen von transgenen Kanalrhodopsin-2 (ChR2) Mäusen unter Verwendung lokaler Photostimulation mit einem Mikro-LED-Array und gleichzeitiger optischer Kartierung des Epikardialmembranpotentials.
Zusammenfassung
Ventrikuläre Tachyarrhythmien sind weltweit eine der Hauptursachen für Mortalität und Morbidität. Die elektrische Defibrillation mit hochenergetischen Elektroschocks ist derzeit die einzige Behandlung für lebensbedrohliches Kammerflimmern. Defibrillation kann jedoch Nebenwirkungen haben, einschließlich unerträglicher Schmerzen, Gewebeschäden und einer Verschlechterung der Prognose, was auf einen erheblichen medizinischen Bedarf für die Entwicklung sanfterer Herzrhythmusmanagementstrategien hinweist. Neben energiereduzierenden elektrischen Ansätzen wurde die kardiale Optogenetik als leistungsfähiges Werkzeug zur Beeinflussung der Herzaktivität durch lichtempfindliche Membranionenkanäle und Lichtpulse eingeführt. In der vorliegenden Studie wird eine robuste und valide Methode zur erfolgreichen Photostimulation von Langendorff-perfundierten intakten Mausherzen beschrieben, die auf Multi-Site-Pacing unter Verwendung eines 3 x 3-Arrays von Mikro-Leuchtdioden (Mikro-LED) basiert. Die simultane optische Kartierung von Epikardialmembranspannungswellen ermöglicht die Untersuchung der Effekte der regionsspezifischen Stimulation und wertet die neu induzierte Herzaktivität direkt vor Ort aus. Die erhaltenen Ergebnisse zeigen, dass die Wirksamkeit der Defibrillation stark von den Parametern abhängt, die für die Photostimulation während einer Herzrhythmusstörung ausgewählt wurden. Es wird gezeigt, dass der beleuchtete Bereich des Herzens eine entscheidende Rolle für den Abbrucherfolg spielt und wie die gezielte Steuerung der Herzaktivität während der Beleuchtung zur Modifikation von Arrhythmiemustern erreicht werden kann. Zusammenfassend bietet diese Technik die Möglichkeit, die Mechanismusmanipulation vor Ort auf dem Weg zur Echtzeit-Feedback-Kontrolle des Herzrhythmus zu optimieren und in Bezug auf die Regionsspezifität neue Ansätze zur Reduzierung der potenziellen Schädigung des Herzsystems im Vergleich zur Verwendung von unspezifischen elektrischen Schlaganwendungen zu entwickeln.
Einleitung
Frühe Untersuchungen der räumlich-zeitlichen Dynamik bei Arrhythmien zeigten, dass die komplexen elektrischen Muster beim Herzflimmern durch wirbelartig rotierende Erregungswellen angetrieben werden1. Dieser Befund lieferte neue Einblicke in die zugrunde liegenden Mechanismen von Arrhythmien, die dann zur Entwicklung neuartiger elektrischer Terminationstherapien führten, die auf der Multi-Site-Anregung des Myokards 2,3,4 basieren. Behandlungen mit elektrischer Feldstimulation sind jedoch nicht lokal und können alle umliegenden erregbaren Zellen, einschließlich Muskelgewebe, innervieren, was zu Zell- und Gewebeschäden sowie zu unerträglichen Schmerzen führt. Im Gegensatz zu elektrischen Therapien bieten optogenetische Ansätze eine spezifische und gewebeschützende Technik, um Kardiomyozyten-Aktionspotentiale mit hoher räumlicher und zeitlicher Präzision zu evozieren. Daher hat die optogenetische Stimulation das Potenzial zur minimalinvasiven Kontrolle der chaotischen Aktivierungsmuster während des Herzflimmerns.
Die Einführung des lichtempfindlichen Ionenkanalkanals Rhodopsin-2 (ChR2) in erregbare Zellen durch genetische Manipulation 5,6,7 ermöglichte die Depolarisation des Membranpotentials erregbarer Zellen mittels Photostimulation. Mehrere medizinische Anwendungen, einschließlich der Aktivierung neuronaler Netzwerke, der Kontrolle der Herzaktivität, der Wiederherstellung von Seh- und Hörvermögen, der Behandlung von Rückenmarksverletzungen und anderen 8,9,10,11,12,13,14 wurden entwickelt. Die Anwendung von ChR2 in der Kardiologie hat aufgrund seiner Millisekunden-Reaktionszeit15 ein erhebliches Potenzial und eignet sich daher gut zur gezielten Steuerung der arrhythmischen Herzdynamik.
In dieser Studie wird die Multi-Site-Photostimulation intakter Herzen eines transgenen Mausmodells gezeigt. Zusammenfassend wurde im Rahmen des Siebten Rahmenprogramms der Europäischen Gemeinschaft FP7/2007-2013 (HEALTH-F2-2009-241526) eine transgene alpha-MHC-ChR2-Mauslinie etabliert und freundlicherweise von Prof. S. E. Lehnart zur Verfügung gestellt. Im Allgemeinen wurden transgene erwachsene männliche C57/B6/J, die Cre-Rekombinase unter Kontrolle von alpha-MHC exprimieren, gepaart, um sich mit dem weiblichen B6.Cg-Gt(ROSA)26Sortm27.1(CAG-COP4*H134R/tdTomato)Hye/J zu paaren. Da die kardiale STOP-Kassette in der zweiten Generation gelöscht wurde, zeigten die Nachkommen eine stabile MHC-ChR2-Expression und wurden zur Aufrechterhaltung kardialer lichtempfindlicher Kolonien verwendet. Alle Experimente wurden mit erwachsenen Mäusen beiderlei Geschlechts im Alter von 36 - 48 Wochen durchgeführt. Die Beleuchtung wird mit einem 3 x 3 Mikro-LED-Array erreicht, das wie in16,17 beschrieben hergestellt wird, mit der Ausnahme, dass das siliziumbasierte Gehäuse und die kurzen optischen Glasfasern nicht implementiert sind. Seine erste Verwendung in einer kardialen Anwendung findet sich in18. Ein lineares Mikro-LED-Array, das auf einer ähnlichen Fertigungstechnologie basiert, wurde als durchdringende Sonde für die Herzschrittweite19 eingesetzt. Die Mikro-LEDs sind in einem 3 x 3-Array mit einem Abstand von 550 μm angeordnet und bieten sowohl eine hohe räumliche Auflösung als auch eine hohe Strahlungsleistung auf einer sehr kleinen Fläche. Die Autoren demonstrieren in dieser Arbeit eine vielseitige lokale Multi-Site-Photostimulation, die den Weg für die Entwicklung neuartiger antiarrhythmischer Therapiemethoden ebnen kann.
Das folgende experimentelle Protokoll beinhaltet eine retrograde Langendorff-Perfusion ex vivo, bei der die kanülierte Aorta als Perfusionseinlass fungiert. Durch den angelegten Perfusionsdruck und die Herzkontraktion fließt das Perfusat durch die Koronararterien, die von der Aorta abzweigen. In der vorgestellten Arbeit wird das Herz mit einem konstanten Druckaufbau durchblutet, der durch Anheben der Perfusatreservoirs auf 1 m Höhe erreicht wird, was 73,2 mmHg entspricht, was zu einer Durchflussrate von 2,633 ± 0,583 ml / min führt. Zwei Arten von Tyrode-Lösung werden während des Experiments als Perfusat verwendet. Die reguläre Tyrode-Lösung unterstützt einen stabilen Sinusrhythmus, während die Lösung von Low-K + Tyrode mit Pinacidil gemischt wird, um die Induktion von Arrhythmien in murinen Herzen zu ermöglichen. Die Verwendung eines hexagonalen Wasserbades ermöglicht die Beobachtung des Herzens durch sechs verschiedene planare Fenster, was die Kopplung mehrerer optischer Komponenten mit weniger Verzerrung durch Brechung ermöglicht.
Protokoll
Alle Versuche folgten strikt der Tierschutzverordnung, in Übereinstimmung mit der deutschen Gesetzgebung, lokalen Bestimmungen und in Übereinstimmung mit den Empfehlungen der Federation of European Laboratory Animal Science Associations (FELASA). Der Antrag auf Genehmigung von Tierversuchen wurde von der zuständigen Tierschutzbehörde genehmigt und alle Versuche wurden unseren Tierschutzbeauftragten gemeldet.
1. Versuchsvorbereitung und Materialien
- Optisches Mapping-Setup
HINWEIS: Der optische Aufbau sowie der elektrische Aufbau sind in Abbildung 1 dargestellt. Alle Komponenten, die im optischen und elektrischen Aufbau verwendet werden, sind in der Materialtabelle detailliert aufgeführt.- Verwenden Sie LED 1 und LED 2 für die Induktion von Arrhythmie und Backup-Defibrillation. Wählen Sie Hochleistungs-LEDs mit einer Wellenlänge λblau nahe 475 nm, was dem Höhepunkt der Anregungswellenlänge von ChR26 entspricht. Um das optische Spektrum weiter einzuschränken, verwenden Sie einen Bandpassfilter von 470 ± 20 nm.
HINWEIS: In dieser Arbeit haben LED 1 und LED 2 einen typischen Strahlungsstrom von 3,9 bis 5,3 W, gemäß dem Datenblatt20. - Beleuchten Sie das Epikard für die optische Kartierung mit einer roten Hochleistungs-LED (LED 3 in Abbildung 1), die Licht mit einer Mittenwellenlänge von λrot = 625 nm und einem Strahlungsfluss von 700 mW21 emittiert. Das Rotlicht wird mit einem 628 ± 20 nm Bandpassfilter gefiltert und von einem dichroitischen Langpassspiegel (DM) mit einer Grenzwellenlänge von λDM = 685 nm reflektiert.
- Verwenden Sie einen Emissionsfilter mit λFilter-Cam = 775 ± 70 nm vor dem Kameraobjektiv, um nur die Fluoreszenzemission der Herzaktivität aufzuzeichnen. Verwenden Sie ein schnelles Objektiv, das sich gut für Anwendungen bei schlechten Lichtverhältnissen eignet.
HINWEIS: Die Häufigkeit von Flimmern eines Mausherzens liegt zwischen 20 und 35 Hz; Verwenden Sie daher eine Kamera, die schnell genug ist, um mit einer Frequenz von 1 bis 2 kHz oder sogar höher aufzunehmen.
- Verwenden Sie LED 1 und LED 2 für die Induktion von Arrhythmie und Backup-Defibrillation. Wählen Sie Hochleistungs-LEDs mit einer Wellenlänge λblau nahe 475 nm, was dem Höhepunkt der Anregungswellenlänge von ChR26 entspricht. Um das optische Spektrum weiter einzuschränken, verwenden Sie einen Bandpassfilter von 470 ± 20 nm.
- Micro-LED-Array
HINWEIS: Die hier verwendeten Mikro-LED-Arrays werden unter Verwendung von Mikrosystemverarbeitung realisiert, wie an anderer Stelle16,17 näher ausgeführt.- Schleudern Sie eine 5 μm dicke Polyimidschicht (PI) auf 4-Zoll-Siliziumsubstrate (einseitig poliert, 525 μm dick).
- Diese PI-Schicht wird bei einer maximalen Temperatur von 450 °C unter Stickstoffatmosphäre ausgehärtet. Halten Sie die maximale Temperatur für 10 min konstant.
- Abscheiden und Mustern eines Bildumkehr-Fotolacks (PR) mittels ultravioletter (UV) Lithographie und Sputtern eine 250 nm dünne Platinschicht (Pt).
- Verdicken Sie diese Pt-basierte Metallisierung, indem Sie eine 1 μm dicke Goldschicht (Au) galvanisieren, wobei die gemusterte PR als Maskierungsschicht dient.
- Vor dem Schleudern einer zweiten PI-Schicht wird der Wafer mit seiner ersten PI-Schicht und der Au-galvanischen Metallisierung einem Sauerstoffplasma ausgesetzt, das die Oberfläche der PI-Schicht chemisch aktiviert.
- Die zweite PI-Schicht wird erneut bei 450 °C ausgehärtet, mittels UV-Lithographie eine PR-Schicht gemustert und die Kontaktpads des Arrays für die Mikro-LED-Chips und die Schnittstellenleiterplatte (PCB) durch reaktives Ionenätzen (RIE) unter Verwendung der gemusterten PR als Maskierungsschicht geöffnet.
HINWEIS: In diesen RIE-Prozessschritten wird empfohlen, 200 W bzw. 100 W für 10 bzw. 30 Minuten aufzubringen, um die Kontaktpadöffnungen sowie die äußere Form des zweidimensionalen (2D) Mikro-LED-Arrays zu definieren. - Entfernen Sie die PR mit Lösungsmitteln und Plasmaätzen. Verdicken Sie die Kontaktpads weiter, indem Sie eine zusätzliche 6 μm dicke Goldschicht galvanisieren.
- Befestigen Sie die Micro-LED-Chips mit einem Flip-Chip-Bonder an den Kontaktpads.
- Aktivieren Sie die PI-Oberfläche in einem Sauerstoffplasma und unterfüllen Sie die Mikro-LED-Chips mit einem lösemittelfreien Klebstoff. Anschließend den Klebstoff für 12 h bei 120 °C aushärten.
- Um die Mikro-LED-Chips zu verkapseln, führen Sie eine weitere Plasmabehandlung mit Argon durch und tragen Sie manuell eine dünne Fluorpolymerschicht auf. Diese Schicht bei 80 °C für 1 h vorhärten.
- Tragen Sie Silikon manuell als letzte Verkapselungsschicht auf, nachdem Sie das Mikro-LED-Array einem Sauerstoffplasma ausgesetzt haben, um die Siliziumhaftung an der darunter liegenden Fluorpolymerschicht zu verbessern. Die Silikonschicht bei 80 °C und 180 °C jeweils 1 h aushärten. Diese letzten Aushärtungsschritte härten auch die Fluorpolymerschicht vollständig aus.
- Löten Sie die Kontaktpads des PI-Substrats auf eine Leiterplatte, die Streifenanschlüsse für die Verbindung des Arrays mit einer externen Instrumentierung trägt. Decken Sie die Lötpads auf der Leiterplatte mit einem Klebstoff ab.
- Elektrischer Aufbau
- Verwenden Sie Elektroden, die für die Aufzeichnung eines Elektrokardiogramms (EKG) geeignet sind, z. B. Silber/Silberchlorid-Elektroden oder Monophasic Action Potential (MAP)-Elektroden und einen EKG-Verstärker, um die elektrische Aktivität des Herzens kontinuierlich zu überwachen. Verwenden Sie außerdem ein geeignetes Erfassungsgerät (AD), um alle erhaltenen elektrischen Signale aufzuzeichnen.
- Wählen Sie einen geeigneten Treiber für die Hochleistungs-LEDs (LED 1, LED 2 und LED 3), der den maximalen Strom an jedes Gerät verwalten kann. Verwenden Sie einen Arbiträrfunktionsgenerator (AFG), um den Ausgang der LED-Treiber genau zu steuern.
- Verwenden Sie einen Mehrkanal-LED-Treiber, um den Strom zu steuern, der durch das Micro-LED-Array fließt. Auch ein AFG mit mehreren Ausgängen ist für diese Aufgabe geeignet.
HINWEIS: Es ist ratsam, LED-Treiber zu wählen, die den Strom auf den maximalen Strom der Mikro-LED begrenzen, da sonst die Dioden beschädigt werden können. Ein Beispiel für einen Mehrkanal-Mikro-LED-Treiber wird in einer anderen Arbeit18 beschrieben. Bei Bedarf kann der AFG oder ein anderer LED-Treiber an einen Computer angeschlossen werden, um die Micro-LED-Einstellungen fernzusteuern. Wenn dies der Fall ist, verbinden Sie den LED-Treiber mit dem Kommunikationsprotokoll Ihrer Wahl, z. B. General Purpose Interface Bus (GPIB) oder einer seriellen Verbindung.
2. Versuchsverfahren
- Lösungsvorbereitung
- Tyrode-Lösung vorbereiten: 130 mM NaCl, 4 mM KCl, 1 mM MgCl2, 24 mM NaHCO3, 1,8 mM CaCl 2, 1,2 mM KH2 PO4, 5,6 mM Glucose,0,1% BSA/Albumin.
- Low-K+ Tyrode-Lösung vorbereiten: Low-K+ Tyrode's wird auf die gleiche Weise wie normale Tyrode's Lösung hergestellt, außer dass nur die Hälfte der Menge an KCl hinzugefügt wird (2 mM statt 4 mM KCl).
HINWEIS: Für ein Experiment, das 3 h dauert, sind normalerweise 2-3 L Low-K+ Tyrode (zusätzlich gemischt mit Blebbistatin (Schritt 2.1.5), wenn eine optische Kartierung durchgeführt wird) und 1-2 L normale Tyrode ausreichend. - Fügen Sie Pinacidil zu der Low-K + Tyrode-Lösung hinzu, um den Prozess der Arrhythmie-Induktion zu erleichtern, wie in22 beschrieben, um eine Konzentration von 100 mM zu erhalten. Tragen Sie beim Umgang mit Pinacidil Laborschutzhandschuhe.
- Bereiten Sie 1 ml 50 μM DI-4-ANBDQPQ mit normaler Tyrode-Lösung vor. Schützen Sie den Farbstoff vor Licht, um ein Photobleichen zu verhindern.
- Machen Sie eine 10 mM Stammlösung von Blebbistatin. Für die optische Kartierung mischen Sie Blebbistatin mit der 100 mM Pinacidil-Tyrode-Lösung (Schritt 2.1.3), um eine 5 μM-Lösung zu erhalten. Tragen Sie beim Umgang mit Blebbistatin Laborschutzhandschuhe.
HINWEIS: Halten Sie sowohl den Farbstoff als auch die Blebbistatin-Lösung beiseite, bis die optische Zuordnung beginnt.
- Langendorff Perfusion
HINWEIS: Das Setup besteht aus zwei Reservoirs für die beiden Tyrode-Lösungen. Sie sind über Rohre mit Dreiwegehähnen mit einer Blasenfalle verbunden. Das Herz wird später mit einem Luer-Lock-Anschluss an der Blasenfalle befestigt und dann in einem sechseckigen Wasserbad aufgehängt. Das Wasserbad wird wiederum mit einem Abfallbehälter verbunden, um die gebrauchte Tyrode-Lösung zu sammeln.- Reinigen Sie alle Röhrchen vor jedem Versuch mit vollständig demineralisiertem Wasser.
- Belüften Sie beide Tyrode-Lösungen mit Carbogen (5% CO2 und 95%O2) für 30 min bei Raumtemperatur vor Beginn des Experiments. Stellen Sie den pH-Wert der Tyrode-Lösungen mit NaOH auf 7,4 ein.
- Füllen Sie 500 ml jeder Tyrode-Lösung in das entsprechende Reservoir und entlüften Sie die Röhrchen sowie die Blasenfalle, indem Sie Tyrodes Lösung durch das Perfusionssystem laufen lassen, bis keine eingeschlossenen Luftblasen mehr in den Röhrchen oder in der Blasenfalle zu sehen sind.
- Belüften Sie die Tyrode-Lösungen während des gesamten Experiments in den Reservoirs mit Carbogen, um sicherzustellen, dass der pH-Wert des Perfusats später während der Perfusion stabil bleibt.
- Heizen Sie die Perfusionsanlage mit einer Wasserwärmepumpe auf 37 °C. Halten Sie die Perfusattemperatur im Wasserbad konstant, indem Sie ein zusätzliches Heizelement wie ein wasserdichtes Heizkabel verwenden.
HINWEIS: Während des Experiments ist es wichtig, die Reservoirs der Tyrode wieder aufzufüllen, bevor sie leer sind. Andernfalls können Luftblasen in das Herz eindringen, die die Gefäße verstopfen und zu Ischämie führen können.
- Maus-Vorbereitung
- Injizieren Sie subkutan 0,1 ml 500 I.E. Heparin 30 min vor der Herzisolierung.
- Füllen Sie eine 6 cm Petrischale und eine 2 ml Spritze mit eiskalter Tyrode-Lösung. Unter das stereoskopische Mikroskop legen.
- Führen Sie eine Kurzzeitanästhesie von Mäusen in einer gesättigten Isofluran-Umgebung für 2 Minuten und eine sofortige zervikale Dislokation danach durch.
HINWEIS: Um eine ausreichende Anästhesie zu überprüfen, ist eine Überprüfung auf den negativen Interzehenreflex unbedingt erforderlich. - Öffnen Sie die Brust, entfernen Sie das Herz, wie an anderer Stelle23 beschrieben, und legen Sie es in die 6 cm große Petrischale mit eiskalter Tyrode-Lösung. Herzschläge werden aufgrund des Temperaturabfalls verringert.
- Führen Sie die Feinvorbereitung unter einem stereoskopischen Mikroskop durch, wie an anderer Stelle beschrieben23. Befestigen Sie die Aorta auf der stumpfen Nadel und fixieren Sie das Gefäß mit Nahtmaterial.
- Als Kontrolle injizieren Sie eiskalte Tyrode-Lösung durch die Nadel in das Herz und überprüfen Sie, ob das Herz fest montiert ist. Dieser Schritt spült auch das restliche Blut aus dem Herzen.
- Übertragen Sie das montierte Herz in das Perfusionssystem. Stellen Sie sicher, dass das Perfusat fließt, um zu verhindern, dass Luft in das Herz eindringt, während Sie die Nadel mit der Blasenfalle verbinden. Überprüfen Sie, ob das Herz mit Tyrodes Lösung im Wasserbad bedeckt ist. Die Schritte 2.3.4, 2.3.5 und 2.3.7 sind in Abbildung 2 dargestellt.
- Stellen Sie sicher, dass das Herz innerhalb weniger Minuten zu schlagen beginnt. Lassen Sie das Herz für 15 bis 20 Minuten an den Perfusionsaufbau anpassen und wechseln Sie dann zu einer Lösung mit niedrigem K+ Tyrode mit Pinacidil (Schritt 2.1.3) bzw. einer Lösung mit niedrigem K+ Tyrode mit Pinacidil und Blebbistatin (Schritt 2.1.5), wenn ein optisches Mapping durchgeführt werden soll.
- Arrhythmie-Induktion und optische Defibrillation
- Platzieren Sie eine der EKG-Elektroden so nah wie möglich an der Herzoberfläche, um eine gute Signalqualität zu gewährleisten. Suspendieren Sie die zweite EKG-Elektrode in der Tyrode-Lösung. Stellen Sie sicher, dass das erworbene EKG von der AD Ihrer Wahl aufgezeichnet wird.
- Platzieren Sie das Micro-LED-Array auf dem interessierenden Bereich der Studie, beispielsweise auf dem linken Ventrikel.
- Ändern Sie die Perfusion auf Low-K+ Tyrode's mit Pinacidil und perfundiert Sie das Herz für 15 bis 30 min.
- Um Arrhythmien zu induzieren, beleuchten Sie das Herz mit LED 1 und LED 2 mit einem Zug von 20 bis 50 Lichtimpulsen mit einerFrequenz von 25 bis 35 Hz, einer Pulsdauer Wind von 2 bis 15 ms und einer Lichtintensität LIopt_ind von 2,8 mW mm-2.
- Wiederholen Sie den Vorgang, bis eine Arrhythmie induziert wird.
HINWEIS: Arrhythmien sind im EKG-Signal leicht zu identifizieren, da sich die Frequenz und Morphologie des Signals vom normalen Sinusrhythmus unterscheiden. Sollte die Arrhythmie innerhalb der nächsten 5 s enden, klassifizieren Sie sie als selbstbeendet und starten Sie einen neuen Induktionsversuch. - Sobald eine anhaltende Arrhythmie visuell erkannt wird, wenden Sie einen Impulsstoß mit unterschiedlichen Breiten W def und Frequenzen fdef an, wobei drei, sechs oder neun Mikro-LEDs des Arrays bei einem pulsierendenStrom-I-Impuls von 15 mA verwendet werden, der einer Lichtintensität LIμLED = 33,31 ± 2,05 mW mm-2 entspricht.
- Sollte die Arrhythmie nach fünf Mikro-LED-Array-basierten Defibrillationsversuchen anhalten, klassifizieren Sie den Versuch als erfolglos und beginnen Sie mit der Backup-Defibrillation.
- Verwenden Sie für die Backup-Defibrillation LED 1 und LED 2 mit denselben Timing-Parametern wie für das Micro-LED-Array.
HINWEIS: Da das Herz während des gesamten Versuchszeitraums ischämischem und metabolischem Stress ausgesetzt ist, ist es möglich, dass Abbruchversuche der Arrhythmie auch bei Backup-Defibrillation nicht erfolgreich sind. Wann immer dies geschieht, wechseln Sie die Perfusionslösung auf die normale Tyrode's und lassen Sie das Herz für 5 bis 10 Minuten erholen. Wenn das EKG zum Sinusrhythmus zurückkehrt, wiederholen Sie das Protokoll aus Schritt 2.4.3 erneut.
- Optisches Mapping
- Perfusion des Herzens mit der in Schritt 2.1.5 vorbereiteten Blebbistatinlösung und warten Sie, bis eine mechanische Entkopplung erfolgt. Dies wird erreicht, wenn das Herz aufhört zu schlagen, aber ein EKG-Signal immer noch messbar ist.
HINWEIS: Das Mischen der Blebbistatin-Lösung auf die genannte Konzentration und das Durchbluten des Herzens mit dieser Lösung hält die kardiale mechanische Aktivität während des gesamten Experiments von der elektrischen Aktivität entkoppelt. - Geben Sie den 1 mL Spannungsfarbstoff DI-4-ANBDQPQ (hergestellt in Schritt 2.1.4) als Bolus in die Blasenfalle der Langendorff-Perfusion. Warten Sie 5 bis 10 Minuten, damit der Farbstoff das Herz gleichmäßig durchbluten kann.
HINWEIS: Vermeiden Sie das Photobleichen des Farbstoffs, indem Sie das rote Licht ausschalten, wenn keine Aufnahme gemacht wird. Wenn das Signal-Rausch-Verhältnis der Aufzeichnung zu klein wird (das erfasste Signal ist zu verrauscht), wiederholen Sie die Schritte 2.1.4 und 2.5.2. - Fokussieren Sie die Kamera auf die Herzoberfläche, schalten Sie LED 3 ein und legen Sie 1,27 mW mm-2 optische Leistung an.
- Schalten Sie die Laborbeleuchtung aus und starten Sie die Aufnahme. Stellen Sie sicher, dass ein optisches Signal erfasst wird, indem Sie die Frequenz des erhaltenen Signals mit der Frequenz des aufgezeichneten EKGs vergleichen. Dadurch wird sichergestellt, dass das erhaltene optische Signal ausschließlich mit der elektrischen Aktivität des Herzens zusammenhängt.
HINWEIS: Da das vom Farbstoff emittierte Fluoreszenzlicht sehr wöchentlich ist, wird die optische Kartierung in einem dunklen Raum durchgeführt. Dadurch werden Signalstörungen durch andere Lichtquellen vermieden.
- Perfusion des Herzens mit der in Schritt 2.1.5 vorbereiteten Blebbistatinlösung und warten Sie, bis eine mechanische Entkopplung erfolgt. Dies wird erreicht, wenn das Herz aufhört zu schlagen, aber ein EKG-Signal immer noch messbar ist.
Ergebnisse
Das Protokoll ermöglicht die Induktion von ventrikulären Arrhythmien in intakten murinen Herzen unter Verwendung von Photostimulationsimpulsen, die von LED 1 und LED 2 erzeugt werden (Abbildung 1) mit einer Frequenz f ind zwischen 25 Hz und 35 Hz und einer Pulsdauer Wind zwischen 2 ms und 10 ms. Bitte beachten Sie, dass das Ziel solcher schnellen Lichtimpulse nicht darin besteht, den Herzrhythmus zu erfassen, sondern die Herzaktivität aus dem Gleichgewicht zu bringen, so dass unregelmäßige elektrische Wellen erzeugt werden können, die dann eine Arrhythmie begünstigen. Der Vorteil der Induktion von Arrhythmien mit Licht gegenüber der Induktion mit elektrischer Stimulation besteht darin, dass im EKG keine Artefakte provoziert werden, was die Möglichkeit bietet, das erfasste Signal ohne Einschränkungen nachzuanalysieren und sogar die elektrische Reaktion des Herzens während der schnellen Geschwindigkeit zu bewerten, diese Tatsache bietet auch die Möglichkeit, das Herzverhalten während der Photodefibrillation zu beobachten. Dies ist mit elektrischen Induktions- oder Defibrillationsverfahren nicht möglich. Wenn der verwendete Aufbau jedoch die Verwendung externer Hochleistungs-LEDs nicht zulässt, z. B. aufgrund von Ortsbeschränkungen, kann eine zusätzliche Schrittmacherelektrode auf das Herz gelegt werden, um Arrhythmien auszulösen, wie an anderer Stelle 3,22,24 gezeigt.
Sobald das Flimmern induziert ist, muss die Arrhythmie mindestens 5 Sekunden dauern, um sicherzustellen, dass sie anhält, danach werden die Mikro-LED-basierten Defibrillationsversuche gestartet. Da sich die Hauptparameter der Herzrhythmusstörungen, wie Grundzykluslänge oder dominante Frequenz, Amplitude und Morphologie, ständig ändern und es bisher nicht möglich ist, vorherzusagen, welche Photodefibrillationsparameter das beste Ergebnis liefern, war es von großem Interesse zu verstehen, ob es einen Zusammenhang zwischen Frequenz, Pulsbreite, Bereich der Photostimulation und Abbruchrate. Daher wurde eine Reihe von Experimenten mit unterschiedlichen Frequenzen f def, Anzahl der Mikro-LEDs und Pulsdauern Wdef getestet und die Erfolgsrate für N = 11 Mäuse extrahiert, wie in Abbildung 3 gezeigt.
Es konnte gezeigt werden, dass Impulse von 1 bis 20 ms Dauer mit unterschiedlichen Erfolgsraten defibrillieren können (Abbildung 3). Da die Lichtintensität LIμLED bei jedem Photostimulationsimpuls konstant gehalten wurde, wie in Schritt 2.4.6 erwähnt, und die Erfolgsrate von drei Mikro-LEDs gegenüber neun deutlich geringer ist, legen die vorgestellten Ergebnisse nahe, dass die abgedeckte Fläche des Herzens, die Anzahl der Mikro-LEDs und damit der gesamte Strahlungsfluss entscheidend für die Defibrillation sind. Wenn man bedenkt, dass jede Mikro-LED auf dem Array eine Lambertsche Lichtquelle ist und dass sie direkt auf der Oberfläche des Herzens positioniert sind, so dass der ungefähre Abstand zum Gewebe Null ist, kann davon ausgegangen werden, dass die Bestrahlungsstärkekontur des beleuchteten Bereichs am Herzen bei Verwendung einer einzelnen Mikro-LED AμLED = 0,059 mm² entspricht, wie auch in25 für flache rechteckige LEDs gezeigt. Obwohl einige Photonen die Mikro-LED seitlich von den Rändern verlassen könnten, wird der Beitrag dieser Photonen zur Gesamtlichtintensität als so gering angesehen, dass ihre Wirkung vernachlässigt werden kann. Um das eingestrahlte Licht des Arrays zu quantifizieren, maßen die Autoren den Strahlungsfluss des Micro-LED-Arrays mit einem kommerziellen Leistungsmesser und berechneten die Lichtintensität, die das Herz erreicht, wie in Tabelle 1 gezeigt. Aus Tabelle 1 ist auch zu lesen, dass der Strahlungsstrom mit der Anzahl der verwendeten Mikro-LEDs zunimmt, die Lichtintensität jedoch aufgrund der zuvor erwähnten Beleuchtungsprofilimplikationen konstant bleibt.
Interessanterweise lässt sich auch beobachten, dass die Erfolgsrate von neun LEDs mit W def = 1 ms (Abbildung 3a) und W def = 20 ms (Abbildung 3d) bei einer Defibrillationsfrequenz f def = 18 Hz und f def = 20 Hz vergleichsweise hoch ist. Wenn man bedenkt, dass die durchschnittliche Frequenz der induzierten Arrhythmien 22,55 ± 4,03 Hz beträgt, könnte diese Tatsache darauf hindeuten, dass bei ChR2-murinen Herzen die Erfolgsrate signifikant ansteigt, je näher die Schrittfrequenz an der Arrhythmiefrequenz liegt. Dies zeigt auch numerische Simulationen26. Dies kann jedoch nicht einfach verallgemeinert werden, da sich die dominante Häufigkeit komplexer Arrhythmien ständig ändert. Um dies zu veranschaulichen, zeigt Abbildung 4 zwei verschiedene Defibrillationsversuche mit fdef = 14 Hz. Zu Beginn des EKG-Ausschnitts in Abbildung 4a) und entsprechend der Morphologie des EKG-Signals ist ein Kammerflimmern (VF) dargestellt. Wenn die Mikro-LED-Photostimulation beginnt, wird das Flimmern in ein geordneteres Muster umgewandelt, bei dem es sich eher um eine ventrikuläre Tachykardie (VT) handelt. Immer wenn das Micro-LED-Array ausgeschaltet wird, übernehmen die ursprünglichen chaotischen VF-Wellen wieder. Somit wird die Arrhythmie nicht beendet. Obwohl in diesem Beispiel der VF nicht mit den angegebenen Parametern beendet werden kann, wird er gestört und kann in ein regelmäßigeres Muster (VT) geändert werden. Abbildung 4b Segment 1 zeigt, dass die dominante Frequenz von 24 Hz leicht ansteigt, bis die Photostimulation beginnt und die VF in Segment 2 in eine VT umgewandelt wird, wo die dominante Frequenz auf 14 Hz fällt. Weiterhin zeigt Abbildung 4c einen VT, der mit der gleichen f def wie in Abbildung 4a terminiert werden kann, jedoch mit einer anderen Wdef. Zunächst verändert die Mikro-LED-Photostimulation die Morphologie der Arrhythmie, um sie schließlich mit 1:1 Pacing-Erfassung ab dem 19.Puls zu beenden. Diese Ergebnisse könnten bedeuten, dass sich die Photodefibrillationsparameter, zum Beispiel Wdef, im Laufe der Zeit an die morphologische Veränderung der Arrhythmie anpassen müssen. Die Experimente, die zu diesen Ergebnissen führten, wurden aufgrund der daraus resultierenden Änderung der Aktionspotentialdauer (APD) ohne Blebbistatin durchgeführt27. Daher wurde in diesen Serien kein optisches Mapping durchgeführt.
Eine weitere Reihe von Experimenten wurde für die optische Kartierung mit dem rotverschobenen potentiometrischen Farbstoff durchgeführt (Schritt 2.1.4). Die optische Kartierung mit Hochgeschwindigkeitskameras ermöglicht es, sich ausbreitende Erregungswellen auf der Oberfläche des Herzens während des Sinusrhythmus (Abbildung 5) und komplexe Tachyarrhythmien28 zu beobachten. Da die fraktionelle Änderung des potentiometrischen Farbstoffs sehr gering ist, wurden die erhaltenen Videos mit einer mathematischen Programmiersprache nachbearbeitet. Der erste Schritt zur Verbesserung der Qualität der optischen Signale besteht darin, Rauschen zu entfernen, indem ein Gauß-Glättungsfilter mit einer Standardabweichung von σ = 1 angewendet wird, gefolgt von einem Bandpassfilter mit den Eckfrequenzen fhoch = 0,1 Hz und fniedrig = 70 Hz. Das Stoppband bei fhoch entfernt langsame Änderungen im Signal, die nicht mit der Sinusfrequenz des Herzens zusammenhängen, die zwischen 3 Hz < fsinus < 8 Hz liegt, während das Stoppband flow hochfrequentes Rauschen entfernt, das von der Kamera erfasst wird. Es ist wichtig zu beachten, dass sowohl blaue Lichtemissionen von LED 1, LED 2 und vom Micro-LED-Array Übersprechen und ein sehr hohes Störsignal im optischen Mapping verursachen können. Darüber hinaus wurde beobachtet, dass nicht einmal ein sehr schmaler Bandpassfilter vor der Kamera, mit Wellenlänge λFilter-Cam , wie in Schritt 1.2.3 erwähnt, den Einfluss des blauen Lichts herausfiltern würde. Dies kann teilweise durch die Anregungsreaktion des Farbstoffs selbst verursacht werden. Seien Sie daher sehr vorsichtig bei der Auswahl der Optik für das optische Mapping. Für die Mittel der Videoanalyse mussten alle Bilder, in denen blaues Licht aufgezeichnet wurde, vernachlässigt werden, so dass es in vielen Fällen nicht möglich ist, das Herz während der Photostimulation zu visualisieren, wie auch in einer anderen Studieerwähnt 29.
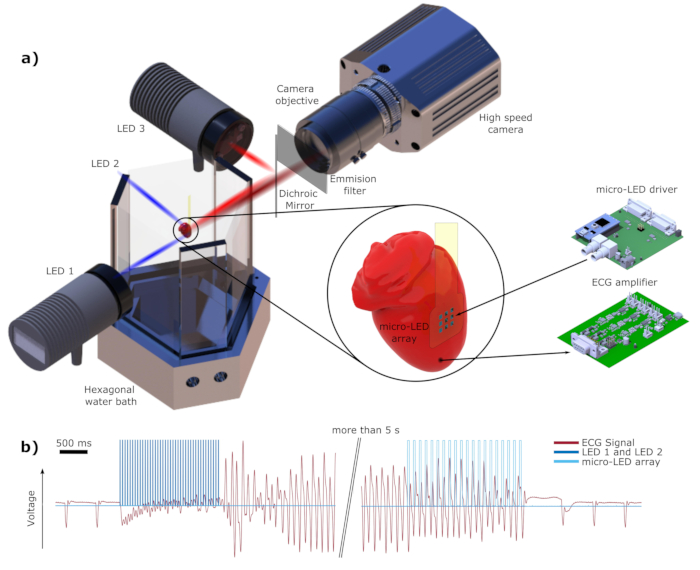
Abbildung 1: Schematische Darstellung des elektrischen und optischen Aufbaus. (a) LED 1 und LED 2 bieten eine blaue Lichtquelle für die Induktion von Arrhythmien und Backup-Defibrillation. LED 3 wird als Anregungslichtquelle für den rotverschobenen Farbstoff DI-4-ANBDQPQ verwendet. Das rote Licht wird mittels des dichroitischen Spiegels DM auf das Herz gerichtet. Das dunkelrot dargestellte Emissionslicht wird, wie im Text erwähnt, von der Hochgeschwindigkeitskamera durch einen Emissionsfilter erfasst. LED 2 und EKG-Elektroden werden der Einfachheit halber nicht angezeigt. (b) Ein Segment des aufgezeichneten EKG-Signals rot dargestellt. Dunkelblau zeigt die Lichtimpulse von LED 1 und LED 2 mit einer Frequenz f ind = 35 Hz und Wind = 4 ms, die zur Induktion von Flimmern verwendet werden. Unmittelbar nach Beendigung des Lichtreizes kann Kammerflimmern (VF) beobachtet werden. Die in Hellblau dargestellte Mikro-LED-basierte Photostimulation (f def = 16 Hz, Wdef = 20 ms) beendet erfolgreich die Arrhythmie. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Herzvorbereitung . (a) Offene Brust einer Maus, die das intakte Herz und die umliegenden Organe zeigt. b) Explantiertes Herz, das zur weiteren Zubereitung in eiskalte Tyrode-Lösung getaucht wurde. (c) Das Mausherz ist ordnungsgemäß an einer stumpfen Nadel befestigt. (d) Murines Herz, das in Tyrodes Lösung schwebt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
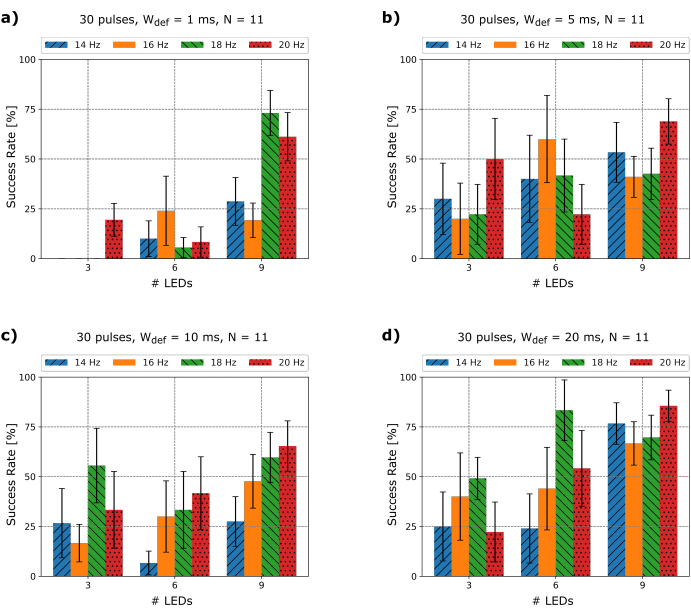
Abbildung 3: Experimentell extrahierte Erfolgsraten. Erfolgsraten für 30 Mikro-LED-basierte Photostimulationsimpulse mit drei, sechs und neun LEDs bei unterschiedlichen Pulsdauern W def und Frequenzen fdef für N = 11. Fehlerbalken mit Standardfehler des Mittelwerts S.E.M. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Manipulation des Herzrhythmus mittels Photostimulation . (a) Segment einer EKG-Aufzeichnung einer nicht terminierten Arrhythmie. b) Spektrogramm des EKG in Panel a. Die spektrale Leistungsdichte (PSD) von Segment (1) zeigt eine Arrhythmie mit einer dominanten Frequenz von 24 Hz. Segment (2) Photostimulation mit den gezeigten Parametern. Es kann beobachtet werden, dass die dominante Frequenz auf 14 Hz abfällt. Segment (3) Erfolglose Beendigung und Rückkehr zu arrhythmischem Verhalten mit einer dominanten Frequenz von 24 Hz. (c) EKG eines erfolgreichen Defibrillationsversuchs. d) Spektrogramm des erfolgreichen Abschlusses in Feld c. Segment (1) zeigt eine ventrikuläre Tachykardie (VT) mit einer dominanten Frequenz von 23 Hz. Segment (2) Photostimulation unter Verwendung der gezeigten Einstellungen. Segment (3) zeigt einen erfolgreichen Abschluss, der zu einem normalen Sinusrhythmus mit einer Grundfrequenz von 3,5 Hz und den daraus resultierenden Obertönen führt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
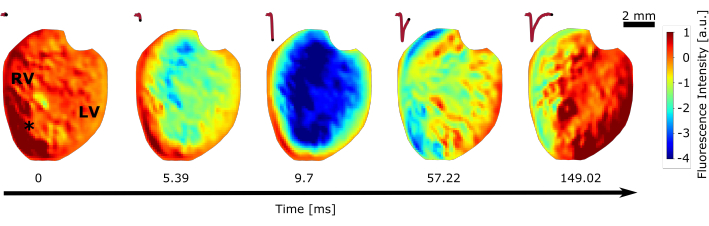
Abbildung 5: Optische Kartierung des ganzen Herzens. Die Änderung der Fluoreszenzintensität während eines einzelnen Herzschlags im normalen Sinusrhythmus wird gezeigt. Das Herz wurde der Kamera zugewandt, so dass der rechte und linke Ventrikel sichtbar sind (RV, LV). Das Sternchen zeigt das Pixel an, bei dem das oben angezeigte Aktionspotential aufgenommen wurde. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Anzahl der microLED | Bestrahlte Fläche Aμled [mm2] | Strahlungsfluss φ [mW] | Lichtstärke LI [mW mm-2] |
| 3 | 0.178 | 5,9 ± 0,47 | 33,11 ± 2,66 |
| 6 | 0.356 | 11,91 ± 0,84 | 33,42 ± 2,37 |
| 9 | 0.535 | 17,85 ± 0,61 | 33,39 ± 1,14 |
Tabelle 1: Gemessener Strahlungsfluss des Micro-LED-Arrays und die entsprechende Lichtintensität.
Diskussion
Eine erfolgreiche Behandlung von Herzrhythmusstörungen ist der Schlüssel zur kardialen Therapie. Die biophysikalischen Mechanismen, die der Initiierung, Aufrechterhaltung und Beendigung von Arrhythmien zugrunde liegen, sind jedoch nicht vollständig verstanden. Die Herzforschung zielt daher darauf ab, die Elektroschocktherapie in Richtung eines schonenderen Abbaus von Arrhythmien zu optimieren und dadurch die Lebensqualität der Patienten zu erhöhen 28,29,30,31. Elektrische Ansätze mit niedriger Energie versprechen eine signifikante Reduzierung schwerer Nebenwirkungen, können jedoch immer noch unerwünschte Muskelerregung hervorrufen. Die kardiale Optogenetik könnte diese Einschränkung überwinden und nicht nur eine gewebeschonende Terminierungstechnik, sondern auch eine flexible Plattform bieten, um die arrhythmiespezifische gezielte Kontrolle wirbelartiger Erregungswellen im intakten murinen Herzen und in Zellkulturen zu untersuchen32,33.
Angesichts dieser Motivation wurden ein robuster Photostimulationsaufbau sowie ein Protokoll entworfen und implementiert, die beide ein hochgradig anpassungsfähiges optisches System bieten, das leicht auf dreidimensionale Panorama-optische Kartierungsstudien erweitert werden könnte34.
Es konnte gezeigt werden, dass Herzrhythmusstörungen mit unterschiedlichen Erfolgsraten erfolgreich beendet werden können, abhängig von den Parametern, die für die Photostimulation gewählt werden, zum Beispiel dem beleuchteten Bereich am Herzen. Die vorgestellten Ergebnisse deuten darauf hin, dass die Erhöhung der bestrahlten Oberfläche eine kritische Anzahl von Kardiomyozyten rekrutierte, die die chaotische Aktivität durch Leitungsblockade auslöschten, wie auch in22 gezeigt. In dieser Studie beträgt die für die Photodefibrillation erforderliche Energie E = 10,69 ± 0,37 mJ (bei neun Mikro-LEDs, 30 Impulsen und Pulsbreite Wdef = 20 ms). Dies erweist sich als niedriger als zuvor in 22,24 mit E 22 = 228,8 mJ und E 24 = 153,6 mJ berichtet, wo eine größere Fläche 22 bzw. das gesamte Herz 24 beleuchtet wurden. Im Vergleich zu dem in 35 gezeigten Ansatz, bei dem ein gut abgegrenzter strukturierter Bereich mit 10 Photodefibrillationsimpulsen beleuchtet wird, was E35 = 1,8 mJ ergibt, ist die Photodefibrillationsenergie in der vorliegenden Studie jedoch deutlich höher. Im Gegensatz zu den drei anderen Ansätzen konnte mit dem vorgestellten Protokoll keine Erfolgsquote von über 90% erreicht werden. Ein möglicher Grund für die verminderte Leistungsfähigkeit trotz höherer Photodefibrillationsenergie könnte sein, dass die Komplexität der zugrunde liegenden Arrhythmie nicht berücksichtigt wird. Im Hinblick auf die in 35 vorgestellten Ergebnisse, bei denen eine hohe Abschlussrate erreicht wird, indem ein kleiner Bereich am Herzen beleuchtet und gleichzeitig die räumlich-zeitliche Dynamik einer Arrhythmie gemessen wird, kann der vorgestellte Ansatz sicherlich weiter verbessert werden, indem die Rückkopplungssteuerung berücksichtigt wird, die je nach aktuellem Zustand des Herzens mit einem anderen Muster der Mikro-LED-Beleuchtung reagiert. Darüber hinaus wurde auch gezeigt, dass, obwohl Arrhythmien mit der aktuellen Methode nicht immer beendet werden können, die intrinsische komplexe Dynamik während der Photostimulation gestört werden kann, was zu einem geordneteren zeitlichen Zustand führt. Wie in36 gezeigt, unterscheidet sich die Terminierungsrate signifikant bei monomorphen (geordneteren) und polymorphen (weniger geordneten) Arrhythmien. Daher könnte der logische Schritt zu einer besseren Defibrillationsrate darin bestehen, die Herzdynamik während einer VF-Episode zu beeinflussen, die Arrhythmie in ein weniger komplexes Muster zu verwandeln und mit einem anderen Satz von Impulsen zu enden, wodurch ein zweistufiger Photostimulationsansatz aufgebaut wird.
In Bezug auf das Perfusionsprotokoll liegen die kritischsten Schritte in der korrekten Extraktion und Vorbereitung des Herzens sowie in der korrekten Einstellung der optischen Kartierungsoptik. Die Einbeziehung der optischen Kartierung erfordert unbedingt die richtige Auswahl von Farbstoffspektren, geeigneten Anregungslichtquellen und gut ausgewählten optischen Filtern für die Kamera29. Andernfalls könnten die aufgezeichneten optischen Signale zu verrauscht sein und auch Übersprechen von Photostimulation mit Farbstoffanregung enthalten. Eine anschließende Analyse würde daher eine Nachbearbeitung der Signale mit mehreren analytischen Filtern und Bildglättung erfordern, die häufig zu einer Verschlechterung führt.
Ein weiterer entscheidender Schritt in diesem Protokoll ist die korrekte und präzise Platzierung des Micro-LED-Arrays. Da die Verbindungsleitung zwischen dem Mikro-LED-Array und dem Treiber sehr dünn und flexibel ist, ist es manchmal schwierig sicherzustellen, dass sich das Array bei jedem Experiment an ungefähr der gleichen Stelle auf der Herzoberfläche befindet. Um die Positionierung zu erleichtern und die erfasste Position des Mikro-LED-Arrays zu fixieren, wurde ein Halter entworfen und in 3D gedruckt, so dass das Array an einem Mikromanipulator befestigt werden kann. Dies gibt mehr Kontrolle über die Bewegung des Arrays in der Tyrode-Lösung. Je nachdem, welches Material für die Verbindungsleitung des Micro-LED-Arrays gewählt wurde, ist die Verwendung einer Halterung möglicherweise nicht erforderlich.
Ein weiterer kritischer Schritt des Protokolls ist die Zugabe von Pro-Arrhythmie-Medikamenten, wie z.B. Pinacidil37. Da mehrere chemische Verbindungen dafür bekannt sind, die physiologische Reaktion des Herzens zu verändern, sollte dies bei der Analyse und Interpretation der Ergebnisse berücksichtigt werden. Was die optische Kartierung betrifft, so verwendet das vorgeschlagene Protokoll Blebbistatin als mechanischen Entkoppler. Dies hat den Vorteil, dass Bewegungsartefakte während der Aufnahme entfernt werden, kann aber auch den APD27 verlängern. Um diesen Nachteil zu überwinden, könnten Analysemethoden der Bewegungsverfolgung während der Aufzeichnung in Betracht gezogen werden38,39. Auf diese Weise bleibt der normale physiologische Zustand des Herzens erhalten und es kann ein qualitativ hochwertiges Signal erhalten werden.
Obwohl nachgewiesen wurde, dass das vorgestellte Protokoll für die Photodefibrillation an mehreren Standorten verwendet werden kann, hat es immer noch einige Einschränkungen. Es wurde festgestellt, dass in einigen Fällen das Flimmern durch die Mikro-LED-basierte Photostimulation nicht beendet, sondern nur gestört werden kann, was zu Frequenzänderungen führt. Eine Hypothese ist, dass die mäandernden Wellen auf dem Herzen nur aus dem linken Ventrikel verdrängt werden und sich in anderen Teilen des Herzens regenerieren. Im Vergleich zu anderen Verfahren wie Global Illumination24 bietet das vorliegende Verfahren aufgrund einer geringeren Abdeckung des Herzens eine geringere Erfolgsrate. Wir sind jedoch zuversichtlich, dass mit der richtigen hardwarebasierten Erkennungsmethode der Spiralaktivität eine Verbesserung der Abschlusserfolgsrate möglich ist.
Zusammenfassend lässt sich sagen, dass das vorgestellte Photostimulationssystem ein leistungsfähiges experimentelles Werkzeug für mehrere Kardioversionsansätze und Manipulationsstudien von Herzrhythmusstörungen darstellt. Das in diesem System erlernte Wissen wird genutzt, um neue potenzielle (Photo-)Defibrillationsprotokolle in klinisch relevanten Großtiermodellen zu untersuchen und zu bewerten.
Offenlegungen
Die Autoren erklären keinen Interessenkonflikt.
Danksagungen
Die Autoren danken Marion Kunze und Tina Althaus für ihre hervorragende technische Unterstützung bei den Experimenten. Die Forschung, die zu den Ergebnissen geführt hat, wurde aus dem Siebten Rahmenprogramm der Europäischen Gemeinschaft RP7/2007-2013 unter der Finanzhilfevereinbarung HEALTH-F2-2009-241526 gefördert. Unterstützt wurde dies auch vom Deutschen Zentrum für Herz-Kreislauf-Forschung, dem DZHK e.V. (Projekt MD28), dem Partnerstandort Göttingen, dem SFB 1002 der Deutschen Forschungsgemeinschaft (Teilprojekt C03) und der Max-Planck-Gesellschaft. Diese Arbeit wurde teilweise unterstützt durch BrainLinks-BrainTools, Exzellenzcluster der Deutschen Forschungsgemeinschaft (DFG, Förderkennzeichen EXC 1086).
Materialien
| Name | Company | Catalog Number | Comments |
| Chemical Components | |||
| Blebbistatin | TargetMol | T6038 | 10 mM stock solution |
| BSA/Albumin | Sigma-Aldrich | A4919 | |
| Calcium Chloride | Sigma-Aldrich | C1016 | CaCl2 |
| Carbogen | Westfalen | 50 l bottle | |
| DI-4-ANBDQPQ | AAT Bioquest | 21499 | Dye for Optical Mapping |
| Glucose | Sigma-Aldrich | D9434 | C6H12O6 |
| Heparin | LEO Pharma | Heparin-Natrium Leo 25.000 I.E./5 ml, available only on prescription | |
| Hydrochlorid Acid | Merck | 1.09057.1000 | HCl, 1 M stock solution |
| Isoflurane | CP Pharma | 1 ml/ml, available only on prescription | |
| Magnesium Chloride | Merck | 8.14733.0500 | MgCl2 |
| Monopotassium Phosphate | Sigma-Aldrich | 30407 | KH2PO4 |
| Pinacidil monohydrate | Sigma-Aldrich | P154-500mg | 10 mM stock solution |
| Potassium Chloride | Sigma-Aldrich | P5405 | KCl |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | NaHCO3 |
| Sodium Chloride | Sigma-Aldrich | S5886 | NaCl |
| Sodium Hydroxide | Merck | 1.09137.1000 | NaOH, 1 M stock solution |
| Electrical Setup | |||
| Biopac MP150 | Biopac Systems | MP150WSW | data acquisition and analysis system |
| Custom-built ECG, alternative ECG100C | Biopac Systems | ECG100C | Electrocardiogram Amplifier |
| Custom-built water bath heater using heating cable | RMS Heating System | HK-5,0-12 | Heating cable 120W |
| Hexagonal water bath | |||
| LED Driver Power supply | Thorlabs | KPS101 | 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube. |
| LEDD1B LED Driver | Thorlabs | LEDD1B | T-Cube LED Driver, 1200 mA Max Drive Current |
| MAP, ECG Electrode | Hugo Sachs Elektronik | BS4 73-0200 | Mini-ECG Electrode for isoalted hearts |
| micro-LED Driver e.g. AFG | Agilent Instruments | A-2230 | Arbitrary function generator (AFG) |
| Signal Generator | Agilent Instruments | A-2230 | AFG |
| micro-LED Array Components | |||
| Epoxid glue | Epoxy Technology | EPO-TEK 353ND | Two component epoxy |
| Fluoropolymer | Asahi Glass Co. Ltd. | Cytop 809M | Fluoropolymer with high transparency |
| Image reversal photoresist | Merck KGaA | AZ 5214E | Image Reversal Resist for High Resolution |
| LED chip | Cree Inc. | C460TR2227-S2100 | Blue micro-LED |
| Photoresist | Merck KGaA | AZ 9260 | Thick Positive Photoresists |
| Polyimide | UBE Industries Ltd. | U-Varnish S | Polyimide Solution |
| Silicone | NuSil Technology LLC | MED-6215 | Low viscosity silicone elastomer |
| Solvent free adhesive | John P. Kummer GmbH | Epo-Tek 301-2 | Epoxy resin with low viscosity |
| Optical Mapping | |||
| Blue Filter | Chroma Technology Corporation | ET470/40x | Blue excitation filter |
| Camera | Photometrics | Cascade 128+ | High performance EMCCD Camera |
| Camera Objective | Navitar | DO-5095 | Navitar high speed fixed focal length lenses work with CCD and CMOS cameras |
| Dichroic Mirror | Semrock | FF685-Di02-25x36 | 685 nm edge BrightLine® single-edge standard epi-fluorescence dichroic beamsplitter |
| Emmision Filter | Semrock | FF01-775/140-25 | 775/140 nm BrightLine® single-band bandpass filter |
| Heatsink | Advanced Thermal Solutions | ATSEU-077A-C3-R0 | Heat Sinks - LED STAR LED Heatsink, 45mm dia., 68mm, Black/Silver, Unthreaded Baseplate Hardware |
| LED 1 and LED 2 | LED Engin Osram | LZ4-00B208 | High Power LEDs - Single Colour Blue, 460 nm 130 lm, 700mA |
| LED 3 | Thorlabs | M625L3 | 625 nm, 700 mW (Min) Mounted LED, 1000 mA |
| Lenses | LED Engin Osram | LLNF-2T06-H | LED Lighting Lenses Assemblies LZ4 LENS NARROW FLOOD BEAM |
| Photodiode for power meter | Thorlabs | S120VC | Standard Photodiode Power Sensor |
| Power Meter | Thorlabs | PM100D | Compact Power and Energy Meter |
| Red Filter | Semrock | FF02-628/40-25 | BrightLine® single-band bandpass filter |
Referenzen
- Davidenko, J. M., Pertsov, A. V., Salamonsz, R. Stationary and drifting spiral waves of excitation in isolated cardiac muscle. Nature. 355, 349-351 (1992).
- Fenton, F. H., et al. Termination of atrial fibrillation using pulsed low-energy far-field stimulation. Circulation. 120 (6), 467-476 (2009).
- Luther, S., et al. Low-energy control of electrical turbulence in the heart. Nature. 475, 235-239 (2011).
- Pumir, A., et al. Wave emission from heterogeneities opens a way to controlling chaos in the heart. Physical Review Letters. 99, 208101(2007).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 26-29 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7, 897-900 (2010).
- Natasha, G., et al. et al.Channelrhodopsins: visual regeneration and neural activation by a light switch. New Biotechnology. 30 (5), 461-474 (2013).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446, 633-639 (2007).
- Alilain, W. J., et al. Light-induced rescue of breathing after spinal cord injury. Journal of Neuroscience. 28 (46), 11862-11870 (2008).
- Ahmad, A., Ashraf, S., Komai, S. Optogenetics applications for treating spinal cord injury. Asian Spine Journal. 9 (2), 299-305 (2015).
- Dieter, A., Keppeler, D., Moser, T. Towards the optical cochlear implant: Optogenetic approaches for hearing restoration. EMBO Molecular Medicine. 12 (4), e11618(2020).
- Keppeler, D., et al. Multichannel optogenetic stimulation of the auditory pathway using microfabricated LED cochlear implants in rodents. Science Translational Medicine. 12 (553), eabb8086(2020).
- Verhoefen, M. K., Bamann, C., Blöcher, R., Förster, U., Bamberg, E. The photocycle of channelrhodopsin-2: ultrafast reaction dynamics and subsequent reaction steps. ChemPhysChem. 11 (14), 3113-3122 (2010).
- Schwaerzle, M., Elmlinger, P., Paul, O., Ruther, P. Miniaturized tool for optogenetics based on an LED and an optical fiber interfaced by a silicon housing. 36th Annual Internation Conference IEEE Engineering in Medicine and Biology Society, Chicago, IL, , 5252-5255 (2014).
- Schwaerzle, M., Elmlinger, P., Paul, O., Ruther, P. Miniaturized 3 x 3 optical fiber array for optogenetics with integrated 460 nm light sources and flexible electrical interconnection. 28th IEEE Proceedigns. MEMS, Estoril, , 162-165 (2015).
- Diaz-Maue, L., Schwaerzle, M., Ruther, P., Luther, S., Richter, C. Follow the light - From low-energy defibrillation to multi-site photostimulation. 40thAnnual International Conference of IEEE Engineering in Medicine and Biology Society, Honolulu, HI, , 4832-4835 (2018).
- Zgierski-Johnston, C., et al. Cardiac pacing using transmural multi-LED probes in channelrhodopsin-expressing mouse hearts. Progress in Biophysics and Molecular Biology. , 51-61 (2020).
- mouser.de, LED Engin, [Online]. , Available: https://www.mouser.de/datasheet/2/228/5412893-LED_2520Engin_Datasheet_LuxiGen_LZ4-00B208- 1531969.pdf (2020).
- thorlabs.com, thorlabs, [Online]. , Available: https://www.thorlabs.com/_sd.cfm?fileName=25135-S01.pdf&partNumber=M625L3 (2020).
- Bruegmann, T., et al. Optogenetic defibrillation terminates ventricular arrhythmia in mouse hearts and human simulations. Journal of Clinical Investigation. 126 (10), 3894-3904 (2016).
- Richter, C., Christoph, J., Lehnart, S. E., Luther, S. Optogenetic light crafting tools for the control of cardiac arrhythmias. Methods in Molecular Biology. 1408, 293-302 (2016).
- Quiñonez Uribe, R. A., Luther, S., Diaz-Maue, L., Richter, C. Energy-reduced arrhythmia termination using global photostimulation in optogenetic murine hearts. Frontiers in Physiology. 9 (1651), (2018).
- Moreno, I. LED irradiance pattern at short distances. Applied Optics. 59 (1), 190-195 (2020).
- Predicting unpinning success rates for a pinned spiral in an excitable medium. Behrend, A., Bittihn, P., Luther, S. Computing in Cardiology, Belfast, , 345-348 (2010).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11 (464), (2020).
- Christoph, J., et al. Electromechanical vortex filaments during cardiac fibrillation. Nature. 555, 667-672 (2018).
- O'Shea, C. Cardiac optogenetics and optical mapping - Overcoming spectral congestion in all-optical cardiac electrophysiology. Frontiers in Physiology. 10 (182), (2019).
- Aras, K. K., Faye, N. R., Cathey, B., Efimov, I. R. Critical volume of human myocardium necessary to maintain ventricular fibrillation. Circulation: Arrhythmia and Electrophysiology. 11 (11), e006692(2018).
- Trayanova, N., Doshi, A. N., Prakosa, A. How personalized heart modeling can help treatment of lethal arrhythmias: A focus on ventricular tachycardia ablation strategies in post-infarction patients. Wiley Interdisciplinary Reviews in System Biology and Medicine. 12 (3), 1477(2020).
- Bingen, B., et al. Light-induced termination of spiral wave arrhythmias by optogenetic engineering of atrial cardiomyocytes. Cardiovascular Research. 104 (1), 194-205 (2014).
- Burton, R. A. B., et al. Optical control of excitation waves in cardiac tissue. Nature Photonics. 9 (12), 813-816 (2015).
- Dura, M., Schröder-Schetelig, J., Luther, S., Lehnart, S. E. Toward panoramic in situ mapping of action potential propagation in transgenic hearts to investigate initiation and therapeutic control of arrhythmias. Frontiers in Physiology. 5, 337(2014).
- Crocini, C., et al. Optogenetics design of mechanistically-based stimulation patterns for cardiac defibrillation. Science Reports. 6 (35628), (2016).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. European Heart Journal. 38 (27), 2132-2136 (2017).
- Wilde, A. A. K+atp channel opening and arrhythmogenesis. Journal of Cardiovascular Pharmacology. 24 (4), 35-40 (1994).
- Christoph, J., Luther, S. Marker-free tracking for motion artifact compensation and deformation measurements in optical mapping videos of contracting hearts. Frontiers in Physiology. 9 (1483), (2018).
- Christoph, J., Schröder-Schetelig, J., Luther, S. Electromechanical optical mapping. Progress in Biophysics and Molecular Biology. 130(B), 150-169 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten