Method Article
Gestion avancée du rythme cardiaque par application d’une photostimulation optogénétique multisite dans les cœurs murins
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce travail rapporte une méthode pour contrôler le rythme cardiaque de cœurs murins intacts de souris transgéniques channelrhodopsin-2 (ChR2) en utilisant la photostimulation locale avec un réseau micro-LED et la cartographie optique simultanée du potentiel de membrane épicardique.
Résumé
Les tachyarythmies ventriculaires sont une cause majeure de mortalité et de morbidité dans le monde. La défibrillation électrique utilisant des chocs électriques à haute énergie est actuellement le seul traitement de la fibrillation ventriculaire potentiellement mortelle. Cependant, la défibrillation peut avoir des effets secondaires, y compris une douleur intolérable, des lésions tissulaires et une aggravation du pronostic, indiquant un besoin médical important pour le développement de stratégies de gestion du rythme cardiaque plus douces. Outre les approches électriques réductrices d’énergie, l’optogénétique cardiaque a été introduite comme un outil puissant pour influencer l’activité cardiaque en utilisant des canaux ioniques membranaires sensibles à la lumière et des impulsions lumineuses. Dans la présente étude, une méthode robuste et valide pour une photostimulation réussie de cœurs murins intacts perfusés de Langendorff sera décrite sur la base d’une stimulation multisite appliquant un réseau 3 x 3 de microdiodes électroluminescentes (micro-LED). La cartographie optique simultanée des ondes de tension de la membrane épicardique permet d’étudier les effets de la stimulation spécifique à la région et d’évaluer l’activité cardiaque nouvellement induite directement sur place. Les résultats obtenus montrent que l’efficacité de la défibrillation dépend fortement des paramètres choisis pour la photostimulation lors d’une arythmie cardiaque. Il sera démontré que la zone éclairée du cœur joue un rôle crucial pour le succès de l’arrêt ainsi que la façon dont le contrôle ciblé de l’activité cardiaque pendant l’éclairage pour modifier les schémas d’arythmie peut être atteint. En résumé, cette technique offre la possibilité d’optimiser la manipulation du mécanisme sur site sur la voie du contrôle en retour en temps réel du rythme cardiaque et, en ce qui concerne la spécificité de la région, de nouvelles approches pour réduire les dommages potentiels au système cardiaque par rapport à l’utilisation d’applications de choc électrique non spécifiques.
Introduction
Les premières recherches sur la dynamique spatio-temporelle au cours de l’arythmie ont révélé que les schémas électriques complexes au cours de la fibrillation cardiaque sont entraînés par des ondes d’excitation rotatives de type vortex1. Cette découverte a donné de nouvelles informations sur les mécanismes sous-jacents des arythmies, ce qui a ensuite conduit au développement de nouvelles thérapies de terminaison électrique basées sur l’excitation multi-sites du myocarde 2,3,4. Cependant, les traitements utilisant la stimulation de champ électrique sont non locaux et peuvent innerver toutes les cellules excitables environnantes, y compris le tissu musculaire, causant des dommages cellulaires et tissulaires, ainsi que des douleurs intolérables. Contrairement aux thérapies électriques, les approches optogénétiques fournissent une technique spécifique et protectrice des tissus pour évoquer les potentiels d’action des cardiomyocytes avec une grande précision spatiale et temporelle. Par conséquent, la stimulation optogénétique a le potentiel de contrôler invasivement le moins possible des schémas d’activation chaotiques pendant la fibrillation cardiaque.
L’introduction du canal ionique sensible à la lumière channelrhodopsin-2 (ChR2) dans les cellules excitables par manipulation génétique 5,6,7, a permis la dépolarisation du potentiel membranaire des cellules excitables par photostimulation. Plusieurs applications médicales, notamment l’activation des réseaux neuronaux, le contrôle de l’activité cardiaque, la restauration de la vision et de l’ouïe, le traitement des lésions de la moelle épinière, et d’autres 8,9,10,11,12,13,14 ont été développées. L’application de ChR2 en cardiologie a un potentiel important en raison de son temps de réponse milliseconde15, ce qui le rend bien adapté au contrôle ciblé de la dynamique cardiaque arythmique.
Dans cette étude, la photostimulation multisite des cœurs intacts d’un modèle murin transgénique est montrée. En résumé, une lignée de souris transgéniques alpha-MHC-ChR2 a été établie dans le cadre du septième programme-cadre de la Communauté européenne FP7/2007-2013 (HEALTH-F2-2009-241526) et aimablement fournie par le professeur S. E. Lehnart. En général, les mâles adultes transgéniques C57/B6/J, exprimant la Cre-recombinase sous contrôle de l’alpha-CMH, ont été jumelés pour s’accoupler avec la femelle B6.Cg-Gt(ROSA)26Sortm27.1(CAG-COP4*H134R/tdTomato)Hye/J. Comme la cassette cardiaque STOP a été supprimée à la deuxième génération, la progéniture a montré une expression stable du CMH-ChR2 et a été utilisée pour maintenir des colonies photosensibles cardiaques. Toutes les expériences ont été effectuées sur des souris adultes des deux sexes âgées de 36 à 48 semaines. L’éclairage est réalisé à l’aide d’un réseau de micro-LED 3 x 3, fabriqué comme décrit en16,17, sauf que le boîtier à base de silicium et les fibres de verre optiques courtes ne sont pas mis en œuvre. Sa première utilisation dans une application cardiaque se trouve dans18. Un réseau linéaire de micro-LED basé sur une technologie de fabrication similaire a été appliqué comme sonde pénétrante pour la stimulation cardiaque19. Les micro-LED sont disposées en un réseau 3 x 3 à un pas de 550 μm, fournissant à la fois une haute résolution spatiale et une puissance rayonnante élevée sur une très petite surface. Les auteurs démontrent dans ce travail une photostimulation multisite locale polyvalente qui pourrait ouvrir la voie au développement de nouvelles méthodes de thérapie antiarythmique.
Le protocole expérimental suivant implique une perfusion de Langendorff rétrograde ex vivo, pour laquelle l’aorte canulée fonctionne comme une entrée de perfusion. En raison de la pression de perfusion appliquée et de la contraction cardiaque, le perfusat circule dans les artères coronaires, qui se ramifient hors de l’aorte. Dans le travail présenté, le cœur est perfusé à l’aide d’une configuration à pression constante obtenue en élevant les réservoirs perfusats à 1 m de hauteur, ce qui équivaut à 73,2 mmHg, ce qui donne un débit de 2,633 ± 0,583 mL / min. Deux types de solution de Tyrode sont utilisés comme perfusat au cours de l’expérience. La solution de Tyrode régulier soutient un rythme sinusal stable, tandis que la solution de Tyrode Low-K+ est mélangée avec Pinacidil pour permettre l’induction de l’arythmie dans les cœurs murins. L’utilisation d’un bain-marie hexagonal permet l’observation du cœur à travers six fenêtres planes différentes, permettant le couplage de plusieurs composants optiques avec moins de distorsion par réfraction.
Protocole
Toutes les expériences ont strictement suivi la réglementation sur le bien-être animal, en accord avec la législation allemande, les stipulations locales et conformément aux recommandations de la Fédération des associations européennes de science des animaux de laboratoire (FELASA). La demande d’approbation des expériences sur les animaux a été approuvée par l’autorité responsable du bien-être animal et toutes les expériences ont été signalées à nos représentants du bien-être animal.
1. Préparation et matériel de l’expérience
- Configuration de la cartographie optique
REMARQUE : La configuration optique, ainsi que la configuration électrique, sont illustrées à la Figure 1. Tous les composants utilisés dans la configuration optique et électrique sont énumérés en détail dans le tableau des matériaux.- Utilisez LED 1 et LED 2 pour l’induction de l’arythmie et la défibrillation de secours. Choisissez des LED haute puissance avec une longueur d’onde λbleue proche de 475 nm, qui est le pic de la longueur d’onde d’excitation de ChR26. Pour réduire davantage le spectre optique, utilisez un filtre passe-bande de 470 ± 20 nm.
NOTE: Dans ce travail, LED 1 et LED 2 ont un flux radiant typique de 3,9 à 5,3 W, selon la fiche technique20. - Illuminer l’épicarde pour la cartographie optique avec une LED rouge haute puissance (LED 3 sur la figure 1), qui émet de la lumière avec une longueur d’onde centrale de λrouge = 625 nm et un flux rayonnant de 700 mW21. La lumière rouge est filtrée avec un filtre passe-bande de 628 ± 20 nm et réfléchie par un miroir dichroïque (DM) passe-long avec une longueur d’onde de coupure de λDM = 685 nm.
- Utilisez un filtre d’émission avec λfiltre-cames = 775 ± 70 nm devant l’objectif de la caméra pour enregistrer uniquement l’émission de fluorescence de l’activité cardiaque. Utilisez un objectif rapide qui convient bien aux applications à faible luminosité.
NOTE: La fréquence de fibrillation d’un cœur de souris varie de 20 à 35 Hz; par conséquent, utilisez une caméra assez rapide pour enregistrer avec une fréquence de 1 à 2 kHz, voire plus.
- Utilisez LED 1 et LED 2 pour l’induction de l’arythmie et la défibrillation de secours. Choisissez des LED haute puissance avec une longueur d’onde λbleue proche de 475 nm, qui est le pic de la longueur d’onde d’excitation de ChR26. Pour réduire davantage le spectre optique, utilisez un filtre passe-bande de 470 ± 20 nm.
- Réseau de micro-LED
NOTE: Les réseaux de micro-LED appliqués ici sont réalisés en utilisant le traitement des microsystèmes comme détaillé ailleurs16,17.- Enduire de spin une couche de polyimide (PI) de 5 μm d’épaisseur sur des substrats de silicium de 4 pouces (polis simple face, épaisseur de 525 μm).
- Durcir cette couche de PI à une température maximale de 450 °C sous atmosphère d’azote. Maintenez la température maximale constante pendant 10 min.
- Déposer et modeler une photorésine photosensible (PR) inversée d’image en utilisant la lithographie ultraviolette (UV) et déposer par pulvérisation une fine couche de platine (Pt) de 250 nm.
- Épaissir cette métallisation à base de Pt en galvanoplastique une couche d’or (Au) de 1 μm d’épaisseur avec le PR à motifs servant de couche de masquage.
- Avant de recouvrir une deuxième couche de PI, exposer la plaquette avec sa première couche de PI et la métallisation électrolytique au à un plasma d’oxygène qui active chimiquement la surface de la couche de PI.
- Durcissez à nouveau la deuxième couche PI à 450 °C, appliquez la lithographie UV pour modeler une couche PR et ouvrez les pastilles de contact du réseau pour les puces micro-LED et la carte de circuit imprimé (PCB) d’interfaçage par gravure ionique réactive (RIE) en utilisant le PR à motifs comme couche de masquage.
REMARQUE: Dans ces étapes de processus RIE, il est recommandé d’appliquer 200 W et 100 W pendant 10 et 30 min, respectivement, pour définir les ouvertures du pavé de contact ainsi que la forme extérieure du réseau micro-LED bidimensionnel (2D). - Décaper le PN à l’aide de solvants et de gravure au plasma. Épaissir davantage les plaquettes de contact en galvanoplastie une couche d’or supplémentaire de 6 μm d’épaisseur.
- Fixez les puces micro-LED aux plaquettes de contact à l’aide d’un bonder flip-chip.
- Activez la surface PI dans un plasma d’oxygène et remplissez les puces micro-LED avec un adhésif sans solvant. Durcir ensuite l’adhésif pendant 12 h à 120 °C.
- Pour encapsuler les puces micro-LED, effectuez un autre traitement plasma avec de l’argon et appliquez manuellement une fine couche de fluoropolymère. Pré-durcir cette couche à 80 °C pendant 1 h.
- Appliquer manuellement le silicone comme couche d’encapsulation finale après avoir exposé le réseau micro-LED à un plasma d’oxygène, utilisé pour améliorer l’adhérence du silicium à la couche de fluoropolymère sous-jacente. Durcir la couche de silicone à 80 °C et 180 °C pendant 1 h chacune. Ces dernières étapes de durcissement durcissent également complètement la couche de fluoropolymère.
- Souder les pastilles de contact du substrat PI à une carte de circuit imprimé qui transporte des connecteurs de bande pour l’interconnexion de la matrice à une instrumentation externe. Couvrez les tampons de soudure sur le circuit imprimé à l’aide d’un adhésif.
- Installation électrique
- Utilisez des électrodes adaptées à l’enregistrement d’un électrocardiogramme (ECG), par exemple, des électrodes argent/chlorure d’argent ou des électrodes de potentiel d’action monophasique (MAP) et un amplificateur ECG pour surveiller l’activité électrique du cœur en continu. De plus, utilisez un dispositif d’acquisition (AD) approprié pour enregistrer tous les signaux électriques obtenus.
- Choisissez un pilote bien adapté aux LED haute puissance (LED 1, LED 2 et LED 3), qui peut gérer le courant maximal appliqué à chaque appareil. Utilisez un générateur de fonctions arbitraires (AFG) pour contrôler avec précision la sortie des pilotes LED.
- Utilisez un pilote LED multicanal pour contrôler le courant circulant dans le réseau de micro-LED. Un AFG avec plusieurs sorties convient également à cette tâche.
REMARQUE: Il est conseillé de choisir des pilotes LED limitant le courant au courant maximum de la micro-LED, sinon les diodes pourraient être endommagées. Un exemple de pilote micro-LED multicanal est décrit dans un autre ouvrage18. Si nécessaire, l’AFG ou tout autre pilote LED peut être connecté à un ordinateur pour contrôler à distance les paramètres micro-LED. Si tel est le cas, connectez le pilote LED à l’ordinateur avec le protocole de communication de votre choix, par exemple, General Purpose Interface Bus (GPIB) ou une connexion série.
2. Procédures expérimentales
- Préparation de la solution
- Préparer la solution de Tyrode : 130 mM NaCl, 4 mM KCl, 1 mM MgCl2, 24 mMNaHCO3, 1,8 mM CaCl2, 1,2 mM KH2PO4, 5,6 mM Glucose,0,1% BSA/Albumine.
- Préparer la solution de Tyrode Low-K+ : Low-K+ Tyrode est fabriquée de la même manière que la solution de Tyrode ordinaire, sauf que seulement la moitié de la quantité de KCl est ajoutée (2 mM au lieu de 4 mM KCl).
NOTE: Pour une expérience d’une durée de 3 heures, généralement 2-3 L de Tyrode Low-K+ (en plus mélangé avec de la Blébbistatine (étape 2.1.5) si une cartographie optique est effectuée) et 1-2 L de Tyrode régulier sont suffisants. - Ajouter Pinacidil à la solution de Low-K+ Tyrode pour faciliter le processus d’induction de l’arythmie, tel que décrit en22, pour obtenir une concentration de 100 mM. Portez des gants de laboratoire protecteurs lors de la manipulation de Pinacidil.
- Préparer 1 mL de DI-4-ANBDQPQ 50 μM avec la solution régulière de Tyrode. Protégez le colorant de la lumière pour éviter le photoblanchiment.
- Faire une solution mère de 10 mM de blébbistatine. Pour la cartographie optique, mélanger la blébbistatine avec la solution de Pinacidil-Tyrode à 100 mM (étape 2.1.3) pour obtenir une solution de 5 μM. Porter des gants de laboratoire protecteurs lors de la manipulation de la blébbistatine.
REMARQUE: Gardez le colorant et la solution de blébbistatine de côté jusqu’à ce que la cartographie optique commence.
- Perfusion de Langendorff
REMARQUE: La configuration se compose de deux réservoirs pour les deux solutions du Tyrode. Ils sont reliés à un piège à bulles via des tubes avec des coqs à trois voies. Le cœur est ensuite attaché au piège à bulles par un connecteur de verrouillage Luer, puis suspendu dans un bain-marie hexagonal. Le bain-marie est, à son tour, relié à un conteneur à déchets pour recueillir la solution de Tyrode usagée.- Nettoyez tous les tubes avant chaque expérience avec de l’eau entièrement déminéralisée.
- Aérer les deux solutions de Tyrode avec du Carbogen (5% de CO2 et 95% d’O2) pendant 30 min à température ambiante avant le début de l’expérience. Ajustez la valeur du pH des solutions Tyrode à 7,4 avec NaOH.
- Remplir 500 mL de chaque solution de Tyrode dans le réservoir correspondant et désaérer les tubes ainsi que le piège à bulles en faisant passer la solution de Tyrode dans le système de perfusion jusqu’à ce qu’il n’y ait plus de bulles d’air piégées dans les tubes ou dans le piège à bulles.
- Continuer à aérer les solutions du Tyrode pendant toute l’expérience dans les réservoirs avec Carbogen pour s’assurer que le pH du perfusat reste stable plus tard pendant la perfusion.
- Chauffer le système de perfusion à 37 °C avec une pompe à chaleur à eau. Maintenez la température du perfusat constante dans le bain-marie en utilisant un élément chauffant supplémentaire tel qu’un câble chauffant étanche.
NOTE: Au cours de l’expérience, il est crucial de remplir les réservoirs du Tyrode avant qu’ils ne soient vides. Sinon, des bulles d’air peuvent pénétrer dans le cœur, ce qui peut obstruer les vaisseaux et entraîner une ischémie.
- Préparation de la souris
- Injecter par voie sous-cutanée 0,1 mL de 500 I.E. Heparine 30 min avant la procédure d’isolement cardiaque.
- Remplissez une boîte de Petri de 6 cm et une seringue de 2 ml avec la solution de Tyrode glacée. Placer sous le microscope stéréoscopique.
- Effectuer une anesthésie de courte durée sur des souris dans un environnement saturé d’isoflurane pendant 2 minutes et une luxation cervicale immédiate par la suite.
REMARQUE: Afin de vérifier une anesthésie suffisante, une vérification du réflexe inter-orteil négatif est absolument nécessaire. - Ouvrez la poitrine, retirez le cœur, comme décrit ailleurs23, et placez-le dans la boîte de Petri de 6 cm avec la solution de Tyrode glacée. Les battements cardiaques seront diminués en raison de la chute de température.
- Faire la préparation fine au microscope stéréoscopique, comme détaillé ailleurs23. Fixez l’aorte sur l’aiguille émoussée et fixez le vaisseau avec un matériau de suture.
- Comme contrôle, injectez la solution de Tyrode glacée à travers l’aiguille dans le cœur et vérifiez que le cœur est bien monté. Cette étape rince également le sang restant du cœur.
- Transférer le cœur monté dans le système de perfusion. Assurez-vous que le perfusat circule pour empêcher l’air de pénétrer dans le cœur tout en reliant l’aiguille au piège à bulles. Vérifiez que le cœur est recouvert de la solution de Tyrode au bain-marie. Les étapes 2.3.4, 2.3.5 et 2.3.7 sont illustrées à la figure 2.
- Assurez-vous que le cœur commence à battre en quelques minutes. Laissez le cœur s’adapter à la configuration de perfusion pendant 15 à 20 min, puis passez à la solution de Tyrode à faible K+ avec Pinacidil (étape 2.1.3) ou à la solution de Tyrode à faible K+ avec Pinacidil et Blebbistatin (étape 2.1.5) si une cartographie optique doit être effectuée.
- Induction de l’arythmie et défibrillation optique
- Placez l’une des électrodes ECG aussi près que possible de la surface du cœur pour assurer une bonne qualité du signal. Suspendre la deuxième électrode ECG dans la solution Tyrode. Assurez-vous que l’ECG acquis est enregistré par l’AD de votre choix.
- Placez le réseau de micro-LED sur la zone d’intérêt de l’étude, par exemple, sur le ventricule gauche.
- Changez la perfusion en Tyrode à faible K + avec Pinacidil et perfusez le cœur pendant 15 à 30 minutes.
- Pour induire l’arythmie, illuminer le cœur avec LED 1 et LED 2 avec un train de 20 à 50 impulsions lumineuses avec une fréquence f ind de 25 à 35 Hz, une durée d’impulsion Wind de 2 à 15 ms et une intensité lumineuse LIopt_ind de 2,8 mW mm-2.
- Répétez le processus jusqu’à ce que l’arythmie soit induite.
REMARQUE: Les arythmies sont faciles à identifier dans le signal ECG car la fréquence et la morphologie du signal diffèrent du rythme sinusal normal. Si l’arythmie se termine dans les 5 s suivantes, classez-la comme auto-terminée et commencez une nouvelle tentative d’induction. - Une fois qu’une arythmie soutenue est détectée visuellement, appliquez une rafale d’impulsions de différentes largeurs Wdef et fréquences fdef, en utilisant trois, six ou neuf micro-LED du réseau à uneimpulsion de courant pulsé I de 15 mA cédant à une intensité lumineuse LIμLED = 33,31 ± 2,05 mW mm-2.
- Si l’arythmie persiste après cinq essais de défibrillation à base de micro-LED, classez la tentative comme infructueuse et commencez la défibrillation de secours.
- Pour la défibrillation de secours, utilisez LED 1 et LED 2 en utilisant les mêmes paramètres de synchronisation que ceux définis pour la matrice micro-LED.
REMARQUE: Parce que le cœur est exposé à un stress ischémique et métabolique pendant toute la période expérimentale, il est possible que les tentatives d’arrêt de l’arythmie échouent, même avec une défibrillation de secours. Chaque fois que cela se produit, changez la solution de perfusion pour le Tyrode régulier et laissez le cœur récupérer pendant 5 à 10 minutes. Lorsque l’ECG revient au rythme sinusal, répétez le protocole de l’étape 2.4.3.
- Cartographie optique
- Perfuser le cœur avec la solution de Blebbistatin préparée à l’étape 2.1.5 et attendre le découplage mécanique. Ceci est accompli lorsque le cœur cesse de battre, mais un signal ECG est toujours mesurable.
REMARQUE: Le mélange de la solution de blébbistatine à la concentration mentionnée et le maintien du cœur perfusé avec cette solution maintiennent l’activité mécanique cardiaque découplée de l’activité électrique pendant toute l’expérience. - Donner le colorant de tension de 1 mL DI-4-ANBDQPQ (préparé à l’étape 2.1.4) comme bol dans le piège à bulles de la perfusion de Langendorff. Attendez 5 à 10 minutes pour permettre au colorant de perfuser le cœur uniformément.
REMARQUE: Évitez le photoblanchiment du colorant en éteignant la lumière rouge chaque fois qu’aucun enregistrement n’est effectué. Si le rapport signal/bruit de l’enregistrement devient trop faible (le signal acquis est trop bruyant), répétez les étapes 2.1.4 et 2.5.2. - Concentrez la caméra sur la surface du cœur, allumez la LED 3 et appliquez une puissance optique de 1,27 mW mm-2 .
- Éteignez les lumières du laboratoire et commencez l’enregistrement. Assurez-vous qu’un signal optique est acquis en comparant la fréquence du signal obtenu à la fréquence de l’ECG enregistré. Cela garantit que le signal optique obtenu est purement lié à l’activité électrique du cœur.
REMARQUE: Comme la lumière de fluorescence émise par le colorant est très hebdomadaire, la cartographie optique se fait dans une pièce sombre. Cela évite les interférences de signal provenant de toute autre source lumineuse.
- Perfuser le cœur avec la solution de Blebbistatin préparée à l’étape 2.1.5 et attendre le découplage mécanique. Ceci est accompli lorsque le cœur cesse de battre, mais un signal ECG est toujours mesurable.
Résultats
Le protocole permet l’induction d’arythmies ventriculaires dans des cœurs murins intacts à l’aide d’impulsions de photostimulation générées par LED 1 et LED 2 (Figure 1) avec une fréquence f ind comprise entre 25 Hz et 35 Hz et une durée d’impulsion Wind comprise entre 2 ms et 10 ms. Veuillez noter que le but de telles impulsions lumineuses rapides n’est pas de capturer le rythme cardiaque, mais plutôt de déséquilibrer l’activité cardiaque afin que des ondes électriques erratiques puissent être générées, ce qui facilite ensuite une arythmie. L’avantage d’induire une arythmie avec la lumière par rapport à l’induction avec stimulation électrique est qu’aucun artefact n’est provoqué dans l’ECG, offrant la possibilité de post-analyser le signal acquis sans restrictions et même d’évaluer la réponse électrique du cœur pendant la stimulation rapide, ce fait fournit également la possibilité d’observer le comportement cardiaque pendant la photo-défibrillation. Cela n’est pas possible avec les méthodes d’induction électrique ou de défibrillation. Néanmoins, si la configuration utilisée ne permet pas l’utilisation de LED externes haute puissance, par exemple en raison de contraintes de place, une électrode de stimulation supplémentaire peut être placée sur le cœur pour induire une arythmie, comme indiqué ailleurs 3,22,24.
Une fois que la fibrillation est induite, l’arythmie doit durer au moins 5 secondes pour s’assurer qu’elle se maintient, après quoi les tentatives de défibrillation à base de micro-LED sont lancées. Étant donné que les principaux paramètres de l’arythmie cardiaque, tels que la durée du cycle de base ou la fréquence dominante, l’amplitude et la morphologie, changent continuellement et qu’il n’est pas possible à ce jour de prédire quels paramètres de photodéfibrillation fournissent le meilleur résultat, il était très intéressant de comprendre s’il existe une relation entre la fréquence, la largeur de l’impulsion, zone de photostimulation et taux de terminaison. Par conséquent, une série d’expériences avec différentes fréquences f def, nombre de micro-LED et durées d’impulsion Wdef ont été testées, et le taux de réussite pour N = 11 souris a été extrait, comme le montre la figure 3.
Il a pu être démontré que des impulsions d’une durée de 1 à 20 ms peuvent défibriller avec différents taux de réussite (Figure 3). Étant donné que l’intensité lumineuse LIμLED a été maintenue constante pendant chaque impulsion de photostimulation, comme mentionné à l’étape 2.4.6, et que le taux de réussite de trois micro-LED contre neuf est nettement inférieur, les résultats présentés suggèrent que la zone couverte sur le cœur, le nombre de micro-LED, et donc le flux radiant total appliqué sont des facteurs cruciaux pour obtenir la défibrillation. Considérant que chaque micro-LED du réseau est une source lumineuse lambertienne et qu’elles sont positionnées directement sur la surface du cœur de sorte que la distance approximative au tissu est nulle, on peut supposer que le contour d’éclairement de la zone éclairée sur le cœur lors de l’utilisation d’une seule micro-LED est équivalent à AμLED = 0,059 mm², comme indiqué également dans25 pour les LED rectangulaires plates. De plus, bien que certains photons puissent quitter la micro-LED latéralement par les bords, la contribution de ceux-ci à l’intensité lumineuse totale est considérée comme si faible que leur effet peut être négligé. Pour quantifier la lumière irradiée du réseau, les auteurs ont mesuré le flux rayonnant du réseau micro-LED avec un capteur de puissance commercial et calculé l’intensité lumineuse qui atteint le cœur, comme indiqué dans le tableau 1. D’après le tableau 1 , on peut également lire que le flux radiant augmente avec le nombre de micro-LED utilisées, mais l’intensité lumineuse reste constante en raison des implications du profil d’éclairage mentionnées précédemment.
Fait intéressant, on peut également observer que le taux de réussite de neuf LED avec W def = 1 ms (Figure 3a) et W def = 20 ms (Figure 3d) à une fréquence de défibrillation fdef = 18 Hz et fdef = 20 Hz sont comparativement élevés. Considérant que la fréquence moyenne des arythmies induites est de 22,55 ± 4,03 Hz, ce fait pourrait indiquer que pour les cœurs murins ChR2, le taux de réussite augmente considérablement plus la fréquence de stimulation est proche de la fréquence de l’arythmie. Ceci est également montré dans les simulations numériques26. Cependant, cela ne peut pas être facilement généralisé car la fréquence dominante des arythmies complexes change constamment. Pour illustrer cela, la figure 4 montre deux tentatives de défibrillation différentes avec fdef = 14 Hz. Au début du segment ECG de la figure 4a) et selon la morphologie du signal ECG, une fibrillation ventriculaire (FV) est montrée. Lorsque la photostimulation micro-LED commence, la fibrillation est transformée en un motif plus ordonné qui est plus susceptible d’être une tachycardie ventriculaire (VT). Chaque fois que le réseau de micro-LED est éteint, les ondes VF chaotiques d’origine reprennent le dessus. Ainsi, l’arythmie n’est pas terminée. Bien que dans cet exemple, le VF ne puisse pas être terminé avec les paramètres donnés, il est perturbé et il peut être modifié pour un modèle plus régulier (VT). Graphique 4b Le segment 1 montre que la fréquence dominante de 24 Hz augmente légèrement jusqu’à ce que la photostimulation commence et que la VF soit transformée en VT dans le segment 2, où la fréquence dominante tombe à 14 Hz. De plus, la figure 4c montre un VT qui peut être terminé avec la mêmef def que sur la figure 4a, mais avec unedef W différente. Tout d’abord, la photostimulation micro-LED modifie la morphologie de l’arythmie, pour finalement y mettre fin avec une capture de stimulation 1:1 à partir de la 19èmeimpulsion. Ces résultats pourraient impliquer que les paramètres de photodéfibrillation, par exemple Wdef, doivent s’adapter au changement morphologique de l’arythmie au fil du temps. Les expériences menant à ces résultats ont été menées sans utiliser de blébbistatine en raison du changement de la durée du potentiel d’action (DPA)27 qui en résulte. Par conséquent, aucune cartographie optique n’a été effectuée dans ces séries.
Une autre série d’expériences a été réalisée pour la cartographie optique à l’aide du colorant potentiométrique décalé vers le rouge (étape 2.1.4). La cartographie optique avec des caméras à grande vitesse permet d’observer la propagation des ondes d’excitation à la surface du cœur pendant le rythme sinusal (Figure 5) et les tachyarythmies complexes28. Comme le changement fractionnaire du colorant potentiométrique est très faible, les vidéos obtenues ont été post-traitées à l’aide d’un langage de programmation mathématique. La première étape pour améliorer la qualité des signaux optiques consiste à supprimer le bruit en appliquant un filtre de lissage gaussien avec un écart-type de σ = 1, suivi d’un filtre passe-bande avec des fréquences d’angle fhigh = 0,1 Hz et flow = 70 Hz. La bande d’arrêt à fhaut supprime les changements lents du signal qui ne sont pas liés à la fréquence sinusale du cœur qui se situe entre 3 Hz < fsinus < 8 Hz, tandis que la bande d’arrêt fbasse supprime le bruit haute fréquence qui est capturé par la caméra. Il est important de noter que les émissions de lumière bleue des LED 1, LED 2 et du réseau de micro-LED peuvent provoquer une diaphonie et un signal d’interférence très élevé dans la cartographie optique. En outre, il a été observé que même un filtre passe-bande très étroit devant la caméra, avec une longueur d’onde λfiltre-came , comme mentionné à l’étape 1.2.3, ne filtrerait pas l’influence de la lumière bleue. Cela peut être causé en partie par la réponse d’excitation du colorant lui-même. Soyez donc très prudent lors du choix de l’optique pour la cartographie optique. Pour les moyens d’analyse vidéo, toutes les images dans lesquelles la lumière bleue a été enregistrée ont dû être négligées de sorte que, dans de nombreux cas, il n’est pas possible de visualiser le cœur pendant la photostimulation, comme mentionné également dans une autre étude29.
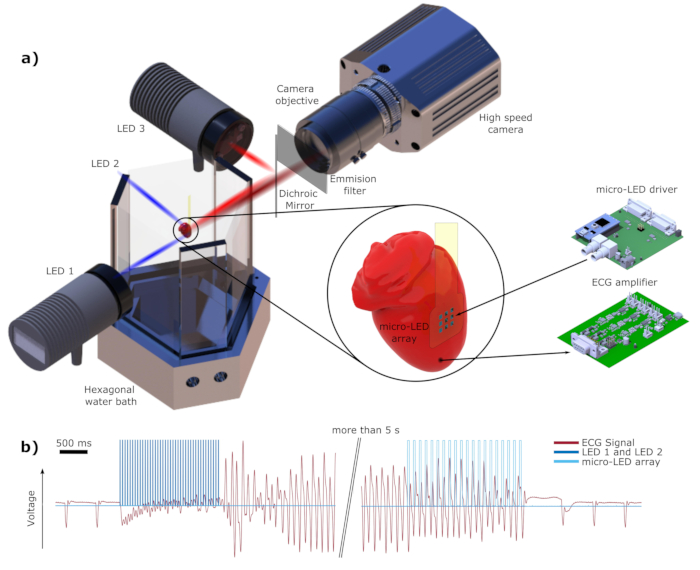
Figure 1 : Schéma de la configuration électrique et optique. a) Les LED 1 et LED 2 fournissent une source de lumière bleue utilisée pour l’induction de l’arythmie et la défibrillation de secours. La LED 3 est utilisée comme source lumineuse d’excitation pour le colorant décalé vers le rouge DI-4-ANBDQPQ. La lumière rouge est dirigée vers le cœur au moyen du miroir dichroïque DM. La lumière d’émission affichée en rouge foncé est enregistrée par la caméra haute vitesse à travers un filtre d’émission, comme mentionné dans le texte. Les électrodes LED 2 et ECG ne sont pas montrées pour plus de simplicité. b) Un segment du signal ECG enregistré en rouge. Le bleu foncé montre les impulsions lumineuses des LED 1 et LED 2 à une fréquence find = 35 Hz et Wind = 4 ms utilisées pour induire la fibrillation. Immédiatement après la fin du stimulus lumineux, une fibrillation ventriculaire (FV) peut être observée. La photostimulation à base de micro-LED montrée en bleu clair (f def = 16 Hz, Wdef = 20 ms) met fin avec succès à l’arythmie. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Préparation du cœur. (a) Poitrine ouverte d’une souris montrant le cœur intact et les organes environnants. b) Cœur explanté immergé dans la solution glacée de Tyrode pour une préparation ultérieure. c) Cœur de souris correctement attaché à une aiguille contondante. d) Cœur murin suspendu dans la solution de Tyrode. Veuillez cliquer ici pour voir une version agrandie de cette figure.
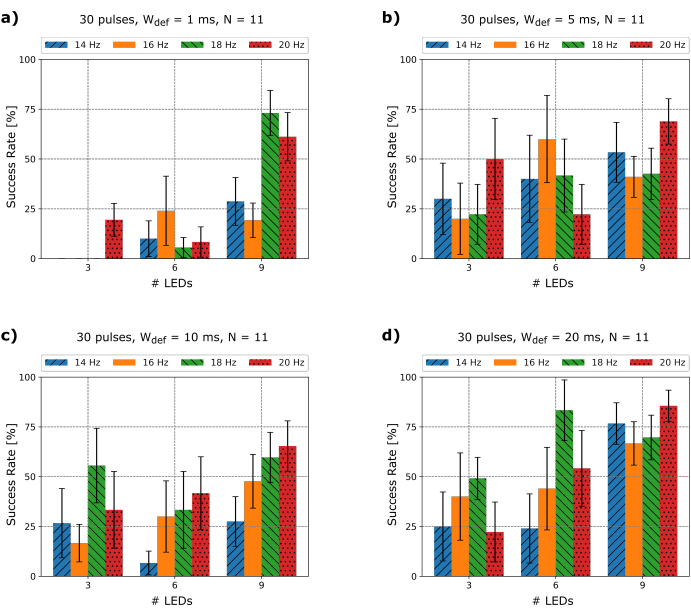
Figure 3 : Taux de réussite extraits expérimentalement. Taux de réussite pour 30 impulsions de photostimulation à base de micro-LED utilisant trois, six et neuf LED à différentes durées d’impulsion W def et fréquences fdef pour N = 11. Barres d’erreur affichées avec l’erreur type de la moyenne S.E.M. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Manipulation du rythme cardiaque par photostimulation. a) Segment d’un enregistrement ECG d’une arythmie non terminée. b) Spectrogramme de l’ECG représenté dans le panneau a. La densité spectrale de puissance (PSD) du segment (1) montre une arythmie avec une fréquence dominante de 24 Hz. Segment (2) photostimulation avec les paramètres indiqués. On peut observer que la fréquence dominante tombe à 14 Hz. Segment (3) Arrêt infructueux et retour au comportement arythmique avec une fréquence dominante de 24 Hz. (c) ECG d’une tentative de défibrillation réussie. d) Spectrogramme de l’arrêt réussi affiché dans le panneau c. Le segment (1) montre une tachycardie ventriculaire (VT) avec une fréquence dominante de 23 Hz. Segment (2) photostimulation en utilisant les paramètres indiqués. Le segment (3) affiche une terminaison réussie, ce qui conduit à un rythme sinusal normal avec une fréquence fondamentale de 3,5 Hz et les harmoniques résultantes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
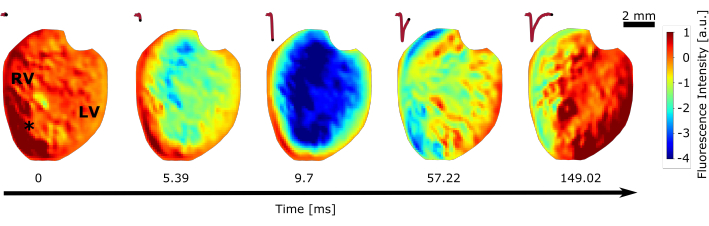
Figure 5 : Cartographie optique de l’ensemble du cœur. Le changement d’intensité de fluorescence au cours d’un seul battement du cœur dans le rythme sinusal normal est montré. Le cœur a été positionné face à la caméra de manière à ce que les ventricules droit et gauche soient visibles (RV, LV). L’astérisque indique le pixel auquel le potentiel d’action indiqué en haut a été effectué. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Nombre de microLED | Zone irradiée Aμled [mm2] | Flux radiant φ [mW] | Intensité lumineuse LI [mW mm-2] |
| 3 | 0.178 | 5,9 ± 0,47 | 33,11 ± 2,66 |
| 6 | 0.356 | 11,91 ± 0,84 | 33,42 ± 2,37 |
| 9 | 0.535 | 17,85 ± 0,61 | 33,39 ± 1,14 |
Tableau 1 : Flux rayonnant mesuré du réseau de micro-LED et intensité lumineuse correspondante.
Discussion
Un traitement réussi des tachyarythmies cardiaques est la clé de la thérapie cardiaque. Cependant, les mécanismes biophysiques sous-jacents à l’initiation, à la perpétuation et à l’arrêt de l’arythmie ne sont pas entièrement compris. Par conséquent, la recherche cardiaque vise à optimiser la thérapie par choc électrique vers une fin plus douce des arythmies, augmentant ainsi la qualité de vie des patients 28,29,30,31. Les approches électriques à faible énergie promettent une réduction significative des effets secondaires graves, mais peuvent encore induire une excitation musculaire indésirable. L’optogénétique cardiaque pourrait surmonter cette limitation et fournir non seulement une technique de terminaison douce des tissus, mais aussi une plate-forme flexible pour étudier le contrôle ciblé spécifique de l’arythmie des ondes d’excitation de type vortex dans le cœur murin intact et dans les cultures cellulaires32,33.
Compte tenu de cette motivation, une installation de photostimulation robuste, ainsi qu’un protocole ont été conçus et mis en œuvre, tous deux offrant un système optique hautement adaptable, qui pourrait facilement être étendu aux études de cartographie optique panoramique tridimensionnelle34.
Il a pu être démontré que les arythmies cardiaques peuvent être terminées avec succès avec différents taux de réussite en fonction des paramètres choisis pour la photostimulation, par exemple la zone éclairée sur le cœur. Les résultats présentés suggèrent que l’augmentation de la surface irradiée a recruté un nombre critique de cardiomyocytes éteignant l’activité chaotique par bloc de conduction comme le montre également22. Dans cette étude, l’énergie requise pour photodéfibriller est E = 10,69 ± 0,37 mJ (en utilisant neuf micro-LED, 30 impulsions et une largeur d’impulsion Wdef = 20 ms). Cela s’avère être inférieur à celui précédemment rapporté dans 22,24 avec E 22 = 228,8 mJ et E 24 = 153,6 mJ, où une plus grande surface22 ou le cœur entier 24 ont été éclairés, respectivement. Néanmoins, par rapport à l’approche illustrée en 35, où une zone bien délimitée est éclairée par 10 impulsions de photodéfibrillation résultant en E 35 = 1,8 mJ, l’énergie de photodéfibrillation dans la présente étude est nettement plus élevée. Contrairement aux trois autres approches, un taux de réussite supérieur à 90% n’a pas pu être atteint avec le protocole présenté. Une raison possible de la performance réduite malgré une énergie de photodéfibrillation plus élevée pourrait être que la complexité de l’arythmie sous-jacente n’est pas prise en compte. En ce qui concerne les résultats présentés en 35, où un taux de terminaison élevé est obtenu en éclairant une petite zone du cœur et en mesurant simultanément la dynamique spatio-temporelle d’une arythmie, l’approche présentée peut certainement être encore améliorée en considérant le contrôle de rétroaction, qui répond par un modèle différent d’éclairage micro-LED en fonction de l’état actuel du cœur. De plus, il a également été démontré que bien que les arythmies ne puissent pas toujours être terminées avec la méthode actuelle, la dynamique complexe intrinsèque peut être perturbée pendant la photostimulation conduisant à un état temporel plus ordonné. Comme le montrela section 36, le taux de terminaison est significativement différent lorsqu’il s’agit d’arythmies monomorphes (plus ordonnées) et polymorphes (moins ordonnées). Par conséquent, l’étape logique vers un meilleur taux de défibrillation pourrait être d’influencer la dynamique cardiaque pendant un épisode de FV, de transformer l’arythmie en un schéma moins complexe et de terminer avec une autre série d’impulsions, construisant ainsi une approche de photostimulation en deux étapes.
En ce qui concerne le protocole de perfusion, les étapes les plus critiques se trouvent dans l’extraction et la préparation correctes du cœur ainsi que dans le réglage correct de l’optique de cartographie. La cartographie optique nécessite strictement la sélection appropriée de spectres de colorants, de sources lumineuses d’excitation appropriées et de filtres optiques bien choisis pour la caméra29. Sinon, les signaux optiques enregistrés pourraient être trop bruyants et pourraient également contenir une diaphonie de photostimulation avec excitation de colorant. Une analyse ultérieure nécessiterait donc un post-traitement des signaux avec plusieurs filtres analytiques et un lissage de l’image entraînant souvent une aggravation.
Une autre étape cruciale de ce protocole est le placement correct et précis du réseau de micro-LED. Étant donné que le fil d’interconnexion entre le réseau de micro-LED et le pilote est très mince et flexible, il est parfois difficile de s’assurer que le réseau sera situé à peu près au même endroit sur la surface du cœur pour chaque expérience. Pour faciliter le positionnement et fixer la position acquise du réseau de micro-LED, un support a été conçu et imprimé en 3D, permettant de fixer le réseau à un micromanipulateur. Cela donne plus de contrôle sur le mouvement du réseau dans la solution du Tyrode. Selon le matériau choisi pour le fil d’interconnexion du réseau de micro-LED, l’utilisation d’un support peut ne pas être nécessaire.
En outre, une autre étape critique du protocole est l’ajout de médicaments pro-arythmie, comme par exemple, Pinacidil37. Étant donné que plusieurs composés chimiques sont bien connus pour modifier la réponse physiologique du cœur, cela devrait être pris en compte lors de l’analyse et de l’interprétation des résultats. En ce qui concerne la cartographie optique, le protocole proposé utilise la blébbistatine comme découpleur mécanique. Cela a l’avantage de supprimer les artefacts de mouvement pendant l’enregistrement, mais cela peut également prolonger l’APD27. Pour surmonter cet inconvénient, l’analyse des méthodes de suivi de mouvement pendant l’enregistrement pourrait être envisagée38,39. De cette façon, l’état physiologique normal du cœur serait préservé et un signal de haute qualité pourrait être obtenu.
Bien qu’il ait été prouvé que le protocole présenté peut être utilisé pour la photo-défibrillation multi-sites, il présente encore certaines limites. Il a été constaté que dans certains cas, la fibrillation ne peut pas être terminée par la photostimulation à base de micro-LED, mais seulement être perturbée, ce qui entraîne des changements de fréquence. Une hypothèse est que les ondes sinueuses sur le cœur ne sont déplacées que du ventricule gauche, se régénérant dans d’autres parties du cœur. Par rapport à d’autres méthodes telles que l’illumination globale24, la méthode actuelle offre un taux de réussite inférieur en raison d’une couverture plus petite du cœur. Cependant, nous sommes convaincus qu’avec la méthode de reconnaissance matérielle appropriée de l’activité en spirale, l’amélioration du taux de réussite de la terminaison est réalisable.
En conclusion, le système de photostimulation présenté établit un outil expérimental puissant pour de multiples approches de cardioversion et des études de manipulation de l’arythmie cardiaque. Les connaissances acquises dans ce système seront utilisées pour étudier et évaluer de nouveaux protocoles potentiels de défibrillation (photo) dans des modèles de grands animaux cliniquement pertinents.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Les auteurs tiennent à remercier Marion Kunze et Tina Althaus pour leur excellent soutien technique lors des expériences. La recherche qui a conduit aux résultats a reçu un financement du septième programme-cadre de la Communauté européenne FP7/2007-2013 sous le numéro de convention de subvention HEALTH-F2-2009-241526. Le Centre allemand de recherche cardiovasculaire, DZHK e.V. (projet MD28), le site partenaire de Göttingen, la Fondation allemande pour la recherche CRC 1002 (projet C03) et la Société Max Planck ont également apporté leur soutien. Ce travail a été en partie soutenu par BrainLinks-BrainTools, Cluster of Excellence financé par la Fondation allemande pour la recherche (DFG, numéro de subvention EXC 1086).
matériels
| Name | Company | Catalog Number | Comments |
| Chemical Components | |||
| Blebbistatin | TargetMol | T6038 | 10 mM stock solution |
| BSA/Albumin | Sigma-Aldrich | A4919 | |
| Calcium Chloride | Sigma-Aldrich | C1016 | CaCl2 |
| Carbogen | Westfalen | 50 l bottle | |
| DI-4-ANBDQPQ | AAT Bioquest | 21499 | Dye for Optical Mapping |
| Glucose | Sigma-Aldrich | D9434 | C6H12O6 |
| Heparin | LEO Pharma | Heparin-Natrium Leo 25.000 I.E./5 ml, available only on prescription | |
| Hydrochlorid Acid | Merck | 1.09057.1000 | HCl, 1 M stock solution |
| Isoflurane | CP Pharma | 1 ml/ml, available only on prescription | |
| Magnesium Chloride | Merck | 8.14733.0500 | MgCl2 |
| Monopotassium Phosphate | Sigma-Aldrich | 30407 | KH2PO4 |
| Pinacidil monohydrate | Sigma-Aldrich | P154-500mg | 10 mM stock solution |
| Potassium Chloride | Sigma-Aldrich | P5405 | KCl |
| Sodium Bicarbonate | Sigma-Aldrich | S5761 | NaHCO3 |
| Sodium Chloride | Sigma-Aldrich | S5886 | NaCl |
| Sodium Hydroxide | Merck | 1.09137.1000 | NaOH, 1 M stock solution |
| Electrical Setup | |||
| Biopac MP150 | Biopac Systems | MP150WSW | data acquisition and analysis system |
| Custom-built ECG, alternative ECG100C | Biopac Systems | ECG100C | Electrocardiogram Amplifier |
| Custom-built water bath heater using heating cable | RMS Heating System | HK-5,0-12 | Heating cable 120W |
| Hexagonal water bath | |||
| LED Driver Power supply | Thorlabs | KPS101 | 15 V, 2.4 A Power Supply Unit with 3.5 mm Jack Connector for One K- or T-Cube. |
| LEDD1B LED Driver | Thorlabs | LEDD1B | T-Cube LED Driver, 1200 mA Max Drive Current |
| MAP, ECG Electrode | Hugo Sachs Elektronik | BS4 73-0200 | Mini-ECG Electrode for isoalted hearts |
| micro-LED Driver e.g. AFG | Agilent Instruments | A-2230 | Arbitrary function generator (AFG) |
| Signal Generator | Agilent Instruments | A-2230 | AFG |
| micro-LED Array Components | |||
| Epoxid glue | Epoxy Technology | EPO-TEK 353ND | Two component epoxy |
| Fluoropolymer | Asahi Glass Co. Ltd. | Cytop 809M | Fluoropolymer with high transparency |
| Image reversal photoresist | Merck KGaA | AZ 5214E | Image Reversal Resist for High Resolution |
| LED chip | Cree Inc. | C460TR2227-S2100 | Blue micro-LED |
| Photoresist | Merck KGaA | AZ 9260 | Thick Positive Photoresists |
| Polyimide | UBE Industries Ltd. | U-Varnish S | Polyimide Solution |
| Silicone | NuSil Technology LLC | MED-6215 | Low viscosity silicone elastomer |
| Solvent free adhesive | John P. Kummer GmbH | Epo-Tek 301-2 | Epoxy resin with low viscosity |
| Optical Mapping | |||
| Blue Filter | Chroma Technology Corporation | ET470/40x | Blue excitation filter |
| Camera | Photometrics | Cascade 128+ | High performance EMCCD Camera |
| Camera Objective | Navitar | DO-5095 | Navitar high speed fixed focal length lenses work with CCD and CMOS cameras |
| Dichroic Mirror | Semrock | FF685-Di02-25x36 | 685 nm edge BrightLine® single-edge standard epi-fluorescence dichroic beamsplitter |
| Emmision Filter | Semrock | FF01-775/140-25 | 775/140 nm BrightLine® single-band bandpass filter |
| Heatsink | Advanced Thermal Solutions | ATSEU-077A-C3-R0 | Heat Sinks - LED STAR LED Heatsink, 45mm dia., 68mm, Black/Silver, Unthreaded Baseplate Hardware |
| LED 1 and LED 2 | LED Engin Osram | LZ4-00B208 | High Power LEDs - Single Colour Blue, 460 nm 130 lm, 700mA |
| LED 3 | Thorlabs | M625L3 | 625 nm, 700 mW (Min) Mounted LED, 1000 mA |
| Lenses | LED Engin Osram | LLNF-2T06-H | LED Lighting Lenses Assemblies LZ4 LENS NARROW FLOOD BEAM |
| Photodiode for power meter | Thorlabs | S120VC | Standard Photodiode Power Sensor |
| Power Meter | Thorlabs | PM100D | Compact Power and Energy Meter |
| Red Filter | Semrock | FF02-628/40-25 | BrightLine® single-band bandpass filter |
Références
- Davidenko, J. M., Pertsov, A. V., Salamonsz, R. Stationary and drifting spiral waves of excitation in isolated cardiac muscle. Nature. 355, 349-351 (1992).
- Fenton, F. H., et al. Termination of atrial fibrillation using pulsed low-energy far-field stimulation. Circulation. 120 (6), 467-476 (2009).
- Luther, S., et al. Low-energy control of electrical turbulence in the heart. Nature. 475, 235-239 (2011).
- Pumir, A., et al. Wave emission from heterogeneities opens a way to controlling chaos in the heart. Physical Review Letters. 99, 208101(2007).
- Deisseroth, K. Optogenetics. Nature Methods. 8, 26-29 (2011).
- Boyden, E. S., Zhang, F., Bamberg, E., Nagel, G., Deisseroth, K. Millisecond-timescale, genetically targeted optical control of neural activity. Nature Neuroscience. 8, 1263-1268 (2005).
- Nagel, G., et al. Channelrhodopsin-2, a directly light-gated cation-selective membrane channel. Proceedings of the National Academy of Sciences. 100 (24), 13940-13945 (2003).
- Bruegmann, T., et al. Optogenetic control of heart muscle in vitro and in vivo. Nature Methods. 7, 897-900 (2010).
- Natasha, G., et al. et al.Channelrhodopsins: visual regeneration and neural activation by a light switch. New Biotechnology. 30 (5), 461-474 (2013).
- Zhang, F., et al. Multimodal fast optical interrogation of neural circuitry. Nature. 446, 633-639 (2007).
- Alilain, W. J., et al. Light-induced rescue of breathing after spinal cord injury. Journal of Neuroscience. 28 (46), 11862-11870 (2008).
- Ahmad, A., Ashraf, S., Komai, S. Optogenetics applications for treating spinal cord injury. Asian Spine Journal. 9 (2), 299-305 (2015).
- Dieter, A., Keppeler, D., Moser, T. Towards the optical cochlear implant: Optogenetic approaches for hearing restoration. EMBO Molecular Medicine. 12 (4), e11618(2020).
- Keppeler, D., et al. Multichannel optogenetic stimulation of the auditory pathway using microfabricated LED cochlear implants in rodents. Science Translational Medicine. 12 (553), eabb8086(2020).
- Verhoefen, M. K., Bamann, C., Blöcher, R., Förster, U., Bamberg, E. The photocycle of channelrhodopsin-2: ultrafast reaction dynamics and subsequent reaction steps. ChemPhysChem. 11 (14), 3113-3122 (2010).
- Schwaerzle, M., Elmlinger, P., Paul, O., Ruther, P. Miniaturized tool for optogenetics based on an LED and an optical fiber interfaced by a silicon housing. 36th Annual Internation Conference IEEE Engineering in Medicine and Biology Society, Chicago, IL, , 5252-5255 (2014).
- Schwaerzle, M., Elmlinger, P., Paul, O., Ruther, P. Miniaturized 3 x 3 optical fiber array for optogenetics with integrated 460 nm light sources and flexible electrical interconnection. 28th IEEE Proceedigns. MEMS, Estoril, , 162-165 (2015).
- Diaz-Maue, L., Schwaerzle, M., Ruther, P., Luther, S., Richter, C. Follow the light - From low-energy defibrillation to multi-site photostimulation. 40thAnnual International Conference of IEEE Engineering in Medicine and Biology Society, Honolulu, HI, , 4832-4835 (2018).
- Zgierski-Johnston, C., et al. Cardiac pacing using transmural multi-LED probes in channelrhodopsin-expressing mouse hearts. Progress in Biophysics and Molecular Biology. , 51-61 (2020).
- mouser.de, LED Engin, [Online]. , Available: https://www.mouser.de/datasheet/2/228/5412893-LED_2520Engin_Datasheet_LuxiGen_LZ4-00B208- 1531969.pdf (2020).
- thorlabs.com, thorlabs, [Online]. , Available: https://www.thorlabs.com/_sd.cfm?fileName=25135-S01.pdf&partNumber=M625L3 (2020).
- Bruegmann, T., et al. Optogenetic defibrillation terminates ventricular arrhythmia in mouse hearts and human simulations. Journal of Clinical Investigation. 126 (10), 3894-3904 (2016).
- Richter, C., Christoph, J., Lehnart, S. E., Luther, S. Optogenetic light crafting tools for the control of cardiac arrhythmias. Methods in Molecular Biology. 1408, 293-302 (2016).
- Quiñonez Uribe, R. A., Luther, S., Diaz-Maue, L., Richter, C. Energy-reduced arrhythmia termination using global photostimulation in optogenetic murine hearts. Frontiers in Physiology. 9 (1651), (2018).
- Moreno, I. LED irradiance pattern at short distances. Applied Optics. 59 (1), 190-195 (2020).
- Predicting unpinning success rates for a pinned spiral in an excitable medium. Behrend, A., Bittihn, P., Luther, S. Computing in Cardiology, Belfast, , 345-348 (2010).
- Kappadan, V., et al. High-resolution optical measurement of cardiac restitution, contraction, and fibrillation dynamics in beating vs. blebbistatin-uncoupled isolated rabbit hearts. Frontiers in Physiology. 11 (464), (2020).
- Christoph, J., et al. Electromechanical vortex filaments during cardiac fibrillation. Nature. 555, 667-672 (2018).
- O'Shea, C. Cardiac optogenetics and optical mapping - Overcoming spectral congestion in all-optical cardiac electrophysiology. Frontiers in Physiology. 10 (182), (2019).
- Aras, K. K., Faye, N. R., Cathey, B., Efimov, I. R. Critical volume of human myocardium necessary to maintain ventricular fibrillation. Circulation: Arrhythmia and Electrophysiology. 11 (11), e006692(2018).
- Trayanova, N., Doshi, A. N., Prakosa, A. How personalized heart modeling can help treatment of lethal arrhythmias: A focus on ventricular tachycardia ablation strategies in post-infarction patients. Wiley Interdisciplinary Reviews in System Biology and Medicine. 12 (3), 1477(2020).
- Bingen, B., et al. Light-induced termination of spiral wave arrhythmias by optogenetic engineering of atrial cardiomyocytes. Cardiovascular Research. 104 (1), 194-205 (2014).
- Burton, R. A. B., et al. Optical control of excitation waves in cardiac tissue. Nature Photonics. 9 (12), 813-816 (2015).
- Dura, M., Schröder-Schetelig, J., Luther, S., Lehnart, S. E. Toward panoramic in situ mapping of action potential propagation in transgenic hearts to investigate initiation and therapeutic control of arrhythmias. Frontiers in Physiology. 5, 337(2014).
- Crocini, C., et al. Optogenetics design of mechanistically-based stimulation patterns for cardiac defibrillation. Science Reports. 6 (35628), (2016).
- Nyns, E. C. A., et al. Optogenetic termination of ventricular arrhythmias in the whole heart: towards biological cardiac rhythm management. European Heart Journal. 38 (27), 2132-2136 (2017).
- Wilde, A. A. K+atp channel opening and arrhythmogenesis. Journal of Cardiovascular Pharmacology. 24 (4), 35-40 (1994).
- Christoph, J., Luther, S. Marker-free tracking for motion artifact compensation and deformation measurements in optical mapping videos of contracting hearts. Frontiers in Physiology. 9 (1483), (2018).
- Christoph, J., Schröder-Schetelig, J., Luther, S. Electromechanical optical mapping. Progress in Biophysics and Molecular Biology. 130(B), 150-169 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon