Method Article
Измерение сердечного выброса на модели свиньи
В этой статье
Резюме
Термодилюция, петлевые катетеры и контрастная вентрикулография являются надежными и точными методами определения физиологии сердца, такой как ударный объем и сердечный выброс в лабораторных условиях у свиней.
Аннотация
Свиньи часто используются в медицинских исследованиях, учитывая их схожую физиологию сердца с физиологией человека. Измерение сердечных параметров, таких как ударный объем и сердечный выброс, имеет важное значение в этом типе исследований. Контрастная вентрикулография, термодилюция и петля давления (PV-петля) могут использоваться для точного получения данных о работе сердца в зависимости от имеющихся ресурсов и опыта. Для этого исследования пять йоркширских свиней были обезболены и интубированы. Получен центральный венозный и артериальный доступ для размещения необходимых измерительных приборов. Температурный зонд был помещен в корень аорты. В правое предсердие был доставлен холодный физиологический ком, и была зарегистрирована кривая температурного отклонения. Интегрирование площади под кривой позволило рассчитать текущий сердечный выброс. Катетер с косичкой был чрескожно помещен в левый желудочек и 30 мл йодсодержащего контраста был введен в течение 2 секунд. Изображения цифровой субтракционной ангиографии были загружены в программное обеспечение для объемного анализа для расчета ударного объема и сердечного выброса. В левый желудочек (ЛЖ) был помещен объемный катетер давления, который обеспечивал непрерывные данные о давлении и объеме ЛЖ, что позволило рассчитать как ударный объем, так и сердечный выброс. Все три метода продемонстрировали хорошую корреляцию друг с другом. Катетер PV-петли и термодилюция показали наилучшую корреляцию с ошибкой 3% и коэффициентом Пирсона 0,99, с 95% ДИ = 0,97 до 1,1 (p = 0,002). Катетер ПВ-петли в сравнении с вентрикулографией также показал хорошую корреляцию с ошибкой 6% и коэффициентом Пирсона 0,95, 95% ДИ = 0,96 до 1,1 (p = 0,01). Наконец, термодилюция на фоне вентрикулографии имела 2% ошибку при r=0,95, 95% ДИ=0,93 до 1,11, (p=0,01). В заключение мы заявляем, что катетер с PV-петлей, контрастная вентрикулография и термодилюция имеют определенные преимущества в зависимости от требований исследователя. Каждый метод надежен и точен для измерения различных сердечных параметров у свиней, таких как ударный объем и сердечный выброс.
Введение
Свиньи часто используются в исследованиях по контролю кровотечения и реанимации из-за их схожей физиологии с человеком. Неотъемлемой частью реанимационных исследований является непрерывный мониторинг сердечного выброса для оценки физиологической реакции на вмешательства. Существует несколько клинических систем, таких как катетеры легочной артерии (ПА) и системы на основе анализа пульсового контура1. Кроме того, эхокардиография (эхокардиография), компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) могут использоваться для сбора гемодинамических данных. Изображения, полученные во время конечной диастолы и систолы, могут быть использованы для определения объема крови, выбрасываемой во время этого сердечного цикла. Несмотря на то, что эти методы являются минимально инвазивными, они представляют только данные, полученные во время визуализации, и не обеспечивают непрерывных измерений2. Они также либо в значительной степени зависят от оператора (эхокардиография), либо требуют современного, дорогостоящего оборудования (КТ и МРТ). Учитывая возможности и ресурсы различных лабораторий, существуют различные альтернативные методы оптимального измерения сердечного выброса в каждом конкретном случае.
Термодилюция является распространенным методом измерения сердечного выброса в клинических условиях с использованием катетера Свана-Ганца3. Этот метод может быть воссоздан в лабораторных условиях на свиньях для непосредственного измерения сердечного выброса. Контрастная вентрикулография также может быть использована, если рентгеноскопические возможности легко доступны4. Наконец, петлевые катетеры давления-объема предлагают средства прямого измерения давления и объема желудочков на основе удара к удару и могут генерировать более тонкие данные5. Этот метод использует электрический адмиттанс и уравнение Вэя для измерения объема камеры. По сравнению со старыми катетерами на основе проводимости, катетеры с адмиттансом устраняют явление параллельной проводимости между кровью и сердечной мышцей, тем самым производя более точные измерения без необходимостиповторной калибровки.
Целью данного исследования является проверка точности этих трех методов в сравнении друг с другом с точки зрения измерения объема и выхода сердечного удара в модели здоровой свиньи. В конечном счете, каждый исследователь может выбрать, какой подход лучше всего соответствует его потребностям, в зависимости от его требований к исследованию и имеющихся у него ресурсов.
протокол
Процедуры были одобрены Университетом штата Мэриленд, Балтиморским комитетом по уходу за животными и их использованию (Одобрение #0320017) и соответствуют рекомендациям Национальных институтов здравоохранения по этическим исследованиям на животных. В исследование были включены пять взрослых самцов йоркширских свиней весом от 50 до 70 кг. В этом исследовании использовалась цифровая система сбора данных и сопряженное программное обеспечение для записи всех гемодинамических и температурных данных. Измерение сердечных параметров на модели свиньи состояло из следующих этапов: подготовка, термодилюция, вентрикулография, установка PV-петлевого катетера и, наконец, эвтаназия. Все пять животных прошли каждый из трех протоколов измерения сердечного выброса.
1. Отбор и содержание животных
- Используйте подростка-самца йоркширской свиньи (Sus Scrofa) весом 50-70 кг.
- Размещайте животных в клетках площадью не менее 30 квадратных футов с высокоуглеродистой подстилкой, такой как сено, солома или сосновая стружка. Приютите животное индивидуально в ночь перед процедурой.
- Предусмотрите период акклиматизации для новых животных в соответствии с рекомендациями учреждения.
ПРИМЕЧАНИЕ: Обычно это 48-72 часа для крупных млекопитающих7. - Кормите животных стандартным рационом и обеспечьте свободный доступ к воде до ночи перед экспериментом.
- Голодайте животных в ночь перед процедурой, чтобы свести к минимуму риск аспирации во время эндотрахеальной интубации.
- Еженедельно следите за здоровьем животных, осматривая кожу на наличие признаков травм, таких как струпья, царапины или ссадины. Обеспечьте нормальную работу дыхания (15-30 вдохов/мин) и правильное, интерактивное поведение. Следите за тем, чтобы слизистая оболочка полости рта была розовой, влажной и без выделений.
- Регулярно взвешивайте животных, чтобы убедиться в том, что они получают достаточное питание. Сообщайте о любых отклонениях ветеринарному персоналу, а затем исключайте животное из протокола.
2. Седация и индукция общей анестезии
- Усыпляют животное в области содержания путем внутримышечного введения Телазола (4-5 мг/кг)/Ксилазина (1,8-2,2 мг/кг) в жировую подушку каудально к уху.
- Подождите, пока животное не будет полностью усыплено и реакция на стимуляцию будет сведена к минимуму или вообще не отсутствует, чтобы обеспечить безопасное обращение с животным и его транспортировку.
- Транспортируйте животное из зоны содержания в процедурный кабинет и положите его в лежачем положении на операционный стол.
- Поместите пульсоксиметрический зонд на ухо животного и начните вентиляцию животного с помощью маски для морды с использованием аппарата искусственной вентиляции легких со 100%O2. Обеспечьте надлежащую герметизацию резиновой прокладки маски вокруг рыла. После того, как будет обеспечена надлежащая герметизация, введите 3-4% изофлуран до тех пор, пока не будет введена общая анестезия и челюсть не расслабится.
ПРИМЕЧАНИЕ: Обязательно следуйте рекомендациям учреждения по использованию ингаляционных летучих веществ. В целом, процедурный кабинет должен хорошо проветриваться, а для исключения ингаляционного воздействия должен использоваться надлежащий механизм очистки/вентиляции. - Поместите оротрахеальную трубку с помощью ларингоскопа, выключив исофурановый вапорайзер и сняв маску рыла. Попросите второго человека держать челюсти открытыми, пока оператор вставляет ларингоскоп и смещает надгортанник вентрально от мягкого неба. После того, как голосовые связки будут визуализированы, вставьте 8-0 эндотрахеальная трубка (ЭТ) через голосовые связки не менее чем на 5 см.
- Надуйте манжету ЭТ 10 мл воздуха и закрепите трубку ЭТ на морде животного с помощью пуповинной ленты. Подтвердите установку трубки путем подъема грудной клетки, концентрацииCO2 в конце выдоха и/или аускультации грудной клетки.
- Подсоедините трубку ЭТ к наркозному аппарату с помощью теплообменника и влаги.
- Отрегулируйте настройки аппарата искусственной вентиляции легких таким образом, чтобы обеспечить вдыханиеO2 в размере 30%, с дыхательным объемом 7-10 мл/кг и частотой дыхания 10-16 вдохов/мин, чтобы поддерживать напряжениеCO2 в конце выдоха на уровне 38-42 мм рт.ст.
- Вернуть и поддерживать ингаляционный анестетик с использованием 1,5-3% изофлурана. Следите за животным на предмет признаков боли и дискомфорта, таких как непроизвольные движения или тахикардия. Корректируйте изофлуран до тех пор, пока движения не погаснут или не пройдет тахикардия.
3. Стерилизация и подготовка хирургического поля
- Подстригайте волосы, лежащие над ними, и участки чрескожного доступа (двусторонняя вентральная шея) с помощью электрической машинки для стрижки волос.
- Подготовьте и потрите все места чрескожных проколов бетадином и изопропиловым спиртом и дайте полностью высохнуть.
- Наложите стерильные простыни вокруг операционного участка, чтобы сохранить стерильные операционные поля и предотвратить загрязнение. Закрепите их на месте скобами.
- Закрепите животное на операционном столе, привязав передние и задние конечности к столу с помощью ленты или веревки. Поместите грелку под животное и установите температуру 37 °C.
- Нанесите лубрикант на водной основе на кончик температурного зонда и вставьте зонд в прямую кишку, чтобы обеспечить непрерывные данные о температуре тела.
- Поместите адгезивные электроды ЭКГ на правую и левую боковую стенку грудной клетки. Подсоедините отвести ЭКГ к адгезивным электродам и подсоедините отвести ЭКГ к блоку сбора данных.
- Осторожно переверните животное в положение вентрального лежания, убедившись, что трубка дыхательных путей и отведения ЭКГ контролируются во время перемещения.
4. Канюляция наружной яремной вены
ПРИМЕЧАНИЕ: Доступ к яремным венам достигается при введении канюли правой венозной вены предсердия во время процедуры термодилюции.
- Под ультразвуковым контролем (УЗИ) определите местоположение наружной яремной вены в яремной борозде, расположенной в боковой области шеи. Проколите кожу иглой 18 G, расположенной под углом 45° к коже, и продвигайте кончик в венозный просвет под контролем УЗИ.
- Пропустите проводник Сельдингера 0,035 дюйма через иглу в венозный просвет. Извлеките иглу, оставив проводник на месте в венозном просвете.
- Сделайте разрез кожи толщиной 5 мм рядом с проволокой с помощью скальпеля с лезвием #11 и проденьте оболочку длиной 15 см, 7 Fr с расширителем в вену над направляющей проволокой. Снимите проводник и расширитель. Следите за тем, чтобы ножны оставались на месте. Прострочите оболочку на месте, пришить ее к коже шелковыми швами 3-0.
- Повторите шаги с 4.1 по 4.3, чтобы канюлировать контралатеральную наружную яремную вену.
5. Канюляция сонной артерии
ПРИМЕЧАНИЕ: Канюляция сонной артерии проводится для обеспечения доступа к ЛЖ и корню аорты во время термодилюции, контрастной вентрикулографии и введения катетера PV-петли.
- Локализируйте сонную артерию латерально к трахее с помощью УЗИ-зонда. Обеспечьте пульсирующий поток с помощью цветной допплеровской визуализации, если таковая имеется.
- Проколите кожу иглой 18 G, расположенной под углом 45° к коже, и продвигайте ее в просвет артерии под ультразвуковым контролем. Проведите проводник Сельдингера 0,035 дюйма через иглу в просвет артерии. Извлеките иглу, оставив проводник на месте в просвете артерии.
- Сделайте разрез кожи толщиной 5 мм рядом с проволокой с помощью скальпеля с лезвием #11 и проденьте в артерию через проводник оболочку диаметром 20 см 7 Fr с расширителем. Оставьте 5-10 см влагалища за пределами кожи. Снимите направляющую проволоку и расширитель и убедитесь, что тубус остается на месте. Закрепите ножны на месте, приложив их к коже шелковыми швами3-0 8.
6. Измерение сердечного выброса
Примечание: Все следующие методы выполняются последовательно на каждом из 5 животных, использованных в этом исследовании.
- Терморазбавление
- Введите датчик термопары Т-образного типа через оболочку сонной артерии и введите зонд в корень аорты под контролем рентгеноскопии.
- Подключите щуп к системе сбора данных. Потратьте несколько минут на сбор данных, чтобы установить уверенную базовую температуру аорты. Уверенная базовая температура достигается, когда температура остается в пределах 1 °C от центрального значения в течение 2-3 минут после сбора данных.
- Затем введите катетер 5 Fr, 110 см через наружную оболочку яремной вены и проведите катетер к правому предсердию с помощью рентгеноскопии.
- После того, как положение будет проверено, с усилием протолкните в катетер 20 мл физиологического раствора 12 °C.
- Наблюдайте за кривой отклонения температуры в программном обеспечении для сбора данных. Выделите эту область и используйте функцию сердечного выброса программного обеспечения для расчета сердечного выброса (Рисунок 1).
- Повторите этот процесс 3-5 раз по мере необходимости, чтобы получить среднее значение по этим измерениям.
- Вентрикулография
- Используя портативный рентгеновский рентгеноскопический контроль, введите проводник 0,035 дюйма через оболочку сонной артерии в левый желудочек. Отодвиньте оболочку так, чтобы наконечник пересекал аортальный клапан. Снимите направляющую проволоку диаметром 0,035 дюйма и вставьте маркерный катетер для косички диаметром 80 см через оболочку сонной артерии так, чтобы косичка находилась в верхушке ЛЖ. Отведите влагалище на 5 см, оставив косичку на месте, чтобы влагалище больше не находилось внутри ЛЖ.
- Убедитесь, что весь персонал в помещении одет в фартук, эквивалентный 0,5 мм. Попросите всех, кто находится в пределах 1 м от излучателя, надеть свинцовые очки.
- Сведите к минимуму время включения луча и убедитесь, что излучатель хорошо коллимирован, чтобы снизить воздействие на персонал лаборатории.
- Убедитесь, что весь персонал находится как можно дальше от излучателя, но при этом может выполнять процедуру для снижения воздействия.
- Присоедините катетер к инжектору контрастной мощности с загруженным йодсодержащим контрастом не менее 30 мл. Обратите внимание на текущую частоту сердечных сокращений животного.
- Настройте инжектор питания так, чтобы он обеспечивал контрастность 15 мл/с, что в сумме составляет 30 мл, и поставьте устройство под охрану.
- Настройте флюороскоп для цифровой субтракционной ангиографии (DSA) со скоростью 30 кадров в секунду при 30° слева вперед под углом.
- Запустите DSA на флюороскопе и подождите, пока изображение вычтется. Начните инжекцию мощности, как только рентгеноскопический аппарат покажет изображение вычитания. Для этого необходимо нажать кнопку инжектора, как только рентгеноскопический аппарат вычтет рентгеноконтрастный материал из изображения, чтобы во время серии изображений затемнялась только камера ЛЖ (рис. 2A).
ПРИМЕЧАНИЕ: В качестве альтернативы классическая рентгеноскопия может быть использована для вентрикулографии, если DSA недоступна. - Загрузите эти изображения в систему архивации и передачи изображений (PACS).
- Импортируйте изображения вентрикулограммы в программное обеспечение для количественной визуализации.
- Используя функцию анализа левого желудочка, откалибруйте программное обеспечение по изображению, используя отметки 1 см на маркерной косичке в качестве эталона.
- Нажмите на кнопку «Конец диастолы» и найдите на изображениях DSA кадр, отображающий наибольший объем LV, указывающий на окончание диастолы. Затем обведите границу LV с помощью мыши с небольшим шагом для обеспечения точности.
- Далее нажмите на кнопку End Systole и найдите рамку, изображающую конечную систолу, где объем LV наименьший. Снова обведите границу LV таким же образом, как и на предыдущем шаге.
- Нажмите кнопку «Анализировать ». Затем программа выполняет количественный объемный анализ сиспользованием метода Доджа-Сандлера 9 для расчета конечного систолического объема, конечного диастолического объема, а также ударного объема. Затем данные выводятся в документ анализа ЛЖ.
- Определите сердечный выброс путем умножения измеренного ударного объема на ранее зарегистрированную частоту сердечных сокращений.
- Используя портативный рентгеновский рентгеноскопический контроль, введите проводник 0,035 дюйма через оболочку сонной артерии в левый желудочек. Отодвиньте оболочку так, чтобы наконечник пересекал аортальный клапан. Снимите направляющую проволоку диаметром 0,035 дюйма и вставьте маркерный катетер для косички диаметром 80 см через оболочку сонной артерии так, чтобы косичка находилась в верхушке ЛЖ. Отведите влагалище на 5 см, оставив косичку на месте, чтобы влагалище больше не находилось внутри ЛЖ.
- Петлевой катетер давления и объема
- Предварительно замочите катетер PV-петли в обычном физрастворе не менее чем на 20 минут перед использованием. Подключите катетер к системе сбора данных.
- Вставьте кончик катетера PV-петли, содержащего датчик давления, в шприц с физиологическим раствором и держите датчик давления непосредственно под мениском. С помощью кнопок грубой и тонкой регулировки на модуле катетера отрегулируйте выходной сигнал давления до тех пор, пока он не достигнет 0 мм рт.ст. в программном обеспечении для сбора данных.
- Откалибруйте удельное сопротивление крови и ударный объем катетера PV-loop в соответствии с инструкциями производителя.
ПРИМЕЧАНИЕ: Производитель предлагает использовать удельное сопротивление крови 1,5 мОм и ударный объем 60 мл для крупных моделей животных. - Как и в шаге 6.2.1, вставьте проводник диаметром 0,035 дюйма в оболочку сонной артерии и продвигайте его в ЛЖ с помощью рентгеноскопического контроля. Продвигайте оболочку до тех пор, пока она не пройдет через аортальный клапан. Снимите проводниковую проволоку, оставив тубус на месте, и вставьте катетер PV-петли под рентгеноскопическим контролем через оболочку сонной артерии до тех пор, пока часть косички не окажется в верхушке ЛЖ (рис. 2B). Отодвиньте тубус на ~5 см так, чтобы он больше не находился в LV, оставив косичку на месте.
- В соответствии с инструкциями производителя выполните базовое сканирование перед сбором данных, перейдя к параметру «Сканирование базового уровня » на экране сбора данных и нажав кнопку «Ввод ». Базовое сканирование проводится с помощью катетерной системы PV-loop для подтверждения точного измерения частоты сердечных сокращений. Нажмите кнопку Enter еще раз, чтобы начать сбор данных о давлении и объеме. Сегменты объема можно прокручивать, чтобы получить наилучшую форму волны объема.
- Проверьте объемную кривую давления, выводимую в программное обеспечение для сбора данных. Убедитесь, что фотоэлектрическая петля записана адекватно, которая должна быть прямоугольной формы с гладкими краями. (Рисунок 2C). Если нет, аккуратно измените положение катетера либо скручивая, либо двигаясь вперед и назад, пока не будет зафиксирована соответствующая петля. Рассчитайте ударный объем и сердечный выброс, умножив частоту сердечных сокращений на разницу между конечным диастолическим и конечным систолическим объемом.
- Закрепите катетер на месте с помощью ленты или шва, чтобы обеспечить правильное положение на всем протяжении.
7. Эвтаназия
- Усыпить животное с помощью инъекции хлорида калия в дозе >2 мг-экв/кг (50-70 мл 2 мг-экв/мл KCl) через оболочку яремной вены.
- Продолжайте общую анестезию и мониторинг сердца до тех пор, пока трассировка ЭКГ не покажет отсутствие электрической активности сердца и давление CO2 в конце выдоха не достигнет 0 мм рт.ст.
ПРИМЕЧАНИЕ: Гемодинамический мониторинг поддерживался на протяжении всего эксперимента.
Результаты
Вес свиней варьировался от 51,4 кг до 61,5 кг при среднем весе 56,6 ± 3,6 кг. Средние инсультные объемы, измеренные с помощью катетера PV-петли, вентрикулографии и термодилюции у всех пяти субъектов, составили 58,0 ± 12,0 мл, 57,6 ± 8,5 мл и 53,0 ± 9,8 мл соответственно. Средние сердечные выбросы, измеренные с помощью PV-петлевого катетера, вентрикулографии и термодилюции у всех пяти пациентов, составили 5,0 ± 1,1 л/мин, 5,3 ± 1,2 л/мин и 5,2 ± 1,0 л/мин соответственно (таблица 1). На рисунке 3 показаны диаграммы рассеяния измерений сердечного выброса с помощью каждого из трех методов в сравнении с двумя другими. Линия тождества показывает, куда упали бы все баллы, если бы между каждым тестом было полное согласие. Линия идентичности для всех трех методов находится в пределах 95% доверительного интервала. При измерении сердечного выброса катетер PV-петли по сравнению с термодилюцией показал наилучшую корреляцию с коэффициентом Пирсона r=0,99 (рис. 3А). Наклон линии регрессии составил 1,03, что указывает на ошибку в 3% с 95% ДИ=0,97 до 1,1, p=0,002. Как видно на рисунке 3B, катетер PV-loop по сравнению с вентрикулографией также показал хорошую корреляцию с коэффициентом Пирсона r=0,95. Наклон линии регрессии составил 1,06, что указывает на ошибку 6% с 95% ДИ=0,96 до 1,1, p=0,01. Наконец, вентрикулография по сравнению с термодилюцией также показала согласие с коэффициентом Пирсона r=0,93 (рис. 3C). Наклон линии регрессии составил 1,02, что указывает на ошибку 2% с 95% ДИ=0,93 до 1,1 и p=0,01.
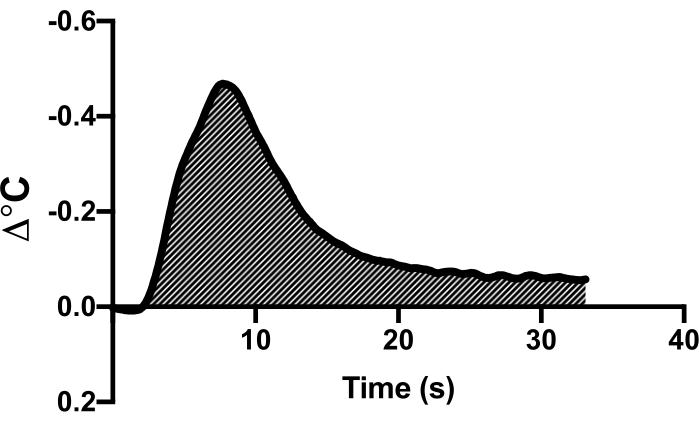
Рисунок 1: Пример кривой терморазбавления. Приведен пример кривой терморазбавления на одном репрезентативном животном, демонстрирующий отклонение температурной кривой при воздействии холодного солевого болюса. Площадь под кривой используется для расчета сердечного выброса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
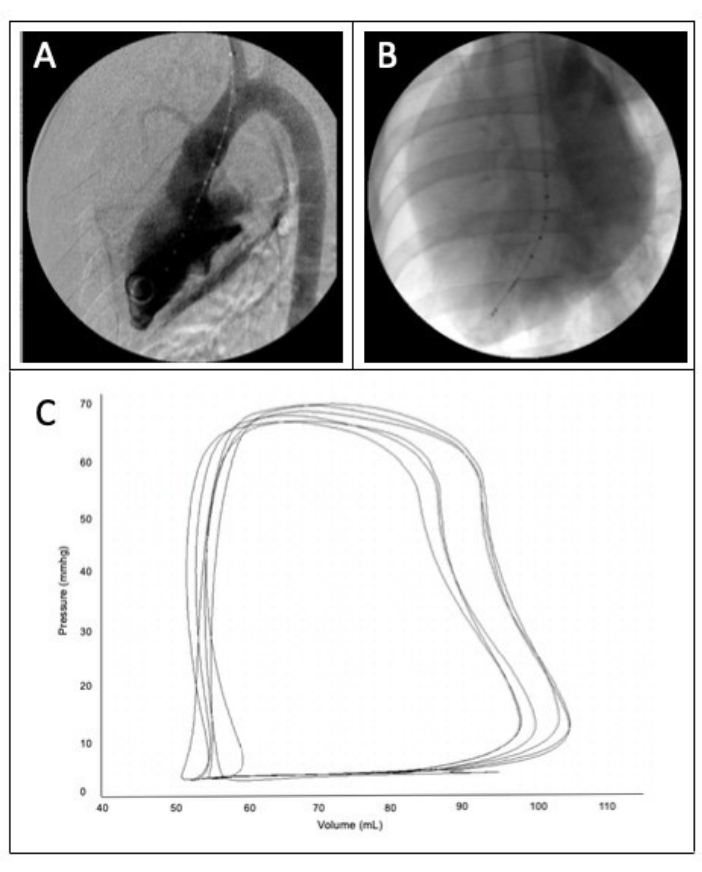
Рисунок 2: Вентрикулограмма и петли ЛВ. (А) Левый вентрикулограмма. (B) Успешная установка катетера PV-loop в верхушке LV. (C) Пример высококачественных PV-петель. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
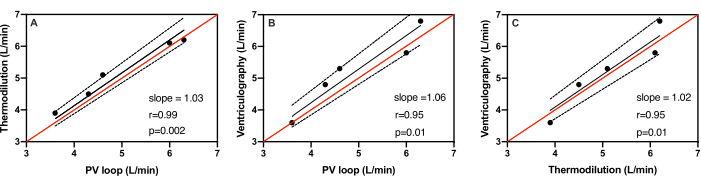
Рисунок 3: Линейная регрессия измерений сердечного выброса. Линейная регрессия измерений сердечного выброса у пяти различных животных с использованием (A) катетера PV-петли против (A). термодилюция, (В) катетер PV-петли в сравнении с вентрикулографией и (В) термодилюция в сравнении с вентрикулографией. Линия идентичности (красная) находится в пределах 95% доверительного диапазона (пунктирная) линии наилучшего соответствия (черная) среди всех трех методов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Метод | Объем удара (мл) | Сердечный выброс (л/мин) |
| PV-петля | 58,0 ± 12,0 | 5,0 ± 1,1 |
| Контрастная вентрикулография | 57,6 ± 8,5 | 5.3 ± 1.2 |
| Терморазбавление | 53,0 ± 9,8 | 5.2 ± 1.0 |
Таблица 1: Средние результаты сердечных показателей с помощью петли ЛВ, контрастной вентрикулографии и термодилюции.
Обсуждение
В этом исследовании подробно описан стандартизированный метод, состоящий из трех различных способов точного измерения сердечного выброса у свиней. Свиньи имеют анатомию и физиологию сердечно-сосудистой системы, аналогичную человеческой, и обычно используются в качестве модели для физиологии сердца человека, в частности, для доклинической оценки хирургических и интервенционныхпроцессов. Это позволяет свиньям служить основной моделью для сердечно-сосудистой физиологии, патологии и новых биотехнологий. Для того чтобы оценить эти концепции, гемодинамический мониторинг должен быть доступным и надежным инструментом для моделей свиней.
Катетеры с PV-петлей обычно не используются в медицине из-за неотъемлемого риска длительной канюляции желудочков (т.е. аритмии, образования тромбов и повреждения миокарда). Несмотря на это, они иногда используются в течение короткого времени во время процедур катетеризации сердца для измерения ударного объема и ударной работы13. Тем не менее, в исследованиях на здоровых животных, не выживающих, польза и универсальность катетеров PV-loop обычно перевешивают вышеупомянутые риски. Другие клинические инструменты включают катетеры легочной артерии. Однако этот метод предполагает, что выход правого сердца совпадает с выходом левого сердца, и игнорирует вариации на выходе между двумя камерами12. Метод термодилюции, описанный в этом исследовании, смягчает эти вариации путем измерения термодилюции в обоих желудочках сердца одновременно, а не только в правомжелудочке. Учитывая эти ограничения, для надежного получения данных о работе сердца в лабораторных условиях можно использовать контрастную вентрикулографию, катетер с ПВ-петлей или термодилюцию.
Что касается канюляции сосудов, в этом исследовании использовалась техника Сельдингера, а не сосудистая канюляция. Техника Сельдингера была использована благодаря быстрому сосудистому доступу с навыками новичка и небольшим количеством осложнений. И наоборот, открытое расслоение сосудов требует большего набора навыков и сопряжено с большим риском осложнений, которые могут либо задержать, либо даже запретить дальнейшие эксперименты на животном. Кроме того, в этом исследовании используется канюляция сонной артерии, а не бедренная канюляция. Во многом это связано с легкостью доступа к камерам сердца, исключающей необходимость навигации по дуге аорты для доступа к ЛЖ. Такой выбор протоколов позволил обеспечить более эффективный сосудистый доступ и эндоваскулярную навигацию, что придает этим методам универсальность и простоту использования в различных протоколах в лабораторных условиях.
Это исследование демонстрирует, что у здоровых свиней наблюдается хорошая корреляция сердечных параметров между различными методами измерения, включая контрастную вентрикулографию с количественным объемным анализом, термодилюцию и катетер PV-петли. Когда данные измерений между двумя методами сравниваются напрямую, тождественная линия указывает, куда попали бы все измерения, если бы междудвумя методами существовало полное согласие. Катетер ПВ-петли, вентрикулография и термодилюция производили измерения, в которых линия идентичности попадала в диапазон доверительных интервалов, что указывает на точность измерений каждым методом при сравнении друг с другом.
Исходя из имеющихся ресурсов и опыта, можно выбрать оптимальный метод. Если есть доступ к набору измерительных зондов и сбора данных, в зависимости от потребностей протокола идеальным выбором являются катетеры PV-петли или термодилюирование. Катетеры PV-loop обеспечивают непрерывный сбор данных в режиме реального времени на протяжении всего экспериментального протокола и обеспечивают множество сердечных параметров, включая ударный объем, фракцию выброса, конечный диастолический объем, конечный систолический объем и работу при инсульте. Термодилюция обеспечивает быстрые и простые, мгновенные измерения при необходимости и позволяет избежать необходимости канюляции желудочков. Метод, описанный в этом исследовании, также имеет преимущество в измерении сердечного выброса в обоих желудочках сердца. Наконец, при ограниченном доступе к передовым измерительным инструментам бентрикулография с контрастным вентрикулографией с программным обеспечением для объемного анализа легко доступна и требует сравнительно небольшого опыта для использования.
У каждого из этих методов есть несколько ограничений. А именно, все они потребуют легкодоступной рентгеноскопии для подтверждения различных положений катетеров при получении измерений. Выбор анестетика также влияет на работу сердца, но каждый метод будет обеспечивать последовательные измерения при условии использования одного и того же анестетика. Наконец, данное исследование ориентировано на здоровых животных без сердечной патологии. Согласованность и точность между этими методами могут различаться с учетом различных состояний хронического заболевания, таких как сердечная недостаточность, клапанная регургитация или кардиомиопатия. Тем не менее, эти три метода предлагают исследователям гибкость в выборе метода, который является наиболее идеальным для данного эксперимента, обеспечивая при этом надежные и точные измерения сердечной деятельности у здоровых свиней.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Никакой
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride injection | Hospira | 0409-4888-50 | |
| 7 Fr Introducer Kit | Terumo | RCFW-5.0-35 | |
| Anesthesia Machine | Drager | Fabius Tiro | |
| Contrast Power Injector | GEHealthcare | E8004N | |
| Fluoroscope | GEHealthcare | OEC 9800 | |
| Heating/Cooling T/pump | Gaymar | Tp-700 | |
| Isoflurane | Baxter | 10019-360-40 | |
| Jackie catheter | Terumo | 40-5023 | |
| Omnipaque | GEHealthcare | 559289 | |
| PowerChart | ADinstruments | ML866/P | Software |
| PowerLab | ADinstruments | PL3516 | |
| PV-loop catheter | Transonic | Prefer pigtail tip to straight tip | |
| PV-loop module | Transonic | FFS-097-A004 | |
| Surgical suture, black braided silk, 3.0 | Surgical Speciaties Corp. | ||
| Thermocouple probe | ADinstruments | MLT1401 | |
| Ultrasound probe | Philips | L12-4 | |
| Various-sized syringes | |||
| ViewPlus | Sanders Data Systems | Software |
Ссылки
- Pinsky, M. R., Payen, D. Functional hemodynamic monitoring. Critical Care. 9, London. England. 566-572 (2005).
- Geerts, B. F., Aarts, L. P., Jansen, J. R. Methods in pharmacology: Measurement of cardiac output. British Journal of Clinical Pharmacology. 71, 316-330 (2011).
- Argueta, E. E., Paniagua, D. Thermodilution cardiac output: A concept over 250 years in the making. Cardiology in Review. 27, 138-144 (2019).
- Higgins, C. B., et al. Quantitation of left ventricular dimensions and function by digital video subtraction angiography. Radiology. 144, 461-469 (1982).
- Abraham, D., Mao, L. Cardiac pressure-volume loop analysis using conductance catheters in Mice. Journal of Visual Experiments. (103), e52942(2015).
- Porterfield, J. E., et al. Dynamic correction for parallel conductance, GP, and gain factor, α, in invasive murine left ventricular volume measurements. Journal of Applied Physiology. 107, 1693-1703 (2009).
- Obernier, J. A., Baldwin, R. L. Establishing an appropriate period of acclimatization following transportation of laboratory animals. Institution of Laboratory Animal Research Journal. 47, 364-369 (2006).
- Madurska, M. J., et al. Development of a selective aortic arch perfusion system in a porcine model of exsanguination cardiac arrest. Journal of Visualized Experiments. (162), e61573(2020).
- Dodge, H. T., Sandler, H., Ballew, D. W., Lord, J. D. The use of biplane angiocardigraphy for the measurement of left ventricular volume in man. American Heart Journal. 60, 762-776 (1960).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: comparisons with normal human cardiac structure. Journal of Anatomy. 193, 105-119 (1998).
- Smith, A. C., Swindle, M. M. Preparation of Swine for the Laboratory. Institution of Laboratory Animal Research Journal. 47, 358-363 (2006).
- Franklin, D. L., Van Citters, R. L., Rushmer, R. F. Balance between right and left ventricular output. Circulation Research. 10, 17-26 (1962).
- Borlaug, B. A., Kass, D. A. Invasive hemodynamic assessment in heart failure. Cardiology Clinics. 29, 269-280 (2011).
- Thrush, D., Downs, J. B., Smith, R. A. Continuous thermodilution cardiac output: Agreement with fick and bolus thermodilution methods. Journal of Cardiothoracic and Vascular Anesthesia. 9, 399-404 (1995).
- Izer, J., Wilson, R., Hernon, K., Ündar, A. Ultrasound-guided vessel catheterization in adult Yorkshire cross-bred pigs. Veterinary Anesthesia and Analgesia. 44, 133-137 (2017).
- Hanneman, S. K. Design, analysis, and interpretation of method-comparison studies. AACN Advanced Critical Care. 19, 223-234 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены