Method Article
Medición del gasto cardíaco en un modelo porcino
En este artículo
Resumen
La termodilución, los catéteres de bucle de presión-volumen y la ventriculografía con contraste son métodos fiables y precisos para determinar la fisiología cardíaca, como el volumen sistólico y el gasto cardíaco en un entorno de laboratorio en cerdos.
Resumen
Los cerdos se utilizan con frecuencia en la investigación médica dada su fisiología cardíaca similar a la de los humanos. La medición de parámetros cardíacos, como el volumen sistólico y el gasto cardíaco, es esencial en este tipo de investigación. Los catéteres de ventriculografía con contraste, termodilución y bucle de presión-volumen (PV-loop) se pueden utilizar para obtener datos de rendimiento cardíaco con precisión, según los recursos y la experiencia disponibles. Para este estudio, cinco cerdos de Yorkshire fueron anestesiados e intubados. Se obtuvo acceso venoso y arterial central para colocar los instrumentos de medición necesarios. Se colocó una sonda de temperatura en la raíz aórtica. Se administró un bolo de solución salina fría en la aurícula derecha y se registró la curva de deflexión de la temperatura. La integración del área bajo la curva permitió el cálculo del gasto cardíaco actual. Se colocó un catéter flexible por vía percutánea en el ventrículo izquierdo y se inyectaron 30 mL de contraste yodado durante 2 segundos. Las imágenes de angiografía por sustracción digital se cargaron en el software de análisis volumétrico para calcular el volumen sistólico y el gasto cardíaco. Se colocó un catéter de volumen de presión en el ventrículo izquierdo (VI) y proporcionó datos continuos de presión y volumen del VI, lo que permitió el cálculo tanto del volumen sistólico como del gasto cardíaco. Los tres métodos demostraron una buena correlación entre sí. El catéter PV-asa y la termodilución presentaron la mejor correlación con un error del 3% y un coeficiente de Pearson de 0,99, con IC=0,97 a 1,1 del 95% (p=0,002). El catéter PV-loop frente a la ventriculografía también mostró buena correlación con un error del 6% y un coeficiente de Pearson de 0,95, IC95%=0,96 a 1,1 (p=0,01). Finalmente, la termodilución frente a ventriculografía tuvo un error del 2% con r=0,95, IC95%=0,93 a 1,11, (p=0,01). En conclusión, afirmamos que el catéter de asa PV, la ventriculografía con contraste y la termodilución ofrecen ciertas ventajas en función de las necesidades del investigador. Cada método es fiable y preciso para medir diversos parámetros cardíacos en cerdos, como el volumen sistólico y el gasto cardíaco.
Introducción
Los cerdos se utilizan con frecuencia en el control de hemorragias y en la investigación de reanimación debido a su fisiología similar a la de los humanos. Una parte integral de la investigación en reanimación es la monitorización continua del gasto cardíaco para evaluar la respuesta fisiológica a las intervenciones. Existen varios sistemas clínicos, como los catéteres de arteria pulmonar (AP) y los sistemas basados en el análisis del contorno del pulso1. Además, la ecocardiografía (eco), la tomografía computarizada (TC) y la resonancia magnética (RM) se pueden utilizar para capturar datos hemodinámicos. Las imágenes obtenidas durante la diástole final y la sístole se pueden utilizar para determinar el volumen de sangre expulsada durante ese ciclo cardíaco. Si bien estas técnicas son mínimamente invasivas, solo presentan datos adquiridos en el momento de la obtención de imágenes y no proporcionan medidas continuas2. También dependen en gran medida del operador (eco) o requieren equipos avanzados y costosos (TC y RM). Dadas las capacidades y recursos de los diferentes laboratorios, existen varios métodos alternativos para medir el gasto cardíaco de manera óptima en cada caso.
La termodilución es un método común para medir el gasto cardíaco en el entorno clínico utilizando un catéter Swan-Ganz3. Este método se puede recrear en un entorno de laboratorio en cerdos para medir directamente el gasto cardíaco. La ventriculografía con contraste también se puede utilizar si la capacidad fluoroscópica está fácilmente disponible4. Por último, los catéteres de bucle presión-volumen ofrecen un medio para medir directamente la presión y el volumen ventricular latido a latido y pueden generar datos más matizados5. Este método utiliza la admitancia eléctrica y la ecuación de Wei para medir el volumen de la cámara. En comparación con los catéteres basados en conductancia más antiguos, los catéteres de admisión eliminan el fenómeno de conductancia paralela entre la sangre y el músculo cardíaco, produciendo así mediciones más precisas sin necesidad de calibración repetida6.
El objetivo de este estudio es validar la precisión de estos tres métodos entre sí en términos de medición del volumen y el gasto cardíaco sistólico en un modelo de cerdos sanos. En última instancia, cada investigador puede elegir el enfoque que mejor se adapte a sus necesidades, en función de los requisitos de su estudio y de los recursos de los que disponga.
Protocolo
Los procedimientos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Maryland, Baltimore (Aprobación #0320017) y se ajustaron a las pautas de los Institutos Nacionales de Salud para la investigación ética con animales. Se incluyeron en el estudio cinco cerdos Yorkshire machos adultos con un peso de entre 50 y 70 kg. Este estudio utilizó un sistema de recolección de datos digitales y un software emparejado para registrar todos los datos hemodinámicos y de temperatura. La medición de los parámetros cardíacos en el modelo porcino consistió en las siguientes etapas: preparación, termodilución, ventriculografía, inserción del catéter PV-loop y, finalmente, eutanasia. Los cinco animales se sometieron a cada uno de los tres protocolos de medición del gasto cardíaco.
1. Selección y alojamiento de animales
- Utilice cerdos Yorkshire machos adolescentes (Sus Scrofa) que pesen entre 50 y 70 kg.
- Aloje a los animales en jaulas de al menos 30 pies cuadrados en un área con lechos con alto contenido de carbono, como heno, paja o virutas de pino. Aloje al animal individualmente, la noche anterior al procedimiento.
- Permitir un período de aclimatación para nuevos animales según las pautas de la institución.
NOTA: Esto suele ser de 48 a 72 h para los grandes mamíferos7. - Alimente a los animales con una dieta estándar y proporcione acceso libre al agua hasta la noche anterior al experimento.
- Ayunar los animales la noche anterior al procedimiento para minimizar el riesgo de aspiración durante la intubación endotraqueal.
- Monitoree la salud de los animales semanalmente inspeccionando la piel en busca de signos de lesiones como costras, raspaduras o abrasiones. Asegure el trabajo normal de la respiración (15-30 respiraciones/min) y el comportamiento adecuado e interactivo. Asegúrese de que la mucosa oral esté rosada, húmeda y sin secreción.
- Pesar a los animales con regularidad para confirmar que tienen una nutrición adecuada. Informe cualquier anomalía al personal veterinario y luego excluya al animal del protocolo.
2. Sedación e inducción de anestesia general
- Sedar al animal en su zona de alojamiento mediante inyección intramuscular de Telazol (4-5 mg/kg)/xilacina (1,8-2,2 mg/kg) en la almohadilla de grasa caudal a la oreja.
- Espere hasta que el animal esté completamente sedado y haya una respuesta mínima o nula a la estimulación para garantizar el manejo y transporte seguros del animal.
- Transporte al animal desde el área de alojamiento hasta la sala de procedimientos y colóquelo en decúbito dorsal sobre la mesa de operaciones.
- Coloque una sonda de oximetría de pulso en el oído del animal y comience a ventilar al animal con una máscara de hocico utilizando un ventilador mecánico con 100% deO2. Asegúrese de sellar correctamente la junta de goma de la máscara alrededor del hocico. Una vez asegurado un sellado adecuado, se administra isoflurano al 3-4% hasta que se induzca la anestesia general y se relaje la mandíbula.
NOTA: Asegúrese de seguir las pautas institucionales para el uso de agentes volátiles inhalados. En general, la sala de procedimientos debe estar bien ventilada y se debe utilizar un mecanismo de barrido/ventilación adecuado para eliminar la exposición por inhalación. - Coloque un tubo orotraqueal con un laringoscopio apagando el vaporizador de isoflurano y quitando la máscara del hocico. Pida a una segunda persona que mantenga las mandíbulas abiertas mientras el operador inserta el laringoscopio y desplaza la epiglotis ventralmente lejos del paladar blando. Una vez visualizadas las cuerdas vocales, inserta un 8-0 tubo endotraqueal (ET) a través de las cuerdas vocales por al menos 5 cm.
- Infle el manguito ET con 10 mL de aire y asegure el tubo ET al hocico del animal con cinta umbilical. Confirme la colocación de la sonda mediante la elevación del tórax, el CO2 al final de la espiración y/o la auscultación del tórax.
- Conecte el tubo endotraqueal a la máquina de anestesia con un intercambiador de calor y humedad.
- Ajuste la configuración del ventilador mecánico para proporcionar una fracción inspirada deO2 del 30%, con un volumen corriente de 7-10 mL/kg y una frecuencia respiratoria de 10-16 respiraciones/min, para mantener una tensión de CO2 al final de la espiración de 38-42 mmHg.
- Regrese y mantenga el anestésico inhalado con isoflurano al 1,5-3%. Vigile al animal para detectar signos de dolor y malestar, como movimientos involuntarios o taquicardia. Ajuste el isoflurano hasta que los movimientos se extingan o la taquicardia se resuelva.
3. Esterilización y preparación del sitio quirúrgico
- Cortar el vello suprayacente y los sitios de acceso percutáneo (cuello ventral bilateral) con una cortadora de pelo eléctrica.
- Prepare y frote todos los sitios de punción percutánea con betadine y alcohol isopropílico y deje secar completamente.
- Coloque paños estériles alrededor de los sitios quirúrgicos para preservar los campos quirúrgicos estériles y evitar la contaminación. Asegúrelos en su lugar con grapas.
- Asegure al animal a la mesa de operaciones sujetando las extremidades delanteras y traseras a la mesa con cinta adhesiva o cuerda. Coloque la almohadilla térmica debajo del animal y ajústela a 37 °C.
- Aplique un lubricante a base de agua en la punta de la sonda de temperatura e inserte la sonda en el recto para proporcionar datos continuos de la temperatura corporal.
- Coloque los electrodos adhesivos de ECG en la pared torácica lateral derecha e izquierda. Conecte los cables de ECG a los electrodos adhesivos y conecte los cables de ECG a la unidad de recopilación de datos.
- Con cuidado, voltee al animal a la decúbito ventral, asegurándose de que el tubo de las vías respiratorias y los cables del ECG estén controlados durante la transferencia.
4. Canulación de la vena yugular externa
NOTA: Se obtiene acceso venoso yugular para la inserción de la cánula venosa auricular derecha durante el procedimiento de termodilución.
- Utilice la guía ecográfica (US) para localizar la vena yugular externa en el surco yugular situado en la región lateral del cuello. Perfore la piel con una aguja de 18 G colocada en un ángulo de 45° con respecto a la piel y avance la punta hacia la luz venosa bajo la guía de la ecografía.
- Pase una guía Seldinger de 0.035" a través de la aguja y dentro de la luz venosa. Retire la aguja dejando la guía en su lugar dentro de la luz venosa.
- Haga una incisión en la piel de 5 mm adyacente al alambre con un bisturí de hoja # 11 y pase una vaina de 15 cm y 7 Fr con un dilatador en la vena sobre el alambre guía. Retire la guía y el dilatador. Asegúrese de que la funda permanezca en su posición. Cose la funda en su lugar suturándola a la piel con suturas de seda 3-0.
- Repita los pasos 4.1 a 4.3 para canular la vena yugular externa contralateral.
5. Canulación de la arteria carótida
NOTA: La canulación de la arteria carótida se realiza para proporcionar acceso al VI y a la raíz aórtica durante la termodilución, la ventriculografía con contraste y la inserción del catéter con asa VP.
- Localice la arteria carótida lateral a la tráquea con una sonda de ecografía. Asegure el flujo pulsátil utilizando imágenes Doppler en color si están disponibles.
- Perfore la piel con una aguja de 18 G colocada en un ángulo de 45° con respecto a la piel y avancela hacia la luz arterial bajo visión de ultrasonido. Avance una guía Seldinger de 0.035" a través de la aguja y hacia el lumen arterial. Retire la aguja dejando la guía en su posición dentro de la luz arterial.
- Haga una incisión en la piel de 5 mm adyacente al alambre con un bisturí de hoja # 11 y pase una vaina de 20 cm 7 Fr con un dilatador en la arteria sobre el alambre guía. Deje 5-10 cm de la vaina fuera de la piel. Retire la guía y el dilatador y asegúrese de que la funda permanezca en su posición. Asegure la funda en su lugar suturándola a la piel con suturas de seda 3-08.
6. Medición del gasto cardíaco
NOTA: Todos los siguientes métodos se realizan secuencialmente en cada uno de los 5 animales utilizados en este estudio.
- Termodilución
- Inserte una sonda de termopar tipo T a través de la vaina arterial carótida y guíe la sonda hacia la raíz aórtica utilizando guía fluoroscópica.
- Conecte la sonda al sistema de recopilación de datos. Permita varios minutos de recolección de datos para establecer una temperatura aórtica basal confiable. Se logra una temperatura de referencia segura cuando la temperatura se mantiene dentro de 1 °C del valor central durante 2-3 minutos de recopilación de datos.
- A continuación, inserte un catéter de 5 Fr y 110 cm a través de la vaina de la vena yugular externa y desplácelo hasta la aurícula derecha mediante fluoroscopia.
- Una vez verificada la posición, enjuague con fuerza 20 mL de solución salina a 12 °C en el catéter.
- Observe la curva de deflexión de temperatura en el software de recopilación de datos. Resalte esta región y utilice la función de gasto cardíaco del software para calcular el gasto cardíaco (Figura 1).
- Repita este proceso de 3 a 5 veces según sea necesario para obtener un valor promedio en estas mediciones.
- Ventriculografía
- Usando la guía fluoroscópica de rayos X portátil, inserte una guía de 0.035" a través de la vaina arterial carotídea y dentro del ventrículo izquierdo. Avance la vaina de modo que la punta atraviese la válvula aórtica. Retire la guía de 0,035" e inserte un catéter marcador de 80 cm a través de la vaina arterial carotídea para que la cola quede en el ápice del ventrículo izquierdo. Retire la funda 5 cm mientras deja la coleta en su lugar para que la funda ya no quede dentro del VI.
- Asegúrese de que todo el personal de la sala lleve un delantal de plomo de 0,5 mm. Haga que cualquier persona que se encuentre a menos de 1 m del emisor use anteojos con plomo.
- Minimice el tiempo de encendido y asegúrese de que el emisor esté bien colimado para reducir la exposición del personal del laboratorio.
- Asegúrese de que todo el personal se mantenga lo más lejos posible del emisor y que al mismo tiempo pueda realizar el procedimiento para reducir la exposición.
- Conecte el catéter a un inyector de contraste con al menos 30 mL de contraste yodado cargado. Fíjate en la frecuencia cardíaca actual del animal.
- Configure el inyector de energía para que proporcione 15 mL/s de contraste para un total de 30 mL y arme el dispositivo.
- Configure el fluoroscopio para angiografía por sustracción digital (DSA) a 30 fotogramas/s a 30° de oblicuidad anterior izquierda.
- Inicie DSA en el fluoroscopio y espere a que la imagen se retraiga. Comience la inyección de energía tan pronto como la imagen de sustracción sea mostrada por la máquina de fluoroscopia. Para ello, presione el botón del inyector tan pronto como la máquina de fluoroscopia reste el material radioopaco de la imagen, de modo que solo la cámara del VI quede opacificada durante la serie de imágenes (Figura 2A).
NOTA: Alternativamente, la fluoroscopia clásica se puede utilizar para la ventriculografía si no se dispone de DSA. - Cargue estas imágenes en un sistema de comunicación y archivo de imágenes (PACS).
- Importe las imágenes del ventriculograma a un software de imágenes cuantitativas.
- Utilizando la función de análisis del ventrículo izquierdo, calibre el software a la imagen utilizando las marcas de 1 cm en el cable flexible del marcador como referencia.
- Haga clic en el botón Fin de la diástole y busque en las imágenes de la DSA el fotograma que representa el mayor volumen del VI que indica el fin de la diástole. A continuación, trace el borde del VI con el ratón en pequeños incrementos para garantizar la precisión.
- A continuación, haga clic en el botón Finalizar sístole y busque el marco que representa el final de la sístole donde el volumen de VI es menor. De nuevo, traza el borde LV de la misma manera que en el paso anterior.
- Haga clic en el botón Analizar . A continuación, el programa realiza un análisis volumétrico cuantitativo utilizando el método de área-longitud de Dodge-Sandler9 para calcular el volumen telesistólico, el volumen telediastólico y el volumen sistólico. A continuación, los datos se generan en un documento de análisis de BT.
- Determine el gasto cardíaco multiplicando el volumen sistólico medido por la frecuencia cardíaca registrada previamente.
- Usando la guía fluoroscópica de rayos X portátil, inserte una guía de 0.035" a través de la vaina arterial carotídea y dentro del ventrículo izquierdo. Avance la vaina de modo que la punta atraviese la válvula aórtica. Retire la guía de 0,035" e inserte un catéter marcador de 80 cm a través de la vaina arterial carotídea para que la cola quede en el ápice del ventrículo izquierdo. Retire la funda 5 cm mientras deja la coleta en su lugar para que la funda ya no quede dentro del VI.
- Catéter de asa presión-volumen
- Remoje previamente el catéter de asa PV en solución salina normal durante al menos 20 minutos antes de usarlo. Conecte el catéter al sistema de recolección de datos.
- Inserte la punta del catéter de asa PV que contiene el transductor de presión en una jeringa de solución salina y sostenga el transductor de presión justo debajo del menisco. Con los botones de ajuste grueso y fino del módulo de catéter, ajuste la señal de presión de salida hasta que lea 0 mmHg en el software de recopilación de datos.
- Calibre la resistividad sanguínea y el volumen sistólico del catéter PV-loop según las instrucciones del fabricante.
NOTA: El fabricante sugiere utilizar una resistividad sanguínea de 1,5 mΩ y un volumen sistólico de 60 mL para modelos animales grandes. - Al igual que en el paso 6.2.1, inserte una guía de 0,035" en la vaina arterial carotídea y avancéela hacia el ventrículo izquierdo utilizando guía fluoroscópica. Avance la vaina hasta que atraviese la válvula aórtica. Retire la guía dejando la vaina en su lugar e inserte el catéter de asa PV bajo guía fluoroscópica a través de la vaina arterial carotídea hasta que la porción de la cola de cerdo descanse en el ápice del ventrículo izquierdo (Figura 2B). Retire la funda ~5 cm para que ya no quede dentro del VI mientras deja la coleta en su lugar.
- De acuerdo con las instrucciones del fabricante, realice un escaneo de línea de base antes de recopilar datos navegando a la opción de escaneo de línea de base en la pantalla de adquisición de datos y presione el botón Enter . Se realiza una exploración basal con el sistema de catéter PV-loop para confirmar una medición precisa de la frecuencia cardíaca. Presione el botón Enter nuevamente para comenzar la adquisición de datos de presión y volumen. Los segmentos de volumen se pueden desplazar para adquirir la mejor forma de onda de volumen.
- Verifique la curva de volumen de presión que se envía al software de recopilación de datos. Asegúrese de que el bucle PV se registre adecuadamente, que debe ser rectangular con bordes lisos. (Figura 2C). De lo contrario, vuelva a colocar suavemente el catéter, ya sea girándolo o moviéndolo hacia adelante y hacia atrás hasta que se registre un bucle adecuado. Calcule el volumen sistólico y el gasto cardíaco multiplicando la frecuencia cardíaca por la diferencia entre el volumen telediastólico y el volumen telesistólico.
- Asegure el catéter en su lugar, ya sea con cinta adhesiva o sutura para garantizar una posición adecuada en todo momento.
7. Eutanasia
- Eutanasiar al animal utilizando una inyección de cloruro de potasio de >2 mEq/kg (50-70 mL de 2 mEq/mL de KCl) a través de la vaina de la vena yugular.
- Continuar con la anestesia general y la monitorización cardíaca hasta que el trazado del ECG no muestre actividad eléctrica cardíaca y la tensión de CO2 al final de la espiración alcance los 0 mmHg.
NOTA: Se mantuvo la monitorización hemodinámica durante todo el experimento.
Resultados
El peso de los cerdos osciló entre 51,4 kg y 61,5 kg, con un peso medio de 56,6 ± 3,6 kg. Los volúmenes sistólicos promedio medidos por catéter PV-asa, ventriculografía y termodilución en los cinco sujetos fueron 58,0 ± 12,0 mL, 57,6 ± 8,5 mL y 53,0 ± 9,8 mL, respectivamente. Los gastos cardíacos medios medidos por un catéter de bucle PV, ventriculografía y termodilución en los cinco sujetos fueron de 5,0 ± 1,1 L/min, 5,3 ± 1,2 L/min y 5,2 ± 1,0 L/min, respectivamente (Tabla 1). La Figura 3 muestra los diagramas de dispersión de las mediciones del gasto cardíaco por cada uno de los tres métodos en comparación con los otros dos. La línea de identidad demuestra dónde caerían todos los puntos si hubiera un acuerdo perfecto entre cada prueba. La línea de identidad de los tres métodos se encuentra dentro del intervalo de confianza del 95%. Al medir el gasto cardíaco, el catéter PV-loop comparado con la termodilución demostró la mejor correlación con un coeficiente de Pearson de r=0,99 (Figura 3A). La pendiente de la línea de regresión fue de 1,03, indicando un error del 3% con IC=0,97 a 1,97 a 1,1, p=0,002. Como se observa en la Figura 3B, el catéter PV-asa comparado con la ventriculografía también mostró una buena correlación con un coeficiente de Pearson r=0,95 La pendiente de la línea de regresión fue de 1,06, lo que indica un error del 6% con IC=0,96 del 95% a 1,96 a 1,1, p=0,01. Por último, la ventriculografía comparada con la termodilución también demostró concordancia con un coeficiente de Pearson de r=0,93 (Figura 3C). La pendiente de la línea de regresión fue de 1,02, indicando un error del 2% con IC=95%=0,93 a 1,1 y p=0,01.
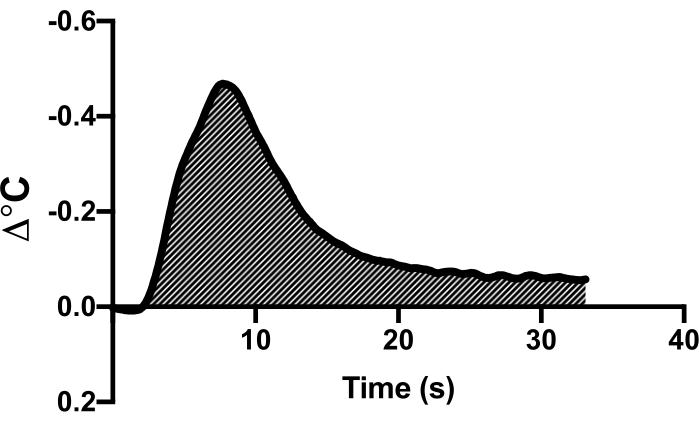
Figura 1: Ejemplo de curva de termodilución. Se proporciona un ejemplo de curva de termodilución en un solo animal representativo que demuestra la deflexión de la curva de temperatura como un bolo de solución salina fría. El área debajo de la curva se utiliza para calcular el gasto cardíaco. Haga clic aquí para ver una versión más grande de esta figura.
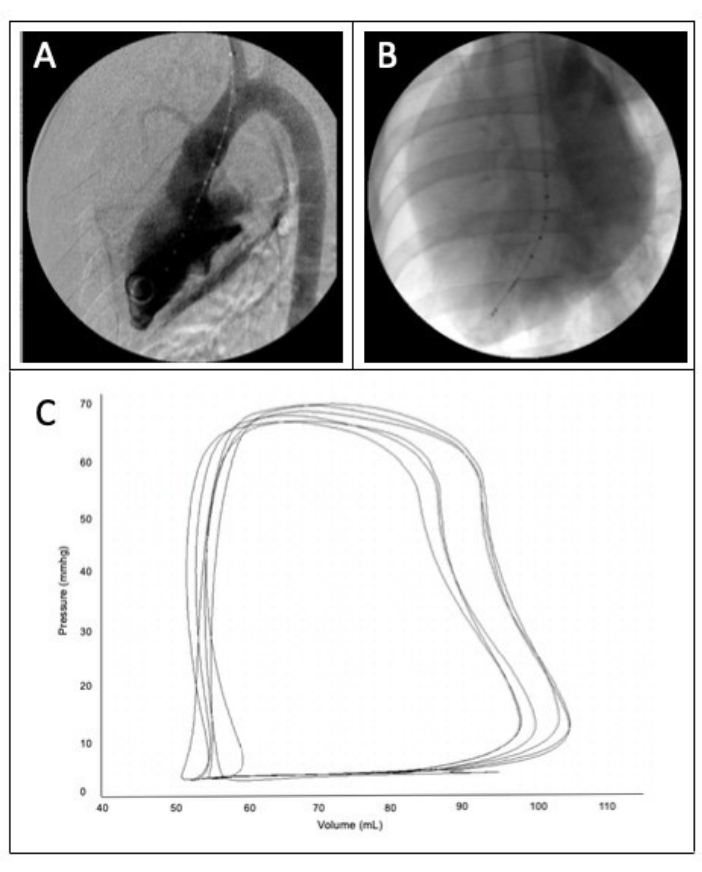
Figura 2: Ventriculograma y asas VP. (a) Ventriculograma izquierdo. (B) Colocación exitosa del catéter PV en el ápice del VI. (C) Ejemplo de asas PV de alta calidad. Haga clic aquí para ver una versión más grande de esta figura.
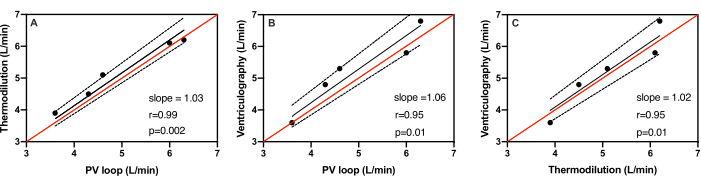
Figura 3: Regresión lineal de las mediciones de gasto cardíaco. Regresión lineal de las mediciones de gasto cardíaco en cinco animales diferentes utilizando (A) catéter PV-loop vsus. termodilución, (B) catéter de asa PV frente a ventriculografía, y (C) termodilución frente a ventriculografía. La línea de identidad (rojo) se encuentra dentro del rango de confianza del 95% (punteado) de la línea de mejor ajuste (negro) entre los tres métodos. Haga clic aquí para ver una versión más grande de esta figura.
| Método | Volumen sistólico (mL) | Gasto cardíaco (L/min) |
| Bucle PV | 58,0 ± 12,0 | 5.0 ± 1.1 |
| Ventriculografía con contraste | 57,6 ± 8,5 | 5.3 ± 1.2 |
| Termodilución | 53,0 ± 9,8 | 5.2 ± 1.0 |
Tabla 1: Resultados promedio de los parámetros cardíacos mediante asa PV, ventriculografía con contraste y termodilución.
Discusión
Este estudio detalla un método estandarizado de tres formas diferentes de medir con precisión el gasto cardíaco en cerdos. El ganado porcino tiene una anatomía y fisiología cardiovascular análoga a la de los seres humanos y se utiliza comúnmente como modelo para la fisiología cardíaca humana, específicamente para las evaluaciones preclínicas de los procesos quirúrgicos e intervencionistas10. Esto permite que los cerdos sirvan como modelo principal para la fisiología cardiovascular, la patología y la biotecnología emergente11. Para evaluar estos conceptos, la monitorización hemodinámica debe ser una herramienta accesible y fiable para los modelos porcinos.
Los catéteres de asa PV no se usan comúnmente en medicina humana debido a los riesgos inherentes a la canulación ventricular prolongada (es decir, arritmia, formación de trombos y lesión miocárdica). A pesar de esto, ocasionalmente se utilizan durante períodos cortos durante los procedimientos de cateterismo cardíaco para medir el volumen sistólico y el trabajo sistólico13. Sin embargo, en estudios con animales sanos que no sobreviven, el beneficio y la versatilidad de los catéteres de bucle PV generalmente superan los riesgos antes mencionados. Otras herramientas clínicas incluyen catéteres de arteria pulmonar. Sin embargo, esta técnica asume que la salida del corazón derecho coincide con la salida del corazón izquierdo e ignora las variaciones de latido a latido en la salida entre las dos cámaras12. El método de termodilución descrito en este estudio mitiga estas variaciones midiendo la termodilución en ambos ventrículos del corazón simultáneamente en lugar de solo en el ventrículo derecho14. Dadas estas limitaciones, la ventriculografía con contraste, el catéter de bucle PV o la termodilución se pueden utilizar para obtener datos de rendimiento cardíaco de forma fiable en el entorno de laboratorio.
En cuanto a la canulación vascular, este estudio empleó la técnica de Seldinger en lugar de un corte vascular. Se utilizó la técnica de Seldinger debido a su rápido acceso vascular con habilidad a nivel de principiante y pocas complicaciones. Por el contrario, la disección vascular abierta requiere un mayor conjunto de habilidades y conlleva un mayor riesgo de complicaciones que pueden retrasar o incluso prohibir nuevos experimentos en el animal15. Además, este estudio utiliza la canulación carotídea en lugar de la canulación femoral. Esto se debe en gran medida a la facilidad de acceso a las cámaras cardíacas, lo que impide la necesidad de navegar por el arco aórtico para acceder al VI. Estas opciones de protocolo permitieron un acceso vascular y una navegación endovascular más eficientes, lo que confiere a estos métodos versatilidad y facilidad de uso en varios protocolos en el entorno de laboratorio.
Este estudio demuestra que en cerdos sanos, existe una buena correlación de los parámetros cardíacos entre los diferentes métodos de medición, incluida la ventriculografía de contraste con análisis volumétrico cuantitativo, la termodilución y un catéter de bucle PV. Cuando los datos de medición entre dos métodos se comparan directamente, la línea de identidad indica dónde caerían todas las mediciones si existiera una concordancia perfecta entre los dos métodos16. El catéter de bucle PV, la ventriculografía y la termodilución produjeron mediciones en las que la línea de identidad se encuentra dentro del rango de intervalo de confianza, lo que indica mediciones precisas por cada método cuando se comparan entre sí.
En función de los recursos y la experiencia disponibles, se puede elegir el método óptimo. Si hay acceso a un conjunto de sondas de medición y adquisición de datos, los catéteres de bucle PV o la termodilución son opciones ideales en función de las necesidades del protocolo. Los catéteres de bucle PV ofrecen una adquisición de datos continua en tiempo real durante todo el protocolo experimental y proporcionan una gran variedad de parámetros cardíacos, incluido el volumen sistólico, la fracción de eyección, el volumen diastólico final, el volumen telesistólico y el trabajo sistólico. La termodilución ofrece mediciones rápidas y sencillas siempre que sea necesario, y evita la necesidad de canulación ventricular. El método descrito en este estudio también tiene la ventaja de medir el gasto cardíaco en ambos ventrículos del corazón. Por último, si hay un acceso limitado a herramientas de medición avanzadas, la ventriculografía de contraste con software de análisis volumétrico está fácilmente disponible y requiere comparativamente poca experiencia para emplearla.
Cada uno de estos métodos tiene varias limitaciones. Es decir, todos requerirán fluoroscopia fácilmente disponible para confirmar varias posiciones del catéter al obtener mediciones. La elección del anestésico también influirá en el rendimiento cardíaco, pero cada método proporcionará mediciones consistentes siempre que se utilice el mismo anestésico. Por último, este estudio está dirigido a animales sanos sin patología cardíaca. La concordancia y la precisión entre estos métodos pueden diferir dados los diferentes estados de enfermedades crónicas, como la insuficiencia cardíaca, la regurgitación valvular o la miocardiopatía. Sin embargo, estos tres métodos ofrecen a los investigadores flexibilidad para elegir el método más idóneo para un experimento determinado, al tiempo que proporcionan mediciones fiables y precisas del rendimiento cardíaco en especímenes porcinos sanos.
Divulgaciones
Los autores declaran que no existe conflicto de intereses.
Agradecimientos
Ninguno
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride injection | Hospira | 0409-4888-50 | |
| 7 Fr Introducer Kit | Terumo | RCFW-5.0-35 | |
| Anesthesia Machine | Drager | Fabius Tiro | |
| Contrast Power Injector | GEHealthcare | E8004N | |
| Fluoroscope | GEHealthcare | OEC 9800 | |
| Heating/Cooling T/pump | Gaymar | Tp-700 | |
| Isoflurane | Baxter | 10019-360-40 | |
| Jackie catheter | Terumo | 40-5023 | |
| Omnipaque | GEHealthcare | 559289 | |
| PowerChart | ADinstruments | ML866/P | Software |
| PowerLab | ADinstruments | PL3516 | |
| PV-loop catheter | Transonic | Prefer pigtail tip to straight tip | |
| PV-loop module | Transonic | FFS-097-A004 | |
| Surgical suture, black braided silk, 3.0 | Surgical Speciaties Corp. | ||
| Thermocouple probe | ADinstruments | MLT1401 | |
| Ultrasound probe | Philips | L12-4 | |
| Various-sized syringes | |||
| ViewPlus | Sanders Data Systems | Software |
Referencias
- Pinsky, M. R., Payen, D. Functional hemodynamic monitoring. Critical Care. 9, London. England. 566-572 (2005).
- Geerts, B. F., Aarts, L. P., Jansen, J. R. Methods in pharmacology: Measurement of cardiac output. British Journal of Clinical Pharmacology. 71, 316-330 (2011).
- Argueta, E. E., Paniagua, D. Thermodilution cardiac output: A concept over 250 years in the making. Cardiology in Review. 27, 138-144 (2019).
- Higgins, C. B., et al. Quantitation of left ventricular dimensions and function by digital video subtraction angiography. Radiology. 144, 461-469 (1982).
- Abraham, D., Mao, L. Cardiac pressure-volume loop analysis using conductance catheters in Mice. Journal of Visual Experiments. (103), e52942(2015).
- Porterfield, J. E., et al. Dynamic correction for parallel conductance, GP, and gain factor, α, in invasive murine left ventricular volume measurements. Journal of Applied Physiology. 107, 1693-1703 (2009).
- Obernier, J. A., Baldwin, R. L. Establishing an appropriate period of acclimatization following transportation of laboratory animals. Institution of Laboratory Animal Research Journal. 47, 364-369 (2006).
- Madurska, M. J., et al. Development of a selective aortic arch perfusion system in a porcine model of exsanguination cardiac arrest. Journal of Visualized Experiments. (162), e61573(2020).
- Dodge, H. T., Sandler, H., Ballew, D. W., Lord, J. D. The use of biplane angiocardigraphy for the measurement of left ventricular volume in man. American Heart Journal. 60, 762-776 (1960).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: comparisons with normal human cardiac structure. Journal of Anatomy. 193, 105-119 (1998).
- Smith, A. C., Swindle, M. M. Preparation of Swine for the Laboratory. Institution of Laboratory Animal Research Journal. 47, 358-363 (2006).
- Franklin, D. L., Van Citters, R. L., Rushmer, R. F. Balance between right and left ventricular output. Circulation Research. 10, 17-26 (1962).
- Borlaug, B. A., Kass, D. A. Invasive hemodynamic assessment in heart failure. Cardiology Clinics. 29, 269-280 (2011).
- Thrush, D., Downs, J. B., Smith, R. A. Continuous thermodilution cardiac output: Agreement with fick and bolus thermodilution methods. Journal of Cardiothoracic and Vascular Anesthesia. 9, 399-404 (1995).
- Izer, J., Wilson, R., Hernon, K., Ündar, A. Ultrasound-guided vessel catheterization in adult Yorkshire cross-bred pigs. Veterinary Anesthesia and Analgesia. 44, 133-137 (2017).
- Hanneman, S. K. Design, analysis, and interpretation of method-comparison studies. AACN Advanced Critical Care. 19, 223-234 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados