Method Article
在猪模型中测量心输出量
摘要
热稀释法、压力-容积环导管和造影剂心室造影是在实验室环境中确定猪心脏生理学(例如每搏输出量和心输出量)的可靠且准确的方法。
摘要
猪经常用于医学研究,因为它们的心脏生理机能与人类相似。在此类研究中,测量心脏参数(如每搏输出量和心输出量)是必不可少的。造影剂心室造影、热稀释和压力-体积环 (PV-loop) 导管可用于准确获取心脏功能数据,具体取决于可用的资源和专业知识。在这项研究中,对 5 只约克夏猪进行了麻醉和插管。获得中心静脉和动脉通路以放置必要的测量仪器。将温度探头放置在主动脉根部。将冷盐水推注至右心房并记录温度偏转曲线。对曲线下面积进行积分,可以计算当前的心输出量。将尾纤导管经皮放置在左心室中,并在 2 秒内注射 30 mL 碘造影剂。将数字减影血管造影图像上传到容量分析软件,以计算每搏输出量和心输出量。将压力容积环导管放置在左心室 (LV) 中,并提供 LV 的连续压力和容量数据,从而可以计算每搏输出量和心输出量。所有 3 种方法都显示出良好的相关性。PV 环导管和热稀释法表现出最佳相关性,误差为 3%,皮尔逊系数为 0.99,95% CI = 0.97 至 1.1,(p = 0.002)。PV 环导管与心室造影也显示出良好的相关性,误差为 6%,皮尔逊系数为 0.95,95% CI = 0.96 至 1.1 (p = 0.01)。最后,针对心室造影的热稀释法有 2% 的误差,r=0.95,95% CI =0.93 至 1.11,(p=0.01)。总之,我们指出 PV 环导管、造影剂心室造影和热稀释法都提供了一定的优势,具体取决于研究人员的要求。每种方法对于测量猪的各种心脏参数(如每搏输出量和心输出量)都是可靠和准确的。
引言
猪因其与人类的生理机能相似而经常用于出血控制和复苏研究。复苏研究不可或缺的是持续的心输出量监测,以评估对干预的生理反应。存在多种临床系统,例如肺动脉 (PA) 导管和基于脉搏轮廓分析的系统1。此外,超声心动图 (echo)、计算机断层扫描 (CT) 和磁共振成像 (MRI) 都可用于捕获血流动力学数据。舒张末期和收缩期获得的图像可用于确定该心动周期期间射出的血容量。虽然这些技术是微创的,但它们只提供在成像时获得的数据,不提供连续测量2。它们要么在很大程度上依赖于作员(回声),要么需要先进、昂贵的设备(CT 和 MRI)。鉴于不同实验室的能力和资源,在每种情况下都有各种替代方法可以最佳地测量心输出量。
热稀释法是在临床环境中使用 Swan-Ganz 导管测量心输出量的常用方法3。这种方法可以在猪的实验室环境中重现,以直接测量心输出量。如果透视能力很容易获得,也可以使用造影剂心室造影4。最后,压力-容积环形导管提供了一种在逐次跳动的基础上直接测量心室压力和容积的方法,并且可以产生更细致的数据5。该方法利用电导纳和 Wei 方程来测量腔室体积。与旧的基于电导的导管相比,导纳导管消除了血液和心肌之间的平行电导现象,从而产生更准确的测量,而无需重复校准6。
本研究的目的是验证这三种方法在健康猪模型中测量心搏输出量和输出量方面的准确性。最终,每个研究者都可以根据他们的研究要求和可用的资源,选择最适合他们需求的方法。
研究方案
程序已获得马里兰大学巴尔的摩机构动物护理和使用委员会 (Approval #0320017) 的批准,并符合美国国立卫生研究院的伦理动物研究指南。该研究招募了 5 头体重在 50 至 70 公斤之间的成年雄性约克夏猪。本研究利用数字数据收集系统和配对软件来记录所有血流动力学和体温数据。在猪模型中测量心脏参数包括以下步骤:准备、热稀释、心室造影、PV 环导管插入,最后安乐死。所有 5 只动物都接受了三种心输出量测量方案中的每一种。
1. 动物选择和饲养
- 使用体重 50-70 公斤的青春雄性约克夏猪 (Sus Scrofa)。
- 将家畜关在至少 30 平方英尺的笼子里,笼子里有干草、稻草或松树屑等高碳床上用品。在手术前一晚单独安置动物。
- 根据机构指南为新动物留出适应期。
注意:对于大型哺乳动物,这通常是 48-72 小时7. - 给动物喂食标准饮食,并在实验前一天晚上免费饮水。
- 在手术前一晚对动物进行禁食,以尽量减少气管插管期间的误吸风险。
- 通过检查皮肤是否有受伤迹象(例如结痂、擦伤或擦伤)每周监测动物的健康状况。确保正常的呼吸工作(15-30 次呼吸/分钟)和适当的互动行为。确保口腔粘膜呈粉红色、湿润且无分泌物。
- 定期给动物称重,以确认它们有足够的营养。向兽医工作人员报告任何异常情况,然后将动物排除在方案之外。
2. 全身麻醉的镇静和诱导
- 通过在耳朵尾部的脂肪垫中肌肉注射 Telazol (4-5 mg/kg)/甲苯噻嗪 (1.8-2.2 mg/kg),使动物在其饲养区镇静。
- 等到动物完全镇静并且对刺激几乎没有反应,以确保动物的安全处理和运输。
- 将动物从饲养区运送到手术室,并将其背卧放在手术台上。
- 将脉搏血氧仪探头放在动物的耳朵上,并使用 100% O2 的机械呼吸机开始用鼻子面罩给动物通气。确保面罩的橡胶垫圈在鼻子周围正确密封。一旦确保适当的密封,施用 3-4% 异氟醚,直到诱导全身麻醉并且下巴放松。
注意:请务必遵循吸入挥发性物质使用的机构指南。一般来说,手术室必须通风良好,并且必须使用适当的清除/通风机制来消除吸入暴露。 - 通过关闭异氟烷蒸发器并取下鼻子面罩,使用喉镜放置经口气管插管。让第二个人保持下巴张开,同时作者插入喉镜并将会厌从软腭腹侧移位。一旦声带可视化,插入 8-0气管插管穿过声带至少 5 cm。
- 用 10 mL 空气给 ET 袖带充气,并使用脐带将 ET 管固定到动物的鼻子上。通过胸部起伏、呼气末 CO2 和/或胸部听诊确认导管放置。
- 将 ET 管连接到带有热湿交换器的麻醉机。
- 调整机械呼吸机设置,以提供 30% 的吸入 O2 分数,潮气量 7-10 mL/kg,呼吸频率为 10-16 次呼吸/分钟,以维持呼气末 CO2 张力 38-42 mmHg。
- 使用 1.5-3% 异氟醚返回并保持吸入麻醉剂。监测动物是否有疼痛和不适的迹象,例如不自主运动或心动过速。调整异氟醚,直到运动消失或心动过速消退。
3. 手术部位消毒和准备
- 使用电动理发器剪住覆盖和经皮穿刺部位(双侧腹颈)的毛发。
- 用优碘和异丙醇准备并擦洗所有经皮穿刺部位,并使其完全干燥。
- 在手术部位周围放置无菌窗帘,以保护无菌手术区域并防止污染。用订书钉将它们固定到位。
- 使用胶带或绳索将前肢和后肢束缚在手术台上,将动物固定在手术台上。将加热垫放在动物下方并设置为 37 °C。
- 在温度探头的尖端涂抹水基润滑剂,并将探头插入直肠,以提供连续的体温数据。
- 将 ECG 粘合电极放在右侧和左侧胸壁上。将 ECG 导联连接到粘性电极,并将 ECG 导联连接到数据采集单元。
- 小心地将动物翻转到腹侧卧位,确保在转移过程中控制气道管道和心电图导联。
4. 颈外静脉插管
注意:在热稀释手术期间,右心房静脉插管插入可获得颈静脉通路。
- 使用超声 (US) 引导定位位于颈外侧区域的颈外静脉沟中的颈外静脉。用 18 G 针头与皮肤成 45° 角穿刺皮肤,并在超声引导下将尖端推进静脉腔。
- 将 0.035 英寸 Seldinger 导丝穿过针头并进入静脉腔。取下针头,同时将导丝留在静脉腔内。
- 使用 #5 刀片手术刀在金属丝附近做一个 11 毫米的皮肤切口,然后用扩张器将 15 厘米、7 Fr 的护套拧入导丝上方的静脉中。拆下导丝和扩张器。确保护套保持在原位。用 3-0 丝缝合线将护套缝合到皮肤上,将护套缝合到位。
- 重复步骤 4.1 至 4.3 以套管对侧颈外静脉。
5. 颈动脉插管
注意:进行颈动脉插管是为了在热稀释、造影剂脑室造影和 PV 环导管插入期间提供进入 LV 和主动脉根部的通路。
- 使用 US 探针定位气管外侧的颈动脉。如果可用,使用彩色多普勒成像确保血流脉动。
- 用 18 G 针与皮肤成 45° 角放置刺穿皮肤,并在超声视力下将其推进到动脉腔。将 0.035 英寸 Seldinger 导丝穿过针头并进入动脉管腔。取下针头,同时将导丝留在动脉腔内的位置。
- 用 #5 刀片手术刀在导线附近做一个 11 毫米的皮肤切口,然后用扩张器将 20 厘米 7 Fr 的护套穿入导丝上的动脉中。将护套留出皮肤 5-10 厘米。拆下导丝和扩张器,确保护套保持在原位。用 3-0 丝缝合线将护套缝合到皮肤上,将护套固定到位8.
6. 心输出量测量
注意:以下所有方法均在本研究中使用的 5 只动物中依次进行。
- 热稀释法
- 通过颈动脉鞘插入 T 型热电偶探头,并使用透视引导将探头引导至主动脉根部。
- 将探测器连接到数据收集系统。允许几分钟的数据收集,以建立可靠的基线主动脉温度。当温度在数据收集 2-3 分钟内保持在中心值的 1 °C 以内时,即可获得可靠的基线温度。
- 接下来,通过颈外静脉鞘插入一根 5 Fr、110 cm 的导管,并使用透视将导管导航至右心房。
- 验证位置后,将 20 mL 12 °C 盐水强行冲洗到导管中。
- 观察数据收集软件上的温度偏转曲线。突出显示此区域并使用软件的心输出量功能计算心输出量(图 1)。
- 根据需要重复此过程 3-5 次,以获得这些测量值的平均值。
- 心室造影
- 使用便携式 X 射线透视引导,将 0.035 英寸导丝穿过颈动脉鞘插入左心室。推进护套,使尖端穿过主动脉瓣。取下 0.035 英寸的导丝,并通过颈动脉鞘插入一根 80 厘米的标记尾纤导管,使尾纤位于左心室根尖。将护套抽出 5 cm,同时将尾纤留在原位,使护套不再位于 LV 内。
- 确保房间内的所有人员都穿着 0.5 mm 等效铅围裙。让发射器 1 m 范围内的任何人佩戴含铅眼镜。
- 最大限度地减少光束开启时间,并确保发射器准直良好,以减少对实验室人员的暴露。
- 确保所有人员尽可能远离发射器,同时仍能执行该程序以减少暴露。
- 将导管连接到至少装有 30 mL 碘造影剂的造影剂注射器上。记下动物的当前心率。
- 将进样器配置为提供 15 mL/s 的造影剂,总共 30 mL,并配备设备。
- 在左前倾斜 30° 以 30 帧/秒的速度配置用于数字减影血管造影 (DSA) 的荧光镜。
- 在荧光镜上启动 DSA 并等待图像减去。透视机显示减影图像后立即开始动力注射。一旦透视机从图像中减去不透射线的材料,就按下注射器按钮来执行此作,以便在图像系列中只有 LV 腔室混浊(图 2A)。
注意:或者,如果 DSA 不可用,可以使用经典透视进行心室造影。 - 将这些图像上传到图片存档和通信系统 (PACS)。
- 将心室照片图像导入定量成像软件。
- 使用左心室分析功能,使用标记尾纤上的 1 cm 标记作为参考,将软件校准到图像。
- 单击“ 舒张末 期”按钮,并在 DSA 图像中搜索描绘最大 LV 体积的框架,指示舒张末期。然后,使用鼠标以较小的增量跟踪 LV 边界,以确保准确性。
- 接下来,单击 End Systole 按钮并搜索描述 LV 体积最少的 End Systole 的帧。同样,以与上一步相同的方式跟踪 LV 边界。
- 单击 Analyze 按钮。然后,该程序使用 Dodge-Sandler 面积长度方法9 进行定量体积分析,以计算收缩末期容积、舒张末期容积以及每搏输出量。然后,数据输出到 LV 分析文档中。
- 通过将测得的每搏输出量乘以先前记录的心率来确定心输出量。
- 使用便携式 X 射线透视引导,将 0.035 英寸导丝穿过颈动脉鞘插入左心室。推进护套,使尖端穿过主动脉瓣。取下 0.035 英寸的导丝,并通过颈动脉鞘插入一根 80 厘米的标记尾纤导管,使尾纤位于左心室根尖。将护套抽出 5 cm,同时将尾纤留在原位,使护套不再位于 LV 内。
- 压力-容积环导管
- 使用前将 PV 环导管预先浸泡在生理盐水中至少 20 分钟。将导管连接到数据收集系统。
- 将包含压力传感器的 PV 环导管的尖端插入盐水注射器中,并将压力传感器保持在弯液面下方。使用导管模块上的粗调和微调按钮,调整输出压力信号,直到数据采集软件上的读数为 0 mmHg。
- 根据制造商的说明校准 PV 回路导管的血液电阻率和每搏输出量。
注:制造商建议对大型动物模型使用 1.5 mΩ 的血液电阻率和 60 mL 的冲搏体积。 - 与步骤 6.2.1 一样,将 0.035 英寸导丝插入颈动脉鞘,并使用透视引导将其推进到 LV 中。推进鞘,直到它穿过主动脉瓣。取下导丝,将护套留在原位,并在透视引导下通过颈动脉护套插入 PV 环导管,直到尾纤部分位于 LV 顶点(图 2B)。将护套抽出 ~5 cm,使其不再位于 LV 内,同时将尾纤留在原位。
- 根据制造商的说明,在收集数据之前,通过导航到数据采集屏幕上的 Baseline scan 选项并按 Enter 按钮来执行基线扫描。使用 PV 环导管系统进行基线扫描,以确认准确的心率测量。再次按下 Enter 按钮开始压力和体积数据采集。可以滚动 volume segments 以获得最佳音量波形。
- 检查输出到数据收集软件的压力体积曲线。确保 PV 循环被充分记录,它应该是矩形的,边缘光滑。(图 2C)。如果没有,请通过扭转或来回移动轻轻地重新定位导管,直到记录到足够的环。通过将心率乘以舒张末期和收缩末期容积之间的差值来计算每搏输出量和心输出量。
- 用胶带或缝合线将导管固定到位,以确保在整个过程中保持适当的定位。
7. 安乐死
- 通过颈静脉鞘使用 >2 mEq/kg 氯化钾(50-70 mL 的 2 mEq/mL KCl)注射对动物实施安乐死。
- 继续全身麻醉和心脏监测,直到心电图显示无心脏电活动且呼气末 CO2 张力达到 0 mmHg。
注意:在整个实验过程中保持血流动力学监测。
结果
猪的体重从 51.4 公斤到 61.5 公斤不等,平均体重为 56.6 ± 3.6 公斤。所有 5 名受试者通过 PV 环导管、心室造影和热稀释法测量的平均每搏输出量分别为 58.0 ± 12.0 mL、57.6 ± 8.5 mL 和 53.0 ± 9.8 mL。所有五名受试者通过 PV 环导管、心室造影和热稀释法测量的平均心输出量分别为 5.0 ± 1.1 L/min、5.3 ± 1.2 L/min 和 5.2 ± 1.0 L/min(表 1)。 图 3 显示了三种方法中每一种与其他两种方法相比的心输出量测量散点图。同一行表示如果每个测试之间完全一致,则所有点都将落在何处。所有三种方法的标识线都在 95% 置信区间范围内。在测量心输出量时,与热稀释法相比,PV 环导管与 r=0.99 的 Pearson 系数显示出最佳相关性(图 3A)。回归线的斜率为 1.03,表明 3% 的误差,95% CI = 0.97 至 1.1,p = 0.002。如图 3B 所示,PV 环导管与心室造影相比也表现出良好的相关性,皮尔逊系数 r=0.95 回归线的斜率为 1.06,表明 6% 误差,95% CI =0.96 至 1.1,p=0.01。最后,心室造影与热稀释法相比也显示出一致性,皮尔逊系数为 r=0.93(图 3C)。回归线的斜率为 1.02,表明 2% 的误差,95% CI = 0.93 至 1.1,p = 0.01。
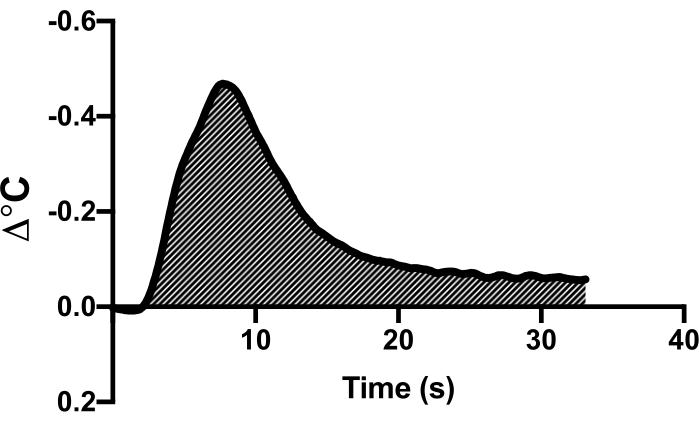
图 1:热稀释法曲线示例。 单个代表性动物的热稀释曲线示例,显示了当冷盐水推注时温度曲线的偏转。曲线下面积用于计算心输出量。 请单击此处查看此图的较大版本。
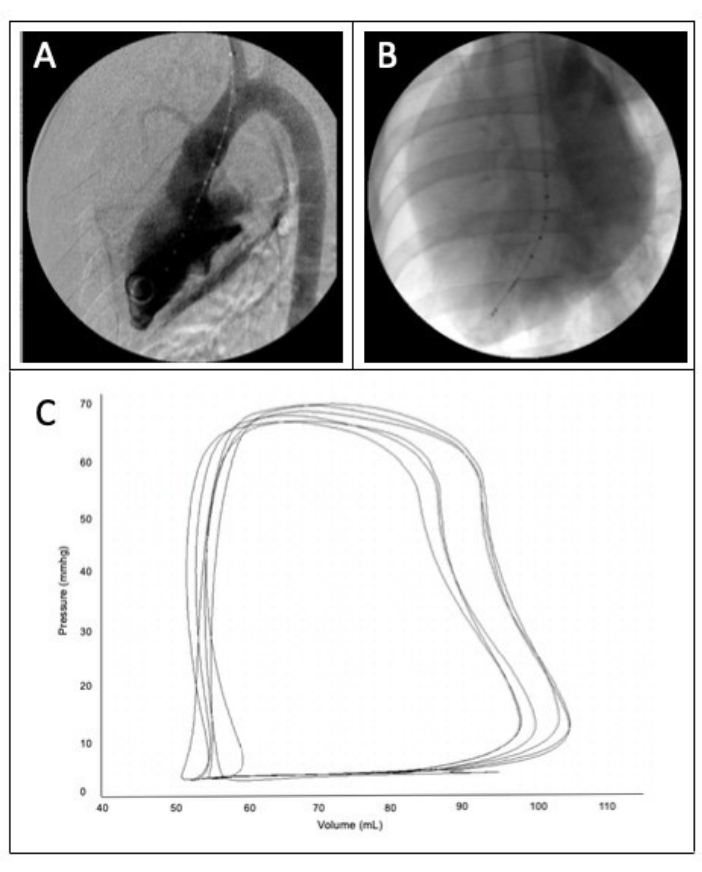
图 2:心室造影和 PV 环。 (A) 左心室造影。(B) 在 LV 根尖成功放置 PV 环导管。(C) 高质量 PV 环示例。 请单击此处查看此图的较大版本。
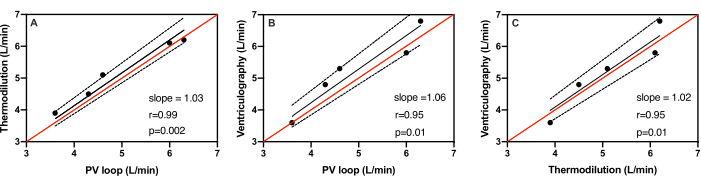
图 3:心输出量测量值的线性回归。 使用 (A) PV 环导管对 5 只不同动物的心输出量测量值进行线性回归。热稀释法,(B) PV 环导管与心室造影法,以及 (C) 热稀释法与心室造影法。在所有三种方法中,标识线(红色)位于最佳拟合线(黑色)的 95% 置信度范围(虚线)内。 请单击此处查看此图的较大版本。
| 方法 | 每搏输出量 (mL) | 心输出量 (L/min) |
| PV 回路 | 58.0 ± 12.0 | 5.0 ± 1.1 |
| 造影剂心室造影 | 57.6 ± 8.5 | 5.3 ± 1.2 |
| 热稀释法 | 53.0 ± 9.8 | 5.2 ± 1.0 |
表 1:使用 PV 环、造影剂心室造影和热稀释法的心脏参数平均结果。
讨论
本研究详细介绍了一种标准化方法,其中包含三种不同方法来准确测量猪的心输出量。猪的心血管解剖学和生理学与人类相似,通常用作人类心脏生理学的模型,特别是用于手术和介入过程的临床前评估10。这使得猪成为心血管生理学、病理学和新兴生物技术的主要模型11。为了评估这些概念,血流动力学监测必须成为猪模型的可访问且可靠的工具。
由于心室插管时间延长的固有风险(即心律失常、血栓形成和心肌损伤),PV 环导管在人类医学中不常用。尽管如此,它们偶尔会在心导管插入术中短期用于测量每搏输出量和每冲程工作13。然而,在健康的非存活动物研究中,PV 环导管的好处和多功能性通常超过上述风险。其他临床工具包括肺动脉导管。然而,该技术假设右心输出量与左心输出量匹配,并忽略两个腔室之间输出的心跳间变化12。本研究中描述的热稀释法通过同时测量心脏两个心室的热稀释度而不仅仅是右心室来减轻这些变化14。鉴于这些局限性,造影剂心室造影、PV 环导管或热稀释法可用于在实验室环境中可靠地获得心脏功能数据。
在血管插管方面,本研究采用了 Seldinger 技术而不是血管切割。使用 Seldinger 技术是因为它具有新手水平技能和很少并发症的快速血管通路。相反,开放性血管夹层需要更大的技能,并且具有更大的并发症风险,这可能会延迟甚至禁止对动物进行进一步的实验15。此外,本研究使用颈动脉插管而不是股动脉插管。这主要是由于易于进入心腔,无需穿过主动脉弓即可进入 LV。这些方案选择允许更高效的血管通路和血管内导航,使这些方法在实验室环境中的各种方案中具有多功能性和易用性。
这项研究表明,在健康猪中,不同测量方法之间的心脏参数具有良好的相关性,包括造影剂脑室造影与定量体积分析、热稀释和 PV 环导管。当直接比较两种方法之间的测量数据时,同一线表示如果两种方法之间存在完全一致,则所有测量都将落在何处16。PV 环导管、心室造影和热稀释法均产生了同一线位于置信区间范围内的测量值,这表明每种方法在相互比较时测量准确。
根据可用的资源和专业知识,可以选择最佳方法。如果可以使用一套测量探针和数据采集,则根据方案需要,PV 环导管或热稀释液是理想的选择。PV 环导管在整个实验方案中提供实时、连续的数据采集,并提供无数的心脏参数,包括每搏输出量、射血分数、舒张末期容积、收缩末期容积和每搏功。热稀释法可在需要时提供快速简便的快速测量,并且无需心室插管。本研究中描述的方法还具有测量心脏两个心室的心输出量的优势。最后,如果高级测量工具的机会有限,带有体积分析软件的造影剂心室造影是现成的,并且需要相对较少的专业知识来使用。
这些方法中的每一种都存在一些限制。也就是说,在进行测量时,它们都需要现成的透视来确认各种导管位置。麻醉剂的选择也会影响心脏功能,但只要使用相同的麻醉剂,每种方法都会提供一致的测量结果。最后,本研究针对没有心脏病理的健康动物。鉴于不同的慢性疾病状态,例如心力衰竭、瓣膜反流或心肌病,这些方法之间的一致性和准确性可能会有所不同。尽管如此,这三种方法为研究人员提供了灵活性,让他们可以选择最适合给定实验的方法,同时提供可靠和准确的健康猪标本心脏功能测量。
披露声明
作者声明不存在利益冲突。
致谢
没有
材料
| Name | Company | Catalog Number | Comments |
| 0.9% sodium chloride injection | Hospira | 0409-4888-50 | |
| 7 Fr Introducer Kit | Terumo | RCFW-5.0-35 | |
| Anesthesia Machine | Drager | Fabius Tiro | |
| Contrast Power Injector | GEHealthcare | E8004N | |
| Fluoroscope | GEHealthcare | OEC 9800 | |
| Heating/Cooling T/pump | Gaymar | Tp-700 | |
| Isoflurane | Baxter | 10019-360-40 | |
| Jackie catheter | Terumo | 40-5023 | |
| Omnipaque | GEHealthcare | 559289 | |
| PowerChart | ADinstruments | ML866/P | Software |
| PowerLab | ADinstruments | PL3516 | |
| PV-loop catheter | Transonic | Prefer pigtail tip to straight tip | |
| PV-loop module | Transonic | FFS-097-A004 | |
| Surgical suture, black braided silk, 3.0 | Surgical Speciaties Corp. | ||
| Thermocouple probe | ADinstruments | MLT1401 | |
| Ultrasound probe | Philips | L12-4 | |
| Various-sized syringes | |||
| ViewPlus | Sanders Data Systems | Software |
参考文献
- Pinsky, M. R., Payen, D. Functional hemodynamic monitoring. Critical Care. 9, London. England. 566-572 (2005).
- Geerts, B. F., Aarts, L. P., Jansen, J. R. Methods in pharmacology: Measurement of cardiac output. British Journal of Clinical Pharmacology. 71, 316-330 (2011).
- Argueta, E. E., Paniagua, D. Thermodilution cardiac output: A concept over 250 years in the making. Cardiology in Review. 27, 138-144 (2019).
- Higgins, C. B., et al. Quantitation of left ventricular dimensions and function by digital video subtraction angiography. Radiology. 144, 461-469 (1982).
- Abraham, D., Mao, L. Cardiac pressure-volume loop analysis using conductance catheters in Mice. Journal of Visual Experiments. (103), e52942(2015).
- Porterfield, J. E., et al. Dynamic correction for parallel conductance, GP, and gain factor, α, in invasive murine left ventricular volume measurements. Journal of Applied Physiology. 107, 1693-1703 (2009).
- Obernier, J. A., Baldwin, R. L. Establishing an appropriate period of acclimatization following transportation of laboratory animals. Institution of Laboratory Animal Research Journal. 47, 364-369 (2006).
- Madurska, M. J., et al. Development of a selective aortic arch perfusion system in a porcine model of exsanguination cardiac arrest. Journal of Visualized Experiments. (162), e61573(2020).
- Dodge, H. T., Sandler, H., Ballew, D. W., Lord, J. D. The use of biplane angiocardigraphy for the measurement of left ventricular volume in man. American Heart Journal. 60, 762-776 (1960).
- Crick, S. J., Sheppard, M. N., Ho, S. Y., Gebstein, L., Anderson, R. H. Anatomy of the pig heart: comparisons with normal human cardiac structure. Journal of Anatomy. 193, 105-119 (1998).
- Smith, A. C., Swindle, M. M. Preparation of Swine for the Laboratory. Institution of Laboratory Animal Research Journal. 47, 358-363 (2006).
- Franklin, D. L., Van Citters, R. L., Rushmer, R. F. Balance between right and left ventricular output. Circulation Research. 10, 17-26 (1962).
- Borlaug, B. A., Kass, D. A. Invasive hemodynamic assessment in heart failure. Cardiology Clinics. 29, 269-280 (2011).
- Thrush, D., Downs, J. B., Smith, R. A. Continuous thermodilution cardiac output: Agreement with fick and bolus thermodilution methods. Journal of Cardiothoracic and Vascular Anesthesia. 9, 399-404 (1995).
- Izer, J., Wilson, R., Hernon, K., Ündar, A. Ultrasound-guided vessel catheterization in adult Yorkshire cross-bred pigs. Veterinary Anesthesia and Analgesia. 44, 133-137 (2017).
- Hanneman, S. K. Design, analysis, and interpretation of method-comparison studies. AACN Advanced Critical Care. 19, 223-234 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。