Method Article
Изолировать миофибрили от биопсии скелетных мышц и определения контрактильной функции с помощью нано-ньютоновского разрешения силы трансдуцера
В этой статье
Резюме
Здесь представлен протокол для оценки контрактильные свойства полосатых мышечных миофибриллей с нано-ньютоновым разрешением. Протокол использует установку с интерферометрией на основе, оптический зонд силы. Эта установка генерирует данные с высоким соотношением сигнала к шуму и позволяет оценить контрактильной кинетики миофибрил.
Аннотация
Полосатые мышечные клетки незаменимы для активности человека и животных. Одиночные мышечные волокна состоят из миофибрил, которые состоят из последовательно связанных саркомеров, самых маленьких контрактильные единицы в мышцах. Саркомерная дисфункция способствует мышечной слабости у пациентов с мутациями в генах, кодирующих саркомерные белки. Изучение механики миофибриля позволяет оценить актин-миозин взаимодействия без потенциального путаницы эффекты поврежденных, смежных миофибрил при измерении контрактности одного мышечного волокна. Ультраструктурное повреждение и несогласованность миофибрил может способствовать нарушению контрактности. Если структурные повреждения присутствуют в миофибрилях, они, вероятно, ломаются во время процедуры изоляции или во время эксперимента. Кроме того, исследования в миофибрилях дают оценку актин-миозин взаимодействий в присутствии геометрических ограничений саркомеров. Например, измерения в миофибрилях могут выяснить, является ли дисфункция миофибриллярной является основным следствием мутации в саркомерных белках. Кроме того, перфузия с растворами кальция или соединений почти мгновенно из-за малого диаметра миофибриля. Это делает миофибриль в высшей степени подходящим для измерения темпов активации и релаксации во время силового производства. В протоколе, описанном в настоящем документе, используется оптический силовой зонд, основанный на принципе интерферометра Фабри-Перо, способного измерять силы в диапазоне нано-ньютона, в сочетании с двигателем длины пьезо и быстроступной системой перфузии. Эта установка позволяет изучать механику миофибриля с высоким разрешением измерения силы.
Введение
Полосатые мышечные клетки незаменимы для повседневной жизни. Движение конечностей, дыхательная функция и насосное движение сердца зависят от силы, генерируемой мышечными клетками. Скелетная мышца состоит из мышечных фасциклов, содержащих пучки одиночных мышечных волокон(рисунок 1A). Эти мышечные волокна состоят из миофибрил, которые образуются последовательно связанных саркомеров (Рисунок 1B,D). Саркомеры содержат тонкие и толстые нити. Они в основном состоят из цепей молекул актина и миозин, соответственно (Рисунок 1B). Взаимодействия Актин-миозин отвечают за силу генерирующей способности мышц. Пациенты с мутациями в генах, кодирующих саркомерные белки, такие как небулин, актин и тропонин Т, страдают мышечной слабостью из-за контрактнойдисфункции 1.
Качество мышечной контрактности можно изучать на различных уровнях организации, начиная от in vivo целые мышцы для актин-миозин взаимодействия в пробирке подвижности анализов. За последние десятилетия несколько исследовательских групп разработали установки для определения контрактности отдельныхмиофибрил 2,,3,,4,,5,,6,,7,,8,,9,,10. Эти установки основаны на обнаружении изменений в лазерном отклонении от кантилевера (т.е. оптического отклонения пучка), вызванного сокращением миофибриля (подробнее см. Labuda et al.11). Хотя определение контрактной функции миофибриля имеет некоторые ограничения (например, динамика процессов соединения возбуждения и сокращения, которые находятся вверх по течению от миофибрил, отсутствуют), есть несколько преимуществ этого подхода. К ним относятся: 1) способность оценивать актин-миозин взаимодействия в присутствии геометрических ограничений саркомеров; 2) способность оценивать актин-миозин взаимодействия без потенциального путаницы эффекты поврежденных, смежных миофибрил (при измерении контрактности одной мышцы волокон ультраструктурного повреждения и несогласованности миофибрил может способствовать нарушению контрактности) (Рисунок 1D); 3) малый диаметр миофибринов (1 мкм, рисунок 2A) и отсутствие мембран позволяют почти мгновенное распространение кальция в саркомеры. Кроме того, если структурные повреждения присутствуют в миофибрилях, они, вероятно, ломаются во время их изоляции или во время эксперимента. Таким образом, оценка миофибриль контрактности является элегантным методом для изучения основных механизмов сокращения мышц и понять, являются ли нарушенные актин-миозин взаимодействия являются основной причиной мышечных заболеваний, вызванных мутациями в саркомерных белков.
Этот протокол представляет собой недавно разработанную установку для определения контрактности миофибриллов, включающих силовой зонд кантилевера с нано-ньютоновским разрешением (т.е. Optiforce). Этот силовой зонд основан на принципе интерферометрии. Интерферометрия позволяет использовать относительно жесткие кантилеверы. Это позволяет измерить силу с небольшим отклонением кантилевера, приближаясь к изометрическим сокращениям миофибриля. Зонд позволяет оценить низкие пассивные и активные силы, которые производятся одним миофибрилем, изолированным от различных биопсий мышц, в том числе от человека, с высоким соотношением сигнала к шуму. Оптический силовой зонд кантилевера, включенный в эту установку, основан на интерферометреФабри-Перо 12. Интерферометр обнаруживает небольшие смещения между оптическим волокном и позолоченным кантилевером, установленным на ферруле(рисунок 3). Зазор между оптическим волокном и кантилевером называется полостью Фабри-Перот. Миофибрили устанавливаются между зондом и пьезо-мотором с использованием двух стеклянных волокон, покрытых клеем. Сила, производимая миофибрилем, может быть математически получена из данных интерферометра. Интерферометрия основана на суперпозиции или вмешательстве двух или более волн (в этой установке три световые волны). Лазерный свет длиной волны от 1528,77 до 1563,85 нм излучается из интерферометра и направляется через оптическое волокно. В зонде свет отражается 1) на стыке оптического волокна и среды(рисунок 3A); 2) на интерфейсе среды и кантилевера(рисунок 3B); и 3) на стыке металлического и золотого покрытия кантилевера(рисунок 3C). Отражение в интерфейсе А и В зависит от рефракционногоиндекса (n)среды, в которую погружается зонд. Свет, состоящий из трех наложенных отражений, возвращается к фотодиоду в интерферометре. Фотодиод измеряет интенсивность света, что является результатом интерференционной картины трех наложенных отражений. Когда контрактная сила генерируется путем активации или растяжения миофибриля, миофибриль тянет на кантилевер. Это движение изменяет размер полости(d) и, следовательно, количество длин волн, которые вписываются в полость. Свет, отраженный в кантилевере, будет иметь другую фазу, что приведет к другой схеме помех. Фотодиод записывает это изменение интенсивности интерференционной модели как изменение Вольтов. Впоследствии, myofibril силовой генерации рассчитывается из этого изменения, с учетом жесткости кантилевера. Силовой зонд откалиброван производителем, нажав кончик монтажной иглы, прикрепленный к свободной передаче конца кантилевера, против весовой шкалы, сохраняя при этом изгиб кантилевера, равный кратной длине волны лазерасчитывания 13. Таким образом, интерферометрия является весьма чувствительным методом обнаружения небольших изменений расстояния, позволяющим измерять силы с нано-ньютоновым разрешением. Это разрешение позволяет оценить производство миофибрилляции с высоким соотношением сигнала к шуму. В то время как традиционная интерферометрия ограничивает диапазон измерений линейной частью кривой интерференции, используя усилитель блокировки и модуляцию длины волны лазера,преодолевает это ограничение 14. Это более подробно описано в разделе обсуждения.
Для измерения миофибриля активного напряжения, быстро шаг перфузии система была включена подвергать миофибриля кальция решений(рисунок 4A). Система быстрой перфузии позволяет вносить изменения в раствор в пределах 10 мс. Из-за их малого диаметра, диффузии кальция в миофибриль почти мгновенно. Следовательно, эта система особенно подходит для измерения скорости связывания актин-миозин во время активации и высвобождения во время релаксации. Скорость активации (kACT) и релаксации (kREL) может быть определена по кривым активации релаксации. Кроме того, подвергая миофибрилляции кальция решения повышения концентрации, сила кальция отношения и чувствительность кальция может быть определена.
Кроме того, двигатель длины пьезо позволяет быстро растягиваться и сокращать миофибриль. Это дает возможность изучить вязко-вязкие свойства (т.е. пассивное напряжение) миофибриля, а также выполнение быстрого сокращения и рестайка миофибриля для определения скорости редевелопмента напряжения (kTR). Параметры, извлеченные из экспериментов с активным и пассивным напряжением, могут быть изменены генными мутациями в саркомерном белке.
Эта специально созданная установка была использована для измерения активных и пассивных контрактильные характеристики миофибрил, изолированных от здоровых человеческих, терпеливых и мышиных скелетных мышц.
протокол
Протокол для получения биопсии человека был одобрен институциональным советом по обзору в Медицинском центре Университета VU (#2014/396) и письменное информированное согласие было получено от испытуемых. Протокол для получения биопсии мышц животных был одобрен местным комитетом по этике животных университета VU (AVD114002016501)
1. Подготовка и изоляция миофибриля
ПРИМЕЧАНИЕ: Используйте ранее описанные методы глицерината биопсии, подготовить различные концентрации кальция (pCa)решения 7,16,17, и изолировать миофибрили2,18.
- Оттепель расслабляющий (pCa 9.0, Rx) и активации (pCa 4.5, Закон) решения, а также ингибиторы (1 M E64, 1 M DTT, 1 M лейпептин, 1 M PMSF), которые хранятся при -80 градусов по Цельсию.
- Возьмите глицеринированный кусок полосатых биопсии мышц примерно 1мм 3 и поместите его в небольшую чашку Петри с 1:1 Rx/glycerol (v/v) раствор и поместите чашку Петри на холодную тарелку при 4 градусов по Цельсию.
- Рассекаете кусок мышцы с помощью микроскопа вскрытия и миппов, отделяя одиночные мышечные волокна, не изолируя их от части мышцы.
ПРИМЕЧАНИЕ: Удалите как можно больше жировой и соединительной ткани, чтобы предотвратить загрязнение подвески миофибриля. - Перенесите кусок расчлененной ткани в трубку 5 мл с 1,5 мл расслабляющего раствора с ингибиторами (1 йл/мл E-64, 1 мл/мл лейпептина, 1 йл/мл ДТТ и 125 хл/мл ПМСФ). Дайте ткани закаляться при температуре около 4 градусов по Цельсию в течение 1 ч.
- Во время инкубации загрузим оба ПК, включите устройства и откройте связанное с ними программное обеспечение (см. таблицу материалов).
- Погрузите силовой зонд в ультрапурную воду в чашку Петри и откалибровайте зонд.
- Нажмите'Start Wizard'на интерферометре и следуйте инструкциям на экране. После нажатия Калибровка, нажмите на сцене микроскопа.
ПРИМЕЧАНИЕ: Нажатие на стадии микроскопа приведет к кантилевер отклоняться и проходить через бахрому. Это позволяет откалибровать зонд. - Оставьте зонд погруженным в ультрачистую воду в чашке Петри после калибровки.
- Нажмите'Start Wizard'на интерферометре и следуйте инструкциям на экране. После нажатия Калибровка, нажмите на сцене микроскопа.
- Инициализируйте положение двигателя пьезо. Для этого следуйте одному из шагов, описанных ниже.
- Когда пьезо двигатель будет использоваться дляk TR напряженности, установить длину до 0 мкм.
Настройки генератора сигналов можно найти в таблице 1, рисунок 5A. - Когда пьезо двигатель будет использоваться для пассивного напряжения, установить длину до 50 мкм.
Настройки генератора сигналов можно найти в таблице 1.
ПРИМЕЧАНИЕ: Разница между шагами является начальное положение двигателя длины пьезо. Чтобы растянуть миофибриль, пьезо двигатель должен тянуть, чтобы увеличить расстояние между обеими монтажных игл и удлинить миофибриль. Чтобы ослабить миофибриль, пьезо двигатель должен нажать, чтобы уменьшить расстояние между обеими монтажных игл и сократить миофибриль.
- Когда пьезо двигатель будет использоваться дляk TR напряженности, установить длину до 0 мкм.
- Подготовьте слайд микроскопа. Pipette 150 Л раствора полигидроксиэтилметакрилата (поли-HEMA) (5% поли-HEMA в 95% этанола, ж / в) на слайде микроскопа и распространить его по слайду, чтобы все это покрыто.
ПРИМЕЧАНИЕ: Если подвеска миофибриля трубят на неокрашенном слайде микроскопа, миофибрили, которые опускаются на дно будет придерживаться слайд микроскопа, и это не будет возможно, чтобы приклеить их. - Заполните шприцы растворами pCa (см. рисунок 4A)и заполните систему перфузии.
ПРИМЕЧАНИЕ: В этих шагах все трубы предварительно заполнены с соответствующим решением, чтобы убедиться, что все пузырьки воздуха удаляются из труб.- Заполните приток труб потока фонового потока камеры(рисунок 3, 4A)приток с Rx.
- При использовании, промыть многообразие с ультрачистой водой, чтобы удалить воздух. Для этого соедините шприц с ультрачистой водой к розетке и смойте в нем в обратном направлении. Заблокив неиспользованные порты многообразного.
- Включите каждый шприц pCa, чтобы заполнить свои соответствующие трубки с раствором pCa. Затем соедините их с многообразием и Ɵ стеклом.
- Откройте клапаны 1 и 6 с программным обеспечением панели получения данных(см. Таблицу материалов),проверяя кнопку ' 1'6' (рисунок6A),чтобы заполнить Ɵ-стекло с расслабляющим (pCa 9.0) и активации (4,5) решения и закрыть клапаны, когда Ɵ-стекло заполнено (Рисунок 6B).
2. Монтаж миофибриля
- Пальто микроскоп слайд с поли-HEMA для предотвращения миофибрильки от прилипания к стеклу.
- Подготовка гомогенизатора (см. таблицу материалов)для гомогенизации тканей. Очистите внутренний стержень ротора с чистой бумагой ткани, собрать гомогенизатор, и спина 1x для 15 с в спирте и трижды по 15 с каждый в ультрапурной воде. Предварительно процразить гомогенизатор в расслабляющем растворе 1 x для 15 с на льду.
- Поместите стержень гомогенизатора в трубку, содержащую мышечную ткань, как описано в шаге 1.4 и, сохраняя трубку на льду, спина ротора на 15 с на скорости 5, чтобы разорвать мышечную ткань и получить подвеску миофибриля.
- Пипетка 50 йл подвески миофибриля и 250 йл расслабляющего раствора на слайде микроскопа, покрытом поли-HEMA в тканевой ванне. Это сформирует жидкое падение. Накройте ванну крышкой, чтобы защитить от пыли и ждать 5-10 минут, чтобы миофибрили опуститься на дно.
ПРИМЕЧАНИЕ: Соотношение между подвеской и расслабляющим раствором зависит от качества изоляции, поэтому соответствующим образом корректируется. Например, если доходность миофибриля низкая и мало подходящих миофибрилляций присутствуют в подвеске, добавьте больше подвески миофибриля и разбавьте менее расслабляющим раствором (например, 75 мл подвески миофибриля и 225 йл расслабляющего раствора). Сердечную и скелетную мышечную ткань легко распознать из-за ее структуры. Используя цель 10x или 40x, эта закономерность также видна в одной миофибриле. В случае, если другие ткани присутствуют в подвеске, миофибриллы могут быть выбраны визуально. Можно пропустить 5-10 минут ожидания. Тем не менее, это увеличивает сложность склеивания миофибриля. - Пальто монтажные иглы с клеем (оболочка и этанол; 120 мг шелухи в 2 мл 70% этанола). Для этого нагрейте клей при температуре 65 градусов по Цельсию в течение 30-60 с и пипетку 6 йл на новой стеклянной горке без покрытия. Опустите кончик каждой монтажной иглы в клей и повторяйте до тех пор, пока не будет виден слой клея. Перемести зонд и пьезо вверх вертикально с микроманипуляторами, чтобы освободить место для места ванны ткани на стадии микроскопа. Удалите стеклянную горку, содержащую клей.
- Монтаж миофибриль
- Поместите ванну с микроскопом слайд покрыты поли-HEMA, содержащий подвеску миофибриля на стадии микроскопа. Используйте сцену, чтобы найти подходящий миофибриль с целью 40x. При необходимости переместите и поверните тканевую ванну, чтобы переместить миофибриль в монтируемое положение.
ПРИМЕЧАНИЕ: Ищите миофибрильки с видимым рисунком полосы длиной около 30 мкм. Как подробно описано в шагах 3.1 и 3.2.1 можно проверить длину и длину саркомера до склеивания миофибриля. Не клея разорванные миофибриль, потому что они могут сломаться во время сокращения. - Сдвиньте камеру потока на место прямо над каплей жидкости, содержащей миофибриль в тканевой ванне (начатой на слайд в шаге 2.4) и опустите ее. Остановитесь, прежде чем он попадает в жидкое падение.
- Опустите пьезо монтаж иглы и нажмите его на нижней оконечности миофибриля. Поднимите его немного, чтобы проверить, если миофибриль прилагается к игле.
- Опустите камеру потока достаточно далеко для монтажной иглы зонда, чтобы достичь дна без зонда касаясь камеры потока.
- Нажмите монтажную иглу зонда на верхнюю оконечность миофибриля. Поднимите его немного, чтобы проверить, если миофибриль прилагается к игле.
- Поднимите миофибриль со дна ванны, насколько это возможно, не теряя способности фокусироваться без объективного прикосновения к нижней части стекла.
- Поместите ванну с микроскопом слайд покрыты поли-HEMA, содержащий подвеску миофибриля на стадии микроскопа. Используйте сцену, чтобы найти подходящий миофибриль с целью 40x. При необходимости переместите и поверните тканевую ванну, чтобы переместить миофибриль в монтируемое положение.
3. Первоначальный эксперимент
- Используйте микроманипуляторы, камеру и программное обеспечение системного контроллера(рисунок 7A, см. Таблицу материалов) для измерения длины саркомера. Перемести пьезо и/или силовой зонд, чтобы установить начальную длину саркомера миофибриля до 2,5 мкм.
ПРИМЕЧАНИЕ: Саркомерная длина 2,5 мкм обеспечивает оптимальное перекрытие между головками миозин и актином. - Используя функцию сосуда программного обеспечения системного контроллера, измеряйте длину и ширину миофибриля(рисунок 7B,C).
ПРИМЕЧАНИЕ: При повороте камеры, он может наклоняться горизонтально и / или вертикально. Чтобы проверить выравнивание камеры, уровень духа может быть использован для проверки того, что камера вращается и не наклонена.- Распоить миофибриль в центре видео изображения с помощью микроскопа.
- Нарисуйте квадрат с одной стороны миофибриля на другую. Для длины, убедитесь, что включить темный край клея капель(рисунок 2A) в квадрате, потому что обработка изображения основана на контрасте.
- Начните записывать данные в программное обеспечение контроллера системы (см.Таблицу материалов), нажав 'Start' и после 5 с паузы системного контроллера записи программных данных, нажав кнопку 'Пауза' . Длина теперь записана в данных.
- Для ширины сначала поверните камеру на 90 градусов (см. таблицу материалов),а затем используйте контраст края самого миофибриля.
- Начните записывать данные в программное обеспечение контроллера системы (см. Таблицу материалов),нажав 'Start' и после 5 с паузы системного контроллера записи программных данных, нажавкнопку 'Пауза'. Ширина теперь записана в данных.
- Если необходимо определить активное напряжение миофибриля, необходимо использовать установку перфузии. Если это так, продолжайте шаг 3.4. Если будет определено только пассивное напряжение, пропустите шаги 3.4-4.1.3.7 и продолжайте на шаге 4.2.
- Позиция и инициализировать установку перфузии.
ПРИМЕЧАНИЕ: Это необходимо только для генерации активной силы. Продолжайте шаг 4.2 при выполнении экспериментов пассивного напряжения.- Установите быстро шаговую моторную позицию на 4 V(рисунок 5B).
- Сдвиньте перфузию стоять на столе, чтобы выровнять левый нижний угол стенда с лентой на столе.
ПРИМЕЧАНИЕ: Будьте осторожны, чтобы не попасть в силу зонда или пьезо двигателя. - Используйте манипулятор, чтобы примерно Ɵ стекло на глаз.
- Посмотрите через окуляр и осторожно переместите Ɵ к миофибрилю с помощью манипулятора.
- Выровнять верхний канал Ɵ-стекло с миофибрилем с помощью манипулятора и проверить положение, выполняя быстрый шаг (настройки генератора сигнала можно найти в таблице 1) с программным обеспечением контроллера системы(рисунок 2B-C, см. Таблицу материалов).
ПРИМЕЧАНИЕ: Убедитесь, что нижний канал будет выровнен с миофибрилем во время фазы активации быстрого шага(рисунок 2B-C).
- Включите фоновый поток Rx(рисунок 4A), чтобы создать поток ламинарного фона в камере потока.
ПРИМЕЧАНИЕ: Фоновый поток необходим для предотвращения турбулентного потока в результате потока раствора pCa из Ɵ-стекла.- Включите приток камеры потока с рычагом клапана Luer.
- Отправить следующие параметры на отток насоса, чтобы начать осушеть камеру потока и предотвратить переполнение камеры потока (Рисунок 9): Клапан и клапан ванны (2); Режим микростепа - Micro; Целевой показатель Плункера - 48 000 евро; Скорость погружения 38-40 (произвольный).
ПРИМЕЧАНИЕ: Убедитесь, что уровень жидкости стабилен во все времена. Миофибриль не должен иссякнуть, как и кантилевер. Лучше иметь небольшой перелив, чем слишком мало потока.
- Отправить следующие параметры на отток насоса, чтобы начать осушеть камеру потока и предотвратить переполнение камеры потока (Рисунок 9): Клапан и клапан ванны (2); Режим микростепа - Micro; Целевой показатель Плункера - 48 000 евро; Скорость погружения 38-40 (произвольный).
- Включите приток камеры потока с рычагом клапана Luer.
- Чтобы установить температуру до нужного значения с термоэлектрическим контроллером температуры(рисунок 8, см. Таблицу материалов), введите нужную температуру и нажмите'Старт'. Подождите, пока желаемая температура не будет достигнута, проверив график в программном обеспечении термоэлектрического контроллера температуры и продолжайте.
ПРИМЕЧАНИЕ: При проведении экспериментов при комнатной температуре термоэлектрический контроллер температуры не должен использоваться.
4. Экспериментальный протокол (ы)
- Решите, какие протоколы активной силы должны быть выполнены.
ПРИМЕЧАНИЕ: В зависимости от данных, необходимых для исследования, может быть проведено несколько типов активных силовых экспериментов: шаг 4.1.1, измерение максимальной силы при насыщенииот 2 до 2 евро]; шаг 4.1.2, получение кривой Force-pCa для определения чувствительности кальция в дополнение к шагу 4.1.1; шаг 4.1.3, определяющий скорость перестройки напряжения путем составления протокола сокращения рестайка в дополнение к шагу 4.1.1 или 4.1.2.- Измерьте максимальную активную силу.
- Начните записывать данные в программное обеспечение контроллера системы (см. Таблицуматериалов), нажав' Начало'.
- Откройте клапаны 1 и 6 с помощью панели сбора данных (см. таблицуматериалов),проверяя кнопку '1'6', чтобы начать Ɵ-стеклянный поток расслабляющего решения и активации решения через Ɵ-стекло(рисунок 6A).
- Сбросить диапазон интерферометра так, чтобы базовая сила 0 V, выбрав и нажав 'Диапазон сброса' на интерферометре (см. таблицу материалов).
- Когда след силы стабилен, выполните Ɵ быстро шаг (размер шага 100 мкм).
Настройки генератора сигналов можно найти в таблице 1 (рисунок 5C). След активации-расслабления, похожий на рисунок 4D, будет записан и виден в программном обеспечении системного контроллера. - Приостановить запись программного обеспечения контроллера системы, нажавкнопку«Пауза».
- Если больше не будут выполняться активации, закройте клапаны 1 и 6, чтобы остановить поток Ɵ-стекла, контролируя кнопку '1'6'(рисунок 6B), остановите шприц насос(рисунок 9, см. Таблица материалов), нажав 'Прекратить', и остановить фоновый поток, закрыв клапан Luer.
- Кривая силы-pCa
ПРИМЕЧАНИЕ: Это похоже на шаг 4.1.1 для получения максимальной активной силы, но с несколькими активациями с использованием различных решений pCa.- Начните записывать данные в программное обеспечение контроллера системы, нажавкнопку "Старт".
- Откройте клапаны 1 и 2 с программным обеспечением панели сбора данных, чтобы начать поток расслабляющего решения и pCa 6.2 Ɵ стекло.
- Диапазон сброса интерферометра таким образом, чтобы базовая сила была 0 В, выбравинажав на диапазон сброса на интерферометре.
- Когда след силы стабилен, выполните Ɵ быстро шаг (размер шага 100 мкм).
Настройки генератора сигналов можно найти в таблице 1. - Приостановить программное обеспечение системного контроллера, нажавкнопку 'Пауза'.
- Повторите шаги 4.1.2.1-4.1.2.4 для клапанов 1 и 3 (pCa 5.8), клапанов 1 и 4 (pCa 5.6), клапанов 1 и 5 (pCa 5.4), и клапанов 1 и 6 (pCa 4.5).
- Если больше не будут выполняться активации, закройте клапаны 1 и 6, чтобы остановить поток Ɵ-стекла, контролируя кнопку '1'6'(рисунок 6A),остановите шприц-насос(рисунок 9), нажав 'Прекратить', и остановить фоновый поток, закрыв клапан Luer.
- Измерить скорость редевелопмента напряжения (kTR).
ПРИМЕЧАНИЕ: Это похоже на шаг 4.1.1 для максимальной активной силы, но с некоторыми изменениями и дополнительными шагами.- Рассчитайте движение пьезо, необходимое для ослабления миофибриля на 15% и введите это значение вгенераторе сигналов (рисунок 5D, Таблица 1).
- Начните записывать данные в программное обеспечение контроллера системы, нажав'Start'.
- Откройте клапаны 1 и 6 с программного обеспечения длясбора данных (рисунок 6A),чтобы начать поток расслабляющего решения и pCa 4.5 Ɵ стекло.
- Диапазон сброса интерферометра таким образом, чтобы базовая сила была 0 В, выбравинажав на диапазон сброса на интерферометре.
- Когда след силы стабилен, выполните Ɵ быстро шаг (размер шага 100 мкм).
Настройки генератора сигналов можно найти в таблице 1. - Когда сила плато будет достигнута, выполнить сокращение-restretch с пьезо.
Настройки генератора сигналов можно найти в(рисунок 5D, таблица 1). След активации-расслабления, похожий на рисунок 4E, будет записан и виден в программном обеспечении системного контроллера.
ПРИМЕЧАНИЕ: Пользовательский протокол может быть сделан для автоматизации шагов выше. - Приостановить программное обеспечение системного контроллера, нажавкнопку 'Пауза'.
- Если больше не будут выполняться активации, закройте клапаны 1 и 6, чтобы остановить поток Ɵ-стекла, контролируя кнопку '1'6'(рисунок 6B), остановите шприц насос (Рисунок 9), нажав 'Прекратить', и остановить фоновый поток, закрыв клапан Luer.
- Измерьте максимальную активную силу.
- Выполняем пассивные измерения силы.
- Выполните непрерывный стрейч.
- Рассчитайте движение пьезо, необходимое для растяжения миофибриля и введите это значение в генераторе сигналов(таблица 1).
ПРИМЕЧАНИЕ: Это пример параметров. Рассчитайте количество растяжения и время растяжения относительно длины саркомера. Эти настройки необходимы для обеспечения того, чтобы скорость растяжения на саркомер остается равной по миофибрилям. - Начните записывать данные в программное обеспечение контроллера системы, нажав'Start'.
- Диапазон сброса интерферометра таким образом, чтобы базовая сила была 0 В, выбравинажав на диапазон сброса на интерферометре.
- Выполните непрерывный стрейч с генератором сигнала в программном обеспечении контроллера системы для работы пьезо. Пример параметров генератора сигналов можно найти в таблице 1.
- Сократите миофибриль, чтобы ослабить длину с пьезо после завершения растяжения(таблица 1).
- Рассчитайте движение пьезо, необходимое для растяжения миофибриля и введите это значение в генераторе сигналов(таблица 1).
- Выполните шаг за шагом стрейч.
- Начните записывать данные в программное обеспечение контроллера системы, нажав'Start'.
- Диапазон сброса интерферометра таким образом, чтобы базовая сила была 0 В, выбравинажав на диапазон сброса на интерферометре.
- Выполните шаг за шагом стрейч с генератором сигнала в программном обеспечении контроллера системы для работы пьезо. Пример параметров генератора сигналов можно найти в таблице 1 (рисунок 5E).
- Сократите миофибриль, чтобы ослабить длину с пьезо после растяжения закончена. Пример параметров генератора сигналов можно найти в таблице 1.
- Выполните непрерывный стрейч.
- Приостановить программное обеспечение системного контроллера, нажавкнопку 'Пауза'.
- Остановите запись данных, нажав кнопку'Stop'в программном обеспечении системного контроллера.
- Сохраните данные, нажав 'Файл' и ' Сохранитьданные ' впрограммном обеспечении контроллера системы.
5. Очистка
- Удалите измеренную миофибриль и приготовьтесь к следующему миофибрилю.
- Чтобы сделать это, осторожно оторвать миофибриль, глядя через глаз с 40x цели.
- Перемести вверх силовой зонд и пьезо. Двигайтесь вверх Ɵ стеклом вверх, вправо и в спину. Затем двигайтесь вверх и сползай от камеры потока. Удалите тканевую ванну.
- Чтобы очистить монтажную иглу, привести его в фокус с помощью 10x и глаз. Опустите щетку в этанол и тщательно отмахнуться и удалить клей с иглы.
ПРИМЕЧАНИЕ: Имейте в виду, что это может занять некоторое время, прежде чем клей отключается. - Промыть поток камеры и ткани ванны с ультрачистой водой.
- Поместите зонд в небольшую чашку Петри, наполненную ультрачистой водой. Убедитесь, что зонд полностью подводной.
- Когда эксперименты будут закончены, очистите настройку как выше и выполните следующие дополнительные шаги.
- Освободите трубки от ванны потока. Отправить параметры для оттока шприц насоса (см. Таблицу материалов, рисунок 9). Клапан и клапан ванны (2); Режим микростепа - Нормальный; Целевой показатель Плункера No 0; Скорость погружения 30.
ПРИМЕЧАНИЕ: Прекратите команду, когда трубка пуста. - Инициализировать насос несколько раз(рисунок 9B).
- Слейте шприцы. Для этого закройте все клапаны Luer, откройте все клапаны, снимите трубки с иглы шприца, удерживайте трубку конкретного pCa под иглой и откройте клапан Luer. Используйте вилки давления, чтобы ускорить процесс.
- Прикрепите трубку к игле шприца. Заполните шприцы 5 мл ультрачистой воды. Поместите чашку под Ɵ стекло. Откройте все клапаны и откройте клапан давления, чтобы промыть систему.
- Выключите систему. Выключите блок питания ПК, интерферометра и контроллера пьезо.
- Освободите трубки от ванны потока. Отправить параметры для оттока шприц насоса (см. Таблицу материалов, рисунок 9). Клапан и клапан ванны (2); Режим микростепа - Нормальный; Целевой показатель Плункера No 0; Скорость погружения 30.
6. Анализ данных
- Экспортные следы данных от программного обеспечения контроллера системы (см.Таблицу материалов) до программы программного обеспечения электронной таблицы или буфера обмена, открыв файл данных и выбрав нужный сегмент. Показанные следы будут экспортироваться (например, сырая сила, длина саркомера и положение пьезо).
- Выполняем анализ с помощью программного обеспечения по выбору (например, MATLAB).
Результаты
Следы данных были записаны и открыты с помощью программного обеспечения контроллера системы (см. таблицу материалов). Полные следы или выбранные сегменты были экспортированы в буфер обмена или текстовый файл для дальнейшего анализа с желаемым программным обеспечением. Клапаны для управления потоком различных решений были переключены с помощью пользовательского программного обеспечения или вручную. Пользовательский скрипт MATLAB был использован для анализа темпов активации, реконструкции напряжения и релаксации. Максимальная активная сила и пик и сила плато экспериментов пассивной силы были взяты непосредственно из системного контроллера программного обеспечения силы след. После монтажа миофибриля(рисунок 2)был выбран желаемый протокол.
Максимальная активная сила икальций -чувствительность силы в миофибрилях, изолированных от биопсии мышей и скелетных мышц человека
На рисунке 4А схематично изображена экспериментальная установка, используемая для экспериментов с активной силой. Показаны следы силы активного силового эксперимента с миофибриль, изолированной от здоровых человеческих четырехглавых мышц. Миофибриль был активирован 5 раз с решениями с различной pCa (pCa 6.2, 5.8, 5.6, 5.4, 4.5; данные показаны на рисунке 4B). Средняя максимальная сила всех миофибриллей в этом эксперименте составила 123 мН/мм2. Кривая force-pCa была построена из сил плато, достигнутых во время каждой активации в каждом из пяти растворов кальция. Результаты показаны на рисунке 4C. Из этой кривой был рассчитан pCa на уровне 50% от максимальной силы производства (pCa50). В этом myofibril, pCa50 было 5.75.
Кроме того, одно или несколько соединений могут быть добавлены в перфлитый раствор для измерения его влияния на силу, вырабатываемую миофибриль. На рисунке 4Dиллюстрируется эффект ингибитора N-benzyl-p-toluene sulphonamide (BTS), быстрой подергивания мышц (тип II) ингибитора тяжелой цепи II (MHCII). 19 Myofibril был активирован сначала с помощью решения pCa 5.6, а затем с решением pCa 5.6 и BTS. Во время второй активации было произведено меньше силы, что указывает на то, что это была миофибриль, содержащая MHCII. Есть мутации в белках, которые присутствуют исключительно в конкретных типах мышц, и, таким образом, влияют только на миофибриллы из этого конкретного типа мышц. В этом случае важно различить влияние мутации на различные типы мышц. Кроме того, этот пример иллюстрирует возможность для тестирования эффективности терапевтических соединений в миофибрилях.
Рисунок 4E показывает активный след силы одного миофибриля, изолированного от мышечной ткани скелетной подошвы мыши. Миофибриль был установлен в установке и проникнут расслабляющим раствором (pCa 9.0), а затем перфузией с активироваваемым раствором (pCa 4.5, 0.032 mM кальция). Мы одновременно зафиксировали силу и длину саркомера. Это было почти изометрическое сокращение, так как отклонение кантилевера составило 0,5 мкм, что составило примерно 1% от вялой длины миофибриля (50 мкм). На рисунке 4E во время активного сокращения был выполнен протокол быстрого сокращения-рекремента для оценки скорости редевелопмента напряжения (kTR,желтая пунктирная линия). KTR является мерой кросс-мост велосипедной кинетики. Кроме того, активации и релаксации кривые были установлены для определения скорости активации(k ACT, красная пунктирной линии)и релаксации(k REL , зеленый пунктирной линии), соответственно. На рисунке 4 показан более подробный вид фазы релаксации, выделенной на рисунке 4F. Стали очевидными две фазы: 1) начальная медленная фаза релаксации (доминируют поперечный отслоение) и 2) быстрая фаза релаксации (доминируют поперечный отслоение и кальций-диссоциация)20.
Пассивная сила в миофибрилях, выделенная из биопсии скелетных мышц человека
На рисунке 10 показан след эксперимента с пассивной силой с миофибрилем, изолированным от здоровой мышечной ткани диафрагмы человека. Первый протокол касался одного или нескольких пассивных растяжек для определения вязко-вязких свойств саркомеров. На рисунке 10 показан силовой след непрерывного участка миофибриля (растяжение от саркомерной длины 2,2–3,0 мкм). Во время растяжения миофибрили проявляли как вязкие, так и эластичные характеристики. Об этом свидетельствует кривая, показанная на рисунке 10A. Резкий пик представляет обе характеристики, в то время как сила плато является мерой эластичности. Вязкость сопротивляется деформации линейно. Таким образом, сила упала после того, как напряжение было удалено. Рисунок 10B подчеркивает само растяжение и иллюстрирует высокое соотношение сигнала к шуму. Обратите внимание, что следы силы нефильтрованы.

Рисунок 1: Схематическое изображение и электронная микроскопия изображений скелетной мышцы и ее морфологии. (A) Показывает структуру скелетных мышц и (B) показывает структуру саркомера, самый маленький контрактильный блок. Эти схематические изображения адаптированы из Servier Medical Art. (C) показывает изображение одного мышечного волокна и (D ) показываетизображение электронноймикроскопии мышечного волокна, раскрывающее повреждение миофибриллятора, а также сохраненную ультраструктуру миофибрилляра. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Изображения, показывающие установленную миофибриль, Ɵ выравнивание, и пьезо монтаж иглы. (A) миофибриль установлен на слабину длины между стеклянными иглами волокна покрыты shellac, как видно через 40x цели. (B)Изображения положения миофибриллы Ɵ по отношению к миофибрилю (выделены белыми овалами), как видно из 10-х целей. (Вверху) Выровнено к верхнему каналу (расслабляющее решение, pCa 9.0); (Внизу) Нет, нет, нет. Выровнены к нижнему каналу (активация раствора, pCa 4.5) для окаймлять миофибриль кальцием и вызывать сокращение. (C)Схематические изображения положения Ɵ по отношению к миофибриль. (Вверху) Выровнено с верхним каналом (расслабляющее решение, pCa 9.0); (Внизу) Нет, нет, нет. Выровнены с нижним каналом (активация раствора, pCa 4.5) для окутывания миофибриля кальцием и индуцирования сокращения. (D)Монтаж иглы прилагается к углеродной стержень держателя пьезо. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Схематическое представление установки и конечной части камеры потока тканей. В темно-синей камере потока тканей, сделанной из алюминия, а в белом полости, в которой в положении показаны силовой зонд Ɵ стекло; (В центре) Миофибриль, прикрепленный между двумя стеклянными волокнами монтажных игл, прикрепленных к силовой зонду, и двигателем длины пьезо. Стекло Ɵ выровнено с миофибрилем. Стекло Ɵ двигаться вверх и вниз, чтобы подвергнуть миофибриль раствору кальция. (справа) Крупным планом силового зонда кантилевера. Указаны размер полости (или полость Фабри-Перо, d); интерфейсы отражения A, B и C; и пример световой волны, испускаемой лазером (красный). Кантилевер устанавливается на плече феррула. Волокно, которое несет лазер с интерферометра выходит из феррула на кончике кантилевера. Стеклянное монтажное волокно фиксируется на кантилевере с помощью воска. (Вверху слева) Интерферометр анализирует интерферометрный сигнал, передаваемый программному обеспечению системного контроллера. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4: Экспериментальная установка и данные экспериментов с активным напряжением. (A)Схематическое представление установки перфузии и используемых решений. Обратите внимание, что первая и последняя трубки (светло-голубой) содержат раствор без кальция (т.е. расслабляющий раствор). (B)Пример силовых следов активного эксперимента напряжения с миофибрилем, изолированным от мышечной ткани человека, показывающим пять активаций от расслабляющего раствора (pCa 9.0) до нескольких растворов активации (pCa 6.2 - 4.5). (C)кривая силы кальция; уровни силы на плато в панели (B) были нормализовывы и построены против их соответствующих уровней кальция. (D) Пример силового следа типа II (быстрое подергивание) миофибриля, выделенного из скелетной мышцы человека, активированной с раствором pCa 5.6 (синий), а затем с pCa 5.6 BTS (тип II специфический ингибитор поперечного моста, красный). (E) Пример данных след активного эксперимента напряжения с миофибрилями изолированы от мыши soleus скелетной мышечной ткани с быстрым сокращением-restretch протокола во время активации, чтобы определить скорость реконструкции напряжения (kTR, желтый пунктирной линии). Кроме того, активация и релаксация кривой были установлены для определения скорости активации (kACT, красная пунктирной линии)и релаксации(k REL , зеленый пунктирной линии), соответственно. (F) Зум фазы релаксации (вверху слева), выделенный в (E). Быстрый сигнал двигателя (внизу слева) указал точку времени, в которой решение изменилось с раствора активации (pCa 4.5) на расслабляющий раствор (pCa 9.0). Фаза релаксации состояла из линейной, медленной фазы (вверху справа) и экспоненциальной, быстрой фазы (внизу справа). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Пример установки для генератора сигналов в программном обеспечении управления системой. (см. таблицу материалов). 1) Указывает кнопку для выполнения команд, введенных в генератор сигнала. (A)Настройка двигателя длины пьезо. (B)Настройка быстрошагового двигателя. (C) Выполнение быстрого шага для активации миофибриля в течение 5с.( D ) Выполнение быстрого сокращения-restretch миофибриля для определения кTR. (E) Выполнение шаг за шагом участок миофибриля для определения вязко-вязких свойств. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Рисунок 6: Программное обеспечение контроллера Valve, используемое на ПК. (A)Кнопка, используемая для открытия клапанов 1 (Rx) и 6 (Акт). (B)Состояние кнопок, когда все клапаны закрыты. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
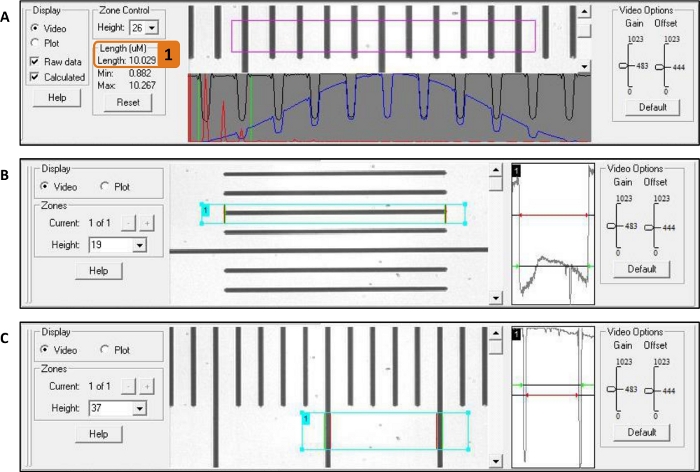
Рисунок 7: Измерение длины саркомера, длины миофибриля и ширины миофибриля с помощью программного обеспечения системного контроллера. В качестве примера используется линейка. (A) Измерение длины саркомера: фиолетовый ящик помещается вокруг миофибриля и длина саркомера показана в (1). (B) Измерение длины: циановая коробка помещается от начала до конца миофибриля. (C)Измерение ширины: После вращения камеры на 90 градусов, циановая коробка помещается с одной стороны миофибриля на другую. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 8: Программное обеспечение термоэлектрического контроллера температуры. (A)Установить связь с термоэлектрическим контроллером температуры. (B)Расширение температурных параметров. (C) Установите желаемую температуру, в этом случае: 15 градусов поЦельсию (D) Включите термоэлектрический контроллер температуры и отправьте напряжение в термоэлектрический охладитель модуля Peltier. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 9: Настройки для насоса оттока шприца. (A)Открытое подключение к насосу при нажатии (1). (B) Запустите насос с предопределенными настройками, нажав (2). (C) Начало откачки оттока, установив'Valve Commands' на ' BathValve'(2) и введя ' Параметрыкомандного набора' как показано на фото. Выполняйте команду, нажав (3). Команды могут быть прекращены путем нажатия (4). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
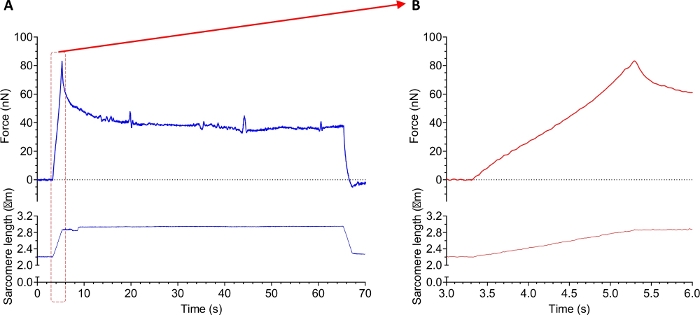
Рисунок 10: Пример данных след пассивного эксперимента напряжения с миофибрилями изолированы от человеческой скелетной мышечной ткани. (A) Запись силы (верхняя) и саркомерная длина (нижняя) во время протокола растяжения и выпуска. (B) Увеличить (A) показывая силу (Верхний) и саркомер длины во время фазы растяжения миофибриля. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
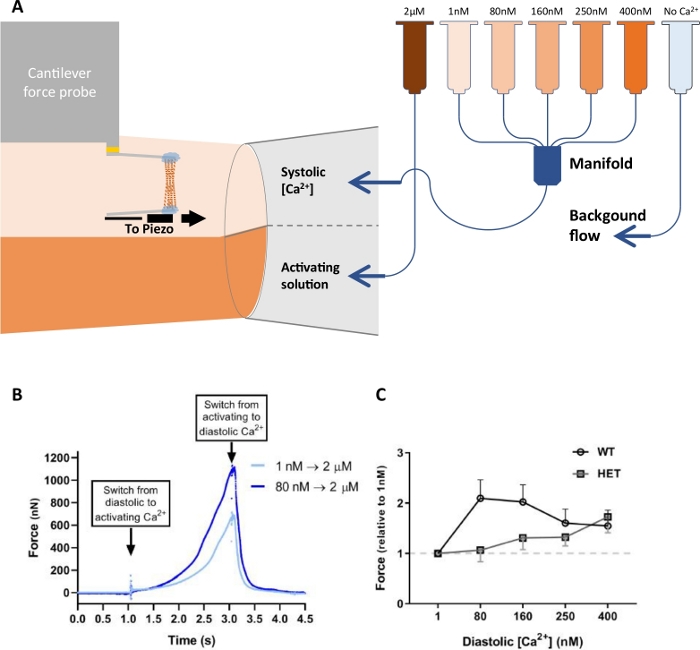
Рисунок 11: Экспериментальная установка и данные кардиомиоцитов экспериментов по предварительной активации кальция. (A)Схематическое представление установки перфузии. Обратите внимание, что последняя трубка (светло-голубой) содержит раствор без кальция (расслабляющий раствор). (B) Наложенные кривые активации кардиомиоцита без (светло-голубой) и с (темно-синий) предварительной активации кальция, с концентрациями кальция 1 нм и 80 нм, соответственно. (C)Сравнение преактивации кальция в диком типе (WT) и гетерозиготных РБМ20 (HET) кардиомиоцитов, изолированных от крысиного левого желудочка. Эта цифра была изменена с Najafi и др.21. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Шаг | Устройства | Описание | Формы | Первоначального | ||||||||
| 1.7.1. | Пьезо | Инициализация пассивного напряжения | Фиксированной | 51,6 мкм | ||||||||
| 1.7.2. | Пьезо | Инициализация активного напряжения | Фиксированной | 0 мкм | ||||||||
| Шаг | Устройства | Описание | Формы | Первоначального | Задержки | Представители | Уровень | Задержки | Уровень | Задержки | ||
| 3.4.4. / 4.1.1.4. / 4.1.2.4. | Быстрый шаг | Тестирование ɵ-стеклянное положение / Активация миофибриля | Импульса | 4 V | 1 с | 1 x | 3 V | 5 с | 4 V | 1 с | ||
| 4.1.3.4. | Быстрый шаг | Активация миофибриля (включить kTR) | Импульса | 4 V | 1 с | 1 x | 3 V | 10-е годы | 4 V | 1 с | ||
| Шаг | Устройства | Описание | Формы | Первоначального | Задержки | Представители | Уровень рампы | Длительность рампы | Задержки | Уровень рампы | Длительность рампы | Задержки |
| 4.1.3.1. / 4.1.3.6. | Пьезо | Сокращение-Restretch для kTR | Трапеции | 0 мкм | 0,5 с | 1 x | 0 и 0,150 л 0 | 0,01 с | 0,01 с | 0 мкм | 0,01 с | 1 с |
| 4.2.1.1. / 4.2.1.4. | Пьезо | Продолжает растягиваться | Трапеции | 51,6 мкм | 2 с | 1 x | 51,6 - 0,30 й л0 | 2 с | 0 с | 51,6 - 0,30 й л0 | 0 с | 1 с |
| 4.2.1.4. | Пьезо | Верните миофибриль в слабину длины | Трапеции | 1,6 мкм | 2 с | 1 x | 51,6 мкм | 5 с | 0 с | 51,6 мкм | 0 с | 1 с |
| 4.2.2.3. | Пьезо | Шаг за шагом растянуть | Трапеции | 51,6 мкм | 2 с | 10 x | 51,6 - 5 мкм | 0,5 с | 10 с | 51,6 - 5 мкм | 0 с | 0 с |
| 4.2.3. | Пьезо | Верните миофибриль в слабину длины | Трапеции | 1,6 мкм | 2 с | 1 x | 51,6 мкм | 5 с | 0 с | 51,6 мкм | 0 с | 0 с |
Таблица 1: Таблица, описывающая различные настройки генератора сигналов, используемые в программном обеспечении системного контроллера для работы двигателя длины пьезо и быстрошагового двигателя.
Обсуждение
Описан протокол для оценки контрактильной функции миофибрил, изолированных от человеческих или животных скелетных мышечных тканей. Силовое разрешение этой установки было описано ранее Chavan et al.12. Короче говоря, это определяется случайными колебаниями длины полости Фабри-Перо, образовавав место между обнаружением волокна и кантилевером, которые производят доминирующую часть шума на выходе считывания (выраженного в V), который, помноженные на чувствительность отклонения (выраженную в м/в) и пружинной константой кантилевера (выраженной в N/m), обеспечивает силовой шум. Для нашей установки, корень средний квадратный (rms) шум в воздухе на выходе считывания, отобранных на 1000 точек данных / с (образец / с), составляет около 2 мВ. Для типичного измерения миофибриля используется зонд с пружинной константой 0,7 Н/м (чувствительность отклонения ∼300 нм/В). Это значение rms соответствует разрешению отклонения кантилевера 0,6 нм, что приводит к чувствительности силы в размере 0,37 нн. Силовой зонд калибруется, толкая кончик монтажной иглы против весовой шкалы, сохраняя при этом изгиб кантилевера равным кратной длине волны лазера считывания13. Этот метод калибровки влечет за собой как кантилевер и монтаж жесткости иглы, а также возможные изменения крутящего момента кантилевера и монтаж иглы из-за скорости и величины сокращения миофибриля. В настоящее время доступна установка для оценки контрактности миофибриля, которая основана на обнаружении лазера, отклоняемого от кантилевера, т.е. оптического отклонения луча (1700 A; разрешение силы 1 nN). Эта система была разработана Labuda et al. с использованием оптического перископа для управления лазерным светом в направлении и от кантилевера в ограничивающихконфигурациях 11. В этой системе миофибриль устанавливается между кантилевером атомной силы и жесткой стеклянной иглой. Преимуществом описанной здесь системы является более высокая чувствительность силы и соотношение сигнала к шуму. Кроме того, в этой установке можно использовать относительно жесткие кантилеверы, что приводит к небольшому отклонению кантилевера при применении миофибрилляторной силы. Это важно, так как позволяет проводить измерения силы при почти постоянной длине саркомера. Наконец, по сравнению с системой, описанной Labuda et al., система здесь использует аналогичные или идентичные методы для контроля температуры, чтобы вызвать изменения длины на миофибриле, и изменить перфузионые решения с помощью Ɵ-стекло и быстрый шаг двигателя. Преимущество системы, описанной Labuda et al., заключается в том, что изменение состава раствора (между кантилевером и оптическим перископом) не влияет на выход сигнала. В описанной здесь системе состав раствора между кантилевером и оптическим волокном должен оставаться неизменным. Решение этой проблемы описано более подробно ниже.
Оптимизации
Оптический силовой зонд в сочетании с быстрошаговой перфузионой системой привел к осложнениям. Разница в оптических свойствах между растворами Ca2 с низкой и высокой концентрацией мешает измерению силы. Для предотвращения обратного потока раствора высокого кальция была спроектирована пользовательская камера потока(рисунок 3). Постоянный фоновый поток раствора без кальция индуцируется справа налево, чтобы сохранить раствор постоянным между верхней частью оптического волокна и кантилевером(рисунок 3D).
Для контроля температуры на камере потока устанавливается элемент Пелтиера с жидким охлаждением. Эта камера потока термически отсоединяется от микроскопа, устанавливая ее на пластиковый адаптер. С помощью элемента Peltier, управляемого системой TEC, можно контролировать температуру раствора с точностью 0,1 градуса по Цельсию. Температура контролируется датчиком температуры, установленным на камере потока. Температура стабильности имеет важное значение в связи с характером силы превлодока. Кантилевер состоит из стеклянной полосы с золотым покрытием, что фактически делает его термометром. Таким образом, кантилевер изгибается с перепадами температуры.
Установка использует быстро шаг перфузионные системы (см.Таблица материалов ), чтобы контролировать движение Ɵ стекла. Эта система позволяет перфузии переключатели в течение 10 мс. Сочетание метода контроля температуры и переключения раствора делает эту систему особенно подходящей для измерения кинетики саркомерной контрактности (т.е. темпов развития силы, редевелопмента напряжения и релаксации) в миофибрилях.
Первоначально недостатком использования интерферометрии был небольшой годный к использованию диапазон из-за необходимости использования линейной части кривой помех (No/8, при этом длина волны лазера). Однако последние нововведения устранили эту потребность, объединив модуляцию длин волн с усилителем блокировки. Таким образом, система не ограничивается одной линейной частью кривой помех. Это позволяет измерять бесконечное отклонение кантилевера14. Таким образом, диапазон считывания отклонения кантилевера этой системы значительно увеличен по сравнению с традиционной интерферометрией. Кроме того, силы зонды описаны легко заменить и Есть много кантилеверов доступны, с жесткостью, начиная от 0,5 Н / м до 20 Н / м. Таким образом, можно быстро изменить между кантилеверами и выбрать жесткость наиболее подходящий для эксперимента.
Проблемы
Нынешняя система является прототипом на основе системы измерения кардиомиоцитов (см. Таблицу материалов). Несколько компонентов могут быть улучшены, чтобы обеспечить лучший пользовательский опыт и данные более высокого качества. Во-первых, из-за надстройок к системе, вибрация и резонанс может быть проблемой, которая добавит шума сигналу. Кроме того, Ɵ держателя стекла и быстро шаг двигателя крепления метод может быть улучшен, чтобы сделать его менее склонным к вибрации.
Во-вторых, желательно заменить скоростной двигатель приводом длины пьезо, чтобы увеличить скорость переключения раствора и получить более последовательное движение.
В-третьих, растворы кальция, которые мы ранее использовали для активации одиночных полосатых мышечных волокон, включали пропионовую кислоту, но эти растворы поглощают ближнее инфракрасное излучение, мешая измерениям силы. Хлорид кальция был использован для устранения необходимости в пропионовой кислоте, что значительно уменьшило этот эффект. Этот вопрос присущ системе, основанной на интерферометрии и не присутствуют при использовании оптического отклонения пучка.
В-четвертых, пользовательский поток ванна была разработана для создания ламинарного потока, чтобы соответствовать потоку Ɵ стекла. Это предотвращает отток назад из-за турбулентности богатого кальцием раствора. Таким образом, раствор между кончиком оптического волокна и кантилевер остается постоянным. Крышки с миофибрилями могут свободно перемещаться под камерой потока и, следовательно, выбор подходящих миофибрилов не ограничивается небольшой площадью камеры потока.
Воспроизводимость и изменчивость
Существует несколько элементов системы и протокола, которые имеют важное значение для степени воспроизводимости и изменчивости полученных данных.
Во-первых, качество измерений сильно зависит от качества изоляции миофибриля. Идентичные протоколы дают различные качества и количества миофибрил от различных биопсий. В некоторых случаях биопсия едва дает годные к использования миофибриль или вообще не дают. Общий консенсус заключается в том, что поврежденные миофибрили будут ломаться во время сокращения и, таким образом, не учитываются в результатах.
Во-вторых, существует неопределенность в определении поперечной области миофибриля. Из-за технических ограничений можно измерить ширину миофибриля только в одной плоскости. Поэтому для расчета поперечной области мы предполагаем, что ширина и глубина равны. Когда сила нормализуется в поперечную область для расчета максимального активного напряжения, следует знать об этом предположении.
Монтаж миофибрил из-за миофибриля монтаж угол, положение, и целостность клея.
Хотя угол и положение монтажа в значительной степени можно контролировать визуально, небольшие различия между миофибрилями могут присутствовать. Целостность клея не была тщательно исследована. Тем не менее, целостность клея может быть проверена путем мониторинга длины саркомера в миофибриле до и после активации. Когда больше саркомеров находятся между клеем после протокола, это говорит о том, что проскальзывание миофибриля в клее произошло. Следовательно, этот миофибриль должен быть исключен из набора данных.
Другие применения установки: Преактивация кальция в кардиомиоцитах, изолированных от левого желудочка крысы
В дополнение к оценке контрактильной функции миофибрилляций, система также может быть использована для измерения механики кардиомиоцитов. Например, рисунок 11 иллюстрирует использование мембранно-пермеабилизированных одиночных кардиомиоцитов, изолированных от крысиного левого желудочка21. В отличие от описанных выше экспериментов, расслабляющее решение было изменено, и активация раствора была постоянной. Каждый кардиомиоцит прошел пять наборов активаций, подвергая его 2 мкм свободного раствора кальция в течение 1 с. Ограничение времени 1 выбрано, чтобы имитировать ограниченный по времени характер сердечных сокращений, где воздействие растворов низкой концентрации кальция имитирует диастолическую фазу, а воздействие растворов высокой концентрации кальция имитирует систолическую фазу сокращения сердечной мышцы(рисунок 11A). Для каждого из пяти наборов диастолический кальций был разнообразным (1, 80, 160, 250 и 400 нм кальция), в то время как систолический кальций оставался неизменным(рисунок 11A). Набор состоял из двух наборов из трех циклов активации-расслабления на уровне 1,8 мкм против 2,0 мкм и 2,0 мкм против 2,2 мкм для различных экспериментальных групп. Пиковая сила измерялась на уровне 1 с от выключателя пипетки и усредовылась для набора трех циклов активации-расслабления. Высокое соотношение сигнала к шуму и высокий динамический диапазон этого прев дьякона силы позволили нам измерить как небольшие изменения в диастолической силе, так и гораздо большие систолическиесилы (рисунок 11B). Увеличение диастолического кальция привело к более высокой силе на 2 МК кальция по отношению к первой активации(рисунок 11B). WT крысы кардиомиоциты были по сравнению с гетерозиготных (HET) RMB20 крыс кардиомиоцитов. Из-за альтернативного сращивания, HET крысы имеют более совместимый белок титина по сравнению с WT крыс. Эффект был преувеличен в ХТ кардиомиоцитов на 80 и 160 МК кальция(рисунок 11C).
Раскрытие информации
Михель Хельмес является акционером и совладельцем IONOptix Inc.
Благодарности
Этот проект финансировался AFM-Telethon и Фондом «Строительная сила для Немалин Миопати». Авторы хотели бы отметить создателя продуктов, упомянутых в этой статье, IONOptix Inc.
Материалы
| Name | Company | Catalog Number | Comments |
| Bio Spec Products, Inc. | 985370-XL | To isolate myofibrils | |
| Custom coded | Matlab | ||
| Custom fabricated | Includes Labview program to control over serial connection; To control valves | ||
| Custom fabricated | To cool the Peltier module | ||
| Custom fabricated | |||
| Custom fabricated | Aluminum tissue chamber | ||
| Custom fabricated | To control the valves; Includes PC software to control over USB | ||
| IonOptix | System controller software: data recording software with advanced signal generator for piezo and fast-step | ||
| IonOptix | MCS100 | To record sarcomere length | |
| IonOptix | Includes: Optiforce (interferometer), Micromanipulators, Signal interface, Piezo motor and controller. Based on the MyoStretcher | ||
| IonOptix | Force probe | ||
| Koolance | ADT-EX004S | ||
| Koolance | EX2-755 | To cool the Peltier module | |
| Microsoft | Data registration | ||
| Olympus | IX71 | ||
| Olympus | TH4-200 | ||
| Sigma-Aldrich | 529265 | Poly(2-hydroxyethyl methacrylate); Coating for microscope slides to prevent sticking of tissue | |
| Sigma-Aldrich | 78471 | Crystals to dissolve in ethanol resulting in glue | |
| TE Technology, Inc. | TE-63-1.0-1.3 | To cool the tissue flow chamber | |
| TE Technology, Inc. | TC-720 | Includes PC software to control over USB | |
| Tecan Trading AG | 20736652 | ||
| Tecan Trading AG | 20739263 | Syringe pump to induce backgroundflow together with fast-step perfusion system; Outflow from tissue flow chamber | |
| Thermo scientific | 2441081 | ||
| Warner Instruments (Harvard Bioscience, Inc.) | Discontinued | Alternative: SF-77CST/VCS-77CSP | |
| Warner Instruments (Harvard Bioscience, Inc.) | TG150-4 | To perfuse the tissue | |
| 1 PC for IonWizard and 1 PC for other software |
Ссылки
- Winter, J. M., Ottenheijm, C. A. C. Sarcomere Dysfunction in Nemaline Myopathy. J. Neuromuscular. Disease. 4, 99-113 (2017).
- Colomo, F., Piroddi, N., Poggesi, C., te Kronnie, G., Tesi, C. Active and passive forces of isolated myofibrils from cardiac and fast skeletal muscle of the frog. Journal of Physiology. 500, 535-548 (1997).
- Kulke, M., et al. a major source of myofibrillar stiffness in Drosophila indirect flight muscle. Journal of Cell Biology. 154, 1045-1057 (2001).
- Stehle, R., et al. Isometric force kinetics upon rapid activation and relaxation of mouse, guinea pig and human heart muscle studied on the subcellular myofibrillar level. Basic Research in Cardiology. 97, 127-135 (2002).
- Iorga, B., et al. Micromechanical function of myofibrils isolated from skeletal and cardiac muscles of the zebrafish. Journal of General Physiology. 137, 255-270 (2011).
- Ribeiro, P. A. B., et al. Contractility of myofibrils from the heart and diaphragm muscles measured with atomic force cantilevers: Effects of heart-specific deletion of arginyl-tRNA-protein transferase. International Journal of Cardiology. 168, 3564-3571 (2013).
- Joureau, B., et al. Dysfunctional sarcomere contractility contributes to muscle weakness in ACTA1-related nemaline myopathy (NEM3). Annals of Neurology. 83, 269-282 (2018).
- de Souza Leite, F., Minozzo, F. C., Altman, D., Rassier, D. E. Microfluidic perfusion shows intersarcomere dynamics within single skeletal muscle myofibrils. Proceedings of the National Academy of Sciences of the United States of America. 114, 8794-8799 (2017).
- Shalabi, N., Cornachione, A., de Souza Leite, F., Vengallatore, S., Rassier, D. E. Residual force enhancement is regulated by titin in skeletal and cardiac myofibrils. Journal of Physiology. 595, 2085-2098 (2017).
- Cornachione, A. S., Leite, F., Bagni, M. A., Rassier, D. E. The increase in non-cross-bridge forces after stretch of activated striated muscle is related to titin isoforms. American Journal of Physiology - Cell Physiology. 310, 19-26 (2016).
- Labuda, A., Brastaviceanu, T., Pavlov, I., Paul, W., Rassier, D. E. Optical detection system for probing cantilever deflections parallel to a sample surface. Review of Scientific Instruments. 82, 013701 (2011).
- Chavan, D., et al. Ferrule-top nanoindenter: an optomechanical fiber sensor for nanoindentation. Review of Scientific Instruments. 83, 115110 (2012).
- Beekmans, S. V., Iannuzzi, D. A metrological approach for the calibration of force transducers with interferometric readout. Surface Topography: Metrology and Properties. 3, (2015).
- van Hoorn, H., Kurniawan, N. A., Koenderink, G. H., Iannuzzi, D. Local dynamic mechanical analysis for heterogeneous soft matter using ferrule-top indentation. Soft Matter. 12, 3066-3073 (2016).
- Winter, J. M., et al. KBTBD13 is an actin-binding protein that modulates muscle kinetics. Journal of Clinical Investigation. , (2019).
- Winter, J. M., et al. Mutation-specific effects on thin filament length in thin filament myopathy. Annals of Neurology. 79, 959-969 (2016).
- Ottenheijm, C. A. C., et al. Deleting exon 55 from the nebulin gene induces severe muscle weakness in a mouse model for nemaline myopathy. Brain. 136, 1718-1731 (2013).
- Ribeiro, P. A., et al. Contractility of myofibrils from the heart and diaphragm muscles measured with atomic force cantilevers: effects of heart-specific deletion of arginyl-tRNA-protein transferase. International Journal of Cardiology. 168, 3564-3571 (2013).
- Pinniger, G. J., Bruton, J. D., Westerblad, H., Ranatunga, K. W. Effects of a Myosin-II Inhibitor (N-benzyl-p-toluene Sulphonamide, BTS) on Contractile Characteristics of Intact Fast-twitch Mammalian Muscle Fibres. Journal of Muscle Research and Cell Motililty. 26, 135-141 (2005).
- Stehle, R., Krüger, M., Pfitzer, G. Force kinetics and individual sarcomere dynamics in cardiac myofibrils after rapid Ca(2+) changes. Biophysics Journal. 83, 2152-2161 (2002).
- Najafi, A., et al. End-diastolic force pre-activates cardiomyocytes and determines contractile force: role of titin and calcium. Journal of Physiology. 597, 4521-4531 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены