Method Article
Isoler les myofibrils des biopsies des muscles squelettiques et déterminer la fonction contractile avec un transducteur de force de résolution nano-newton
Dans cet article
Résumé
Présenté ici est un protocole pour évaluer les propriétés contractiles des myofibrils musculaires striés avec la résolution nano-Newton. Le protocole utilise une configuration avec une sonde de force optique basée sur l’interférométrie. Cette configuration génère des données avec un rapport signal/bruit élevé et permet d’évaluer la cinétique contractile des myofibrils.
Résumé
Les cellules musculaires striées sont indispensables à l’activité des humains et des animaux. Les fibres musculaires simples sont composées de myofibrils, qui se composent de sarcomeres liés en série, les plus petites unités contractiles dans le muscle. Le dysfonctionnement sarcomérique contribue à la faiblesse musculaire chez les patients présentant des mutations dans les gènes encodage pour les protéines sarcomériques. L’étude de la mécanique du myofibril permet l’évaluation des interactions actin-myosine sans effets confusionnels potentiels des myofibrils endommagés et adjacents lors de la mesure de la contractilité des fibres musculaires simples. Les dommages ultrastructuraux et le désalignement des myofibrils pourraient contribuer à une contractilité altérée. Si des dommages structurels sont présents dans les myofibrils, ils se brisent probablement pendant la procédure d’isolement ou pendant l’expérience. En outre, les études sur les myofibrils fournissent l’évaluation des interactions actin-myosine en présence des contraintes géométriques des sarcomeres. Par exemple, les mesures dans les myofibrils peuvent élucider si le dysfonctionnement myofibrillaire est l’effet primaire d’une mutation dans une protéine sarcomérique. En outre, la perfusion avec des solutions de calcium ou des composés est presque instantanée en raison du petit diamètre du myofibril. Cela rend les myofibrils éminemment appropriés pour mesurer les taux d’activation et de relaxation pendant la production de force. Le protocole décrit dans cet article utilise une sonde de force optique basée sur le principe d’un interféromètre Fabry-Pérot capable de mesurer les forces de la gamme nano-Newton, couplée à un moteur de longueur piézo et à un système de perfusion à pas rapide. Cette configuration permet l’étude de la mécanique myofibril avec des mesures de force à haute résolution.
Introduction
Les cellules musculaires striées sont indispensables pour les activités de la vie quotidienne. Le mouvement des membres, la fonction respiratoire et le mouvement de pompage du cœur reposent sur la force générée par les cellules musculaires. Le muscle squelettique se compose de fascicles musculaires contenant des faisceaux de fibres musculaires simples (Figure 1A). Ces fibres musculaires sont composées de myofibrils, qui sont formés par des sarcomeres liés en série (Figure 1B,D). Les sarcomeres contiennent des filaments minces et épais. Celles-ci se composent principalement de chaînes de molécules d’actine et de myosine, respectivement (figure 1B). Les interactions Actin-myosine sont responsables de la capacité de génération de force du muscle. Les patients présentant des mutations dans les gènes encodage pour les protéines sarcomériques, telles que la nébuline, l’actine, et la troponine T, souffrent d’une faiblesse musculaire due au dysfonctionnement contractile1.
La qualité de la contractilité musculaire peut être étudiée à différents niveaux d’organisation, allant des muscles entiers in vivo aux interactions actin-myosine dans les tests de motilité in vitro. Au cours des dernières décennies, plusieurs groupes de recherche ont développé des configurations pour déterminer la contractilité des myofibrils individuels2,3,4,5,6,7,8,9,10. Ces configurations sont basées sur la détection des changements dans la déviation laser d’un porte-à-faux (c.-à-d. la déviation optique du faisceau) causés par la contraction du myofibril (pour plus de détails, voir Labuda et al.11). Bien que la détermination de la fonction contractile des myofibrils ait certaines limites (p. ex., la dynamique des processus de couplage excitation-contraction qui sont en amont des myofibrils font défaut), cette approche présente de multiples avantages. Il s’agit notamment de : 1) la capacité d’évaluer les interactions actin-myosine en présence des contraintes géométriques des sarcomeres; 2) la capacité d’évaluer les interactions actin-myosine sans effets confusionnels potentiels des myofibrils endommagés et adjacents (lors de la mesure de la contractilité des fibres musculaires simples dommages ultrastructuraux et le désalignement des myofibrils pourrait contribuer à une contractilité altérée) (Figure 1D); 3) le petit diamètre des myofibrils (~1 μm, figure 2A)et l’absence de membranes permettent une diffusion presque instantanée du calcium dans les sarcomeres. En outre, si des dommages structurels sont présents dans les myofibrils, ils se brisent probablement pendant leur isolement ou pendant l’expérience. Par conséquent, l’évaluation de la contractilité myofibril est une méthode élégante pour étudier les mécanismes de base de la contraction musculaire et de comprendre si les interactions perturbées actin-myosine sont la principale cause de la maladie musculaire causée par des mutations dans les protéines sarcomériques.
Ce protocole présente une configuration nouvellement développée pour déterminer la contractilité des myofibrils incorporant une sonde de force en porte-à-faux avec la résolution nano-Newton (c.-à-d. Optiforce). Cette sonde de force est basée sur le principe de l’interférométrie. L’interférométrie permet l’utilisation de cantilevers relativement rigides. Cela permet de mesurer la force avec peu de déviation du porte-à-faux, en approchant les contractions isométriques du myofibril. La sonde permet l’évaluation des forces passives et actives faibles qui sont produites par un seul myofibril isolé de différentes biopsies musculaires, y compris celles des sujets humains, avec un rapport signal/bruit élevé. La sonde de force de cantilever optique incorporée dans cette configuration est basée sur un interféromètre Fabry-Pérot12. L’interféromètre détecte de petits déplacements entre une fibre optique et un porte-à-faux recouvert d’or monté sur une ferrule (figure 3). L’écart entre la fibre optique et le porte-à-faux est appelé la cavité Fabry-Pérot. Myofibrils sont montés entre la sonde et le moteur piezo à l’aide de deux fibres de montage en verre enduit de colle. La force produite par le myofibril peut être mathématiquement dérivée des données de l’interféromètre. L’interférométrie est basée sur la superposition ou l’interférence de deux ondes ou plus (dans cette configuration trois ondes lumineuses). La lumière laser d’une longueur d’onde comprise entre 1 528,77–1 563,85 nm est émise par l’interféromètre et est envoyée par la fibre optique. Dans la sonde, la lumière est réfléchie 1) à l’interface entre la fibre optique et le milieu (Figure 3A); 2) à l’interface du milieu et du porte-à-faux (figure 3B); et 3) à l’interface entre le revêtement métallique et or du porte-à-faux (figure 3C). La réflexion à l’interface A et B dépend del’indicede réfraction ( n ) du milieu dans lequel la sonde est submergée. La lumière, composée des trois reflets superposés, revient à une photodiode dans l’interféromètre. La photodiode mesure l’intensité de la lumière, qui est le résultat du modèle d’interférence des trois réflexions superposées. Lorsque la force contractile est générée par l’activation ou l’étirement d’un myofibril, le myofibril tire sur le porte-à-faux. Ce mouvement modifie la taille de la cavité (d) et, par conséquent, le nombre de longueurs d’onde qui s’adaptent dans la cavité. La lumière réfléchie au porte-à-faux aura une phase différente, ce qui se traduira par un modèle d’interférence différent. La photodiode enregistre ce changement d’intensité du modèle d’interférence comme un changement dans volts. Par la suite, la génération de force de myofibril est calculée à partir de ce changement, en tenant compte de la rigidité du porte-à-faux. La sonde de force est calibrée par le fabricant en poussant la pointe de l’aiguille de montage, attachée à l’extrémité libre du porte-à-faux, contre une balance tout en gardant la flexion du porte-à-faux égale à un multiple de la longueur d’onde du laser de lecture13. Ainsi, l’interférométrie est une méthode très sensible pour détecter de petits changements de distance, permettant la mesure des forces avec la résolution nano-Newton. Cette résolution permet l’évaluation de la production de force myofibrillaire avec un rapport signal/bruit élevé. Alors que l’interférométrie traditionnelle limite la gamme de mesures à la partie linéaire de la courbe d’interférence, l’utilisation d’un amplificateur de verrouillage et la modulation de la longueur d’onde laser surmonte cette limitation14. Ceci est expliqué plus en détail dans la section de discussion.
Pour mesurer la tension active de myofibril, un système de perfusion à étapes rapides a été incorporé pour exposer le myofibril aux solutions de calcium (Figure 4A). Le système de perfusion à étapes rapides permet aux modifications de solution de se produire dans les 10 ms. En raison de leur petit diamètre, la diffusion du calcium dans les myofibrils est presque instantanée. Par conséquent, ce système est particulièrement approprié pour mesurer les taux de liaison actin-myosine pendant l’activation et la libération pendant la relaxation. Le taux d’activation (kACT)et de relaxation (kREL)peut être déterminé à partir des courbes d’activation-relaxation. En outre, en exposant les myofibrils aux solutions de calcium de concentration croissante, la relation force-calcium et la sensibilité de calcium peuvent être déterminées.
En outre, un moteur de longueur piezo permet l’étirement rapide et le raccourcissement du myofibril. Cela offre la possibilité d’étudier les propriétés viscoélastiques (c’est-à-dire la tension passive) du myofibril, ainsi que d’effectuer un raccourcissement rapide et le restretch du myofibril pour déterminer le taux de réaménagement de la tension (kTR). Les paramètres récupérés à la fois des expériences de tension active et passive peuvent être modifiés par des mutations génétiques dans une protéine sarcomérique.
Cette configuration sur mesure a été utilisée pour mesurer les caractéristiques contractiles actives et passives des myofibrils isolés du muscle squelettique humain, patient et de souris en bonne santé.
Protocole
Le protocole pour l’obtention de biopsies humaines a été approuvé par la commission d’examen institutionnel du Vu University Medical Center (#2014/396) et le consentement écrit en connaissance de cause a été obtenu à partir des sujets. Le protocole d’obtention de biopsies musculaires animales a été approuvé par le comité local d’éthique animale de l’Université VU (AVD114002016501)
1. Préparation et isolement myofibril
REMARQUE : Utilisez des méthodes précédemment décrites pour les biopsies de glycérinate, préparez les différentes solutions de concentration de calcium (pCa)7,16,17, et isolez les myofibrils2,18.
- Décongeler les solutions de détente (pCa 9.0, Rx) et d’activation (pCa 4.5, Act) ainsi que les inhibiteurs (1 M E64, 1 M DTT, 1 M de leupeptin, 1 M PMSF), qui sont stockés à -80 °C.
- Prenez un morceau glycériné de biopsie musculaire striée d’environ 1 mm3 et placez-le dans une petite boîte de Pétri avec 1:1 Rx/glycérol (v/v) solution et placez la boîte de Petri sur une plaque froide à 4 °C.
- Disséquer le morceau de muscle à l’aide du microscope de dissection et des forceps, séparant les fibres musculaires simples sans les isoler du morceau de muscle.
REMARQUE : Retirez autant de tissu gras et conjonctif que possible pour prévenir la contamination de la suspension myofibril. - Transférer le morceau de tissu disséqué dans un tube de 5 ml avec 1,5 ml de solution relaxante avec des inhibiteurs (1 μL/mL E-64, 1 μL/mL leupeptin, 1 μL/mL DTT et 125 μL/mL PMSF). Laisser le tissu se tempérer à environ 4 °C pendant 1 h.
- Pendant l’incubation, démarrez les deux PC, allumez les appareils et ouvrez le logiciel associé (voir Tableau des matériaux).
- Submerger la sonde de force dans de l’eau ultrapure dans une boîte de Pétri et calibrer la sonde.
- Appuyez surl’Assistant Démarrersur l’interféromètre et suivez les instructions à l’écran. Après avoir appuyé sur Calibrer,appuyez sur l’étape du microscope.
REMARQUE : Taper sur le microscope provoquera le porte-à-faux à dévier et à passer à travers les franges. Cela permet l’étalonnage de la sonde. - Laissez la sonde immergée dans l’eau ultrapure dans la boîte de Pétri après étalonnage.
- Appuyez surl’Assistant Démarrersur l’interféromètre et suivez les instructions à l’écran. Après avoir appuyé sur Calibrer,appuyez sur l’étape du microscope.
- Initialiser la position du moteur piezo. Pour ce faire, suivez l’une des étapes détaillées ci-dessous.
- Lorsque le moteur piézo sera utilisé pour la tension kTR, réglez la longueur à 0 μm.
Les paramètres du générateur de signaux se trouvent dans le tableau 1, figure 5A. - Lorsque le moteur piézo est utilisé pour la tension passive, réglez la longueur à 50 μm.
Les paramètres du générateur de signaux se trouvent dans le tableau 1.
REMARQUE : La différence entre les étapes est la position initiale du moteur de longueur de piezo. Pour étirer le myofibril, le moteur piezo doit tirer pour augmenter la distance entre les deux aiguilles de montage et d’allonger le myofibril. Pour relâcher le myofibril, le moteur piezo doit pousser pour diminuer la distance entre les deux aiguilles de montage et pour raccourcir le myofibril.
- Lorsque le moteur piézo sera utilisé pour la tension kTR, réglez la longueur à 0 μm.
- Préparer une diapositive au microscope. Pipette 150 μL de solution polyhydroxyéthylméthacrylate (poly-HEMA) (5% poly-HEMA dans 95% d’éthanol, w/v) sur une lame de microscope et l’étaler sur la lame afin qu’elle soit recouverte.
REMARQUE : Si une suspension de myofibril est pipette sur une lame de microscope non enduite, les myofibrils qui coulent au fond colleront à la lame de microscope et il ne sera pas possible de les coller. - Remplissez les seringues de solutions pCa (voir la figure 4A)et primez le système de perfusion.
REMARQUE : Dans ces étapes, tous les tubes sont préremplies avec la solution appropriée pour s’assurer que toutes les bulles d’air sont retirées du tube.- Remplissez le tube d’entrée du débit de fond de chambre d’écoulement (Figure 3, 4A) entrée avec Rx.
- Lorsqu’il est utilisé, rincer le collecteur avec de l’eau ultrapure pour enlever l’air. Pour ce faire, connecter la seringue avec de l’eau ultrapure à la sortie et rincer dans la direction inverse. Bloquez les ports inutilisés du collecteur.
- Activez chaque seringue pCa pour remplir leurs tubes respectifs avec une solution pca. Ensuite, connectez-les au collecteur et au verre.
- Ouvrez les vannes 1 et 6 avec le logiciel de panneau d’acquisition dedonnées (voir tableau des matériaux) en vérifiant le bouton '1+6' (Figure 6A) pour remplir le verre avec les solutions relaxantes (pCa 9.0) et activantes (4.5) et fermer les vannes lorsque le verre est rempli (Figure 6B).
2. Montage d’un myofibril
- Enrober une lame de microscope de poly-HEMA pour empêcher les myofibrils de coller au verre.
- Préparer l’homogénéiseur (voir tableau des matériaux)pour l’homogénéisation des tissus. Nettoyez la tige de rotor interne avec du papier de soie propre, assemblez l’homogénéisant, et tournez 1x pour 15 s dans l’alcool et trois fois pour 15 s chacun dans l’eau ultrapure. Prériser l’homogénéisant dans une solution relaxante 1 x pour 15 s sur glace.
- Placez la tige d’homogénéisation dans le tube contenant le tissu musculaire tel que décrit à l’étape 1.4 et, tout en gardant le tube sur la glace, faire tourner le rotor pendant 15 s à la vitesse 5 pour déchirer le tissu musculaire et obtenir une suspension myofibril.
- Pipette ~50 μL de la suspension myofibril et ~250 μL de la solution de détente sur la lame de microscope recouverte de poly-HEMA dans le bain de tissu. Cela formera une goutte liquide. Couvrir le bain d’un couvercle pour se protéger de la poussière et attendre 5 à 10 min pour permettre aux myofibrils de couler au fond.
NOTE: Le rapport entre la suspension et la solution de détente dépend de la qualité de l’isolement, par conséquent, ajuster en conséquence. Par exemple, si le rendement du myofibril est faible et que peu de myofibrils appropriés sont présents dans la suspension, ajoutez plus de suspension myofibril et diluez avec une solution moins relaxante (p. ex., 75 μL de suspension myofibril et 225 μL de solution relaxante). Le tissu musculaire cardiaque et squelettique est facile à reconnaître en raison de son modèle de striation. En utilisant un objectif 10x ou 40x, ce modèle est également visible dans un seul myofibril. Dans le cas où d’autres tissus sont présents dans la suspension, les myofibrils peuvent être sélectionnés visuellement. On peut sauter l’attente de 5 à 10 minutes. Cependant, cela augmente la difficulté de coller un myofibril. - Enrober les aiguilles de montage de colle (shellac + éthanol; 120 mg shellac dans 2 mL d’éthanol à 70 %). Pour ce faire, chauffer la colle à 65 °C pour 30–60 s et la pipette ~6 μL sur une nouvelle lame de verre non enduite. Tremper la pointe de chaque aiguille de montage dans la colle et répéter jusqu’à ce qu’une couche de colle soit visible. Déplacez la sonde et le piezo verticalement avec les micromanipulateurs pour faire de la place pour placer le bain de tissu sur le stade du microscope. Retirez la lame en verre contenant la colle.
- Montage des myofibrils
- Placez le bain de tissu avec la lame de microscope enduite de poly-HEMA contenant la suspension de myofibril sur le stade de microscope. Utilisez la scène pour trouver un myofibril approprié avec l’objectif 40x. Si nécessaire, déplacez et faites pivoter le bain de tissu pour déplacer le myofibril à une position supportable.
REMARQUE : Recherchez les myofibrils avec un motif de strilation visible d’environ 30 μm de long. Comme décrit en détail dans les étapes 3.1 et 3.2.1, il est possible de vérifier la longueur et la longueur du sarcomère avant de coller le myofibril. Ne collez pas les myofibrils déchirés, car ceux-ci sont susceptibles de se briser pendant la contraction. - Faites glisser la chambre d’écoulement en place directement au-dessus de la goutte liquide contenant les myofibrils dans le bain de tissu (pipetted sur la diapositive à l’étape 2.4) et l’abaisser. Arrêtez-vous avant qu’il n’atteigne la goutte de liquide.
- Baisser l’aiguille de montage piezo et appuyez-le sur l’extrémité inférieure du myofibril. Soulevez-le légèrement pour vérifier si le myofibril est fixé à l’aiguille.
- Abaissez la chambre d’écoulement assez loin pour que l’aiguille de montage de la sonde atteigne le fond sans que la sonde ne touche la chambre d’écoulement.
- Appuyez sur l’aiguille de montage de la sonde sur l’extrémité supérieure du myofibril. Soulevez-le légèrement pour vérifier si le myofibril est fixé à l’aiguille.
- Soulevez le myofibril du fond du bain autant que possible sans perdre la capacité de se concentrer sans que l’objectif touche le fond du verre.
- Placez le bain de tissu avec la lame de microscope enduite de poly-HEMA contenant la suspension de myofibril sur le stade de microscope. Utilisez la scène pour trouver un myofibril approprié avec l’objectif 40x. Si nécessaire, déplacez et faites pivoter le bain de tissu pour déplacer le myofibril à une position supportable.
3. Initialisation de l’expérience
- Utilisez les micromanipulateurs, la caméra et le logiciel de contrôleur système (Figure 7A, voir Tableau des matériaux) pour mesurer la longueur du sarcomere. Déplacez la sonde piézo et/ou la sonde de force pour définir la longueur initiale du sarcomère du myofibril à 2,5 μm.
REMARQUE : Une longueur de sarcomère de 2,5 μm assure un chevauchement optimal entre les têtes de myosine et l’actine. - À l’aide de la fonction de navire du logiciel de contrôleur système, mesurer la longueur et la largeur du myofibril (figure 7B,C).
REMARQUE : Lors de la rotation de la caméra, elle peut s’incliner horizontalement et/ou verticalement. Pour vérifier l’alignement de la caméra, un niveau d’esprit peut être utilisé pour vérifier que la caméra est tournée et non inclinée.- Placez le myofibril au centre de l’image vidéo à l’aide de l’étape du microscope.
- Dessinez un carré d’un côté du myofibril à l’autre. Pour la longueur, assurez-vous d’inclure le bord sombre des gouttelettes de colle (Figure 2A) dans le carré parce que le traitement de l’image est basé sur le contraste.
- Commencez à enregistrer les données dans le logiciel du contrôleur système (voir Tableau des matériaux)en appuyant sur 'Démarrer' et après 5 s pause de l’enregistrement des données logicielles du contrôleur système en appuyant sur le bouton 'Pause'. La longueur est maintenant enregistrée dans les données.
- Pour la largeur d’abord tourner la caméra 90° (voir Tableau des matériaux) et ensuite utiliser le contraste du bord du myofibril lui-même.
- Commencez à enregistrer les données dans le logiciel du contrôleur système (voir Tableau des matériaux)en appuyant sur 'Démarrer' et après 5 s pause de l’enregistrement des données logicielles du contrôleur système en appuyant sur le bouton «Pause ». La largeur est maintenant enregistrée dans les données.
- Si la tension active du myofibril doit être déterminée, la configuration de perfusion doit être utilisée. Si c’est le cas, continuez à l’étape 3.4. Si seule la tension passive est déterminée, sautez les étapes 3.4–4.1.3.7 et continuez à l’étape 4.2.
- Positionnez et initialisez la configuration de la perfusion.
REMARQUE : Ceci n’est nécessaire que pour la génération de la force active. Continuez à l’étape 4.2 lorsque vous effectuez des expériences de tension passive.- Réglez la position du moteur à pas rapide à 4 V (figure 5B).
- Faites glisser le support de perfusion sur la table pour aligner le coin inférieur gauche du support avec la bande sur la table.
REMARQUE : Veillez à ne pas heurter la sonde de force ou le moteur piezo. - Utilisez le manipulateur pour positionner grossièrement le verre à l’œil.
- Regardez à travers l’oculaire et déplacez soigneusement le verre vers le myofibril à l’aide du manipulateur.
- Alignez le canal supérieur du verre avec le myofibril à l’aide du manipulateur et vérifiez la position en effectuant une étape rapide (les paramètres du générateur de signal peuvent être trouvésdans le tableau 1) avec le logiciel de contrôleur système (Figure 2B–C, voir Tableau des matériaux ).
REMARQUE : Assurez-vous que le canal inférieur sera aligné avec le myofibril pendant la phase d’activation de l’étape rapide (Figure 2B–C).
- Activez le flux d’arrière-plan de Rx (Figure 4A) pour créer un flux d’arrière-plan laminaire dans la chambre d’écoulement.
REMARQUE : Le flux d’arrière-plan est nécessaire pour empêcher le flux turbulent en raison du flux de solution de pCa du verre de 10.- Allumez l’entrée de la chambre d’écoulement avec un levier de valve Luer.
- Envoyer les paramètres suivants à la pompe de sortie pour commencer à vider la chambre d’écoulement et éviter le débordement de la chambred’écoulement( Figure 9 ) : Valve = Vanne de bain (2); Microstep mode = Micro; Cible piston = 48 000; Vitesse du piston = 38–40 (arbitraire).
REMARQUE : Assurez-vous que le niveau de liquide est stable en tout temps. Le myofibril ne doit pas s’épuiser et le porte-à-faux non plus. Il est préférable d’avoir un peu de débordement que trop peu de débit.
- Envoyer les paramètres suivants à la pompe de sortie pour commencer à vider la chambre d’écoulement et éviter le débordement de la chambred’écoulement( Figure 9 ) : Valve = Vanne de bain (2); Microstep mode = Micro; Cible piston = 48 000; Vitesse du piston = 38–40 (arbitraire).
- Allumez l’entrée de la chambre d’écoulement avec un levier de valve Luer.
- Pour régler la température à une valeur souhaitée avec le contrôleur de température thermoélectrique (Figure 8, voir Tableau des matériaux),entrez la température souhaitée et appuyez sur 'Démarrer'. Attendez que la température désirée soit atteinte en vérifiant le graphique dans le logiciel de contrôleur de température thermoélectrique et continuez.
REMARQUE : Lors de l’exécution d’expériences à température ambiante, le contrôleur de température thermoélectrique n’a pas besoin d’être utilisé.
4. Protocole(s) expérimental(s)
- Décidez quels protocoles de force active doivent être exécutés.
REMARQUE : Selon les données nécessaires à l’étude, plusieurs types d’expériences de force active peuvent être effectués : étape 4.1.1, mesure de la force maximale à la saturation [Ca2+]; étape 4.1.2, obtenir une courbe Force-pCa pour déterminer la sensibilité au calcium en plus de l’étape 4.1.1; étape 4.1.3, déterminer le taux de réaménagement de la tension en effectuant un protocole de raccourcissement-restretch en plus de l’étape 4.1.1 ou 4.1.2.- Mesurer la force active maximale.
- Commencez à enregistrer les données dans le logiciel du contrôleur système (voir Tableau des matériaux)en appuyant sur 'Démarrer'.
- Ouvrez les vannes 1 et 6 avec le panneau d’acquisition dedonnées (voir Tableau des matériaux) en vérifiant le bouton '1+6' pour démarrer le flux de verre de la solution de détente et la solution d’activation à travers le verre de l'1/6A .Figure 6A
- Réinitialisez la portée de l’interféromètre de sorte que la force de base est de 0 V en sélectionnant et en appuyant sur laplage de réinitialisationsur l’interféromètre (voir tableau des matériaux).
- Lorsque la trace de force est stable, effectuez l’étape rapide du verre (taille de l’étape = 100 μm).
Les paramètres du générateur de signaux se trouvent dans le tableau 1 (figure 5C). Une trace d’activation-relaxation similaire à la figure 4D sera enregistrée et visible dans le logiciel du contrôleur système. - Pause de l’enregistrement des données logicielles du contrôleur système en appuyant sur le boutonPause.
- Si aucune activation ne doit être effectuée, fermez les vannes 1 et 6 pour arrêter le flux de verre en décochant le bouton '1+6' (Figure 6B),arrêtez la pompe à seringues (Figure 9, voir Tableau des matériaux) en appuyant sur 'Terminate', et arrêtez le flux d’arrière-plan en fermant la valve Luer.
- Courbe Force-pCa
REMARQUE : Ceci est similaire à l’étape 4.1.1 pour obtenir la force active maximale, mais avec plusieurs activations utilisant différentes solutions de pca.- Commencez à enregistrer les données dans le logiciel du contrôleur système en appuyant sur 'Démarrer'.
- Ouvrez les vannes 1 et 2 avec le logiciel de panneau d’acquisition de données pour démarrer le flux de solution de détente et pCa 6.2 à travers le verre.
- Réinitialiser la plage de l’interféromètre de sorte que la force de base est de 0 V en sélectionnant et en appuyant sur 'Reset Range' sur l’interféromètre.
- Lorsque la trace de force est stable, effectuez l’étape rapide du verre (taille de l’étape = 100 μm).
Les paramètres du générateur de signaux se trouvent dans le tableau 1. - Pause le logiciel du contrôleur système en appuyant sur le boutonPause.
- Répétez les étapes 4.1.2.1–4.1.2.4 pour les vannes 1 et 3 (pCa 5.8), les vannes 1 et 4 (pCa 5.6), les vannes 1 et 5 (pCa 5.4) et les vannes 1 et 6 (pCa 4.5).
- Si aucune activation ne doit être effectuée, fermez les vannes 1 et 6 pour arrêter le flux de verre en décochant le bouton '1+6' (Figure 6A),arrêtez la pompe à seringues (Figure 9) en appuyant sur 'Termin', et arrêtez le flux de fond en fermant la valve Luer.
- Mesure du taux de réaménagementité (kTR).
REMARQUE : Ceci est similaire à l’étape 4.1.1 pour la force active maximale, mais avec quelques modifications et étapes supplémentaires.- Calculer le mouvement piézo nécessaire pour relâcher le myofibril 15% et entrez cette valeur dans le générateur de signal (Figure 5D, Tableau 1).
- Commencez à enregistrer les données dans le logiciel du contrôleur système en appuyant sur 'Start'.
- Ouvrez les vannes 1 et 6 avec le panneau d’acquisition de données (Figure 6A) logiciel pour démarrer le flux de la solution de détente et pCa 4.5 à travers le verre.
- Réinitialiser la plage de l’interféromètre de sorte que la force de base est de 0 V en sélectionnant et en appuyant sur 'Reset Range' sur l’interféromètre.
- Lorsque la trace de force est stable, effectuez l’étape rapide du verre (taille de l’étape = 100 μm).
Les paramètres du générateur de signaux se trouvent dans le tableau 1. - Lorsque le plateau de force est atteint, effectuer le shortening-restretch avec le piezo.
Les paramètres du générateur de signaux se trouvent dans (Figure 5D, Tableau 1). Une trace d’activation-relaxation similaire à la figure 4E sera enregistrée et visible dans le logiciel du contrôleur système.
REMARQUE : Un protocole personnalisé peut être conçu pour automatiser les étapes ci-dessus. - Pause le logiciel du contrôleur système en appuyant sur le boutonPause.
- Si il n’y a plus d’activations, fermez les vannes 1 et 6 pour arrêter le flux de verre en décochant le bouton '1+6' (Figure 6B),arrêtez la pompe à seringues (Figure 9) en appuyant sur 'Terminate', et arrêtez le flux de fond en fermant la vanne Luer.
- Mesurer la force active maximale.
- Effectuez des mesures de force passive.
- Effectuez un étirement continu.
- Calculer le mouvement piézo nécessaire pour étirer le myofibril et entrer cette valeur dans le générateur de signal (Tableau 1).
REMARQUE : Il s’agit de paramètres par exemple. Calculer la quantité d’étirement et le temps d’étirement par rapport à la longueur du sarcomère. Ces réglages sont nécessaires pour s’assurer que la vitesse d’étirement par sarcomere reste égale à travers les myofibrils. - Commencez à enregistrer les données dans le logiciel du contrôleur système en appuyant sur 'Start'.
- Réinitialiser la plage de l’interféromètre de sorte que la force de base est de 0 V en sélectionnant et en appuyant sur 'Reset Range' sur l’interféromètre.
- Effectuez un étirement continu avec le générateur de signal dans le logiciel du contrôleur système pour faire fonctionner le piézo. Exemple de paramètres du générateur de signaux dans le tableau 1.
- Raccourcissez le myofibril pour laisser tomber le pied avec le piezo une fois l’étirement terminé (tableau 1).
- Calculer le mouvement piézo nécessaire pour étirer le myofibril et entrer cette valeur dans le générateur de signal (Tableau 1).
- Effectuez un étirement dans le sens des étapes.
- Commencez à enregistrer les données dans le logiciel du contrôleur système en appuyant sur 'Start'.
- Réinitialiser la plage de l’interféromètre de sorte que la force de base est de 0 V en sélectionnant et en appuyant sur 'Reset Range' sur l’interféromètre.
- Effectuez un étirement dans le sens des étapes avec le générateur de signal dans le logiciel de contrôleur système pour faire fonctionner le piezo. Exemple de paramètres du générateur de signaux dans le tableau 1 (figure 5E).
- Raccourcir le myofibril pour mour la longueur avec le piézo après l’étirement est terminé. Exemple de paramètres du générateur de signaux dans le tableau 1.
- Effectuez un étirement continu.
- Pause le logiciel du contrôleur système en appuyant sur le boutonPause.
- Arrêtez l’enregistrement des données en appuyant sur le bouton «Stop» dans le logiciel du contrôleur système.
- Enregistrez les données en appuyant sur 'File' et 'Save Data' dans le logiciel du contrôleur système.
5. Nettoyage
- Retirez le myofibril mesuré et préparez-vous pour le prochain myofibril.
- Pour ce faire, arrachez soigneusement le myofibril tout en regardant à travers l’oculaire avec l’objectif 40x.
- Déplacez la sonde de force et le piezo. Remontez le verre jusqu’à la droite et vers l’arrière. Puis déplacez-vous vers le haut et glissez loin de la chambre d’écoulement. Retirer le bain de tissu.
- Pour nettoyer l’aiguille de montage, mettant en évidence l’utilisation du 10x et de l’oculaire. Tremper la brosse dans l’éthanol et badigeonner soigneusement et retirer la colle de l’aiguille.
REMARQUE : Gardez à l’esprit qu’il faudra peut-être un certain temps avant que la colle ne se détache. - Rincer la chambre d’écoulement et le bain de tissu avec de l’eau ultrapure.
- Placer la sonde dans une petite boîte de Pétri remplie d’eau ultrapure. Assurez-vous que la sonde est complètement submersée.
- Lorsque les expériences sont terminées, nettoyez la configuration comme ci-dessus et effectuez les étapes supplémentaires suivantes.
- Vider le tube du bain d’écoulement. Envoyer les paramètres à la pompe à seringue de sortie (voir tableau des matériaux, figure 9). Valve = Valve de bain (2); Microstep mode = Normal; Cible piston = 0; Vitesse du piston = 30.
REMARQUE : Terminez la commande lorsque le tube est vide. - Initialiser la pompe plusieurs fois (Figure 9B).
- Égoutter les seringues. Pour ce faire, fermez toutes les valves Luer, ouvrez toutes les valves, retirez le tube de l’aiguille de la seringue, maintenez le tube de pCa spécifique sous l’aiguille et ouvrez la valve Luer. Utilisez les prises de pression pour accélérer le processus.
- Rattacher le tube à l’aiguille de la seringue. Remplissez les seringues d’environ 5 mL d’eau ultrapure. Placez une tasse sous le verre. Ouvrez toutes les vannes et ouvrez la vanne de pression pour rincer le système.
- Arrêtez le système. Éteignez le bloc d’alimentation du pc, de l’interféromètre et du contrôleur piezo.
- Vider le tube du bain d’écoulement. Envoyer les paramètres à la pompe à seringue de sortie (voir tableau des matériaux, figure 9). Valve = Valve de bain (2); Microstep mode = Normal; Cible piston = 0; Vitesse du piston = 30.
6. Analyse des données
- Exporter des traces de données du logiciel de contrôleur système (voir Tableau des matériaux)vers un logiciel de feuille de calcul ou un presse-papiers en ouvrant le fichier de données et en sélectionnant le segment souhaité. Les traces indiquées seront exportées (p. ex., force brute, longueur sarcomère et position de piezo).
- Effectuer l’analyse avec le logiciel de choix (p. ex., MATLAB).
Résultats
Les traces de données ont été enregistrées et ouvertes avec le logiciel de contrôleur système (voir tableau des matériaux). Des traces complètes ou des segments sélectionnés ont été exportés vers le presse-papiers ou le fichier texte pour une analyse plus approfondie avec un logiciel souhaité. Les valves pour contrôler le flux des différentes solutions ont été commutées avec un logiciel personnalisé ou manuellement. Un script MATLAB personnalisé a été utilisé pour analyser les taux d’activation, de réaménagement des tensions et de relaxation. La force active maximale et le pic et la force de plateau des expériences de force passive ont été prises directement à partir de la trace de force logicielle de contrôleur de système. Après le montage d’un myofibril (Figure 2), le protocole souhaité a été sélectionné.
Force active maximale et calcium- sensibilité de la force dans lesmyofibrils isolés des biopsies de la souris et des muscles squelettiques humains
Dans la figure 4A, la configuration expérimentale utilisée pour les expériences de force active est représentée schématiquement. Des traces de force d’une expérience de force active avec un myofibril isolé du muscle humain sain de quadriceps sont montrées. Le myofibril a été activé 5 fois avec des solutions avec des pCa variables (pCa 6.2, 5.8, 5.6, 5.4, 4.5; données indiquées dans la figure 4B). La force maximale moyenne de tous les myofibrils dans cette expérience était de ~123 mN/mm2. Une courbe force-pca a été construite à partir des forces de plateau atteintes lors de chaque activation dans chacune des cinq solutions de calcium. Les résultats sont indiqués à la figure 4C. De cette courbe, le pCa à 50% de la production de force maximale (pCa50) a été calculé. Dans ce myofibril, le pCa50 était de 5,75.
En outre, un ou plusieurs composés pourraient être ajoutés à la solution perfusée pour mesurer son effet sur la force produite par le myofibril. Dans la figure 4D, l’effet du sulfonamide N-benzyl-p-toluène (BTS), un inhibiteur de la chaîne lourde ii (MHCII) de muscle à contraction rapide (type II), est illustré. 19 Un myofibril a été activé d’abord avec une solution pCa 5.6, puis avec une solution pCa 5.6 + BTS. Au cours de la deuxième activation moins de force a été produite, ce qui indique qu’il s’agissait d’un myofibril qui contenait MHCII. Il existe des mutations dans les protéines qui sont présents exclusivement dans des types de muscle spécifiques, et donc seulement affecter les myofibrils de ce type de muscle spécifique. Dans ce cas, « typ » les myofibrils est important pour discerner l’effet de mutation sur les différents types de muscles. En outre, cet exemple illustre la possibilité de tester l’efficacité des composés thérapeutiques dans les myofibrils.
La figure 4E montre une trace de force active d’un seul myofibril isolé du tissu musculaire squelettique du soleus de souris. Le myofibril a été monté dans la configuration et perfusé avec la solution relaxante (pCa 9.0), suivie par la perfusion avec la solution d’activation (pCa 4.5, ~0.032 mM de calcium). Nous avons simultanément enregistré la force et la longueur du sarcomere. Il s’agissait d’une contraction isométrique proche, car la déviation du porte-à-faux était de 0,5 μm, soit environ 1 % de la longueur molle du myofibril (~50 μm). À la figure 4E, un protocole de raccourcissement rapide a été effectué pendant la contraction active afin d’évaluer le taux de réaménagement de la tension (kTR, ligne en pointillé jaune). Le kTR est une mesure de la cinétique du cyclisme cross-bridge. En outre, les courbes d’activation et de relaxation ont été ajustées pour déterminer le taux d’activation (kACT,ligne en pointillés rouges) et de relaxation (kREL, ligne pointillée verte), respectivement. La figure 4 montre une vue plus détaillée de la phase de relaxation mise en évidence à la figure 4F. Deux phases sont devenues évidentes : 1) une première phase lente de relaxation (dominée par le détachement de cross-bridge) et 2) une phase rapide de relaxation (dominée par le détachement de cross-bridge et la dissociation du calcium)20.
Force passive dans les myofibrils isolés d’une biopsie du muscle squelettique humain
La figure 10 montre une trace d’une expérience de force passive avec un myofibril isolé du tissu musculaire humain sain de diaphragme. Le premier protocole comportait un ou plusieurs étirements passifs pour déterminer les propriétés viscoélastiques des sarcomeres. La figure 10 montre une trace de force d’un tronçon continu d’un myofibril (étirement de la longueur sarcomère 2,2–3,0 μm). Pendant l’étirement, les myofibrils présentaient des caractéristiques visqueuses et élastiques. Cela ressort de la courbe indiquée à la figure 10A. Le pic aigu représente les deux caractéristiques, alors que la force du plateau est une mesure d’élasticité. La viscosité résiste à la tension linéaire. Ainsi, la force a chuté après que la souche a été enlevée. La figure 10B met en évidence l’étirement lui-même et illustre le rapport signal/bruit élevé. Notez que les traces de force ne sont pas filtrées.

Figure 1 : Représentation schématique et microscopie électronique images d’un muscle squelettique et de sa morphologie. (A) Montre la structure du muscle squelettique et (B) montre la structure du sarcomere, la plus petite unité contractile. Ces images schématiques sont adaptées de Servier Medical Art. (C) montre une image d’une seule fibre musculaire et (D) montre une image de microscopie électronique d’une fibre musculaire révélant des dommages myofibrillaires ainsi que préservés ultrastructure myofibrillaire. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2 : Images montrant un myofibril monté, un alignement en verre et une aiguille de montage piézo. (A) Un myofibril monté à la longueur de mou entre les aiguilles de fibre de verre enduites de shellac comme vu à travers un objectif 40x. (B) Images de la position du verre de l'10x par rapport au myofibril (mis en évidence avec les ovales blancs) vu à travers un objectif 10x. (Haut) Aligné sur le canal supérieur (solution relaxante, pCa 9.0); (En bas) Aligné sur le canal inférieur (solution d’activation, pCa 4.5) pour perfuser le myofibril avec du calcium et induire la contraction. (C) Représentations schématiques de la position du verre de l’Es par rapport au myofibril. (Haut) Aligné avec le canal supérieur (solution relaxante, pCa 9.0); (En bas) Aligné avec le canal inférieur (solution d’activation, pCa 4.5) pour perfuser le myofibril avec du calcium et induire la contraction. (D) Aiguille de montage attachée à la tige de carbone du support de piezo. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Représentation schématique de la configuration et de la partie de fin de la chambre de flux tissulaire. En bleu foncé, la chambre d’écoulement des tissus en aluminium, et en blanc la cavité dans laquelle la sonde de force et le verre sont montrés en position; (Centre) Myofibril attaché entre deux aiguilles de montage en fibre de verre attachées à la sonde de force et moteur de longueur de piezo. Le verre est aligné avec le myofibril. Le verre peut se déplacer de haut en bas pour exposer le myofibril à la solution de calcium. (Droite) Plan rapproché de la sonde de force en porte-à-faux. La taille de la cavité (ou la cavité Fabry-Pérot, d); les interfaces de réflexion A, B et C; et un exemple d’onde lumineuse émise par le laser (rouge). Le porte-à-faux est monté sur l’épaule de la ferrule. La fibre qui transporte le laser de l’interféromètre sort de la ferrule à la pointe du porte-à-faux. Une fibre de montage en verre est fixée sur le porte-à-faux à l’aide de cire. (En haut à gauche) L’interféromètre analyse le signal interféromètre transmis au logiciel du contrôleur système. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 4 : Configuration expérimentale et données provenant d’expériences de tension active. (A) Représentation schématique de la configuration de perfusion et des solutions utilisées. Notez que les premiers et derniers tubes (bleu clair) contiennent une solution sans calcium (c.-à-d. une solution relaxante). (B) Exemple de traces de force d’une expérience de tension active avec un myofibril isolé du tissu musculaire squelettique humain montrant cinq activations de la solution relaxante (pCa 9.0) à des solutions d’activation multiples (pCa 6.2 – 4.5). CC) Une courbe force-calcium; les niveaux de force sur les plateaux du panneau (B) ont été normalisés et tracés par rapport à leurs niveaux respectifs de calcium. (D) Exemple trace de force d’un type II (contraction rapide) myofibril isolé du muscle squelettique humain activé avec la solution pCa 5.6 (bleu) et par la suite avec pCa 5.6 + BTS (un inhibiteur spécifique de type II cross-bridge, rouge). (E) Exemple de trace de données d’une expérience de tension active avec des myofibrils isolés du tissu musculaire squelettique de soleus de souris avec un protocole de raccourcissement-restretch rapide pendant l’activation pour déterminer le taux de réaménagement de tension (kTR, ligne en pointillé jaune). En outre, la courbe d’activation et de relaxation ont été installées pour déterminer le taux d’activation (kACT,ligne en pointillés rouges) et de relaxation (kREL, ligne pointillée verte), respectivement. (F) Un zoom de la phase de relaxation (en haut à gauche), mis en évidence dans (E). Le signal moteur à pas rapide (en bas à gauche) indiquait le moment où la solution passait d’une solution d’activation (pCa 4.5) à une solution relaxante (pCa 9.0). La phase de relaxation se composait d’une phase linéaire lente (en haut à droite) et d’une phase exponentielle et rapide (en bas à droite). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Exemple de paramètre pour le générateur de signal dans le logiciel de contrôle du système. (voir tableau des matériaux). 1) Indique le bouton pour exécuter les commandes entrées dans le générateur de signal. (A) Mise en place du moteur de longueur piezo. (B) Mise en place du moteur à pas rapide. (C) Effectuer une étape rapide pour activer un myofibril pour une durée de 5 s. (D) Effectuer un raccourcissement rapide-restretch d’un myofibril pour déterminer le kTR. (E) Effectuer un tronçon étape d’un myofibril pour déterminer les propriétés viscoélastiques. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Figure 6 : Logiciel de contrôleur de valve tel qu’il est utilisé sur le PC. (A) Le bouton utilisé pour ouvrir les vannes 1 (Rx) et 6 (Act). (B) État des boutons lorsque toutes les vannes sont fermées. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
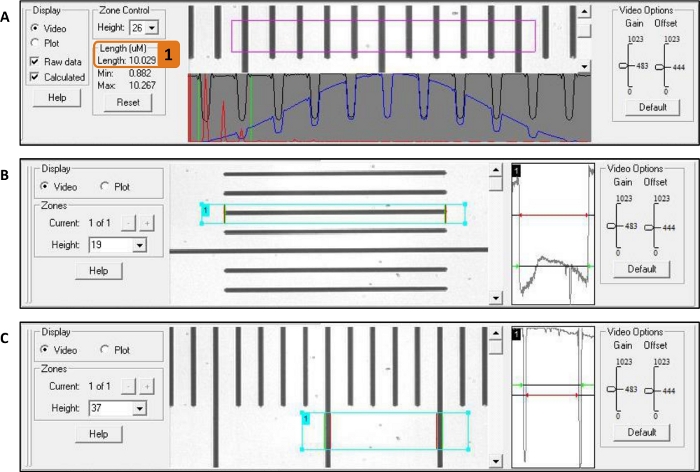
Figure 7 : Mesure de la longueur du sarcomère, de la longueur du myofibril et de la largeur du myofibril avec le logiciel de contrôleur système. Une règle est utilisée comme exemple. (A) Mesure de la longueur du sarcomère : la boîte violette est placée autour du myofibril et la longueur du sarcomère est indiquée dans (1). (B) Mesure de la longueur : La boîte de cyan est placée du début à la fin du myofibril. (C) Largeur de mesure : Après avoir tourné la caméra à 90°, la boîte cyan est placée d’un côté du myofibril à l’autre. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 8 : Logiciel de contrôleur de température thermoélectrique. (A) Établir la connexion avec le contrôleur de température thermoélectrique. (B) Augmentez les paramètres de température. (C) Réglez la température désirée, dans ce cas: 15 °C. (D) Allumez le contrôleur de température thermoélectrique et envoyez la tension au module de refroidisseur thermoélectrique Peltier. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 9 : Paramètres de la pompe de sortie de seringue. (A) Connexion ouverte à la pompe en appuyant (1). (B) Démarrez la pompe avec des réglages prédéfinis en appuyant sur (2). (C) Démarrer le pompage de sortie en définissant les «commandes de valve» à ' BathValve' (2) et en entrant les paramètres de jeude commande' comme indiqué. Exécutez la commande en appuyant sur (3). Les commandes peuvent être terminées en appuyant sur (4). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
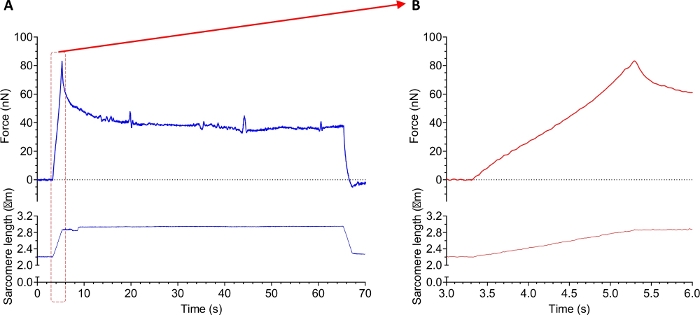
Figure 10 : Exemple de trace de données d’une expérience de tension passive avec des myofibrils isolés du tissu musculaire squelettique humain. (A) Enregistrement de la force (Supérieure) et de la longueur sarcomère (Inférieure) au cours d’un protocole d’étirement et de libération. (B) Zoom de (A) montrant la force (supérieure) et la longueur sarcomère pendant la phase d’étirement du myofibril. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
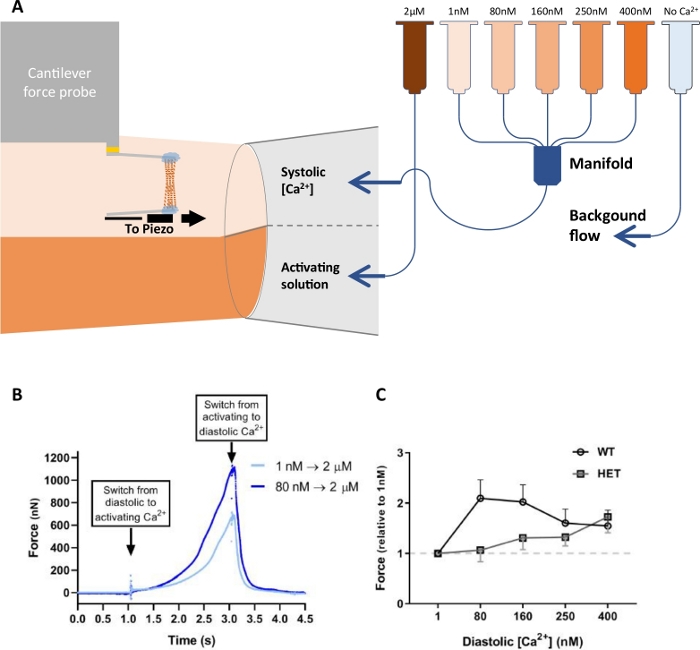
Figure 11 : Configuration expérimentale et données provenant d’expériences de préactivation du calcium cardiomyocyte. (A) Représentation schématique de la configuration de perfusion. Notez que le dernier tube (bleu clair) contient une solution sans calcium (solution relaxante). (B) Courbes superposées d’activation d’un cardiomyocyte sans préactivation de calcium (bleu foncé), avec des concentrations de calcium de 1 nM et 80 nM, respectivement. (C) Comparaison de la préactivation de calcium dans le type sauvage (WT) et les cardiomyocytes de RBM20 (HET) d’hétérozygotes (HET) isolés du ventricule gauche de rat. Ce chiffre a été modifié à partir de Najafi et al.21. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
| Étape | Appareil | Description | Forme | Initiale | ||||||||
| 1.7.1. | Piézo | Initialisation tension passive | Fixe | 51,6 μm | ||||||||
| 1.7.2. | Piézo | Initialisation tension active | Fixe | 0 μm | ||||||||
| Étape | Appareil | Description | Forme | Initiale | Retard | Représentants | Niveau | Retard | Niveau | Retard | ||
| 3.4.4. / 4.1.1.4. / 4.1.2.4. | Étape rapide | Essai de la position du verre / Activation du myofibril | Impulsion | 4 V | 1 s | 1 x | 3 V | 5 s | 4 V | 1 s | ||
| 4.1.3.4. | Étape rapide | Activation du myofibril (inclure kTR) | Impulsion | 4 V | 1 s | 1 x | 3 V | Les années 10 | 4 V | 1 s | ||
| Étape | Appareil | Description | Forme | Initiale | Retard | Représentants | Niveau de rampe | Durée de la rampe | Retard | Niveau de rampe | Durée de la rampe | Retard |
| 4.1.3.1. / 4.1.3.6. | Piézo | Shortening-Restretch pour kTR | Trapèze | 0 μm | 0,5 s | 1 x | 0 + 0,15 * L0 = __ μm | 0,01 s | 0,01 s | 0 μm | 0,01 s | 1 s |
| 4.2.1.1. / 4.2.1.4. | Piézo | Continue l’étirement | Trapèze | 51,6 μm | 2 s | 1 x | 51,6 - 0,30 * L0 = __ μm | 2 s | 0 s | 51,6 - 0,30 * L0 = __ μm | 0 s | 1 s |
| 4.2.1.4. | Piézo | Retourner le myofibril à la longueur mou | Trapèze | 1,6 μm | 2 s | 1 x | 51,6 μm | 5 s | 0 s | 51,6 μm | 0 s | 1 s |
| 4.2.2.3. | Piézo | Étirement en marche | Trapèze | 51,6 μm | 2 s | 10 x | 51,6 à 5 μm | 0,5 s | 10 s | 51,6 à 5 μm | 0 s | 0 s |
| 4.2.3. | Piézo | Retourner le myofibril à la longueur mou | Trapèze | 1,6 μm | 2 s | 1 x | 51,6 μm | 5 s | 0 s | 51,6 μm | 0 s | 0 s |
Tableau 1 : Tableau décrivant les différents paramètres du générateur de signal utilisés dans le logiciel du contrôleur système pour faire fonctionner le moteur de longueur piezo et le moteur à étapes rapides.
Discussion
Décrit est un protocole pour évaluer la fonction contractile des myofibrils isolés des tissus humains ou animaux de muscle squelettique. La résolution de force de cette configuration a déjà été décrite par Chavan et al.12. En bref, il est déterminé par les fluctuations aléatoires de la longueur de la cavité Fabry-Pérot formée entre la fibre de détection et le porte-à-faux, qui produisent la partie dominante du bruit à la sortie de la lecture (exprimée en V) qui, multipliée par la sensibilité de déviation (exprimée en m/V) et par la constante de ressort du cantilever (exprimé en N/m), fournit le bruit de force. Pour notre configuration, le bruit de la racine moyenne carrée (rms) dans l’air à la sortie de la lecture, échantillonné à un 1000 points de données / s (échantillon / s), est d’environ 2 mV. Pour une mesure typique du myofibril, une sonde ferrule-dessus est utilisée avec une constante de ressort d’environ 0,7 N/m (sensibilité de déviation de 300 nm/V). Cette valeur rms correspond à une résolution de déviation en porte-à-faux de 0,6 nm, ce qui se traduit par une sensibilité de force de ~0,37 nN. La sonde de force est calibrée en poussant la pointe de l’aiguille de montage contre une balance tout en gardant la flexion du porte-à-faux égale à un multiple de la longueur d’onde du laser de lecture13. Cette méthode d’étalonnage comporte à la fois la rigidité du porte-à-faux et de l’aiguille de montage ainsi que les variations possibles dans le couple du porte-à-faux et de l’aiguille de montage en raison de la vitesse et de l’ampleur de la contraction du myofibril. Actuellement, une configuration pour évaluer la contractilité de myofibril est disponible, qui est basée sur la détection d’un laser dévié du porte-à-faux, c’est-à-dire la déviation optique de faisceau (1.700 A; ~1 nN résolution de force). Ce système a été développé par Labuda et coll. à l’aide d’un périscope optique pour guider une lumière laser vers et loin du porte-à-faux dans les configurations contraignantes11. Dans ce système, un myofibril est monté entre le porte-à-faux de force atomique et une aiguille rigide en verre. Un avantage du système décrit ici est la sensibilité de force plus élevée et le rapport signal-bruit. En outre, dans cette configuration, des cantilevers relativement rigides peuvent être utilisés, ce qui entraîne une petite déviation en porte-à-faux lorsque la force myofibrillaire est appliquée. Ceci est important, car il permet des mesures de force à la longueur presque constante de sarcomere. Enfin, par rapport au système décrit par Labuda et coll., le système utilise ici des méthodes similaires ou identiques pour contrôler la température, pour induire des changements de longueur sur le myofibril, et pour changer les solutions de perfusion à l’aide d’un moteur à vitres et à pas rapide. L’avantage du système décrit par Labuda et coll. est qu’un changement de composition de la solution (entre le porte-à-faux et le périscope optique) n’affecte pas la sortie du signal. Dans le système décrit ici, la composition de la solution entre le porte-à-faux et la fibre optique doit rester constante. La solution à cette limitation est décrite plus en détail ci-dessous.
Optimisation
La sonde de force optique en combinaison avec le système de perfusion à étapes rapides a conduit à des complications. La différence dans les propriétés optiques entre les solutions Ca2+ à faible et à forte concentration interfère avec les mesures de force. Pour prévenir le retour en arrière de la solution à haute teneur en calcium, une chambre d’écoulement personnalisée a été conçue (figure 3). Un flux constant de fond de solution sans calcium est induit de droite à gauche pour maintenir la solution constante entre le haut de la fibre optique et le porte-à-faux (Figure 3D).
Pour contrôler la température, un élément Peltier avec refroidissement liquide est monté sur la chambre d’écoulement. Cette chambre d’écoulement est thermiquement découplée du microscope en la montant sur un adaptateur en plastique. Avec l’élément Peltier, contrôlé par un système TEC, il est possible de contrôler la température de la solution au fil du temps avec une précision de 0,1 °C. La température est surveillée par un capteur de température monté sur la chambre d’écoulement. La stabilité de la température est importante en raison de la nature du transducteur de force. Le porte-à-faux se compose d’une bande de verre recouverte d’or, ce qui en fait effectivement un thermomètre. Ainsi, le porte-à-faux se plie avec des changements de température.
La configuration utilise un système de perfusion à pas rapide (voir Tableau des matériaux)pour contrôler le mouvement du verre. Ce système permet des commutateurs de perfusion dans les 10 ms. La combinaison de la méthode de contrôle de la température et de commutation de solution rend ce système particulièrement approprié pour mesurer la cinétique de la contractilité sarcomère (c.-à-d. les taux de développement de la force, le réaménagement des tensions et la relaxation) dans les myofibrils.
Initialement, l’inconvénient de l’utilisation de l’interférométrie était la petite plage utilisable en raison de la nécessité d’utiliser la partie linéaire de la courbe d’interférence (λ/8, avec λ étant la longueur d’onde du laser). Cependant, les innovations récentes ont éliminé ce besoin en combinant la modulation de longueur d’onde avec un amplificateur de verrouillage. Par conséquent, le système ne se limite pas à une seule partie linéaire de la courbe d’interférence. Cela permet la mesure de la déviation infinie du porte-à-faux14. Ainsi, la gamme de la lecture de déviation en porte-à-faux de ce système est grandement élargie par rapport à l’interférométrie traditionnelle. En outre, les sondes de force décrites sont faciles à remplacer et il ya beaucoup de cantilevers disponibles, avec des rigidités allant de 0,5 N/m à >20 N/m. Par conséquent, il est possible de changer rapidement entre les cantilevers et de sélectionner la rigidité la plus appropriée pour l’expérience menée.
Défis
Le système actuel est un prototype basé sur un système de mesure cardiomyocyte (voir tableau des matériaux). Plusieurs composants peuvent être améliorés pour fournir une meilleure expérience utilisateur et des données de meilleure qualité. Tout d’abord, en raison des modules complémentaires au système, les vibrations et la résonance peuvent être un problème qui ajoutera du bruit au signal. En outre, le support en verre et la méthode de fixation du moteur à pas rapide pourraient être améliorés pour le rendre moins sujet aux vibrations.
Deuxièmement, il est souhaitable de remplacer le moteur à étapes rapides par un actionneur de longueur piézo pour augmenter la vitesse de commutation de la solution et pour obtenir un mouvement plus cohérent.
Troisièmement, les solutions de calcium que nous utilisions auparavant pour activer les fibres musculaires striées simples comprenaient de l’acide procionique, mais ces solutions absorbent la lumière proche infrarouge, interférant avec les mesures de force. Le chlorure de calcium a été utilisé pour éliminer le besoin d’acide procionique, ce qui a considérablement réduit cet effet. Ce problème est inhérent à un système basé sur l’interférométrie et non présent lors de l’utilisation de la déviation optique du faisceau.
Quatrièmement, un bain d’écoulement personnalisé a été conçu pour créer un flux laminaire, pour correspondre à l’écoulement du verre. Cela empêche le retour en raison de la turbulence de la solution riche en calcium. Par conséquent, la solution entre la pointe de la fibre optique et le porte-à-faux reste constante. Le couvercle avec les myofibrils peut se déplacer librement sous la chambre d’écoulement et, par conséquent, la sélection des myofibrils appropriés ne se limite pas à la petite zone de la chambre d’écoulement.
Reproductibilité et variabilité
Il existe plusieurs éléments du système et du protocole qui sont importants pour le degré de reproductibilité et la variabilité des données obtenues.
Tout d’abord, la qualité des mesures dépend fortement de la qualité de l’isolement myofibril. Des protocoles identiques donnent différentes qualités et quantités de myofibrils provenant de différentes biopsies. Dans certains cas, les biopsies donnent à peine des myofibrils utilisables ou aucun du tout. Le consensus commun est que les myofibrils endommagés se briseront pendant la contraction et ne sont donc pas pris en compte dans les résultats.
Deuxièmement, il y a une incertitude dans la détermination de la zone transversale du myofibril. En raison de contraintes techniques, il est possible de mesurer la largeur du myofibril dans un seul plan. Par conséquent, pour calculer la zone transversale, nous supposons que la largeur et la profondeur sont égales. Lorsque la force est normalisée à une zone transversale pour calculer la tension active maximale, il faut être conscient de cette hypothèse.
Montage de myofibrils en raison de l’angle de montage myofibril, la position, et l’intégrité de la colle.
Bien que l’angle de montage et la position peuvent être largement contrôlés visuellement, de petites variations entre les myofibrils pourraient être présentes. L’intégrité de la colle n’a pas fait l’objet d’une étude approfondie. Cependant, l’intégrité de la colle peut être vérifiée en surveillant la longueur du sarcomère dans le myofibril avant et après l’activation. Lorsque plus de sarcomeres sont entre la colle après un protocole, cela suggère que le glissement du myofibril dans la colle a eu lieu. Par conséquent, ce myofibril devrait être exclu du jeu de données.
Autres applications de la configuration: Préactivation de calcium dans les cardiomyocytes isolés du ventricule gauche de rat
En plus d’évaluer la fonction contractile des myofibrils, le système peut également être utilisé pour mesurer la mécanique des cardiomyocytes. Par exemple, la figure 11 illustre l’utilisation de cardiomyocytes simples perméabilisés à la membrane isolés du ventricule gauche du rat21. Contrairement aux expériences décrites ci-dessus, la solution de détente a été changée et la solution d’activation a été maintenue constante. Chaque cardiomyocyte a subi cinq séries d’activations, l’exposant à une solution de calcium libre de 2 μM pour 1 s. La contrainte de temps de 1 s est choisie pour imiter la nature limitée dans le temps des contractions cardiaques, où l’exposition à des solutions de faible concentration de calcium imite la phase diastolique et l’exposition à des solutions de concentration élevée de calcium imite la phase systolique de contraction musculaire cardiaque (Figure 11A). Pour chacun des cinq ensembles, le calcium diastolique était varié (1, 80, 160, 250 et 400 nM de calcium), tandis que le calcium systolique restait constant (figure 11A). Un ensemble se composait de deux séries de trois cycles d’activation-relaxation à 1,8 μm contre 2,0 μm et 2,0 μm contre 2,2 μm pour différents groupes expérimentaux. La force de pointe a été mesurée à 1 s à partir de l’interrupteur de la pipette et moyenne pour l’ensemble de trois cycles d’activation-relaxation. Le rapport signal/bruit élevé et la portée dynamique élevée de ce transducteur de force nous ont permis de mesurer à la fois les petits changements de la force diastolique et les forces systoliques beaucoup plus importantes (figure 11B). L’augmentation du calcium diastolique a entraîné une force plus élevée à 2 μM de calcium par rapport à la première activation (figure 11B). Les cardiomyocytes de rat de WT ont été comparés aux cardiomyocytes de rat d’heterozygous (HET) de RMB20. En raison de l’épissage alternatif, les rats HET ont une protéine de titine plus conforme par rapport aux rats WT. L’effet a été exagéré chez les cardiomyocytes HET à 80 et 160 μM de calcium (figure 11C).
Déclarations de divulgation
Michiel Helmes est actionnaire et copropriétaire d’IONOptix Inc.
Remerciements
Ce projet a été financé par l’AFM-Téléthon et une fondation building strength for Nemaline Myopathies. Les auteurs souhaitent reconnaître le créateur des produits mentionnés dans cet article, IONOptix Inc.
matériels
| Name | Company | Catalog Number | Comments |
| Bio Spec Products, Inc. | 985370-XL | To isolate myofibrils | |
| Custom coded | Matlab | ||
| Custom fabricated | Includes Labview program to control over serial connection; To control valves | ||
| Custom fabricated | To cool the Peltier module | ||
| Custom fabricated | |||
| Custom fabricated | Aluminum tissue chamber | ||
| Custom fabricated | To control the valves; Includes PC software to control over USB | ||
| IonOptix | System controller software: data recording software with advanced signal generator for piezo and fast-step | ||
| IonOptix | MCS100 | To record sarcomere length | |
| IonOptix | Includes: Optiforce (interferometer), Micromanipulators, Signal interface, Piezo motor and controller. Based on the MyoStretcher | ||
| IonOptix | Force probe | ||
| Koolance | ADT-EX004S | ||
| Koolance | EX2-755 | To cool the Peltier module | |
| Microsoft | Data registration | ||
| Olympus | IX71 | ||
| Olympus | TH4-200 | ||
| Sigma-Aldrich | 529265 | Poly(2-hydroxyethyl methacrylate); Coating for microscope slides to prevent sticking of tissue | |
| Sigma-Aldrich | 78471 | Crystals to dissolve in ethanol resulting in glue | |
| TE Technology, Inc. | TE-63-1.0-1.3 | To cool the tissue flow chamber | |
| TE Technology, Inc. | TC-720 | Includes PC software to control over USB | |
| Tecan Trading AG | 20736652 | ||
| Tecan Trading AG | 20739263 | Syringe pump to induce backgroundflow together with fast-step perfusion system; Outflow from tissue flow chamber | |
| Thermo scientific | 2441081 | ||
| Warner Instruments (Harvard Bioscience, Inc.) | Discontinued | Alternative: SF-77CST/VCS-77CSP | |
| Warner Instruments (Harvard Bioscience, Inc.) | TG150-4 | To perfuse the tissue | |
| 1 PC for IonWizard and 1 PC for other software |
Références
- Winter, J. M., Ottenheijm, C. A. C. Sarcomere Dysfunction in Nemaline Myopathy. J. Neuromuscular. Disease. 4, 99-113 (2017).
- Colomo, F., Piroddi, N., Poggesi, C., te Kronnie, G., Tesi, C. Active and passive forces of isolated myofibrils from cardiac and fast skeletal muscle of the frog. Journal of Physiology. 500, 535-548 (1997).
- Kulke, M., et al. a major source of myofibrillar stiffness in Drosophila indirect flight muscle. Journal of Cell Biology. 154, 1045-1057 (2001).
- Stehle, R., et al. Isometric force kinetics upon rapid activation and relaxation of mouse, guinea pig and human heart muscle studied on the subcellular myofibrillar level. Basic Research in Cardiology. 97, 127-135 (2002).
- Iorga, B., et al. Micromechanical function of myofibrils isolated from skeletal and cardiac muscles of the zebrafish. Journal of General Physiology. 137, 255-270 (2011).
- Ribeiro, P. A. B., et al. Contractility of myofibrils from the heart and diaphragm muscles measured with atomic force cantilevers: Effects of heart-specific deletion of arginyl-tRNA-protein transferase. International Journal of Cardiology. 168, 3564-3571 (2013).
- Joureau, B., et al. Dysfunctional sarcomere contractility contributes to muscle weakness in ACTA1-related nemaline myopathy (NEM3). Annals of Neurology. 83, 269-282 (2018).
- de Souza Leite, F., Minozzo, F. C., Altman, D., Rassier, D. E. Microfluidic perfusion shows intersarcomere dynamics within single skeletal muscle myofibrils. Proceedings of the National Academy of Sciences of the United States of America. 114, 8794-8799 (2017).
- Shalabi, N., Cornachione, A., de Souza Leite, F., Vengallatore, S., Rassier, D. E. Residual force enhancement is regulated by titin in skeletal and cardiac myofibrils. Journal of Physiology. 595, 2085-2098 (2017).
- Cornachione, A. S., Leite, F., Bagni, M. A., Rassier, D. E. The increase in non-cross-bridge forces after stretch of activated striated muscle is related to titin isoforms. American Journal of Physiology - Cell Physiology. 310, 19-26 (2016).
- Labuda, A., Brastaviceanu, T., Pavlov, I., Paul, W., Rassier, D. E. Optical detection system for probing cantilever deflections parallel to a sample surface. Review of Scientific Instruments. 82, 013701 (2011).
- Chavan, D., et al. Ferrule-top nanoindenter: an optomechanical fiber sensor for nanoindentation. Review of Scientific Instruments. 83, 115110 (2012).
- Beekmans, S. V., Iannuzzi, D. A metrological approach for the calibration of force transducers with interferometric readout. Surface Topography: Metrology and Properties. 3, (2015).
- van Hoorn, H., Kurniawan, N. A., Koenderink, G. H., Iannuzzi, D. Local dynamic mechanical analysis for heterogeneous soft matter using ferrule-top indentation. Soft Matter. 12, 3066-3073 (2016).
- Winter, J. M., et al. KBTBD13 is an actin-binding protein that modulates muscle kinetics. Journal of Clinical Investigation. , (2019).
- Winter, J. M., et al. Mutation-specific effects on thin filament length in thin filament myopathy. Annals of Neurology. 79, 959-969 (2016).
- Ottenheijm, C. A. C., et al. Deleting exon 55 from the nebulin gene induces severe muscle weakness in a mouse model for nemaline myopathy. Brain. 136, 1718-1731 (2013).
- Ribeiro, P. A., et al. Contractility of myofibrils from the heart and diaphragm muscles measured with atomic force cantilevers: effects of heart-specific deletion of arginyl-tRNA-protein transferase. International Journal of Cardiology. 168, 3564-3571 (2013).
- Pinniger, G. J., Bruton, J. D., Westerblad, H., Ranatunga, K. W. Effects of a Myosin-II Inhibitor (N-benzyl-p-toluene Sulphonamide, BTS) on Contractile Characteristics of Intact Fast-twitch Mammalian Muscle Fibres. Journal of Muscle Research and Cell Motililty. 26, 135-141 (2005).
- Stehle, R., Krüger, M., Pfitzer, G. Force kinetics and individual sarcomere dynamics in cardiac myofibrils after rapid Ca(2+) changes. Biophysics Journal. 83, 2152-2161 (2002).
- Najafi, A., et al. End-diastolic force pre-activates cardiomyocytes and determines contractile force: role of titin and calcium. Journal of Physiology. 597, 4521-4531 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon