Method Article
عزل Myofibrils من خزعات العضلات والهيكل العظمي وتحديد وظيفة المتعاقدة مع نانو نيوتن القرار نقل الطاقة
In This Article
Summary
قدم هنا هو بروتوكول لتقييم خصائص العقد من myofibrils العضلات المتصدع مع قرار نانو نيوتن. يستخدم البروتوكول إعدادًا باستخدام مسبار قوة بصري قائم على التداخل. هذا الإعداد يولد البيانات مع نسبة إشارة عالية إلى الضوضاء وتمكن من تقييم الحركية العقدية من myofibrils.
Abstract
خلايا العضلات المُتَمَرّسة لا غنى عنها لنشاط البشر والحيوانات. تتكون ألياف العضلات المفردة من myofibrils ، والتي تتكون من الساركوميريات المرتبطة بشكل متسلسل ، أصغر وحدات التقلص في العضلات. يساهم الخلل الاختيائي الساركميري في ضعف العضلات لدى المرضى الذين يعانون من طفرات في ترميز الجينات للبروتينات الساركية. دراسة ميكانيكا myofibril يسمح لتقييم التفاعلات actin-myosin دون آثار الخلط المحتملة من التالفة، الميوفيبرليس المجاورة عند قياس قابلية ألياف العضلات واحدة. قد يسهم الضرر الفائق البنية واتّصال الميوفي في إعاقة التقلص. إذا كان الضرر الهيكلي موجود في myofibrils، فإنها من المرجح أن كسر أثناء إجراء العزل أو أثناء التجربة. وعلاوة على ذلك، توفر الدراسات في myofibrils تقييم التفاعلات actin-myosin في وجود القيود الهندسية من الساركوميريات. على سبيل المثال، يمكن أن توضح القياسات في myofibrils ما إذا كان الخلل في myofibrillar هو التأثير الأساسي لطفرة في البروتين الساركيري. بالإضافة إلى ذلك ، فإن التسريب مع حلول الكالسيوم أو المركبات هو فوري تقريبًا بسبب القطر الصغير للميوفيريبريل. وهذا يجعل myofibrils مناسبة بشكل بارز لقياس معدلات التنشيط والاسترخاء أثناء إنتاج القوة. البروتوكول الموصوف في هذه الورقة يستخدم مسبار قوة بصرية على أساس مبدأ مقياس التداخل فابري-بيرو قادر على قياس القوى في نطاق نانو نيوتن، إلى جانب محرك طول بيزو ونظام الضخ السريع الخطوة. هذا الإعداد تمكن من دراسة الميكانيكا myofibril مع قياسات قوة عالية الدقة.
Introduction
خلايا العضلات المُرَقّلة لا غنى عنها لأنشطة الحياة اليومية. حركة الأطراف، وظيفة الجهاز التنفسي، وحركة ضخ القلب تعتمد على القوة التي تولدها خلايا العضلات. العضلات الهيكلية تتكون من كراسات العضلات التي تحتوي على حزم من ألياف العضلات الفردية (الشكل 1A). تتكون هذه الألياف العضلية من myofibrils ، والتي تتكون من الساركوميريات المرتبطة بشكل متسلسل (الشكل 1B ، D). تحتوي الساركوميريات على خيوط رقيقة وسميكة. هذه تتكون في المقام الأول من سلاسل من جزيئات actin و myosin ، على التوالي (الشكل 1B). Actin-myosin التفاعلات هي المسؤولة عن القدرة على توليد القوة من العضلات. المرضى الذين يعانون من طفرات في ترميز الجينات للبروتينات الساركية، مثل النيبولين، actin، وتروبونين تي، يعانون من ضعف العضلات بسبب خلل الوظيفي1انكماشية .
يمكن دراسة نوعية العضلات العقدية على مختلف مستويات التنظيم, بدءا من في العضلات الكاملة في الجسم الحي إلى التفاعلات actin-myosin في مقايسات الحركة في المختبر. خلال العقود الماضية، وضعت العديد من مجموعات البحث الاجهزة لتحديد قابلية الفردية myofibrils2،3،4،5،6،7،8،9،10. وتستند هذه الاجهزة على الكشف عن التغيرات في انحراف الليزر من cantilever (أي انحراف شعاع البصرية) الناجمة عن تقلص myofibril (للحصول على التفاصيل، انظر لابودا وآخرون11). على الرغم من أن تحديد وظيفة العقد من myofibrils لديه بعض القيود (على سبيل المثال ، فإن ديناميات عمليات اقتران الإثارة والانكماش التي هي في المنبع من myofibrils تفتقر) ، وهناك مزايا متعددة لهذا النهج. وتشمل هذه: 1) القدرة على تقييم التفاعلات actin-myosin في وجود القيود الهندسية من الساركوميريات; 2) القدرة على تقييم التفاعلات actin-myosin دون آثار مربكة محتملة من التالفة، ميوسل المجاورة (عند قياس قابلية التقلص من ألياف العضلات واحدة تلف ultrastructural وسوء محاذاة myofibrils قد تسهم في ضعف قابلية) (الشكل 1D); 3) قطر صغير من myofibrils (~ 1 ميكرومتر، الشكل 2A)وعدم وجود أغشية تسمح لنشر الكالسيوم فورية تقريبا في ساركوميريس. وعلاوة على ذلك، إذا كان الضرر الهيكلي موجود في myofibrils، فإنها من المرجح أن كسر أثناء عزلتهم أو أثناء التجربة. وبالتالي، تقييم العقد myofibril هو طريقة أنيقة لدراسة الآليات الأساسية لتقلص العضلات وفهم ما إذا كانت التفاعلات actin-myosin المضطربة هي السبب الرئيسي لأمراض العضلات الناجمة عن الطفرات في البروتينات الساركية.
هذا البروتوكول يقدم الإعداد وضعت حديثا لتحديد قابلية myofibrils دمجها في الكوتليف قوة التحقيق مع نانو نيوتن القرار (أي Optiforce). ويستند هذا التحقيق قوة على مبدأ قياس التداخل. يمكن قياس التداخل استخدام الكناتليف شديدة نسبيا. وهذا يجعل من الممكن لقياس القوة مع انحراف قليلا من cantilever، تقترب من تقلصات متساوي القياس من myofibril. يسمح المسبار بتقييم القوى السلبية والنشطة المنخفضة التي تنتجها myofibril واحدة معزولة عن خزعات العضلات المختلفة ، بما في ذلك تلك من البشر ، مع نسبة عالية من الإشارة إلى الضوضاء. ويستند البصرية cantilever قوة التحقيق المدرجة في هذا الإعداد على مقياس التداخل Fabry-Pérot12. جهاز قياس التداخل يكشف النزوح صغيرة بين الألياف البصرية و cantilever المغلفة بالذهب التي شنت على ضراوة(الشكل 3). وتسمى الفجوة بين الألياف البصرية و cantilever تجويف فابري-Pérot. يتم تركيب Myofibrils بين المسبار والمحرك بيزو باستخدام اثنين من الألياف الزجاجية المغلفة الغراء. يمكن أن تستمد القوة التي تنتجها myofibril رياضيا من البيانات التداخل. ويستند قياس التداخل على تراكب أو تدخل اثنين أو أكثر من موجات (في هذا الإعداد ثلاث موجات ضوئية). ينبعث ضوء الليزر مع الطول الموجي بين 1,528.77-1,563.85 نانومتر من مقياس التداخل ويتم إرسالها من خلال الألياف البصرية. في التحقيق، ينعكس الضوء 1) في الواجهة بين الألياف البصرية والمتوسطة(الشكل 3A)؛ 2) في واجهة من الوسط و cantilever (الشكل 3B); و 3) في واجهة بين طلاء المعادن والذهب من cantilever (الشكل 3C). يعتمد الانعكاس في الواجهة A و B على مؤشر الانكسار(n)للوسيلة التي يتم فيها غمر المسبار. يعود الضوء، الذي يتكون من الانعكاسات الثلاثة فوقها، إلى الصمام الضوئي في مقياس التداخل. يقيس الصمام الضوئي شدة الضوء ، والذي هو نتيجة لنمط التداخل للانعكاسات الثلاثة فوقها. عندما يتم إنشاء قوة المتعاقدة عن طريق تفعيل أو تمتد myofibril، ويسحب myofibril على cantilever. هذه الحركة يغير حجم تجويف (د ) ، وبالتالي ، فإن عدد من الأطوال الموجية التي تناسب في تجويف. وسيكون للضوء المنعوت في الـ cantilever مرحلة مختلفة، مما يؤدي إلى نمط تداخل مختلف. يسجل الصمام الضوئي هذا التغيير في كثافة نمط التداخل كتغيير في فولت. في وقت لاحق، يتم حساب توليد قوة myofibril من هذا التغيير، مع الأخذ في الاعتبار صلابة cantilever. يتم معايرة التحقيق قوة من قبل الشركة المصنعة عن طريق دفع غيض من إبرة تصاعد، تعلق على نهاية تسليم الحرة من cantilever، ضد مقياس وزنها مع الحفاظ على الانحناء من cantilever يساوي مضاعف من الطول الموجي لليزر قراءة13. وبالتالي، فإن قياس التداخل هو طريقة حساسة للغاية للكشف عن التغيرات الصغيرة في المسافة، مما يسمح بقياس القوى بدقة نانو نيوتن. هذا القرار يتيح تقييم إنتاج قوة myofibrillar مع نسبة إشارة عالية إلى الضوضاء. في حين أن قياس التداخل التقليدي يحد من نطاق القياسات إلى الجزء الخطي من منحنى التداخل ، فإن استخدام مكبر للصوت وتأمين وتعديل الطول الموجي بالليزر يتغلب على هذا القيد14. يتم شرح ذلك بمزيد من التفصيل في قسم المناقشة.
لقياس التوتر الفعال myofibril ، تم دمج نظام الضخ السريع خطوة لفضح myofibril إلى حلول الكالسيوم (الشكل 4A). يتيح نظام الضخ السريع للخطوة تغييرات الحل في غضون 10 مللي ثانية. بسبب قطرها الصغير ، وانتشار الكالسيوم في myofibrils هو فوري تقريبا. وبالتالي، هذا النظام هو مناسبة خاصة لقياس معدلات actin-myosin ملزمة أثناء التنشيط والافراج أثناء الاسترخاء. يمكن تحديد معدل التنشيط (kACT)والاسترخاء (kREL)من منحنيات التنشيط والاسترخاء. أيضا، من خلال تعريض myofibrils لمحلول الكالسيوم من زيادة التركيز، يمكن تحديد العلاقة قوة الكالسيوم وحساسية الكالسيوم.
وعلاوة على ذلك، محرك طول بيزو تمكن تمتد بسرعة وتقصير من myofibril. وهذا يوفر إمكانية لدراسة خصائص viscoelastic (أي التوتر السلبي) من myofibril، فضلا عن أداء تقصير سريع ومرح من myofibril لتحديد معدل إعادة تطوير التوتر (كTR). يمكن تغيير المعلمات التي تم استردادها من تجارب التوتر النشط والسلبي على حد سواء عن طريق الطفرات الجينية في البروتين الساركيري.
تم استخدام هذا الإعداد المخصص لقياس الخصائص المتعاقدة النشطة والسلبية لـ myofibrils المعزولة عن العضلات العظمية البشرية والصحية والمريض والفأر.
Protocol
وقد وافق مجلس المراجعة المؤسسية في المركز الطبي لجامعة VU (#2014/396) على بروتوكول الحصول على الخزعات البشرية وتم الحصول على موافقة خطية مستنيرة من الأشخاص. تمت الموافقة على بروتوكول الحصول على خزعات العضلات الحيوانية من قبل لجنة أخلاقيات الحيوان المحلية في جامعة VU (AVD114002016501)
1. إعداد وعزلة myofibril
ملاحظة: استخدام أساليب سبق وصفها للخزعات الجليسرينات، وإعداد تركيز الكالسيوم مختلفة (pCa) حلول7،,16،,17،وعزل myofibrils2،18.
- ذوبان الاسترخاء (pCa 9.0، Rx) وتفعيل (pCa 4.5، قانون) فضلا عن مثبطات (1 M E64، 1 M DTT، 1 M ليووبيبتين، 1 M PMSF)، والتي يتم تخزينها في -80 درجة مئوية.
- خذ قطعة من خزعة العضلات المُرَكّرة من 1 مم3 تقريباً ووضعها في طبق بيتري صغير مع محلول 1:1 Rx/glycerol (v/v) ووضع طبق بيتري على طبق بارد عند 4 درجات مئوية.
- تشريح قطعة من العضلات باستخدام المجهر التشريح والملقط، وفصل ألياف العضلات واحدة دون عزلها عن قطعة من العضلات.
ملاحظة: إزالة الأنسجة الدهنية والزام قدر الإمكان لمنع تلوث تعليق myofibril. - نقل قطعة من الأنسجة تشريح إلى أنبوب 5 مل مع 1.5 مل من محلول الاسترخاء مع مثبطات (1 ميكرولتر / مل E-64، 1 ميكرولتر/ مل ليوبيبتين، 1 ميكرولتر/مل DTT، و 125 ميكرولتر/مل PMSF). السماح للأنسجة لتخفيف في حوالي 4 درجة مئوية لمدة 1 ساعة.
- أثناء الحضانة، قم بتشغيل كل من جهاز الكمبيوتر الشخصي، قم بتشغيل الأجهزة، ثم افتح البرامج المرتبطة بها (انظر جدول المواد).
- غمر مسبار القوة في الماء فائق الخطورة في طبق بيتري ومعايرة المسبار.
- اضغط على'بدء معالج'على مقياس التداخل واتبع التعليمات التي تظهر على الشاشة. بعد الضغط على معايرة، اضغط على مرحلة المجهر.
ملاحظة: إن النقر على مرحلة المجهر سيتسبب في انحراف الـ cantilever والمرور عبر هامش. وهذا يتيح معايرة المسبار. - اترك المسبار مغمورًا في الماء فائق الخطورة في طبق بيتري بعد المعايرة.
- اضغط على'بدء معالج'على مقياس التداخل واتبع التعليمات التي تظهر على الشاشة. بعد الضغط على معايرة، اضغط على مرحلة المجهر.
- تهيئة موقف السيارات بيزو. للقيام بذلك، اتبع إحدى الخطوات المفصلة أدناه.
- عندما سيتم استخدام المحرك بيزو للتوترK TR، تعيين الطول إلى 0 μm.
يمكن العثور على إعدادات مولد إشارة في الجدول 1، الشكل 5A. - عندما سيتم استخدام المحرك بيزو للتوتر السلبي، تعيين طول إلى 50 ميكرومتر.
يمكن العثور على إعدادات مولد الإشارة في الجدول 1.
ملاحظة: الفرق بين الخطوات هو الموضع الأولي لمحرك طول بيزو. لتمتد myofibril، المحرك بيزو يحتاج إلى سحب لزيادة المسافة بين كل من الإبر المتصاعد وإطالة myofibril. لتراخي myofibril، المحرك بيزو يحتاج إلى دفع لتقليل المسافة بين كل من الإبر المتصاعدة وتقصير myofibril.
- عندما سيتم استخدام المحرك بيزو للتوترK TR، تعيين الطول إلى 0 μm.
- إعداد شريحة المجهر. الماصات 150 ميكرولتر من بوليهيدروكسيليوميثي مييثيثيكاريلات (بولي-هيما) حل (5٪ بولي-هيما في 95٪ الإيثانول، ث / الخامس) على شريحة المجهر ونشرها عبر الشريحة لذلك يتم تغطيتها جميعا.
ملاحظة: إذا كان تعليق myofibril pipetted على شريحة المجهر غير المصقول، فإن myofibrils التي تغرق إلى الأسفل التمسك الشريحة المجهر وأنه لن يكون من الممكن الغراء لهم. - ملء المحاقن مع حلول pCa (انظر الشكل 4A)ورئيس نظام الضخ.
ملاحظة: في هذه الخطوات يتم ملء جميع الأنابيب مسبقاً مع الحل المناسب للتأكد من إزالة جميع فقاعات الهواء من الأنابيب.- ملء أنابيب تدفق تدفق خلفية غرفة تدفق(الشكل 3، 4A)التدفق مع Rx.
- عند استخدامها، دافق متعددة مع الماء فائقة الpure لإزالة الهواء. للقيام بذلك، قم بتوصيل الحقنة بالماء فائق الخطورة بالمنفذ واتدفق فيه في الاتجاه المعاكس. حظر المنافذ غير المستخدمة للمقطع.
- تمكين كل حقنة pCa لملء الأنابيب الخاصة بهم مع حل pCa. ثم، ربطها إلى متعددة والزجاج Ɵ.
- فتح الصمامات 1 و 6 مع لوحة الحصول على البيانات البرمجيات (انظر جدول المواد)عن طريق التحقق من زر '1 +6' (الشكل 6A) لملء Ɵ الزجاج مع الاسترخاء (pCa 9.0) وتفعيل (4.5) حلول وإغلاق الصمامات عندما يتم تعبئة الزجاج Ɵ (الشكل 6B).
2. تركيب myofibril
- معطف شريحة المجهر مع بولي-HEMA لمنع myofibrils من التمسك الزجاج.
- إعداد التجانس (انظر جدول المواد)لتجانس الأنسجة. تنظيف قضيب الدوار الداخلي مع ورقة الأنسجة النظيفة، وتجميع التجانس، وتدور 1x لمدة 15 ق في الكحول و3 مرات لمدة 15 ق كل في الماء فائقة الطهر. Prerinse المهيج في حل الاسترخاء 1 x لمدة 15 s على الجليد.
- ضع قضيب المهواك في الأنبوب الذي يحتوي على أنسجة العضلات كما هو موضح في الخطوة 1.4، وبينما تحافظ على الأنبوب على الجليد، تدور الدوار لمدة 15 s على سرعة 5 لتمزيق الأنسجة العضلية والحصول على تعليق myofibril.
- ماصة ~ 50 μL من تعليق myofibril و ~ 250 ميكرولتر من حل الاسترخاء على شريحة المجهر المغلفة مع بولي-HEMA في حمام الأنسجة. هذا سوف يشكل قطرة سائلة. تغطية الحمام مع غطاء لحماية من الغبار والانتظار 5-10 دقيقة للسماح myofibrils لغرق إلى القاع.
ملاحظة: تعتمد النسبة بين التعليق والحل المريح على جودة العزلة ، وبالتالي ، قم بضبطها وفقًا لذلك. على سبيل المثال، إذا كان العائد myofibril منخفضة وعدد قليل من myofibrils مناسبة موجودة في التعليق، إضافة أكثر تعليق myofibril وتمييع مع حل أقل استرخاء (على سبيل المثال، 75 ميكرولتر من تعليق ميوفيبيل و 225 μL من حل الاسترخاء). من السهل التعرف على أنسجة العضلات في القلب والهيكل العظمي بسبب نمط التهريب. باستخدام هدف 10x أو 40x ، وهذا النمط هو أيضا مرئية في myofibril واحد. في حالة وجود الأنسجة الأخرى في التعليق، يمكن اختيار موفيريبريلس بصريا. يمكن للمرء أن تخطي الانتظار 5-10 دقيقة. ومع ذلك، وهذا يزيد من صعوبة الإلتصاق myofibril. - معطفة الإبر مع الغراء (اللك + الإيثانول; 120 ملغ shellac في 2 مل من 70٪ الإيثانول). للقيام بذلك، تسخين الغراء في 65 درجة مئوية لمدة 30-60 ق وماصة ~ 6 ميكرولتر على شريحة جديدة من الزجاج غير المصقول. تراجع غيض من كل إبرة تصاعد في الغراء وكرر حتى طبقة من الغراء مرئية. نقل التحقيق و بيزو حتى عموديا مع micromanipulators لإفساح المجال لوضع حمام الأنسجة على مرحلة المجهر. إزالة الشريحة الزجاجية التي تحتوي على الغراء.
- تركيب myofibrils
- ضع حمام الأنسجة مع شريحة المجهر المغلفة ببولي-هيما التي تحتوي على تعليق myofibril على مرحلة المجهر. استخدام المرحلة للعثور على myofibril مناسبة مع الهدف 40x. إذا لزم الأمر، نقل وتدوير حمام الأنسجة لنقل myofibril إلى موقف يمكن التغلب عليها.
ملاحظة: ابحث عن myofibrils مع نمط التهريب المرئية التي هي تقريبا 30 ميكرومتر طويلة. كما هو موضح بالتفصيل في الخطوتين 3.1 و 3.2.1 من الممكن التحقق من طول و طول الساركومير قبل الإلتصاق في myofibril. لا الغراء تمزق myofibrils، لأن هذه من المرجح أن كسر أثناء الانكماش. - حرك غرفة التدفق في مكانها مباشرة فوق قطرة السائل التي تحتوي على myofibrils في حمام الأنسجة (pipetted على الشريحة في الخطوة 2.4) وخفضه. توقف قبل أن يضرب قطرة السائل.
- خفض إبرة بيزو تصاعد واضغط عليه على الطرف السفلي من myofibril. رفعه قليلا للتحقق مما إذا كان تعلق myofibril على الإبرة.
- خفض غرفة تدفق بعيدا بما فيه الكفاية لإبرة تصاعد من التحقيق للوصول إلى أسفل دون لمس التحقيق غرفة تدفق.
- اضغط على إبرة متزايدة من التحقيق على الطرف العلوي من myofibril. رفعه قليلا للتحقق مما إذا كان تعلق myofibril على الإبرة.
- رفع myofibril من الجزء السفلي من الحمام قدر الإمكان دون أن تفقد القدرة على التركيز دون لمس الهدف الجزء السفلي من الزجاج.
- ضع حمام الأنسجة مع شريحة المجهر المغلفة ببولي-هيما التي تحتوي على تعليق myofibril على مرحلة المجهر. استخدام المرحلة للعثور على myofibril مناسبة مع الهدف 40x. إذا لزم الأمر، نقل وتدوير حمام الأنسجة لنقل myofibril إلى موقف يمكن التغلب عليها.
3. تجربة تهيئة
- استخدام micromanipulators ، وكاميرا ، ونظام البرمجيات وحدة تحكم (الشكل 7A، انظر جدول المواد) لقياس طول الساركومير. نقل بيزو و / أو قوة التحقيق لتعيين طول الساركوميري الأولي من myofibril إلى 2.5 μm.
ملاحظة: طول الساركومير 2.5 ميكرومتر يضمن التداخل الأمثل بين رؤوس الميوسين و actin. - باستخدام وظيفة السفينة من نظام وحدة تحكم البرمجيات قياس طول myofibril وعرض(الشكل 7B،C).
ملاحظة: عند تدوير الكاميرا، قد إمالة أفقياً و/أو رأسياً. للتحقق من محاذاة الكاميرا، يمكن استخدام مستوى الروح للتحقق من أن الكاميرا استدارة وغير مائلة.- ضع myofibril في وسط صورة الفيديو باستخدام مرحلة المجهر.
- رسم مربع من جانب واحد من myofibril إلى الآخر. لطول، تأكد من أن تشمل الحافة الداكنة من قطرات الغراء(الشكل 2A)في المربع لأن تتم معالجة الصور على أساس التباين.
- ابدأ في تسجيل البيانات في برنامج وحدة تحكم النظام (انظر جدول المواد)عن طريق الضغط على 'Start' وبعد 5 s إيقاف مؤقت لتسجيل بيانات برنامج تحكم النظام بالضغط على زر 'إيقاف مؤقت'. يتم الآن تسجيل طول في البيانات.
- لعرض أول تدوير الكاميرا 90 درجة (انظر جدول المواد)ومن ثم استخدام النقيض من حافة myofibril نفسه.
- ابدأ في تسجيل البيانات في برنامج وحدة تحكم النظام (انظر جدول المواد)عن طريق الضغط على 'Start' وبعد 5 s إيقاف مؤقت لتسجيل بيانات برنامج تحكم النظام بالضغط على زر'Pause'. يتم الآن تسجيل العرض في البيانات.
- إذا كان التوتر النشط من myofibril يحتاج إلى تحديد، إعداد perfusion يحتاج إلى استخدامها. إذا كان الأمر كذلك، تابع الخطوة 3.4. إذا تم تحديد التوتر السلبي فقط، تخطى الخطوات 3.4-4.1.3.7 واستمر في الخطوة 4.2.
- ضع تهيئة إعداد perfusion.
ملاحظة: هذا ضروري فقط من أجل إنشاء القوة النشطة. تابع الخطوة 4.2 عند تنفيذ تجارب التوتر السلبي.- تعيين موقف السيارات خطوة سريعة في 4 V(الشكل 5B).
- حرك الحاملة على الطاولة لمحاذاة الركن السفلي الأيسر من الحامل مع الشريط على الطاولة.
ملاحظة: يجب الحرص على عدم ضرب التحقيق قوة أو المحرك بيزو. - استخدام المتلاعب لوضع ما يقرب من Ɵ الزجاج بالعين.
- ننظر من خلال العدسة ونقل بعناية Ɵ الزجاج نحو myofibril باستخدام المتلاعب.
- محاذاة القناة العليا من Ɵ-الزجاج مع myofibril باستخدام المتلاعب والتحقق من موقف عن طريق تنفيذ خطوة سريعة (يمكن العثور على إعدادات مولد إشارة في الجدول 1) مع برنامج وحدة تحكم النظام (الشكل 2B-C، انظر جدول المواد).
ملاحظة: تأكد من أن القناة السفلية سيتم محاذاتها مع myofibril خلال مرحلة التنشيط من الخطوة السريعة(الشكل 2B-C).
- تشغيل تدفق الخلفية من Rx (الشكل 4A) لإنشاء تدفق الخلفية لارينار في غرفة تدفق.
ملاحظة: تدفق الخلفية ضروري لمنع تدفق مضطرب نتيجة تدفق حل pCa من الزجاج Ɵ.- بدوره على تدفق غرفة تدفق مع ذراع صمام Luer.
- إرسال المعلمات التالية إلى مضخة تدفق لبدء استنزاف غرفة تدفق ومنع تفيض من غرفة تدفق (الشكل 9): صمام = صمام حمام (2)؛ وضع Microstep = مايكرو؛ هدف المكبس = 48,000؛ سرعة المكبس = 38-40 (التعسفي).
ملاحظة: تأكد من استقرار مستوى السوائل في جميع الأوقات. وينبغي أن myofibril لا تعمل الجافة ولا ينبغي ل cantilever. فمن الأفضل أن يكون قليلا من تجاوز التدفق قليلا جدا.
- إرسال المعلمات التالية إلى مضخة تدفق لبدء استنزاف غرفة تدفق ومنع تفيض من غرفة تدفق (الشكل 9): صمام = صمام حمام (2)؛ وضع Microstep = مايكرو؛ هدف المكبس = 48,000؛ سرعة المكبس = 38-40 (التعسفي).
- بدوره على تدفق غرفة تدفق مع ذراع صمام Luer.
- لضبط درجة الحرارة إلى القيمة المطلوبة مع وحدة تحكم الحرارة الكهروحرارية (الشكل 8، انظر جدول المواد)، أدخل درجة الحرارة المطلوبة واضغط على 'ابدأ. انتظر حتى يتم الوصول إلى درجة الحرارة المطلوبة عن طريق التحقق من الرسم البياني في برنامج تحكم درجة الحرارة الحرارية والاستمرار.
ملاحظة: عند إجراء التجارب في درجة حرارة الغرفة، لا يلزم استخدام وحدة التحكم في درجة الحرارة الحرارية.
4- البروتوكولات التجريبية(البروتوكولات)
- تحديد أي بروتوكولات القوة النشطة التي يجب تنفيذها.
ملاحظة: اعتمادا على البيانات اللازمة للدراسة، يمكن إجراء أنواع متعددة من تجارب القوة النشطة: الخطوة 4.1.1، قياس القوة القصوى عند التشبع [Ca2+]; الخطوة 4.1.2، الحصول على منحنى قوة-pCa لتحديد حساسية الكالسيوم بالإضافة إلى الخطوة 4.1.1. الخطوة 4.1.3، تحديد معدل إعادة تطوير التوتر عن طريق القيام بروتوكول تقصير-restretch بالإضافة إلى الخطوة 4.1.1 أو 4.1.2.- قياس القوة النشطة القصوى.
- ابدأ في تسجيل البيانات في برنامج وحدة تحكم النظام (انظر جدول المواد)عن طريق الضغط على 'Start'.
- فتح الصمامات 1 و 6 مع لوحة الحصول على البيانات (انظر جدول المواد) البرمجيات عن طريق التحقق من زر '1 +6' لبدء تدفق الزجاج Ɵ من حل الاسترخاء وتفعيل الحل من خلال Ɵ-الزجاج (الشكل 6A).
- إعادة تعيين نطاق مقياس التداخل بحيث تكون قوة خط الأساس 0 V عن طريق تحديد والضغط على 'إعادة تعيين المدى' على مقياس التداخل (انظر جدول المواد).
- عندما يكون أثر القوة ثابتًا، قم بتنفيذ الخطوة السريعة Ɵ الزجاج (حجم الخطوة = 100 ميكرومتر).
يمكن العثور على إعدادات مولد إشارة في الجدول 1 (الشكل 5C). سيتم تسجيل تتبع التنشيط والاسترخاء مشابهاً لـ Figure 4D ومرئي في برنامج وحدة تحكم النظام. - إيقاف تسجيل بيانات برنامج وحدة تحكم النظام مؤقتًا عن طريق الضغط على الزر'Pause'.
- إذا لم يتم تنفيذ المزيد من التنشيطات، أغلق الصمامات 1 و 6 لإيقاف تدفق Ɵ الزجاج عن طريق إلغاء الزر '1+6' (الشكل 6B)،إيقاف مضخة الحقنة (الشكل 9، انظر جدول المواد)عن طريق الضغط على 'إنهاء' ، ووقف تدفق الخلفية عن طريق إغلاق صمام Luer.
- منحنى قوة-pCa
ملاحظة: هذا مشابه الخطوة 4.1.1 للحصول على القوة النشطة القصوى ولكن مع عمليات التنشيط متعددة باستخدام حلول pCa مختلفة.- بدء تسجيل البيانات في برنامج وحدة تحكم النظام عن طريق الضغط على'ابدأ'.
- فتح الصمامات 1 و 2 مع لوحة الحصول على البيانات البرمجيات لبدء تدفق حل الاسترخاء وpCa 6.2 من خلال Ɵ الزجاج.
- إعادة تعيين نطاق مقياس التداخل بحيث تكون قوة الأساس 0 V عن طريق تحديد الضغط على"إعادة تعيين المدى"على مقياس التداخل.
- عندما يكون أثر القوة ثابتًا، قم بتنفيذ الخطوة السريعة Ɵ الزجاج (حجم الخطوة = 100 ميكرومتر).
يمكن العثور على إعدادات مولد الإشارة في الجدول 1. - إيقاف برنامج تحكم النظام مؤقتًا عن طريق الضغط على الزر'Pause'.
- كرر الخطوات 4.1.2.1-4.1.2.4 للصمامات 1 و3 (pCa 5.8)، والصمامات 1 و4 (pCa 5.6)، والصمامات 1 و5 (pCa 5.4)، والصمامات 1 و6 (pCa 4.5).
- إذا لم يتم تنفيذ المزيد من التنشيطات، أغلق الصمامات 1 و 6 لوقف تدفق الزجاج Ɵ عن طريق إلغاء الزر '1 +6'(الشكل 6A)،ووقف ضخ حقنة (الشكل 9) عن طريق الضغط على 'إنهاء' ، ووقف تدفق الخلفية عن طريق إغلاق صمام Luer.
- قياس معدل إعادة تطوير التوتر (kTR).
ملاحظة: هذا مشابه الخطوة 4.1.1 القوة النشطة القصوى ولكن مع بعض التغييرات و إضافة الخطوات.- حساب حركة بيزو اللازمة لتراخي myofibril 15٪ وأدخل هذه القيمة في مولد إشارة (الشكل 5D، الجدول 1).
- بدء تسجيل البيانات في برنامج تحكم النظام عن طريق الضغط على 'ابدأ'.
- فتح الصمامات 1 و 6 مع لوحة الحصول على البيانات(الشكل 6A)البرمجيات لبدء تدفق حل الاسترخاء وpCa 4.5 من خلال Ɵ الزجاج.
- إعادة تعيين نطاق مقياس التداخل بحيث تكون قوة الأساس 0 V عن طريق تحديد الضغط على"إعادة تعيين المدى"على مقياس التداخل.
- عندما يكون أثر القوة ثابتًا، قم بتنفيذ الخطوة السريعة Ɵ الزجاج (حجم الخطوة = 100 ميكرومتر).
يمكن العثور على إعدادات مولد الإشارة في الجدول 1. - عندما يتم الوصول إلى هضبة القوة، تنفيذ shortretch مع بيزو.
يمكن العثور على إعدادات مولد إشارة في (الشكل 5D، الجدول 1). سيتم تسجيل تتبع التنشيط والاسترخاء مشابهاً لـ Figure 4E ومرئي في برنامج وحدة تحكم النظام.
ملاحظة: يمكن إجراء بروتوكول مخصص لأتمتة الخطوات أعلاه. - إيقاف برنامج تحكم النظام مؤقتًا عن طريق الضغط على الزر'Pause'.
- إذا لم يتم تنفيذ المزيد من التنشيطات، إغلاق الصمامات 1 و 6 لوقف تدفق الزجاج Ɵ عن طريق إلغاء الزر '1 +6'(الشكل 6B)،وقف ضخ الحقنة(الشكل 9)عن طريق الضغط على 'إنهاء'، ووقف تدفق الخلفية عن طريق إغلاق صمام Luer.
- قياس القوة النشطة القصوى.
- تنفيذ قياسات القوة السلبية.
- تنفيذ امتداد مستمر.
- حساب حركة بيزو اللازمة لتمتد myofibril وأدخل هذه القيمة في مولد إشارة (الجدول 1).
ملاحظة: هذه هي إعدادات المثال. حساب مقدار التمدد ووقت التمدد بالنسبة لطول الساركومير. هذه الإعدادات ضرورية لضمان أن سرعة تمتد لكل ساركومير تبقى متساوية عبر myofibrils. - بدء تسجيل البيانات في برنامج تحكم النظام عن طريق الضغط على 'ابدأ'.
- إعادة تعيين نطاق مقياس التداخل بحيث تكون قوة الأساس 0 V عن طريق تحديد الضغط على"إعادة تعيين المدى"على مقياس التداخل.
- تنفيذ امتداد مستمر مع مولد إشارة في برنامج وحدة تحكم النظام لتشغيل بيزو. يمكن العثور على إعدادات مولد إشارة المثال في الجدول 1.
- تقصير myofibril إلى طول الركود مع بيزو بعد الانتهاء من تمتد(الجدول 1).
- حساب حركة بيزو اللازمة لتمتد myofibril وأدخل هذه القيمة في مولد إشارة (الجدول 1).
- تنفيذ امتداد متدرج.
- بدء تسجيل البيانات في برنامج تحكم النظام عن طريق الضغط على 'ابدأ'.
- إعادة تعيين نطاق مقياس التداخل بحيث تكون قوة الأساس 0 V عن طريق تحديد الضغط على"إعادة تعيين المدى"على مقياس التداخل.
- تنفيذ امتداد متدرج مع مولد إشارة في برنامج تحكم النظام لتشغيل بيزو. يمكن العثور على مثال إعدادات مولد إشارة في الجدول 1 (الشكل 5E).
- تقصير myofibril إلى طول الركود مع بيزو بعد الانتهاء من تمتد. يمكن العثور على إعدادات مولد إشارة المثال في الجدول 1.
- تنفيذ امتداد مستمر.
- إيقاف برنامج تحكم النظام مؤقتًا عن طريق الضغط على الزر'Pause'.
- إيقاف تسجيل البيانات عن طريق الضغط على زر 'إيقاف' في برنامج تحكم النظام.
- حفظ البيانات عن طريق الضغط على 'ملف' و 'حفظ البيانات' في برنامج تحكم النظام.
5. التنظيف
- إزالة myofibril قياس والاستعداد لميوفيبيلل المقبل.
- للقيام بذلك، المسيل للدموع بعناية قبالة myofibril في حين يبحث من خلال العين مع الهدف 40x.
- تحريك أعلى التحقيق قوة وبيزو. تحركوا إلى أعلى Ɵ الزجاج على طول الطريق لأعلى، إلى اليمين وإلى الخلف. ثم الانتقال إلى أعلى والانزلاق بعيدا غرفة تدفق. إزالة حمام الأنسجة.
- لتنظيف إبرة التركيب، جعله في التركيز باستخدام 10x والعصب. تراجع الفرشاة في الإيثانول وفرشاة بعناية قبالة وإزالة الغراء من الإبرة.
ملاحظة: ضع في اعتبارك أن الأمر قد يستغرق بعض الوقت قبل أن يخرج الغراء. - شطف غرفة تدفق وحمام الأنسجة مع الماء فائقة الخطورة.
- وضع التحقيق في طبق صغير بيتري مليئة المياه فائقة الpure. تأكد من أن المسبار هو الغمر تماما.
- عند الانتهاء من التجارب، قم بتنظيف الإعداد كما هو أعلى ثم قم بتنفيذ الخطوات الإضافية التالية.
- إفراغ الأنابيب من حمام التدفق. إرسال المعلمات إلى مضخة حقنة الخارج (انظر جدول المواد، الشكل 9). صمام = صمام حمام (2); وضع microstep = عادي؛ هدف المكبس = 0؛ سرعة المكبس = 30.
ملاحظة: إنهاء الأمر عندما تكون الأنابيب فارغة. - تهيئة مضخة عدة مرات (الشكل 9B).
- استنزف المحاقن للقيام بذلك، إغلاق جميع الصمامات Luer، وفتح جميع الصمامات، وإزالة الأنابيب من إبرة الحقنة، وعقد أنبوب من pCa محددة تحت الإبرة، وفتح صمام لور. استخدام سدادات الضغط لتسريع العملية.
- أعد ربط الأنبوب بإبرة المحاقن. ملء الحقن مع ~ 5 مل من الماء فائقة الpure. ضع كوبًا تحت Ɵ الزجاج. فتح جميع الصمامات وفتح صمام الضغط لطرد النظام.
- أغلق النظام. أوقف تشغيل الكمبيوتر، ومقياس التداخل، وكتلة طاقة وحدة تحكم بيزو.
- إفراغ الأنابيب من حمام التدفق. إرسال المعلمات إلى مضخة حقنة الخارج (انظر جدول المواد، الشكل 9). صمام = صمام حمام (2); وضع microstep = عادي؛ هدف المكبس = 0؛ سرعة المكبس = 30.
6 - تحليل البيانات
- تصدير تعقب البيانات من برنامج وحدة تحكم النظام (انظر جدول المواد)إلى برنامج برنامج جدول بيانات أو حافظة عن طريق فتح ملف البيانات وتحديد الجزء المطلوب. سيتم تصدير الآثار المعروضة (مثل القوة الخام، وطول الساركومير، وموقف بيزو).
- إجراء تحليل مع البرنامج المفضل (على سبيل المثال، MATLAB).
النتائج
تم تسجيل عمليات تتبع البيانات وفتحها باستخدام برنامج وحدة تحكم النظام (انظر جدول المواد). تم تصدير آثار كاملة أو شرائح مختارة إلى الحافظة أو ملف نصي لمزيد من التحليل مع البرامج المطلوبة. تم تبديل الصمامات للتحكم في تدفق الحلول المختلفة مع برامج مخصصة أو يدويا. تم استخدام سيناريو MATLAB مخصص لتحليل معدلات التنشيط ، وإعادة تطوير التوتر ، والاسترخاء. أخذ القوة قصوى نشطة والذرّية والهضاب قوة من القوّة سلبيّة قوة تجارب كان مباشرة من النظام تحكم برمجيّة قوة أثر. بعد تركيب myofibril (الشكل 2) ، تم اختيار البروتوكول المطلوب.
أقصى قوة نشطة والكالسيوم-حساسية القوة في myofibrils معزولة عن خزعات العضلات الماوس والهيكل العظمي البشري
في الشكل 4A يتم تصوير الإعداد التجريبي المستخدم لتجارب القوة النشطة تخطيطياً. تظهر آثار القوة لتجربة قوة نشطة مع myofibril معزولة عن العضلات الرباعية البشرية السليمة. تم تنشيط myofibril 5 مرات مع حلول مع pCa متفاوتة (pCa 6.2، 5.8، 5.6، 5.4، 4.5؛ البيانات المعروضة في الشكل 4B). وكان متوسط القوة القصوى لجميع myofibrils في هذه التجربة ~ 123 mN / مم2. تم بناء منحنى قوة-pCa من قوات الهضبة التي تم التوصل إليها خلال كل تنشيط في كل من حلول الكالسيوم الخمسة. وتظهر النتائج في الشكل 4C. من هذا منحنى ال [ب][ في 50% من قوة قصوى إنتاج([ب]50) كان يحسب. في هذا myofibril، وكان pCa50 5.75.
بالإضافة إلى ذلك، يمكن إضافة مركب واحد أو عدة مركبات إلى الحل المُركّب لقياس تأثيره على القوة التي ينتجها الميوفيبيرل. في الشكل 4D، يظهر تأثير N-benzyl-p-toluene sulphonamide (BTS) ، وهو عضلة ارتعاش سريع (من النوع الثاني) الميوسين سلسلة ثقيلة II (MHCII) مثبطات. 19 تم تنشيط myofibril الأول مع حل pCa 5.6 ، وبعد ذلك مع حل PCa 5.6 + BTS. أثناء الثاني تنشيط أنتجت قوة أقلّ كان, يشير أنّ هذا كان myofibril أنّ احتوى هكد. هناك طفرات في البروتينات التي هي موجودة حصرا في أنواع العضلات محددة, وبالتالي تؤثر فقط myofibrils من نوع العضلات المحددة. في هذه الحالة، "كتابة" myofibrils المهم لتمييز تأثير الطفرة على أنواع العضلات المختلفة. أيضا, هذا المثال يوضح إمكانية لاختبار فعالية المركبات العلاجية في myofibrils.
يظهر الشكل 4E أثر قوة نشطة لميوفيبيل واحد معزولة من أنسجة العضلات وحيد الهيكل العظمي الماوس. وقد شنت myofibril في الإعداد و perfused مع حل الاسترخاء (PCa 9.0)، تليها perfusion مع تفعيل الحل (pCa 4.5، ~ 0.032 mM الكالسيوم). سجلنا في وقت واحد طول القوة وساركومير. وكان هذا انكماشاً شبه متساوي القياس، حيث كان انحراف الكانتيليف ~0.5 ميكرومتر، والذي كان حوالي 1% من طول فترة الركود في myofibril (~ 50 ميكرومتر). وفي الشكل 4E تم تنفيذ بروتوكول سريع لتقصير بقية الاستراحة أثناء الانكماش النشط لتقييم معدل إعادة تطوير التوتر (kTR، خط أصفر متقطع). وKTR هو مقياس لحركيات ركوب الدراجات عبر الجسر. أيضا، تم تركيب منحنيات التنشيط والاسترخاء لتحديد معدل التنشيط (كACT،خط أحمر متقطع) والاسترخاء (كREL،خط متقطع الأخضر)، على التوالي. ويبين الشكل 4 نظرة أكثر تفصيلا لمرحلة الاسترخاء التي تم تسليط الضوء عليها في الشكل 4F. أصبحت مرحلتين واضحة: 1) مرحلة أولية بطيئة من الاسترخاء (التي تهيمن عليها انفصال عبر الجسر) و 2) مرحلة سريعة من الاسترخاء (التي تهيمن عليها انفصال عبر الجسر والكالسيوم تفكك)20.
القوة السلبية في myofibrils معزولة عن خزعة العضلات الهيكل العظمي البشري
يظهر الشكل 10 أثر تجربة قوة سلبية مع myofibril معزولة عن الأنسجة العضلية الحجاب الحاجز البشري السليم. البروتوكول الأول ينطوي على واحد أو عدة تمتد السلبي لتحديد خصائص اللزوجة من الساركوميري. ويبين الشكل 10 أثر قوة لامتداد مستمر من myofibril (تمتد من طول الساركومير 2.2-3.0 ميكرومتر). خلال فترة التمدد، عرض myofibrils الخصائص اللزجة والمرنة على حد سواء. وهذا واضح من المنحنى المبين في الشكل 10A. ويمثل الذروة الحادة كلا من الخصائص، في حين أن قوة الهضبة هي مقياس للمرونة. اللزوجة يقاوم سلالة خطيا. وهكذا، انخفضت القوة بعد إزالة السلالة. الشكل 10B يسلط الضوء على امتداد نفسها ويوضح نسبة إشارة عالية إلى الضوضاء. لاحظ أن تتبعات القوة غير مفلترة.

الشكل 1: التصوير التخطيطي وصور المجهر الإلكتروني لعضلات الهيكل العظمي ومورفولوجيا. (أ)يظهر هيكل الهيكل العظمي و (B) يظهر هيكل ساركومير ، أصغر وحدة انقباضي. يتم تكييف هذه الصور التخطيطية من Servier الطبية الفن. (C)يظهر صورة من الألياف العضلية واحد و (D) يظهر صورة المجهر الإلكتروني من الألياف العضلية الكشف عن تلف myofibrillar وكذلك الحفاظ على هيكل ميديبريلار الفائقة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: صور تظهر myofibril شنت، Ɵ الزجاج محاذاة، وبيزو إبرة متزايدة. (أ) و myofibril شنت على طول الركود بين الإبر الألياف الزجاجية المغلفة مع shellac كما رأينا من خلال هدف 40x. (ب) صور لموضع Ɵ الزجاج بالنسبة إلى الميوفيبرريل (المميزة مع البيضاويات البيضاء) كما رأينا من خلال هدف 10x. (أعلى) الانحياز إلى القناة العليا (حل الاسترخاء، pCa 9.0)؛ (أسفل) الانحياز إلى القناة السفلية (تفعيل الحل، pCa 4.5) ل perfuse myofibril مع الكالسيوم والحث على الانكماش. (C) تصوير تخطيطي لموقف Ɵ الزجاج بالنسبة إلى myofibril. (أعلى) الانحياز مع القناة العليا (حل الاسترخاء، pCa 9.0)؛ (أسفل) الانحياز مع القناة السفلية (تفعيل الحل، pCa 4.5) ل perfuse myofibril مع الكالسيوم والحث على الانكماش. (D) تركيب إبرة تعلق على قضيب الكربون من حامل بيزو. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التمثيل التخطيطي للإعداد ونهاية جزء من غرفة تدفق الأنسجة. في الأزرق الداكن غرفة تدفق الأنسجة مصنوعة من الألومنيوم، والأبيض تجويف التي تظهر التحقيق قوة والزجاج Ɵ في الموقف. (وسط) Myofibril تعلق بين اثنين من الألياف الزجاجية تصاعد الإبر تعلق على قوة التحقيق و الميكانيكية طول بيزو. يتم محاذاة الزجاج Ɵ مع myofibril. يمكن للزجاج Ɵ التحرك صعودا وهبوطا لفضح myofibril لمحلول الكالسيوم. (يمين) عن قرب من التحقيق قوة cantilever. يشار إلى حجم تجويف (أو Fabry-Pérot تجويف, د); واجهات انعكاس A و B و C; ومثال على موجة الضوء المنبعثة من الليزر (الأحمر). يتم تركيب الـ"كانتليفر" على كتف النتروس. الألياف التي تحمل الليزر من مقياس التداخل يخرج من النبير في طرف cantilever. يتم إصلاح الألياف تصاعد الزجاج على cantilever باستخدام الشمع. (أعلى اليسار) يحلل مقياس التداخل إشارة مقياس التداخل التي يتم إرسالها إلى برنامج وحدة تحكم النظام. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: الإعداد التجريبي والبيانات المستمدة من تجارب التوتر النشطة. (أ) تمثيل تخطيطي لإعداد الضخ والحلول المستخدمة. لاحظ أن الأنابيب الأولى والأخيرة (الأزرق الفاتح) تحتوي على محلول خالي من الكالسيوم (أي حل الاسترخاء). (ب) مثال آثار القوة لتجربة التوتر النشط مع myofibril معزولة عن أنسجة العضلات الهيكل العظمي البشري تظهر خمسة تنشيطات من حل الاسترخاء (pCa 9.0) إلى حلول تنشيط متعددة (pCa 6.2 – 4.5). (C) منحنى قوة الكالسيوم؛ تم تطبيع مستويات القوة في الهضاب في لوحة (B) ورسمت ضد مستويات الكالسيوم الخاصة بكل منها. (D) مثال أثر القوة من النوع الثاني (نشل سريع) myofibril معزولة عن العضلات العظمية البشرية تنشيط مع pCa 5.6 حل (الأزرق) وبعد ذلك مع pCa 5.6 + BTS (نوع II محددة عبر جسر المانع، أحمر). (E) مثال تتبع البيانات من تجربة التوتر النشط مع myofibrils معزولة عن الماوس soleus الهيكل العظمي أنسجة العضلات مع بروتوكول سريع تقصير restretch أثناء تفعيل لتحديد معدل إعادة تطوير التوتر (كTR، خط أصفر متقطع). أيضا، تم تركيبها على تنشيط ومنحنى الاسترخاء لتحديد معدل التنشيط (كACT،خط أحمر متقطع) والاسترخاء (كREL،خط متقطعة الخضراء)، على التوالي. (F) زووم من مرحلة الاسترخاء (أعلى اليسار)، وتسليط الضوء في (E). إشارة المحرك خطوة سريعة (أسفل اليسار) أشار إلى نقطة الوقت التي حل تغير من حل التنشيط (pCa 4.5) إلى حل الاسترخاء (pCa 9.0). تألفت مرحلة الاسترخاء من مرحلة خطية بطيئة (أعلى اليمين) ومرحلة أسية وسريعة (أسفل اليمين). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: مثال على إعداد مولد الإشارة في برنامج التحكم بالنظام. (راجع جدول المواد). 1) يشير إلى زر لتنفيذ الأوامر التي أدخلت في مولد إشارة. (A) إعداد محرك طول بيزو. (ب) إعداد المحرك السريع. (C) تنفيذ خطوة سريعة لتنشيط myofibril لمدة 5 s. (D) تنفيذ سريع تقصير restretch من myofibril لتحديدTRك . (E) تنفيذ امتداد متدرج من myofibril لتحديد خصائص اللزجة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
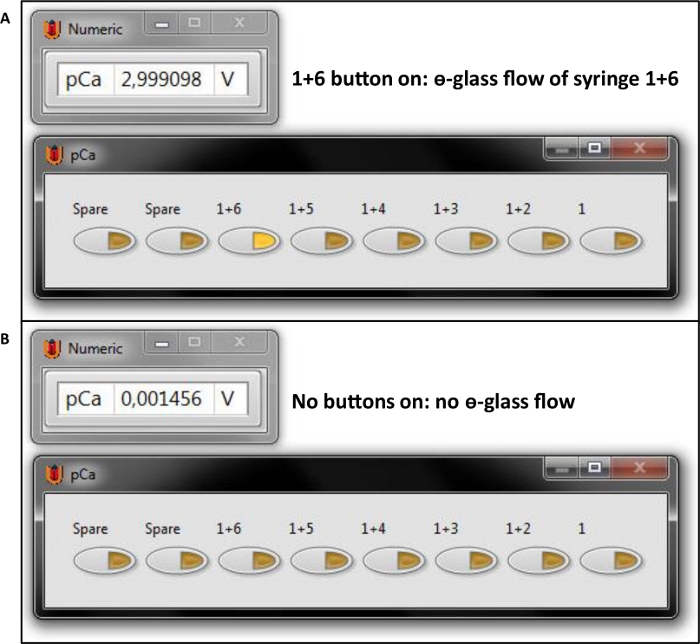
الشكل 6: برنامج تحكم صمام كما هو مستخدم على جهاز الكمبيوتر. (أ) الزر المستخدم لفتح الصمامات 1 (Rx) و 6 (القانون). (ب) حالة الأزرار عند إغلاق جميع الصمامات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
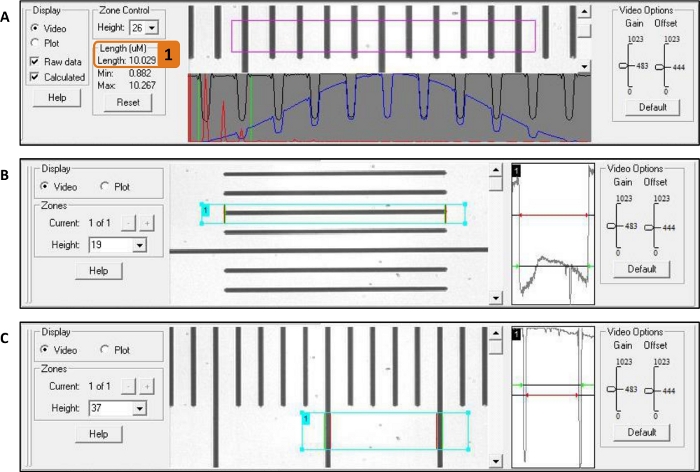
الشكل 7: قياس طول الساركومير، طول myofibril، وعرض myofibril مع برنامج وحدة تحكم النظام. يُستخدم المسطرة كمثال. (أ) قياس طول السارومير: يوضع الصندوق الأرجواني حول الميوفيبيرريل ويظهر طول الساركومير في (1). (B) قياس الطول: يتم وضع مربع السماوي من البداية إلى نهاية myofibril. (C) قياس العرض: بعد تدوير الكاميرا 90 درجة، يتم وضع مربع السماوي من جانب واحد من myofibril إلى الآخر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 8: برنامج تحكم درجة الحرارة الحرارية. (أ) إقامة اتصال مع وحدة تحكم درجة الحرارة الكهروحرارية. (B) توسيع إعدادات درجة الحرارة. (C) تعيين درجة الحرارة المطلوبة، في هذه الحالة: 15 درجة مئوية (D)تشغيل وحدة تحكم درجة الحرارة الكهروحرارية وإرسال الجهد إلى بلتييه وحدة برودة الكهروحرارية. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 9: إعدادات مضخة تدفق المحقن. (A) فتح اتصال للمضخة عن طريق الضغط (1). (B) بدء تشغيل المضخة مع إعدادات محددة مسبقا عن طريق الضغط (2). (C)بدء ضخ تدفق من خلال إعداد'أوامر صمام' إلى 'صمام الحمام' (2) وإدخال 'المعلمات مجموعة الأوامر' كما هو مبين. تنفيذ الأمر عن طريق الضغط (3). يمكن إنهاء الأوامر عن طريق الضغط (4). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
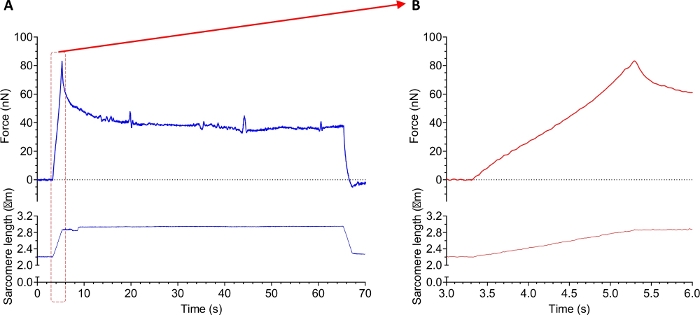
الشكل 10: مثال على تتبع البيانات لتجربة التوتر السلبي مع myofibrils معزولة عن أنسجة العضلات الهيكل العظمي البشري. (أ) تسجيل القوة (العلوي) وطول الساركومير (السفلي) أثناء بروتوكول التمدد والإطلاق. (ب) تكبير (A) تظهر القوة (العلوي) وطول الساركومير خلال مرحلة التمدد من myofibril. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
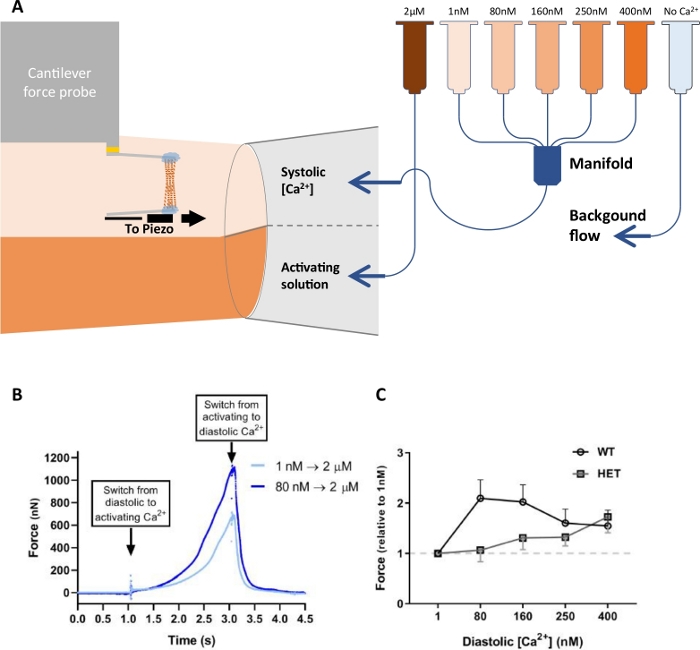
الشكل 11: الإعداد التجريبي والبيانات من تجارب تنشيط الكالسيوم cardiomyocyte. (A) تمثيل تخطيطي لإعداد التسريب. لاحظ أن الأنبوب الأخير (الأزرق الفاتح) يحتوي على محلول خالي من الكالسيوم (حل الاسترخاء). (B) منحنيات فوق تنشيط عضلة القلب بدون (الأزرق الفاتح) ومع (الأزرق الداكن) تنشيط الكالسيوم ، مع تركيزات الكالسيوم من 1 ن م و 80 ن م ، على التوالي. (C) مقارنة من قبل تنشيط الكالسيوم في نوع البرية (WT) و هيتروزيغوس RBM20 (HET) cardiomyocytes معزولة عن البطين الأيسر الفئران. وقد تم تعديل هذا الرقم من النجفي وآخرون21. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| خطوه | الجهاز | وصف | الشكل | الاولي | ||||||||
| 1.7.1. | بيزو | تهيئة التوتر السلبي | الثابته | 51.6 ميكرومتر | ||||||||
| 1.7.2. | بيزو | تهيئة التوتر النشط | الثابته | 0 ميكرومتر | ||||||||
| خطوه | الجهاز | وصف | الشكل | الاولي | تاخير | ممثلين | مستوي | تاخير | مستوي | تاخير | ||
| 3.4.4. / 4.1.1.4. / 4.1.2.4. | خطوة سريعة | اختبار ɵ الزجاج الموقف / تفعيل myofibril | نبض | 4 فولت | 1 s | 1 x | 3 فولت | 5 س | 4 فولت | 1 s | ||
| 4.1.3.4. | خطوة سريعة | تفعيل myofibril (وتشمل كTR) | نبض | 4 فولت | 1 s | 1 x | 3 فولت | 10S | 4 فولت | 1 s | ||
| خطوه | الجهاز | وصف | الشكل | الاولي | تاخير | ممثلين | مستوى المنحدر | المدة المنحدرية | تاخير | مستوى المنحدر | المدة المنحدرية | تاخير |
| 4.1.3.1. / 4.1.3.6. | بيزو | تقصير-ريستريدش لKTR | شبه منحرف | 0 ميكرومتر | 0.5 س | 1 x | 0 + 0.15 * L0 = __ μm | 0.01 س | 0.01 س | 0 ميكرومتر | 0.01 س | 1 s |
| 4.2.1.1. / 4.2.1.4. | بيزو | استمرار الامتداد | شبه منحرف | 51.6 ميكرومتر | 2 s | 1 x | 51.6 - 0.30 * L0 = __ μm | 2 s | 0 s | 51.6 - 0.30 * L0 = __ μm | 0 s | 1 s |
| 4.2.1.4. | بيزو | إرجاع myofibril إلى طول فترة الركود | شبه منحرف | 1.6 ميكرومتر | 2 s | 1 x | 51.6 ميكرومتر | 5 س | 0 s | 51.6 ميكرومتر | 0 s | 1 s |
| 4.2.2.3. | بيزو | شد متدرج | شبه منحرف | 51.6 ميكرومتر | 2 s | 10 x | 51.6 - 5 ميكرومتر | 0.5 س | 10 س | 51.6 - 5 ميكرومتر | 0 s | 0 s |
| 4.2.3. | بيزو | إرجاع myofibril إلى طول فترة الركود | شبه منحرف | 1.6 ميكرومتر | 2 s | 1 x | 51.6 ميكرومتر | 5 س | 0 s | 51.6 ميكرومتر | 0 s | 0 s |
الجدول 1: جدول يصف إعدادات مولد الإشارة المختلفة المستخدمة في برنامج تحكم النظام لتشغيل المحرك بطول بيزو والمحرك السريع.
Discussion
وصف هو بروتوكول لتقييم وظيفة العقد من myofibrils معزولة عن أنسجة العضلات الهيكل العظمي البشري أو الحيوانية. وقد تم وصف قرار القوة لهذا الإعداد من قبل Chavan وآخرون12. باختصار ، يتم تحديدها من خلال التقلبات العشوائية لطول تجويف Fabry-Pérot التي تشكلت بين ألياف الكشف و cantilever ، والتي تنتج الجزء المهيمن من الضوضاء عند إخراج القراءة (المعبر عنها في V) التي ، مضروبة في حساسية الانحراف (المعبر عنها في m /V) وثبات الربيع من cantilever (التعبير عنها في N / m) ، توفر ضوضاء القوة. لإعدادنا ، والضوضاء الجذر مربع (rms) في الهواء في إخراج قراءات ، وعينات في 1000 نقطة / الثانية البيانات (عينة / ق) ، هو ما يقرب من 2 mV. لقياس myofibril نموذجي، يتم استخدام مسبار فيرول الأعلى مع ثابت ربيع من ~ 0.7 نيوتن /م (حساسية انحراف ∼300 نانومتر / V). هذه القيمة rms يتوافق مع قرار انحراف cantilever من 0.6 نانومتر، والذي يترجم إلى حساسية قوة من ~ 0.37 nN. يتم معايرة التحقيق قوة عن طريق دفع غيض من إبرة تصاعد ضد مقياس وزنها مع الحفاظ على الانحناء من cantilever يساوي مضاعف من الطول الموجي من الليزر قراءة13. هذه الطريقة للمعايرة ينطوي على كل من كانتليفر وتصاعد تصلب إبرة فضلا عن الاختلافات الممكنة في عزم الدوران من كانتليفر والإبرة المتصاعدة بسبب سرعة وحجم تقلص myofibril. حاليا ، وإعداد لتقييم myofibril العقد المتاحة ، والذي يقوم على الكشف عن ليزر منحرفة من cantilever ، أي انحراف شعاع البصرية (1700 A ؛ ~ 1 nN القرار قوة). وقد تم تطوير هذا النظام من قبل لابودا وآخرون باستخدام periscope البصرية لتوجيه ضوء الليزر نحو وبعيدا عن كانتليفر في تقييد تكوينات11. في هذا النظام، يتم تركيب myofibril بين كانتليفر القوة الذرية وإبرة زجاجية صلبة. ميزة من النظام الموصوف هنا هي حساسية القوة الأعلى ونسبة الإشارة إلى الضوضاء. وعلاوة على ذلك، في هذا الإعداد، يمكن استخدام كانتيليفس قاسية نسبيا، مما يؤدي إلى انحراف كانتيليفر الصغيرة عندما يتم تطبيق قوة myofibrillar. هذا مهم، لأنه يسمح لقياسات القوة في طول ساركومير ثابت تقريبا. وأخيرا ، بالمقارنة مع النظام الذي وصفه لابودا وآخرون ، فإن النظام هنا يستخدم أساليب مماثلة أو متطابقة للسيطرة على درجة الحرارة ، للحث على تغيرات الطول على myofibril ، وتغيير حلول التسريب باستخدام محرك Ɵ الزجاج وسريع الخطوة. وميزة النظام الذي وصفه لبودا وآخرون هو أن تغيير تركيبة الحل (بين المنظار البصري والبصري) لا يؤثر على إخراج الإشارة. في النظام الموصوف هنا ، يجب أن يبقى تكوين الحل بين الألياف البصرية والألياف البصرية ثابتًا. ويرد أدناه وصف لحل هذا القيد بمزيد من التفصيل.
الامثل
أدى مسبار القوة البصرية في تركيبة مع نظام الضخ السريع الخطوة إلى مضاعفات. الفرق في الخصائص البصرية بين منخفض وعالي التركيز Ca2 + حلول يتداخل مع قياسات القوة. لمنع التدفق الخلفي من محلول الكالسيوم العالي ، تم هندسة غرفة تدفق مخصصة (الشكل 3). يتم حث تدفق الخلفية المستمرة من محلول خال من الكالسيوم من اليمين إلى اليسار للحفاظ على ثابت الحل بين الجزء العلوي من الألياف البصرية و cantilever (الشكل 3D).
للسيطرة على درجة الحرارة، يتم تركيب عنصر بلتيير مع تبريد سائل على غرفة التدفق. يتم فصل غرفة التدفق هذه حراريًا عن المجهر عن طريق تركيبها على محول بلاستيكي. مع عنصر بلتيير، التي يسيطر عليها نظام TEC، فمن الممكن للسيطرة على درجة حرارة الحل مع مرور الوقت مع 0.1 درجة مئوية الدقة. يتم رصد درجة الحرارة بواسطة جهاز استشعار درجة الحرارة التي شنت على غرفة تدفق. استقرار درجة الحرارة مهم نظرا لطبيعة محول القوة. وتتألف النتليفر من شريط زجاجي مطلي بالذهب، مما يجعله ميزان حرارة. وهكذا، فإن كانتليفر ينحني مع تغيرات في درجة الحرارة.
يستخدم الإعداد نظام اضخار سريع الخطوة (انظر جدول المواد)للتحكم في حركة الزجاج Ɵ. هذا النظام يسمح لمفاتيح perfusion داخل 10 مللي ثانية. الجمع بين طريقة التحكم في درجة الحرارة والحلول التبديل يجعل هذا النظام مناسبة بشكل خاص لقياس الحركية من التقلص ساركومير (أي، معدلات تطوير القوة، وإعادة تطوير التوتر، والاسترخاء) في myofibrils.
في البداية، كان الجانب السلبي لاستخدام قياس التداخل هو النطاق الصغير القابل للاستخدام بسبب ضرورة استخدام الجزء الخطي من منحنى التداخل (λ/8، مع كون λ هو الطول الموجي لليزر). ومع ذلك، ألغت الابتكارات الأخيرة هذه الحاجة من خلال الجمع بين تعديل الطول الموجي مع مكبر للصوت القفل في. ولذلك، فإن النظام لا يقتصر على جزء خطي واحد من منحنى التداخل. وهذا يتيح قياس انحراف لانهائي من كانتليفر14. وبالتالي ، فإن نطاق قراءات انحراف الانتراف من هذا النظام هو توسيع كبير بالمقارنة مع قياس التداخل التقليدي. بالإضافة إلى ذلك، فإن مسابير القوة الموصوفة سهلة الاستبدال وهناك العديد من النتيفريسات المتاحة، مع تصلب يتراوح من 0.5 N/m إلى >20 N/m. لذلك، فمن الممكن للتغيير بسرعة بين cantilevers واختيار صلابة الأنسب للتجربة التي أجريت.
التحديات
النظام الحالي هو نموذج أولي يستند إلى نظام قياس عضلة القلب (انظر جدول المواد). يمكن تحسين العديد من المكونات لتوفير تجربة مستخدم أفضل وبيانات ذات جودة أعلى. أولاً، بسبب الإضافات إلى النظام، يمكن أن يكون الاهتزاز والرنين مشكلة من شأنها أن تضيف ضوضاء إلى الإشارة. أيضا، يمكن تحسين حامل Ɵ الزجاج وسريع خطوة السيارات مرفق طريقة لجعلها أقل عرضة للاهتزاز.
ثانيا، من المستحسن أن تحل محل المحرك السريع الخطوة مع المحرك طول بيزو لزيادة سرعة تبديل الحل والحصول على حركة أكثر اتساقا.
ثالثاً، شملت حلول الكالسيوم التي استخدمناها سابقًا لتنشيط ألياف العضلات المفردة حمض البرروبيونيك، ولكن هذه الحلول تمتص ضوء الأشعة تحت الحمراء القريبة، وتتدخل في قياسات القوة. تم استخدام كلوريد الكالسيوم للقضاء على الحاجة إلى حمض البربونيك، مما قلل إلى حد كبير من هذا التأثير. وهذه المسألة متأصلة في نظام قائم على قياس التداخل ولا يوجد عند استخدام انحراف الشعاع البصري.
رابعاً، تم تصميم حمام تدفق مخصص لإنشاء تدفق لارينار، لتتناسب مع تدفق الزجاج Ɵ. وهذا يمنع التدفق الخلفي بسبب اضطراب الحل الغني بالكالسيوم. ولذلك، فإن الحل بين غيض من الألياف البصرية و cantilever لا تزال ثابتة. يمكن للأغطية مع myofibrils التحرك بحرية تحت غرفة التدفق ، وبالتالي ، لا يقتصر اختيار myofibrils مناسبة على مساحة صغيرة من غرفة التدفق.
قابلية التكاثر والتباين
11- وهناك عدة عناصر من النظام والبروتوكول لها أهميتها بالنسبة لدرجة قابلية استنساخ البيانات التي يتم الحصول عليها ومدى تغيرها.
أولاً، نوعية القياسات تعتمد بقوة على جودة عزل الميوفيبيل. بروتوكولات متطابقة تسفر عن صفات وكميات مختلفة من myofibrils من الخزعات المختلفة. في بعض الحالات، الخزعات بالكاد تسفر عن myofibrils قابلة للاستخدام أو لا شيء على الإطلاق. توافق الآراء المشترك هو أن myofibrils التالفة سوف كسر خلال الانكماش ، وبالتالي لا يتم حسابها في النتائج.
ثانياً، هناك عدم يقين في تحديد المنطقة المقطعية في الميوفيريبريل. بسبب القيود التقنية، فمن الممكن لقياس عرض myofibril في طائرة واحدة فقط. ولذلك، لحساب منطقة المقطع العرضي نفترض أن العرض والعمق متساويان. عندما يتم تطبيع القوة إلى منطقة مقطعية لحساب أقصى التوتر النشط، ينبغي للمرء أن يكون على بينة من هذا الافتراض.
تركيب myofibrils بسبب myofibril تصاعد زاوية ، والموقف ، وسلامة الغراء.
على الرغم من أن زاوية التركيب والموضع يمكن التحكم فيه بصريًا إلى حد كبير ، فقد تكون الاختلافات الصغيرة بين myofibrils موجودة. لم يتم التحقيق في سلامة الغراء على نطاق واسع. ومع ذلك، يمكن التحقق من سلامة الغراء من خلال مراقبة طول الساركومير في myofibril قبل وبعد التنشيط. عندما يكون أكثر sarcomeres بين الغراء بعد بروتوكول، وهذا يشير إلى أن انزلاق من myofibril في الغراء قد حدث. وبالتالي، يجب استبعاد هذا myofibril من مجموعة البيانات.
تطبيقات أخرى من الإعداد: تنشيط الكالسيوم في cardiomyocytes معزولة عن البطين الأيسر الفئران
بالإضافة إلى تقييم وظيفة العقد من myofibrils، ويمكن أيضا أن تستخدم النظام لقياس ميكانيكا القلب. على سبيل المثال، يوضح الشكل 11 استخدام خلايا القلب القلبية الوحيدة المميّزة بالأغشية المُنعزلة عن البطين الأيسرالجرذ 21. على عكس التجارب المذكورة أعلاه، تم تغيير حل الاسترخاء وتم الحفاظ على حل تفعيل ثابت. خضعت كل عضلة القلب خمس مجموعات من التنشيط، مما يعرضها لمحلول الكالسيوم 2 μM مجاناً لمدة 1 s. يتم اختيار قيد الوقت 1 لتقليد الطبيعة المحدودة زمنيا من تقلصات القلب، حيث التعرض لحلول تركيز الكالسيوم منخفضة يحاكي المرحلة الانبساطي والتعرض لحلول تركيز الكالسيوم عالية يحاكي المرحلة الانقباضي من تقلص عضلة القلب(الشكل 11A). وبالنسبة لكل مجموعة من خمس مجموعات، كان الكالسيوم الانبساطي متنوعاً (1، 80، 160، 250، و400 ن م) الكالسيوم)، بينما بقي الكالسيوم الانقباضي ثابتاً (الشكل 11A). وتألفت المجموعة من مجموعتين من ثلاث دورات تنشيط واسترخاء بمعدل 1.8 ميكرومتر مقابل 2.0 ميكرومتر و2.0 ميكرومتر مقابل 2.2 ميكرومتر لمجموعات تجريبية مختلفة. تم قياس قوة الذروة في 1 s من تبديل الماصة ومتوسط لمجموعة من ثلاث دورات التنشيط والاسترخاء. نسبة الإشارة إلى الضوضاء العالية والمدى الديناميكي العالي لمحول القوة هذا سمح لنا بقياس كل من التغيرات الصغيرة في القوة الانبساطية والقوى الانقباضية الأكبر بكثير (الشكل 11B). أدى زيادة الكالسيوم الانبساطي في قوة أعلى في 2 ميكرومتر الكالسيوم نسبة إلى التنشيط الأول (الشكل 11B). تمت مقارنة WT الفئران cardiomyocytes مع heterozygous (HET) RMB20 الفئران cardiomyocytes. بسبب الربط البديل، فئران HET لديها بروتين الثدي أكثر توافقا بالمقارنة مع الفئران WT. وكان تأثير مبالغ فيها في أمراض القلب HET في 80 و 160 μM الكالسيوم(الشكل 11C).
Disclosures
ميشال هيلمز هو المساهم والمالك المشارك لشركة IONOptix Inc.
Acknowledgements
تم تمويل هذا المشروع من قبل AFM-Telethon وقوة بناء مؤسسة لـ Nemaline Myopathies. يرغب المؤلفان في الإشادة بمبتكر المنتجات المذكورة في هذه المقالة، IONOptix Inc.
Materials
| Name | Company | Catalog Number | Comments |
| Bio Spec Products, Inc. | 985370-XL | To isolate myofibrils | |
| Custom coded | Matlab | ||
| Custom fabricated | Includes Labview program to control over serial connection; To control valves | ||
| Custom fabricated | To cool the Peltier module | ||
| Custom fabricated | |||
| Custom fabricated | Aluminum tissue chamber | ||
| Custom fabricated | To control the valves; Includes PC software to control over USB | ||
| IonOptix | System controller software: data recording software with advanced signal generator for piezo and fast-step | ||
| IonOptix | MCS100 | To record sarcomere length | |
| IonOptix | Includes: Optiforce (interferometer), Micromanipulators, Signal interface, Piezo motor and controller. Based on the MyoStretcher | ||
| IonOptix | Force probe | ||
| Koolance | ADT-EX004S | ||
| Koolance | EX2-755 | To cool the Peltier module | |
| Microsoft | Data registration | ||
| Olympus | IX71 | ||
| Olympus | TH4-200 | ||
| Sigma-Aldrich | 529265 | Poly(2-hydroxyethyl methacrylate); Coating for microscope slides to prevent sticking of tissue | |
| Sigma-Aldrich | 78471 | Crystals to dissolve in ethanol resulting in glue | |
| TE Technology, Inc. | TE-63-1.0-1.3 | To cool the tissue flow chamber | |
| TE Technology, Inc. | TC-720 | Includes PC software to control over USB | |
| Tecan Trading AG | 20736652 | ||
| Tecan Trading AG | 20739263 | Syringe pump to induce backgroundflow together with fast-step perfusion system; Outflow from tissue flow chamber | |
| Thermo scientific | 2441081 | ||
| Warner Instruments (Harvard Bioscience, Inc.) | Discontinued | Alternative: SF-77CST/VCS-77CSP | |
| Warner Instruments (Harvard Bioscience, Inc.) | TG150-4 | To perfuse the tissue | |
| 1 PC for IonWizard and 1 PC for other software |
References
- Winter, J. M., Ottenheijm, C. A. C. Sarcomere Dysfunction in Nemaline Myopathy. J. Neuromuscular. Disease. 4, 99-113 (2017).
- Colomo, F., Piroddi, N., Poggesi, C., te Kronnie, G., Tesi, C. Active and passive forces of isolated myofibrils from cardiac and fast skeletal muscle of the frog. Journal of Physiology. 500, 535-548 (1997).
- Kulke, M., et al. a major source of myofibrillar stiffness in Drosophila indirect flight muscle. Journal of Cell Biology. 154, 1045-1057 (2001).
- Stehle, R., et al. Isometric force kinetics upon rapid activation and relaxation of mouse, guinea pig and human heart muscle studied on the subcellular myofibrillar level. Basic Research in Cardiology. 97, 127-135 (2002).
- Iorga, B., et al. Micromechanical function of myofibrils isolated from skeletal and cardiac muscles of the zebrafish. Journal of General Physiology. 137, 255-270 (2011).
- Ribeiro, P. A. B., et al. Contractility of myofibrils from the heart and diaphragm muscles measured with atomic force cantilevers: Effects of heart-specific deletion of arginyl-tRNA-protein transferase. International Journal of Cardiology. 168, 3564-3571 (2013).
- Joureau, B., et al. Dysfunctional sarcomere contractility contributes to muscle weakness in ACTA1-related nemaline myopathy (NEM3). Annals of Neurology. 83, 269-282 (2018).
- de Souza Leite, F., Minozzo, F. C., Altman, D., Rassier, D. E. Microfluidic perfusion shows intersarcomere dynamics within single skeletal muscle myofibrils. Proceedings of the National Academy of Sciences of the United States of America. 114, 8794-8799 (2017).
- Shalabi, N., Cornachione, A., de Souza Leite, F., Vengallatore, S., Rassier, D. E. Residual force enhancement is regulated by titin in skeletal and cardiac myofibrils. Journal of Physiology. 595, 2085-2098 (2017).
- Cornachione, A. S., Leite, F., Bagni, M. A., Rassier, D. E. The increase in non-cross-bridge forces after stretch of activated striated muscle is related to titin isoforms. American Journal of Physiology - Cell Physiology. 310, 19-26 (2016).
- Labuda, A., Brastaviceanu, T., Pavlov, I., Paul, W., Rassier, D. E. Optical detection system for probing cantilever deflections parallel to a sample surface. Review of Scientific Instruments. 82, 013701 (2011).
- Chavan, D., et al. Ferrule-top nanoindenter: an optomechanical fiber sensor for nanoindentation. Review of Scientific Instruments. 83, 115110 (2012).
- Beekmans, S. V., Iannuzzi, D. A metrological approach for the calibration of force transducers with interferometric readout. Surface Topography: Metrology and Properties. 3, (2015).
- van Hoorn, H., Kurniawan, N. A., Koenderink, G. H., Iannuzzi, D. Local dynamic mechanical analysis for heterogeneous soft matter using ferrule-top indentation. Soft Matter. 12, 3066-3073 (2016).
- Winter, J. M., et al. KBTBD13 is an actin-binding protein that modulates muscle kinetics. Journal of Clinical Investigation. , (2019).
- Winter, J. M., et al. Mutation-specific effects on thin filament length in thin filament myopathy. Annals of Neurology. 79, 959-969 (2016).
- Ottenheijm, C. A. C., et al. Deleting exon 55 from the nebulin gene induces severe muscle weakness in a mouse model for nemaline myopathy. Brain. 136, 1718-1731 (2013).
- Ribeiro, P. A., et al. Contractility of myofibrils from the heart and diaphragm muscles measured with atomic force cantilevers: effects of heart-specific deletion of arginyl-tRNA-protein transferase. International Journal of Cardiology. 168, 3564-3571 (2013).
- Pinniger, G. J., Bruton, J. D., Westerblad, H., Ranatunga, K. W. Effects of a Myosin-II Inhibitor (N-benzyl-p-toluene Sulphonamide, BTS) on Contractile Characteristics of Intact Fast-twitch Mammalian Muscle Fibres. Journal of Muscle Research and Cell Motililty. 26, 135-141 (2005).
- Stehle, R., Krüger, M., Pfitzer, G. Force kinetics and individual sarcomere dynamics in cardiac myofibrils after rapid Ca(2+) changes. Biophysics Journal. 83, 2152-2161 (2002).
- Najafi, A., et al. End-diastolic force pre-activates cardiomyocytes and determines contractile force: role of titin and calcium. Journal of Physiology. 597, 4521-4531 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.