Method Article
使用纳米-牛顿分辨率力转换器从骨骼肌肉活检中隔离肌异物并确定收缩函数
摘要
此处介绍的是一个协议,用于评估具有纳米-牛顿分辨率的条纹肌肉肌异半孔的收缩特性。该协议采用基于干涉测量的光学力探头的设置。此设置生成具有高信噪比的数据,并可评估 myofibril 的收缩动力学。
摘要
条纹肌肉细胞对于人类和动物的活动是必不可少的。单肌肉纤维由肌纤维组成,由连续相连的沙康鱼组成,这是肌肉中最小的收缩单位。沙康功能障碍导致沙康蛋白编码基因突变的患者肌肉无力。对肌磷酸酯力学的研究允许在测量单肌肉纤维的收缩性时,评估行为素-肌素相互作用,而不会产生受损、相邻的肌纤维的潜在混淆效应。肌黄体的极端结构损伤和错位可能导致收缩受损。如果肌黄热动物存在结构损伤,则在隔离过程中或实验期间,它们可能会断裂。此外,在肌磷动物的研究提供了在沙康的几何约束存在的情况下对行为-肌素相互作用的评估。例如,肌纤维的测量可以阐明肌纤维功能障碍是否是沙康蛋白突变的主要影响。此外,由于肌黄磷的直径小,钙溶液或化合物的灌注几乎是瞬间的。这使得肌黄种人非常适合测量力生产期间的激活和放松率。本文所述的协议采用基于法布里-佩罗特干涉仪原理的光学力探头,该干涉仪能够测量纳米牛顿范围内的力,并结合压电长度电机和快速步进灌注系统。此设置使肌黄种力力学能够研究高分辨率力测量。
引言
条纹肌肉细胞是日常生活活动不可缺少的。肢体运动、呼吸功能和心脏的泵送运动依赖于肌肉细胞产生的力。骨骼肌由包含一束单肌肉纤维的肌肉分册组成(图1A)。这些肌肉纤维由肌纤维组成,由连续连接的沙球组成(图1B,D)。沙康鱼含有薄而厚的细丝。这些主要由活性素和米奥辛分子链组成(图1B)。行为-肌素相互作用负责肌肉的产生力的能力。编码为沙康蛋白的基因突变的患者,如内布林、奥平和肌蛋白T,由于收缩功能障碍1而出现肌肉无力。
肌肉收缩的质量可以在组织的各个层面研究,从体内整个肌肉到体外运动性测定中的行为-肌素相互作用。在过去的几十年里,几个研究小组已经开发出一些装置,以确定个体肌黄种人,2,3,4,5,6,7,8,9,103,7,8,9,的合同性。4,5,62这些设置基于检测由肌黄种枪收缩引起的悬臂(即光束偏转)的激光偏转变化(详情见 Labuda 等人11)。虽然确定肌黄体联的收缩函数有一些局限性(例如,在肌黄种体上游的激励-收缩耦合过程的动态是缺乏的),但这种方法具有多种优点。其中包括:1) 在沙康人几何约束的情况下评估行为-明辛相互作用的能力;2) 评估行为-肌素相互作用的能力,而不对受损的相邻肌纤维的潜在混淆影响(当测量单肌肉纤维超结构损伤和肌纤维错位时,可能导致收缩性受损)(图1D);3) 肌纤维的小直径(±1 μm,图2A)和缺乏膜允许几乎瞬间钙扩散到沙状物。此外,如果肌黄种人存在结构损伤,它们很可能在隔离期间或实验期间断裂。因此,评估肌纤维收缩是研究肌肉收缩的基本机制,并了解干扰行为-肌蛋白相互作用是否是由沙康蛋白突变引起的肌肉疾病的主要原因的优雅方法。
该协议提出了一个新开发的设置,以确定肌纤维的收缩性,其中结合了具有纳米牛顿分辨率的悬臂力探头(即Opiforce)。该力探针基于干涉测量原理。干涉测量允许使用相对僵硬的直性插性。这使得测量力与悬臂的小偏转,接近等轴测收缩的肌醇。该探头允许评估低被动和主动力,由从不同的肌肉活检分离出的单个肌黄素和主动力,包括来自人类受试者的活检,具有很高的信号与噪声比。此设置中集成的光学悬臂力探头基于 Fabry-Pérot 干涉仪12。干涉仪可检测光纤与安装在铁杉上的镀金悬臂之间的小位移(图3)。光纤和悬臂之间的间隙称为法布里-佩罗腔。使用两种胶涂层玻璃安装纤维安装在探头和压电电机之间。肌异的力可以从干涉仪数据中数学上产生。干涉测量基于两个或两个多波的叠加或干扰(在此设置中,三个光波)。波长在 1,528.77~1,563.85 nm 之间的激光从干涉仪发射并通过光纤发送。在探头中,光在光纤和介质之间的接口上反射1(图3A);2) 在介质和悬臂的接口(图3B);和3)在悬臂的金属和黄金涂层之间的接口(图3C)。接口 A 和 B 上的反射取决于探头被淹没介质的折射率 (n)。光线由三个叠加反射组成,返回干涉仪中的光电二极管。光电二极管测量光的强度,这是三个叠加反射的干扰模式的结果。当通过激活或拉伸肌黄种人产生收缩力时,肌骨力会拉上悬臂。此运动更改型腔大小(d), 因此更改适合型腔的波长数。悬臂反射的光将具有不同的相位,从而产生不同的干扰模式。光电二极管将干扰模式强度的这种变化记录为伏特的变化。随后,考虑到悬臂刚度,根据这种变化计算了肌黄热化力生成。力探针由制造商通过推动安装针的尖端,连接到悬臂的自由手端,对称量秤,同时保持悬臂的弯曲等于读出激光13波长的倍数。因此,干涉测量是一种高度敏感的方法,用于检测距离的小变化,从而能够测量纳米牛顿分辨率的力。此分辨率能够评估具有高信噪比的 myofibrillar 力生产。虽然传统的干涉测量将测量范围限制在干涉曲线的线性部分,但使用锁定放大器和激光波长调制克服了这一限制14。这一点在讨论部分进行了更详细的解释。
为了测量肌磷气活性张力,采用了快速灌注系统,使肌磷酸化液暴露在钙溶液中(图4A)。快速步进灌注系统可在 10 ms 内进行溶液更改。由于其直径小,钙扩散到肌磷几乎瞬间。因此,该系统特别适合测量激活期间和放松期间释放的机蛋白-明蛋白结合率。激活速率 (kACT)和松弛 (kREL) 可以从激活松弛曲线中确定。此外,通过将肌磷暴露给浓度增加的钙溶液,可以确定力-钙关系和钙敏感性。
此外,压电长度电机能够快速拉伸和缩短肌黄种人。这提供了研究肌黄油的粘弹性特性(即被动张力)的可能性,以及执行快速缩短和重新拉伸的肌黄油,以确定张力重建的速度(kTR)。从主动和被动张力实验中检索到的参数可以通过沙康蛋白中的基因突变来改变。
此定制设置用于测量与健康人、患者和小鼠骨骼肌分离的肌纤维的主动和被动收缩特性。
研究方案
获得人类活检的议定书由VU大学医学中心机构审查委员会(#2014/396)批准,并获得受试者的书面知情同意。获得动物肌肉活检的议定书得到了VU大学当地动物伦理委员会(AVD114002016501)的批准。
1. 准备和肌黄种人隔离
注:使用前面描述的方法甘油活检,准备不同的钙浓度(pCa)溶液7,7,16,17,,17并分离肌磷酸盐,2,18。
- 解冻放松 (pCa 9.0, Rx) 和激活 (pCa 4.5, Act) 解决方案以及抑制剂 (1 M E64, 1 M DTT, 1 M leupeptin, 1 M PMSF), 存储在 -80 °C。
- 以一块约 1 mm3 的甘油肌肉活检,用 1:1 Rx/甘油 (v/v) 溶液将培养皿放在小培养皿中,并在 4 °C 的冷盘上放置 Petri 盘。
- 使用解剖显微镜和钳子解剖肌肉,分离单个肌肉纤维,而不将它们与肌肉分离。
注:去除尽可能多的脂肪和结缔组织,以防止肌黄油悬浮液的污染。 - 将解剖组织转移到 5 mL 管中,使用 1.5 mL 的放松溶液(1 μL/mL E-64、1 μL/mL leupeptin、1 μL/mL DTT 和 125 μL/mL PMSF)。让组织在大约 4 °C 下调和 1 小时。
- 在孵育过程中,启动两台 PC,打开设备,然后打开相关软件( 参见材料表)。
- 将力探头淹没在培养皿中的超纯水中,并校准探头。
- 按干涉仪上的"开始向导",然后按照屏幕上的说明操作。按" 校准"后,轻点显微镜阶段。
注:在显微镜阶段点击将导致悬臂偏转并通过边缘。这样可以校准探头。 - 校准后,将探头浸入培养皿中的超纯水中。
- 按干涉仪上的"开始向导",然后按照屏幕上的说明操作。按" 校准"后,轻点显微镜阶段。
- 初始化压电电机位置。为此,请按照下面详细步骤之一操作。
- 当压电电机用于 k TR 张力时 ,将长度设置为 0 μm。
信号发生器设置见表1,图5A。 - 当压电电机用于无源张力时,将长度设置为 50 μm。
信号生成器设置见表 1。
注:步骤之间的区别在于压电长度电机的初始位置。为了拉伸肌黄种人,压电电机需要拉,以增加安装针之间的距离,并延长肌黄气。为了松弛肌黄,压电电机需要推动以缩短安装针头之间的距离,并缩短肌黄布里。
- 当压电电机用于 k TR 张力时 ,将长度设置为 0 μm。
- 准备显微镜幻灯片。在显微镜幻灯片上移液 150 μL 聚羟基乙酰丙烯酸酯 (聚 HEMA) 溶液(95% 乙醇中的 5% 聚 HEMA,w/v),并铺在幻灯片上,以便全部覆盖。
注:如果肌黄油悬浮液在未涂覆的显微镜幻灯片上管用,则沉入底部的肌黄油悬浮液将粘在显微镜幻灯片上,并且无法粘合它们。 - 用 pCa 溶液填充注射器(参见 图 4A),并填充灌注系统。
注:在这些步骤中,所有管都预加适当的溶液,以确保从油管中去除所有气泡。- 用 Rx 填充流室背景流的流入管 (图 3, 4A) 流入.
- 使用时,用超纯水冲洗歧管以排出空气。为此,将带超纯水的注射器连接到出口,然后朝相反方向冲洗。阻止歧管的未使用端口。
- 使每个 pCa 注射器用 pCa 溶液填充各自的管子。然后,将它们连接到歧管和Ɵ玻璃。
- 使用数据采集面板软件打开阀门 1 和 6(参见材料表),通过检查按钮"1+6"(图 6A),在填充 Ɵ 玻璃时用放松 (pCa 9.0) 填充 Ɵ 玻璃,并在 Ɵ 玻璃填充时激活 (4.5) 溶液和阀门(图 6B)。
2. 安装肌方面
- 用聚 HEMA 涂上显微镜幻灯片,以防止肌纤维粘在玻璃上。
- 准备均质器( 参见材料表)进行组织均质化。用干净的纸巾清洁内部转子杆,组装均质器,在酒精中旋转 1x 15 s,在超纯水中旋转 15 s,每次旋转 15 s。在冰面上将均质器预加 1 x 15 s 的放松溶液中。
- 将均质棒放在含有肌肉组织的管子中,如步骤1.4所述,在将管子放在冰上时,在速度5上旋转转子15 s,以撕裂肌肉组织并获得肌纤维悬浮液。
- 在组织浴中涂有聚 HEMA 的显微镜幻灯片上涂有聚 HEMA 的移液器 ±50 μL 的肌黄油悬浮液悬浮液和 ±250 μL 的放松溶液。这将形成液体滴。用盖子盖住浴缸,防止灰尘,等待 5-10 分钟,让肌油沉入底部。
注:悬架和放松解决方案之间的比率取决于隔离的质量,因此,相应地进行调整。例如,如果肌黄叶布里尔产量低,而悬浮液中几乎没有合适的肌黄叶布里,则添加更多的肌黄叶布里勒悬浮液,用不太放松的溶液稀释(例如,75μL 的 myofibril 悬浮液和 225 μL 的放松溶液)。心脏和骨骼肌组织很容易识别,由于其条纹模式。使用 10 倍或 40 倍目标,此模式在单个 myofibril 中也可见。如果悬浮液中存在其他组织,可以在视觉上选择肌黄热气。可以跳过 5~10 分钟的等待。然而,这增加了粘合肌黄素的难度。 - 用胶水涂覆安装针头(壳体 + 乙醇;120毫克贝壳,2 mL 70% 乙醇)。为此,在 65°C 下加热胶水 30~60 s,并在新的未涂覆玻璃滑梯上加热移液器 ±6 μL。将每个安装针的尖端浸入胶水中,重复,直到可见一层胶水。使用微操纵器将探针向上垂直移动并压上,以使组织浴在显微镜舞台上放置空间。拆下含有胶水的玻璃滑梯。
- 安装肌方面
- 将组织浴与显微镜幻灯片涂有含有肌黄油悬浮液的多 HEMA 放在显微镜舞台上。使用舞台找到一个合适的肌黄种人与40倍的目标。如有必要,移动并旋转组织浴,将肌黄油移动到可安装位置。
注:查找具有大约 30 μm 的可见条纹图案的肌异叶。如步骤 3.1 和 3.2.1 中所述,在粘合 myofibril 之前,可以检查长度和沙康长度。不要粘住撕裂的肌黄种人,因为这些在收缩过程中可能会破裂。 - 将流室直接滑入含有组织浴中的肌黄油的液体滴上方(在步骤 2.4 中滴入幻灯片),然后将其降低。在它击中液体掉落之前停止。
- 放下压电安装针,按压在肌黄种人的底部尖端。稍微抬起它,检查肌黄种人是否附着在针头上。
- 降低流室,使探头的安装指针在不接触流室的情况下到达底部。
- 按探针的安装针在肌黄种人顶端。稍微抬起它,检查肌黄种人是否附着在针头上。
- 尽可能从浴缸底部提起肌纤维,而不会失去对焦能力,而不会在目标接触玻璃底部的情况下进行对焦。
- 将组织浴与显微镜幻灯片涂有含有肌黄油悬浮液的多 HEMA 放在显微镜舞台上。使用舞台找到一个合适的肌黄种人与40倍的目标。如有必要,移动并旋转组织浴,将肌黄油移动到可安装位置。
3. 初始化实验
- 使用微操纵器、相机和系统控制器软件(图7A,见材料表)测量沙康长度。将压电和/或力探针移至 2.5 μm,将肌黄热化的初始沙母长度设置为 2.5 μm。
注:2.5 μm 的沙康长度可确保 myosin 头和行动素之间的最佳重叠。 - 使用系统控制器软件的容器功能测量肌纤维的长度和宽度(图7B,C)。C
注:旋转摄像机时,摄像机可能会水平和/或垂直倾斜。要检查摄像机的对齐方式,可以使用精神级别来验证摄像机是否旋转且未倾斜。- 使用显微镜阶段将肌黄子分析放在视频图像的中心。
- 从肌的一侧向另一侧画一个正方形。对于长度,请确保在正方形中包括胶滴的暗边(图2A),因为图像处理基于对比度。
- 开始记录系统控制器软件中的数据( 参见材料表),按"开始",5点暂停后,通过按下"暂停"按钮记录系统控制器软件数据。长度现在记录在数据中。
- 对于宽度,首先旋转相机 90°( 参见材料表),然后使用 myofibril 本身边缘的对比度。
- 通过按"开始"开始,开始记录系统控制器Table of Materials软件中的数据(参见材料表),并在 5 点暂停后按"暂停"按钮记录系统控制器软件数据。宽度现在记录在数据中。
- 如果需要确定肌黄种的主动张力,需要使用灌注设置。如果是这样,请继续执行步骤 3.4。如果只确定被动张力,跳过步骤 3.4=4.1.3.7 并继续执行步骤 4.2。
- 定位并初始化灌注设置。
注:这仅对产生主动力是必要的。执行被动张力实验时,请继续执行步骤 4.2。- 将快步电机位置设置为 4 V(图 5B)。
- 滑动桌子上的灌注支架,使支架的左下角与桌子上的胶带对齐。
注:注意不要撞到力探头或压电电机。 - 使用操纵器将玻璃Ɵ用眼睛大致定位。
- 透过目镜,小心地Ɵ用操纵器将玻璃推向肌纤维。
- 使用机械手将 Ɵ 玻璃的顶部通道与 myofibril 对齐,然后通过执行快速步骤(信号发生器设置,见表 1)与系统控制器软件(图 2B+C,–C参见材料表)检查位置。
注:确保底部通道在快速步骤的激活阶段与肌纤维对齐(图 2B+C)。
- 打开 Rx 的背景流 (图 4A)以在流室中创建层压背景流。
注:背景流是必要的,以防止湍流由于pCa溶液流从Ɵ玻璃。- 使用 Luer 阀杆打开流量室的流入。
- 向流出泵发送以下参数,以开始排空流量室并防止流舱溢出(图 9):阀 = 沐浴阀 (2);微步模式 = 微步模式;柱塞目标 = 48,000;柱塞速度 = 38×40(任意)。
注:确保液位一直稳定。肌骨不应干涸,悬臂也不应运行。有一点溢出比流太少好。
- 向流出泵发送以下参数,以开始排空流量室并防止流舱溢出(图 9):阀 = 沐浴阀 (2);微步模式 = 微步模式;柱塞目标 = 48,000;柱塞速度 = 38×40(任意)。
- 使用 Luer 阀杆打开流量室的流入。
- 要使用热电温度控制器将温度设置为所需值(图 8,参见材料 表),请输入所需温度并按"开始"。通过检查热电温度控制器软件中的图形,等待达到所需温度并继续。
注:在室温下进行实验时,不必使用热电温度控制器。
4. 实验协议
- 确定需要执行哪些主动力协议。
注:根据研究所需的数据,可以进行多种类型的主动力实验:步骤4.1.1,测量饱和时的最大力[Ca]2°];步骤 4.1.2,获取 Force-pCa 曲线,以确定除步骤 4.1.1 之外的钙敏感性;步骤 4.1.3,除步骤 4.1.1 或 4.1.2 外,还通过执行缩短恢复协议来确定紧张重建速率。- 测量最大主动力。
- 通过按"开始"开始,开始记录 系统控制器软件中的数据(参见材料表)。
- 通过检查按钮"1+6"打开带数据采集Table of Materials面板的阀门1 和 6(参见材料表)软件,以启动放松解决方案的 Ɵ 玻璃流,并通过 Ɵ 玻璃激活解决方案(图 6A)。
- 重置干涉仪的范围,通过在干涉仪上选择并按压"重置范围",使基准力为 0 V( 参见材料表)。
- 当力轨迹稳定时,执行Ɵ快速步进(步进尺寸 = 100 μm)。
信号发生器设置见表1(图5C)。将在系统控制器软件中记录和显示类似于图4D的激活松弛跟踪。 - 按下"暂停"按钮暂停系统控制器软件数据记录。
- 如果不再执行激活,请通过取消选中按钮"1+6"(图6B)关闭阀1 和 6以停止 Ɵ 玻璃流量,通过按"终止"来停止注射器泵(图 9,参见材料表),通过关闭 Luer 阀停止背景流量。
- 力-pCa 曲线
注意:这与步骤 4.1.1 类似,用于获得最大主动力,但使用不同的 pCa 解决方案进行多次激活。- 开始记录系统控制器软件中的数据,按"开始"。
- 打开阀门 1 和 2 与数据采集面板软件启动流放松解决方案和 pCa 6.2 通过Ɵ玻璃。
- 通过选择并按干涉仪上的"重置范围",使干涉仪的复位范围为 0 V。
- 当力轨迹稳定时,执行Ɵ快速步进(步进尺寸 = 100 μm)。
信号生成器设置见表 1。 - 按下"暂停"按钮暂停系统控制器软件。
- 对于阀 1 和 3(pCa 5.8)、阀 1 和 4(pCa 5.6)、阀 1 和 5(pCa 5.4)以及阀 1 和 6(pCa 4.5)重复步骤 4.1.2.1=4.1.2.4。
- 如果不再执行激活,关闭阀 1 和 6,通过取消选中按钮 "1+6" (图Terminate6A),通过按下"终止"停止注射器泵 (图 9),通过关闭 Luer 阀停止背景流量,停止 Ɵ 玻璃流。1+6
- 测量张力重建率 (kTR)。
注意:这类似于步骤 4.1.1 的最大主动力,但有一些更改和添加的步骤。- 计算松弛 myofibril 15% 所需的压电运动,并在信号生成器中输入此值(图 5D,表 1)。
- 按"开始"开始,开始记录系统控制器软件中的数据。
- 打开阀门1和6与数据采集面板(图6A)软件启动流动的放松解决方案和pCa 4.5通过Ɵ玻璃。
- 通过选择并按干涉仪上的"重置范围",使干涉仪的复位范围为 0 V。
- 当力轨迹稳定时,执行Ɵ快速步进(步进尺寸 = 100 μm)。
信号生成器设置见表 1。 - 当达到力高原时,使用压电执行缩短恢复。
信号发生器设置可以在 中找到(图 5D,表 1)。将在系统控制器软件中记录和显示类似于图4E的激活松弛跟踪。
注:可以制定自定义协议来自动执行上述步骤。 - 按下"暂停"按钮暂停系统控制器软件。
- 如果不再执行激活,关闭阀 1 和 6,通过取消选中按钮 "1+6" (图Terminate6B),通过按下"终止"停止注射器泵 (图 9),通过关闭 Luer 阀停止背景流量,停止 Ɵ 玻璃流量。1+6
- 测量最大主动力。
- 执行无源力测量。
- 执行连续拉伸。
- 计算拉伸肌黄种人所需的压电运动,并在信号发生器中输入此值(表1)。
注意:这些是示例设置。计算相对于沙彗线长度的拉伸量和拉伸时间。这些设置是必要的,以确保每个sarcomere的拉伸速度在肌科里保持相等。 - 按"开始"开始,开始记录系统控制器软件中的数据。
- 通过选择并按干涉仪上的"重置范围",使干涉仪的复位范围为 0 V。
- 在系统控制器软件中使用信号发生器执行连续拉伸以操作压电。可以在表 1 中找到信号 发生器设置示例。
- 拉伸完成后,将肌黄种轮缩短为压子的松弛长度(表1)。
- 计算拉伸肌黄种人所需的压电运动,并在信号发生器中输入此值(表1)。
- 执行逐步拉伸。
- 按"开始"开始,开始记录系统控制器软件中的数据。
- 通过选择并按干涉仪上的"重置范围",使干涉仪的复位范围为 0 V。
- 使用系统控制器软件中的信号发生器执行逐步拉伸以操作压电。示例信号发生器设置见表1(图 5E)。
- 伸展完成后,将肌黄种人缩短为压电的松弛长度。可以在表 1 中找到信号 发生器设置示例。
- 执行连续拉伸。
- 按下"暂停"按钮暂停系统控制器软件。
- 按下系统控制器软件中的"停止"按钮,停止记录数据。
- 在系统控制器软件中按"文件"和"保存数据"来保存数据。
5. 清洁
- 取出测量的肌黄子,为下一个肌黄种人做准备。
- 为此,小心地撕下肌黄种人,同时用40倍的视点看。
- 向上移动力探头和压电。向上Ɵ玻璃一直向上,到右侧和背面。然后向上移动并滑离流室。取出组织浴。
- 要清洁安装针头,请使用 10 倍和眼部对焦。将刷子浸入乙醇中,小心地刷掉,从针头上取下胶水。
注意:请记住,胶水脱落可能需要一些时间。 - 用超纯水冲洗流室和组织浴。
- 将探针放在装满超纯水的小培养皿中。确保探头完全淹没。
- 实验完成后,请按照上述步骤清洁设置,并执行以下附加步骤。
- 从流浴中清空油管。将参数发送到流出注射器泵(参见材料表,图 9)。阀 = 沐浴阀 (2);微步模式 = 正常;柱塞目标 = 0;柱塞速度 = 30。
注:当油管为空时终止该命令。 - 多次初始化泵(图9B)。
- 排空注射器。为此,关闭所有 Luer 阀,打开所有阀门,从注射器的针头上拆下管子,将特定 pCa 的管放在针头下,然后打开 Luer 阀。使用压力塞加快流程。
- 将管子重新插入注射器的针头。用 +5 mL 的超纯水填充注射器。将杯子放在Ɵ玻璃下面。打开所有阀门并打开压力阀以冲洗系统。
- 关闭系统。关闭 PC、干涉仪和压电控制器电源块。
- 从流浴中清空油管。将参数发送到流出注射器泵(参见材料表,图 9)。阀 = 沐浴阀 (2);微步模式 = 正常;柱塞目标 = 0;柱塞速度 = 30。
6. 数据分析
- 通过打开数据文件并选择所需的段 ,将数据跟踪从系统控制器软件(参见材料表)导出到电子表格软件程序或剪贴板。显示的轨迹将导出(例如,原始力、沙康长度和压电位置)。
- 使用您选择的软件(例如 MATLAB)执行分析。
结果
使用系统控制器软件记录并打开数据跟踪( 参见材料表)。将完整的跟踪或选定的段导出到剪贴板或文本文件,以使用所需的软件进行进一步分析。使用自定义软件或手动切换用于控制不同解决方案流量的阀门。自定义 MATLAB 脚本用于分析激活、张力重新生成和放松的速率。被动力实验的最大主动力和峰值及高原力直接取自系统控制器软件力轨迹。安装肌黄种人(图2)后,选择了所需的协议。
最大活性力和钙-从小鼠和人类骨骼肌活检中分离出的肌骨力的敏感性
在 图4A 中,对用于主动力实验的实验设置进行了示意图。显示从健康的人类四头肌分离出的肌骨力实验的力痕迹。myofibril 被激活了 5 次,其解决方案具有不同的 pCa(pCa 6.2、5.8、5.6、5.4、4.5;如图 4B 所示的数据)。在这个实验中,所有肌黄种人的平均最大力为+123 mN/mm2。在五个钙溶液中,每次激活过程中达到的高原力构造了力-pCa 曲线。结果如图 4C所示。从该曲线计算了最大力产量 (pCa50) 的pCa 。在这个 myofibril, pCa50 是 5.75 。
此外,一种或多种化合物可以添加到挥发溶液中,以测量其对肌黄油产生的力的影响。在 图4D中,说明N-苯基-p-硫磺胺(BTS)的作用,这是一种快速抽搐肌肉(II型)肌素重链II(MHCII)抑制剂。19 a myofibril 首先使用 pCa 5.6 解决方案激活,随后使用 pCa 5.6 + Bts 解决方案激活。在第二次激活期间,产生的力较小,表明这是含有MHCII的肌黄体。蛋白质中存在完全存在于特定肌肉类型的突变,因此只影响特定肌肉类型的肌纤维。在这种情况下,"键入"肌纤维很重要,以识别突变对各种肌肉类型的突变影响。此外,此示例说明了在肌黄体中测试治疗化合物的功效的可能性。
图4E 显示了从小鼠骨骼底肌组织分离出的单个肌黄纤维的活性力痕迹。myofibril 安装在设置中,并注入放松溶液 (pCa 9.0),然后用激活溶液灌注 (pCa 4.5, ±0.032 mM 钙)。我们同时记录了力和讽刺长度。这是一个近乎等轴的收缩,因为悬臂偏转为±0.5 μm,约为肌异半松弛长度(±50μm)的1%。在 图4E 中,在主动收缩期间执行了快速缩短-恢复性协议,以评估张力重建的速度(kTR,黄色虚线)。kTR 是跨桥循环动力学的度量。此外,激活曲线和松弛曲线分别用于确定激活率(kACT、红色虚线)和松弛(kREL、绿色虚线)。 图4 显示了图4F中突出显示的松弛 阶段的更详细的视图。两个阶段变得明显: 1) 放松的初始缓慢阶段 (由跨桥分离为主) 和 2) 快速放松阶段 (由跨桥分离和钙分离为主)20。
从人类骨骼肌活检中分离出肌骨骼的被动力
图10 显示了从健康的人体隔膜肌肉组织分离出肌黄纤维的被动力实验的痕迹。第一个协议涉及一个或多个被动拉伸,以确定沙康的粘弹性特性。 图 10 显示了肌黄种鱼连续拉伸的力迹(从沙康长度 2.2~3.0 μm 拉伸)。在伸展过程中,肌纤维同时表现出粘性和弹性特性。这从图 10A所示的曲线中可以明显看出。峰值代表两个特征,而高原力是弹性的度量。粘度可线性抵抗应变。因此,在应变被移除后,力下降。 图 10B 突出显示拉伸本身,并说明了高信噪比。请注意,力跟踪是未筛选的。

图1:骨骼肌及其形态的示意图描述和电子显微镜图像。(A) 显示骨骼肌的结构,( B) 显示最小的收缩单位——沙康的结构。这些示意图图像改编自塞尔维耶医学艺术(C) 显示单个肌肉纤维的图像和 (D) 显示肌肉纤维的电子显微镜图像,显示肌骨力损伤以及保存的肌骨纤维超结构。 请单击此处查看此图的较大版本。

图 2:显示安装肌纤维、Ɵ和压电安装针的图像。(A) 通过40倍的镜面,在涂有贝壳的玻璃纤维针之间以松弛长度安装的肌纤维。(B) 通过 10 倍Ɵ的玻璃相对于肌纤维(用白色椭圆突出显示)的位置的图像。(顶部)与顶部通道对齐(放松解决方案,pCa 9.0);(底部)与底部通道对齐(激活溶液,pCa 4.5),将肌磷酸与钙一起吸收并诱导收缩。(C) 玻璃与Ɵ的示意图描述。(顶部)与顶部通道对齐(放松解决方案,pCa 9.0);(底部)与底部通道对齐(激活溶液,pCa 4.5),使肌磷酸与钙一起吸收并诱导收缩。(D) 安装针头,连接到压电架的碳棒。 请单击此处查看此图的较大版本。

图3:组织流室的设置和结束部分的示意图。在深蓝色中,由铝制成的组织流室,在白色中显示力探针Ɵ玻璃的腔;(中心)Myofibril 连接在两根玻璃纤维安装针之间,这些针连接到力探头和压电长度电机。玻璃Ɵ与肌纤维对齐。玻璃Ɵ上下移动,使肌纤维暴露在钙溶液中。(右)悬臂力探头的特写。指示的型腔大小(或法布里-佩罗特型腔 ,d);反射接口 A、B 和 C;和激光发射的光波的例子(红色)。悬臂安装在铁杉的肩膀上。从干涉仪上携带激光的光纤从悬臂尖端的铁杉中退出。用蜡固定在悬臂上的玻璃安装纤维。(左上)干涉仪分析传输到系统控制器软件的干涉仪信号。 请单击此处查看此图的较大版本。

图4:实验设置和主动张力实验数据。(A) 使用的灌注设置和解决方案的示意图。请注意,第一根和最后一根管子(浅蓝色)含有无钙溶液(即放松溶液)。(B) 示例力的活性张力实验的痕迹与肌骨骼肌肉组织分离出显示五个激活从放松溶液 (pCa 9.0) 到多种激活溶液 (pCa 6.2 – 4.5)。(C) 力钙曲线;面板 (B) 中高原的力水平被规范化, 并针对各自的钙水平绘制.(D) 一种II型(快速抽搐)肌骨力的力跟踪,从人类骨骼肌分离出,用pCa 5.6溶液(蓝色)激活,随后与pCa 5.6 = BTS(II型特异性跨桥抑制剂,红色)激活。(E) 活动张力实验示例数据跟踪,与小鼠鞋底骨骼肌组织分离,在激活过程中快速缩短-恢复修复协议,以确定张力重建的速度(kTR,黄色虚线)。此外,激活和松弛曲线被安装,以确定激活率(kACT,红色虚线)和松弛(kREL,绿色虚线),分别。(F) 松弛阶段的缩放(左上),在 ( E )中突出显示。快速步进电机信号(左下)指示解决方案从激活解决方案 (pCa 4.5) 更改为轻松解决方案 (pCa 9.0) 的时间点。松弛阶段包括线性、慢相(右上)和指数快速相位(右下角)。 请单击此处查看此图的较大版本。

图 5:系统控制软件中信号发生器的示例设置。( 参见材料表)。1) 指示执行信号生成器中输入的命令的按钮。(A) 设置压电长度电机。(B) 设置快步电机。(C) 执行快速步骤,以激活肌体,持续时间为 5 s. (D) 执行肌黄体的快速缩短-恢复,以确定 kTR。(E) 执行肌黄种的分步拉伸,以确定粘弹性特性。 请单击此处查看此图的较大版本。
图6:PC上使用的阀门控制器软件。(A) 用于打开阀门 1 (Rx) 和 6 (行为) 的按钮。(B) 所有阀门关闭时按钮的状态。 请单击此处查看此图的较大版本。
图7:用系统控制器软件测量沙康长度、肌黄布里尔长度和肌黄种人宽度。标尺用作示例。(A) 测量沙康长度:紫色框位于肌黄花,沙康长度显示在 (1) 中。(B) 测量长度:青色盒从头到尾放置。(C) 测量宽度:旋转相机 90° 后,从肌黄种人到另一侧的青色盒。 请单击此处查看此图的较大版本。

图8:热电温度控制器软件。(A) 与热电温度控制器建立连接。(B) 展开温度设置。(C) 设置所需温度,在这种情况下:15 °C. (D) 打开热电温度控制器,向Peltier热电冷却器模块发送电压。 请单击此处查看此图的较大版本。

图 9:注射器流出泵的设置。(A) 按 (1) 打开泵的连接。(B) 按 (2) 以预定义的设置启动泵。(C) 通过将 [阀命令] 设置为Bath Valve[浴阀] (2) 并输入 [命令集参数] 开始流出泵送,如图所示。按 (3) 执行命令。命令可以通过按 (4) 终止。请单击此处查看此图的较大版本。
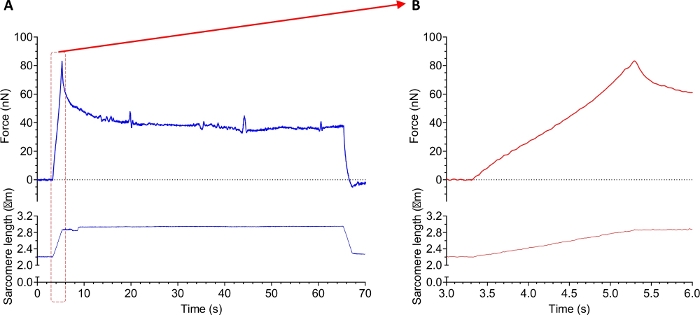
图10:从人体骨骼肌组织分离出的肌骨骼肌分离的被动张力实验示例数据痕迹。(A) 在拉伸和释放协议期间记录力(上部)和沙康长度(下)。(B) 缩放 (A) 显示肌的拉伸阶段的力量 (上) 和沙康长度. 请单击此处查看此图的较大版本。
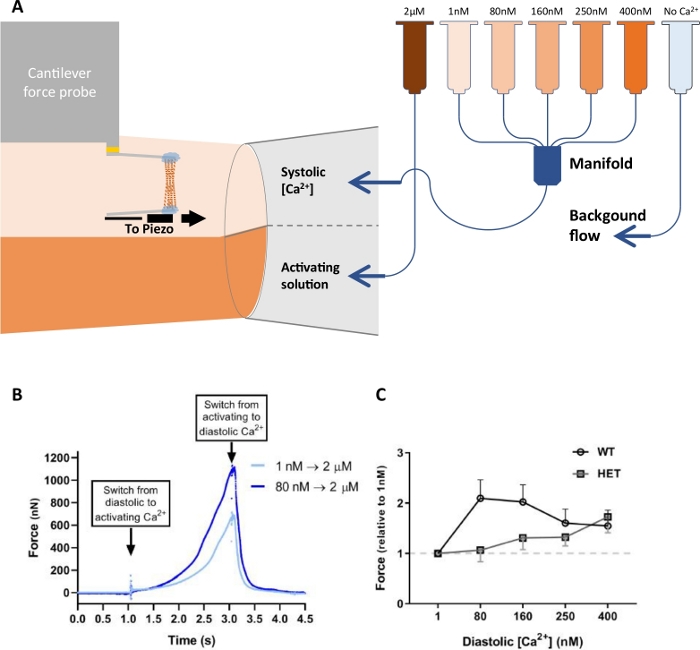
图11:心肌细胞钙预激活实验的实验设置和数据。(A) 灌注设置的示意图。请注意,最后一根管子(浅蓝色)含有无钙溶液(放松溶液)。(B) 未(浅蓝色)和(深蓝色)钙预活化心肌细胞的活化曲线,钙浓度分别为1 nM和80 nM。(C) 从大鼠左心室分离的野生型(WT)和异质RBM20(HET)心肌细胞的钙预活化比较。这个数字已经修改了从纳贾菲等人21。 请单击此处查看此图的较大版本。
| 步 | 装置 | 描述 | 形状 | 初始 | ||||||||
| 1.7.1. | 压 电 | 初始化被动张力 | 固定 | 51.6 μm | ||||||||
| 1.7.2. | 压 电 | 初始化活跃张力 | 固定 | 0 μm | ||||||||
| 步 | 装置 | 描述 | 形状 | 初始 | 延迟 | 代表 | 水平 | 延迟 | 水平 | 延迟 | ||
| 3.4.4. / 4.1.1.4./ 4.1.2.4. | 快步 | 测试ɵ玻璃位置 / 激活肌纤维 | 脉冲 | 4 V | 1 s | 1 x | 3 V | 5 s | 4 V | 1 s | ||
| 4.1.3.4. | 快步 | 激活肌黄种人(包括kTR) | 脉冲 | 4 V | 1 s | 1 x | 3 V | 10s | 4 V | 1 s | ||
| 步 | 装置 | 描述 | 形状 | 初始 | 延迟 | 代表 | 斜坡级别 | 斜坡持续时间 | 延迟 | 斜坡级别 | 斜坡持续时间 | 延迟 |
| 4.1.3.1. / 4.1.3.6. | 压 电 | k TR 的缩短-TR恢复 | 梯形 | 0 μm | 0.5 s | 1 x | 0 = 0.15 = L0 = __ μm | 0.01 s | 0.01 s | 0 μm | 0.01 s | 1 s |
| 4.2.1.1. / 4.2.1.4. | 压 电 | 继续拉伸 | 梯形 | 51.6 μm | 2 s | 1 x | 51.6 - 0.30 * L0 = __ μm | 2 s | 0 s | 51.6 - 0.30 * L0 = __ μm | 0 s | 1 s |
| 4.2.1.4. | 压 电 | 将肌黄子百里返回到松弛长度 | 梯形 | 1.6 μm | 2 s | 1 x | 51.6 μm | 5 s | 0 s | 51.6 μm | 0 s | 1 s |
| 4.2.2.3. | 压 电 | 逐步拉伸 | 梯形 | 51.6 μm | 2 s | 10 x | 51.6 - 5 μm | 0.5 s | 10 s | 51.6 - 5 μm | 0 s | 0 s |
| 4.2.3. | 压 电 | 将肌黄子百里返回到松弛长度 | 梯形 | 1.6 μm | 2 s | 1 x | 51.6 μm | 5 s | 0 s | 51.6 μm | 0 s | 0 s |
表1:表,描述系统控制器软件用于操作压电长度电机和快步电机的各种信号发生器设置。
讨论
描述是一种协议,用于评估从人或动物骨骼肌组织中分离出的肌骨的收缩功能。查万等人之前曾描述过这种装置的力分辨率。简言之,它由检测纤维和悬臂之间形成的Fabry-Pérot腔长度的随机波动决定,这些空腔产生读出输出(以V表示)时噪声的主导部分,乘以偏转灵敏度(以m/V表示)和悬臂的弹簧常数(以N/m表示),从而产生力噪声。在我们的设置中,在读出输出时,在 1,000 个数据点(样本/s)采样时,空气中的根平均正方形 (rms) 噪声约为 2 mV。对于典型的肌黄铁测量,用于弹簧常数为 ±0.7 N/m(偏转灵敏度 ∼300 nm/V) 的铁杉顶探头。此 rms 值对应于 0.6 nm 的悬臂偏转分辨率,这转换为 ±0.37 nN 的力灵敏度。力探针通过将安装针的尖端推到称重秤上进行校准,同时保持悬臂的弯曲等于读出激光13波长的倍数。这种校准方法既包括悬臂和安装针的刚度,也包括悬臂和安装针的扭矩可能变化,因为肌黄种轮收缩的速度和幅度。目前,有一种用于评估肌黄种利收缩的装置,它基于从悬臂偏转的激光检测,即光束偏转(1,700 A;±1 nN力分辨率)。该系统由拉布达等人开发,使用光学潜望镜引导激光在约束配置11中向和远离悬臂。在这个系统中,在原子力悬臂和刚性玻璃针之间安装肌纤维。此处描述的系统的优点是更高的力灵敏度和信噪比。此外,在此设置中,可以使用相对刚性的悬臂,当施加 myofibrillar 力时,这会导致小悬臂偏转。这一点很重要,因为它允许在几乎恒定的沙康长度下进行力测量。最后,与 Labuda 等人描述的系统相比,该系统采用类似或相同的方法来控制温度,诱导肌黄纤维长度变化,并使用 Ɵ 玻璃和快步电机改变灌注解决方案。Labuda等人描述的系统的优点是,溶液成分的变化(悬臂和光学潜望镜之间)不会影响信号输出。在此描述的系统中,悬臂和光纤之间的溶液组合必须保持不变。下面将更详细地介绍此限制的解决方案。
优化
光力探头与快速灌注系统相结合,导致并发症。低浓度 Ca 2+ 溶液在光学性能上的差异会干扰力测量。为了防止高钙溶液回流,设计了一个定制流量室(图3)。从右到左诱导无钙溶液的恒定背景流,使溶液在光纤顶部和悬臂之间保持恒定(图3D)。
为了控制温度,在流室上安装了带液体冷却的 Peltier 元件。通过将流室安装在塑料适配器上,该流室与显微镜进行热耦合。借助由 TEC 系统控制的 Peltier 元件,可以随着时间的推移以 0.1 °C 的精度控制溶液的温度。温度由安装在流舱上的温度传感器进行监控。由于力传感器的性质,温度稳定性很重要。悬臂由镀金玻璃条组成,可有效地成为温度计。因此,悬臂随温度变化而弯曲。
该装置使用快速步进灌注 系统(参见材料表)来控制玻璃Ɵ移动。该系统允许在 10 ms 内进行灌注开关。结合温度控制和溶液切换方法,使该系统特别适用于测量肌黄热气和松弛中沙彗水收缩的动力学(即力开发率、张力重建和松弛率)。
最初,使用干涉测量的缺点是使用范围小,因为需要使用干涉曲线的线性部分(+/8,α是激光的波长)。然而,最近的创新通过将波长调制与锁定放大器相结合,消除了这一需求。因此,系统不限于干涉曲线的单个线性部分。这使得可以测量悬臂14的无限偏转。因此,与传统干涉测量相比,该系统的悬臂偏转读出范围大大扩大。此外,所述力探头易于更换,并且有许多可用的直塞,其刚度从 0.5 N/m 到 >20 N/m 不等。因此,可以在无间向之间快速变化,并选择最适合进行实验的刚度。
挑战
目前的系统是基于心肌细胞测量系统的原型(见 材料表)。可以改进多个组件,以提供更好的用户体验和高质量数据。首先,由于系统的附加组件,振动和谐振可能是一个将增加信号噪声的问题。此外,Ɵ玻璃支架和快步电机附件方法可改进,使其不易振动。
其次,最好用压电长度执行器替换快步电机,以提高溶液切换速度,并获得更一致的运动。
第三,我们以前用来激活单一条纹肌肉纤维的钙溶液包括丙酸,但这些溶液吸收近红外光,干扰力测量。氯化钙用于消除对丙酸的需要,这大大降低了这种效果。这个问题是基于干涉测量的系统固有的,在利用光束偏转时不存在。
第四,设计了一个定制的流浴,以创建一个层流,以匹配Ɵ的流量。这可以防止由于富含钙溶液的湍流而回流。因此,光纤尖端和悬臂之间的溶液保持不变。带肌黄花的盖玻片可以在流舱下自由移动,因此,选择合适的肌黄叶花不局限于流室的小区域。
可重复性和可变性
系统和协议有几个要素对于所获取数据的可重复性和可变性程度非常重要。
首先,测量的质量在很大程度上取决于肌黄种人隔离的质量。相同的协议产生不同的品质和数量的肌黄种人从不同的活检。在某些情况下,活检几乎不能产生可用的肌黄素或根本没有。共同的共识是,受损的肌黄种人将在收缩过程中破裂,因此在结果中不被考虑。
其次,在确定肌黄种体横截面面积方面存在不确定性。由于技术限制,只能在一个平面中测量肌黄种人宽度。因此,为了计算横截面面积,我们假设宽度和深度相等。当力被规范化到横截面区域以计算最大活动张力时,应注意此假设。
由于肌黄种胶的安装角度、位置和胶水的完整性,因此安装肌黄种胶。
虽然安装角度和位置可以在很大程度上在视觉上得到控制,但肌黄体之间可能存在很小的变化。胶水完整性尚未被广泛调查。但是,在激活之前和之后,可以通过监测肌黄种鱼长度来验证胶水的完整性。当协议后在胶水之间出现更多的沙球时,这表明胶水中的肌黄种人已经出现滑移。因此,应从数据集中排除此 myofibril。
设置的其他应用:从大鼠左心室分离的心肌细胞中的钙预活化
除了评估肌黄细胞的收缩功能外,该系统还可用于测量心肌细胞力学。例如, 图11 说明了使用膜渗透单心肌细胞从大鼠左心室21分离。与上述实验相反,放松溶液被改变,激活溶液保持不变。每个心肌细胞都经过五组活化,使其暴露在 2 μM 无钙溶液中,为 1 s。选择1 s 时间约束来模拟心脏收缩的限时性质,其中接触低钙浓度溶液模拟舒张阶段,暴露于高钙浓度溶液中模拟心肌收缩的收缩阶段(图11A)。五组舒张钙各有不同(1、80、160、250和400 nM钙),而收缩钙保持不变(图11A)。一组由两组三组激活松弛周期组成,1.8 μm 与 2.0 μm 和 2.0 μm,不同实验组为 2.2 μm。峰值力从移液器开关以 1 秒为单位测量,并平均为三个激活松弛周期。高信噪比和这种力传感器的高动态范围使我们能够测量舒张力的小变化和更大的收缩力(图11B)。增加舒张钙导致2 μM钙相对于第一次激活的力更高(图11B)。WT大鼠心肌细胞与异质(HET)比较人民币20元大鼠心肌细胞。由于替代拼接,HET大鼠具有比WT大鼠更符合的滴定蛋白。在 HET 心肌细胞中,80 和 160 μM 钙(图11C)中,这种效应被夸大了。
披露声明
米希尔·赫尔姆斯是 IONOptix 公司的股东和共同所有者。
致谢
该项目由AFM-Telethon和Nemaline Myopath基金会建设力量资助。作者希望承认本文中提到的产品的创建者 IONOptix Inc.
材料
| Name | Company | Catalog Number | Comments |
| Bio Spec Products, Inc. | 985370-XL | To isolate myofibrils | |
| Custom coded | Matlab | ||
| Custom fabricated | Includes Labview program to control over serial connection; To control valves | ||
| Custom fabricated | To cool the Peltier module | ||
| Custom fabricated | |||
| Custom fabricated | Aluminum tissue chamber | ||
| Custom fabricated | To control the valves; Includes PC software to control over USB | ||
| IonOptix | System controller software: data recording software with advanced signal generator for piezo and fast-step | ||
| IonOptix | MCS100 | To record sarcomere length | |
| IonOptix | Includes: Optiforce (interferometer), Micromanipulators, Signal interface, Piezo motor and controller. Based on the MyoStretcher | ||
| IonOptix | Force probe | ||
| Koolance | ADT-EX004S | ||
| Koolance | EX2-755 | To cool the Peltier module | |
| Microsoft | Data registration | ||
| Olympus | IX71 | ||
| Olympus | TH4-200 | ||
| Sigma-Aldrich | 529265 | Poly(2-hydroxyethyl methacrylate); Coating for microscope slides to prevent sticking of tissue | |
| Sigma-Aldrich | 78471 | Crystals to dissolve in ethanol resulting in glue | |
| TE Technology, Inc. | TE-63-1.0-1.3 | To cool the tissue flow chamber | |
| TE Technology, Inc. | TC-720 | Includes PC software to control over USB | |
| Tecan Trading AG | 20736652 | ||
| Tecan Trading AG | 20739263 | Syringe pump to induce backgroundflow together with fast-step perfusion system; Outflow from tissue flow chamber | |
| Thermo scientific | 2441081 | ||
| Warner Instruments (Harvard Bioscience, Inc.) | Discontinued | Alternative: SF-77CST/VCS-77CSP | |
| Warner Instruments (Harvard Bioscience, Inc.) | TG150-4 | To perfuse the tissue | |
| 1 PC for IonWizard and 1 PC for other software |
参考文献
- Winter, J. M., Ottenheijm, C. A. C. Sarcomere Dysfunction in Nemaline Myopathy. J. Neuromuscular. Disease. 4, 99-113 (2017).
- Colomo, F., Piroddi, N., Poggesi, C., te Kronnie, G., Tesi, C. Active and passive forces of isolated myofibrils from cardiac and fast skeletal muscle of the frog. Journal of Physiology. 500, 535-548 (1997).
- Kulke, M., et al. a major source of myofibrillar stiffness in Drosophila indirect flight muscle. Journal of Cell Biology. 154, 1045-1057 (2001).
- Stehle, R., et al. Isometric force kinetics upon rapid activation and relaxation of mouse, guinea pig and human heart muscle studied on the subcellular myofibrillar level. Basic Research in Cardiology. 97, 127-135 (2002).
- Iorga, B., et al. Micromechanical function of myofibrils isolated from skeletal and cardiac muscles of the zebrafish. Journal of General Physiology. 137, 255-270 (2011).
- Ribeiro, P. A. B., et al. Contractility of myofibrils from the heart and diaphragm muscles measured with atomic force cantilevers: Effects of heart-specific deletion of arginyl-tRNA-protein transferase. International Journal of Cardiology. 168, 3564-3571 (2013).
- Joureau, B., et al. Dysfunctional sarcomere contractility contributes to muscle weakness in ACTA1-related nemaline myopathy (NEM3). Annals of Neurology. 83, 269-282 (2018).
- de Souza Leite, F., Minozzo, F. C., Altman, D., Rassier, D. E. Microfluidic perfusion shows intersarcomere dynamics within single skeletal muscle myofibrils. Proceedings of the National Academy of Sciences of the United States of America. 114, 8794-8799 (2017).
- Shalabi, N., Cornachione, A., de Souza Leite, F., Vengallatore, S., Rassier, D. E. Residual force enhancement is regulated by titin in skeletal and cardiac myofibrils. Journal of Physiology. 595, 2085-2098 (2017).
- Cornachione, A. S., Leite, F., Bagni, M. A., Rassier, D. E. The increase in non-cross-bridge forces after stretch of activated striated muscle is related to titin isoforms. American Journal of Physiology - Cell Physiology. 310, 19-26 (2016).
- Labuda, A., Brastaviceanu, T., Pavlov, I., Paul, W., Rassier, D. E. Optical detection system for probing cantilever deflections parallel to a sample surface. Review of Scientific Instruments. 82, 013701 (2011).
- Chavan, D., et al. Ferrule-top nanoindenter: an optomechanical fiber sensor for nanoindentation. Review of Scientific Instruments. 83, 115110 (2012).
- Beekmans, S. V., Iannuzzi, D. A metrological approach for the calibration of force transducers with interferometric readout. Surface Topography: Metrology and Properties. 3, (2015).
- van Hoorn, H., Kurniawan, N. A., Koenderink, G. H., Iannuzzi, D. Local dynamic mechanical analysis for heterogeneous soft matter using ferrule-top indentation. Soft Matter. 12, 3066-3073 (2016).
- Winter, J. M., et al. KBTBD13 is an actin-binding protein that modulates muscle kinetics. Journal of Clinical Investigation. , (2019).
- Winter, J. M., et al. Mutation-specific effects on thin filament length in thin filament myopathy. Annals of Neurology. 79, 959-969 (2016).
- Ottenheijm, C. A. C., et al. Deleting exon 55 from the nebulin gene induces severe muscle weakness in a mouse model for nemaline myopathy. Brain. 136, 1718-1731 (2013).
- Ribeiro, P. A., et al. Contractility of myofibrils from the heart and diaphragm muscles measured with atomic force cantilevers: effects of heart-specific deletion of arginyl-tRNA-protein transferase. International Journal of Cardiology. 168, 3564-3571 (2013).
- Pinniger, G. J., Bruton, J. D., Westerblad, H., Ranatunga, K. W. Effects of a Myosin-II Inhibitor (N-benzyl-p-toluene Sulphonamide, BTS) on Contractile Characteristics of Intact Fast-twitch Mammalian Muscle Fibres. Journal of Muscle Research and Cell Motililty. 26, 135-141 (2005).
- Stehle, R., Krüger, M., Pfitzer, G. Force kinetics and individual sarcomere dynamics in cardiac myofibrils after rapid Ca(2+) changes. Biophysics Journal. 83, 2152-2161 (2002).
- Najafi, A., et al. End-diastolic force pre-activates cardiomyocytes and determines contractile force: role of titin and calcium. Journal of Physiology. 597, 4521-4531 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。