Method Article
Задержка прививки Модель хронической Pseudomonas aeruginosa раневой инфекции
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы описываем протокол с задержкой прививки для генерации хронических раневых инфекций у иммунокомпетентных мышей.
Аннотация
Pseudomonas aeruginosa (P. aeruginosa) является основным нозокомиальным патогеном, имеющим все большее значение для здоровья человека и болезней, особенно в условиях хронических раневых инфекций у больных сахарным диабетом и госпитализированных пациентов. Существует настоятельная необходимость в хронических моделей инфекции, чтобы помочь в исследовании патогенеза раны и разработки новых методов лечения против этого патогена. Здесь мы описываем протокол, который использует задержку прививки 24 часов после полной толщины иссечения раны. Инфекция предварительной раневой матрицы, присутствующей в это время, предвосхищает либо быстрое разминирование, либо распространение инфекции, а вместо этого устанавливает хроническую инфекцию продолжительностью 7-10 дней без необходимости имплантации посторонних материалов или подавления иммунитета. Этот протокол имитирует типичный временной ход послеоперационной инфекции у людей. Использование люминесцентного штамма P. aeruginosa (PAO1:lux) позволяет количественно ежедневно оценивать бактериальную нагрузку на рюнные инфекции P. aeruginosa. Эта новая модель может быть полезным инструментом в исследовании бактериального патогенеза и разработке новых методов лечения хронических P. aeruginosa раны инфекций.
Введение
Pseudomonas aeruginosa (P. aeruginosa) — бактерия в форме грам-негативного стержня, имеющая все большее отношение к здоровью и болезням человека. Он отвечает за обширную заболеваемость и смертность в нозокомиальных условиях, в частности, с участием рановых инфекций у пациентов с ослабленным иммунитетом1,2. Появление мультирезистентных штаммов этого патогена дало дополнительный импульс для исследования факторов, способствующих вирулентности P. aeruginosa, механизмов устойчивости к антибиотикам P. aeruginosa, а также новых методов профилактики и лечения этой смертельной инфекции3. Таким образом, потребность в животных моделях хронической раневой инфекции в качестве инструментов для расследования этих исследований вопросы никогда не было больше.
К сожалению, многие животные модели инфекции P. aeruginosa, как правило, имитируют острую инфекцию с быстрым разрешением инфекции или быстрое снижение из-за сепсиса4,5, который не адекватно моделирует часто хронический характер этих инфекций. Для устранения этого недостатка, некоторые модели используют имплантации инородных тел, таких как агар бисер, силиконовые имплантаты, или альгинат гели6,7,8. Другие модели используют мышей, которые иммунокомпромиссных из-за преклонного возраста, ожирения или диабета, или с помощью фармакологических средств, таких как циклофосфамид индуцированной нейтропения9,10,11,12. Однако, либо использование иностранных материалов или иммунной скомпрометированы хостов, вероятно, изменяет местный воспалительный процесс, что делает его трудно получить представление о патофизиологии, участвующих в хронических рановых инфекций в хостах с иным нормальной иммунной системы.
Мы разработали хроническую модель P. aeruginosa раневой инфекции у мышей, которая включает в себя задержку прививки с бактериями после иссечения ран. Задержка прививки позволяет проводить эксперименты по оценке бактериальной нагрузки, распространяющейся как минимум на 7 дней. Эта модель открывает новые возможности для исследования как патогенеза и новых методов лечения P. aeruginosa хронических инфекций.
протокол
Все методы, описанные здесь, были одобрены Институциональным комитетом по уходу за животными и использованию (IACUC) при Стэнфордском университете.
1. Подготовка и рост бактерий
- Проведите всю работу с P. aeruginosa и животных с BSL-2 меры предосторожности в институциональном комитете по биобезопасности исследователя и животных руководящих принципов комитета по использованию. У всех шагов, описанных здесь с участием P. aeruginosa, в том числе мышь прививки, в кабинете биобезопасности.
- Люминесцентный штамм PAO1:lux P. aeruginosa доступен в нашей лаборатории по запросу. Полоса PAO1, хранящаяся в виде замороженного глицерола, на лисогенном бульоне (LB) агаре. Для люминесцентного штамма PAO1:lux, LB агар должен содержать селективные антибиотики (100 мкг/мл карбеничиллина и 12,5 мкг/мл канамицина). Выращивайте при 37 градусах Цельсия в ночь в бактериальном инкубаторе.
- Выберите изолированную колонию и расти на ночь при 37 градусов по Цельсию в 3 мл LB среды, рН 7,4. Для люминесцентных штаммов бульон должен содержать 100 мкг/мл карбеничиллина. Расти под тряску, аэробные условия.
2. Процедура подготовки
- Поимеют все сотрудники, выполняющие операции носить чистое платье / Lab пальто, маска для лица, сетка для волос, и перчатки.
- Автоклав все хирургические инструменты, в том числе ножницы и щипцы. Используйте асептический метод для стерилизации инструментов между животными.
- Очистите хирургический стол с этанолом и подготовить чистое хирургическое поле.
3. Удаление волос
- Анестезия 8-12 недель C57BL/6J мышей с использованием 1%-3% изофруран. Следователи должны следовать рекомендациям ветеринарного персонала своего учреждения по анестезии при использовании изофруран.
- Начните анестезию, доставляя изофлюранию на 1%-3% и регулируйте скорость потока кислорода до 1,5 л/мин. Поместите мышь в индукционную камеру.
- Pinch ног мыши для оценки глубины анестезии. Когда мышь больше не реагирует на стимуляцию, удалите ее из индукционной камеры и поместите на хирургическую скамейку носом в изофлюранский носовой конус.
- Нанесите глазную смазку на оба глаза.
- Взвесьте мышь, чтобы получить базовый вес перед процедурой.
- Поместите мышь в положение подверженных. Вводят мышь подкожно с предварительно разогретым стерилизом 0,9% хлорида натрия, 250 л на каждом фланге в общей сложности 500 л.
- Бритье в дозах мыши с помощью электрической бритвы. Бритье должно происходить в другом месте, чем хирургическая станция, чтобы предотвратить заражение волос раны.
- Нанесите тонкий слой лосьона для удаления волос. Пусть лосьон сидят 20-60 с. Удалите волосы и лишний лосьон с марлей, смоченной в теплой воде. После удаления волос, перейти к иссечению раны процедуры.
4. Полная толщина иссеченной хирургии раны
- Вводят устойчивый высвобождение бупренорфин 0,6-1 мг/кг подкожно с помощью 25 G иглы в середине дорсальной области мыши. Медленное высвобождение бупренорфина обеспечивает облегчение боли в течение 48-72 ч.
- Дезинфицировать хирургическое место. Протрите поверхность дона стерильным бетадином тампоном. Протрите лишний бетадин стерильным спиртным тампоном. Это должно быть выполнено 3 раза (чередование между бетадином и алкоголем), мазок, двигаясь от центра в круговой манере к краю. Дайте области высохнуть.
- Создайте драпировку, окружающую хирургическое место, используя стерильную марлю или пластиковую пленку.
- Растянуть кожу тугой каудально. Используйте стерильный 6-мм диаметр биопсии кожи удар, чтобы сделать первоначальный разрез через левый маркеров. Повторите справа прядите эпидермис.
- Используйте щипцвы для палатки кожи из центра левой очерченной области раны. Акциз эпидермальных и кожных слоев с помощью ножниц. Повторите на правой очерченной области раны для создания симметричных иссечения ран.
- Вымойте раны с 50 зл стерильного солевых растворов. Разрешить хирургического сайта и окружающей кожи воздуха сухой. Затем накройте раны и сум прозрачной пленкой.
- Поместите мышь обратно в чистую клетку. Дом 1 животное на клетку.
- Поместите клетку на грелку и монитор, пока мышь не проснется.
- При выполнении вышеупомянутой операции на нескольких животных, использовать горячий стерилизатор биса для очистки всех хирургических инструментов между животными.
- Разрешить 24 ч для мышей, чтобы оправиться от хирургической процедуры и для формирования предварительной матрицы раны над ранами до начала прививки с бактериями.
5. Прививка с Помощью. аэругиносы
- Разбавить ночь PAO1:lux культуры до OD600 и 0,05 в 75 мл LB средств массовой информации, содержащей 100 мкг /мл карбенииллина и расти бактерий, пока культура находится в начале экспоненциальной фазы (OD600 и 0,3). Это должно занять примерно 2-3 ч.
- Разбавить PAO1:lux в PBS до концентрации (7,5 и 2,5) х 102 CFU/mL. Обязательно подготовьте избыток инокулума, чтобы обеспечить достаточный объем и обеспечить покрытие после эксперимента. При транспортировке между объектами (т.е. из лаборатории в вивариум) используйте двойное сдерживание в коробке с подтверждением утечки, четко обозначенной Biohazard.
- Выполните всю работу с P. aeruginosa и мышами с использованием утвержденного средства индивидуальной защиты в утвержденном кабинете биологической безопасности (ABSL-2) (ABSL-2). Многоразовое оборудование, такое как шкала взвешивания, должно быть покрыто цепляющейся пленкой для предотвращения загрязнения.
- Анестезия с использованием 3% изолюран, как описано выше. Взвесьте мышь и запишите вес. Вводят мышь подкожно с предварительно разогретым стерилизом 0,9% хлорида натрия, 250 л на каждом фланге в общей сложности 500 л.
- Если мышь прозрачная пленка соусом оторвался на ночь, удалить любой результировать тщательно и положить на новую повязку.
- Используйте 500 люберкулина 27 G шприц безопасности, чтобы ввести 40 зл и гл от PAO1:lux подвески через прозрачную пленку соусом в каждую рану. Различные мыши должны быть использованы для не-привитых / PBS раны управления для того, чтобы предотвратить перекрестное загрязнение с контралатеральной стороны.
- Поместите мышь обратно в клетку на грелку и монитор, пока он не проснется. Все мыши должны быть размещены индивидуально в отдельных клетках для предотвращения перекрестного загрязнения.
- Обеспечить высококалорийную пищевую добавку пасты зажатой между пищевыми гранулами на полу клетки.
- Используйте оставшийся инокулум, чтобы разлить пластину lb agar. Сосчитайте колонии, чтобы подтвердить количество бактерий, управляемых.
6. В vivo изображения инфицированных ран
- Следуйте протоколам сдерживания BSL-2 для транспортировки мышей в и из прибора визуализации, включая использование вторичного контейнера. Будьте осторожны, чтобы не передать или падение любого животного постельных принадлежностей во время передачи мыши в индукционную камеру или инструмент изображения.
- Индуцировать анестезию мыши с вдыхаемым 1%-3% изофлюрани в индукционной камере, как описано в шаге 3.1.
- После того, как мышь под анестетом, поместите его в подверженное положение в камере визуализации оптической системы визуализации с носом в изофлуранном носовом конусе.
- Откройте программу.
- Параметры приобретения будут варьироваться в зависимости от количества животных, изображенных одновременно и интенсивности биолюминесценции. Основные параметры, которые необходимо установить, включают время экспозиции, связующие, f/stop и поле зрения (FOV). Наши настройки запуска по умолчанию являются время экспозиции 30 секунд, binning низкий (2), f/stop 1.2, и FOV 25. Отрегулируйте эти настройки по мере необходимости в зависимости от потребностей исследователя.
- Анализ данных о люминесценции с помощью программы визуализации (см. Таблица материалов). Люминесценция будет представлена как псевдоцветное изображение, наложенное на цветную фотографию мышей.
- Создайте область интереса (ROI) на месте раны и измерьте средний поток (фотоны в секунду) обнаруженный. Обратите внимание, что данные также могут быть сообщены как сияние (фотоны/второй/см2/стеридиан), но до тех пор, пока расстояние платформы изображений от камеры остается постоянным между изображениями, поток достаточен.
- Измерьте фон, создав рентабельность инвестиций в случайной области на платформе визуализации. Вычесть фоновое количество фотонов в секунду.
- Экспорт данных в электронную таблицу для дальнейшего анализа.
- Выполните изображения, как описано выше, как часто, как ежедневно, чтобы отслеживать прогрессирование инфекции.
7. Послеоперационное управление
- Мониторинг мышей в соответствии с руководящими принципами, установленными протоколом IACUC исследователя. Мы ежедневно следим за всеми мышами в течение первых 4 дней, затем через день до конца эксперимента. Взвешивать мышей один раз в день в течение первых 4 дней после операции в BSC. Вводят 250 л 0,9% хлорида натрия подкожно в постинфекционные дни 1 и 2.
- Проверьте наличие признаков боли / бедствия у мышей, в том числе сгорбленная осанка, грязный пальто, вялость, затрудненное дыхание, лица гримасы, и потеря веса.
- Если у животных проявлены признаки ухудшения здоровья, обратитесь к ветеринару. Любая мышь, которая, как представляется, показывают ухудшающиеся признаки боли / бедствия и потеря веса 20% или больше должны быть усыплены.
8. Иссечение ран
- В конце эксперимента, пожертвовать мышей с помощью CO2 ингаляции, а затем вывихшей шейки матки. Утилизация туши животного в соответствии с протоколами ABSL-2 учреждения.
- Акцизные раны с использованием стерильных ножниц и щипцы в BSC. Поместите каждую ранную кровать в 1 мл стерильной PBS в 1,5 мл полипропиленовой трубки. Фарш раневой ткани ножницами. Все раны следует рассматривать как ASBL-2, даже если они не считаются инфицированными.
- Инкубировать на шейкере при 300 об/мин при 2 ч при 4 градусах Цельсия. Vortex каждая трубка на 10 с и последовательно разбавить бактериальных сточных вод в PBS. Плита разбавленных бактериальных сточных вод на агарLB, чтобы перечислить бактериальной нагрузки.
- Рассмотрим раны инфицированных, если люминесцентный сигнал в ране выше фоновой люминесценции и больше бактерий обнаружены в ране стоков, чем в раны, привитые с PBS в качестве контроля.
Результаты
Используя люминесцентный штамм PAO1 с плазмидным кодированием системы репортеров luxABCDE (PAO1:lux), мы выполнили иссецистовую рану на мышах, привили эти раны планктонным P. aeruginosa 24 h позже и измерили бактериальную нагрузку с течением времени(рисунок 1 и рисунок 2). Репрезентативное изображение, полученное с помощью оптической системы визуализации, показывает, что эта модель приводит к обнаружению люминесценции(рисунок 3A). Инфекция достигла пика на 3-й день после прививки и сохраняется 7 дней после прививки на основе как биолюминесценции и колонии рассчитывает(Рисунок 3B-C). Используя эту модель, мы можем надежно генерировать раны продолжительностью 7-10 айс в зависимости от штамма бактерий и мышиного фона. Культура бактерий, изолированных от раны, показала, что количественные CFU/раны коррелируют с обнаруженным люминесценцией(рисунок 3D). Наконец, несмотря на очевидное и количественное P. aeruginosa инфекции, мышей выжили, по крайней мере 7 дней. Хотя была первоначальная быстрая потеря веса сразу после заражения, сольные инъекции и дополнительное питание привело к восстановлению веса(рисунок 3E). Наконец, мы рассчитали дозу прививки, при которой 50% ран будут устойчиво инфицированы ПАО1. Расчетное значение IC50 составило 7,7 х 10 cFU/mL. Дозы выше, чем 104 CFU/mL привело к 100% уровень инфекции(рисунок 3F). Эти результаты были адаптированы из ранее опубликованных данных13.
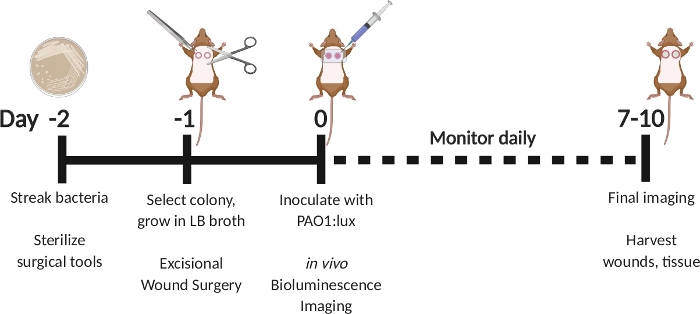
Рисунок 1: Схема, изображающая иссеционную модель раневой инфекции с задержкой прививок с биолюминесцентной P. aeruginosa. Полоса PAO1:lux в день -2. Выберите колонию в день -1 и расти на ночь в бульоне LB. Выполните операцию на иссечении раны в день -1. На день 0, привить с PAO1:lux путем введения в рану кровать через прозрачный пленочный соус. Выполните биолюминесценцию после прививки. Повторите визуализацию так часто, как ежедневно в течение дня 7-10. На 7-10 день, жертвовать животными и забирать раны. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: Схема операции на иссечении ран. После удаления волос и стерилизации кожи с алкоголем и бетадином, используйте 6 мм биопсии удар, чтобы сделать первоначальный разрез через эпидермис левой и правой обратной. Используйте ножницы и щипцы для удаления кожных и эпидермальных слоев. Вымойте с PBS. Обложка с четкой заправкой. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: P. aeruginosa раневой инфекции могут быть обнаружены через 7 дней инфекции. (A) Представитель изображение мыши, инфицированной PAO1:lux с наложением биолюминесценции на иссецисционные раны. (B) Люминесцентный сигнал, отражающий рану бактериальной нагрузки. N и 6 ран. Прививка: 105 CFU/mL PAO1. (C) Линейный регрессионный анализ in vivo люминесцентного сигнала и бактериального CFU PAO1:lux-инфицированных ран, собранных 4-7 дней после прививки с 105 CFU/mL, чтобы обеспечить диапазон бактериальных бремени. (D) Бактериальное бремя в CFU / раны с течением времени у мышей, инфицированных 105 CFU/mL PAO1:lux. (E) Изменение веса (относительно веса до операции по иссечению раны на Т -1) N 4 мышей / группы. Изображены квадратные участки для 5-95 процентиль. Статистика двусторонняя ANOVA исправлена с Sidak несколько сравнения. (F) Нелинейный регрессионный анализ частоты раневой инфекции, используемый для расчета IC50 для PAO1 три дня после прививки. Все графики являются репрезентативными для экспериментов n-3. Эта цифра была изменена с Sweere et al. 201913. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Мы разработали новый задержки прививки P. aeruginosa раны инфекции модели. Стратегия задержки прививки с бактериями до 24 ч после иссечения раны позволяет оценки рановых инфекций в течение 1-недельного периода времени. С помощью люминесцентного штамма P. aeruginosa,можно отслеживать прогрессирование инфекции на протяжении всего инфекционного курса. Более длительный курс инфекции по сравнению с другими p. aeruginosa инфекции модели позволят новые возможности для изучения принимающей патоген взаимодействия и новые методы лечения ориентации P. aeruginosa раны инфекций. Например, мы уже использовали эту модель, чтобы продемонстрировать роль бактериофага Pf в стимулировании противовирусного иммунного ответа, что позволяет P. aeruginosa уклоняться от иммунной системы хозяина14.
Включение 24 ч времени восстановления между иссецисионной хирургии раны и бактериальной прививки является критическим шагом в этой модели раны инфекции. Это позволяет животным оправиться от операции на ране до заражения, что, вероятно, играет определенную роль в их способности выжить в течение по крайней мере 7 дней. Кроме того, он поддерживает формирование предварительной раневой матрицы до прививки, которая, в сочетании с прозрачной пленкой, обеспечивает среду, способствующую образованию биопленки. Мы провели серию поисковых экспериментов во время разработки этой модели, рассматривая различные количества времени между ранением и прививкой. По нашему опыту, немедленная прививка после ранения часто приводит к сепсису и смерти. И наоборот, прививка в 48 часов и более поздние временные точки приводили к неприемлемому уровню неоднородности между мышами и между ранами на одной и той же мыши. Как видно на рисунке 3A, все еще может быть некоторая степень ожидаемой неоднородности в бактериальной нагрузке инфицированных ран, даже с 24-h задержкой прививки. Один из способов компенсировать это заключается в использовании нескольких животных в каждом эксперименте.
Уникальным аспектом этого протокола является иссечение двух ран самостоятельно, а не складывание кожи по средней линии и пробивание до конца, чтобы создать две двусторонние раны, как это делается в некоторых других моделях ран. Мы обнаружили, что этот метод складывания был также эффективен для производства симметричных ран с чистыми полями. Однако, мышей обработанные в этом образе типично стали септик быстро после бактериальной прививки и умерли. Мы считаем, что это может быть потому, что этот метод складывания удаляет кожный Panniculus carnosus - тонкий слой мышц, лежащих в основе кожи мышей, которые не присутствуют в организме человека. Мы полагаем, что этот барьер может помочь предотвратить распространение бактерий.
Важным компонентом этого протокола является достаточное удаление волос с хирургического участка, так как избыток волос может обеспечить нидус для суперинфекции и мешает привязке прозрачной пленочной повязки. Мы обнаружили, что бритье в дополнение к крему для удаления волос обеспечивает оптимальное удаление волос с минимальным раздражением кожи, хотя тщательно смывает крем с теплой водой по-прежнему важно.
Другим неотъемлемым фактором является поддержка питания, увлажнение и обезболивание в течение первых нескольких дней послеоперационного и инфекционного курса. Для решения этой проблемы мы вводим 500 л подкожного 0,9% хлорида натрия в день -1 и 0, затем 250 Л л в день 1 и 2. Мы также поставляем поливитамины и калорийные жидкие гель дополнения во время операции иссечения раны. Как показано на рисунке 3E, эти меры позволяют адекватное восстановление веса к 3-му дню. Что касается обезболивания, мы обнаружили, что устойчивое освобождение 0,5 мг/кг бупренорфин дается до операции иссечения раны обеспечивает достаточный контроль боли для 72 ч, но дополнительные дозы могут быть даны, если оправдано на основе выводов бедствия в любой отдельной мыши.
Хотя модель P. aeruginosa раневой инфекции, простирающейся до 7-10 дней, является значительным преимуществом по сравнению с более острыми моделями инфекции, этого все еще может быть недостаточно для ответа на некоторые исследовательские вопросы, связанные с более хроническими инфекциями. Одной из причин этого ограничения является то, что люминесцентный сигнал ШТАММа PAO1:lux P. aeruginosa пиков на 2-3 день(рисунок 3B). Через 7 дней сигнал люциферазы может стать ненадежным. По этой причине, мы количественно бактерий путем покрытия рана сточных вод на пластинах LB и подсчета CFUs для того, чтобы подтвердить инфекцию каждой раны в конце эксперимента. Другим возможным недостатком этой модели является требование к системе визуализации in vivo, к которой некоторые лаборатории могут не иметь доступа. Один из способов обойти это препятствие заключается в использовании нелюминесцентных диких штаммов дикого типа. Это по-прежнему позволяет исследователю воспользоваться этой хронической инфекционной модели и, как указано выше, бактерии CFUs могут быть количественно в конце эксперимента.
Мы описали новую модель задержки прививки P. aeruginosa раневой инфекции, которая позволяет эксперименты, простирающиеся до 7-10 дней. Эта модель послужит полезным инструментом для оценки взаимодействия хозяина-патогена с P. aeruginosa,а также для разработки новых методов лечения. Эта модель имеет потенциал для нескольких будущих направлений, втомь адаптацию для других патогенов раны, таких как золотистый стафилококк,а также полимикробных инфекций, включая P. aeruginosa в сочетании с другими патогенными микроорганизмами.
Раскрытие информации
Авторы не имеют конкурирующих финансовых интересов раскрывать.
Благодарности
PUT-Tn5-EM7-lux-Km1 люминесцентный вектор конструкции был добрый подарок от J. Харди. Схемы создавались с BioRender.com. Мы благодарим лабораторию Г. Гуртнера за их советы по модели раневой инфекции. Мы также благодарим Т. Дойла из Стэнфордского центра инноваций в In Vivo Imaging за его технический опыт. Эта работа была поддержана грантами R21AI13370, R21AI133240, R01AI12492093, а также грантами Стэнфордского СПАРК, Фонда медицинских исследований Фалька и Фонда мукситического фиброза (CFF) P.L.B. C.R.D. Габилан Стэнфордского стипендий по науке и технике и Люберец Страйер Bio-X Стэнфордского междисциплинарного стипендий при поддержке JMS
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride injection | Hospira | 2484457 | |
| 18 G x 1 sterile needle | BD | 305195 | |
| 25 G x 1 1/5 sterile needle | BD | 305127 | |
| Alcohol swab | BD | 326895 | |
| Aura Imaging Software | Spectral Instruments Imaging | n/a | |
| Betadine | Purdue Frederick Company | 19-065534 | |
| Buprenorphine SR LAB | Zoopharm | n/a | |
| C57BL/6J male mice | The Jackson Laboratory | 000664 | |
| Disposable biopsy punch, 6mm | Integra | 33-36 | |
| Fine scissors - Tungsten Carbide | Fine Science Tools | 14568-09 | |
| Glass Bead Dry Sterilizer | Harvard Apparatus | 61-0183 | |
| Granulated Agar | Fisher BioReagents | BP9744 | |
| Heating Pad | Milliard | 804879481218 | |
| Insulin syringe with 28 G needle | BD | 329461 | |
| Lago X Imaging System | Spectral Instruments Imaging | n/a | |
| LB broth | Fisher BioReagents | BP1426 | |
| Leur-Lok 1 mL syringe | BD | 309628 | |
| Mini Arco Animal Trimmer | Wahl Professional | 919152 | |
| Nair Hair Removal Lotion with Baby Oil | Church and Dwight | n/a | Available at any pharmacy |
| Octagon Forceps | Fine Science Tools | 11041-08 | |
| Petri dish | Falcon | 351029 | |
| Phosphate Buffered Saline (PBS) 1x | Corning | 21-040-CV | |
| Press and Seal Cling Wrap | Glad | n/a | |
| SafetyGlide Insulin syringe with 30 G needle | BD | 305934 | |
| Safetyglide Insulin syringe, 1/2 mL, 30 G x 5/16 TW | BD | 305934 | |
| Scale | Ohaus Scout Pro | SP202 | |
| Supplical Nutritional Supplement | Henry Schein Animal Health | 29908 | |
| Tegaderm, 6 cm x 7 cm | 3M | 1624W |
Ссылки
- Sen, C. K., et al. Human skin wounds: a major and snowballing threat to public health and the economy. Wound Repair and Regeneration. 17 (6), 763-771 (2009).
- Serra, R., et al. Chronic wound infections: the role of Pseudomonas aeruginosa and Staphylococcus aureus. Expert Review of Anti-infective Therapy. 13 (5), 605-613 (2015).
- Obritsch, M. D., Fish, D. N., MacLaren, R., Jung, R. Nosocomial infections due to multidrug-resistant Pseudomonas aeruginosa: epidemiology and treatment options. Pharmacotherapy. 25 (10), 1353-1364 (2005).
- Secor, P. R., et al. Filamentous Bacteriophage Produced by Pseudomonas aeruginosa Alters the Inflammatory Response and Promotes Noninvasive Infection In Vivo. Infection and Immunity. 85 (1), (2017).
- Rice, S. A., et al. The biofilm life cycle and virulence of Pseudomonas aeruginosa are dependent on a filamentous prophage. The ISME Journal. 3 (3), 271-282 (2009).
- Bayes, H. K., Ritchie, N., Irvine, S., Evans, T. J. A murine model of early Pseudomonas aeruginosa lung disease with transition to chronic infection. Scientific Reports. 6, 35838(2016).
- van Gennip, M., et al. Interactions between polymorphonuclear leukocytes and Pseudomonas aeruginosa biofilms on silicone implants in vivo. Infection and Immunity. 80 (8), 2601-2607 (2012).
- Trøstrup, H., et al. Pseudomonas aeruginosa biofilm aggravates skin inflammatory response in BALB/c mice in a novel chronic wound model. Wound Repair and Regeneration. 21 (2), 292-299 (2013).
- Zhao, G., et al. Time course study of delayed wound healing in a biofilm-challenged diabetic mouse model. Wound Repair and Regeneration. 20 (3), 342-352 (2012).
- Brubaker, A. L., Rendon, J. L., Ramirez, L., Choudhry, M. A., Kovacs, E. J. Reduced neutrophil chemotaxis and infiltration contributes to delayed resolution of cutaneous wound infection with advanced age. Journal of Immunolology. 190 (4), 1746-1757 (2013).
- Watters, C., et al. Pseudomonas aeruginosa biofilms perturb wound resolution and antibiotic tolerance in diabetic mice. Medical Microbiology and Immunology. 202 (2), 131-141 (2013).
- Lee, C., Kerrigan, C. L., Picard-Ami, L. A. Cyclophosphamide-induced neutropenia: effect on postischemic skin-flap survival. Plastic and Reconstructive Surgery. 89 (6), 1092-1097 (1992).
- Sweere, J. M., et al. The immune response to Chronic Pseudomonas aeruginosa wound infection in immunocompetent mice. Advances in Wound Care. , (2019).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science. 363 (6434), (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены