Method Article
Um modelo de inoculação retardada da infecção crônica de pseudomonas aeruginosa ferida
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Descrevemos um protocolo de inoculação atrasado para gerar infecções crônicas de feridas em camundongos imunocompetentes.
Resumo
Pseudomonas aeruginosa (P. aeruginosa) é um grande patógeno nosocomial de crescente relevância para a saúde e doença humana, particularmente no cenário de infecções crônicas de feridas em pacientes diabéticos e hospitalizados. Há uma necessidade urgente de modelos de infecção crônica para auxiliar na investigação da patogênese ferida e no desenvolvimento de novas terapias contra esse patógeno. Aqui, descrevemos um protocolo que usa inoculação atrasada 24 horas após ferimentos excisional de espessura total. A infecção da matriz de feridas provisórias presente neste momento, ou a liberação rápida ou a disseminação da infecção e, em vez disso, estabelece infecção crônica que dura de 7 a 10 dias sem a necessidade de implantação de materiais estranhos ou supressão imunológica. Este protocolo imita um curso temporal típico de infecção pós-operatória em humanos. O uso de uma cepa luminescente P. aeruginosa (PAO1:lux) permite a avaliação diária quantitativa da carga bacteriana para infecções por feridas P. aeruginosa. Este novo modelo pode ser uma ferramenta útil na investigação da patogênese bacteriana e no desenvolvimento de novas terapias para infecções crônicas de feridas P. aeruginosa.
Introdução
Pseudomonas aeruginosa (P. aeruginosa) é uma bactéria em forma de vara gram-negativa com crescente relevância para a saúde e doenças humanas. É responsável pela morbidade e mortalidade extensivas em ambientes nosocomiais, particularmente envolvendo infecções por feridas em pacientes imunocomprometidos1,2. O surgimento de cepas multidrogaresistentes deste patógeno proporcionou mais impulso para a investigação de fatores que contribuem para a virulência P. aeruginosa, mecanismos de resistência a antibióticos P. aeruginosa e novos métodos de prevenção e tratamento desta infecção mortal3. Como tal, a necessidade de modelos animais de infecção por feridas crônicas como ferramentas para investigar essas questões de pesquisa nunca foi tão grande.
Infelizmente, muitos modelos animais de infecção por P. aeruginosa tendem a simular infecção aguda com resolução rápida de infecção ou declínio rápido devido à sepse4,5, que não simula adequadamente a natureza frequentemente crônica dessas infecções. Para resolver essa desvantagem, alguns modelos utilizam a implantação de corpos estranhos, como contas de agar, implantes de silicone ou géis alginatos6,7,8. Outros modelos usam camundongos imunocomprometidos devido à idade avançada, obesidade ou diabetes, ou por meios farmacológicos como neutropenia induzida por ciclofosfhamide9,10,11,12. No entanto, ou o uso de materiais estranhos ou hospedeiros imunes comprometidos provavelmente altera o processo inflamatório local, dificultando a compreensão da fisiopatologia envolvida em infecções crônicas de feridas em hospedeiros com sistemas imunológicos normais.
Desenvolvemos um modelo crônico de infecção por ferida de P. aeruginosa em camundongos que envolve inoculação tardia com bactérias após ferimentos excisional. A inoculação retardada permite experimentos que avaliam a carga bacteriana que se estende por pelo menos 7 dias. Este modelo abre novas oportunidades para investigar tanto a patogênese quanto novos tratamentos de infecções crônicas p. aeruginosa.
Protocolo
Todos os métodos aqui descritos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade de Stanford.
1. Preparação e crescimento de bactérias
- Realizar todo o trabalho com P. aeruginosa e animais com precauções BSL-2 de acordo com o comitê institucional de biossegurança do pesquisador e diretrizes do comitê de uso de animais. Faça todas as etapas descritas aqui envolvendo P. aeruginosa, incluindo a inoculação do rato, em um armário de biossegurança.
- A cepa luminescente PAO1:lux de P. aeruginosa está disponível em nosso laboratório por solicitação. Raia PAO1, armazenada como estoque de glicerol congelado, no agar Lysogeny Broth (LB). Para a cepa luminescente PAO1:lux, a agar LB deve conter antibióticos seletivos (100 μg/mL carbenicillin e 12,5 μg/mL kanamicina). Cresça a 37 °C durante a noite em uma incubadora bacteriana.
- Escolha uma colônia isolada e cresça durante a noite a 37 °C em 3 ml lb médio, pH 7.4. Para cepas luminescentes, o caldo deve conter 100 μg/mL carbenicillin. Cresça condições aeróbicas.
2. Preparação do procedimento
- Faça com que todo o pessoal que faça a cirurgia use um vestido limpo/jaleco, máscara facial, rede de cabelo e luvas.
- Autoclave todas as ferramentas cirúrgicas, incluindo tesouras e fórceps. Use técnica asséptica para esterilizar ferramentas entre animais.
- Limpe a mesa cirúrgica com etanol e prepare um campo cirúrgico limpo.
3. Depilação
- Anestesiados de 8 a 12 semanas de camundongos C57BL/6J usando ratos C57BL/6J de 8 a 12 semanas usando 1%-3% isoflurane. Os investigadores devem seguir as diretrizes da equipe veterinária de sua instituição para anestesia ao usar isoflurane.
- Inicie a anestesia entregando 1%-3% de isoflurano e ajuste a taxa de fluxo de oxigênio para 1,5 L/min. Coloque o mouse na câmara de indução.
- Belisque o dedo do rato para avaliar a profundidade da anestesia. Quando o rato não responde mais à estimulação, remova-o da câmara de indução e coloque-o no banco cirúrgico com o nariz no cone do nariz isoflurano.
- Aplique lubrificante ocular em ambos os olhos.
- Pesar o mouse para obter um peso pré-procedimento da linha de base.
- Coloque o rato em posição propensa. Injete o mouse subcutâneamente com estéril pré-aquecido 0,9% cloreto de sódio, 250 μL em cada flanco para um total de 500 μL.
- Raspe a área dorsal do mouse usando uma máquina elétrica. A barba deve ocorrer em um local diferente da estação cirúrgica para evitar a contaminação capilar da ferida.
- Aplique uma fina camada de loção de depilação. Deixe a loção sentar para 20-60 s. Remova o cabelo e o excesso de loção com gaze umedecida em água morna. Após a depilação, proceda para o procedimento de ferimento excisional.
4. Cirurgia de ferida excisional de espessura total
- Injete a liberação sustentada buprenorfina 0,6-1 mg/kg subcutâneamente usando uma agulha de 25 G na área dorsal média do camundongo. A liberação lenta buprenorfina proporciona alívio da dor ao longo de 48-72 h.
- Desinfete o local cirúrgico. Limpe a superfície dorsal com um cotonete de betadina estéril. Limpe o excesso de betadina com um cotonete de álcool estéril. Isso deve ser realizado 3 vezes (alternando entre betadina e álcool), cotocando movendo-se do centro de forma circular para a borda. Deixe a área secar.
- Crie uma cortina ao redor do local cirúrgico usando gaze estéril ou envoltório de aderência de plástico.
- Estique a pele esticada caudally. Use um soco estéril de biópsia da pele de 6 mm de diâmetro para fazer uma incisão inicial através da epiderme dorsal esquerda. Repita na epiderme dorsal direita.
- Use fórceps para engrossar a pele do centro da área de ferida delineada à esquerda. Excir as camadas epidérmicas e dérmicas usando tesouras. Repita na área de ferida delineada direita para criar feridas excisional simétricas.
- Lave feridas com 50 μL de soro soro estéril. Deixe que o local cirúrgico e a pele circundante sequem. Em seguida, cubra as feridas e dorsum com um vestido transparente de filme.
- Coloque o rato de volta em uma gaiola limpa. Casa 1 animal por gaiola.
- Coloque a gaiola em uma almofada de aquecimento e monitore até o rato acordar.
- Ao realizar a cirurgia acima em vários animais, use um esterilizador de contas quentes para limpar todos os instrumentos cirúrgicos entre os animais.
- Permita 24h para que os camundongos se recuperem do procedimento cirúrgico e para a formação de uma matriz de feridas provisórias sobre as feridas antes de proceder à inoculação com bactérias.
5. Inoculação com P. aeruginosa
- Diluir durante a noite pao1:lux cultura para OD600 = 0,05 em 75 mL de mídia LB contendo 100 μg/mL carbenicillin e cultivar as bactérias até que a cultura esteja em fase exponencial inicial (OD600 ◗ 0,3). Isso deve levar aproximadamente 2-3 h.
- Diluir PAO1:lux em PBS a uma concentração de (7,5 ± 2,5) x 102 CFU/mL. Certifique-se de preparar o excesso de inóculo para garantir volume suficiente e permitir o revestimento após o experimento. Se transportar entre instalações (ou seja, do laboratório para o vivarium), use dupla contenção em uma caixa de prova de vazamento claramente marcada biohazard.
- Realize todo o trabalho com P. aeruginosa e camundongos utilizando equipamentos de proteção individual aprovados em um gabinete de segurança biológica aprovado em Um Animal Biosafety Nível 2 (ABSL-2) aprovado pelo gabinete de segurança biológica (BSC). Equipamentos reutilizáveis, como a escala de pesagem, devem ser cobertos com envoltório agarrado para evitar contaminação.
- Anestesiando usando 3% de isoflurano como descrito acima. Pesar rato e registrar o peso. Injete o mouse subcutâneamente com estéril pré-aquecido 0,9% cloreto de sódio, 250 μL em cada flanco para um total de 500 μL.
- Se o vestido transparente do mouse sair durante a noite, remova cuidadosamente qualquer cicatriz resultante e coloque um novo curativo.
- Use uma seringa de tampa de segurança de 500 μL 27 G para injetar 40 μL da suspensão PAO1:lux através da imagem transparente vestindo em cada ferida. Diferentes camundongos devem ser usados para controles de feridas não inoculados/PBS, a fim de evitar contaminação cruzada do lado contralateral.
- Coloque o mouse de volta em sua gaiola em uma almofada de aquecimento e monitore até que ele acorde. Todos os ratos devem ser alojados individualmente em gaiolas separadas para evitar contaminação cruzada.
- Forneça pasta de suplemento nutricional de alta caloria sanduíche entre pelotas de alimentos no chão da gaiola.
- Use o inóculo restante para estar uma placa de agar LB. Conde colônias para confirmar o número de bactérias administradas.
6. Em imagens invivo de feridas infectadas
- Siga os protocolos de contenção BSL-2 para o transporte de camundongos de e para o instrumento de imagem, incluindo o uso de um recipiente secundário. Tenha cuidado para não transferir ou soltar qualquer cama animal durante a transferência do rato para a câmara de indução ou instrumento de imagem.
- Induzir anestesia do camundongo com isoflurano inalado de 1%-3% em uma câmara de indução, conforme descrito na etapa 3.1.
- Uma vez anestesiado o mouse, coloque-o em posição propensa na câmara de imagem de um sistema óptico de imagem com o nariz no cone do nariz isoflurano.
- Abra o programa de software.
- Os parâmetros de aquisição variarão com base no número de animais imagems simultaneamente e intensidade da bioluminescência. Os parâmetros básicos a serem definidos incluem tempo de exposição, binning, f/stop e campo de visão (FOV). Nossas configurações iniciais padrão são o tempo de exposição 30 segundos, binning low (2), f/stop 1.2 e FOV 25. Ajuste essas configurações conforme necessário, dependendo das necessidades do pesquisador.
- Analisar dados de luminescência usando um programa de imagem (ver Tabela de Materiais). Luminescência será representada como uma imagem pseudocolor sobreposta em uma fotografia colorida dos ratos.
- Crie uma região de interesse (ROI) no local da ferida e meça o fluxo médio (fótons/segundo) detectados. Observe que os dados também podem ser relatados como brilho (fótons/segundo/cm²/steradiano), mas desde que a distância da plataforma de imagem da câmera permaneça constante entre a imagem, o fluxo é suficiente.
- Meça o fundo criando um ROI em uma área aleatória na plataforma de imagem. Subtraia o número de antecedentes de fótons/segundo.
- Exporte os dados para uma planilha para análise si só.
- Realizar imagens como descrito acima como diariamente para rastrear a progressão da infecção.
7. Gestão pós-operatória
- Monitorar camundongos de acordo com as diretrizes estabelecidas pelo protocolo iACUC do pesquisador. Monitoramos todos os ratos diariamente durante os primeiros 4 dias, depois a cada dois dias até o final do experimento. Pesar os camundongos uma vez por dia durante os primeiros 4 dias após a cirurgia em um BSC. Injete 250 μL de 0,9% de cloreto de sódio subcutânea nos dias pós-infecção 1 e 2.
- Verifique se há sinais de dor/angústia nos camundongos, incluindo postura curvada, casaco desleixado, letargia, dificuldade para respirar, careta facial e perda de peso.
- Se os animais apresentarem sinais de deterioração da saúde, consulte um veterinário. Qualquer rato que pareça mostrar sinais piores de dor/angústia e perda de peso de 20% ou mais deve ser eutanizado.
8. Excisão de ferida
- No final do experimento, sacrifique os camundongos usando inalação de CO2, seguido de luxação cervical. Descarte a carcaça animal de acordo com os protocolos ABSL-2 da instituição.
- Leitos de feridas de consumo usando tesouras e fórceps estéreis em um BSC. Coloque cada cama ferida em 1 mL de PBS estéril em um tubo de polipropileno de 1,5 mL. Pique o tecido da ferida com uma tesoura. Todas as feridas devem ser tratadas como ASBL-2, mesmo que não sejam consideradas infectadas.
- Incubar em um shaker a 300 rpm por 2 h a 4 °C. Vórtice cada tubo para 10 s e diluir serialmente o efluente bacteriano em PBS. Plaquere o efluente bacteriano diluído em agar LB para enumerar a carga bacteriana.
- Considere feridas infectadas se o sinal luminescente na ferida estiver acima da luminescência do fundo e mais bactérias são detectadas no efluente da ferida do que em feridas inoculadas com PBS como controle.
Resultados
Utilizando uma cepa luminescente de PAO1 com uma codificação plasmídea codificando o sistema de repórteres luxABCDE (PAO1:lux), realizamos ferimentos excisional em camundongos, inoculamos essas feridas com plânctnico P. aeruginosa 24 h depois, e medimos carga bacteriana ao longo do tempo (Figura 1 e Figura 2). Uma imagem representativa obtida usando um sistema óptico de imagem demonstra que este modelo resulta em luminescência detectável (Figura 3A). A infecção atingiu o pico no 3º dia após a inoculação e persistiu 7 dias após a inoculação com base tanto na bioluminescência quanto nas contagens das colônias(Figura 3B-C). Usando este modelo, somos capazes de gerar feridas com duração de 7 a 10 ays, dependendo da cepa de bactérias e do fundo do mouse. A cultura das bactérias isoladas da ferida mostrou que a CFU/ferida quantificada correlacionada com a luminescência detectada (Figura 3D). Finalmente, apesar da infecção p. aeruginosa comprovada e quantificável, os camundongos sobreviveram por pelo menos 7 dias. Embora tenha havido perda de peso rápida inicial imediatamente após a infecção, injeções salinais e nutrição suplementar resultaram na restauração do peso (Figura 3E). Finalmente, calculamos a dose de inoculação na qual 50% das feridas seriam infectadas de forma sustentável com pao1. O valor calculado ic50 foi ~7,7 x 102 CFU/mL. Doses superiores a 104 UFC/mL resultaram em 100% de taxa de infecção(Figura 3F). Esses resultados foram adaptados a partir dos dados publicados anteriormente13.
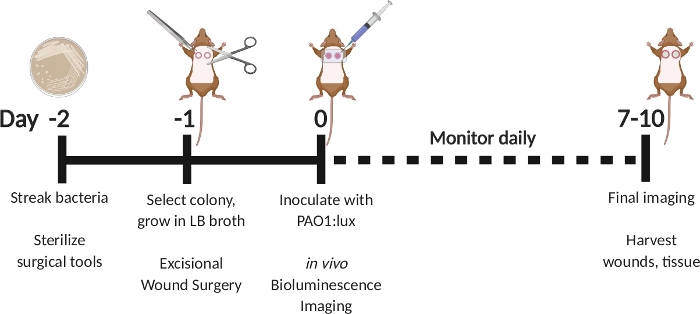
Figura 1: Esquemática representando o modelo de infecção por feridas de espessura total excisional com inoculação retardada com P. aeruginosabioluminescente . Raia PAO1:lux no dia -2. Selecione uma colônia no dia -1 e cresça durante a noite no caldo LB. Realizar uma cirurgia de ferida excisional no dia -1. No dia 0, inocular com PAO1:lux injetando na cama da ferida através do vestido transparente de filme. Realizar imagens de bioluminescência após a inoculação. Repita a imagem tão frequentemente quanto o dia 7-10. No dia 7 a 10, sacrificar animais e colher feridas. Clique aqui para ver uma versão maior deste valor.

Figura 2: Esquema da cirurgia de ferida excisional. Após a depilação e esterilização da pele com álcool e betadina, use um soco de biópsia de 6 mm para fazer uma incisão inicial através da epiderme do dorso esquerdo e direito. Use tesouras e fórceps para remover as camadas dérmicas e epidérmicas. Lave com PBS. Cubra com um curativo claro. Clique aqui para ver uma versão maior deste valor.

Figura 3: Infecção por ferida p. aeruginosa pode ser detectada através de 7 dias de infecção. (A) Imagem representativa de um rato infectado com PAO1:lux com sobreposição de bioluminescência em feridas excisional. (B)Sinal luminescente refletindo carga bacteriana ferida. N = 6 feridas. Inoculação: 105 CFU/mL PAO1. (C) A análise linear de regressão do sinal luminescente in vivo e da CFU bacteriana de feridas infectadas por PAO1:lux, coletada sem 4 a 7 dias após a inoculação com 105 UFC/mL para permitir uma série de cargas bacterianas. (D) Carga bacteriana na CFU/ferida ao longo do tempo em camundongos infectados com 105 CFU/mL PAO1:lux. (E) Mudança de peso (em relação ao peso antes da cirurgia de excisão da ferida em T = -1) N = 4 camundongos/grupo. Retratados são boxplots para 5-95 percentil. As estatísticas são de duas vias ANOVA corrigidas com comparação múltipla do Sidak. (F)Análise de regressão não linear da taxa de infecção por feridas usada para calcular o IC50 para PAO1 três dias após a inoculação. Todos os gráficos são representativos de experimentos n≥3. Esse número foi modificado a partir de Sweere et al. 201913. Clique aqui para ver uma versão maior deste valor.
Discussão
Desenvolvemos um novo modelo de infecção por feridas de inoculação tardia P. aeruginosa. A estratégia de retardar a inoculação com bactérias até 24 h após o ferimento excisional permite a avaliação de infecções por feridas durante um prazo de 1 semana. Usando uma cepa luminescente de P. aeruginosa,é possível rastrear a progressão da infecção ao longo do curso de infecção. O curso mais longo de infecção em comparação com outros modelos de infecção por P. aeruginosa permitirá novas oportunidades para estudar interações hospedpatas-patógenas e novas terapias voltadas para infecções por feridas P. aeruginosa. Por exemplo, já usamos esse modelo para demonstrar o papel da pf bacteriófago no estímulo a uma resposta imune antiviral que permite que P. aeruginosa fuja do sistema imunológico hospedeiro14.
A inclusão de 24h de tempo de recuperação entre a cirurgia de ferida excisional e a inoculação bacteriana é um passo fundamental neste modelo de infecção por feridas. Permite que os animais se recuperem da cirurgia de ferida antes de serem infectados, o que provavelmente desempenha um papel em sua capacidade de sobreviver por pelo menos 7 dias. Além disso, apoia a formação de uma matriz de feridas provisórias antes da inoculação, que, em combinação com o vestido transparente de filme, proporciona um ambiente propício à formação de biofilmes. Realizamos uma série de experimentos exploratórios durante o desenvolvimento deste modelo olhando para diferentes quantidades de tempo entre ferimentos e inoculação. Em nossa experiência, a inoculação imediata após ferir muitas vezes resulta em sepse e morte. Por outro lado, a inoculação em 48 horas e pontos de tempo posteriores levou a níveis inaceitáveis de heterogeneidade entre camundongos e entre feridas no mesmo rato. Como evidente na Figura 3A,ainda pode haver algum grau de heterogeneidade esperada na carga bacteriana de feridas infectadas, mesmo com a inoculação tardia de 24 h. Uma maneira de compensar isso é usar vários animais em cada experimento.
Um aspecto único deste protocolo é a excisão de duas feridas independentemente em vez de dobrar a pele pela linha média e perfurar para criar duas feridas bilaterais, como é feito em alguns outros modelos de feridas. Descobrimos que este método dobrável também era eficaz para produzir feridas simétricas com margens limpas. No entanto, os camundongos tratados dessa maneira tipicamente se tornaram sépticos rapidamente após a inoculação bacteriana e morreram. Acreditamos que isso pode ser porque este método dobrável remove o carnoso de Panniculus dérmico - uma fina camada de músculo subjacente à pele de camundongos que não está presente em humanos. Especulamos que essa barreira pode ajudar a prevenir a disseminação bacteriana.
Um componente importante deste protocolo é a depilação suficiente do local cirúrgico, pois o excesso de cabelo poderia fornecer um nidus para superinfecção e interfere na adesão do curativo transparente do filme. Descobrimos que a barba além do creme de depilação fornece remoção de cabelo ideal com irritação mínima da pele, embora lavar completamente o creme com água morna ainda seja importante.
Outro fator integral é o apoio nutricional, hidratação e controle da dor durante os primeiros dias do curso pós-cirúrgico e infecção. Para resolver isso, administramos 500 μL de cloreto de sódio subcutâneo 0,9% no dia -1 e 0, depois 250 μL nos dias 1 e 2. Também fornecemos um suplemento de gel líquido multivitamínico e calórico no momento da cirurgia de ferida excisional. Como demonstrado na Figura 3E,essas medidas permitem a recuperação adequada do peso até o dia 3. Em relação à analgesia, descobrimos que a liberação sustentada de 0,5 mg/kg buprenorfina dada antes da cirurgia de ferida excisional fornece controle suficiente da dor para 72h, mas doses adicionais podem ser dadas se justificadas com base em achados de angústia em qualquer camundongo individual.
Embora um modelo de infecção por ferida p. aeruginosa que se estende por 7 a 10 dias seja uma vantagem significativa sobre modelos mais agudos de infecção, isso ainda pode não ser suficiente para responder a certas questões de pesquisa envolvendo mais infecções crônicas. Uma das razões para essa limitação é que o sinal luminescente da cepa PAO1:lux dos picos p. aeruginosa no dia 2-3(Figura 3B). Depois de ~7 dias, o sinal de luciferase pode se tornar não confiável. Por essa razão, quantificamos as bactérias emplacando efluentes de feridas em placas LB e contando CFUs para confirmar a infecção de cada ferida no final do experimento. Outra possível desvantagem desse modelo é a exigência de um sistema de imagem in vivo, ao qual alguns laboratórios podem não ter acesso. Uma maneira de contornar esse obstáculo é usar cepas bacterianas do tipo selvagem não luminescentes. Isso ainda permite que o pesquisador aproveite esse modelo de infecção crônica e, como indicado acima, as CFUs bacterianas podem ser quantificadas no final do experimento.
Descrevemos um novo modelo de infecção por ferida de inoculação retardada P. aeruginosa que permite que experimentos se estendam para 7-10 dias. Este modelo servirá como uma ferramenta útil para avaliar a interação hospedeiro-patógeno com P. aeruginosa,bem como o desenvolvimento de novas terapias. Este modelo tem potencial para múltiplas direções futuras, incluindo adaptação para outros patógenos de feridas, como Staphylococcus aureus,bem como infecções polimicrobianas, incluindo P. aeruginosa combinada com outros patógenos.
Divulgações
Os autores não têm interesses financeiros concorrentes para divulgar.
Agradecimentos
O vetor de construção luminescente pUT-Tn5-EM7-lux-Km1 foi um presente gracioso de J. Hardy. Os esquemas foram criados com BioRender.com. Agradecemos ao laboratório de G. Gurtner por seus conselhos sobre o modelo de infecção por feridas. Também agradecemos a T. Doyle, do Stanford Center for Innovation in In Vivo Imaging, por sua experiência técnica. Este trabalho foi apoiado por subsídios R21AI133370, R21AI133240, R01AI12492093, e subsídios da Stanford SPARK, do Falk Medical Research Trust e da Cystic Fibrosis Foundation (CFF) para p.L.B. C.R.D foi apoiado pela T32AI007502. Uma Bolsa de Pós-Graduação em Ciência e Engenharia de Gabilan Stanford e uma Lubert Stryer Bio-X Stanford Interdisciplinar Graduate Fellowship apoiaram j.M.S.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride injection | Hospira | 2484457 | |
| 18 G x 1 sterile needle | BD | 305195 | |
| 25 G x 1 1/5 sterile needle | BD | 305127 | |
| Alcohol swab | BD | 326895 | |
| Aura Imaging Software | Spectral Instruments Imaging | n/a | |
| Betadine | Purdue Frederick Company | 19-065534 | |
| Buprenorphine SR LAB | Zoopharm | n/a | |
| C57BL/6J male mice | The Jackson Laboratory | 000664 | |
| Disposable biopsy punch, 6mm | Integra | 33-36 | |
| Fine scissors - Tungsten Carbide | Fine Science Tools | 14568-09 | |
| Glass Bead Dry Sterilizer | Harvard Apparatus | 61-0183 | |
| Granulated Agar | Fisher BioReagents | BP9744 | |
| Heating Pad | Milliard | 804879481218 | |
| Insulin syringe with 28 G needle | BD | 329461 | |
| Lago X Imaging System | Spectral Instruments Imaging | n/a | |
| LB broth | Fisher BioReagents | BP1426 | |
| Leur-Lok 1 mL syringe | BD | 309628 | |
| Mini Arco Animal Trimmer | Wahl Professional | 919152 | |
| Nair Hair Removal Lotion with Baby Oil | Church and Dwight | n/a | Available at any pharmacy |
| Octagon Forceps | Fine Science Tools | 11041-08 | |
| Petri dish | Falcon | 351029 | |
| Phosphate Buffered Saline (PBS) 1x | Corning | 21-040-CV | |
| Press and Seal Cling Wrap | Glad | n/a | |
| SafetyGlide Insulin syringe with 30 G needle | BD | 305934 | |
| Safetyglide Insulin syringe, 1/2 mL, 30 G x 5/16 TW | BD | 305934 | |
| Scale | Ohaus Scout Pro | SP202 | |
| Supplical Nutritional Supplement | Henry Schein Animal Health | 29908 | |
| Tegaderm, 6 cm x 7 cm | 3M | 1624W |
Referências
- Sen, C. K., et al. Human skin wounds: a major and snowballing threat to public health and the economy. Wound Repair and Regeneration. 17 (6), 763-771 (2009).
- Serra, R., et al. Chronic wound infections: the role of Pseudomonas aeruginosa and Staphylococcus aureus. Expert Review of Anti-infective Therapy. 13 (5), 605-613 (2015).
- Obritsch, M. D., Fish, D. N., MacLaren, R., Jung, R. Nosocomial infections due to multidrug-resistant Pseudomonas aeruginosa: epidemiology and treatment options. Pharmacotherapy. 25 (10), 1353-1364 (2005).
- Secor, P. R., et al. Filamentous Bacteriophage Produced by Pseudomonas aeruginosa Alters the Inflammatory Response and Promotes Noninvasive Infection In Vivo. Infection and Immunity. 85 (1), (2017).
- Rice, S. A., et al. The biofilm life cycle and virulence of Pseudomonas aeruginosa are dependent on a filamentous prophage. The ISME Journal. 3 (3), 271-282 (2009).
- Bayes, H. K., Ritchie, N., Irvine, S., Evans, T. J. A murine model of early Pseudomonas aeruginosa lung disease with transition to chronic infection. Scientific Reports. 6, 35838(2016).
- van Gennip, M., et al. Interactions between polymorphonuclear leukocytes and Pseudomonas aeruginosa biofilms on silicone implants in vivo. Infection and Immunity. 80 (8), 2601-2607 (2012).
- Trøstrup, H., et al. Pseudomonas aeruginosa biofilm aggravates skin inflammatory response in BALB/c mice in a novel chronic wound model. Wound Repair and Regeneration. 21 (2), 292-299 (2013).
- Zhao, G., et al. Time course study of delayed wound healing in a biofilm-challenged diabetic mouse model. Wound Repair and Regeneration. 20 (3), 342-352 (2012).
- Brubaker, A. L., Rendon, J. L., Ramirez, L., Choudhry, M. A., Kovacs, E. J. Reduced neutrophil chemotaxis and infiltration contributes to delayed resolution of cutaneous wound infection with advanced age. Journal of Immunolology. 190 (4), 1746-1757 (2013).
- Watters, C., et al. Pseudomonas aeruginosa biofilms perturb wound resolution and antibiotic tolerance in diabetic mice. Medical Microbiology and Immunology. 202 (2), 131-141 (2013).
- Lee, C., Kerrigan, C. L., Picard-Ami, L. A. Cyclophosphamide-induced neutropenia: effect on postischemic skin-flap survival. Plastic and Reconstructive Surgery. 89 (6), 1092-1097 (1992).
- Sweere, J. M., et al. The immune response to Chronic Pseudomonas aeruginosa wound infection in immunocompetent mice. Advances in Wound Care. , (2019).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science. 363 (6434), (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados