Method Article
Ein verzögertes Impfmodell der chronischen Pseudomonas aeruginosa Wundinfektion
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Wir beschreiben ein verzögertes Impfprotokoll zur Erzeugung chronischer Wundinfektionen bei immunkompetenten Mäusen.
Zusammenfassung
Pseudomonas aeruginosa (P. aeruginosa) ist ein großer nosokomialer Erreger von zunehmender Relevanz für die menschliche Gesundheit und Krankheit, insbesondere bei chronischen Wundinfektionen bei Diabetikern und stationären Patienten. Es besteht ein dringender Bedarf an chronischen Infektionsmodellen, die bei der Untersuchung der Wundpathogenese und der Entwicklung neuer Therapien gegen diesen Erreger helfen. Hier beschreiben wir ein Protokoll, das eine verzögerte Impfung 24 Stunden nach der exzisionalen Verwundung mit voller Dicke verwendet. Die Infektion der provisorischen Wundmatrix, die zu diesem Zeitpunkt vorhanden ist, versichre entweder eine schnelle Clearance oder Verbreitung von Infektionen und stellt stattdessen eine chronische Infektion fest, die 7–10 Tage dauert, ohne dass Fremdstoffe implantation oder Immunsuppression erforderlich sind. Dieses Protokoll imitiert einen typischen zeitlichen Verlauf einer postoperativen Infektion beim Menschen. Die Verwendung eines lumineszierenden P. aeruginosa-Stamms (PAO1:lux) ermöglicht eine quantitative tägliche Beurteilung der bakteriellen Belastung für P. aeruginosa Wundinfektionen. Dieses neuartige Modell kann ein nützliches Werkzeug bei der Untersuchung der bakteriellen Pathogenese und der Entwicklung neuer Therapien für chronische P. aeruginosa Wundinfektionen sein.
Einleitung
Pseudomonas aeruginosa (P. aeruginosa) ist ein gramnegatives, stabförmiges Bakterium mit zunehmender Relevanz für die menschliche Gesundheit und Krankheit. Es ist verantwortlich für eine umfangreiche Morbidität und Mortalität in nosokomialen Umgebungen, insbesondere mit Wundinfektionen bei immungeschwächten Patienten1,2. Das Aufkommen multiresistenter Stämme dieses Erregers hat weitere Impulse für die Untersuchung von Faktoren gegeben, die zur Virulenz von P. aeruginosa, Mechanismen der Antibiotikaresistenz von P. aeruginosa und neuen Methoden zur Vorbeugung und Behandlung dieser tödlichen Infektion beitragen3. Daher war der Bedarf an Tiermodellen chronischer Wundinfektionen als Werkzeuge zur Untersuchung dieser Forschungsfragen noch nie so groß.
Leider neigen viele Tiermodelle der P. aeruginosa-Infektion dazu, eine akute Infektion mit schneller Auflösung der Infektion oder einem schnellen Rückgang aufgrund der Sepsis4,5zu simulieren, was die oft chronische Natur dieser Infektionen nicht ausreichend simuliert. Um diesen Nachteil zu beheben, nutzen einige Modelle die Implantation von Fremdkörpern wie Agarperlen, Silikonimplantaten oder Alginatgelen6,7,8. Andere Modelle verwenden Mäuse, die aufgrund des fortgeschrittenen Alters, Adipositas oder Diabetes immungeschwächt sind, oder durch pharmakologische Mittel wie Cyclophosphamid-induzierte Neutropenie9,10,11,12. Jedoch, entweder die Verwendung von Fremdstoffen oder immungeschwächte Wirte verändert wahrscheinlich den lokalen Entzündungsprozess, so dass es schwierig, ein Verständnis der Pathophysiologie in chronischen Wundinfektionen bei Wirten mit ansonsten normalen Immunsystem beteiligt zu gewinnen.
Wir haben ein chronisches Modell der P. aeruginosa Wundinfektion bei Mäusen entwickelt, das eine verzögerte Impfung mit Bakterien nach exzisionalen Wunden beinhaltet. Verzögerte Impfung ermöglicht Experimente zur Beurteilung der bakteriellen Belastung, die sich auf mindestens 7 Tage ausdehnt. Dieses Modell eröffnet neue Möglichkeiten für die Untersuchung sowohl pathogenese als auch neuer Behandlungen von chronischen Infektionen mit P. aeruginosa.
Protokoll
Alle hier beschriebenen Methoden wurden vom Institutional Animal Care and Use Committee (IACUC) der Stanford University genehmigt.
1. Vorbereitung und Wachstum von Bakterien
- Führen Sie alle Arbeiten mit P. aeruginosa und Tieren mit BSL-2-Vorkehrungen gemäß den Richtlinien des institutionellen Ausschusses für biosicherheitspolitische Sicherheit und Tierverwendungsausschüsse des Forschers durch. Führen Sie alle hier beschriebenen Schritte mit P. aeruginosa, einschließlich der Mausimpfung, in einem Biosicherheitsschrank aus.
- Der leuchtende PAO1:lux-Stamm von P. aeruginosa ist auf Anfrage in unserem Labor erhältlich. Streak PAO1, gelagert als gefrorener Glycerinbestand, auf Lysogeny Broth (LB) Agar. Für den lumineszierenden PAO1:lux-Stamm sollte LB-Agar selektive Antibiotika enthalten (100 g/ml Carbenicillin und 12,5 g/ml Kanamycin). Wachsen Sie bei 37 °C über Nacht in einem bakteriellen Inkubator.
- Wählen Sie eine isolierte Kolonie und wachsen Sie über Nacht bei 37 °C in 3 ml LB Medium, pH 7,4. Bei lumineszierenden Stämmen sollte die Brühe 100 g/ml Carbenicillin enthalten. Wachsen Sie unter schüttelnden, aeroben Bedingungen.
2. Verfahrensvorbereitung
- Lassen Sie alle Mitarbeiter, die eine Operation durchführen, ein sauberes Kleid/Lab-Mantel, Gesichtsmaske, Haarnetz und Handschuhe tragen.
- Autoklaven Sie alle chirurgischen Werkzeuge, einschließlich Schere und Zange. Verwenden Sie aseptische Technik, um Werkzeuge zwischen Tieren zu sterilisieren.
- Reinigen Sie den OPERATIONStisch mit Ethanol und bereiten Sie ein sauberes Operationsfeld vor.
3. Haarentfernung
- Anästhetisieren Sie 8–12 Wochen alte C57BL/6J-Mäuse mit 1%–3% Isofluran. Die Ermittler sollten die Richtlinien des Veterinärpersonals ihrer Institution für anästhesien befolgen, wenn isoflurane verwendet werden.
- Starten Sie die Anästhesie, indem Sie 1%–3% Isofluran liefern und den Sauerstoffdurchfluss auf 1,5 l/min einstellen. Platzieren Sie die Maus in der Induktionskammer.
- Pinch die Maus Zehen, um die Tiefe der Anästhesie zu beurteilen. Wenn die Maus nicht mehr auf Stimulation reagiert, entfernen Sie sie aus der Induktionskammer und legen Sie sie mit der Nase in den Isofluran-Nasenkegel auf die Operationsbank.
- Okularschmierstoff auf beide Augen auftragen.
- Wiegen Sie die Maus, um ein Grundgewicht vor der Prozedur zu erhalten.
- Stellen Sie die Maus in eine anfällige Position. Injizieren Sie die Maus subkutan mit vorgewärmten sterilen 0,9% Natriumchlorid, 250 l an jeder Flanke für insgesamt 500 l.
- Rasieren Sie den dorsalen Bereich der Maus mit einem elektrischen Rasierer. Die Rasur sollte an einem anderen Ort als der chirurgischen Station erfolgen, um eine Haarkontamination der Wunde zu verhindern.
- Tragen Sie eine dünne Schicht Haarentfernung Lotion. Lassen Sie die Lotion für 20-60 s sitzen. Entfernen Sie das Haar und überschüssige Lotion mit Gaze in warmem Wasser befeuchtet. Nach der Haarentfernung, gehen Sie mit dem exzisionalen Verwundungsverfahren.
4. Volle Dicke exzisionale Wundchirurgie
- Injizieren Sie das subkutane Buprenorphin 0,6–1 mg/kg subkutan mit einer 25 G Nadel im mittleren Dorsalen bereich der Maus. Langsame Freisetzung Buprenorphin bietet Schmerzlinderung über 48-72 h.
- Desinfizieren Sie die chirurgische Stelle. Wischen Sie die dorsale Oberfläche mit einem sterilen Betadine-Tupfer ab. Überschüssiges Betadin mit einem sterilen Alkoholtupfer abwischen. Dies sollte 3 Mal durchgeführt werden (abwechselnd zwischen Betadin und Alkohol), Abstriche, indem sie sich von der Mitte in einer kreisförmigen Weise an den Rand bewegen. Lassen Sie den Bereich trocknen.
- Erstellen Sie einen Vorhang, der die chirurgische Stelle mit steriler Gaze oder Kunststoff-Klebefolie umgibt.
- Stretch Haut straff kaudal. Verwenden Sie einen sterilen Hautbiopsie-Punch mit 6 mm Durchmesser, um einen ersten Schnitt durch die linke dorsale Epidermis zu machen. Wiederholen Sie dies auf der rechten dorsalen Epidermis.
- Verwenden Sie Zangen, um die Haut aus der Mitte des links umrissenen Wundbereichs zu zelten. Verbrauchen Sie die epidermalen und dermalen Schichten mit einer Schere. Wiederholen Sie dies auf der rechten Umrissbereich, um symmetrische Exzisionswunden zu erstellen.
- Wunden mit 50 l steriler Saline waschen. Lassen Sie die chirurgische Stelle und die umgebende Haut trocknen. Dann bedecken Sie die Wunden und dorsum mit einem transparenten Filmverband.
- Legen Sie die Maus wieder in einen sauberen Käfig. Haus 1 Tier pro Käfig.
- Legen Sie den Käfig auf ein Heizkissen und überwachen Sie, bis die Maus aufwacht.
- Wenn Sie die oben genannte Operation an mehreren Tieren durchführen, verwenden Sie einen heißen Perlensterilisator, um alle chirurgischen Instrumente zwischen den Tieren zu reinigen.
- Erlauben Sie 24 h für die Mäuse, sich vom chirurgischen Eingriff zu erholen und eine provisorische Wundmatrix über den Wunden zu bilden, bevor Sie mit Bakterien impfen.
5. Impfung mit P. aeruginosa
- Über Nacht PAO1:lux-Kultur auf OD600 = 0,05 in 75 ml LB-Medien verdünnen, die 100 g/ml Carbenicillin enthalten, und die Bakterien wachsen, bis sich die Kultur in einer frühen exponentiellen Phase befindet (OD600 x 0,3). Dies sollte etwa 2-3 h dauern.
- PAO1:lux in PBS auf eine Konzentration von (7,5 x 2,5) x 102 KBE/ml verdünnen. Achten Sie darauf, überschüssiges Inokulum vorzubereiten, um ausreichend Volumen zu gewährleisten und eine Beschichtung nach dem Experiment zu ermöglichen. Wenn Sie zwischen Einrichtungen (d.h. vom Labor zum Vivarium) transportieren, verwenden Sie die doppelte Einschließung in einer leckagenden Box mit deutlich emprogdiengeschützter Aufschrift Biohazard.
- Führen Sie alle Arbeiten mit P. aeruginosa und Mäusen mit zugelassener persönlicher Schutzausrüstung in einem tierbiologischen Sicherheitsschrank (ABSL-2) durch, der für biologische Sicherheit (BSC) zugelassen ist. Wiederverwendbare Geräte wie die Waage sollten mit Einertinkelfolie abgedeckt werden, um eine Kontamination zu verhindern.
- Anästhetisieren mit 3% Isofluran, wie oben beschrieben. Wiegen Sie die Maus und zeichnen Sie das Gewicht auf. Injizieren Sie die Maus subkutan mit vorgewärmten sterilen 0,9% Natriumchlorid, 250 l an jeder Flanke für insgesamt 500 l.
- Wenn das transparente Filmdressing der Maus über Nacht abgekommen ist, entfernen Sie alle resultierenden Schorf sorgfältig und ziehen Sie ein neues Dressing an.
- Verwenden Sie eine 500-L-Tuberkulin-27-G-Sicherheitskappenspritze, um 40 l der PAO1:lux-Suspension durch den transparenten Folienverband in jede Wunde zu injizieren. Verschiedene Mäuse sollten für nicht geimpfte/PBS-Wundkontrollen verwendet werden, um kreuzkontaminationen von der kontralateralen Seite zu verhindern.
- Legen Sie die Maus wieder in ihren Käfig auf einem Heizkissen und überwachen Sie, bis sie aufwacht. Alle Mäuse sollten einzeln in separaten Käfigen untergebracht werden, um kreuzkontaminationen zu verhindern.
- Bieten Sie kalorienreiche Nahrungsergänzungsmittel Paste zwischen Lebensmittelpellets auf dem Boden des Käfigs eingeklemmt.
- Verwenden Sie das restliche Inokulum, um eine LB-Agarplatte zu streichen. Zählen Sie Kolonien, um die Anzahl der verabreichten Bakterien zu bestätigen.
6. In-vivo-Bildgebung infizierter Wunden
- Befolgen Sie die BSL-2-Containment-Protokolle für den Transport von Mäusen zum und vom Bildgebungsinstrument, einschließlich der Verwendung eines sekundären Behälters. Achten Sie darauf, während des Transfers der Maus in die Induktionskammer oder das Bildgebungsinstrument keine Tierbetten zu übertragen oder fallen zu lassen.
- Induzieren Sie die Anästhesie der Maus mit inhaliertem 1%–3% Isofluran in einer Induktionskammer, wie in Schritt 3.1 beschrieben.
- Sobald die Maus anästhesiert ist, legen Sie sie in eine anfällige Position in der Bildkammer eines optischen Bildgebungssystems mit der Nase im Isofluran-Nasenkegel.
- Öffnen Sie das Softwareprogramm.
- Die Erfassungsparameter variieren je nach Anzahl der gleichzeitig abgebildeten Tiere und der Intensität der Biolumineszenz. Zu den festzulegenden grundlegenden Parametern gehören Belichtungszeit, Binning, f/Stop und Sichtfeld (FOV). Unsere Standard-Starteinstellungen sind Belichtungszeit 30 Sekunden, Binning low (2), f/stop 1.2 und FOV 25. Passen Sie diese Einstellungen je nach Bedarf an den Anforderungen des Forschers an.
- Analysieren von Lumineszenzdaten mithilfe eines Bildgebungsprogramms (siehe Tabelle der Materialien). Lumineszenz wird als Pseudofarbbild dargestellt, das auf einem Farbfoto der Mäuse überlagert wird.
- Erstellen Sie eine Region von Interesse (ROI) an der Wundstelle und messen Sie den durchschnittlichen Fluss (Photonen/Sekunde) gemessen. Beachten Sie, dass Daten auch als Ausstrahlung (Photonen/Sekunde/cm2/Steradian) gemeldet werden können, aber solange der Abstand der Bildplattform von der Kamera zwischen der Bildgebung konstant bleibt, ist der Fluss ausreichend.
- Messen Sie den Hintergrund, indem Sie einen ROI in einem zufälligen Bereich auf der Bildverarbeitungsplattform erstellen. Subtrahieren Sie die Hintergrundanzahl der Photonen/Sekunde.
- Exportieren Sie die Daten zur weiteren Analyse in eine Kalkulationstabelle.
- Führen Sie die Bildgebung wie oben beschrieben so oft wie täglich durchzuführen, um das Fortschreiten der Infektion zu verfolgen.
7. Postoperatives Management
- Überwachen Sie Mäuse gemäß den Richtlinien des IACUC-Protokolls des Forschers. Wir überwachen alle Mäuse täglich für die ersten 4 Tage, dann jeden zweiten Tag bis zum Ende des Experiments. Wiegen Sie die Mäuse einmal täglich für die ersten 4 Tage nach der Operation in einem BSC. In jizieren Sie an den Tagen 1 und 2 an den Tagen 1 und 2 2 250 l 0,9 % Natriumchlorid subkutan injizieren.
- Überprüfen Sie auf Anzeichen von Schmerzen/Distress bei den Mäusen, einschließlich geknickter Körperhaltung, schroffer Mantel, Lethargie, Atembeschwerden, Gesichtsgrimassen und Gewichtsverlust.
- Wenn Tiere Anzeichen einer Verschlechterung der Gesundheit zeigen, konsultieren Sie einen Tierarzt. Jede Maus, die sich verschlimmernde Anzeichen von Schmerz/Not und einen Gewichtsverlust von 20% oder mehr zu zeigen scheint, sollte eingeschläfert werden.
8. Wundexzision
- Am Ende des Experiments opfern Sie die Mäuse mit CO2-Inhalation, gefolgt von zervikalen Dislokationen. Entsorgen Sie den Tierkadaver gemäß den ABSL-2-Protokollen der Institution.
- Verbrauchen Sie Wundbetten mit steriler Schere und Zange in einem BSC. Legen Sie jedes Wundbett in 1 ml steriles PBS in ein 1,5 ml Polypropylenrohr. Das Wundgewebe mit einer Schere zerkleinern. Alle Wunden sollten als ASBL-2 behandelt werden, auch wenn sie nicht als infiziert gelten.
- Auf einem Shaker bei 300 Umdrehungen pro Minute für 2 h bei 4 °C inkubieren. Wirbel jede Röhre für 10 s und seriell verdünnen die bakteriellen Abwässer in PBS. Die verdünnten bakteriellen Abwässer auf LB-Agar auftragen, um die bakterielle Belastung aufzuzählen.
- Betrachten Sie Wunden infiziert, wenn Lumineszenz signal in der Wunde ist über Hintergrund Lumineszenz und mehr Bakterien in der Wunde Abwasser als in Wunden mit PBS als Kontrolle geimpft erkannt werden.
Ergebnisse
Mit einem lumineszierenden PaO1-Stamm mit einem Plasmid, das für das luxABCDE-Reportersystem (PAO1:lux) kodiert, führten wir exzisierende Verwundungen an Mäusen durch, impften diese Wunden mit planktonischem P. aeruginosa 24 h später und maßen die bakterielle Belastung im Laufe der Zeit(Abbildung 1 und Abbildung 2). Ein repräsentatives Bild, das mit einem optischen Bildsystem gewonnen wurde, zeigt, dass dieses Modell zu einer nachweisbaren Lumineszenz führt (Abbildung 3A). Die Infektion erreichte ihren Höhepunkt am Tag 3 nach der Impfung und dauerte 7 Tage nach der Impfung auf der Grundlage sowohl der Biolumineszenz als auch der Koloniezahlen an (Abbildung 3B-C). Mit diesem Modell sind wir in der Lage, verlässlich Wunden mit einer Dauer von 7-10 Ays zu erzeugen, abhängig von der Bakterienstämme und dem Maushintergrund. Die Kultur der aus der Wunde isolierten Bakterien zeigte, dass quantifizierte KBE/Wund mit der nachgewiesenen Lumineszenz korrelierten (Abbildung 3D). Schließlich überlebten Mäuse trotz nachweisbarer und quantifizierbarer P. aeruginosa-Infektion mindestens 7 Tage. Obwohl es erste schnelle Gewichtsverlust unmittelbar nach der Infektion, Saline-Injektionen und zusätzliche Ernährung führte zur Wiederherstellung des Gewichts (Abbildung 3E). Schließlich berechneten wir die Impfdosis, bei der 50% der Wunden nachhaltig mit PAO1 infiziert würden. Der berechnete IC50-Wert betrug 7,7 x 102 KBE/ml. Dosen von mehr als 104 KBE/ml führten zu einer 100%igen Infektionsrate (Abbildung 3F). Diese Ergebnisse wurden an die zuvor veröffentlichten Daten13angepasst.
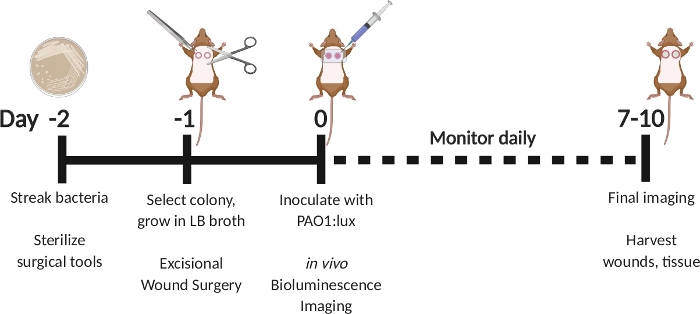
Abbildung 1: Schematische Darstellung des exzisionalen Wundinfektionsmodells mit voller Dicke mit verzögerter Impfung mit biolumineszierendem P. aeruginosa. Streak PAO1:lux am Tag -2. Wählen Sie eine Kolonie am Tag -1 und wachsen Übernacht in LB Brühe. Führen Sie eine exzissale Wundoperation am Tag -1 durch. Am Tag 0 mit PAO1:lux impfen, indem Sie durch das transparente Foliendressing in das Wundbett injizieren. Führen Sie Biolumineszenz-Bildgebung nach der Impfung durch. Wiederholen Sie die Bildgebung so oft wie täglich bis Tag 7–10. Am 7. bis 10. Tag Tiere opfern und Wunden ernten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schemat der exzisionalen Wundchirurgie. Nach der Haarentfernung und Sterilisation der Haut mit Alkohol und Betadin, verwenden Sie einen 6 mm Biopsie-Punch, um einen ersten Schnitt durch die Epidermis des linken und rechten Dorsums zu machen. Verwenden Sie Scheren und Zangen, um die dermalen und epidermalen Schichten zu entfernen. Mit PBS waschen. Abdeckung mit einem klaren Verband. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Eine P. aeruginosa Wundinfektion kann durch 7 Tage Infektion erkannt werden. (A) Repräsentatives Bild einer mit PAO1:lux infizierten Maus mit Biolumineszenz-Overlay auf exzisenden Wunden. (B) Lumineszierendes Signal, das die wunde bakterielle Belastung reflektiert. N = 6 Wunden. Impfung: 105 CFU/ml PAO1. (C) Lineare Regressionsanalyse von in vivo Lumineszenzsignal und bakterieller KBE von PAO1:lux-infizierten Wunden, gesammelt 4–7 Tage nach der Inokulation mit 105 KBE/ml, um eine Reihe von bakteriellen Belastungen zu ermöglichen. (D) Bakterielle Belastung in DerKBE/Wunde im Laufe der Zeit bei Mäusen, die mit 105 KBE/ml PAO1:lux infiziert sind. (E) Gewichtsänderung (bezogen auf das Gewicht vor der Wundexzitenoperation an T = -1) N = 4 Mäuse/Gruppe. Dargestellt sind Boxplots für 5-95 Perzentil. Statistiken sind zweiwegweise ANOVA korrigiert mit Sidak Mehrfachvergleich. (F) Nichtlineare Regressionsanalyse der Wundinfektionsrate, die zur Berechnung des IC50 für PAO1 drei Tage nach der Impfung verwendet wird. Alle Graphen sind repräsentativ für n-3-Experimente. Diese Zahl wurde von Sweere et al. 201913geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir haben ein neuartiges Modell für die verzögerte Impfung P. aeruginosa Wundinfektion entwickelt. Die Strategie, die Impfung mit Bakterien nach exzissiver Verwundung um 24 stunden zu verzögern, ermöglicht die Bewertung von Wundinfektionen über einen Zeitraum von einer Woche. Durch die Verwendung eines lumineszierenden Stammes von P. aeruginosaist es möglich, das Infektionsverlauf während des Infektionsverlaufs zu verfolgen. Der längere Infektionsverlauf im Vergleich zu anderen P. aeruginosa-Infektionsmodellen wird neue Möglichkeiten für die Untersuchung von Wirts-Pathogen-Wechselwirkungen und neuartigen Therapien ermöglichen, die auf P. aeruginosa Wundinfektionen abzielen. Zum Beispiel haben wir dieses Modell bereits verwendet, um die Rolle von Pf-Bakteriophagen bei der Stimulierung einer antiviralen Immunantwort zu demonstrieren, die es P. aeruginosa ermöglicht, dem Wirtsimmunsystem zu umgehen14.
Die Einbeziehung von 24 h Erholungszeit zwischen der exzisionalen Wundoperation und der bakteriellen Impfung ist ein entscheidender Schritt in diesem Wundinfektionsmodell. Es ermöglicht den Tieren, sich von der Wundoperation zu erholen, bevor sie infiziert werden, was wahrscheinlich eine Rolle in ihrer Fähigkeit spielt, mindestens 7 Tage zu überleben. Darüber hinaus unterstützt es die Bildung einer provisorischen Wundmatrix vor der Impfung, die in Kombination mit dem transparenten Filmverband eine der Biofilmbildung förderliche Umgebung bietet. Wir führten eine Reihe von Sondierungsexperimenten während der Entwicklung dieses Modells durch, bei denen verschiedene Zeitmengen zwischen Verwundung und Impfung untersucht wurden. Nach unserer Erfahrung führt die sofortige Impfung nach der Verwundung oft zu Sepsis und Tod. Umgekehrt führte die Impfung nach 48 Stunden und späteren Zeitpunkten zu einem inakzeptablen Grad an Heterogenität zwischen Mäusen und zwischen Wunden auf derselben Maus. Wie abbildung 3Azeigt, kann es auch bei der 24-h verzögerten Impfung noch zu einer gewissen zu erwartenden Heterogenität in der bakteriellen Belastung infizierter Wunden kommen. Eine Möglichkeit, dies zu kompensieren, besteht darin, in jedem Experiment mehrere Tiere zu verwenden.
Ein einzigartiger Aspekt dieses Protokolls ist die Exzision von zwei Wunden unabhängig, anstatt die Haut auf der Mittellinie zu falten und durchzuschlagen, um zwei bilaterale Wunden zu schaffen, wie es bei einigen anderen Wundmodellen der Fall ist. Wir fanden heraus, dass diese Faltmethode auch für die Herstellung von symmetrischen Wunden mit sauberen Rändern wirksam war. Mäuse, die auf diese Weise behandelt wurden, wurden jedoch in der Regel schnell nach der bakteriellen Impfung septisch und starben. Wir glauben, dass dies daran liegen kann, dass diese Faltmethode den dermalen Panniculus carnosus entfernt - eine dünne Muskelschicht, die der Haut von Mäusen zugrunde liegt, die beim Menschen nicht vorhanden ist. Wir spekulieren, dass diese Barriere dazu beitragen kann, die Verbreitung von Bakterien zu verhindern.
Ein wichtiger Bestandteil dieses Protokolls ist eine ausreichende Haarentfernung von der chirurgischen Stelle, da überschüssiges Haar einen Nidus für eine Superinfektion liefern könnte und die Einhaltung des transparenten Filmverbandes beeinträchtigt. Wir haben festgestellt, dass Rasur zusätzlich zur Haarentfernung Creme bietet eine optimale Haarentfernung mit minimalen Hautreizungen, obwohl gründlich abwaschen die Creme mit warmem Wasser ist immer noch wichtig.
Ein weiterer integraler Faktor ist Ernährungsunterstützung, Hydratation und Schmerzkontrolle während der ersten Tage des postoperativen und Infektionskurses. Um diesem Problem zu begegnen, verabreichen wir 500 l subkutanes 0,9% Natriumchlorid am Tag -1 und 0, dann 250 l am Tag 1 und 2. Wir liefern auch eine Multivitamin- und Kalorien-Flüssiggel-Ergänzung zum Zeitpunkt der exzisionalen Wundoperation. Wie in Abbildung 3Edargestellt, ermöglichen diese Maßnahmen eine angemessene Rückgewinnung des Gewichts bis Tag 3. In Bezug auf Analgesie haben wir festgestellt, dass eine anhaltende Freisetzung 0,5 mg/kg Buprenorphin, das vor der exzisenen Wundoperation verabreicht wurde, eine ausreichende Schmerzkontrolle für 72 h bietet, aber zusätzliche Dosen können gegeben werden, wenn dies aufgrund von Befunden von Not bei jeder einzelnen Maus gerechtfertigt ist.
Obwohl ein Modell der P. aeruginosa Wundinfektion, die sich auf 7-10 Tage erstreckt, ein signifikanter Vorteil gegenüber akuteren Infektionsmodellen ist, reicht dies möglicherweise immer noch nicht aus, um bestimmte Forschungsfragen mit chronischeren Infektionen zu beantworten. Ein Grund für diese Einschränkung ist, dass das Leuchtsignal des PAO1:lux-Stamms von P. aeruginosa an Tag 2–3(Abbildung 3B) spitzen. Nach 7 Tagen kann das Luziferase-Signal unzuverlässig werden. Aus diesem Grund quantifizieren wir die Bakterien, indem wir Wundabwässer auf LB-Platten plattieren und KBE zählen, um die Infektion jeder Wunde am Ende des Experiments zu bestätigen. Ein weiterer möglicher Nachteil dieses Modells ist die Anforderung eines In-vivo-Bildgebungssystems, auf das einige Labore möglicherweise keinen Zugriff haben. Ein Weg um dieses Hindernis ist nicht-lumineszierende wilde Art Bakterienstämme zu verwenden. Dies ermöglicht es dem Forscher immer noch, dieses modellhafte Infektion zu nutzen, und wie oben angegeben, können die Bakterien-KBE am Ende des Experiments quantifiziert werden.
Wir haben ein neuartiges Modell der verzögerten Impfung P. aeruginosa Wundinfektion beschrieben, die Experimente ermöglicht, die bis zu 7-10 Tage dauern. Dieses Modell wird als nützliches Werkzeug zur Bewertung der Wirts-Pathogen-Interaktion mit P. aeruginosadienen, sowie die Entwicklung neuer Therapien. Dieses Modell hat das Potenzial für mehrere zukünftige Richtungen, einschließlich Anpassung für andere Wundpathogene wie Staphylococcus aureus, sowie polymikrobielle Infektionen einschließlich P. aeruginosa kombiniert mit anderen Krankheitserregern.
Offenlegungen
Die Autoren haben keine konkurrierenden finanziellen Interessen offenzulegen.
Danksagungen
Der pUT-Tn5-EM7-lux-Km1 Leuchtkonstruktvektor war ein gnädiges Geschenk von J. Hardy. Schemata wurden mit BioRender.com erstellt. Wir danken dem Labor von G. Gurtner für ihre Ratschläge zum Wundinfektionsmodell. Wir danken auch T. Doyle vom Stanford Center for Innovation in In Vivo Imaging für sein technisches Know-how. Diese Arbeit wurde durch Stipendien R21AI133370, R21AI133240, R01AI12492093 und Stipendien von Stanford SPARK, dem Falk Medical Research Trust und der Cystic Fibrosis Foundation (CFF) an P.L.B. C.R.D unterstützt, die von T32AI007502 unterstützt wurde. Ein Gabilan Stanford Graduate Fellowship for Science and Engineering und ein Lubert Stryer Bio-X Stanford Interdisciplinary Graduate Fellowship unterstützten J.M.S.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride injection | Hospira | 2484457 | |
| 18 G x 1 sterile needle | BD | 305195 | |
| 25 G x 1 1/5 sterile needle | BD | 305127 | |
| Alcohol swab | BD | 326895 | |
| Aura Imaging Software | Spectral Instruments Imaging | n/a | |
| Betadine | Purdue Frederick Company | 19-065534 | |
| Buprenorphine SR LAB | Zoopharm | n/a | |
| C57BL/6J male mice | The Jackson Laboratory | 000664 | |
| Disposable biopsy punch, 6mm | Integra | 33-36 | |
| Fine scissors - Tungsten Carbide | Fine Science Tools | 14568-09 | |
| Glass Bead Dry Sterilizer | Harvard Apparatus | 61-0183 | |
| Granulated Agar | Fisher BioReagents | BP9744 | |
| Heating Pad | Milliard | 804879481218 | |
| Insulin syringe with 28 G needle | BD | 329461 | |
| Lago X Imaging System | Spectral Instruments Imaging | n/a | |
| LB broth | Fisher BioReagents | BP1426 | |
| Leur-Lok 1 mL syringe | BD | 309628 | |
| Mini Arco Animal Trimmer | Wahl Professional | 919152 | |
| Nair Hair Removal Lotion with Baby Oil | Church and Dwight | n/a | Available at any pharmacy |
| Octagon Forceps | Fine Science Tools | 11041-08 | |
| Petri dish | Falcon | 351029 | |
| Phosphate Buffered Saline (PBS) 1x | Corning | 21-040-CV | |
| Press and Seal Cling Wrap | Glad | n/a | |
| SafetyGlide Insulin syringe with 30 G needle | BD | 305934 | |
| Safetyglide Insulin syringe, 1/2 mL, 30 G x 5/16 TW | BD | 305934 | |
| Scale | Ohaus Scout Pro | SP202 | |
| Supplical Nutritional Supplement | Henry Schein Animal Health | 29908 | |
| Tegaderm, 6 cm x 7 cm | 3M | 1624W |
Referenzen
- Sen, C. K., et al. Human skin wounds: a major and snowballing threat to public health and the economy. Wound Repair and Regeneration. 17 (6), 763-771 (2009).
- Serra, R., et al. Chronic wound infections: the role of Pseudomonas aeruginosa and Staphylococcus aureus. Expert Review of Anti-infective Therapy. 13 (5), 605-613 (2015).
- Obritsch, M. D., Fish, D. N., MacLaren, R., Jung, R. Nosocomial infections due to multidrug-resistant Pseudomonas aeruginosa: epidemiology and treatment options. Pharmacotherapy. 25 (10), 1353-1364 (2005).
- Secor, P. R., et al. Filamentous Bacteriophage Produced by Pseudomonas aeruginosa Alters the Inflammatory Response and Promotes Noninvasive Infection In Vivo. Infection and Immunity. 85 (1), (2017).
- Rice, S. A., et al. The biofilm life cycle and virulence of Pseudomonas aeruginosa are dependent on a filamentous prophage. The ISME Journal. 3 (3), 271-282 (2009).
- Bayes, H. K., Ritchie, N., Irvine, S., Evans, T. J. A murine model of early Pseudomonas aeruginosa lung disease with transition to chronic infection. Scientific Reports. 6, 35838(2016).
- van Gennip, M., et al. Interactions between polymorphonuclear leukocytes and Pseudomonas aeruginosa biofilms on silicone implants in vivo. Infection and Immunity. 80 (8), 2601-2607 (2012).
- Trøstrup, H., et al. Pseudomonas aeruginosa biofilm aggravates skin inflammatory response in BALB/c mice in a novel chronic wound model. Wound Repair and Regeneration. 21 (2), 292-299 (2013).
- Zhao, G., et al. Time course study of delayed wound healing in a biofilm-challenged diabetic mouse model. Wound Repair and Regeneration. 20 (3), 342-352 (2012).
- Brubaker, A. L., Rendon, J. L., Ramirez, L., Choudhry, M. A., Kovacs, E. J. Reduced neutrophil chemotaxis and infiltration contributes to delayed resolution of cutaneous wound infection with advanced age. Journal of Immunolology. 190 (4), 1746-1757 (2013).
- Watters, C., et al. Pseudomonas aeruginosa biofilms perturb wound resolution and antibiotic tolerance in diabetic mice. Medical Microbiology and Immunology. 202 (2), 131-141 (2013).
- Lee, C., Kerrigan, C. L., Picard-Ami, L. A. Cyclophosphamide-induced neutropenia: effect on postischemic skin-flap survival. Plastic and Reconstructive Surgery. 89 (6), 1092-1097 (1992).
- Sweere, J. M., et al. The immune response to Chronic Pseudomonas aeruginosa wound infection in immunocompetent mice. Advances in Wound Care. , (2019).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science. 363 (6434), (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten