Method Article
Un modello di inoculazione ritardata dell'infezione cronica di Pseudomonas aeruginosa Wound
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Descriviamo un protocollo di inoculazione ritardata per generare infezioni croniche delle ferite nei topi immunocompetenti.
Abstract
Pseudomonas aeruginosa (P. aeruginosa) è un grave agente patogeno nosocomial e crescente rilevanza per la salute umana e le malattie, in particolare nell'impostazione di infezioni croniche delle ferite nei pazienti diabetici e ricoverati in ospedale. Vi è un'urgente necessità di modelli di infezione cronica per aiutare nello studio della patogenesi delle ferite e nello sviluppo di nuove terapie contro questo agente patogeno. Qui, descriviamo un protocollo che utilizza l'inoculazione ritardata 24 ore dopo la ferita escissionale a tutto spessore. L'infezione della matrice provvisoria della ferita presente in questo momento previene la rapida staccazione o la diffusione dell'infezione e stabilisce invece un'infezione cronica della durata di 7-10 giorni senza la necessità di impiantare materiali estranei o di soppressione immunitaria. Questo protocollo imita un tipico decorso temporale di infezione post-operatoria negli esseri umani. L'uso di un ceppo luminescente di P. aeruginosa (PAO1:lux) consente una valutazione giornaliera quantitativa del carico batterico per le infezioni da ferite da P. aeruginosa. Questo nuovo modello può essere uno strumento utile nello studio della patogenesi batterica e nello sviluppo di nuove terapie per le infezioni croniche della ferita P. aeruginosa.
Introduzione
Pseudomonas aeruginosa (P. aeruginosa) è un batterio a forma di asta Gram-negative con crescente rilevanza per la salute umana e la malattia. È responsabile di un'estesa morbilità e mortalità in contesti nosocomiali, in particolare per quanto riguarda le infezioni delle ferite nei pazienti immunocompromessi1,2. L'emergere di ceppi multifarmacoresistenti di questo agente patogeno ha fornito ulteriore impulso per l'indagine sui fattori che contribuiscono alla virulenza Di P. aeruginosa, i meccanismi della resistenza agli antibiotici P. aeruginosa e nuovi metodi per la prevenzione e il trattamento di questa infezione mortale3. Di conseguenza, la necessità di modelli animali di infezione da ferite croniche come strumenti per studiare queste domande di ricerca non è mai stata maggiore.
Purtroppo, molti modelli animali di infezione da P. aeruginosa tendono a simulare l'infezione acuta con rapida risoluzione dell'infezione o il rapido declino a causa della sepsi4,5, che non simula adeguatamente la natura spesso cronica di queste infezioni. Per risolvere questo inconveniente, alcuni modelli utilizzano l'impianto di corpi estranei come perline di agar, impianti in silicone o gel alnati6,7,8. Altri modelli utilizzano topi immunocompromessi a causa dell'età avanzata, dell'obesità o del diabete, o attraverso mezzi farmacologici come la neutropenia indotta da ciclofosofe9,10,11,12. Tuttavia, l'uso di materiali estranei o di ospiti compromessi immunitari probabilmente altera il processo infiammatorio locale, rendendo difficile comprendere la fisiopatologia coinvolta nelle infezioni croniche delle ferite negli ospiti con sistemi immunitari altrimenti normali.
Abbiamo sviluppato un modello cronico di infezione da ferita da P. aeruginosa nei topi che comporta un'inoculazione ritardata con batteri dopo la ferita escisazionale. L'inoculazione ritardata consente esperimenti che valutano il carico batterico che si estende ad almeno 7 giorni. Questo modello apre nuove opportunità per studiare sia la patogenesi che i nuovi trattamenti delle infezioni croniche di P. aeruginosa.
Protocollo
Tutti i metodi qui descritti sono stati approvati dall'Institutional Animal Care and Use Committee (IACUC) della Stanford University.
1. Preparazione e crescita dei batteri
- Condurre tutto il lavoro con P. aeruginosa e gli animali con precauzioni BSL-2 in base al comitato istituzionale per la biosicurezza del ricercatore e alle linee guida del comitato per l'uso degli animali. Eseguire tutti i passaggi qui descritti che coinvolgono P. aeruginosa, compresa l'inoculazione del topo, in un mobile di biosicurezza.
- Il ceppo luminescente PAO1:lux di P. aeruginosa è disponibile dal nostro laboratorio su richiesta. Streak PAO1, conservato come brodo di glicerolo congelato, su agar di Lysogeny Broth (LB). Per il ceppo luminescente PAO1:lux, l'agar LB deve contenere antibiotici selettivi (100 carbenicillin/mL e 12,5 g/mL di kanamycin). Coltivare a 37 gradi centigradi in un'incubatrice batterica.
- Scegli una colonia isolata e coltiva durante la notte a 37 ml in mezzo 3 ml LB, pH 7.4. Per i ceppi luminescenti, il brodo deve contenere 100 g/mL di carbenicillina. Crescere in condizioni aerobiche tremanti.
2. Preparazione della procedura
- Chiedi a tutto il personale che esegue un intervento chirurgico di indossare un abito pulito / cappotto Lab, maschera per il viso, rete per capelli e guanti.
- Autoclave tutti gli strumenti chirurgici, tra cui forbici e pinze. Utilizzare la tecnica asettica per sterilizzare gli strumenti tra gli animali.
- Pulire la tavola chirurgica con etanolo e preparare un campo chirurgico pulito.
3. Rimozione dei capelli
- Anestesizza i topi C57BL/6J di 8-12 settimane utilizzando l'1%-3% dell'isoflurane. Gli investigatori devono seguire le linee guida del personale veterinario della loro istituzione per l'anestesia quando utilizzano l'isoflurane.
- Iniziare l'anestesia erogare l'1-3% di isoflurane e regolare la portata dell'ossigeno a 1,5 L/min. Posizionare il mouse nella camera di induzione.
- Pizzica la punta del mouse per valutare la profondità dell'anestesia. Quando il mouse non risponde più alla stimolazione, rimuoverlo dalla camera di induzione e posizionarlo sul banco chirurgico con il naso nel cono naso isoflurane.
- Applicare il lubrificante oculare su entrambi gli occhi.
- Pesare il mouse per ottenere un peso pre-procedura linea di base.
- Posizionare il mouse in posizione prona. Iniettare il topo sottocutaneamente con cloruro sterile preriscaldato dello 0,9% di sodio, 250 l ad ogni fianco per un totale di 500 l.
- Rasare l'area dorsale del mouse utilizzando un rasoio elettrico. La rasatura deve avvenire in una posizione diversa rispetto alla stazione chirurgica per prevenire la contaminazione dei capelli della ferita.
- Applicare un sottile strato di lozione per la depilazione. Lascia che la lozione si sieda per 20-60 s. Rimuovere i capelli e la lozione in eccesso con una garza inumidita in acqua tiepida. Dopo la depilazione, procedere alla procedura di ferita eccisionale.
4. Chirurgia della ferita escissione a tutto spessore
- Iniettare buprenorfine sostenuta 0,6–1 mg/kg sottocutaneamente utilizzando un ago da 25 G nella zona centrale dorsale del mouse. La buprenorfine a lento rilascio fornisce sollievo dal dolore oltre 48-72 h.
- Disinfettare il sito chirurgico. Pulire la superficie dorsale con uno sterile tampone betadine. Pulire betadine in eccesso con un tampone di alcool sterile. Questo dovrebbe essere eseguito 3 volte (alternando tra betadine e alcol), swabbing muovendosi dal centro in modo circolare al bordo. Lasciare asciugare all'aria l'area.
- Creare un drappo che circonda il sito chirurgico utilizzando garza sterile o involucro di plastica.
- Allungare la pelle tesa caudally. Utilizzare un punzone sterile di biopsia cutanea di 6 mm di diametro per fare un'incisione iniziale attraverso l'epidermide dorsale sinistra. Ripetere sull'epidermide dorsale destra.
- Utilizzare pinze per tendare la pelle dal centro dell'area della ferita delineata a sinistra. Accise gli strati epidermici e dermici con le forbici. Ripetere sulla zona della ferita delineata a destra per creare ferite escisionali simmetriche.
- Lavare le ferite con 50 litri di salina sterile. Lasciare asciugare il sito chirurgico e la pelle circostante. Quindi, coprire le ferite e il dorsum con una medicazione trasparente.
- Riposizionare il mouse in una gabbia pulita. Casa 1 animale per gabbia.
- Posizionare la gabbia su una piastra di riscaldamento e monitorare fino a quando il mouse si sveglia.
- Quando si esegue l'intervento chirurgico di cui sopra su più animali, utilizzare uno sterilizzatore di perline caldo per pulire tutti gli strumenti chirurgici tra gli animali.
- Lasciare 24 h per i topi per recuperare dalla procedura chirurgica e per la formazione di una matrice provvisoria della ferita sulle ferite prima di procedere all'inoculazione con i batteri.
5. Inoculazione con P. aeruginosa
- Diluire la coltura di pPA1:lux durante la notte a OD600 x 0,05 in 75 mL di supporti LB contenenti 100 carbenicilline g/mL e far crescere i batteri fino a quando la coltura è in fase esponenziale precoce (OD600 x 0,3). Questo dovrebbe richiedere circa 2-3 h.
- Diluire PAO1:lux in PBS ad una concentrazione di (7,5 x 2,5) x 102 CFU/mL. Assicurarsi di preparare l'eccesso di inoculum per garantire un volume sufficiente e per consentire la placcatura dopo l'esperimento. Se si trasporta tra le strutture (cioè dal laboratorio al vivaio), utilizzare il doppio contenimento in una scatola di prova delle perdite chiaramente contrassegnata come Biohazard.
- Eseguire tutti i lavori con P. aeruginosa e topi utilizzando dispositivi di protezione personale approvati in un armadio di sicurezza biologico approvato Animal Biosafety Level 2 (ABSL-2). Le attrezzature riutilizzabili come la bilancia di pesatura devono essere coperte con impacchi agguati per evitare contaminazioni.
- Anestesizza recidiva utilizzando il 3% dell'isoflurane come descritto sopra. Pesare il mouse e registrare il peso. Iniettare il topo sottocutaneamente con cloruro sterile preriscaldato dello 0,9% di sodio, 250 l ad ogni fianco per un totale di 500 l.
- Se la medicazione trasparente del mouse si è staccata durante la notte, rimuovere con attenzione la crosta risultante e indossare una nuova medicazione.
- Utilizzare una siringa per cocchieri di sicurezza da 500 l 27 G per iniettare 40 gradi di sospensione PAO1:lux attraverso la medicazione trasparente della pellicola in ogni ferita. Per evitare la contaminazione incrociata dal lato contralaterale, devono essere utilizzati topi diversi.
- Posizionare nuovamente il mouse nella sua gabbia su una piastra di riscaldamento e monitorare fino a quando non si sveglia. Tutti i topi devono essere alloggiati singolarmente in gabbie separate per evitare contaminazioni incrociate.
- Fornire pasta integratore nutrizionale ad alto contenuto calorico inserita tra pellet alimentari sul pavimento della gabbia.
- Utilizzare l'inoculum rimanente per strisciare una piastra di agar LB. Conta le colonie per confermare il numero di batteri somministrati.
6. Immagini in vivo di ferite infette
- Seguire i protocolli di contenimento BSL-2 per il trasporto di topi da e verso lo strumento di imaging, incluso l'uso di un contenitore secondario. Fare attenzione a non trasferire o rilasciare alcuna biancheria da letto animale durante il trasferimento del mouse alla camera di induzione o strumento di imaging.
- Indurre l'anestesia del topo con isoflurane inalato 1-3% in una camera di induzione come descritto al punto 3.1.
- Una volta che il mouse è anetizzato, posizionarlo in posizione prona nella camera di imaging di un sistema di imaging ottico con il naso nel cono naso isoflurane.
- Aprire il programma software.
- I parametri di acquisizione variano in base al numero di animali immagine simultaneamente e all'intensità della bioluminescenza. I parametri di base da impostare includono il tempo di esposizione, la binning, il f/stop e il campo visivo (FOV). Le impostazioni di avvio predefinite sono il tempo di esposizione di 30 secondi, il binning basso (2), f/stop 1.2 e FOV 25. Regolare queste impostazioni in base alle esigenze del ricercatore.
- Analizzare i dati di luminescenza utilizzando un programma di imaging (vedere Tabella dei materiali). La luminescenza sarà rappresentata come un'immagine pseudocolore sovrapposta a una fotografia a colori dei topi.
- Creare una regione di interesse (ROI) nel sito della ferita e misurare il flusso medio (fotoni/secondo) rilevato. Si noti che i dati possono anche essere segnalati come radianza (fotoni/secondo/cm2/steradian), ma finché la distanza della piattaforma di imaging dalla fotocamera rimane costante tra l'imaging, il flusso è sufficiente.
- Misura lo sfondo creando un ROI in un'area casuale della piattaforma di imaging. Sottrarre il numero di sfondo di fotoni al secondo.
- Esportare i dati in un foglio di calcolo per un'ulteriore analisi.
- Eseguire l'imaging come descritto sopra con la frequenza con cui spesso ogni giorno per monitorare la progressione dell'infezione.
7. Gestione postoperatoria
- Monitorare i topi secondo le linee guida stabilite dal protocollo IACUC del ricercatore. Monitoriamo tutti i topi ogni giorno per i primi 4 giorni, poi a giorni alterni fino alla fine dell'esperimento. Pesare i topi una volta al giorno per i primi 4 giorni post-intervento chirurgico in un BSC. Iniettare 250 L dello 0,9% di cloruro di sodio sottocutaneamente nei giorni post-infezione 1 e 2.
- Verificare la presenza di segni di dolore/angoscia nei topi, tra cui postura curva, cappotto trasandato, letargia, difficoltà di respirazione, smorfia facciale e perdita di peso.
- Se gli animali mostrano segni di deterioramento della salute, consultare un veterinario. Qualsiasi topo che sembra mostrare segni peggiori di dolore / angoscia e una perdita di peso di 20% o superiore dovrebbe essere eutanasia.
8. Escissione della ferita
- Alla fine dell'esperimento, sacrificare i topi usando l'inalazione di CO2, seguita da lussazione cervicale. Smaltire la carcassa animale secondo i protocolli ABSL-2 dell'istituzione.
- Ascisso letti ferita utilizzando forbici sterili e pinze in un BSC. Collocare ogni letto della ferita in PBS sterile da 1 mL in un tubo di polipropilene da 1,5 ml. Mitare il tessuto della ferita con le forbici. Tutte le ferite devono essere trattate come ASBL-2, anche se non sono considerate infette.
- Incubare su uno shaker a 300 giri/min per 2 h a 4 gradi centigradi. Vorticare ogni tubo per 10 s e diluire in serie gli effluenti batterici in PBS. Piastrare gli effluenti batterici diluiti su LB agar per enumerare il carico batterico.
- Considerare le ferite infettate se il segnale luminescente nella ferita è superiore alla luminescenza di fondo e più batteri vengono rilevati nell'effluente della ferita rispetto alle ferite inocuizzate con PBS come controllo.
Risultati
Utilizzando un ceppo luminescente di PAO1 con un plasmide che codifica il luxABCDE reporter system (PAO1:lux), abbiamo eseguito la ferita eccisionale sui topi, inoculato queste ferite con planctonico P. aeruginosa 24 h più tardi, e onere batterico nel tempo(Figura 1 e Figura 2). Un'immagine rappresentativa ottenuta utilizzando un sistema ottico di imaging dimostra che questo modello produce luminescenza rilevabile (Figura 3A). L'infezione ha raggiunto il picco al terzo giorno di inoculazione e ha continuato 7 giorni dopo l'inoculazione sulla base sia della bioluminescenza che dei conteggi delle nestici(Figura 3B–C). Utilizzando questo modello, siamo in grado di generare in modo affidabile ferite della durata di 7-10 ay a seconda del ceppo di batteri e dello sfondo del topo. La coltura dei batteri isolati dalla ferita ha mostrato che la CFU/ferita quantificata era correlata alla luminescenza rilevata (Figura 3D). Infine, nonostante l'infezione da P. aeruginosa dimostrabile e quantificabile, i topi sopravvissero per almeno 7 giorni. Anche se c'era iniziale perdita di peso rapida subito dopo l'infezione, iniezioni saline e nutrizione supplementare ha portato al ripristino del peso (Figura 3E). Infine, abbiamo calcolato la dose di inoculazione alla quale il 50% delle ferite sarebbe stato infettato in modo sostenibile da PAO1. Il valore Calcolato iC50 era di 7,7 USD x 102 CFU/mL. Dosi superiori a 104 CFU/mL hanno provocato un tasso di infezione del 100% (Figura 3F). Questi risultati sono stati adattati dai dati pubblicati in precedenza13.
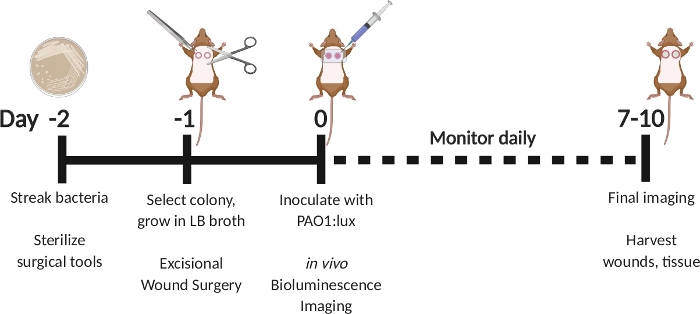
Figura 1: Schematico raffigurante il modello di infezione della ferita a grande spessore excisionale con inoculazione ritardata con bioluminescente P. aeruginosa. Streak PAO1:lux il giorno -2. Selezionare una colonia il giorno -1 e crescere durante la notte in brodo LB. Eseguire un intervento chirurgico di ferita excisionale il giorno -1. Il giorno 0, inoculare con PAO1:lux iniettando nel letto della ferita attraverso la medicazione pellicola trasparente. Eseguire l'imaging di bioluminescenza dopo l'inoculazione. Ripetere l'imaging ogni giorno fino al giorno 7-10. Il giorno 7-10, sacrifica gli animali e raccogli le ferite. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Schema della chirurgia escissionale delle ferite. Dopo la depilazione e la sterilizzazione della pelle con alcol e betadina, utilizzare un punzone biopsia di 6 mm per fare un'incisione iniziale attraverso l'epidermide del dorsum sinistro e destro. Utilizzare forbici e pinze per rimuovere gli strati dermici ed epidermici. Lavare con PBS. Coprire con una medicazione chiara. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: L'infezione da ferita da P. aeruginosa può essere rilevata attraverso 7 giorni di infezione. (A) Immagine rappresentativa di un topo infettato da PAO1:lux con sovrapposizione di bioluminescenza su ferite escissionali. (B) Segnale luminescente che riflette il carico batterico della ferita. N - 6 ferite. Inoculazione: 105 CFU/mL PAO1. (C) Analisi lineare di regressione del segnale luminescente in vivo e della CFU batterica delle ferite infettate da PAO1:lux, raccolta 4-7 giorni dopo l'inoculazione con 105 CFU/mL per consentire una serie di oneri batterici. (D) Il carico batterico nella CFU/ferita nel tempo nei topi infettati da 105 CFU/mL PAO1:lux. (E) Cambio di peso (relativo al peso prima dell'intervento chirurgico di escissione della ferita su T -1) N Sono raffigurati boxplot per 5-95 percentile. Le statistiche sono bidirezionali a Nova corrette con il confronto multiplo di Sidak. (F) Analisi di regressione non lineare del tasso di infezione della ferita utilizzata per calcolare l'IC50 per PAO1 tre giorni dopo l'inoculazione. Tutti i grafici sono rappresentativi di esperimenti n-3. Questa cifra è stata modificata da Sweere et al. 201913. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Abbiamo sviluppato un nuovo modello di infezione della ferita P. aeruginosa ritardata. La strategia di ritardare l'inoculazione con i batteri fino a 24 h dopo il ferimento eccisionale consente la valutazione delle infezioni della ferita in un lasso di tempo di 1 settimana. Utilizzando un ceppo luminescente di P. aeruginosa, è possibile monitorare la progressione dell'infezione durante il corso di infezione. Il più lungo decorso dell'infezione rispetto ad altri modelli di infezione da P. aeruginosa permetterà nuove opportunità per studiare le interazioni ospite-patogeno e nuove terapie che prendono di mira le infezioni da ferite da P. aeruginosa. Ad esempio, abbiamo già usato questo modello per dimostrare il ruolo del batteriofago Pf nello stimolare una risposta immunitaria antivirale che permette a P. aeruginosa di eludere il sistema immunitario ospite14.
L'inclusione di 24 h di tempo di recupero tra la chirurgia della ferita escisazionale e l'inoculazione batterica è un passo critico in questo modello di infezione della ferita. Permette agli animali di riprendersi dall'intervento chirurgico della ferita prima di essere infettati, che probabilmente svolge un ruolo nella loro capacità di sopravvivere attraverso almeno 7 giorni. Inoltre, supporta la formazione di una matrice provvisoria della ferita prima dell'inoculazione, che, in combinazione con la pellicola trasparente, fornisce un ambiente favorevole alla formazione di biofilm. Abbiamo eseguito una serie di esperimenti esplorativi durante lo sviluppo di questo modello esaminando diverse quantità di tempo tra ferimento e inoculazione. Nella nostra esperienza, l'inoculazione immediata dopo il ferimento spesso provoca sepsi e morte. Al contrario, l'inoculazione a 48 ore e successivi punti temporali ha portato a livelli inaccettabili di eterogeneità tra i topi e tra le ferite sullo stesso topo. Come evidente nella Figura 3A, ci può essere ancora un certo grado di eterogeneità prevista nel carico batterico di ferite infette, anche con l'inoculazione ritardata 24 ore. Un modo per compensare questo è quello di utilizzare più animali in ogni esperimento.
Un aspetto unico di questo protocollo è l'escissione di due ferite in modo indipendente piuttosto che piegare la pelle lungo la linea mediana e perforare per creare due ferite bilaterali, come avviene in alcuni altri modelli di ferita. Abbiamo scoperto che questo metodo di piegatura era efficace anche per produrre ferite simmetriche con margini puliti. Tuttavia, i topi trattati in questo modo in genere sono diventati settici rapidamente dopo l'inoculazione batterica e sono morti. Crediamo che questo possa essere dovuto al fatto che questo metodo di piegatura rimuove il dermal Panniculus carnosus - un sottile strato di muscolo alla base della pelle dei topi che non è presente negli esseri umani. Ipotizziamo che questa barriera possa aiutare a prevenire la diffusione batterica.
Una componente importante di questo protocollo è la rimozione dei peli sufficiente dal sito chirurgico, in quanto i capelli in eccesso potrebbero fornire un nidus per la superinfezione e interferisce con l'aderenza della medicazione trasparente pellicola. Abbiamo scoperto che la rasatura oltre alla crema per la rimozione dei peli fornisce la rimozione ottimale dei peli con un'irritazione minima della pelle, anche se lavare accuratamente la crema con acqua tiepida è ancora importante.
Un altro fattore integrale è il supporto nutrizionale, idratazione, e il controllo del dolore durante i primi giorni del corso postchirurgico e infezione. Per risolvere questo problema, amministriamo 500 l di cloruro di sodio sottocutaneo 0,9% il giorno -1 e 0, quindi 250 l il giorno 1 e 2. Forniamo anche un integratore di gel liquido multivitaminico e calorico al momento della chirurgia della ferita excisionale. Come illustrato nella Figura 3E, queste misure consentono un adeguato recupero del peso entro il terzo giorno. Per quanto riguarda l'analgesia, abbiamo scoperto che il rilascio sostenuto 0,5 mg/kg di buprenorphine somministrato prima della chirurgia della ferita excisionale fornisce un controllo del dolore sufficiente per 72 h, ma possono essere somministrate dosi aggiuntive se giustificate in base ai risultati di disagio in ogni singolo topo.
Anche se un modello di infezione da ferita da P. aeruginosa che si estende a 7-10 giorni è un vantaggio significativo rispetto ai modelli più acuti di infezione, questo potrebbe ancora non essere sufficiente per rispondere ad alcune domande di ricerca che coinvolgono più infezioni croniche. Uno dei motivi di questa limitazione è che il segnale luminescente del ceppo PAO1:lux di P. aeruginosa raggiunge il giorno 2–3 (Figura 3B). Dopo 7 giorni il segnale luciferasi può diventare inaffidabile. Per questo motivo, quantifichiamo i batteri placcando gli effluenti delle ferite su piastre LB e contando le CFU per confermare l'infezione di ogni ferita alla fine dell'esperimento. Un altro possibile svantaggio di questo modello è il requisito di un sistema di imaging in vivo, a cui alcuni laboratori potrebbero non avere accesso. Un modo per aggirare questo ostacolo è quello di utilizzare ceppi batterici di tipo selvatico non luminescente. Questo permette ancora al ricercatore di sfruttare questo modello di infezione cronica e, come indicato sopra, i batteri CFU possono essere quantificati alla fine dell'esperimento.
Abbiamo descritto un nuovo modello di inoculazione ritardata dell'infezione da ferita da P. aeruginosa che consente esperimenti che si estendono fino a 7-10 giorni. Questo modello servirà come uno strumento utile per valutare l'interazione ospite-patogeno con P. aeruginosa, così come lo sviluppo di nuove terapie. Questo modello ha il potenziale per molteplici direzioni future, tra cui l'adattamento per altri patogeni della ferita come lo Staphylococcus aureus, così come le infezioni polimicrobiche tra cui P. aeruginosa combinate con altri patogeni.
Divulgazioni
Gli autori non hanno interessi finanziari concorrenti da divulgare.
Riconoscimenti
Il vettore di costruzione luminescente pUT-Tn5-EM7-lux-Km1 è stato un dono gracile di J. Hardy. Gli schemi sono stati creati con BioRender.com. Ringraziamo il laboratorio di G. Gurtner per i loro consigli sul modello di infezione da ferita. Ringraziamo anche T. Doyle dello Stanford Center for Innovation in In Vivo Imaging per la sua esperienza tecnica. Questo lavoro è stato sostenuto dalle sovvenzioni R21AI13370, R21AI13340, R01AI12492093, e le sovvenzioni di Stanford SPARK, il Falk Medical Research Trust e la Cystic Fibrosis Foundation (CFF) a P.L.B. C.R.D è stata supportata da T32AI0007502. Una Gabilan Stanford Graduate Fellowship for Science and Engineering e una Lubert Stryer Bio-X Stanford Interdisciplinary Graduate Fellowship hanno supportato J.M.S.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% Sodium Chloride injection | Hospira | 2484457 | |
| 18 G x 1 sterile needle | BD | 305195 | |
| 25 G x 1 1/5 sterile needle | BD | 305127 | |
| Alcohol swab | BD | 326895 | |
| Aura Imaging Software | Spectral Instruments Imaging | n/a | |
| Betadine | Purdue Frederick Company | 19-065534 | |
| Buprenorphine SR LAB | Zoopharm | n/a | |
| C57BL/6J male mice | The Jackson Laboratory | 000664 | |
| Disposable biopsy punch, 6mm | Integra | 33-36 | |
| Fine scissors - Tungsten Carbide | Fine Science Tools | 14568-09 | |
| Glass Bead Dry Sterilizer | Harvard Apparatus | 61-0183 | |
| Granulated Agar | Fisher BioReagents | BP9744 | |
| Heating Pad | Milliard | 804879481218 | |
| Insulin syringe with 28 G needle | BD | 329461 | |
| Lago X Imaging System | Spectral Instruments Imaging | n/a | |
| LB broth | Fisher BioReagents | BP1426 | |
| Leur-Lok 1 mL syringe | BD | 309628 | |
| Mini Arco Animal Trimmer | Wahl Professional | 919152 | |
| Nair Hair Removal Lotion with Baby Oil | Church and Dwight | n/a | Available at any pharmacy |
| Octagon Forceps | Fine Science Tools | 11041-08 | |
| Petri dish | Falcon | 351029 | |
| Phosphate Buffered Saline (PBS) 1x | Corning | 21-040-CV | |
| Press and Seal Cling Wrap | Glad | n/a | |
| SafetyGlide Insulin syringe with 30 G needle | BD | 305934 | |
| Safetyglide Insulin syringe, 1/2 mL, 30 G x 5/16 TW | BD | 305934 | |
| Scale | Ohaus Scout Pro | SP202 | |
| Supplical Nutritional Supplement | Henry Schein Animal Health | 29908 | |
| Tegaderm, 6 cm x 7 cm | 3M | 1624W |
Riferimenti
- Sen, C. K., et al. Human skin wounds: a major and snowballing threat to public health and the economy. Wound Repair and Regeneration. 17 (6), 763-771 (2009).
- Serra, R., et al. Chronic wound infections: the role of Pseudomonas aeruginosa and Staphylococcus aureus. Expert Review of Anti-infective Therapy. 13 (5), 605-613 (2015).
- Obritsch, M. D., Fish, D. N., MacLaren, R., Jung, R. Nosocomial infections due to multidrug-resistant Pseudomonas aeruginosa: epidemiology and treatment options. Pharmacotherapy. 25 (10), 1353-1364 (2005).
- Secor, P. R., et al. Filamentous Bacteriophage Produced by Pseudomonas aeruginosa Alters the Inflammatory Response and Promotes Noninvasive Infection In Vivo. Infection and Immunity. 85 (1), (2017).
- Rice, S. A., et al. The biofilm life cycle and virulence of Pseudomonas aeruginosa are dependent on a filamentous prophage. The ISME Journal. 3 (3), 271-282 (2009).
- Bayes, H. K., Ritchie, N., Irvine, S., Evans, T. J. A murine model of early Pseudomonas aeruginosa lung disease with transition to chronic infection. Scientific Reports. 6, 35838(2016).
- van Gennip, M., et al. Interactions between polymorphonuclear leukocytes and Pseudomonas aeruginosa biofilms on silicone implants in vivo. Infection and Immunity. 80 (8), 2601-2607 (2012).
- Trøstrup, H., et al. Pseudomonas aeruginosa biofilm aggravates skin inflammatory response in BALB/c mice in a novel chronic wound model. Wound Repair and Regeneration. 21 (2), 292-299 (2013).
- Zhao, G., et al. Time course study of delayed wound healing in a biofilm-challenged diabetic mouse model. Wound Repair and Regeneration. 20 (3), 342-352 (2012).
- Brubaker, A. L., Rendon, J. L., Ramirez, L., Choudhry, M. A., Kovacs, E. J. Reduced neutrophil chemotaxis and infiltration contributes to delayed resolution of cutaneous wound infection with advanced age. Journal of Immunolology. 190 (4), 1746-1757 (2013).
- Watters, C., et al. Pseudomonas aeruginosa biofilms perturb wound resolution and antibiotic tolerance in diabetic mice. Medical Microbiology and Immunology. 202 (2), 131-141 (2013).
- Lee, C., Kerrigan, C. L., Picard-Ami, L. A. Cyclophosphamide-induced neutropenia: effect on postischemic skin-flap survival. Plastic and Reconstructive Surgery. 89 (6), 1092-1097 (1992).
- Sweere, J. M., et al. The immune response to Chronic Pseudomonas aeruginosa wound infection in immunocompetent mice. Advances in Wound Care. , (2019).
- Sweere, J. M., et al. Bacteriophage trigger antiviral immunity and prevent clearance of bacterial infection. Science. 363 (6434), (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon