Method Article
Свиная Корнел Эндотелиальная модель органной культуры с использованием сплит-корневых кнопок
В этой статье
Резюме
Здесь представлен пошаговой протокол для приготовления и выращивания свиных роговицы. Поскольку эта органо-типично культивируемая модель культуры органов показывает показатели смертности клеток в течение 15 дней, сопоставимые с роговицами донора человека, она представляет собой первую модель, позволяющую долгосрочное культивирование нечеловеческих роговиц без добавления токсичных декрен.
Аннотация
Экспериментальные исследования эндотелиальных клеток роговицы связаны с несколькими трудностями. Роговицы донора человека являются скудными и редко доступны для экспериментальных исследований, поскольку они обычно необходимы для трансплантации. Эндотелиальные клеточные культуры часто не очень хорошо переводятся в ситуации in vivo. Из-за биоструктурных характеристик нечеловеческих роговиц, стромальный отек во время выращивания вызывает значительную потерю эндотелиальных клеток роговицы, что затрудняет культивирование в течение длительного периода времени. Для противодействия этому ответу используются деозавуированные агенты, такие как декек. Тем не менее, они также вызывают значительную потерю эндотелиальных клеток. Таким образом, была создана модель культуры культуры ex vivo, не требующая деотечных агентов. Свиньи глаза из местной скотобойни были использованы для подготовки раскол роговицы кнопки. После частичного трефинации роговицы внешние слои роговицы (эпителий, слой лукмана, части стромы) были удалены. Это значительно снижает потери эндотелиальных клеток роговицы, вызванные массивным стромальным отеком и мембраной Десцемета, складывающейся в течение более длительных периодов культивирования, и улучшает общее сохранение эндотелиального клеточного слоя. Последующее полное трифинирование роговицы последовало удаление раскол апогея кнопки из оставшейся луковицы глаза и выращивания. Плотность эндотелиальных клеток оценивалась в период ы наблюдения до 15 дней после приготовления (т.е. дней 1, 8, 15) с помощью световой микроскопии. Используемый метод подготовки позволяет лучше сохранить эндотелиальный слой клеток, включенный менее стромальным отеком тканей, что приводит к медленному и линейному снижению в сплит-кнопках роговицы, сопоставимых с роговицами донора человека. Поскольку эта стандартизированная органо-типично культивируемая исследовательская модель впервые позволяет стабильно культивироваться в течение по крайней мере двух недель, она является ценной альтернативой кукурузе донора человека для будущих исследований различных внешних факторов в отношении их оказывает влияние на эндотелий роговицы.
Введение
Процедуры трансплантации корневой трансплантации являются одними из наиболее часто выполняемых трансплантаций во всем мире1. Как существует острая нехватка человеческих доноров роговицы, экспериментальные исследования решения роговицы эндотелиальных клеток в роговицы человека трудно выполнить1. Однако внедрение оросительных растворов и других веществ, используемых в глазу, офтальмологических вязкоупругих устройств, а также хирургических инструментов и методов (например, инструменты и методы факоэмульсификации, ультразвуковая энергия) требует действительные и обширные исследования относительно их воздействия на эндотелий роговицы перед клиническим использованием.
Немногие альтернативы донорской роговицы человека существуют для исследований. Модели исследований на животных очень ценны, но в то же время очень ресурсоемкие и все более под сомнение этически. Основным недостатком культур клеток in vitro является их ограниченный перевод человеческому глазу. Результаты, полученные из клеточных культур может быть несовместимы с условиями in vivo, потому что клетки могут претерпеть эндотелиальный мезенхимальный переход (EMT), в результате чего фибробластоподобная морфология вызвана потерей клеточной полярности и изменениями в форме клеток и гене выражение2.
В то время как предыдущие модели ex vivo сообщили периоды выращивания до всего 120 ч, новый метод подготовки к созданию свиной роговицы эндотелиальной модели культуры органов путем культивирования свежей свиной роговицы, по крайней мере 15 дней был недавно введен3 ,4,5,6. Если эпителий роговицы и части стромы удаляются (всего около 300 мкм) из роговицы до культивирования, отек стромы уменьшается в разделенных кнопках роговицы, что приводит к меньшей эндотелиальной потере клеток и ухоженной эндотелиальной клеточный слой после 15 дней, в то время как не расщепленные кнопки роговицы показывают значительную эндотелиальную потерю клеток из-за неравномерного стромального отека и образования складок Десцемета. Глаз банки обычно используют осмотические деоретные агенты, такие как декек, чтобы уменьшить отек роговицы до трансплантации. Тем не менее, эти агенты были показаны, чтобы вызвать увеличение эндотелиальной потери клеток7,8,9.
Эта статья направлена на визуализацию этой стандартизированной модели исследования ex vivo в подробном пошаговом протоколе, чтобы позволить будущим следователям проводить исследования по эндотелию роговицы с помощью сплит-кнопок роговицы. Эта модель представляет собой простой метод для тестирования веществ и методов, используемых в глазу, таких как офтальмологические вязкоупругие устройства, оросительные растворы, и ультразвуковой энергии, или другие процедуры, где эндотелий роговицы представляет интерес.
протокол
Этот протокол соответствует этическим принципам нашего учреждения. В соответствии с уставом комитета по этике нашего учреждения до начала экспериментов не должно было быть получено никакого этического утверждения, так как все свиные роговицы были получены с местной скотобойни.
1. Органная культура
- Приготовьте свиные глаза.
- С местной скотобойни, получить свиньи глаза, которые были удалены вскоре посмертно, но до термической обработки. Транспорт глаза в лабораторию и обрабатывать их в течение нескольких часов. Во время транспортировки держите глаза при комнатной температуре (примерно 21 градусов по Цельсию) перед обработкой.
- Удалите все орбитальные прижима (глазные мышцы, конъюнктива, жировую ткань) до дезинфекции с помощью ножниц для глаз и щипцы колибри. Отделить и отбросить все глаза с очевидной травмой, внешним иронизом (например, разрез ножом) или видимой непрозрачностью роговицы.
- Подготовьте 5% йод-PBS-раствор (1:20) в стерильной чашке, добавив 3 мл 7,5% повидона йода до 57 мл фосфатного буферного солей (PBS). Также приготовьте отдельную стерильную чашку, содержащую 60 мл чистого PBS.
ПРИМЕЧАНИЕ: Общее количество использованного йода-PBS-решения и размер чашки зависит от количества роговицы, которые должны быть вскрыты. От пяти до шести глаз требуется примерно 60 мл 5%-йод-PBS-решение, чтобы быть дезинфицированы должным образом. - Положите пять-шесть глаз в 5%-йод-PBS раствор в общей сложности 5 мин, чтобы правильно дезинфицировать поверхность глаза. Тщательно перемешать каждую минуту, чтобы убедиться, что поверхность глаза полностью погружена в воду и полностью дезинфицируется в растворе йода.
- После 5 минут, передача дезинфицированных глаз в подготовленную чашку заполнены чистым PBS. Опять же, тщательно перемешать, чтобы обеспечить йод-PBS-раствор смывается с поверхности глаза.
ПРИМЕЧАНИЕ: Выполните этот шаг на чистой скамейке, чтобы предотвратить загрязнение дезинфицированных глаз.
- Подготовка пластин клеточной культуры.
ПРИМЕЧАНИЕ: Выполните следующие шаги на чистой скамейке с постоянным ламинарным потоком воздуха.- Оттепель 2 мл сыворотки плода теленка (FCS). Заполните шприц (5 мл) с FCS с помощью тупой канюли. Опорожните шприц через фильтр шприца (0.22 мкм) для предотвращения возможного бактериального загрязнения FCS в 80 мл декрен-свободной среды культуры I (минимальная необходимая среда «MEM» с солями Эрла, пенициллин/стрептомицин, L-глутамамин (200 мМ), амфотерицин B (250 мкг/мл), буфер hepes (1 М) (50x), NaHCO3и дистиллированная вода). Агитировать смесь, чтобы обеспечить равномерное распределение субстрата.
- Заполните каждый колодец 12 хорошо пластины культуры клеток с 3 мл субстратной смеси.
- Выполните вскрытие и инкубацию.
ПРИМЕЧАНИЕ: Выполните этот шаг на чистой скамейке. Не прикасайтесь к эндотелию роговицы с помощью каких-либо инструментов.- Передача глазной луковицы из чашки с PBS в держатель луковицы для глаз с роговицы вверх и поместите его под офтальмологический хирургический микроскоп. Используйте шприц заполнены 0,9% NaCl слегка применить некоторые всасывания в глаза над держателем луковицы для глаз, чтобы зафиксировать глаз в положении для вскрытия.
- Используйте трефин (7,5 мм), содержащий стандартизированную инкрустированную, которая гарантирует, что глубина трефином не превысит 300 мкм, чтобы нарезать поверхностно центральную роговицу(рисунок 1А).
- Используйте щипцы колибри и одноразовый скальпель с треугольным лезвием, чтобы вырезать и удалить частично тройной части роговицы горизонтально через стромы. Откажитесь от разделенной части роговицы, состоящей из эпителия роговицы, слоя лукмана и части стромы.
ПРИМЕЧАНИЕ: Строго поддерживать горизонтальное направление резки, чтобы получить ровную толщину оставшейся стромы. - Поверхностно поместите 10-0 шов (10-0 полиамид 6) в стромы, чтобы иметь возможность дифференцировать эндотелиал от стромальной стороны во время экспериментов (Рисунок 1B). Предотвратить проникновение эндотелия роговицы. Откажитесь от глазной лампы, если эндотелий проник.
ПРИМЕЧАНИЕ: Проникновение роговицы эндотелия с швов ойильной иглой будет видно, как жидкость из передней глазной камеры будет просачиваться через шовный канал. - Используйте трефин без инкрустировки для продвижения трефинированного разреза на полную глубину до тех пор, пока не будет достигнута передняя глазная камера(рисунок 1C). Отчетливое падение сопротивления и утечки жидкости из передней глазной камеры может быть воспринято после полного проникновения роговицы.
ПРИМЕЧАНИЕ: Используйте хоккейный нож, если кнопка раскола роговицы остается прикрепленной на одной стороне кнопки раскола роговицы после трефинации. - Передача полученных раскол роговицы кнопку, в настоящее время состоящий из части стромы (Рисунок 2), мембраны Descemet, и роговицы эндотелия, в среде культуры (культура среднего I И FCS, см. раздел 1.2) в 12 хорошо пластины культуры клеток с помечены стороны вниз, так что роговицы эндотелий лицом вверх.
ПРИМЕЧАНИЕ: Если эндотелиальная сторона обращена вниз, эндотелий может получить повреждения. - Назначьте индивидуальный номер каждой кнопке разделенной роговицы для идентификации во время последующих взлетов и пометьте колодцы на пластине клеточной культуры соответственно.
- Инкубировать заполненные пластины культуры клеток в инкубаторе при стандартных условиях при температуре 37 градусов по Цельсию, 5% CO2 и относительной влажности воздуха 95%. Измените среду культуры (культурная среда I и FCS) на 8-й день, если инкубационный период составляет 7 дней.
ПРИМЕЧАНИЕ: Процедура инкубации с использованием сплит-кнопок роговицы была проверена на срок до 15 дней.

Рисунок 1: Рассечение свиной роговицы для получения сплит-кнопок роговицы. ( )После трефинации роговицы с помощью трефина с инкрусом, чтобы разрезать на глубину 300 мкм и удаление эпителия и частей стромальной ткани, (B) шов помещается поверхностно в строму без проникновения роговицы эндотелий для последующей идентификации стромальной стороны. (C) Полное трефинирование оставшейся роговицы сопровождается (D) удаление полученной кнопки раскол роговицы из глазной луковицы. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
2. Микроскопия и исследование эндотелия
- Выполните незапятнанное обследование.
ПРИМЕЧАНИЕ: Неокрашенные экзамены могут быть выполнены несколько раз (например, на еженедельных последующих исследующих на день 1, 8 и 15). Однако неокрашенный подсчет позволяет только оценивать плотность эндотелиальных клеток, а не морфологические параметры.- Заполните 3 мл гипотонического сбалансированного солевого раствора (hBSS, см. композицию в таблице материалов) в каждом колодце 12 хорошо пластины культуры клеток. Тщательно поместите одну кнопку раскол роговицы в hBSS, чтобы вызвать отек роговицы эндотелиальных клеток и улучшить видимость клеток для подсчета клеток.
ПРИМЕЧАНИЕ: Убедитесь, что эндотелиальная сторона обращена в направлении микроскопа. Если используется перевернутый фазовый контрастный микроскоп, эндотелиальная сторона должна быть обращена вниз. В то время как на месте, культурная плита не должна быть перемещена, чтобы предотвратить повреждение эндотелиальных клеток. - Пусть клетки набухают в течение 1-2 минут, прежде чем сфотографировать эндотелий с камерой, прикрепленной к микроскопу. Сделайте по крайней мере три фотографии по крайней мере трех различных областей, чтобы получить репрезентативное впечатление о фактическом состоянии эндотелия роговицы. Добавьте панель масштаба с истинной для масштабирования длиной 100 мкм для последующего анализа плотности эндотелиальных клеток и морфологических параметров.
- Для предотвращения повреждения осмотическими, удалите сплит-кнопку роговицы из hBSS после максимум5 мин и перенесите ее обратно в среду культуры3.
- Заполните 3 мл гипотонического сбалансированного солевого раствора (hBSS, см. композицию в таблице материалов) в каждом колодце 12 хорошо пластины культуры клеток. Тщательно поместите одну кнопку раскол роговицы в hBSS, чтобы вызвать отек роговицы эндотелиальных клеток и улучшить видимость клеток для подсчета клеток.
- Выполните окрашенные экспертизы.
ПРИМЕЧАНИЕ: Окрашивание прекращает эксперименты, так как используемые окрашивающие сятоксические вещества являются цитотоксическими. Поэтому окрашивание может быть выполнено только в конце периода наблюдения для оценки морфологических параметров (фигуры реформирования, розетки, ализарин красные окрашенные клетки).- Подготовьте раствор 0.25 trypan голубой и 0.2% ализарин красный S разрешение для процедуры окрашивания.
- Для 0,25% trypan синий раствор, разбавить 0,4% trypan синий раствор с 0,9% NaCl раствор.
ПРИМЕЧАНИЕ: Например, для получения 20 мл раствора 0,25% трипан синий, разбавить 12,5 мл 0,4% трипан синий раствор с 7,5 мл 0,9% NaCl раствор. Синий раствор trypan может храниться при комнатной температуре в течение нескольких недель или месяцев. - Для получения 0,2% ализарин красный Раствор S растворяют 100 мг ализарин красного S порошок в 50 мл 0,9% NaCl раствор при постоянном перемешивании и нагревадой до 50 градусов по Цельсию на магните, помешивая пластины с функцией нагрева. Чтобы удалить возможные осадки, отфильтруйте полученное решение. Отрегулируйте рН ализарин красный S раствор рН 4.2, добавив гидроксид натрия или соляной кислоты соответственно.
ПРИМЕЧАНИЕ: Перед каждым применением ализарин красный S решение убедитесь, что рН исправлена до 4,2 и что Есть нет осадков в растворе. Раствор может храниться при комнатной температуре. Не храните раствор дольше 4 недель.
- Для 0,25% trypan синий раствор, разбавить 0,4% trypan синий раствор с 0,9% NaCl раствор.
- Поместите разделенные кнопки роговицы в чашках Петри с эндотелиальной стороной, обращенной вверх, чтобы запятнать эндотелиальные клетки. Используйте пипетку, чтобы медленно капать 0,25% trypan синий раствор капля за каплей на роговицы эндотелия в течение 90 с.
ПРИМЕЧАНИЕ: Трипан синий позволяет идентификации поврежденных клеток роговицы с проницаемой мембраной, потому что это пятна их ядра. - Тщательно промыть раскол роговицы кнопку 3x в 0,9% NaCl в небольшом стакане. Опять же, используйте пипетку, чтобы медленно капать 0,2% ализарин красный S раствор капля за каплей на роговицы эндотелия в течение 90 с.
ПРИМЕЧАНИЕ: Ализарин красный S пятна мембраны Descemet, который помогает выделить клеточные границы в неповрежденных роговицы эндотелиальных клеток и выделить разрушенные клетки, когда мембрана descemet становится видимым. Кроме того, это позволяет легко идентифицировать более крупные разрушенные районы. - Для изучения окрашенных роговицы эндотелия следовать шаги объяснил для неокрашенных подсчета в разделе 2.1.
- Подготовьте раствор 0.25 trypan голубой и 0.2% ализарин красный S разрешение для процедуры окрашивания.
3. Анализ плотности эндотелиальных клеток роговицы и морфологических параметров
- Проект подсчета квадратов на картинках с помощью программного обеспечения для редактирования графики (Таблица материалов).
- Откройте программное обеспечение и откройте изображение эндотелия роговицы, выбрав файл Открыто (ru) Выберите.
- Проект квадрата с истинной для масштабирования боковой длины 100 мкм на изображении.
ПРИМЕЧАНИЕ: Следующие шаги раздела 3.1.2 могут быть проигнорированы, если программное обеспечение для просмотра позволяет проецировать подсчет квадратов на картинку. Длина стороны квадрата зависит от разрешения изображений, сделанных с помощью камеры микроскопа, и может быть рассчитана с помощью панели масштаба.- Обрезать шкалу бар с фотографией, сделанной с микроскопом: выберите прямоугольный инструмент Marquee на панели инструментов или нажмите M, затем границы шкалы бар, а затем выберите Edit Урожай или нажмите Ctrl x.
- Нажмите файл (ru) Новое (или нажмите Ctrl n). В предстоящем окне выберите Clipboard в списке выпадающих типов документов. Количество показанных пикселей — это длина стороны квадрата подсчета. Обратите внимание на соответствующие пиксели для других фотографий и нажмите OK.
- Выберите файл Новое (или Ctrl n). Вставьте ширину и длину (в пикселях) квадрата подсчета в предстоящем окне в зависимости от длины панели шкалы. Выберите фоновый цвет белый,затем нажмите OK.
- Нажмите Выберите Выберите все (или Ctrl и A). Выбрать Edit Копировать (или Ctrl и C).
- Выберите изображение эндотелия роговицы, открытого в шаге 3.1.1. Выбрать Edit Вставить (или Ctrl и V),чтобы вставить квадрат на фото роговицы эндотелия.
- Выберите слой квадрата и отрегулируйте прозрачность. Выберите Слой Стиль слоя (англ.) Варианты смешивания (англ.) Установите непрозрачность до 30% OK.
- Сохранить изображение с проецируемой площади с истинной для масштабирования боковой длины 100 мкм. Повторите с другими изображениями, необходимыми для анализа.
- Оцените плотность эндотелиальных клеток и морфологические параметры.
- Откройте изображения с проецированными квадратами в ImageJ (версия 1.50i) и используйте PlugIn CellCounter для подсчета ячеек в квадрате. Открыть ImageJ, выберите Файл Открыто (или Ctrl и O) Выберите изображение.
ПРИМЕЧАНИЕ: ImageJ и CellCounter PlugIn являются бесплатно доступны для скачивания в Интернете. - Выберите плагины Сотовый счетчик Счетчик ячеек Инициализация. Подсчитайте эндотелиальные клетки и запишите результат. С двух сторон квадрата подсчитайте ячейки, которые вырезаны краем квадрата. Не считайте вырезанные клетки с двух сторон.
- Проанализируйте по крайней мере шесть квадратов на роговицу из разных областей (например, три картинки, два квадрата на картинку) и определите среднюю плотность эндотелиальных клеток на квадрат (100 мкм2). Экстраполировать плотность эндотелиальных клеток на 100 мкмот 2 до 1 мм2, умножая на 100.
- Откройте изображения с проецированными квадратами в ImageJ (версия 1.50i) и используйте PlugIn CellCounter для подсчета ячеек в квадрате. Открыть ImageJ, выберите Файл Открыто (или Ctrl и O) Выберите изображение.
- Для оценки морфологических изменений, подсчет показателей реформирования (совместное собрание 4 клеток/клеточных границ вместо трех), розетовые образования (характерный розовый вид, пять или более радиорасположенных клеток, окружающих разрушенную клетку ), или ализарин красные области (уничтоженные клетки) в прогнозируемых квадратов.
ПРИМЕЧАНИЕ: Кроме того, может быть полезно использовать большие квадраты (например, 200 х 200 мкм2)для морфологического анализа в хорошо сохранившихся образцах для получения более репрезентативных результатов.
Результаты
Представленный метод вскрытия подразумевает частичное удаление стромальной ткани, в результате чего более тонкий образец роговицы и, таким образом, менее стромальный отек(рисунок 1 и рисунок 2). Менее стромальный отек вызывает меньше сдвига и щепотку сил, которые оказывают негативное влияние на эндотелий роговицы, тем самым вызывая более низкие показатели эндотелиальной потери клеток6. Сплит роговицы кнопки показывают значительно лучше сохранившихся эндотелиального слоя клеток после 15 дней культивирования по сравнению с не-раскол роговицы кнопки и целые образцы роговицы, что отражает меньше эндотелиальной потери клеток и меньшее число реформации цифры (4 ячейки/клеточные границы соединяются вместо трех), образования розеток (пять или более радиорасположенных клеток, встречающихся в одном месте) и ализарин красные (уничтоженные) клетки после 15 дней6.
В течение 15 дней, раскол роговицы кнопки показывают устойчивое снижение плотности эндотелиальных клеток со средней еженедельной процентной эндотелиальной потери клеток 4,90% (n No 40, Рисунок 3). Начиная с первого дня с плотностью эндотелиальных клеток 4033 и 146/163 ячеек/мм2 (средний 25%/75% квартилей), плотность клеток снизилась до 3850 - 167/233 ячеек/мм2 на 8-й день и 3650 - 200/233 клетки/мм2 на 15 день. Определенные потери клеток были одинаковыми в течение первой и второй недели. В дни 1/8, 4,00 и 2,17/1,93% (средний квартиля 25%/75%); дни от 8 до 15, 4,88 и 5,52/4,42%; дни 1/15, 8,64 и 4,32/2,71%). Таким образом, данный показатель снижения аналогичен показателю, зарегистрированному у донорских роговиц человека при выращивании в предыдущих исследованиях10,11,12.
Морфологические параметры были оценены после окрашивания эндотелиального клеточного слоя на 15-й день (n No 28, рисунок 4). Показатели реформации составили 7,18 и 2,36/2,90% (средний квартилей 25%/75%) границ слияния ячеек. В исследуемых образцах присутствовала медиана 1,11 и 1,11/15,56 розетки образований/мм2 (средний - 25%/75% квартилей), в то время как 13,33 и 4,44/11,67 ализарин красных окрашенных клеток/мм2 (средний - 25%/75% квартилы) с пометкой пунктуальные потери.
Рисунок 5 обеспечивает репрезентативные изображения эндотелия роговицы во время микроскопической оценки в hBSS(Рисунок 5A) и после окрашивания с трипан синий и ализарин красный S(Рисунок 5B). Оценка плотности эндотелиальных клеток в hBSS может быть выполнена несколько раз (например, в дни 1, 8 и 15), в то время как окрашенные образцы могут быть использованы для оценки морфологических параметров (реформирование цифры, розетки образований, ализарин красные окрашенные клетки) или определение плотности эндотелиальных клеток в конце экспериментов из-за цитотоксических свойств большинства окрашивающих веществ.
Если разделенные кнопки роговицы размещены и культивируются с эндотелиальной стороны лицом вниз случайно, обширные повреждения эндотелиальных клеток следует ожидать(Рисунок 6A). Нерасщеченные кнопки роговицы страдают значительно увеличенной эндотелиальной потери клеток из-за стромального отека, в результате чего мембрана Десцемета складывается в течение 15 дней выращивания(рисунок 6B),в то время как раскол роговицы кнопки показывают в значительной степени сохранены роговицы эндотелия после 15 дней выращивания, указывается рассеянный пунктуальный ализарин красные окрашенные области, указывающие на одиночные разрушенные клетки(Рисунок 6C).
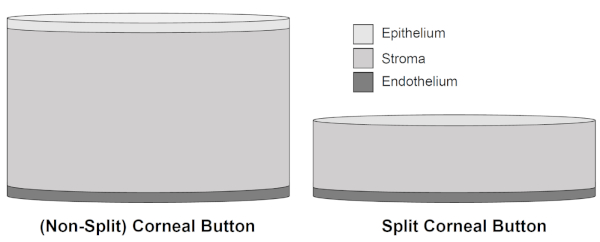
Рисунок 2: Схематическая иллюстрация неразделенных роговицы кнопок и сплит-кнопок роговицы. После удаления 300 мкм свиной роговицы, включая эпителий и основные части стромальной ткани, толщина сплит-кнопок роговицы уменьшается в пользу лучшей консервации эндотелия роговицы из-за уменьшения стромального отека во всем культивирование до 15 дней. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
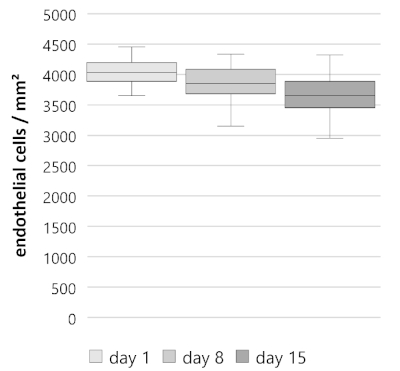
Рисунок 3: Плотность эндотелиальной клетки (ECD) сплит-кнопок роговицы в течение 15 дней. Сплит роговицы кнопки (n No 40) показали устойчивое снижение. ECD на 1-й день, 4033 и 146/163 ячейки/мм2 (средний 25%/75% квартилей); день 8, 3850 и 167/233 ячеек/мм2; день 15, 3650 и 200/233 ячеек/мм2. Данные изображаются в виде медианных квартилей в размере 25%/75%, усы представляют собой как минимальные, либо максимальные, либо 1,5 межквартильного диапазона (ИКР). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
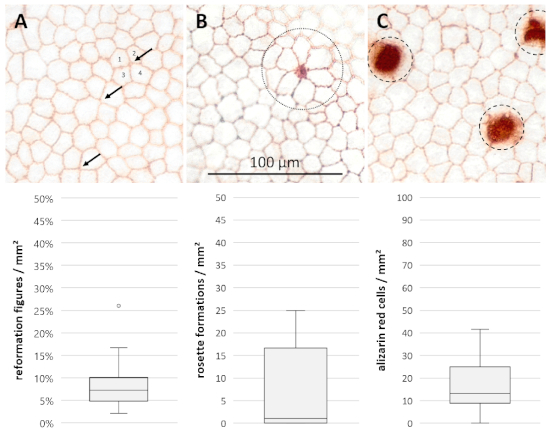
Рисунок 4: Морфологические параметры для дополнительной оценки повреждения клеток и процессов перестановки. Микроскопические фотографии роговицы эндотелия в 400x увеличение после 15 дней выращивания и окрашивания с трипан синий и ализарин красный S показаны (A) Реформации цифры (стрелки, совместное заседание из четырех или более клеток / клеток границ вместо 3), (B) образования розетки (пунктирный круг, центральная уменьшая клетка с характерными образованиями розетки 5 или больше смежных клеток) и (C)ализарин красные окрашенные клетки (dashed круги, разрушенные клетки). Данные (n No 28) изображаются в виде медианных квартила на 25%/75%. Усы представляют собой как минимальный, либо максимальный, либо 1,5 межквартильного диапазона (ИКР). Круги представляют выбросы, не входящих в I'R. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 5: Неокрашенный и окрашенный эндотелий роговицы. Слой эндотелиальных клеток, как видно во время микроскопической оценки (400x увеличение) в (A) гипотонический сбалансированный солевой раствор (hBSS) вызывает эндотелиальные клетки отек и, следовательно, лучше видимость клеток и (B) после окрашивания с трипан синий и alizarin красный S. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
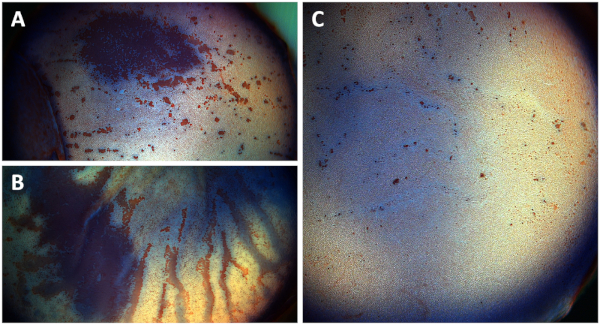
Рисунок 6: Обзор фотографии роговицы эндотелия (A) раскол роговицы кнопку культивируется вверх дном, (B) не-раскол роговицы кнопку, и (C) раскол роговицы кнопку после окрашивания. Фотографии показывают, роговицы эндотелия после окрашивания с трипан синий и ализарин красный S. (A) Обширные повреждения эндотелиальных клеток роговицы (красная область) наблюдается после раскола роговицы кнопки культивируются с эндотелиальной стороны лицом вниз после одного неделя выращивания. (B) Значительно увеличенное повреждение эндотелиальной клетки в non-split кнопках роговицы из-за сворачивать мембраны Descemet и стромального отека после 15 дней культивирования (красные полосы). (C) Сплит роговицы кнопки показывают хорошо сохранившийся эндотелиальный слой клеток после 15 дней выращивания только показаны пунктуальные разрушенные клетки видели в ализарин красные окрашенные области. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Этот протокол предоставляет метод для подготовки свиной сплит роговицы кнопки, которая представляет собой стандартизированные и недорогие ex vivo роговицы эндотелиальной модели культуры органов для исследовательскихцелей 6. Свиной раскол роговицы кнопки показали снижение плотности эндотелиальной клеток сопоставимы с эндотелиальных потерь клеток наблюдается в донорской роговицы человека культивируется в глазных банках в течение двух недель6,10,11, 12.
Превосходство над неразделенными кнопками роговицы, а также целыми образцами роговицы свиней было показано ранее6. В этом исследовании три группы были сопоставлены в дни 1, 8 и 15. Роговицы эндотелия всех групп (роговицы кнопки, не-раскол роговицы кнопки, раскол роговицы кнопки) был в хорошем состоянии на 1 день, представленный хорошо сохранившихся эндотелиальных клеточных слой6. Однако из-за стромального отека, сворачивание мембраны Десцемета уничтожило большие участки эндотелия целых образцов роговицы, так что репрезентативную оценку плотности эндотелиальных клеток роговицы в 8 и 15 дней не удалось провести. Хотя эндотелий неразделенных роговицы пуговиц хорошо сохранился до 15-го дня, некоторые мембранные складки Десцемета также присутствовали. Хотя по сравнению с образцами роговицы эндотелиальный слой неразделенных роговицы кнопки был в лучшем состоянии, эндотелиальный слой клеток раскол агнетизальных кнопок был в гораздо лучшем состоянии. Это можно увидеть в количественных и качественных параметрах, так как эндотелиальная потеря клеток в течение 15 дней культивирования была значительно выше (р 0,041) в неразделенных кнопках роговицы (-575 и 25/250 клеток/мм2)по сравнению с кнопками раскола роговицы (-417 ) 138/179 клеток/мм2), что совпадает с определенными морфологическими характеристиками, проявляющимися в более регулярном шестиугольном клеточном рисунке, меньшем количестве реформации и образованиях розетки, а также меньшем количестве разрушенных клеток (ализарин красных областей) в разделении роговицы кнопки6. Процентальные эндотелиальные потери клеток подтверждают эти выводы, так как процентная потеря клеток в течение 15 дней в неразделенных и разделенных кнопок роговицы составляет 14,89% и 10,2% (р 0,032) соответственно6. Поскольку этот метод был проверен на срок до 15 дней, он позволяет более длительные периоды наблюдения, чем опубликованные исследования до сих пор (72 до 120 ч)3,4,5.
Улучшения в сохранении эндотелиального слоя клеток, применяя общие протоколы культивирования также используется в глазных банках, может быть связано исключительно с сокращением отек роговицы стромы, так как основная часть (300 мкм) стромы удаляется до культивирование6,13. Обычно строма имеет тенденцию к набуханию чрезвычайно во время культивирования из-за его гидрофильных свойств и молекул, встроенных в стромальной ткани14,15. Отек, который вызывает сдвига и щепотку сил и мембраны складки Десцемета, который также вызывает механическую нагрузку на эндотелий роговицы и эндотелиальной потери клеток, уменьшаются после частичного удаления стромы6,10. В отличие от глаз банки, которые часто используют осмотических агентов, таких как dextran для deswell человека донора роговицы до трансплантации, раскол роговицы кнопки не требуют осмотического отек16,17. Как культура среды дополняется dextran, как известно, поглощается роговицы эндотелиальных клеток и вызвать увеличение потери клеток7,8,9,18,19 ,20, выращивание раскол роговицы кнопки без декентна (или других осмотических агентов) устраняет столько негативных токсичных факторов, как это возможно6. Поскольку культурная среда не дополняется никакими добавками в представленном методе, никаких токсичных воздействий, вызванных каким-либо добавленным веществом, не ожидается, что делает эту модель ценной для исследований биосовместимости новых веществ.
Хотя эндотелий роговицы очень тонкий слой клетки и подготовка разделенных кнопок роговицы требует умеренных хирургических навыков и мягкой обработки, этот метод может быть стандартизированным методом для работы с и получения надежных результатов в отношении влияние различных факторов на эндотелий роговицы в очень разумные сроки. Тем не менее, Есть несколько шагов в этом протоколе, где роговицы эндотелий находится под угрозой. Очевидно, поврежденные или непрозрачные глаза должны быть тщательно определены и отбрасываются в начале, чтобы предотвратить возможные предубеждения. Кроме того, эндотелий роговицы всегда должен быть оставлен нетронутым во время трефинации, вскрытия, экстракции и обработки (например, перенос с глаз на культурную плиту, от культурной плиты к культуре пластины и т.д.) раскол апогея кнопки для предотвращения любого механические повреждения. При размещении шов поверхностно в стромы, эндотелий потенциально может быть пронизана, если игла случайно вставляется слишком далеко в глубину. Если это так, то заметная жидкость из передней глазной камеры будет проходить через шовный канал и соответствующий глаз должен быть отброшен. Чтобы предотвратить это, игла должна быть поверхностно в строма. Кроме того, необходимо позаботиться о том, чтобы строго разделить кнопку роговицы горизонтально с помощью скальпеля. Неравномерная резка приведет к неравномерному отеку во время выращивания, что может привести к увеличению эндотелиальной потери клеток.
Изучение неокрашенных эндотелиальных клеток роговицы в hBSS обычно проводится в роговицах донора человека. Существует никаких доказательств значительного повреждения клеток, вызванных осмотическим отеком эндотелиальных клеток для выбранного времени обследования раскол абонетных кнопок в hBSS3. Хотя окрашивание повышает видимость границ клеток, неокрашенные подсчета не приводит к значительно отличающимся результатам эндотелиальной плотности клеток по сравнению с окрашенными подсчетом21. Явным преимуществом неокрашенного подсчета является то, что он позволяет проводить многочисленные последующие исследования в ходе экспериментов, в то время как окрашивающие вещества, как правило, цитотоксические и прекращают период наблюдения. Однако для оценки морфологических характеристик эндотелия по-прежнему важно оценить морфологические характеристики эндотелия. Трипан синий подчеркивает ядра поврежденных клеток, которые часто кажутся неповрежденными в неокрашенных подсчета. Ализарин красный S четко повышает видимость границ клеток и поврежденных клеток путем окрашивания мембраны Descemet, что облегчает оценку плотности эндотелиальных клеток и позволяет анализировать морфологические особенности эндотелия роговицы , такие как реформации цифры, розетки образований, и ализарин красные окрашенные клетки(рисунок 4).
Основным ограничением разделенных кнопок роговицы в качестве модели ex vivo является то, что, как и модели in vitro, они подходят только для исследования внешних воздействий на эндотелиальные клетки роговицы. Поэтому модели in vivo незаменимы для исследования системных заболеваний и состояний с воздействием на глаз и роговицы эндотелия. Несмотря на это, этот метод подготовки может генерировать достоверные данные для тестирования воздействия различных внешних факторов на эндотелий роговицы (например, в биосовместимости тестирования новых веществ)22. Следуя принципу 3R (замена, сокращение, уточнение) для сокращения числа экспериментов на животных, этот метод обеспечивает адекватную исследовательскую модель для дальнейшего сокращения разрыва между культурами клеток in vitro, где результаты часто несовместимы с vivo ситуация в людях, и животных исследований, которые требуют существенных усилий и все чаще поднимает этические проблемы23.
Из-за своих свойств и доступности, свиньи глаза, как представляется, только адекватной заменой для человеческих глаз для исследовательских целей. Корнеи из нечеловеческих приматов не являются хорошей альтернативой из-за этических причин и доступности, хотя эти животные являются ближайшим видом к человеку. С другой стороны, глаза мелких животных просто слишком малы, чтобы обеспечить эффективное удаление роговицы. Свиньи глаза сопоставимы с человеческими глазами по размеру и показывают аналогичные свойства роговицы эндотелиальных клеток, что также находит свое отражение в исследованиях, касающихся возможного будущего ксенотрансплантации генетически модифицированных свиной роговицы24, 25,26. Кроме того, будучи побочным продуктом скотобойни, они легко получить.
В заключение, представленный метод с использованием свиной роговицы предлагает высоко воспроизводимый органо-типично культивируемой исследовательской модели, позволяющей экономически эффективные исследования на роговицы эндотелиальных клеток. Будущие исследователи могут использовать сплит роговицы кнопки для анализа воздействия различных факторов, таких как новые вещества, хирургические методы, оборудование, и другие возможные внешние воздействия, где роговицы эндотелия представляет большой интерес.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Создание представленной исследовательской модели было поддержано КМУ-инноваторив (ФКЗ: 13GW0037F) федерального министерства образования и научных исследований Германии.
Материалы
| Name | Company | Catalog Number | Comments |
| Subject | |||
| Pig eyes | local abbatoir | ||
| Substances | |||
| Alizarin red S | Sigma-Aldrich, USA | ||
| Culture Medium 1, #F9016 | Biochrom GmbH, Germany | ||
| Dulbecco's PBS (1x) | Gibco, USA | ||
| Fetal calf serum | Biochrom GmbH, Germany | ||
| Hydrochloric acid (HCl) solution | own production | ||
| Hypotonic balanced salt solution | own production | per 1 L of H2O: NaCl 4.9 g; KCl 0.75 g; CaCl x H2O 0.49 g; MgCl2 x H2O 0.3 g; Sodium Acetate x 3 H2O 3.9 g; Sodium Citrate x 2 H2O 1.7 g | |
| Povidon iodine 7.5%, Braunol | B. Braun Melsungen AG, Germany | ||
| Sodium chloride (NaCl) 0.9% | B. Braun Melsungen AG, Germany | ||
| Sodium hydroxide (NaOH) solution | own production | ||
| Trypan blue 0.4% | Sigma-Aldrich, USA | ||
| Materials & Instruments | |||
| Accu-jet pro | Brand GmbH, Germany | ||
| Beaker Glass 50 mL | Schott AG, Germany | ||
| Blunt cannula incl. Filter (5 µm) 18G | Becton Dickinson, USA | ||
| Cell culture plate (12 well) | Corning Inc., USA | ||
| Colibri forceps | Geuder AG, Germany | ||
| Corneal scissors | Geuder AG, Germany | ||
| Eppendorf pipette | Eppendorf AG, Germany | ||
| Eye Bulb Holder | L. Klein, Germany | ||
| Eye scissors | Geuder AG, Germany | ||
| Folded Filter ø 185 mm | Whatman, USA | ||
| Hockey knife | Geuder AG, Germany | ||
| Laboratory Glass Bottle with cap 100 mL | Schott AG, Germany | ||
| Magnetic stir bar | Carl Roth GmbH & Co. KG, Germany | ||
| MillexGV Filter (5 µm) | Merck Millopore Ltd., USA | ||
| Needler holder | Geuder AG, Germany | ||
| Petri dishes | VWR International, USA | ||
| Pipette tips | Sarstedt AG & Co., Germany | ||
| Scalpel (single use), triangular blade | Aesculap AG & Co. KG, Germany | ||
| Serological pipette 10 mL | Sarstedt AG & Co., Germany | ||
| Serological pipette 5 mL | Sarstedt AG & Co., Germany | ||
| Sterile cups | Greiner Bio-One, Österreich | ||
| Sterile gloves | Paul Hartmann AG, Germany | ||
| Sterile surgical drape | Paul Hartmann AG, Germany | ||
| Stitch scissors | Geuder AG, Germany | ||
| Suture Ethilon 10-0 Polyamid 6 | Ethicon Inc., USA | ||
| Syringe (5 mL) | Becton Dickinson, USA | ||
| trephine ø 7.5 mm | own production | ||
| Tying forceps | Geuder AG, Germany | ||
| Weighing paper | neoLab Migge GmbH, Germany | ||
| Equipment & Software | |||
| Binocular surgical microscope | Carl Zeiss AG, Germany | ||
| Camera mounted on microscope | Olympus, Japan | ||
| CellSens Entry (software) | Olympus, Japan | ||
| Cold-light source | Schott AG, Germany | ||
| Incubator | Heraeus GmbH, Germany | ||
| Inverted phase contrast microscope | Olympus GmbH, Germany | ||
| Magnetic stirrer with heating function | IKA-Werke GmbH & Co. KG, Germany | ||
| pH-meter pHenomenal | VWR International, USA | ||
| Photoshop CS2 | Adobe Systems, USA | ||
| Precision scale | Ohaus Europe GmbH, Switzerland |
Ссылки
- Gain, P., et al. Global Survey of Corneal Transplantation and Eye Banking. JAMA Ophthalmology. 134 (2), 167-173 (2016).
- Roy, O., et al. Understanding the process of corneal endothelial morphological change in vitro. Investigative Ophthalmology & Visual Science. 56 (2), 1228-1237 (2015).
- Meltendorf, C., Ohrloff, C., Rieck, P., Schroeter, J. Endothelial cell density in porcine corneas after exposure to hypotonic solutions. Graefe's Archive for Clinical and Experimental Ophthalmology. 245 (1), 143-147 (2007).
- Schroeter, J., Meltendorf, C., Ohrloff, C., Rieck, P. Influence of temporary hypothermia on corneal endothelial cell density during organ culture preservation. Graefe's Archive for Clinical and Experimental Ophthalmology. 246 (3), 369-372 (2008).
- Schroeter, J., Ruggeri, A., Thieme, H. Impact of temporary hyperthermia on corneal endothelial cell survival during organ culture preservation. Graefe's Archive for Clinical and Experimental Ophthalmology. 253 (5), 753-758 (2015).
- Kunzmann, B. C., et al. Establishment Of A Porcine Corneal Endothelial Organ Culture Model For Research Purposes. Cell and Tissue Banking. 19 (3), 269-276 (2018).
- Redbrake, C., et al. A histochemical study of the distribution of dextran 500 in human corneas during organ culture. Current Eye Research. 16 (5), 405-411 (1997).
- Zhao, M., et al. Poloxamines for Deswelling of Organ-Cultured Corneas. Ophthalmic Research. 48 (2), 124-133 (2012).
- Filev, F., et al. Semi-quantitative assessments of dextran toxicity on corneal endothelium: conceptual design of a predictive algorithm. Cell and Tissue Banking. 18 (1), 91-98 (2017).
- Pels, E., Schuchard, Y. Organ-culture preservation of human corneas. Documenta Ophthalmologica. 56 (1-2), 147-153 (1983).
- Borderie, V. M., Kantelip, B. M., Delbosc, B. Y., Oppermann, M. T., Laroche, L. Morphology, Histology and Ultrastructure of Human C31 Organ-Cultured Corneas. Cornea. 14 (3), 300-310 (1995).
- Linke, S. J., et al. Thirty years of cornea cultivation: long-term experience in a single eye bank. Acta Opthalmologica. 91 (6), 571-578 (2013).
- Schroeter, J., et al. Arbeitsrichtlinien - Gute Fachliche Praxis für Hornhautbanken [Procedural guidelines. Good tissue practice for cornea banks]. Ophthalmologe. 106 (3), 265-276 (2009).
- Dohlman, C. H., Hedbys, B. O., Mishima, S. The swelling pressure of the corneal stroma. Investigative Ophthalmology & Visual Science. 1, 158-162 (1962).
- Xuan, M., et al. Proteins of the corneal stroma: importance in visual function. Cell and Tissue Research. 364 (1), 9-16 (2016).
- Sperling, S. Human Corneal Endothelium in Organ Culture - The Influence of Temperature and Medium of Incubation. Acta Opthalmologica. 57 (2), 269-276 (1979).
- Schroeter, J. Endothelial Evaluation in the Cornea Bank. Developments in Ophthalmology. 43, 47-62 (2009).
- Pels, E., Schuchard, Y. The Effects of High Molecular Weight dextran on the Presevation of Human Corneas. Cornea. 3 (3), 219-227 (1985).
- van der Want, H. J. L., Pels, E., Schuchard, Y., Olesen, B., Sperling, S. Electron Microscopy of Cultured Human Corneas Osmotic Hydration and the Use of dextran Fraction (dextran T 500) in Organ Culture. Archives of Ophthalmology. 101 (12), 1920-1926 (1983).
- Thuret, G., Manissolle, C., Campos-Guyotat, L., Guyotat, D., Gain, P. Animal compound-free medium and poloxamer for human corneal organ culture and Deswelling. Investigative Ophthalmology & Visual Science. 46 (3), 816-822 (2005).
- Wenzel, D. A., Kunzmann, B. C., Spitzer, M. S., Schultheiss, M. Staining of endothelial cells does not change the result of cell density. Cell and Tissue Banking. 20 (2), 327-328 (2019).
- Wenzel, D. A., Kunzmann, B. C., Hellwinkel, O., Druchkiv, V., Spitzer, M. S., Schultheiss, M. Effects of perfluorobutylpentane (F4H5) on corneal endothelial cells. Current Eye Research. , (2019).
- Olsson, I. A. S., Franco, N. H., Weary, D. M., Sandøe, P. The 3Rs principle - mind the ethical gap!. ALTEX Proceedings, 1/12, Proceedings of WC8. , 333-336 (2012).
- Sanchez, I., Martin, R., Ussa, F., Fernandez-Bueno, I. The parameters of the porcine eyeball. Graefe's Archive for Clinical and Experimental Ophthalmology. 249 (4), 475-482 (2011).
- Kim, M. K., Hara, H. Current status of corneal xenotransplantation. International Journal of Surgery. 23 (Pt B), 255-260 (2015).
- Fujita, M., et al. Comparison of Proliferative Capacity of Genetically-Engineered Pig and Human. Ophthalmic Research. 49 (3), 127-138 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены