Method Article
분할 각막 단추를 사용하여 돼지 각막 내피 내피 기관 문화 모형
요약
여기서, 돼지 분할 각막 버튼의 제조 및 재배를 위한 단계별 프로토콜이 제시된다. 이 오르가노-전형적으로 재배된 장기 배양 모델은 인간 기증자 각막에 필적하는 15일 이내에 세포 사망률을 나타내므로, 독성 덱젠을 첨가하지 않고 비인간 각막의 장기 재배를 허용하는 첫 번째 모델을 나타낸다.
초록
각막 내피 세포에 대한 실험 연구는 여러 가지 어려움과 관련이 있습니다. 인간 기증자 각막은 부족하고 일반적으로 이식을 위해 필요로 하기 때문에 실험적인 조사를 위해 드물게 유효합니다. 내피 세포 배양은 종종 생체 내 상황에 잘 번역되지 않습니다. 비 인간 각막의 생체 구조 특성으로 인해 재배 중 기질 부종은 상당한 각막 내피 세포 손실을 유발하여 장기간 재배를 수행하기가 어렵습니다. dextran과 같은 팽창 에이전트는 이 응답을 중화하는 데 사용됩니다. 그러나, 그(것)들은 또한 중요한 내피 세포 손실을 일으키는 원인이 됩니다. 따라서, 분해에이전트를 필요로 하지 않는 생체본 장기 배양 모델이 확립되었다. 지역 도축장에서 돼지 눈은 분할 각막 버튼을 준비하는 데 사용되었다. 부분 각막 trephination 후, 각막의 외부 층 (상피, 보만 층, 기질의 부분)을 제거하였다. 이것은 크게 대규모 기질 붓기에 의해 유도 된 각막 내피 세포 손실을 감소시키고 더 긴 재배 기간 동안 Descemet의 막 접는 내피 세포 층의 일반적인 보존을 향상. 후속 완전한 각막 담음은 나머지 눈 전구 및 재배에서 분할 각막 버튼의 제거에 의해 뒤따랐다. 내피 세포 밀도는 경현미경을 사용하여 제제 후 최대 15일(즉, 1일, 8일, 15일)의 후속 시간에 평가하였다. 사용된 준비 기술은 인간 기증자 각막에 필적하는 분할 각막 단추에 있는 느리고 선형 쇠퇴 비율 귀착되는 더 적은 기질 조직 팽윤에 의해 가능하게 된 내피 세포 층의 더 나은 보존을 허용합니다. 이 표준화된 유기학-전형적으로 재배된 연구 모델은 적어도 2주 동안 안정적인 재배를 가능하게 하기 때문에, 인간 기증자 각막에 대한 귀중한 대안으로, 향후 다양한 외부 요인에 대한 조사를 위한 귀중한 대안이 될 수 있습니다. 각막 내피에 미치는 영향.
서문
각막 이식 절차는 전 세계적으로 가장 일반적으로 수행 이식 중 하나입니다1. 인간 기증자 각막의 심각한 부족이 있기 때문에, 인간 각막에서 각막 내피 세포를 다루는 실험 연구는 수행하기 어렵다1. 그러나, 눈, 안과 점탄성 장치, 수술 기구 및 기술 (예를 들어, phacoemulsification 기기 및 기술, 초음파 에너지)에서 사용되는 관개 용액 및 기타 물질의 도입은 필요합니다. 임상 사용 전에 각막 내피에 미치는 영향에 관한 유효하고 광범위한 조사.
인간 기증자 각막에 대한 몇 가지 대안은 연구를 위해 존재합니다. 동물 연구 모델은 매우 귀중하지만 동시에 매우 자원 소비와 점점 윤리적으로 의문을 제기. 시험관 내 세포 배양의 주요 단점은 인간의 눈에 그들의 제한 된 번역. 세포 배양에서 얻은 결과는 세포가 내피 중간엽 전이 (EMT)를 겪을 수 있기 때문에 세포 극성의 손실과 세포 모양 및 유전자의 변화로 인한 섬유아세포 와 같은 형태학을 겪을 수 있기 때문에 생체 내 조건에 부합할 수 있습니다. 표현식2.
이전 생체 내 외 모델은 최대 120 h의 재배 기간을보고한 반면, 돼지 각막 내피 내피 장기 배양 모델을 확립하기 위한 새로운 준비 기법은 신선한 돼지 각막을 적어도 15 일 동안 배양하여 최근에 도입되었다3 ,4,5,6. 각막 상피와 기질의 일부가 재배 하기 전에 각막에서 제거 하는 경우 (약 300 전체에서 약 300 μm) 각막의 붓기는 덜 내 피 세포 손실 및 잘 유지 내 피 세포 손실의 결과로 분할 각막 버튼에서 감소 비 분할 각막 단추는 Descemet의 주름의 고르지 않은 기질 팽윤 그리고 대형 때문에 중요한 내피 세포 손실을 보여주기 때문에 15 일까지 후에 세포 층. 눈 은행은 일반적으로 이식 하기 전에 각 막의 붓기를 줄이기 위해 dextran 같은 삼 투 성 팽창 에이전트를 사용. 그러나, 이들 제제는 증가된 내피 세포 손실을 유도하는 것으로 나타났다7,8,9.
이 문서는 분할 각막 단추를 사용하여 각막 내피에 대한 연구를 수행 할 미래의 조사자가 할 수 있도록하기 위해 상세한 단계별 프로토콜에서이 표준화 된 생체 내 비보 연구 모델을 시각화하는 것을 목표로합니다. 이 모형은 안과 점탄성 장치, 관개 해결책 및 초음파 에너지, 또는 각막 내피가 관심있는 그밖 절차와 같은 눈 내의 이용된 물질 그리고 기술을 시험하는 간단한 방법을 나타냅니다.
프로토콜
이 프로토콜은 우리 기관의 윤리적 지침을 따릅니다. 우리 기관의 윤리 검토 위원회의 법령에 따라 모든 돼지 각막이 지역 도축장에서 얻어졌기 때문에 실험 전에 윤리적 승인을 받아야했습니다.
1. 장기 문화
- 돼지 눈을 준비합니다.
- 지역 도축장에서, 곧 사후 하지만 열 처리 하기 전에 제거 된 돼지 눈을 얻을. 실험실로 눈을 운반하고 몇 시간 이내에 처리합니다. 운반 중에는 가공 하기 전에 실온 (약 21 °C)에서 눈을 유지 하십시오.
- 눈 가위와 대장균 집게를 사용하여 소독하기 전에 모든 궤도 부속기 (눈 근육, 결막, 지방 조직)를 제거하십시오. 명백한 외상, 외부 손상 (예 : 칼 절단) 또는 눈에 보이는 각막 불투명도가있는 모든 눈을 분리하고 폐기하십시오.
- 인산완식염수(PBS) 용액의 57 mL에 7.5% 포비돈의 요오드 3 mL을 첨가하여 멸균 컵에 5% 요오드-PBS 용액(1:20)을 준비한다. 또한 60 mL 순수 PBS를 포함하는 별도의 멸균 컵을 준비합니다.
참고 : 사용되는 요오드 - PBS 용액의 총 량과 컵의 크기는 해부 할 각막의 수에 따라 달라집니다. 5~6개의 눈은 5%-요오드-PBS-용액의 약 60 mL가 제대로 비장되어야 합니다. - 5%-요오드-PBS 용액에 5-6개의 눈을 넣고 총 5분 동안 눈의 표면을 적절하게 소독합니다. 눈의 표면이 완전히 물에 잠기고 요오드 용액에 완전히 소독되도록 매 분마다 조심스럽게 저어줍니다.
- 5 분 후, 순수한 PBS로 채워진 준비 된 컵에 감염된 눈을 옮긴다. 요오드-PBS 용액이 눈의 표면에서 멀리 씻어내도록 조심스럽게 저어줍니다.
참고: 깨끗한 벤치에서 이 단계를 수행하여 감염된 눈의 오염을 방지합니다.
- 세포 배양 판을 준비합니다.
참고: 일정한 층류 공기 흐름이 있는 깨끗한 벤치에서 다음 단계를 수행합니다.- 태아 송아지 혈청 (FCS)의 2 mL을 해동. 무딘 캐뉼라를 사용하여 FCS로 주사기(5mL)를 채웁니다. 주사기 필터(0.22 μm)를 통해 주사기를 비우면 FCS의 세균 오염을 80 mL의 덱스트란 없는 배양 배지 I(최소 필수 배지 [MEM]과 얼염, 페니실린/스트렙토마이신, L-글루타민[200 mM]으로 비우십시오. 암포테리신 B [250 μg/mL], 헤페스 버퍼 [1 M] [50x], NaHCO3, 및 증류수). 혼합물을 교반하여 기판 분포를 균일하게 유지합니다.
- 기판 혼합물의 3 mL로 12 웰 세포 배양 플레이트의 각 웰을 채웁니다.
- 해부 및 배양을 수행합니다.
참고: 깨끗한 벤치에서 이 단계를 수행합니다. 모든 악기로 각막 내피를 만지지 마십시오.- PBS를 가진 컵에서 눈 전구를 각막을 위로 향하여 눈 전구 홀더로 옮기고 안과 수술 현미경 아래에 놓습니다. 0.9% NaCl이 채워진 주사기를 사용하여 눈전구 홀더 위에 흡입을 약간 적용하여 해부를 위한 자세로 눈을 고정시다.
- 트레핀(ø 7.5 mm)을 표준화된 인레이가 함유된 트레핀(ø 7.5 mm)을 사용하여 트레핀 깊이가 300 μm를 초과하지 않도록 하여 표면적으로 중앙 각막으로 절단합니다(그림1A).
- 대장균 집게와 삼각형 블레이드가 있는 일회용 메스를 사용하여 각막의 부분적으로 트레핀된 부분을 기질을 통해 수평으로 자르고 제거합니다. 각막 상피, 보우맨 층 및 기질의 일부로 구성된 분리 된 각막 부분을 폐기하십시오.
참고 : 엄격하게 나머지 기의 균일 한 두께를 얻기 위해 수평 절단 방향을 유지합니다. - 피상적으로 10-0 봉합사(10-0 폴리아미드 6)를 기질 내로 배치하여 실험 동안 기질 측으로부터 내피를 분화할 수 있도록하였다(도 1B). 각막 내피의 침투를 방지합니다. 내피가 침투하면 눈전구를 버리십시오.
참고 : 봉합 바늘로 각막 내피의 침투가 볼 수 있습니다, 전방 눈 챔버에서 유체가 봉합사 채널을 통해 누출로. - 인레이 없이 트레핀을 사용하여 전방 안구 챔버에 도달할 때까지 트레핀 컷을 최대 깊이로 진행합니다(도1C). 전방 안구 챔버에서 누출 저항과 유체에 뚜렷한 드롭은 각막의 완전한 침투 후 인식 될 수있다.
참고 : 분할 각막 버튼이 trephination 후 분할 각막 버튼의 한쪽에 부착 남아있는 경우 하키 칼을 사용합니다. - 얻어진 분할 각막 버튼을, 이제 기질의 일부로 구성된(그림 2),Descemet의 막, 및 각막 내피, 배양 배지 (배양 배지 I + FCS, 참조 섹션 1.2)를 가진 12 웰 세포 배양 판으로 각막 내피가 위를 향할 수 있도록 아래를 향한 태그가 지정됩니다.
참고: 내피 측이 아래로 향하고 있는 경우에, 내피는 손상될 수 있습니다. - 후속 조치 동안 식별을 위해 모든 분할 각막 버튼에 개별 번호를 할당하고 그에 따라 세포 배양 판에 우물을 레이블.
- 37°C, 5%CO2 및 95%의 상대적인 공기 수분에서 표준 조건 하에서 채워진 세포 배양 판을 인큐베이터에 배양한다. 배양배지(배양배지 I + FCS)를 8일째인 경우 7일간의 배양기간을 초과한다.
참고 : 분할 각막 버튼을 사용하여 인큐베이션 절차는 최대 15 일 동안 검증되었습니다.

그림 1: 분할 각막 단추를 얻기 위하여 돼지 각막의 해부. (A)각막의 트레핀을 인레이로 300 μm의 깊이로 자르고 기질 조직의 상피와 부분을 제거한 후,(B)봉합사가 각막의 침투 없이 기질에 표면적으로 배치된다. 기질 측의 나중에 식별을위한 내피. (C)남은 각막의 전체 탈질은(D)눈 전구에서 얻어진 분할 각막 버튼을 제거한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 현미경 검사 및 내피의 검사
- 얼룩이 없는 검사를 수행합니다.
참고 : 얼룩이없는 검사는 여러 번 수행 할 수 있습니다 (예 : 1, 8 및 15일의 주간 후속 조치). 그러나, 비염색 계수는 형태학적 파라미터가 아닌 내피 세포 밀도의 평가만허용한다.- 저혈압 균형 염 용액 3 mL을 채우기 (hBSS, 재료의 표에서조성물 참조)를 12 웰 세포 배양 플레이트의 각 웰에. 조심스럽게 각막 내피 세포의 붓기를 유도하고 세포 계산을위한 세포의 가시성을 개선하기 위해 hBSS에 하나의 분할 각막 버튼을 배치합니다.
참고 : 내피 측이 현미경의 방향을 향하고 있는지 확인하십시오. 반전된 상 대조 현미경이 이용되는 경우에, 내피 측은 아래쪽을 향할 필요가 있습니다. 제자리에 있는 동안, 배양 판은 내피 세포 손상을 방지하기 위하여 이동해서는 안됩니다. - 현미경에 부착 된 카메라로 내피 사진을 찍기 전에 세포가 1-2 분 동안 팽창하게하십시오. 각막 내피의 실제 상태의 대표적인 인상을 얻기 위해 적어도 세 개의 서로 다른 영역의 적어도 세 장의 사진을 촬영. 각막 내피 세포 밀도 및 형태학적 매개 변수의 나중에 분석을 위해 100 μm의 스케일 길이에 참을 가진 스케일 막대를 추가합니다.
- 삼투성 손상을 방지하기 위해 최대 5 분 후에 hBSS에서 분할 각막 버튼을 제거하고 배양 매체3으로다시 옮김으로 옮김을 옮김으로 옮김하십시오.
- 저혈압 균형 염 용액 3 mL을 채우기 (hBSS, 재료의 표에서조성물 참조)를 12 웰 세포 배양 플레이트의 각 웰에. 조심스럽게 각막 내피 세포의 붓기를 유도하고 세포 계산을위한 세포의 가시성을 개선하기 위해 hBSS에 하나의 분할 각막 버튼을 배치합니다.
- 염색 검사를 수행합니다.
참고 : 염색은 사용되는 염색 물질이 세포 독성이기 때문에 실험을 종료합니다. 따라서, 염색은 형태학적 파라미터(개혁 수치, 로제트 형성, 알리자린 적색 염색 세포)의 평가를 위한 관찰 기간의 끝에서만 수행될 수 있다.- 염색 시술에 0.25% 트라이판 블루 용액과 0.2% 알리자린 레드 S 용액을 준비한다.
- 0.25% 트라이판 블루 용액의 경우 0.9% NaCl 용액으로 0.4% 트라이판 블루 용액을 희석합니다.
참고: 예를 들어, 0.25% 트라이판 블루 용액의 20 mL을 얻으려면 0.9% NaCl 용액의 7.5 mL로 0.4% 트라이판 블루 용액의 12.5 mL를 희석합니다. 트라이판 블루 용액은 몇 주 또는 몇 달 동안 실온에서 보관될 수 있다. - 0.2% 알리자린 적색 S 용액을 얻기 위해 0.9% NaCl 용액의 50 mL에서 알리자린 적색 S 분말의 100 mg을 가열 기능을 가진 자석 교반 판상에 50°C로 일정한 교반 및 가열 하에 NaCl 용액을 용해한다. 가능한 침전을 제거하려면 얻은 용액을 필터링합니다. 그에 따라 수산화 나트륨 또는 염산을 첨가하여 알리자린 레드 S 용액의 pH를 pH 4.2로 조절한다.
참고 : 알리자린 적색 S 용액의 각 응용 프로그램 전에 pH가 4.2로 보정되고 용액에 침전물이 없는지 확인하십시오. 용액은 실온에서 보관될 수 있다. 4주 이상 보관하지 마십시오.
- 0.25% 트라이판 블루 용액의 경우 0.9% NaCl 용액으로 0.4% 트라이판 블루 용액을 희석합니다.
- 내피 세포를 얼룩지기 위해 내피 측이 위쪽을 향하도록 페트리 접시에 분할 각막 버튼을 놓습니다. 피펫을 사용하여 0.25% 트라이판 블루 용액을 90년대 동안 각막 내피에 떨어뜨려 서서히 떨어뜨립니다.
참고 : 트라이 판 블루는 자신의 핵을 얼룩 때문에 투과성 멤브레인 손상된 각막 세포의 식별을 할 수 있습니다. - 작은 유리 비커에 0.9 % NaCl에서 분할 각막 버튼을 3 배 조심스럽게 헹구세요. 다시, 피펫을 사용하여 0.2% 알리자린 레드 S 용액을 90s에 대한 각막 내피에 떨어뜨려 서서히 떨어뜨립니다.
참고: Alizarin red S는 손상되지 않은 각막 내피 세포의 세포 경계를 강조하고 기본 Descemet의 막이 보이게 되면 파괴된 세포를 강조하는 데 도움이되는 Descemet의 막을 더럽히습니다. 또한, 더 큰 파괴 된 지역을 쉽게 식별 할 수 있습니다. - 스테인드 각막 내피의 검사를 위해 섹션 2.1에서 얼룩이 없는 계수에 대해 설명된 단계를 따르십시오.
- 염색 시술에 0.25% 트라이판 블루 용액과 0.2% 알리자린 레드 S 용액을 준비한다.
3. 각막 내피 세포 밀도 및 형태 학적 매개 변수의 분석
- 그래픽 편집소프트웨어(재질 표)를사용하여 그림에 사각형을 계산하는 프로젝트입니다.
- 소프트웨어를 열고 파일을 선택하여 각막 내피의 이미지를 엽니 다 | 오픈 | 을 선택합니다.
- 이미지에 100 μm의 배율 측 길이가 있는 사각형을 투영합니다.
참고: 보기 소프트웨어가 그림에 사각형 을 계산하는 것을 허용하는 경우 섹션 3.1.2의 다음 단계를 무시할 수 있습니다. 사각형의 측면 길이는 현미경 카메라로 촬영한 이미지의 해상도에 따라 달라지며 스케일 막대로 계산할 수 있습니다.- 현미경으로 찍은 사진에서 배율 막대를 자르기: 도구 모음에서 직사각형 선택 윤곽 도구를 선택하거나 M을누릅니다. 자르기 또는 Ctrl + X를누릅니다.
- 파일 | 클릭 새로운 (또는 Ctrl + N을누릅니다). 예정된 창에서 문서 유형 드롭다운 목록에서 클립보드를 선택합니다. 표시된 픽셀 수는 계수 사각형의 측면 길이입니다. 다른 사진에 해당하는 픽셀을 기록하고 확인을클릭합니다.
- 파일 선택 | 새로운 (또는 Ctrl + N). 축척 막대의 길이에 따라 다가오는 창에 계수 사각형의 너비와 길이(픽셀)를 삽입합니다. 배경색을흰색으로 선택한 다음 확인을누릅니다.
- 선택을 클릭합니다. 모두 (또는 Ctrl + A)를선택합니다. 편집 선택 | 복사 (또는 Ctrl + C).
- 3.1.1단계에서 열린 각막 내피의 이미지를 선택한다. 편집 선택 | 붙여 넣기 (또는 Ctrl + V)각막 내피의 사진에 사각형을 삽입합니다.
- 사각형의 레이어를 선택하고 투명도를 조정합니다. 레이어 선택 | 레이어 스타일 | 블렌딩 옵션 | 불투명도를 30%로 설정 | 확인 .
- 투영된 사각형으로 이미지를 100 μm의 배율 측 길이로 저장합니다.
- 내피 세포 밀도 및 형태학적 파라미터를 평가한다.
- ImageJ(버전 1.50i)에서 투영된 사각형으로 이미지를 열고 CellCounter PlugIn을 사용하여 사각형 내의 셀을 계산합니다. 이미지J 열기, 파일 선택 | 열기 (또는 Ctrl + O) | 이미지 를 선택합니다.
참고 : ImageJ와 셀 카운터 플러그인은 온라인으로 다운로드 할 수있는 프리웨어입니다. - 플러그인 선택 | 셀_카운터 | 셀 카운터 | 초기화합니다. 내피 세포를 계산하고 결과를 기록합니다. 사각형의 양면에서 사각형 가장자리로 잘려있는 셀을 계산합니다. 다른 두 면에 잘라낸 셀을 세지 마십시오.
- 다른 지역에서 각막 당 적어도 6 개의 사각형을 분석하고 (예를 들어, 3 개의 사진, 사진 당 2 개의 사각형) 사각형 당 평균 각막 내피 세포 밀도를 결정합니다 (100 μm2). 100 μm 당 내피 세포밀도를 100을 곱하여 2 ~ 1mm2를 곱한다.
- ImageJ(버전 1.50i)에서 투영된 사각형으로 이미지를 열고 CellCounter PlugIn을 사용하여 사각형 내의 셀을 계산합니다. 이미지J 열기, 파일 선택 | 열기 (또는 Ctrl + O) | 이미지 를 선택합니다.
- 형태학적 변화의 평가를 위해, 개혁 수치 (3 대신 ≥4 세포 / 세포 경계의 공동 회의), 로제트 형성 (특징 적인 장미 모양의 모양, 파괴 된 세포를 둘러싼 5 개 이상의 방사형 으로 배열 된 세포) ) 또는 알리자린 적색 영역 (파괴 된 세포) 투영 된 사각형에.
참고: 또는 잘 보존된 샘플에서 형태학적 분석을 위해 더 큰 제곱(예를 들어, 200 x 200 μm2)을사용하여 보다 대표적인 결과를 얻는 것이 유용할 수 있습니다.
결과
제시된 해부 기술은 기질 조직의 부분적인 제거를 의미하며, 이로 인해 각막 샘플이 얇아지고 기질 이붓기가줄어듭니다(그림 1 및 그림 2). 적은 기질 팽윤은 각막 내피에 부정적인 충격이 있는 더 적은 전단 및 핀치 힘을 유도합니다, 따라서 더 낮은 내피 세포 손실 비율을 일으키는 원인이되는 6. 분할 각막 단추는 더 적은 내피 세포 손실 및 개혁의 더 적은 수를 반영하는 비 분할 각막 단추 및 전체 corneoscleral 견본에 비교된 재배의 15 일 후에 현저하게 더 잘 보존된 내피 세포 층을 보여줍니다 수치 (≥ 4 세포 / 세포 테두리가 3 개가 아닌 결합), 로제트 형성 (단일 자리에서 만나는 5 개 이상의 방사형 으로 배열 된 세포), 및 알리자린 적색 (파괴) 세포 는 15 일후 6.
15일의 기간 동안, 분할 각막 단추는 4.90%의 평균 주간 백초 내피 세포 손실과 내피 세포 밀도에 있는 꾸준한 쇠퇴를 보여줍니다 (n = 40, 그림 3). 내피 세포 밀도가 4,033 ±146/163 세포/mm2(중앙값 ± 25%/75% 분위수)로 1일째부터 시작하여, 세포 밀도는 8일째에 3,850±167/233 세포/mm2로 감소하였고, 15일째에는 3,650±200/233 세포/mm2로 감소하였다. 결정된 세포 손실은 첫째 주와 두 번째 주에 대해 유사했습니다. 1일차,4.00±2.17/1.93%(중앙값 ± 25%/75% 사분위수); 일 8-15, 4.88 ± 5.52 / 4.42 %; 1-15, 8.64 ± 4.32 / 2.71 %). 따라서, 주어진 감소율은 이전 연구에서 재배하는 동안 인간 공여자 각막에서 보고된 비율과유사하다 10,11,12.
형태학적 파라미터는 15일째에 내피 세포 층의 염색 후 평가되었다(n=28, 도 4). 종교 개혁 수치는 7.18 ±2.36/2.90%(중간 ± 25%/75% 사분위수)로 구성되었습니다. 1.11 ±1.11/15.56 로제트 형성/mm2(중앙값 ± 25%/75% 분위수)의 중앙값은 조사된 샘플에 존재하였고, 반면 13.33±4.44/11.67 alizarin 적색 염색 세포/mm2(중앙값 ± 25%/75% 분위수)의 현저한 세포 손실.
도 5는 hBSS(도5A)에서현미경 평가 동안 각막내피의 대표적인 이미지를 제공하고 트리판 블루 및 알리자린 레드S(도 5B)로염색한 후. hBSS에서 내피 세포 밀도의 평가는 여러 번 수행 될 수있다 (예를 들어, 일에 1, 8, 및 15), 스테인드 샘플은 형태 학적 매개 변수의 평가에 사용할 수있는 반면 (개혁 수치, 로제트 형성, 알리자린 붉은 얼룩 세포) 또는 대부분의 염색 물질의 세포 독성 특성으로 인해 실험의 끝에 내피 세포 밀도의 결정.
분할 각막 단추가 우연히 내피 측을 향하고 경작되는 경우에, 광대한 내피 세포 손상이 예상될 것입니다(도 6A). 비 분할 각막 단추는 기질 팽윤 때문에 내피 세포 손실을 현저하게 증가, 재배의 15 일 이상 Descemet의 막 접는 일으키는 원인이 되는 고통(그림 6B),반면 분할 각막 버튼은 크게 보존 각막 내피 재배 15일 후, 단일 파괴 세포를 나타내는 산란된 정시 알리자린 붉은 얼룩부위로표시(도 6C).
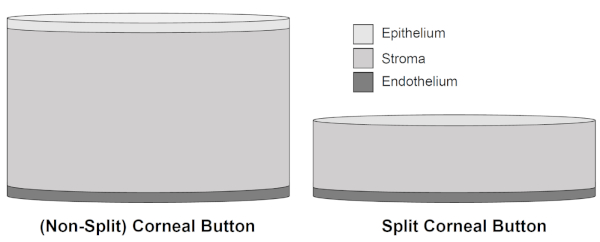
그림 2: 분할되지 않은 각막 버튼과 분할 각막 버튼의 개략적 그림. 상피와 기질 조직의 주요 부분을 포함하여 돼지 각막의 300 μm의 제거 후, 분할 각막 버튼의 두께는 전체 기질 붓기 감소로 인해 각막 내피의 더 나은 보존에 찬성 감소 최대 15일까지 재배할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
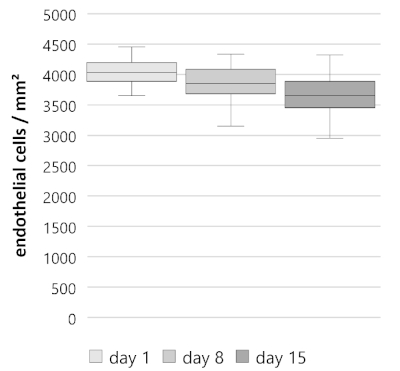
그림 3: 15 일 동안 분할 각막 단추의 내피 세포 밀도 (ECD). 분할 각막 버튼 (n = 40)은 꾸준한 감소를 보였다. 1일째에 ECD, 4,033±146/163 세포/mm2(중앙값 ± 25%/75% 사분위수); 일 8, 3,850 ± 167 / 233 세포 / mm2; 일 15, 3,650 ± 200 / 233 세포 / mm2. 데이터는 중간 ± 25 %/75 % 사분위수로 묘사되며, 수염은 최소 및 최대 또는 1.5 의 interquartile 범위 (IQR)를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
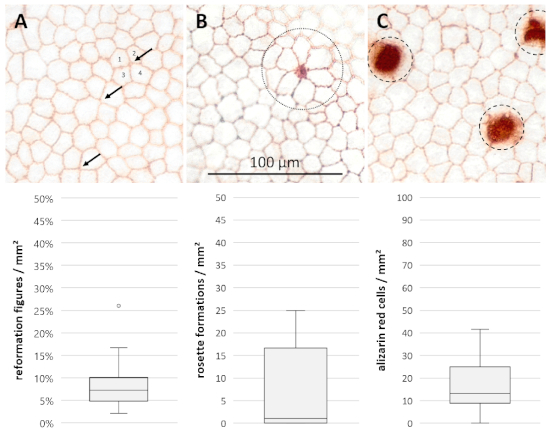
그림 4: 세포 손상 및 재배열 공정의 추가 평가를 위한 형태학적 파라미터. 각막 내피의 현미경 사진 400x 배율의 15 일 재배 및 트리판 블루와 알리자린 빨간 S 보여주는 염색(A)개혁 수치 (화살표, 대신 4 개 이상의 세포 / 세포 테두리의 공동 회의) 3),(B)장미 형성 (점선 원, 5 개 이상의 인접 세포의 특징적인 로제트 형성을 가진 중앙 점감 세포) 및(C)alizarin 적색 염색 세포 (파선 원, 파괴 된 세포). 데이터(n = 28)는 중간 ± 25%/75% 사분위수로 표시됩니다. 수염은 최소 및 최대 또는 1.5의 중간 수위 범위(IQR)를 나타냅니다. 원은 IQR 내에 있지 않은 이상값을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 얼룩이 없고 스테인드 된 각막 내피. 현미경 평가 (400 x 배율)에서 현미경 평가 (400x 배율)에서 볼 수 있듯이 내피 세포 층은 내피 세포 부종을 유발하고 따라서 더 나은 세포 가시성을 일으키는(B)트라이판 블루로 염색 한 후 그리고 알리자린 빨간색 S. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
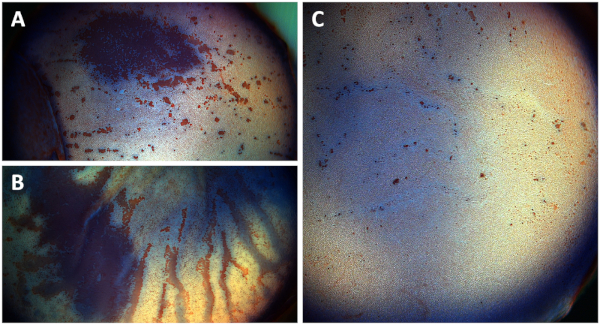
그림 6: (A) 분할 각막 버튼의 각막 내피의 개요 사진 거꾸로 경작, (B) 비 분할 각막 버튼, 및 (C) 염색 후 분할 각막 버튼. 사진은 트라이판 블루와 알리자린 레드 S.(A)광범위한 각막 내피 세포 손상 (빨간색 영역)으로 염색 후 각막 내피 내피 내피 를 보여 (붉은 영역) 분할 각막 버튼이 하나 후 아래로 향하게 재배 후 관찰된다 재배의 주. (B)Descemet의 막 접기 및 기질 부종으로 인해 비 분할 각막 버튼의 내피 세포 손상이 15 일 재배 후 크게 증가 (붉은 줄무늬). (C)분할 각막 버튼은 영양적 붉은 얼룩부위에서 보이는 정시 파괴 세포만을 보여주는 15일 의 재배 후 잘 보존된 내피 세포 층을 보여준다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 연구 목적을 위해 표준화되고 저렴한 비용의 생체 내막 내피 내피 내피 모델을 나타내는 돼지 분할 각막 버튼을 제조하는 방법을 제공한다6. 돼지 분할 각막 버튼은 2 주 기간동안눈 은행에서 재배 된 인간 기증자 각막에서 관찰 된 내피 세포 손실에 필적하는 내피 세포 밀도의 감소를 보였다6,10,11, 12.
비 분할 각막 버튼뿐만 아니라 전체 돼지 코르네오스클레럴 샘플에 대한 우수성은 이전에6을나타내었다. 그 연구에서, 3 개의 그룹 일 1, 8, 그리고 15 에 비교 되었다. 모든 그룹의 각막 내피 (각막 버튼, 비 분할 각막 버튼, 분할 각막 버튼)는 잘 보존 된 내피 세포 층6으로표현 된 1 일째에 양호한 상태였습니다. 그러나, 기질 팽윤으로 인해, Descemet의 막의 접는 전체 corneoscleral 견본의 내피의 내피의 넓은 지역을 파괴했습니다, 그래서 8 및 15 일에 각막 내피 세포 밀도의 대표적인 평가는 수행될 수 없었습니다. 비 분할 각막 단추의 내피는 15 일까지 잘 보존되었지만, 몇몇 Descemet의 막 주름은 또한 존재했습니다. 비록 관상 동맥 샘플비 분할 각막 단추의 내피 세포 층은 더 나은 상태에 있더라도, 분할 각막 단추의 내피 세포 층은 훨씬 더 나은 상태에 있었습니다. 이것은 양적 및 질적 매개 변수에서 볼 수 있습니다, 내피 세포 손실내 15 재배의 일 내 로 비 분할 각막 버튼에서 상당히 높았다 (p = 0.041) 비 분할 각막 버튼 (-575 ± 25/250 세포 /mm2)분할 각막 버튼에 비해 (-417 ± 138/179세포/mm2),보다 규칙적인 육각형 세포 패턴에서 명백한 결정된 형태학적 특성에 일치하며, 더 적은 개혁 수치와 로제트 형성, 그리고 분할된 더 적은 파괴 된 세포 (알리자린 적색 영역)를 각막 버튼6. 백분위내피세포 손실은 비분할 및 분할 각막 버튼에서 15일 이내에 백분세포 손실이 각각 14.89% 및 10.2%(p= 0.032)이기 때문에 이러한 발견을확인한다. 이 방법은 최대 15일의 기간 동안 검증되었기 때문에, 지금까지 발표된 연구(72~120h)보다 더 긴 관찰 기간을 허용한다3,4,5.
내피 세포 층의 보존에 있는 개선은, 또한 눈 은행에서 이용된 일반적인 경작 프로토콜을 적용하고, 전적으로 각막 기질의 감소된 팽윤에 기인할 수 있습니다, 기질의 중요한 부분 (300 μm) 이전에 제거되기 때문에 재배6,13. 일반적으로 기질은 기질 조직14,15내에 내장 된 친수성 특성 및 분자로 인해 재배 중에 엄청나게 팽창하는 경향이 있다. 전단 및 핀치 힘을 유발하는 붓기와 Descemet의 막 접는 것은 각막 내피 및 내피 세포 손실에 기계적 부담을 유발하며, 기질6,10의부분 제거 후 감소됩니다. 이식 전에 인간 기증자 각막을 deswell dextran과 같은 삼투성 에이전트를 사용하는 눈 은행에 반대로, 분할 각막 버튼은 삼투성 팽창을 필요로하지 않는다16,17. 덱스렌으로 보충된 배양배지로서 각막 내피세포에 흡수되어 세포손실을 증가시키는 것으로 알려져있으며, 7,8,9,18,19 ,20,dextran (또는 다른 삼투성 제)없이 분할 각막 버튼의 재배는 가능한 한 많은 부정적인 독성 요인을제거6. 배양 배지는 제시된 방법에 있는 어떤 첨가물든지 보충되지 않기 때문에, 어떤 추가된 물질든지 기인한 유독한 영향은 예상되지 않습니다, 새로운 물질의 생체 적합성 시험의 조사를 위해 이 모형을 귀중한 만드는.
각막 내피는 매우 섬세한 세포 층이고 분할 각막 단추의 준비는 적당한 외과 기술 및 온화한 취급을 요구하더라도, 이 기술은 작동하고 에 관하여 믿을 수 있는 결과를 얻기 위하여 표준화한 방법이 될 수 있습니다 매우 합리적인 시간 프레임 내에서 각막 내피에 다양한 요인의 효과. 그럼에도 불구하고, 각막 내피가 위험한 상태에 있는 이 프로토콜에 있는 몇몇 단계가 있습니다. 분명히 손상되거나 불투명한 눈은 가능한 편견을 방지하기 위해 처음부터 신중하게 식별하고 폐기해야합니다. 또한, 각막 내피는 항상 trephination, 해부, 추출 및 취급 (예를 들어, 배양 판에서 문화 판으로, 문화 판으로 옮겨지는 등) 동안 그대로 방치해야합니다. 기계적 손상. 봉합사를 기질에 표면적으로 놓으면 바늘이 실수로 너무 깊이에 삽입되면 내피가 침투 할 수 있습니다. 그렇다면 전방 안구 챔버에서 눈에 띄는 유체가 봉합사 채널을 통과하고 해당 눈을 폐기해야합니다. 이를 방지하기 위해 바늘은 기질 내에 피상적으로 보관해야합니다. 또한 메스를 사용하여 각막 버튼을 수평으로 엄격하게 분할해야합니다. 고르지 않은 절단 재배 하는 동안 고르지 않은 붓기 귀 착될 것 이다, 아마도 증가 내 피 세포 손실을 일으키는.
hBSS에 있는 얼룩지지 않은 각막 내피 세포의 시험은 인간 적인 공여자 각막에서 일반적으로 행해냅니다. hBSS3에서분할 각막 버튼의 선택된 검사 시간에 대한 내피 세포의 삼투성 팽윤으로 인한 중요한 세포 손상의 증거는 없다. 염색은 세포 경계의 가시성을 향상시키지만, 스테인드 카운팅은 염색된계수(21)에비해 내피 세포 밀도의 현저하게 다른 결과를 초래하지 않는다. 얼룩이 없는 계산의 명확한 이점은 염색 물질이 일반적으로 세포 독성이고 관찰 기간을 종료하는 반면, 실험의 과정을 통해 여러 후속 검사를 할 수 있다는 것입니다. 염색된 계수는, 그러나, 내피의 형태학적 특성을 평가하기 위하여 중요합니다 남아 있습니다. 트라이판 블루는 종종 얼룩이 없는 계산에서 손상되지 않은 것처럼 보이는 손상된 세포의 핵을 강조합니다. Alizarin 빨간 S는 명확하게 내피 세포 밀도의 평가를 용이하게하고 각막 내피의 형태학적 특징의 분석을 가능하게 하는 Descemet의 막을 염색하여 세포 경계 및 손상된 세포의 가시성을 향상시킵니다 , 개혁 수치, 로제트 형성, 및 알리자린 적색 스테인드 세포와 같은(그림 4).
ex vivo 모형으로 분할 각막 단추의 중요한 제한은, 시험관 내 모형 같이, 각막 내피 세포에 외부 영향을 조사하기위해서만 적당하다는 것입니다. 따라서 생체 내 모델은 눈과 각막 내피에 영향을 미치는 전신 질환 및 상태에 대한 연구를 위해 대체 할 수 없습니다. 에 관계없이, 이러한 제제 기술은 각막 내피에 대한 다양한 외부 요인의 효과를 테스트하기 위한 유효한 데이터를 생성할 수 있다(예를 들어, 새로운 물질의 생체 적합성 검사에서)22. 살아있는 동물 실험의 수를 감소시키기 위해 3R 원리 (대체, 감소, 정제)에 따라,이 방법은 시험관 내 세포 배양 사이의 격차를 더 좁히기 위한 적절한 연구 모델을 제공합니다. 인간에서 생체 상황, 그리고 동물 연구, 이는 상당한 노력을 필요로하고 점점 윤리적 우려를 제기23.
그들의 속성 및 가용성 으로 인해, 돼지 눈 연구 목적을 위해 인간의 눈을 위한 유일한 적절 한 대체 될 것 같다. 이 동물은 인간에게 가장 가까운 종이더라도 비 인간 영장류에서 각막은 윤리적인 이유 및 가용성 때문에 좋은 대안이 아닙니다. 다른 한편으로는, 작은 동물의 눈은 단순히 너무 작아서 효율적인 각막 제거를 허용합니다. 돼지 눈은 인간의 눈과 비교할 수 있으며 각막 내피 세포의 유사한 특성을 나타내며, 이는 또한 유전자 변형 돼지각막(24)의가능한 미래 이종이식을 다루는 연구에반영된다. 25,26. 또한, 도축장의 부산물이기 때문에 쉽게 구할 수 있습니다.
결론적으로, 돼지 각막을 사용하여 제시된 방법은 각막 내피 세포에 대한 비용 효율적인 연구를 가능하게 하는 고도로 재현 가능한 유기-전형적으로 재배된 연구 모델을 제공합니다. 미래 조사자는 각막 내피가 큰 관심사인 새로운 물질, 외과 기술, 장비 및 그밖 가능한 외부 영향과 같은 각종 요인의 효력을 분석하기 위하여 분할 각막 단추를 사용할 수 있습니다.
공개
저자는 공개 할 것이 없다.
감사의 말
제시 된 연구 모델의 설립은 교육 및 연구 독일의 연방 정부의 KMU-innovativ (FKZ : 13GW0037F)에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| Subject | |||
| Pig eyes | local abbatoir | ||
| Substances | |||
| Alizarin red S | Sigma-Aldrich, USA | ||
| Culture Medium 1, #F9016 | Biochrom GmbH, Germany | ||
| Dulbecco's PBS (1x) | Gibco, USA | ||
| Fetal calf serum | Biochrom GmbH, Germany | ||
| Hydrochloric acid (HCl) solution | own production | ||
| Hypotonic balanced salt solution | own production | per 1 L of H2O: NaCl 4.9 g; KCl 0.75 g; CaCl x H2O 0.49 g; MgCl2 x H2O 0.3 g; Sodium Acetate x 3 H2O 3.9 g; Sodium Citrate x 2 H2O 1.7 g | |
| Povidon iodine 7.5%, Braunol | B. Braun Melsungen AG, Germany | ||
| Sodium chloride (NaCl) 0.9% | B. Braun Melsungen AG, Germany | ||
| Sodium hydroxide (NaOH) solution | own production | ||
| Trypan blue 0.4% | Sigma-Aldrich, USA | ||
| Materials & Instruments | |||
| Accu-jet pro | Brand GmbH, Germany | ||
| Beaker Glass 50 mL | Schott AG, Germany | ||
| Blunt cannula incl. Filter (5 µm) 18G | Becton Dickinson, USA | ||
| Cell culture plate (12 well) | Corning Inc., USA | ||
| Colibri forceps | Geuder AG, Germany | ||
| Corneal scissors | Geuder AG, Germany | ||
| Eppendorf pipette | Eppendorf AG, Germany | ||
| Eye Bulb Holder | L. Klein, Germany | ||
| Eye scissors | Geuder AG, Germany | ||
| Folded Filter ø 185 mm | Whatman, USA | ||
| Hockey knife | Geuder AG, Germany | ||
| Laboratory Glass Bottle with cap 100 mL | Schott AG, Germany | ||
| Magnetic stir bar | Carl Roth GmbH & Co. KG, Germany | ||
| MillexGV Filter (5 µm) | Merck Millopore Ltd., USA | ||
| Needler holder | Geuder AG, Germany | ||
| Petri dishes | VWR International, USA | ||
| Pipette tips | Sarstedt AG & Co., Germany | ||
| Scalpel (single use), triangular blade | Aesculap AG & Co. KG, Germany | ||
| Serological pipette 10 mL | Sarstedt AG & Co., Germany | ||
| Serological pipette 5 mL | Sarstedt AG & Co., Germany | ||
| Sterile cups | Greiner Bio-One, Österreich | ||
| Sterile gloves | Paul Hartmann AG, Germany | ||
| Sterile surgical drape | Paul Hartmann AG, Germany | ||
| Stitch scissors | Geuder AG, Germany | ||
| Suture Ethilon 10-0 Polyamid 6 | Ethicon Inc., USA | ||
| Syringe (5 mL) | Becton Dickinson, USA | ||
| trephine ø 7.5 mm | own production | ||
| Tying forceps | Geuder AG, Germany | ||
| Weighing paper | neoLab Migge GmbH, Germany | ||
| Equipment & Software | |||
| Binocular surgical microscope | Carl Zeiss AG, Germany | ||
| Camera mounted on microscope | Olympus, Japan | ||
| CellSens Entry (software) | Olympus, Japan | ||
| Cold-light source | Schott AG, Germany | ||
| Incubator | Heraeus GmbH, Germany | ||
| Inverted phase contrast microscope | Olympus GmbH, Germany | ||
| Magnetic stirrer with heating function | IKA-Werke GmbH & Co. KG, Germany | ||
| pH-meter pHenomenal | VWR International, USA | ||
| Photoshop CS2 | Adobe Systems, USA | ||
| Precision scale | Ohaus Europe GmbH, Switzerland |
참고문헌
- Gain, P., et al. Global Survey of Corneal Transplantation and Eye Banking. JAMA Ophthalmology. 134 (2), 167-173 (2016).
- Roy, O., et al. Understanding the process of corneal endothelial morphological change in vitro. Investigative Ophthalmology & Visual Science. 56 (2), 1228-1237 (2015).
- Meltendorf, C., Ohrloff, C., Rieck, P., Schroeter, J. Endothelial cell density in porcine corneas after exposure to hypotonic solutions. Graefe's Archive for Clinical and Experimental Ophthalmology. 245 (1), 143-147 (2007).
- Schroeter, J., Meltendorf, C., Ohrloff, C., Rieck, P. Influence of temporary hypothermia on corneal endothelial cell density during organ culture preservation. Graefe's Archive for Clinical and Experimental Ophthalmology. 246 (3), 369-372 (2008).
- Schroeter, J., Ruggeri, A., Thieme, H. Impact of temporary hyperthermia on corneal endothelial cell survival during organ culture preservation. Graefe's Archive for Clinical and Experimental Ophthalmology. 253 (5), 753-758 (2015).
- Kunzmann, B. C., et al. Establishment Of A Porcine Corneal Endothelial Organ Culture Model For Research Purposes. Cell and Tissue Banking. 19 (3), 269-276 (2018).
- Redbrake, C., et al. A histochemical study of the distribution of dextran 500 in human corneas during organ culture. Current Eye Research. 16 (5), 405-411 (1997).
- Zhao, M., et al. Poloxamines for Deswelling of Organ-Cultured Corneas. Ophthalmic Research. 48 (2), 124-133 (2012).
- Filev, F., et al. Semi-quantitative assessments of dextran toxicity on corneal endothelium: conceptual design of a predictive algorithm. Cell and Tissue Banking. 18 (1), 91-98 (2017).
- Pels, E., Schuchard, Y. Organ-culture preservation of human corneas. Documenta Ophthalmologica. 56 (1-2), 147-153 (1983).
- Borderie, V. M., Kantelip, B. M., Delbosc, B. Y., Oppermann, M. T., Laroche, L. Morphology, Histology and Ultrastructure of Human C31 Organ-Cultured Corneas. Cornea. 14 (3), 300-310 (1995).
- Linke, S. J., et al. Thirty years of cornea cultivation: long-term experience in a single eye bank. Acta Opthalmologica. 91 (6), 571-578 (2013).
- Schroeter, J., et al. Arbeitsrichtlinien - Gute Fachliche Praxis für Hornhautbanken [Procedural guidelines. Good tissue practice for cornea banks]. Ophthalmologe. 106 (3), 265-276 (2009).
- Dohlman, C. H., Hedbys, B. O., Mishima, S. The swelling pressure of the corneal stroma. Investigative Ophthalmology & Visual Science. 1, 158-162 (1962).
- Xuan, M., et al. Proteins of the corneal stroma: importance in visual function. Cell and Tissue Research. 364 (1), 9-16 (2016).
- Sperling, S. Human Corneal Endothelium in Organ Culture - The Influence of Temperature and Medium of Incubation. Acta Opthalmologica. 57 (2), 269-276 (1979).
- Schroeter, J. Endothelial Evaluation in the Cornea Bank. Developments in Ophthalmology. 43, 47-62 (2009).
- Pels, E., Schuchard, Y. The Effects of High Molecular Weight dextran on the Presevation of Human Corneas. Cornea. 3 (3), 219-227 (1985).
- van der Want, H. J. L., Pels, E., Schuchard, Y., Olesen, B., Sperling, S. Electron Microscopy of Cultured Human Corneas Osmotic Hydration and the Use of dextran Fraction (dextran T 500) in Organ Culture. Archives of Ophthalmology. 101 (12), 1920-1926 (1983).
- Thuret, G., Manissolle, C., Campos-Guyotat, L., Guyotat, D., Gain, P. Animal compound-free medium and poloxamer for human corneal organ culture and Deswelling. Investigative Ophthalmology & Visual Science. 46 (3), 816-822 (2005).
- Wenzel, D. A., Kunzmann, B. C., Spitzer, M. S., Schultheiss, M. Staining of endothelial cells does not change the result of cell density. Cell and Tissue Banking. 20 (2), 327-328 (2019).
- Wenzel, D. A., Kunzmann, B. C., Hellwinkel, O., Druchkiv, V., Spitzer, M. S., Schultheiss, M. Effects of perfluorobutylpentane (F4H5) on corneal endothelial cells. Current Eye Research. , (2019).
- Olsson, I. A. S., Franco, N. H., Weary, D. M., Sandøe, P. The 3Rs principle - mind the ethical gap!. ALTEX Proceedings, 1/12, Proceedings of WC8. , 333-336 (2012).
- Sanchez, I., Martin, R., Ussa, F., Fernandez-Bueno, I. The parameters of the porcine eyeball. Graefe's Archive for Clinical and Experimental Ophthalmology. 249 (4), 475-482 (2011).
- Kim, M. K., Hara, H. Current status of corneal xenotransplantation. International Journal of Surgery. 23 (Pt B), 255-260 (2015).
- Fujita, M., et al. Comparison of Proliferative Capacity of Genetically-Engineered Pig and Human. Ophthalmic Research. 49 (3), 127-138 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유