Method Article
Um modelo de cultura de órgão endotelial corneano porcina usando Split córnea botões
Neste Artigo
Resumo
Aqui, um protocolo passo a passo para a preparação e o cultivo de botões córneos rachados suínos é apresentado. Como este modelo organo-tipicamente cultivado da cultura do órgão mostra taxas de morte da pilha dentro de 15 dias, comparável às córneas doadoras humanas, representa o primeiro modelo permitindo o cultivo a longo prazo de córneas não-humanas sem adicionar o Dextran tóxico.
Resumo
A pesquisa experimental sobre as células endoteliais da córnea está associada a várias dificuldades. As córneas doadoras humanas são escassas e raramente estão disponíveis para investigações experimentais, pois são normalmente necessárias para o transplante. As culturas de células endoteliais muitas vezes não se traduzem bem em situações in vivo. Devido às características bioestruturais de córneas não humanas, o inchamento stromal durante o cultivo induz a perda endothelial córnea substancial da pilha, que faz difícil executar o cultivo por um período de tempo prolongado. Os agentes de deswelling tais como o dextrano são usados para neutralizar esta resposta. No entanto, eles também causam significativa perda de células endoteliais. Portanto, estabeleceu-se um modelo de cultura de órgãos ex vivo que não necessitava de agentes de deswelling. Os olhos do porco de um matadouro local foram usados para preparar os botões córneos rachados. Após a trephinação córnea parcial, as camadas exteriores da córnea (epitélio, camada do Bowman, partes do estroma) foram removidas. Isto reduz significativamente a perda endothelial córnea da pilha induzida pelo inchamento stromal maciço e Descemet ' dobra da membrana de s durante períodos mais longos do cultivo e melhora a preservação geral da camada endothelial da pilha. O trefinação córneo completo subseqüente foi seguido pela remoção da tecla córnea rachada do bulbo e do cultivo restantes do olho. A densidade de células endoteliais foi avaliada em tempos de seguimento de até 15 dias após a preparação (i.e., dias 1, 8, 15) utilizando microscopia de luz. A técnica da preparação usada permite uma melhor preservação da camada endothelial da pilha permitida pelo inchamento menos stromal do tecido, que conduz às taxas lentas e lineares do declínio nos botões córneos rachados comparáveis às córneas doadoras humanas. Como este modelo de pesquisa organo-tipicamente cultivado padronizado pela primeira vez permite um cultivo estável por pelo menos duas semanas, é uma alternativa valiosa para as córneas de doadores humanos para futuras investigações de vários fatores externos em relação à sua efeitos sobre o endotélio corneano.
Introdução
Os procedimentos de transplante de córnea estão entre os transplantações mais comumente realizados no mundo1. Como há uma escassez severa de córneas doadoras humanas, a pesquisa experimental que aborda as células endoteliais corneanas em córneas humanas é difícil de realizar1. No entanto, a introdução de soluções de irrigação e outras substâncias utilizadas no olho, dispositivos viscoelásticos oftalmológicos, bem como instrumentos e técnicas cirúrgicas (por exemplo, instrumentos e técnicas de facoemulsificação, energia de ultra-som) requer investigações válidas e extensivas a respeito de seus efeitos no endotélio córneo antes do uso clínico.
Poucas alternativas às córneas doadoras humanas existem para a pesquisa. Modelos de pesquisa animal são muito valiosos, mas ao mesmo tempo muito consumo de recursos e cada vez mais questionado eticamente. Uma grande desvantagem das culturas de células in vitro é a sua tradução limitada para o olho humano. Os resultados obtidos a partir de culturas celulares podem ser incongruentes em condições in vivo, pois as células podem sofrer transição mesenquimal endotelial (EMT), resultando em morfologia fibroblástica causada pela perda da polaridade celular e alterações na forma celular e no gene expressão2.
Considerando que os modelos ex vivo anteriores relataram períodos de cultivo de até apenas 120 h, uma nova técnica de preparo para estabelecer um modelo de cultura de órgãos endoteliais da córnea porcina, cultivando córneas de suínos frescos por pelo menos 15 dias foi recentemente introduzida3 ,4,5,6. Se o epitélio corneano e as partes do estroma forem removidos (aproximadamente 300 μm no total) da córnea antes do cultivo, o inchaço do estroma é reduzido em botões córneos divididos, resultando em menor perda de células endoteliais e um bem mantido endotelial camada da pilha após até 15 dias, visto que os botões córneos não-rachados mostram a perda endothelial significativa da pilha devido ao inchamento stromal desigual e à formação de Descemet ' dobras de s. Os bancos do olho usam geralmente agentes de deswelling osmótica tais como o dextrano para reduzir o inchamento das córneas antes da transplantação. Entretanto, esses agentes demonstraram induzir aumento da perdadecélulas endoteliais7,8,9.
Este artigo tem como objetivo Visualizar este modelo de pesquisa ex vivo padronizado em um protocolo detalhado passo a passo, a fim de permitir que futuros investigadores realizem pesquisas sobre o endotélio corneano usando botões córneos divididos. Este modelo representa um método direto para testar substâncias e técnicas utilizadas dentro do olho, tais como dispositivos viscoelásticos oftalmológicos, soluções de irrigação, e energia de ultra-som, ou outros procedimentos onde o endotélio corneano é de interesse.
Protocolo
Este protocolo segue as diretrizes éticas de nossa instituição. De acordo com os estatutos do Comitê de revisão ética da nossa instituição, nenhuma aprovação ética teve que ser obtida antes dos experimentos, pois todas as córneas suíno foram obtidas do matadouro local.
1. cultura de órgãos
- Prepare os olhos de porco.
- Do matadouro local, obtenha os olhos do porco que foram removidos logo pós-morte mas antes do tratamento térmico. Transportar os olhos para o laboratório e processá-los dentro de algumas horas. Durante o transporte, mantenha os olhos à temperatura ambiente (aproximadamente 21 ° c) antes do processamento.
- Remova todos os anexos orbitais (músculos oculares, conjuntiva, tecido adiposo) antes da desinfecção usando tesouras oculares e fórceps colibri. Separe e descarte todos os olhos com trauma óbvio, danos externos (por exemplo, corte de faca) ou opacidades corneanas visíveis.
- Prepare uma solução de 5% de iodo-PBS (1:20) em um copo estéril adicionando 3 mL de iodo de povidona de 7,5% a 57 mL de solução salina tamponada com fosfato (PBS). Prepare também um copo estéril separado contendo 60 mL de PBS puro.
Nota: a quantidade total de iodo-PBS-solução usada e o tamanho do copo dependem do número de córneas a ser dissecadas. Cinco a seis olhos exigem aproximadamente 60 mL da solução de 5%-iodo-PBS-ser desinfectados corretamente. - Coloque cinco a seis olhos na solução de 5%-iodo-PBS para um total de 5 min para desinfectar adequadamente a superfície dos olhos. Mexa cuidadosamente a cada minuto para garantir que a superfície dos olhos esteja totalmente submersa e desinfectada completamente na solução de iodo.
- Após 5 min, transfira os olhos desinfectados para o copo preparado preenchido com PBS puro. Novamente, mexa cuidadosamente para garantir que a solução de iodo-PBS é lavada longe da superfície dos olhos.
Nota: Realize esta etapa em um banco limpo para evitar a contaminação dos olhos desinfectados.
- Prepare placas de cultura celular.
Nota: execute as seguintes etapas em um banco limpo com fluxo de ar laminar constante.- Thaw 2 mL do soro fetal da vitela (FCS). Encha uma seringa (5 mL) com o FCS usando uma cânula sem corte. Esvazie a seringa através de um filtro de seringa (0,22 μm) para evitar possíveis contaminaçõesbacterianas do FCS em 80 mL de meio de cultura livre de Dextran I (meio essencial mínimo [MEM] com sais de Earle, penicilina/estreptomicina, L-glutamina [200 mM], Anfotericina B [250 μg/mL], tampão de HEPES [1 M] [50x], NaHCO3e água destilada). Agitar a mistura para garantir a distribuição de substrato mesmo.
- Encha cada poço de uma placa da cultura da pilha de 12 poços com 3 mL da mistura do substrato.
- Realize dissecção e incubação.
Nota: execute esta etapa em um banco limpo. Não toque no endotélio corneano com nenhum instrumento.- Transfira um bulbo do olho do copo com o PBS no suporte da ampola do olho com a córnea que enfrenta acima e coloc o abaixo de um microscópio cirúrgico oftálmica. Use uma seringa enchida com o NaCl 0,9% para aplicar ligeiramente alguma sucção ao olho sobre o suporte da ampola do olho para fixar o olho na posição para a dissecção.
- Use uma trefina (ø 7,5 mm) contendo um embutimento padronizado, que assegura que a profundidade trefinado não exceda 300 μm, para cortar superficialmente na córnea central (Figura 1a).
- Use fórceps colibri e um bisturi de uso único com uma lâmina triangular para cortar e remover a parte parcialmente trefinado da córnea horizontalmente através do estroma. Elimine a parte córnea separada consistindo no epitélio córneo, na camada do Bowman, e em uma parte do estroma.
Nota: manter rigorosamente o sentido de corte horizontal para obter uma espessura ainda maior do estroma remanescente. - Coloc superficially uma sutura 10-0 (10-0 poliamida 6) no estroma para poder diferenciar o endothelial do lado stromal durante os experimentos (Figura 1B). Impeça a penetração do endothelium córneo. Descarte o bulbo ocular se o endotélio for penetrado.
Nota: a penetração do endotélio corneano com a agulha de sutura será visível, pois o fluido da câmara ocular anterior irá vazar através do canal de sutura. - Use o trephine sem o embutimento para avançar o corte trefinado à profundidade cheia até que a câmara de olho anterior esteja alcangado (Figura 1C). Uma gota distinta na resistência e no líquido que escapa da câmara anterior do olho pode ser percebida após a penetração completa da córnea.
Nota: Use uma faca do hóquei se o botão córneo rachado permanecer Unido em um lado da tecla córnea rachada após o trephination. - Transferir o botão córneo de divisão obtido, agora constituído por uma parte do estroma (Figura 2), a membrana de Descemet, e o endotélio corneano, para o meio de cultura (meio de cultura I + FCS, ver secção 1,2) na placa de cultura de 12 células bem com o Tagged lado virado para baixo, de modo que o endotélio corneano está virado para cima.
Nota: se o lado endotelial estiver virado para baixo, o endotélio pode ficar danificado. - Atribua um número individual a cada botão córneo dividido para a identificação durante os follow ups e Rotule os poços na placa da cultura da pilha conformemente.
- Incubar as placas de cultura de células preenchidas em uma incubadora condições padrão a uma temperatura de 37 ° c, 5% CO2 e uma umidade relativa do ar de 95%. Mude o meio de cultura (meio de cultura I + FCS) no dia 8 se um período de incubação de 7 dias for excedido.
Nota: o procedimento de incubação utilizando botões corneanos divididos foi validado por até 15 dias.

Figura 1: dissecção da córnea porcina para obtenção de botões córneos divididos. (A) após trefinação da córnea usando um trephine com um embutimento para cortar em uma profundidade de 300 μm e a remoção do epitélio e das partes do tecido stromal, (B) uma sutura é coloc superficialmente no estroma sem penetração do córneo endotélio para posterior identificação do lado estromal. (C) a trephinação completa da córnea restante é seguida por (D) a remoção da tecla córnea rachada obtida do bulbo do olho. Por favor clique aqui para ver uma versão maior desta figura.
2. microscopia e exame do endotélio
- Realize um exame não manchado.
Nota: o exame não manchado pode ser realizado várias vezes (por exemplo, em follow ups semanais no dia 1, 8 e 15). No entanto, a contagem não manchada permite apenas a avaliação da densidade celular endotelial, não parâmetros morfológicos.- Encha 3 ml da solução de sal equilibrada hipotônica (HBSS, veja a composição na tabela de materiais) em cada poço de uma placa da cultura da pilha de 12 poços. Coloc com cuidado uma única tecla córnea da separação em hBSS para induzir o inchamento das pilhas endothelial córneas e para melhorar a visibilidade das pilhas para a contagem da pilha.
Nota: Certifique-se de que o lado endotelial está voltado para a direção do microscópio. Se for utilizado um microscópio de contraste de fase invertida, o lado endotelial deve ser voltado para baixo. Quando no lugar, a placa da cultura não deve ser movida para impedir dano endothelial da pilha. - Deixe as pilhas incham para 1-2 minutos antes de tomar um retrato do endotélio com a câmera unida ao microscópio. Tome pelo menos três fotografias de pelo menos três áreas diferentes a fim obter uma impressão representativa da condição real do endothelium córneo. Adicione uma barra de escala com o comprimento de escala de 100 μm para posterior análise da densidade da célula endotelial corneana e parâmetros morfológicos.
- Para evitar danos osmóticos, retire o botão de córnea da divisão dos hBSS após um máximo de 5 min e transfira-o de volta para o meio de cultura3.
- Encha 3 ml da solução de sal equilibrada hipotônica (HBSS, veja a composição na tabela de materiais) em cada poço de uma placa da cultura da pilha de 12 poços. Coloc com cuidado uma única tecla córnea da separação em hBSS para induzir o inchamento das pilhas endothelial córneas e para melhorar a visibilidade das pilhas para a contagem da pilha.
- Executar o exame manchado.
Nota: a coloração encerra os experimentos, pois as substâncias de coloração utilizadas são citotóxicas. Portanto, a coloração só pode ser realizada no final do período de observação para a avaliação dos parâmetros morfológicos (figuras de reformação, formações de Roseta, células de coloração vermelha alizarina).- Prepare uma solução de 0,25% de Tripan azul e 0,2% de solução de vermelho S de alizarina para o procedimento de coloração.
- Para a solução de 0,25% de Tripan Blue, diluir a solução de azul de Tripan de 0,4% com uma solução de NaCl de 0,9%.
Nota: por exemplo, para obter 20 ml de uma solução de 0,25% de Tripan Blue, diluir 12,5 ml da solução de azul de Tripan de 0,4% com 7,5 ml da solução de NaCl de 0,9%. A solução azul de Tripan pode ser armazenada à temperatura ambiente durante várias semanas ou meses. - Para obter uma solução de 0,2% de S vermelho de alizarina dissolva 100 MGS do pó vermelho de alizarina s em 50 mL de uma solução de NaCl de 0,9% agitação constante e aquecimento a 50 ° c em uma placa de agitação do ímã com função de aquecimento. Para remover possíveis precipitados, filtre a solução obtida. Ajuste o pH da solução de S vermelho de alizarina ao pH 4,2 adicionando o hidróxido de sódio ou o ácido clorídrico conformemente.
Nota: antes de cada aplicação da solução de S vermelho alizarina certifique-se de que o pH é corrigido para 4,2 e que não há precipitados na solução. A solução pode ser armazenada à temperatura ambiente. Não guarde a solução durante mais de 4 semanas.
- Para a solução de 0,25% de Tripan Blue, diluir a solução de azul de Tripan de 0,4% com uma solução de NaCl de 0,9%.
- Coloc os botões córneos rachados em placas de Petri com o lado endothelial que enfrenta para cima a fim manchar as pilhas endothelial. Use uma pipeta para gotejamento lentamente a gota da solução azul do Tripan de 0,25% pela gota no endotélio córneo para 90 s.
Nota: o azul de trypan permite a identificação de pilhas córneas danificadas com uma membrana permeável porque mancha seus núcleos. - Enxaguar com cuidado o botão córneo rachado 3x em 0,9% NaCl em uma taça de vidro pequena. Outra vez, use uma pipeta para gotejamento lentamente a gota da solução do vermelho de 0,2% alizarina pela gota no endotélio córneo para 90 S.
Nota: o vermelho de alizarin mancha a membrana de Descemet, que ajuda a realçar beiras da pilha em pilhas endothelial córneas não danificadas e realçar pilhas destruídas quando a membrana subjacente de Descemet se torna visível. Também, permite a identificação fácil de áreas destruídas maiores. - Para a examinação do endotélio córneo manchado siga as etapas explicadas para a contagem não manchada na seção 2,1.
- Prepare uma solução de 0,25% de Tripan azul e 0,2% de solução de vermelho S de alizarina para o procedimento de coloração.
3. análise da densidade da célula endotelial corneana e parâmetros morfológicos
- Projeto contando praças sobre as imagens usando um software de edição de gráficos (tabela de materiais).
- Abra o software e abra uma imagem do endotélio corneano selecionando File | Aberto | Selecioneo.
- Projetar um quadrado com um comprimento de lado de escala de 100 μm na imagem.
Nota: as seguintes etapas da seção 3.1.2 podem ser ignoradas se o software de visualização permite a projeção de quadrados de contagem para a imagem. O comprimento lateral do quadrado depende da resolução das imagens tiradas com a câmera do microscópio e pode ser calculada com a barra de escala.- Recorte a barra de escala da fotografia tirada com o microscópio: selecione a ferramenta Letreiro Retangular na barra de ferramentas ou pressione Me, em seguida, limite a barra de escala e selecione Editar | Recortar ou pressione Ctrl + X.
- Clique em arquivo | Novo (ou pressione Ctrl + N). Na próxima janela, selecione a área de transferência na lista suspensa tipo de documento . O número de pixels mostrados é o comprimento lateral do quadrado de contagem. Observe os pixels correspondentes para as outras imagens e clique em OK.
- Selecione arquivo | Novo (ou Ctrl + N). Insira a largura e o comprimento (em pixels) do quadrado de contagem na próxima janela de acordo com o comprimento da barra de escala. Seleccione cor de fundo brancoe, em seguida, prima OK.
- Clique em selecionar | Selecione tudo (ou Ctrl + A). Selecione Editar | Copiar (ou Ctrl + C).
- Selecione a imagem do endotélio corneano aberto na etapa 3.1.1. Selecione Editar | Cole (ou Ctrl + V) para inserir o quadrado na foto do endotélio corneano.
- Selecione a camada do quadrado e ajuste a transparência. Selecionar camada | Estilo de camada | Opções de mesclagem | Definir opacidade para 30% | Está bem.
- Salve a imagem com o quadrado projetado com um comprimento lateral de escala de 100 μm. Repita com as outras imagens necessárias para análise.
- Avaliar a densidade celular endotelial e os parâmetros morfológicos.
- Abra as imagens com os quadrados projetados no ImageJ (versão 1.50 i) e use o plug-in CellCounter para contar as células dentro do quadrado. Abra o ImageJ, selecione arquivo | Abrir (ou Ctrl + o) | Selecione imagem.
Nota: ImageJ e o PlugIn CellCounter são freeware disponível para download online. - Selecione plugins | Cell_Counter | Contador de células | Inicializaro. Conte as células endoteliais e registre o resultado. Em dois lados do quadrado, conte as células que são cortadas pela borda do quadrado. Não conte células cortadas nos outros dois lados.
- Analisar pelo menos seis quadrados por córnea de diferentes áreas (por exemplo, três figuras, dois quadrados por imagem) e determinar a média da densidade de células endoteliais corneanas por quadrado (100 μm2). Extrapolar a densidade de células endoteliais por 100 μm2 a 1 mm2 multiplicando por 100.
- Abra as imagens com os quadrados projetados no ImageJ (versão 1.50 i) e use o plug-in CellCounter para contar as células dentro do quadrado. Abra o ImageJ, selecione arquivo | Abrir (ou Ctrl + o) | Selecione imagem.
- Para a avaliação de alterações morfológicas, figuras de reformação de contagem (reunião conjunta de ≥ 4 células/bordas celulares em vez de três), formações de roseta (aspecto característico em forma de Roseta, cinco ou mais células radialmente dispostas em torno de uma célula destruída ), ou áreas vermelhas de alizarina (células destruídas) nos quadrados projetados.
Nota: Alternativamente, pode ser útil usar quadrados maiores (por exemplo, 200 x 200 μm2) para a análise morfológica em amostras bem preservadas para obter resultados mais representativos.
Resultados
A técnica de dissecção apresentada implica a remoção parcial do tecido estromal, resultando em uma amostra de córnea mais fina e, portanto, menos inchaço estromal (Figura 1 e Figura 2). Menos inchaço estromal induz menos cisalhamento e apertar forças que têm um impacto negativo sobre o endotélio corneano, causando menor taxa de perda de células endoteliais6. As teclas córneas rachadas mostram uma camada endothelial significativamente melhor-preservada da pilha após 15 dias do cultivo comparados aos botões córneos não-rachados e às amostras corneoscleral inteiras, que reflete menos perda endothelial da pilha e um número mais baixo de reforma figuras (≥ 4 células/bordas celulares conjoined em vez de três), formações de roseta (cinco ou mais células dispostas radialmente em um único local) e células vermelhas (destruídas) de alizarina após 15 dias6.
Durante um período de 15 dias, as teclas córneas rachadas mostram um declínio constante na densidade de pilha endothelial com uma perda endothelial média semanal da pilha do amarela de 4,90% (n = 40, Figura 3). Iniciando no dia 1 com uma densidade celular endotelial de 4.033 ± 146/163 células/mm2 (mediana ± 25%/75% quartis), a densidade celular diminuiu para 3.850 ± 167/233 células/mm2 no dia 8 e 3.650 ± 200/233 células/mm2 no dia 15. As perdas de células determinadas foram semelhantes para a primeira e segunda semana. Nos dias 1 − 8, 4, 0 ± 2,17/1,93% (mediana ± 25%/75% quartis); dias 8 − 15, 4,88 ± 5.52/5, 8%; dias 1 − 15, 8,64 ± 4.32/2,71%). Assim, a taxa de declínio dada é similar à taxa relatada em córneas doadoras humanas durante o cultivo em estudos prévios10,11,12.
Os parâmetros morfológicos foram avaliados após coloração da camada de células endoteliais no dia 15 (n = 28, Figura 4). Os valores de reformação foram 7,18 ± 2,36/2,90% (mediana ± 25%/75% quartiles) das bordas das células fundindo. Uma mediana de 1,11 ± 1,11/15.56 formações de Roseta/mm2 (mediana ± 25%/75% quartiles) estiveram presentes nas amostras investigadas, enquanto 13,33 ± 4.44/11.67 alizarina de células vermelhas/mm2 (mediana ± 25%/75% quartiles) marcou perdas de células pontuais.
A Figura 5 apresenta imagens representativas do endotélio corneano durante a avaliação microscópica em HBSS (Figura 5A) e após coloração com azul de Tripan e vermelho de alizarina (Figura 5B). A avaliação da densidade de células endoteliais em hBSS pode ser realizada várias vezes (por exemplo, nos dias 1, 8 e 15), enquanto que as amostras manchadas podem ser utilizadas para a avaliação dos parâmetros morfológicos (figuras de reformação, formações de Roseta, vermelho alizarina manchado células) ou determinação da densidade de células endoteliais no final dos experimentos devido às propriedades citotóxicas da maioria das substâncias manchadas.
Se os botões corneanos divididos forem colocados e cultivados com o lado endotelial voltado para baixo por acidente, é esperado um extenso dano de células endoteliais (Figura 6a). Os botões corneanos não-divididos sofrem aumento significativo da perda de células endoteliais devido ao inchaço estromal, causando a dobradura da membrana de Descemet ao longo de 15 dias de cultivo (Figura 6B), enquanto os botões corneanos divididos apresentam uma grande preservação endotélio corneano após 15 dias de cultivo, indicado por áreas de coloração vermelha de alizarina dispersas, indicando células destruídas únicas (Figura 6C).
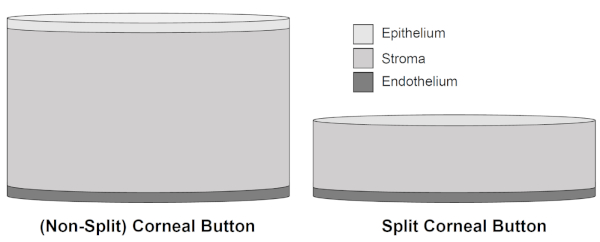
Figura 2: ilustração esquemática de botões córneos não-rachados e de teclas córneas rachadas. Após a remoção de 300 μm da córnea porcina, incluindo o epitélio e as partes principais do tecido stromal, a espessura de teclas córneas rachadas é reduzida em favor da melhor conservação do endotélio córneo devido ao inchamento stromal diminuído durante todo cultivo de até 15 dias. Por favor clique aqui para ver uma versão maior desta figura.
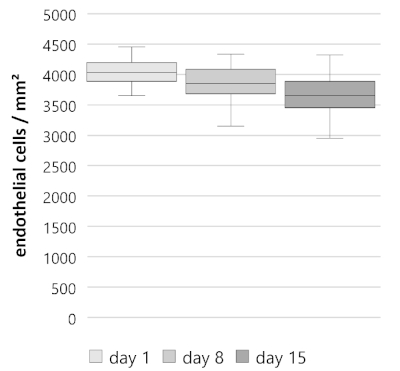
Figura 3: densidade de células endoteliais (ECD) de botões córneos divididos ao longo de 15 dias. As teclas córneas rachadas (n = 40) mostraram um declínio constante. ECD no dia 1, 4.033 ± 146/163 células/mm2 (mediana ± 25%/75% quartis); dia 8, 3.850 ± 167/233 células/mm2; dia 15, 3.650 ± 200/233 células/mm2. Os dados são representados como mediana ± 25%/75% quartiles, bigodes representam mínimo e máximo ou 1,5 da faixa interquartil (IQR). Por favor clique aqui para ver uma versão maior desta figura.
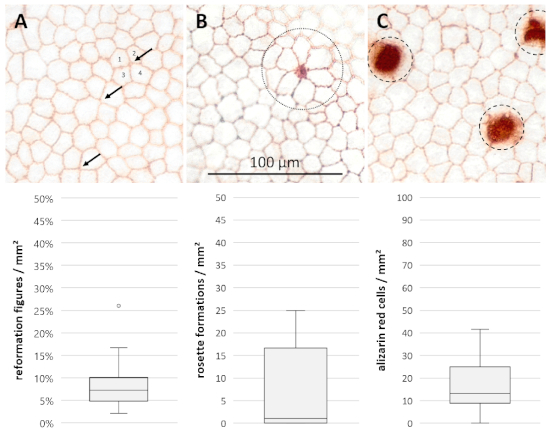
Figura 4: parâmetros morfológicos para avaliação adicional de danos celulares e processos de rearranjo. Fotografias microscópicas do endotélio corneano na ampliação de 400x após 15 dias de cultivo e coloração com azul de Tripan e vermelho de alizarina mostrando (A) figuras de reformação (setas, reunião conjunta de quatro ou mais células/bordas celulares em vez de três), (B) formações da roseta (círculo pontilhado, pilha de diminuição central com formações características do Rosette de cinco ou mais pilhas adjacentes) e (C) pilhas manchadas vermelhas de alizarina (círculos tracejados, pilhas destruídas). Os dados (n = 28) são representados como mediana ± 25%/75% quartis. Os Whiskers representam o mínimo e o máximo ou 1,5 da escala intervalo interquartil (IQR). Círculos representam outliers não dentro do IQR. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: endotélio corneano não manchado e manchado. A camada de células endoteliais como observado durante a avaliação microscópica (ampliação de 400x) em (A) solução de sal balanceada hipotônica (HBSS) causando inchaço das células endoteliais e, portanto, melhor visibilidade celular e (B) após coloração com azul de Tripan e alizarina vermelho S. por favor clique aqui para ver uma versão maior desta figura.
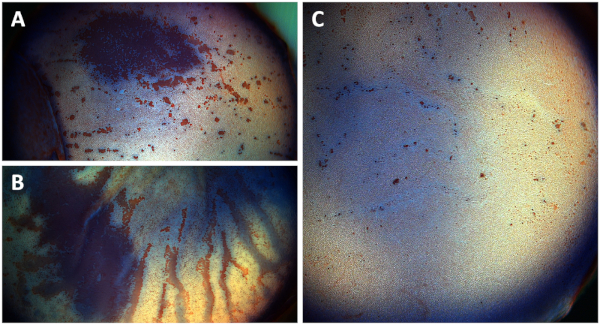
Figura 6: fotografias da vista geral do endotélio córneo de (a) uma tecla córnea rachada cultivada de cabeça para baixo, (B) uma tecla córnea non-Split, e (C) um botão córneo rachado após A mancha. As fotografias mostram o endotélio córneo após a coloração com azul do Tripan e o vermelhodealizarina S. (A) o dano endothelial córneo extensivo da pilha (área vermelha) é observado depois que as teclas córneas rachadas são cultivadas com o lado endothelial que enfrenta para baixo após um semana de cultivo. (B) aumento significativo dos danos das células endoteliais nos botões corneanos não divididos devido à dobradura da membrana de Descemet e ao inchaço estromal após 15 dias de cultivo (estrias vermelhas). (C) as teclas córneas rachadas mostram uma camada endothelial bem preservada da pilha após 15 dias do cultivo que mostram somente as pilhas destruídas pontual vistas em áreas manchadas vermelhas do alizarina. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo fornece um método para a preparação de botões córneos rachados suínos, que represente um modelo endotélio da cultura do órgão endothelial ex vivo estandardizado e de baixo custo para finalidades da pesquisa6. Os botões córneos rachados porcine mostraram uma diminuição da densidade endothelial da pilha comparável às perdas endothelial da pilha observadas nas córneas doadoras humanas cultivadas em bancos do olho durante um período de duas semanas6,10,11, doze anos.
A superioridade sobre as teclas córneas não-rachadas assim como amostras corneoscleral suínos inteiras foi mostrada previamente6. Nesse estudo, três grupos foram comparados nos dias 1, 8 e 15. O endotélio córneo de todos os grupos (botões corneoscleral, botões córneos não-rachados, teclas córneas rachadas) estava nas boas condições no dia 1, representado por uma camada endothelial bem preservada da pilha6. Entretanto, devido ao inchamento stromal, dobrar-se da membrana de Descemet destruiu áreas grandes do endotélio de amostras corneoscleral inteiras, de modo que uma avaliação representativa da densidade endothelial córnea da pilha em dias 8 e 15 não pudesse ser executada. Embora o endotélio dos botões córneos não-rachados fosse preservado bem até o dia 15, algumas dobras da membrana de Descemet estavam igualmente atuais. Embora comparado às amostras corneoscleral a camada endothelial da pilha de teclas córneas não-rachadas estava na melhor circunstância, a camada endothelial da pilha das teclas córneas rachadas estava na condição muito melhor. Isso pode ser observado em parâmetros quantitativos e qualitativos, pois a perda de células endoteliais no prazo de 15 dias de cultivo foi significativamente maior (p = 0, 41) em botões corneanos não divididos (-575 ± 25/250 células/mm2) em comparação com os botões córneos divididos (-417 ± 138/179 células/mm2), que é congruente com as características morfológicas determinadas evidentes em um padrão de células hexágono mais regular, menos figuras de reformação e formações de Roseta, bem como menos células destruídas (áreas vermelhas de alizarina) em divisão botões corneanos6. As perdas de células endoteliais de amarela confirmam esses achados, pois a perda de células amarela no prazo de 15 dias em botões corneanos não divididos e divididos é de 14,89% e 10,2% (p = 0, 32), respectivamente6. Como este método foi validado por um período de até 15 dias, permite períodos de observação mais longos do que estudos publicados até agora (72 a 120 h)3,4,5.
As melhorias na preservação da camada de células endoteliais, aplicando protocolos comuns de cultivo também utilizados em bancos oculares, podem ser atribuídas unicamente ao inchaço reduzido do estroma corneano, uma vez que uma porção maior (300 μm) do estroma é removida antes da cultivo6,13. Normalmente o estroma tende a inchar enormemente durante o cultivo devido a suas propriedades e moléculas hidrófilas encaixadas dentro do tecido stromal14,15. O inchaço, que induz forças de cisalhamento e pitada e a dobradura da membrana de Descemet, que também provoca tensão mecânica sobre o endotélio corneano e a perda de células endoteliais, são reduzidos após a remoção parcial do estroma6,10. Ao contrário dos bancos do olho, que usam frequentemente agentes osmóticos tais como o dextrano às córneas doadoras humanas de deswell Industries antes da transplantação, os botões córneos rachados não exigem o deswelling osmótica16,17. Como meio de cultura suplementado com dextrano é conhecido por ser absorvido pelas células endoteliais da córnea e induzir aumento da perda de células7,8,9,18,19 ,20, o cultivo de botões córneos rachados sem dextrano (ou outros agentes osmóticos) elimina tantos como fatores tóxicos negativos como possível6. Como o meio de cultura não é suplementado com quaisquer aditivos no método apresentado, não são esperadas influências tóxicas causadas por qualquer substância adicionada, o que torna este modelo valioso para investigações de testes de biocompatibilidade de novas substâncias.
Embora o endotélio corneano seja uma camada celular muito delicada e a preparação de botões córneos divididos exija habilidades cirúrgicas moderadas e manuseio delicado, essa técnica pode ser um método padronizado para trabalhar e obter resultados confiáveis em relação ao efeitos de vários fatores no endotélio córneo dentro de um frame de tempo muito razoável. No entanto, existem alguns passos neste protocolo em que o endotélio corneano está em risco. Obviamente os olhos danificados ou opacos precisam ser cuidadosamente identificados e descartados no início para evitar possíveis vieses. Também, o endotélio córneo deve sempre ser deixado intocado durante a trephination, a dissecção, a extração, e a manipulação (por exemplo, transferindo da placa do olho para a cultura, da placa da cultura à placa da cultura, etc.) de teclas córneas rachadas a fim impedir qualquer danos mecânicos. Ao coloc a sutura superficialmente no estroma, o endotélio pode potencial ser penetrado se a agulha é introduzida acidentalmente demasiado distante na profundidade. Em caso afirmativo, o líquido perceptível da câmara anterior do olho estará passando através do canal da sutura e o olho correspondente precisa de ser Descartado. Para evitar isso, a agulha deve ser mantida superficialmente dentro do estroma. Além disso, o cuidado deve ser tomado para dividir estritamente o botão corneano horizontalmente usando o bisturi. O corte desigual conduzirá ao inchamento desigual durante o cultivo, possivelmente causando a perda endothelial aumentada da pilha.
A examinação de pilhas endothelial córneas não manchadas em hBSS é executada geralmente em córneas doadoras humanas. Não há nenhuma evidência de dano de pilha significativo causado pelo inchamento osmótica das pilhas endothelial para o tempo de examinação escolhido de teclas córneas rachadas em HBSS3. Embora a coloração melhore a visibilidade das bordas celulares, a contagem não manchada não resulta em resultados significativamente diferentes da densidade da célula endotelial em comparação com a contagem de coradas21. O benefício claro da contagem não manchada é que permite exames múltiplos da continuação durante todo o curso dos experimentos, visto que as substâncias de coloração são geralmente citotóxica e terminam o período de observação. A contagem manchada, entretanto, permanece importante para avaliar as características morfológicas do endothelium. O azul de trypan destaca os núcleos de pilhas danificadas que parecem frequentemente não danificadas na contagem não manchada. O vermelho S de alizarin realça claramente a visibilidade das beiras da pilha e das pilhas danificadas manchando a membrana de Descemet, que facilita a avaliação da densidade de pilha endothelial e permite a análise de características morfológicas do endotélio córneo , como figuras de reformação, formações de Roseta e células de coloração vermelha de alizarina (Figura 4).
Uma limitação principal de teclas córneas rachadas como um modelo ex vivo é que, apenas como modelos in vitro, são somente apropriadas para investigar influências externas em pilhas endothelial córneas. Portanto, os modelos in vivo são insubstituíveis para pesquisas sobre doenças sistêmicas e condições com impacto no olho e no endotélio corneano. Independentemente disso, essa técnica de preparo pode gerar dados válidos para testar os efeitos de vários fatores externos no endotélio corneano (por exemplo, no teste de biocompatibilidade de novas substâncias)22. Seguindo o princípio de 3R (substituição, redução, refinamento) para reduzir o número de experimentos de animais vivos, este método fornece um modelo de pesquisa adequado para fechar ainda mais a lacuna entre as culturas celulares in vitro, onde os resultados são muitas vezes incongruosos para o em vivo em seres humanos, e pesquisa animal, que exige esforços substanciais e levanta cada vez mais preocupações éticas23.
Devido a suas propriedades e disponibilidade, os olhos do porco parecem ser o único substituto adequado para os olhos humanos para finalidades da pesquisa. Córneas de primatas não humanos não são uma boa alternativa devido a razões éticas e disponibilidade, embora estes animais são a espécie mais próxima para os seres humanos. Por outro lado, os olhos dos animais menores são simplesmente demasiado pequenos para permitir a remoção eficiente da córnea. Os olhos do porco são comparáveis aos olhos humanos no tamanho e mostram propriedades similares das pilhas endothelial córneas, que é refletida igualmente na pesquisa que trata o xenotransplante futuro possível de córneas suínos genetically modificadas24, 25,26. Além disso, sendo um subproduto dos matadouros, eles são fáceis de obter.
Em conclusão, o método apresentado usando córneas porcina oferece um modelo de pesquisa altamente reprodutível organo-tipicamente cultivado permitindo a pesquisa cost-efficient em pilhas endothelial córneas. Futuros investigadores podem usar botões córneos divididos para analisar os efeitos de vários fatores, tais como novas substâncias, técnicas cirúrgicas, equipamentos e outras possíveis influências externas onde o endotélio corneano é de grande interesse.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O estabelecimento do modelo de pesquisa apresentado foi apoiado pelo KMU-Innovativ (FKZ: 13GW0037F) do Ministério Federal da educação e pesquisa da Alemanha.
Materiais
| Name | Company | Catalog Number | Comments |
| Subject | |||
| Pig eyes | local abbatoir | ||
| Substances | |||
| Alizarin red S | Sigma-Aldrich, USA | ||
| Culture Medium 1, #F9016 | Biochrom GmbH, Germany | ||
| Dulbecco's PBS (1x) | Gibco, USA | ||
| Fetal calf serum | Biochrom GmbH, Germany | ||
| Hydrochloric acid (HCl) solution | own production | ||
| Hypotonic balanced salt solution | own production | per 1 L of H2O: NaCl 4.9 g; KCl 0.75 g; CaCl x H2O 0.49 g; MgCl2 x H2O 0.3 g; Sodium Acetate x 3 H2O 3.9 g; Sodium Citrate x 2 H2O 1.7 g | |
| Povidon iodine 7.5%, Braunol | B. Braun Melsungen AG, Germany | ||
| Sodium chloride (NaCl) 0.9% | B. Braun Melsungen AG, Germany | ||
| Sodium hydroxide (NaOH) solution | own production | ||
| Trypan blue 0.4% | Sigma-Aldrich, USA | ||
| Materials & Instruments | |||
| Accu-jet pro | Brand GmbH, Germany | ||
| Beaker Glass 50 mL | Schott AG, Germany | ||
| Blunt cannula incl. Filter (5 µm) 18G | Becton Dickinson, USA | ||
| Cell culture plate (12 well) | Corning Inc., USA | ||
| Colibri forceps | Geuder AG, Germany | ||
| Corneal scissors | Geuder AG, Germany | ||
| Eppendorf pipette | Eppendorf AG, Germany | ||
| Eye Bulb Holder | L. Klein, Germany | ||
| Eye scissors | Geuder AG, Germany | ||
| Folded Filter ø 185 mm | Whatman, USA | ||
| Hockey knife | Geuder AG, Germany | ||
| Laboratory Glass Bottle with cap 100 mL | Schott AG, Germany | ||
| Magnetic stir bar | Carl Roth GmbH & Co. KG, Germany | ||
| MillexGV Filter (5 µm) | Merck Millopore Ltd., USA | ||
| Needler holder | Geuder AG, Germany | ||
| Petri dishes | VWR International, USA | ||
| Pipette tips | Sarstedt AG & Co., Germany | ||
| Scalpel (single use), triangular blade | Aesculap AG & Co. KG, Germany | ||
| Serological pipette 10 mL | Sarstedt AG & Co., Germany | ||
| Serological pipette 5 mL | Sarstedt AG & Co., Germany | ||
| Sterile cups | Greiner Bio-One, Österreich | ||
| Sterile gloves | Paul Hartmann AG, Germany | ||
| Sterile surgical drape | Paul Hartmann AG, Germany | ||
| Stitch scissors | Geuder AG, Germany | ||
| Suture Ethilon 10-0 Polyamid 6 | Ethicon Inc., USA | ||
| Syringe (5 mL) | Becton Dickinson, USA | ||
| trephine ø 7.5 mm | own production | ||
| Tying forceps | Geuder AG, Germany | ||
| Weighing paper | neoLab Migge GmbH, Germany | ||
| Equipment & Software | |||
| Binocular surgical microscope | Carl Zeiss AG, Germany | ||
| Camera mounted on microscope | Olympus, Japan | ||
| CellSens Entry (software) | Olympus, Japan | ||
| Cold-light source | Schott AG, Germany | ||
| Incubator | Heraeus GmbH, Germany | ||
| Inverted phase contrast microscope | Olympus GmbH, Germany | ||
| Magnetic stirrer with heating function | IKA-Werke GmbH & Co. KG, Germany | ||
| pH-meter pHenomenal | VWR International, USA | ||
| Photoshop CS2 | Adobe Systems, USA | ||
| Precision scale | Ohaus Europe GmbH, Switzerland |
Referências
- Gain, P., et al. Global Survey of Corneal Transplantation and Eye Banking. JAMA Ophthalmology. 134 (2), 167-173 (2016).
- Roy, O., et al. Understanding the process of corneal endothelial morphological change in vitro. Investigative Ophthalmology & Visual Science. 56 (2), 1228-1237 (2015).
- Meltendorf, C., Ohrloff, C., Rieck, P., Schroeter, J. Endothelial cell density in porcine corneas after exposure to hypotonic solutions. Graefe's Archive for Clinical and Experimental Ophthalmology. 245 (1), 143-147 (2007).
- Schroeter, J., Meltendorf, C., Ohrloff, C., Rieck, P. Influence of temporary hypothermia on corneal endothelial cell density during organ culture preservation. Graefe's Archive for Clinical and Experimental Ophthalmology. 246 (3), 369-372 (2008).
- Schroeter, J., Ruggeri, A., Thieme, H. Impact of temporary hyperthermia on corneal endothelial cell survival during organ culture preservation. Graefe's Archive for Clinical and Experimental Ophthalmology. 253 (5), 753-758 (2015).
- Kunzmann, B. C., et al. Establishment Of A Porcine Corneal Endothelial Organ Culture Model For Research Purposes. Cell and Tissue Banking. 19 (3), 269-276 (2018).
- Redbrake, C., et al. A histochemical study of the distribution of dextran 500 in human corneas during organ culture. Current Eye Research. 16 (5), 405-411 (1997).
- Zhao, M., et al. Poloxamines for Deswelling of Organ-Cultured Corneas. Ophthalmic Research. 48 (2), 124-133 (2012).
- Filev, F., et al. Semi-quantitative assessments of dextran toxicity on corneal endothelium: conceptual design of a predictive algorithm. Cell and Tissue Banking. 18 (1), 91-98 (2017).
- Pels, E., Schuchard, Y. Organ-culture preservation of human corneas. Documenta Ophthalmologica. 56 (1-2), 147-153 (1983).
- Borderie, V. M., Kantelip, B. M., Delbosc, B. Y., Oppermann, M. T., Laroche, L. Morphology, Histology and Ultrastructure of Human C31 Organ-Cultured Corneas. Cornea. 14 (3), 300-310 (1995).
- Linke, S. J., et al. Thirty years of cornea cultivation: long-term experience in a single eye bank. Acta Opthalmologica. 91 (6), 571-578 (2013).
- Schroeter, J., et al. Arbeitsrichtlinien - Gute Fachliche Praxis für Hornhautbanken [Procedural guidelines. Good tissue practice for cornea banks]. Ophthalmologe. 106 (3), 265-276 (2009).
- Dohlman, C. H., Hedbys, B. O., Mishima, S. The swelling pressure of the corneal stroma. Investigative Ophthalmology & Visual Science. 1, 158-162 (1962).
- Xuan, M., et al. Proteins of the corneal stroma: importance in visual function. Cell and Tissue Research. 364 (1), 9-16 (2016).
- Sperling, S. Human Corneal Endothelium in Organ Culture - The Influence of Temperature and Medium of Incubation. Acta Opthalmologica. 57 (2), 269-276 (1979).
- Schroeter, J. Endothelial Evaluation in the Cornea Bank. Developments in Ophthalmology. 43, 47-62 (2009).
- Pels, E., Schuchard, Y. The Effects of High Molecular Weight dextran on the Presevation of Human Corneas. Cornea. 3 (3), 219-227 (1985).
- van der Want, H. J. L., Pels, E., Schuchard, Y., Olesen, B., Sperling, S. Electron Microscopy of Cultured Human Corneas Osmotic Hydration and the Use of dextran Fraction (dextran T 500) in Organ Culture. Archives of Ophthalmology. 101 (12), 1920-1926 (1983).
- Thuret, G., Manissolle, C., Campos-Guyotat, L., Guyotat, D., Gain, P. Animal compound-free medium and poloxamer for human corneal organ culture and Deswelling. Investigative Ophthalmology & Visual Science. 46 (3), 816-822 (2005).
- Wenzel, D. A., Kunzmann, B. C., Spitzer, M. S., Schultheiss, M. Staining of endothelial cells does not change the result of cell density. Cell and Tissue Banking. 20 (2), 327-328 (2019).
- Wenzel, D. A., Kunzmann, B. C., Hellwinkel, O., Druchkiv, V., Spitzer, M. S., Schultheiss, M. Effects of perfluorobutylpentane (F4H5) on corneal endothelial cells. Current Eye Research. , (2019).
- Olsson, I. A. S., Franco, N. H., Weary, D. M., Sandøe, P. The 3Rs principle - mind the ethical gap!. ALTEX Proceedings, 1/12, Proceedings of WC8. , 333-336 (2012).
- Sanchez, I., Martin, R., Ussa, F., Fernandez-Bueno, I. The parameters of the porcine eyeball. Graefe's Archive for Clinical and Experimental Ophthalmology. 249 (4), 475-482 (2011).
- Kim, M. K., Hara, H. Current status of corneal xenotransplantation. International Journal of Surgery. 23 (Pt B), 255-260 (2015).
- Fujita, M., et al. Comparison of Proliferative Capacity of Genetically-Engineered Pig and Human. Ophthalmic Research. 49 (3), 127-138 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados