Method Article
Обнаружение и характеристика белка самосборки в Vivo по потоку цитометрии
В этой статье
Резюме
В этой статье описывается протокол цитометрии на основе ФРЕт для количественной оценки самосборки белка в обоих клетках S. cerevisiae и HEK293T.
Аннотация
Белковая самосборка регулирует функцию белка и разобщает клеточные процессы в пространстве и времени. Современные методы его изучения страдают от низкой чувствительности, косвенного считывания, ограниченной пропускной связи и/или уровня населения, а не одноклеточного разрешения. Мы разработали единую методологию на основе цитометрии потока, которая устраняет все эти ограничения: Distributed Amphifluoric FRET или DAmFRET. DAmFRET обнаруживает и количественно определяет собственные сборки белка с помощью сенсибилизированных выбросов FRET in vivo, позволяет развертывать в модельных системах - от дрожжей до клеток человека, и достигает чувствительных, одноклеточных, высокопроизводительных считываний независимо от белка локализации или растворимости.
Введение
Анализы для изучения гомотипических белковых взаимодействий, или "самосборки", важны, потому что олигомерное состояние и растворимость белков диктуют свою функцию. Протеом изобилует гомо-мультимерами1,2,3,4,в то время как относительно мало белков функционируют как мономеры. Белки могут также собираться аберранцией из-за стресса, возраста или неправильного регулирования, что приводит к патологическим изменениям в активности. Выявление факторов, модулированных такими событиями, или даже физического характера собраний, часто является исключительно сложной задачей.
Все большее число белков в настоящее время признается самосборки с внеочередной cooperativity и неопределенной стоихиометрии, в результате чего их demixing от других клеточных компонентов, как белковые фазы. Они принимают форму неупорядоченных конденсатов, таких как капли и гели, или высоко упорядоченных нитей, таких как амилоидные волокна. Конформационные колебания, связанные с последним, делают его первоначальное образование, илинуклеацию, по своей сути вероятностной на молекулярном уровне 5,6. Поскольку вероятность нуклеации масштабируется с объемом, образование таких сборок может быть очень стохасальнымв пространственных пределах живых клеток 7,8. На крайности стохастического разделения фазы ядер-ограниченной прионы, высоки приказали агрегаты протеина которые только редк nucleate самопроизвольно, но как только сформировано, шаблон их собственный рост indefinitely. Один из таких белков, известный как ASC, выполняет цифровой прион-подобный переключатель в деятельности врожденных иммунных клеток млекопитающих. Самосборка ASC является ядреным благодаря своему взаимодействию с конкретными белками, которые сами олигомеризированы при связывающих патогенных или связанных с опасностью молекулярных моделях. ASC сборки в свою очередь, нуклеат procaspase-1 для самостоятельной сборки и активации, что приводит к созреванию цитокинов и пироптоз клетки9,10. Область ASC ответственная для своей агрегата принадлежит к superfamily домена смерти, которая consist of над 100 членами в людском proteome. Несмотря на ключевую роль доменов смерти в врожденном иммунитете и запрограммированной смерти клеток, большинство из них до сих пор не охарактеризованы в отношении самосборки. Обнаружению и характеристике дополнительных белков с таким поведением будет значительно способствовать прямое одноклеточное считывание белковой самосборки.
Классические подходы биохимии белка для изучения самосборки белка, такие как хроматография и ультрацентрифугация, в значительной степени ограничены оценками уровня популяции. Однако неоднородность от клетки к клетке, обусловленная переходами фазсы с ограниченной нуклеацией, не может быть смоделирована с помощью этого уровня детализации. Одноклеточные подходы, основанные на флуоресценционной микроскопии, восстанавливают эту способность, но не имеют пропускной способности, необходимой для точной количественной оценки нуклеации или обнаружения редких сборок. Кроме того, растворимые самосборки, такие как большинство ферментов и доамилоидных олигомеров, слишком малы и подвижны, чтобы их можно было решить стандартной световой микроскопией. Они могут быть обнаружены с помощью более сложных подходов, таких как спектроскопия флуоресценции корреляции, но они очень ограничены в количестве клеток и пропускной их.
Непонахтровые анализы белковой сборки, такие как ФРЕТ и сплит-флюорофорная добавка, предлагают потенциальное решение этих проблем. Тем не менее, они, как правило, требуют использования двух различных конструкций, выражающих белок интереса сливается с дополнительными теги-донор и принимающий фторофоров в случае FRET. Это ставит под угрозу экспериментальную пропускную силу, а также снижает чувствительность из-за изменения клеток к клетке в относительных уровнях донора и принимающего. Чтобы обойти это, мы разработали анализ, который использует фотоконвертируемый флюорофор, mEos3.111, который позволяет одной конструкции, чтобы выразить как донора, так и принимая помеченных белка. Спектр выбросов непреобразованного mEos3.1 (GFP-подобный донор) достаточно перекрывается с возбужданием спектра фотопреобразованных mEos3.1 (dsRed-like acceptor), чтобы позволить FRET произойти, когда молекулы находятся в непосредственной близости (Lt;10 нм). Таким образом, подвергая клетки эмпирически определенной дозе 405 нм света, которая фотоконвертирует оптимальную долю общего mEos3.1 в форму приемного, мы достигаем последовательных и воспроизводимых относительных уровней донора и приемного через несколько образцов, уровня хрувыражения и экспериментов. Мы измеряем принимая фторесценции, когда возбужденных либо непосредственно с 561 нм света, или косвенно (по передаче энергии от донора) с 488 нм света (т.е. сенсибилизированных выбросов FRET). Мы сообщаем о созыве белка как о соотношении этих двух значений и термине it amphifluoric FRET или AmFRET.
Для того, чтобы рассчитать концентрацию белка по цитометрии потока, мы сначала вычисляем среднее интенсивность флуоресценции Spc42 помечены mEos3.1. Поскольку дрожжевые клетки содержат около 1000 молекул Spc42, мы затем вычисляем интенсивность флуоресценции одной флуоресцентной зеленой молекулы mEos3.1. Используя ровную фотоконверсию во всех клеточных концентрациях(рисунок 1E),мы затем соотвествуем общие значения флуоресценции mEos3.1 для всех интенсивностей принятия после фотоконверсии. Затем мы можем разделить общее количество родинок флуоресцентных белков на приблизительный цитозоликовый объем (как определяется с помощью цитометрии потока изображений) для получения общей цитозоличной концентрации белка интереса. Для точных расчетов, пожалуйста, смотрите оригинал рукописи8.
Выражая mEos3.1-слитого белка из 2 "плазмида в дрожжах, мы зондпримернов примерно тысячу раз диапазон концентрации белка в каждом образце8. Мы достигаем того же в клетках HEK293T в силу изменения поглощения плазмида во время трансфекции, и, следовательно, переменного номера копии.
В результате распределение AmFRET, или DAmFRET, для многих тысяч клеток показывает концентрацию-зависимость самосборки в цитозол для любого белка, интересуемого. В целом, DAmFRET представляет собой стимулирующую методологию для обнаружения и характеристики самосборки белка с беспрецедентным сочетанием чувствительности, пропускной их возможности и воспроизводимости.
При использовании цитометра изображений позволяет нам получать измерения концентрации белка in vivo, такие цитометры пока не доступны в большинстве научно-исследовательских институтов. Тем не менее, DAmFRET может работать даже в типичном цитометре неизображения, чтобы получить распределение белковой сборки по диапазону экспрессии белка.
протокол
1. Подготовка Saccharomyces cerevisiae для DAmFRET асссе
- Преобразуйте экспериментально релевантные штаммы дрожжей с 2"галактозой индуцируемой плазмидой, которая выражает белок интереса8 помечены либо на C или N конечной с mEos3.1 с использованием стандартного протокола ацетата лития12 .
- Выращивайте дрожжи в жидкой культуре.
- Для каждого белка запроса, прививать дрожжевые колонии (преобразованные), в тройном, каждый в 200 л соответствующих не вызывающих роста носителей (т.е., средства, содержащие 2% декстрозы, дрожжевой азотной базы и аминокислот для выбора плазмиды) в 96-хорошо пластины ( Рисунок 1С).
- Инкубировать клетки во время тряски на тарелке шейкер (см. таблицу материалов) с 1,5 мм орбиты при 1200 об/мин при 30 градусах по Цельсию на 16 ч.
- Индуцировать экспрессию гена интереса (репрезентативный протокол для 16 h-некоторые протеины могут принять больше или меньше время).
- После 16 ч индукции, спина пластины на 2200 х г в течение 2 мин при комнатной температуре (RT0, чтобы гранулы образцы.
- Удалите носители с помощью насильственной инверсии. Повторное удаление клеток с 200 юл соответствующих индукционных носителей (т.е. носителей, содержащих 2% галактозу, дрожжевой азотной базы и аминокислот для выбора плазмиды). Смотрите рисунок 1C.
- Инкубировать клетки при встряхивании при 30 градусах по Цельсию в течение 12 ч.
- Центрифуга (см. таблицу материалов) пластины на 2200 х г в течение 2 мин на RT, чтобы гранулы образцы. Удалите носители с помощью насильственной инверсии. Повторное удаление клеток с 200 злитровых носителей индукции.
- Инкубировать клетки при встряхивании при 1200 об/мин при 30 градусах по Цельсию в течение еще 4 ч. Это повторное приостановление в свежих носителях должно произойти 4 ч до запуска DAmFRET, в целях снижения автофлюоресценции.
2. Создание плазмидной плазмиды млекопитающих
- Построить вектор млекопитающих, который имеет составной промоутер и mEos3.1 с заполнителем, чтобы вставить ген интереса и связующего между ними.
ПРИМЕЧАНИЕ: Мы построили золотой ворота совместимый вектор, M1, из общедоступных плазмид (см. Таблица материалов) со следующими изменениями: существующий сайт BsaI был удален точкой мутации G к А (на позиции 3719 в соответствии с хранением последовательность). mEos3.1 был получен с помощью направленного на сайт мутагенеза флюорофора на I157V. Перевернутые сайты BsaI, за которыми следует 4x(EAAAR) связующий были вставлены, по сборке Гибсона, в кадр между промоутером CMV и mEos3.1 для получения окончательного вектора M1. Выражение белка определяется усилителем и промотором CMV; и прекращение транскрипции по сигналу полиаденилаации SV40. - Создайте библиотеку вставок, совместимую с построенным вектором.
ПРИМЕЧАНИЕ: Мы заказываем наши вставки для сборки Золотые ворота в качестве синтетических линейных фрагментов (см. таблицу материалов) в окружении сайтов BsaI для перевязки в M1 между промоутером CMV и 4x (EAAAR)-mEos3.1.
3. Культура клеток млекопитающих и трансфекция
- Культура HEK293T клетки в DMEM 10% FBS 1x PenStrep средств массовой информации при 37 КК при 5% CO2.
- За день до трансфекции, семена 5 х 105 5 клеток в 6-колодец пластины с 2 мл носителей.
- Трансфектные клетки с 2 мг плазмидной ДНК с помощью трансфекционного реагента (см. ТаблицуМатериалов) в соотношении 3:1 (трансфекционный реагент: ДНК). Смешайте компоненты в 150 л пониженных носителей сыворотки (см. таблицуматериалов) и инкубировать его на RT в течение 15 минут, добавить смесь к каждому колодцу и инкубировать 48 л для экспрессии белка.
- Подтвердить экспрессию белка после 24 ч с помощью эпифлюоресценции микроскопией (488 нм возбуждение, 515 нм эмиссии).
4. Подготовка клеток млекопитающих для dAmFRET
- После 48 ч экспрессии белка, удалить средства массовой информации из каждого колодца и тщательно мыть клетки с 1 мл 37 Градусов по Цельсию фосфат буфера солине (PBS). После мытья, аспирируется PBS.
- Добавить 0,5 мл трипсина-этиленедиаминенететраацетической кислоты (ЭДТА) (0,25%) и инкубировать в течение 5 мин при 37 градусах Цельсия.
- Добавьте 0,5 мл полного носителя DMEM к каждой скважине, отреприметки ячеек и убедитесь, что не видны большие комки.
- Перенесите весь объем каждой скважины в трубы объемом 1,5 мл.
- Спиновые клетки в течение 5 мин при температуре 1000 х при комнатной температуре (RT).
- Удалите супернатант и отдохните клеточные гранулы в 1 мл PBS и 10 мМ EDTA.
- Спин клетки в течение 5 мин на 1000 х г на RT.
- Удалите супернатант и resuspend клеточной гранулы в 1 мл 4% параформальдегида (PFA) и 10 мМ EDTA в PBS.
- Зафиксировать клетки в течение 5 минут на стол встряхнуть с постоянным движением.
- Спиновые клетки в течение 5 мин при 1000 х г на RT.
- Удалите супернатант и resuspend клеточной гранулы в 1 мл PBS 10 мМ EDTA.
- Спиновые клетки в течение 5 мин при 1000 х г на RT.
- Удалите супернатант и resuspend клетки в достаточном объеме буфера для цитометрии перспективе (для 1 хорошо 96-колодец пластины использовать 200 Зл ТЛ PBS 10 мМ EDTA).
- Перенесите перекрываемые клетки к одному колодцу круглой нижней 96-колодцвой пластины.
5. Фотоконверсия дрожжей и клеток млекопитающих для асссея
- Образцы фотоконвертации в микроплите без крышки с помощью УФ-лампы (см. таблицуматериалов), оснащенных фильтром 320-500 нм (фиолетовый) и балком-коллиматором, расположенным на 45 см над пластиной, продолжительностью 25 мин во время встряхивания. Эти условия являются целесообразными, когда мощность луча на пластинесоставляет 11,25 мВт/см 2, с примерно 17000 мДж / см2 от общей дозы фотона8.
6. Сбор данных DamFRET
- Ассай клетки с помощью цитометра с не-коллинера 488/561 лазеров. Ниже приведены минимальные данные для расчета ФРЕТ.
- Используйте 488 нм возбуждение / 515 нм эмиссионный канал для сбора донорской флуоресценции.
- Используйте 488 нм возбуждение / 595 нм эмиссионный канал для сбора флуоресценции сигнала FRET.
- Используйте 561 нм возбуждение / 595 нм выбросов канала (не-коллинейр с 488/595 канал) для сбора приемного флуоресценции.
- Используйте 405 нм возбуждение / 457 нм эмиссионный канал для сбора автофлюоресценции8.
- Используйте канал яркого поля для расчета громкости.
ПРИМЕЧАНИЕ: Настройки цитометра для S. cerevisiae являются следующими:60x цель при низкой скорости потока и высокой чувствительности; лазерные мощности, установленные на уровне 405 нм при скорости 15 мВт, 488 нм при 15 мВт, 561 Нм при настройках цитометра 20 мВт. лазерные мощности установлены на 405 нм при 15 мВт, 488 Нм при 15 мВт, 561 нм при 20 мВт. Кроме того, обратите внимание, что, наш цитометр изображения был специально разработан, чтобы иметь пространственно отделены 488 нм и 561 Нм лазеров (т.е. на различных камерах), с тем чтобы получить четкое разрешение FRET от приемного человека fluorescen Ce.
- Собирайте данные по 20 000-50 000 одиночных ячеек на образец в пределах положительной флуоресценции.
- Ворота одиночных ячеек по высокому соотношению сторон и небольшой области клеток, в отличие от слипшихся клеток или мусора, которые будут иметь низкий соотношения сторон и большие или очень маленькие области клеток соответственно.
ПРИМЕЧАНИЕ: Эквивалентные параметры в цитометре без изображения являются FSC (передний разброс) для приблизительного размера ячейки и SSC (боковой рассеяние) для детализации клеток. Кроме того, используйте fSC частоту импульса по сравнению с шириной импульса в качестве прокси для одноклеточных gating. Кроме того, крайне важно не собирать события, которые имеют значения флуоресценции за пределами верхнего предела чувствительности цитометра. В нашем цитометре изображений мы ограничиваем сбор событий необработанным максимальным значением пикселя на один меньше предела насыщения для каждого флуоресцентного канала, который мы собираем. Аналогичным образом, для обычных цитометров потока не следует анализировать точки данных в ячейке высокой интенсивности (которая включает события, выходящие за рамки динамического диапазона обнаружения).
- Ворота одиночных ячеек по высокому соотношению сторон и небольшой области клеток, в отличие от слипшихся клеток или мусора, которые будут иметь низкий соотношения сторон и большие или очень маленькие области клеток соответственно.
7. Анализ данных
- Выполните компенсацию с использованием нефотоконвертированных mEos3.1 образца для чистого донорского сигнала и мономерного DsRed2, который имеет аналогичный спектр к красной форме mEos3.1, для чистого сигнала приемного13. Для большей чувствительности убедитесь, что канал детектора FRET также рассматривается в качестве цели распространения в программе анализа.
- Образцы ворот для выбора только одиночных ячеек, которые являются положительными флуоресценции (как на рисунке2).
- Рассчитайте параметр AmFRET как соотношение общего сигнала FRET (488ex/595em), разделенного на общий сигнал FRET (561ex/595em).
- Визуализируйте данные с помощью программного обеспечения цитометрии потока (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Цитосолико концентрации для S. cerevisiae в этом исследовании были рассчитаны с настройками ниже, как в Хан и др.8. Анализ данных проводился с использованием программного обеспечения цитометрии потока (см. Таблицаматериалов).
Результаты
Обнаружение олигомеров, которые не образуют пункту
Ранее мы применяли DAmFRET для характеристики разделения белковой фазы, что обычно приводит к образованию крупных белковых сборок, которые также могут быть обнаружены с помощью флуоресценции микроскопии. Чтобы продемонстрировать применимость DAmFRET к дифракционно-ограниченным протеиновым сборкам, мы проанализировали биохимически хорошо охарактеризованный белок, который образует дискретные гомо-гептамы, которые слишком малы, чтобы быть визуализированы световой микроскопией: человек ко-чаперонин, HSPE114. Мы сравнили профили DAmFRET дрожжевых клеток, выражающих mEos3.1 в одиночку, или HSPE1-mEos3.1. Последний продемонстрировал единые положительные значения AmFRET, в то время как бывший выставлены незначительные AmFRET(рисунок 3A). Изображения клеток, полученных цитометром потока изображений (см. Таблица Материалов) показали диффузную флуоресценцию во всех каналах-доноре, FRET и приемце, для обеих mEos3.1- и HSPE1-mEos3.1-expressing клеток (рисунок3B). Чтобы подтвердить этот вывод при более высоком оптическом разрешении, мы использовали конфокальной микроскопии для захвата z-стеков для нескольких полей клеток. Действительно, флуоресценция была равномерно распределена по всему цитозолу, без каких-либо обнаруживаемых пунктуры, независимо от того, клетки выразили HSPE1-mEos3.1 или фторофора в одиночку (Рисунок 3C). Обратите внимание, что характеризуется Kd HSPE1 составляет около 3 мкм, что немного ниже чувствительности нашей системы, и, следовательно, мы не наблюдаем сигмоидальной связи FRET к концентрации, что можно было бы ожидать для этого дискретного гомо-олигомера. Тем не менее, мы пришли к выводу, что DAmFRET надежно обнаруживает растворимые гомо-олигомеризации в vivo с разрешением одной клетки.
Обнаружение нуклеационных сборок с ограниченным
Чтобы продемонстрировать способность DAmFRET различать дискретные гомо-олигомеры от нуклеационных сборок, таких как прионы, мы проанализировали воспалительный белок АСК. В то время как WT ASCPYD образует нити in vivo,неактивный мутант R41E ASCPYD не9,10. Мы выразили в дрожжевых клетках либо mEos3.1 в одиночку, или mEos3.1 сливается с WT или R41E ASCPYD. Дрожжевые клетки, выражающие только фторофор или мутантную форму ASCPYD, продемонстрировали незначительный AmFRET на протяжении всего диапазона концентрации, что указывает на неспособность к самовзаимодействию. В отличие от этого, WT ASCPYD выставил профиль DAmFRET с двумя популяциями: одна с незначительной AmFRET, а другая с высоким AmFRET(рисунок 4A). Как подтверждено флуоресценции изображения(Рисунок 4B), эти популяции представляют клетки, которые содержат только растворимый белок или вместо этого содержат в основном самособранный белок, соответственно. Разрывные отношения между популяциями и тот факт, что они возникают при перекрывающихся концентрациях, указывают на то, что ядровой барьер стабилизирует мономерную форму белка и может удерживать его от сборки в течение всего эксперимента 8.Разрыв в AmFRET между двумя популяциями указывает на то, что, как только нуклеация происходит, он почти мгновенно шаблоны других мономеров в собранной форме и достигает нового устойчивого уровня состояния AmFRET. DAmFRET подтвердил предыдущие структурные данные, что точка мутант ASCPYD R41E нарушил нуклеацию через концентрации, достижимые этой системой выражения (Рисунок 4A).
Применимость DAmFRET в клетках млекопитающих
Хотя дрожжевые клетки являются идеальными клетками-хозяевами для DAmFRET, мы хотели расширить применимость DAmFRET на клетки млекопитающих. Чтобы избежать гибели клеток, вызванной функциональными полимерами ASC, мы протестировали DAmFRET в клетках HEK293T, в которых отсутствует экспрессия каспазы-1. Мы выразили те же белки в клетках HEK293T, как и в дрожжевых клетках на рисунке 4A. Полученные профили DAmFRET в клетках HEK293T качественно напоминают профили в дрожжевых клетках(рисунки 4A,C). DAmFRET, таким образом, служит наиболее универсальным методом in vivo для обнаружения и количественной оценки самосборки ядер ногой белка при одноклеточном разрешении с высокой пропускной мощностью независимо от наличия микроскопически видимой puncta, а также типа клеток.

Рисунок 1 : Обзор экспериментального дизайна для С. церевизия. Эта цифра была адаптирована из Хан и др.8 с разрешения. (A) 2 "плазмидная карта, показывающая открытую рамку чтения для белка интерес, помечены фотоконвертируемых mEos3.1 и управляется индуцируемых промоутер. (B) При преобразовании в дрожжевые клетки, 2 "система репликации приводит к высокой изменчивости числа копий среди клеток. Это изменение, в сочетании с транскрипционным шумом от промоутера GAL1, приводит к широкому распределению экспрессии белка в популяции клеток. (C) Экспериментальный обзор для дрожжей DAmFRET асссс. Для обеспечения здоровых клеток для ассеа, колонии сначала прививаются для распространения более 16 ч в синтетических носителях, содержащих не вызывающий источник углерода, декстроза. После пролиферации клетки передаются в синтетические носители, содержащие индуцирующий источник углерода, галактоза, в течение 16 ч. После индукции клетки частично и равномерно фотопреобразуются при воздействии 405 нм света. (D) Образцы затем анализируются с помощью цитометрии потока изображений. Спектры и интенсивность зеленого и красного mEos3.1 делают их хорошо подходит для донора и приемца FRET, соответственно. Когда в непосредственной близости друг от друга, как это происходит в полимере, изображенном в нижней клетке, красные молекулы будут флуоресценции при возбуждении зеленых молекул (FRET). (E) Участок донора против приемного интенсивности, показывающие тесные линейные отношения на фотоконверсии, показывая, что эффективность фотоконверсии не зависит от уровня выражения. (F) Рассеянный участок среднего приемования против донорской интенсивности от популяций клеток, выражающих различные mEos-тегами белков, как в растворимых, так и в амилоидных формах, показывая, что на эффективность фотоконверсии не влияет слияние партнер или растворительность (бары ошибок указывают на стандартное отклонение биологических трипликетов). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
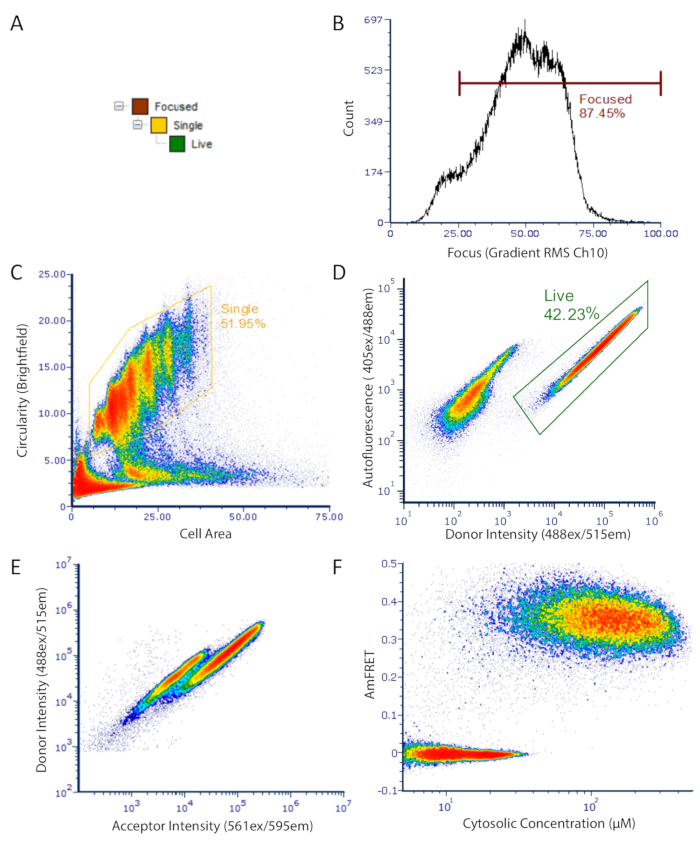
Рисунок 2 : Стратегия DAmFRET gating для данных цитометрии потока изображений. Стратегия Gating используется для анализа только сосредоточенных, необезвренных одиночных клеток, которые имеют низкую аутофлуоресценцию и выражают флуоресцентный белок. (A) Иерархия ворот, чтобы получить хорошо ориентированные, живые, одиночные ячейки для анализа. (B) Гистограмма градиента RMS канала яркого поля. Это измерение позволяет подбирать клетки, которые должным образом сосредоточены под передаваемым светом. (C) Плотность сюжета круговорота по сравнению с областью, показывающей закрытое население небраченных сферических одиночных ячеек. (D) Плотность участка, показывающего автофлуоресценцию (Ch07) против донорской флуоресценции (Ch02) интенсивность, показывающая отдельные популяции выражающихся клеток (закрытых) и темных клеток. (E) Рассеянный участок донора против приемного интенсивности, показывающие явную потерю в донорской флуоресценции в подмножестве клеток, в результате FRET между донором и принимающим флюорофорами. (F) Окончательный участок DamFRET. Клетки, содержащие разобранный белок, сосредоточены вокруг нулевого AmFRET, в то время как клетки, содержащие самособранный белок, обладают положительным значением AmFRET. Две перекрывающиеся популяции в сюжете свидетельствуют о конечном барьере для nucleating, что белок в более высоком порядке сборки, такие как амилоиды. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3 : Репрезентативные данные мономерных и гетемерных белков по цитометрии потока и микроскопии. (A) DAmFRET профиль мономерного белка mEos3.1 (слева) и heptameric HSPE1 помечены mEos3.1 (справа) показаны увеличение соотношения метрических ФРЕТ в результате гомотипической сборки. (B) Изображения из цитометра, клеток, выражающих mEos3.1 (слева) и HSPE1 (справа), показанные во всех захваченных каналах. (C) Репрезентативные изображения дрожжевых клеток, выражающих мономерные mEos3.1 (слева) и HSPE1 (справа). Изображения представляют собой суммапрогнозные проекции конфокальных ломтиков. По крайней мере, пятьдесят клеток были изображены, чтобы подтвердить это наблюдение. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4 : Профили DAmFRET показывают аналогичное поведение самосборки человека ASCPYD белок в S. cerevisiae и HEK293T клетки. (A) Плотность участков, показывающих AmFRET против цитозолической концентрации (в ММ) mEos3.1 (слева), или mEos3.1 сливается с WT (в центре) или мономеризации мутант ASCPYD (справа) в S. cerevisiae. (B) Изображения из цитометра, клеток из нижних и верхних ворот (левая и центральная панели, соответственно), выражающие WT ASCPYD; и ячеек, выражающих ASCPYD R41E указанных ворот (правая панель). (C) Плотность участков, показывающих AmFRET против интенсивности приема для той же серии белков, как в (A), но выражается в клетках HEK293T. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
DAmFRET является наиболее полным методом обнаружения белка самосборки in vivo. DAmFRET сочетает в себе прямое считывание гомотипических белково-белковых взаимодействий в широком диапазоне концентрации, с разрешением одной клетки и высокой пропускной стоимостью. Прямое считывание DAmFRET и тот факт, что сброшенные белки не требуют специфической субклеточной локализации или нерастворимых состояний, устраняют ложные срабатывания и распространяют его применимость на широкий спектр белков в их родных субклеточных местах. Примечательно, что, помечая органеллы флюорофорами, которые являются спектрально совместимыми с mEos3.1, такими как T-Sapphire и mCardinal, субклеточная локализация растворимых и собранных форм белков может быть определена наряду с DAmFRET.
Используя цитометр потока изображений, как описано здесь, требуется 8 ч, чтобы проанализировать 96-ну колодец пластины с примерно 20000 закрытых клеток на скважину. Тем не менее, мы также регулярно выполняем DAmFRET со стандартными (не-изображения) цитометрами, которые достигают гораздо более высокой пропускной всей (до 20 образцов в минуту). В самом деле, любой цитометр потока с пространственно отделены 488 и 561 нм лазеров, который свободен от артефактов усилителя журнала и имеет соответствующие ПМТ и фильтры для обнаружения донора, FRET, и приемсигналсигналов достаточно для выполнения DAmFRET. В настоящее время это увеличение пропускной записи происходит за счет информации о локализации и определения объема, так что самосборка должна быть проанализирована как функция экспрессии белка, а не концентрации. Это не проблема для качественного анализа. Кроме того, можно оценить цитозоликовый объем путем слияния спектрально различных фторофора эндогенного "домашнего хозяйства" белка, выражение которого плотно коррелирует с цитосолительным объемом.
Как мы продемонстрировали благодаря развертыванию DAmFRET как в дрожжах, так и в клетках млекопитающих, DAmFRET может быть легко адаптирован к различным системам экспрессии. Это позволяет самосборку белков изучать сява в их родных клеточных контекстах. Кроме того, он предлагает возможность сравнить сборку белка через широко расходятся модели клеточной культуры для изучения сохранения механизмов, которые регулируют самосборку белка.
Раскрытие информации
Авторы не заявляют о каких-либо конкурирующих интересах.
Благодарности
Мы хотели бы поблагодарить Джеффа Ланге, Джея Унру, Цзяньчжэна Ву, Тарик Хана и Эллен Кеттер за их работу по развитию асссе. Эта работа была проделана для выполнения, в частности, требований к кандидатским диссертационным исследованиям для Т.С.К. и A.R.G. в качестве студентов, зарегистрированных в Открытом университете, Великобритания, и Институте медицинских исследований, США, соответственно. Дополнительную информацию, связанную с ассеиами, можно найти в https://doi-org.remotexs.ntu.edu.sg/10.1016/j.molcel.2018.06.016. Исходные данные, лежащие в основе этой рукописи, можно получить из хранилища исходных данных Stowers в http://www.stowers.org/research/publications/libpb-1372. Эта работа была профинансирована NIH директора ранней независимости премии DP5-OD009152, марта Dimes Фонд Грант No 5-FY17-32, и Stowers институт медицинских исследований.
Вклад автора следующим образом. Концептуализация: Т.С.К., С.В. и Р.Х.; Методология: Т.С.К., С.В., А.Р.Г., а. Б.; Следствие: С.В., Т.С.К.и А.Р.Г.; Формальный анализ: С.В., и Т.С.К.; Кураторирование данных: T.S.K.; Визуализация: Т.С.К., и С.В., Письмо (Оригинальный проект): С.В., и Т.С.К.; Дать (Обзор, Редактирование): R.H., S.V., и T.S.K.; и Приобретение финансирования: R.H.
Материалы
| Name | Company | Catalog Number | Comments |
| 96 Well Plate | Axygen | P96-450R-C-S | |
| ASC 2-92 (mammalian plasmid) | rhm1.0095 | Available on request | |
| ASC 2-92 (R41E) (mammalian plasmid) | rhm1.0096 | Available on request | |
| ASC 2-92 (R41E) (yeast plasmid) | rhx2432 | Available on request | |
| ASC 2-92 (yeast plasmid) | rhx2431 | Available on request | |
| Centrifuge | Eppendorf | 5430R | "centrifuge" in text |
| CSM -Ura | Sunrise Science Products | 1004-100 | |
| Dextrose | EMD Millipore | DX0145-5 | |
| DMEM | Gibco | 11966025 | |
| EDTA | Sigma-Aldrich | EDS-500G | |
| FCS Express 6 | DeNovo | FCS Express 6 Flow | "flow cytometry software" in text |
| Fetal Bovine Serum | VWR Life Science | 45001-108 | |
| Flow Cytometer | BioRad | ZE5 | Non-imaging flow cytometer |
| FUGENE HD | Promega | E2311 | "transfection reagent" in text |
| Galactose | VWR Life Science | 0637-500g | |
| HSPE1 (yeast plasmid) | rhx1531 | Available on request | |
| Imaging Flow Cytometer | EMD Millipore | ImageStream X Mark II | "imaging flow cytometer" in text |
| Mammalian Cells | HEK293T | ||
| mEos3.1 (mammalian plasmid) | rhm1 | Available on request | |
| mEos3.1 (yeast plasmid) | rhx0935 | Available on request | |
| optiMEM | Gibco | 31985062 | "reduced serum media" in text |
| PBS | VWR Life Science | 45000-446 | |
| PenStrep | Gibco | 15070063 | |
| PFA | Sigma-Aldrich | P6148-1KG | |
| Photoconversion Lamp | OmniCure | S1000 | |
| Plasmid #54525 | Addgene | #54525 | "publicly available plasmid" in text |
| Titramax 1000 Plate Shaker | Heidolph Instruments | 1000 | "plate shaker" in text |
| Trypsin-EDTA | Gibco | 25200056 | |
| Yeast Strain | rhy1713 | Available on request- S288c (MATα lyp1Δ can1Δ::STE2pr_SpHIS5 his3Δ1 leu2Δ0 ura3Δ0 met15Δ0 cln3Δ0::GAL1pr_WHI5_hphMX) |
Ссылки
- Krissinel, E., Henrick, K. Inference of macromolecular assemblies from crystalline state. Journal of Molecular Biology. 372 (3), 774-797 (2007).
- Kühner, S., van Noort, V., et al. Proteome organization in a genome-reduced bacterium. Science. 326 (5957), 1235-1240 (2009).
- Marianayagam, N. J., Sunde, M., Matthews, J. M. The power of two: protein dimerization in biology. Trends in Biochemical Sciences. 29 (11), 618-625 (2004).
- Matthews, J. M., Sunde, M. Dimers, oligomers, everywhere. Advances in Experimental Medicine and Biology. 747, 1-18 (2012).
- Glover, J. R., Kowal, A. S., Schirmer, E. C., Patino, M. M., Liu, J. J., Lindquist, S. Self-seeded fibers formed by Sup35, the protein determinant of [PSI+], a heritable prion-like factor of S. cerevisiae. Cell. 89 (5), 811-819 (1997).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Michaels, T. C. T., Dear, A. J., Knowles, T. P. J. Stochastic calculus of protein filament formation under spatial confinement. New journal of physics. , (2018).
- Khan, T., Kandola, T. S., et al. Quantifying Nucleation In Reveals the Physical Basis of Prion-like Phase Behavior. Molecular Cell. 71 (1), 155-168 (2018).
- Cai, X., Chen, J., et al. Prion-like polymerization underlies signal transduction in antiviral immune defense and inflammasome activation. Cell. 156 (6), 1207-1222 (2014).
- Lu, A., Magupalli, V. G., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Zhang, M., Chang, H., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nature Methods. 9 (7), 727-729 (2012).
- Gietz, D., Jean, A., Woods, R. A., Schiestl, R. H. Improved method for high efficiency transformation of intact yeast cells. Nucleic Acids Research. 20 (6), 1425 (1992).
- Nishizawa, K., Kita, Y., Kitayama, M., Ishimoto, M. A red fluorescent protein, DsRed2, as a visual reporter for transient expression and stable transformation in soybean. Plant Cell Reports. 25 (12), 1355-1361 (2006).
- Luke, K., Apiyo, D., Wittung-Stafshede, P. Dissecting homo-heptamer thermodynamics by isothermal titration calorimetry: entropy-driven assembly of co-chaperonin protein 10. Biophysical Journal. 89 (5), 3332-3336 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены