Method Article
الكشف عن وتوصيف البروتين التجميع الذاتي في الجسم الحي عن طريق قياس التدفق
In This Article
Summary
توضح هذه المقالة بروتوكول قياس التدفق المستندة إلى FRET لتحديد حجم التجميع الذاتي للبروتين في كل من خلايا S. cerevisiae و HEK293T.
Abstract
تحكم عملية التجميع الذاتي للبروتين وظيفة البروتين وتقسم العمليات الخلوية في المكان والزمان. وتعاني الأساليب الحالية لدراستها من انخفاض الحساسية، والقراءة غير المباشرة، والإنتاجية المحدودة، و/أو مستوى السكان بدلا ً من حل الخلية الواحدة. لقد قمنا بتصميم منهجية واحدة تعتمد على قياس التدفق والتي تعالج جميع هذه القيود: الاتحاد اتف توزيعه أمفيفلوريك FRET أو DAmFRET. DAmFRET بالكشف عن وكمية التجمعات الذاتية للبروتين عن طريق الانبعاثات الحساسة FRET في الجسم الحي، وتمكن من النشر عبر أنظمة نموذجية- من الخميرة إلى الخلايا البشرية، ويحقق القراءة الحساسة، خلية واحدة، عالية الإنتاجية بغض النظر عن البروتين التعريب أو الذوبان.
Introduction
الاختبارات لدراسة تفاعلات البروتين المتجانسة، أو "التجميع الذاتي" مهمة لأن الدولة القلة وذوبان البروتينات تملي وظيفتها. البروتيوم تكثر مع الإنسان الملتف1،2،3،4،في حين أن عدد قليل نسبيا من البروتينات تعمل كمونومرات. البروتينات يمكن أيضا تجميع شاذة بسبب الإجهاد, العمر, أو سوء التنظيم, مما يؤدي إلى التغيرات المرضية في النشاط. وغالبا ً ما يكون تحديد العوامل التي تعدل مثل هذه الأحداث، أو حتى الطبيعة المادية للتجمعات، أمراً صعباً بشكل استثنائي.
وهناك الآن عدد متزايد من البروتينات المعترف بها لتجميع الذات مع التعاون غير عادية والقياس غير محدد، مما أدى إلى إزالة الاختلاط من المكونات الخلوية الأخرى، ومراحل كثيفة البروتين. هذه تأخذ شكل المكثفات المختلة، مثل قطرات والمواد الهلامية، أو خيوط مرتبة للغاية، مثل ألياف الأميلويد. التقلبات المطابقة المرتبطة بهذا الأخير تجعل تشكيلها الأولي، أو النوى،بطبيعتها الاحتمالية على المستوى الجزيئي 5،6. لأن احتمال موازين النوى مع الحجم، وتشكيل مثل هذه التجمعات يمكن أن يكون مؤشر ستوكاستيك للغاية في الحدود المكانية للخلايا الحية7،8. في أقصى حد من الفصل المرحلة النويات العشوائية هي prions، جمعيات البروتين أمر للغاية التي نادرا ما نواة تلقائيا، ولكن مرة واحدة شكلت، قالب نموها الخاص إلى أجل غير مسمى. أحد هذه البروتينات، المعروف باسم ASC، ينفذ مفتاح رقمي يشبه prion في نشاط الخلايا المناعية الفطرية الثدييات. يتم تمركز التجميع الذاتي ASC من خلال تفاعلها مع بروتينات محددة التي لديها نفسها oligomerized على ربط مسببات الأمراض أو الأنماط الجزيئية المرتبطة بالخطر. جمعيات ASC بدورها النوى procaspase-1 لتجميع ذاتي وتفعيل، مما يؤدي إلى نضج السيتوكينوpyroptosis من الخلية 9،10. ينتسب المنطقة من [أسك] مسؤولة لجمعيته إلى الموت مجال [سوبربمنت], أيّ يتألّف على [أن-هوندرد] أعضاء في ال [بروتيوم] إنسانيّة. وعلى الرغم من الأدوار المحورية لمجالات الموت في الحصانة الفطرية وموت الخلايا المبرمج، فإن معظمها لم يُميّز بعد فيما يتعلق بالتجمع الذاتي. سيتم تسهيل اكتشاف وتوصيف بروتينات إضافية مع مثل هذا السلوك إلى حد كبير من خلال قراءة مباشرة من خلية واحدة من البروتين التجميع الذاتي.
وتقتصر نُهج الكيمياء الحيوية للبروتين الكلاسيكي لدراسة التجميع الذاتي للبروتين، مثل الكروماتوغرافيا والكروماتوغرافيا ذات الضخامة، إلى حد كبير على تقييمات مستوى السكان. ومع ذلك، لا يمكن نمذجة عدم تجانس الخلايا إلى الخلية الناتج عن عمليات الانتقال في المرحلة المحدودة للنواة بالنوى مع هذا المستوى من التفاصيل. وتستعيد نُهج الخلايا الواحدة القائمة على التنظير المجهري الفلوري هذه القدرة، ولكنها تفتقر إلى الإنتاجية اللازمة لتحديد حجم النوى بدقة أو للكشف عن التجميعات النادرة. وعلاوة على ذلك، فإن التجميعات الذاتية القابلة للذوبان مثل معظم الإنزيمات وoligomers ما قبل الأميلويد، صغيرة جداً ومتحركة بحيث لا يمكن حلها عن طريق الفحص المجهري الضوئي القياسي. ويمكن الكشف عنها من خلال نُهُج أكثر تطوراً مثل التحليل الطيفي لارتباط الفلورة، ولكن هذه النُهُج محدودة جداً من حيث عدد الخلايا والإنتاجية.
وتوفر الاختبارات القائمة على القرب لتجميع البروتين، مثل فريت وتكملة الفلوروفور المقسمة، حلاً محتملاً لهذه المشاكل. ومع ذلك، فإنها تتطلب عموما استخدام اثنين من المنشآت المختلفة التي تعبر عن البروتين من الاهتمام تنصهر إلى العلامات التكميلية- المانح والمقبول الفلوروفورفية في حالة فريت. وهذا يعرض الإنتاجية التجريبية للخطر ويقلل أيضا من الحساسية بسبب التباين من خلية إلى خلية في المستويات النسبية للمانح والمقبول. للتحايل على هذا، قمنا بتصميم تحليل يستخدم فلوروفور قابل للتحويل الضوئي، mEos3.111، والذي يسمح لتشييد واحد للتعبير عن كل من البروتين المانح والمقبول الموسومة. يتداخل طيف الانبعاثات لـ mEos3.1 غير المحول (متبرع يشبه GFP) بشكل كافٍ مع طيف الإثارة لـ mEos3.1 (مقبل يشبه dsRed) للسماح بحدوث FRET عندما تكون الجزيئات على مقربة (<10 نانومتر). وهكذا، من خلال تعريض الخلايا لجرعة محددة تجريبيا من 405 نانومتر الضوء، الذي photoconverts جزء الأمثل من مجموع mEos3.1 في شكل مقبول، ونحن نحقق مستويات نسبية متسقة واستنساخ من الجهات المانحة ومقبول عبر عينات متعددة، مستويات التعبير، والتجارب. نحن قياس الفلورية مقبول عندما متحمس إما مباشرة مع 561 نانومتر ضوء، أو بشكل غير مباشر (عن طريق نقل الطاقة من المانح) مع 488 نانومتر ضوء (أي، حساسة الانبعاثات FRET). نحن نبلغ تجميع البروتين كنسبة من هاتين القيمتين والمصطلح هو AMPHIfluoric FRET أو AmFRET.
من أجل حساب تركيز البروتين عن طريق قياس التدفق، نقوم أولا بحساب متوسط كثافة الفلورة من Spc42 الموسومة mEos3.1. لأن خلايا الخميرة تحتوي على ما يقرب من 1000 جزيئات من SPC42، ونحن ثم حساب كثافة الفلورة من جزيء واحد الفلورسنت الأخضر mEos3.1. من خلال الاستفادة من تحويل الصور حتى في جميع التركيزات الخلوية (الشكل1E)،ونحن ثم ربط مجموع قيم الفلورة mEos3.1 لجميع كثافة مقبول بعد تحويل الصور. نحن بعد ذلك قادرون على تقسيم العدد الإجمالي للشامات من البروتينات الفلورية من قبل حجم السيتوسولية التقريبي (كما هو محدد باستخدام التصوير تدفق القياس الدوري) للحصول على التركيز الدوري الكلي للبروتين من الفائدة. للاطلاع على الحسابات الدقيقة، يرجى الاطلاع على المخطوطة الأصلية8.
من خلال التعبير عن البروتين mEos3.1 تنصهر من بلازميد 2μ في الخميرة، ونحن التحقيق في مجموعة ما يقرب من ألف أضعاف من تركيز البروتين في كل عينة8. نحن نحقق نفس الشيء في خلايا HEK293T بحكم الاختلاف في التناول بلازميد أثناء التغوط، وبالتالي رقم نسخة متغير.
التوزيع الناتج من AmFRET، أو DAmFRET، لعدة آلاف من الخلايا يكشف عن تركيز الاعتماد على التجميع الذاتي في السيتوسول لأي بروتين من الفائدة. بشكل عام، يمثل DAmFRET منهجية تمكينية لاكتشاف وتوصيف التجميع الذاتي للبروتين مع مزيج غير مسبوق من الحساسية، والإنتاجية، والقابلية للاستنساخ.
في حين أن استخدام مقياس السيتومتر التصويري يمكننا من الحصول على قياسات تركيز البروتين في الجسم الحي، فإن أجهزة قياس السيتومتر هذه ليست متاحة بعد في معظم مؤسسات البحوث. ومع ذلك، يمكن تشغيل DAmFRET حتى في مقياس السيتومتر غير التصوير نموذجية للحصول على توزيعات تجميع البروتين على مجموعة من التعبير البروتين.
Protocol
1. إعداد Saccharomyces cerevisiae لاختبار DAmFRET
- تحويل سلالات الخميرة ذات الصلة تجريبيا مع بلازميد 2μ اللاكتوز الإندوبوت الذي يعبر عن البروتين من الاهتمام8 الموسومة إما في C أو N تيرمينوس مع mEos3.1 باستخدام بروتوكول خلات الليثيوم القياسية12 .
- تنمو الخميرة في الثقافة السائلة.
- لكل بروتين الاستعلام، وتلقيح مستعمرات الخميرة (تحويلها)، في ثلاثة أضعاف، كل في 200 درجة مئوية من وسائل الإعلام المناسبة النمو غير المحفزة (أي، وسائل الإعلام التي تحتوي على 2٪ سكر العنب، قاعدة النيتروجين الخميرة والأحماض الأمينية لاختيار بلازميد) في لوحة 96 جيدا ( الشكل 1جيم).
- حضانة الخلايا أثناء الاهتزاز على لوحة شاكر (انظر جدولالمواد) مع 1.5 مم المدار في 1200 دورة في الدقيقة في 30 درجة مئوية لمدة 16 ساعة.
- حث التعبير عن جين الاهتمام (بروتوكول تمثيلي ل16 ح-بعض البروتينات قد يستغرق أكثر أو أقل من الوقت).
- بعد 16 ساعة من الحث، تدور لوحة في 2200 × ز لمدة 2 دقيقة في درجة حرارة الغرفة (RT0 لبيليه العينات.
- إزالة الوسائط عن طريق انعكاس قوي. إعادة تعليق الخلايا مع 200 درجة مئوية من وسائل الإعلام التعريفي المناسبة (أي، وسائل الإعلام التي تحتوي على 2٪ جالاكتوز، قاعدة النيتروجين الخميرة والأحماض الأمينية لاختيار بلازميد). انظر الشكل 1 جيم.
- حضانة الخلايا أثناء الاهتزاز عند 30 درجة مئوية لمدة 12 ساعة.
- الطرد المركزي (انظر جدولالمواد) لوحة في 2200 × ز لمدة 2 دقيقة في RT لبيليه العينات. إزالة الوسائط عن طريق انعكاس قوي. إعادة تعليق الخلايا مع 200 درجة مئوية من وسائل الإعلام التعريفي.
- حضانة الخلايا أثناء الاهتزاز عند 1200 دورة في الدقيقة عند 30 درجة مئوية لمدة 4 ساعة إضافية. يجب أن يحدث هذا التعليق في وسائل الإعلام الجديدة 4 ساعة قبل تشغيل DAmFRET، من أجل الحد من الفلورة الذاتية.
2- خلق البلازميد الثدييات
- إنشاء متجه ثديي له مروج تأسيسي وmEos3.1 مع عنصر نائب لإدراج جين الفائدة والرابط بينهما.
ملاحظة: قمنا ببناء متجه متوافق مع البوابة الذهبية، M1، من بلازميد متاح للجمهور (انظر جدولالمواد) مع التعديلات التالية: تمت إزالة موقع BsaI موجود بواسطة طفرة نقطة G إلى A (في الموقع 3719 وفقا للإيداع تسلسل). تم الحصول على mEos3.1 باستخدام الطفرات الموجهة إلى الموقع من الفلوروفور في I157V. تم إدراج مواقع BsaI المقلوبة تليها 4x (EAAAR) linker، من قبل جيبسون الجمعية، في الإطار بين المروج CMV وmEos3.1 لإنتاج ناقلات M1 النهائي. ويحرك التعبير البروتين من قبل CMV محسن والمروج; وإنهاء النسخ بواسطة إشارة Polyadenylation SV40. - إنشاء مكتبة من إدراج، متوافقة مع المتجه الذي تم إنشاؤه.
ملاحظة: نحن نطلب إدراج لدينا لتجميع البوابة الذهبية كشظايا خطية اصطناعية (انظر جدول المواد) يحيط بها مواقع BsaI للربط في M1 بين المروج CMV و4X (EAAAR)-mEos3.1.
3- ثقافة الخلايا الثدييات ومستخواها
- ثقافة HEK293T الخلايا في DMEM + 10٪ FBS + 1X وسائل الإعلامPenStrep في 37 درجة مئوية في 5٪ CO 2.
- في اليوم السابق للانتراب، البذور 5 × 105 الخلايا في لوحة 6 جيدا مع 2 مل من وسائل الإعلام.
- الخلايا المتحولة مع 2 ميكروغرام من الحمض النووي بلازميد باستخدام كاشف التغوط (انظر جدولالمواد) بنسبة 3:1 (كاشف التغوط:DNA). خلط المكونات في 150 درجة مئوية من وسائل الإعلام المصل مخفضة (انظر جدولالمواد) واحتضانه في RT لمدة 15 دقيقة، إضافة المزيج إلى كل بئر وحضانة لمدة 48 ساعة للتعبير عن البروتين.
- تأكيد التعبير البروتين بعد 24 ساعة عن طريق الميكروسكوب الظهارة (488 نانومتر الإثارة, 515 نانومتر الانبعاثات).
4- إعداد خلايا الثدييات لاختبار DAmFRET
- بعد 48 ساعة من التعبير البروتيني، قم بإزالة الوسائط من كل خلية جيدة وتغسل الخلايا بعناية مع 1 مل من 37 درجة مئوية من محلول الفوسفات المخزنة مؤقتاً (PBS). بعد الغسيل، يستنشق الـ PBS.
- إضافة 0.5 مل من حمض التربسين-اثيلين ديامينيتراسيتيك (EDTA) (0.25٪) وحضانة لمدة 5 دقائق في 37 درجة مئوية.
- إضافة 0.5 مل من وسائط DMEM كاملة إلى كل بئر، وإعادة تعليق الخلايا وضمان عدم وجود كتل كبيرة مرئية.
- نقل حجم كامل من كل بئر في أنابيب 1.5 مل.
- تدور الخلايا لمدة 5 دقائق في 1000 × ز في درجة حرارة الغرفة (RT).
- إزالة supernatant وإعادة تعليق بيليه الخلية في 1 مل من PBS + 10 MM EDTA.
- تدور الخلايا لمدة 5 دقائق في 1000 × ز في RT.
- إزالة supernatant وإعادة تعليق بيليه الخلية في 1 مل 4٪ بارافورماليدهايد (PFA) + 10 MM EDTA في PBS.
- إصلاح الخلايا لمدة 5 دقائق على طاولة هزة مع حركة مستمرة.
- تدور الخلايا لمدة 5 دقائق في 1000 × ز في RT.
- إزالة supernatant وإعادة تعليق بيليه الخلية في 1 مل من PBS + 10 MM EDTA.
- تدور الخلايا لمدة 5 دقائق في 1000 × ز في RT.
- إزالة supernatant وإعادة تعليق الخلايا في حجم كاف من المخزن المؤقت لتشغيل قياس الخلايا (ل1 جيدا من لوحة 96 جيدا استخدام 200 ميكرولتر من PBS + 10 MM EDTA).
- نقل الخلايا المعلقة إلى بئر واحد من أسفل جولة لوحة 96 جيدا.
5. تحويل الصور من الخميرة وخلايا الثدييات للتحديد
- عينات تحويل الصور في لوحة صغيرة مع عدم وجود غطاء باستخدام مصباح الأشعة فوق البنفسجية (انظر جدولالمواد) مزودة 320-500 نانومتر (البنفسجي) مرشح وشعاع collimator، وضعت 45 سم فوق لوحة، لمدة 25 دقيقة في حين يهز. هذه الشروط مناسبة عندما تكون قوة الحزمة في اللوحة 11.25 م.م.وات/سم2، مع ما يقرب من 17000 مج/سم2 من إجمالي جرعة الفوتون8.
6 - جمع بيانات DAmFRET
- خلايا اختبار باستخدام مقياس الخلايا مع الليزر غير الخطي 488/561. البيانات التالية هي الحد الأدنى من متطلبات حساب FRET.
- استخدام 488 نانومتر الإثارة / 515 نانومتر قناة الانبعاثات لجمع الفلورة المانحة.
- استخدام 488 نانومتر الإثارة / 595 نانومتر قناة الانبعاثات لجمع الفلورة من إشارة فريت.
- استخدام 561 نانومتر الإثارة / 595 نانومتر قناة الانبعاثات (غير خطي مع قناة 488/595) لجمع الفلورة مقبول.
- استخدام 405 نانومتر الإثارة / 457 نانومتر قناة الانبعاثات لجمع autofluorescence8.
- استخدم قناة صورة brightfield لحساب مستوى الصوت.
ملاحظة: إعدادات مقياس السيتومتر التصوير لS. سيريفيسياي هي كما يلي: 60x الهدف في انخفاض معدل التدفق وحساسية عالية; تعيين القوى الليزر إلى 405 نانومتر في 15 مواطوات، 488 نانومتر في 15 مواطوات، 561 نانومتر في 20 mW.Imaging إعدادات مقياس الخلايا لخلايا HEK293T هي كما يلي: 40x الهدف في انخفاض معدل التدفق وحساسية عالية؛ تعيين القوى الليزر إلى 405 نانومتر في 15 مليواط/ نانومتر في 15 مليواط, 561 نانومتر في 20 mW.Also لاحظ أن, لدينا التصوير cytometer تم تصميمها خصيصا لفصل مكانيا 488 نانومتر و 561 نانومتر الليزر (أي, على كاميرات مختلفة) وذلك للحصول على قرار واضح من FRET من المقبل fluorceneses Ce.
- جمع البيانات ل20،000-50،000 خلية واحدة لكل عينة داخل بوابة إيجابية الفلورة.
- بوابة خلايا واحدة بنسبة ارتفاع نسبة العرض إلى الارتفاع ومنطقة خلية صغيرة بدلا من الخلايا المقطوعة أو الحطام التي سيكون لها نسبة العرض إلى الارتفاع منخفضة ومناطق الخلايا الكبيرة أو الصغيرة جدا على التوالي.
ملاحظة: المعلمات المكافئة في مقياس الخلايا غير التصويري هي FSC (مبعثر للأمام) لحجم الخلية التقريبي وSSC (تشتت الجانب) لحبيبات الخلايا. بالإضافة إلى ذلك، استخدم ارتفاع نبض FSC مقابل عرض النبض كوكيل للزماة خلية واحدة. بالإضافة إلى ذلك، من الضروري عدم جمع الأحداث التي لها قيم الفلورة خارج الحد الأعلى للحساسية من مقياس السيتومتر. في مقياس السيتومتر التصويري لدينا، نقوم بتقييد جمع الأحداث إلى قيمة بكسل قصوى خام تقل عن حد التشبع لكل قناة فلورسنت نجمعها. وبالمثل، بالنسبة لمقاييس التدفق التقليدي، لا ينبغي تحليل نقاط البيانات في سلة الكثافة الأعلى (التي تتضمن أحداثاً تتجاوز النطاق الديناميكي للكشف).
- بوابة خلايا واحدة بنسبة ارتفاع نسبة العرض إلى الارتفاع ومنطقة خلية صغيرة بدلا من الخلايا المقطوعة أو الحطام التي سيكون لها نسبة العرض إلى الارتفاع منخفضة ومناطق الخلايا الكبيرة أو الصغيرة جدا على التوالي.
7 - تحليل البيانات
- إجراء تعويض باستخدام عينة mEos3.1 غير محولة ضوئياً لإشارة المتبرع النقية وDsRed2 الأحادية، التي لها طيف مماثل للشكل الأحمر من mEos3.1، لإشارة المقبل النقية13. لمزيد من الحساسية، تأكد من أن قناة كاشف فريت تعتبر أيضا هدفا غير مباشر، في برنامج التحليل.
- عينات بوابة لتحديد الخلايا المفردة فقط التي هي إيجابية الفلورة (كما هو الحال في الشكل2).
- حساب المعلمة AmFRET كنسبة من مجموع إشارة فريت (488ex/595em) مقسوما ً على إجمالي إشارة قبول FRET (561ex/595em).
- تصور البيانات باستخدام برنامج قياس التدفق (راجع جدولالمواد).
ملاحظة: تم حساب التركيزات السيتوسالية لـ S. cerevisiae في هذه الدراسة بالإعدادات الواردة أدناه كما هو الحال في Khan et al.8. تم إجراء تحليل البيانات باستخدام برنامج قياس التدفق (انظر جدولالمواد).
النتائج
الكشف عن oligomers التي لا تشكل الملتحمة
لقد سبق لنا تطبيق DAmFRET لتوصيف فصل مرحلة البروتين، والذي يؤدي عادة إلى تشكيل جمعيات البروتين الكبيرة التي يمكن أيضا الكشف عنها عن طريق الفحص المجهري الفلوري. لإثبات إمكانية تطبيق DAmFRET على جمعيات البروتين محدودة الانعراج، قمنا بتحليل بروتين يتميز كيميائياً بياوياً بشكل جيد ويشكل قطعاً منفصلة من الهومنس هي صغيرة جداً بحيث لا يمكن تصورها بواسطة الفحص المجهري الخفيف: الإنسان شارك في مرافقة، HSPE114. قارنا ملامح DAmFRET من خلايا الخميرة التعبير عن mEos3.1 وحدها، أو HSPE1-mEos3.1. وقد أظهر هذا الأخير قيماً إيجابية موحدة للفرنكوفريت، في حين عرضت الأولى قيمة لا تذكر (الشكل3ألف). كشفت صور الخلايا التي تم الحصول عليها بواسطة مقياس تدفق التصوير (انظر جدولالمواد) الفلورة المنتشرة في جميع القنوات المانحة، وفريت ومقبول، لكل من الخلايا المعبّر عن mEos3.1 وHSPE1-mEos3.1 (الشكل3B). لتأكيد هذا الاستنتاج في دقة بصرية أعلى، استخدمنا الفحص المجهري البؤري لالتقاط مكدسات z لحقول متعددة من الخلايا. في الواقع، تم توزيع الفلورة بشكل موحد في جميع أنحاء السيتوسول، مع عدم وجود الملتحمة للكشف، ما إذا كانت الخلايا أعرب HSPE1-mEos3.1 أو الفلوروفور وحدها (الشكل3C). لاحظ أن K d المميز من HSPE1 حوالي 3 μM وهو أقل قليلا من حساسية نظامنا، وبالتالي نحن لا نلاحظ العلاقة السينية من فريت إلى التركيز الذي من المتوقع لهذا homo-oligomer منفصلة. ومع ذلك، نخلص إلى أن DAmFRET يكشف بقوة القابلة للذوبان homo-oligomerization في الجسم الحي في قرار خلية واحدة.
الكشف عن التجميعات المحدودة النوى
لعرض قدرة DAmFRET على التمييز بين المتجانسات المنفصلة والتجمعات المحدودة النوى مثل prions، قمنا بتحليل البروتين المُشنّف البشري ASC. في حين أن WT ASCPYD أشكال خيوط في الجسم الحي، ومتحولة غير نشط R41E منPYD ASC لا9،10. عبرنا في خلايا الخميرة إما mEos3.1 وحدها، أو mEos3.1 تنصهر إما WT أو R41E ASCPYD. خلايا الخميرة التي تعبر عن الفلوروفور وحدها أو شكل متحولة من ASCPYD أظهرت AmFRET لا يكاد يذكر على نطاق التركيز بأكمله، مما يشير إلى عدم القدرة على التفاعل الذاتي. وعلى النقيض من ذلك، عرضحزب الاتحاد الديمقراطي لقوى الديمقراطية في العالم صورة موجزة لـ DAmFRET تضم اثنين من السكان: أحدهما لا يكاد يذكر من نوع AmFRET والآخر مع درجة عالية من الـ AmFRET (الشكل4A). كما أكدت الصور الفلورية(الشكل 4B)،تمثل هذه التجمعات الخلايا التي تحتوي على البروتين القابل للذوبان فقط أو بدلا من ذلك تحتوي على البروتين تجميعها ذاتيا في الغالب، على التوالي. العلاقة المتقطعة بين السكان، وحقيقة أنها تحدث في تركيزات متداخلة تشير إلى أن حاجز النويات يثبت شكل أحادي ة من البروتين ويمكن أن يمنعها من تجميع على مدى مدة التجربة 8- وتشير الفجوة في AmFRET بين السكان إلى أنه بمجرد حدوث النويات، فإنها تقترب على الفور من قوالب مونومرات أخرى إلى الشكل المجمع وتحقق مستوى حالة ثابت جديد من AmFRET. وأكد DAmFRET البيانات الهيكلية السابقة أن نقطة متحولة ASCPYD R41E تعطيل النوى عبر تركيزات يمكن تحقيقها من قبل نظام التعبير هذا (الشكل4A).
انطباق DAmFRET في خلايا الثدييات
على الرغم من أن خلايا الخميرة هي الخلايا المضيفة المثالية لDAmFRET، أردنا توسيع نطاق تطبيق DAmFRET إلى خلايا الثدييات. من أجل تجنب موت الخلايا الناجمة عن البوليمرات ASC وظيفية، اختبرنا DAmFRET في خلايا HEK293T التي تفتقر إلى التعبير caspase-1. عبرنا عن نفس البروتينات في خلايا HEK293T كما فعلنا في خلايا الخميرة في الشكل 4A. ملامح DAmFRET الناتجة في خلايا HEK293T تشبه نوعيا تلك الموجودة في خلايا الخميرة(الأرقام 4A،C). DAmFRET، وبالتالي، بمثابة الأكثر تنوعا في طريقة الجسم الحي للكشف عن وقياس التجمعات الذاتية البروتين النووي في قرار خلية واحدة مع الإنتاجية العالية بغض النظر عن كل من وجود الملتحمة مرئية مجهريًا وكذلك نوع الخلية.

الشكل 1 نظرة عامة على التصميم التجريبي لـ: س. سيريفيسياي. وقد تم تكييف هذا الرقم من خان وآخرون8 بإذن. (A) خريطة بلازميد 2 μ تبين إطار القراءة المفتوحة للبروتين من الفائدة، والموسومة مع mEos3.1 القابلة للتحويل الضوئي ويقودها المروج غير قابل للاخ. (B) عند تحويلها إلى خلايا الخميرة، نظام 2μ من النسخ المتماثل يؤدي إلى ارتفاع تباين عدد النسخ بين الخلايا. هذا الاختلاف، جنبا إلى جنب مع الضوضاء النسخية من المروج GAL1، يؤدي إلى توزيع واسع للتعبير البروتين في مجموعة من الخلايا. (C) نظرة عامة تجريبية لـ «فحص الخميرة DAmFRET». لضمان الخلايا السليمة للفحص، يتم تلقيح المستعمرات لأول مرة للانتشار أكثر من 16 ساعة في وسائل الإعلام الاصطناعية التي تحتوي على مصدر الكربون غير المحفز، سكر العنب. بعد الانتشار، يتم نقل الخلايا إلى وسائل الإعلام الاصطناعية التي تحتوي على مصدر الكربون المحفز، الجالاكتوز، لمدة 16 ساعة. بعد الحث، يتم تحويل الخلايا جزئيا وبشكل موحد عن طريق التعرض للضوء 405 نانومتر. (D) ثم يتم تحليل العينات باستخدام التصوير تدفق قياس السيتومترية. الأطياف والكثافات من الأخضر والأحمر mEos3.1 جعلها مناسبة تماما لمانح فريت ومقبول، على التوالي. عندما تكون على مقربة من بعضها البعض، كما يحدث في البوليمر يصور في الخلية السفلية، فإن الجزيئات الحمراء الفلورية عند إثارة الجزيئات الخضراء (FRET). (E) مؤامرة من المانح مقابل كثافة مقبول تظهر علاقة خطية ضيقة على تحويل الصور، مما يدل على أن كفاءة تحويل الصور لا تتأثر مستوى التعبير. (F) مؤامرة مبعثرة من متوسط قبول مقابل كثافة المانحين من مجموعات من الخلايا التي تعبر عن مجموعة متنوعة من البروتينات ذات العلامات mEos، في كل من الأشكال القابلة للذوبان والأميلويد، مما يدل على أن كفاءة تحويل الصور لا يتأثر الانصهار شريك أو الذوبان (أشرطة الخطأ تشير إلى الانحراف المعياري للثلاثيالبيولوجية). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
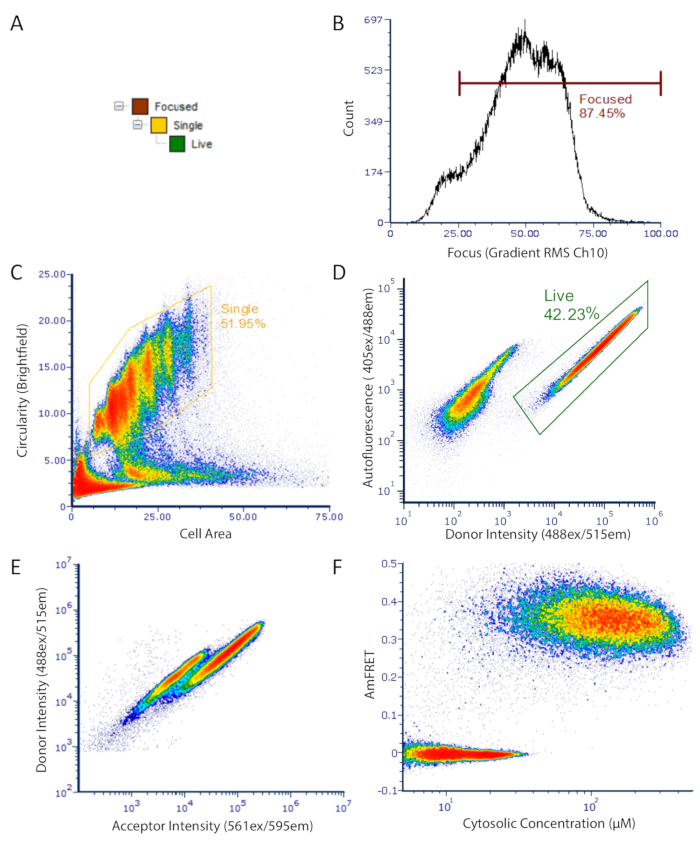
الشكل 2 DAmFRET استراتيجية gating لتصوير تدفق البيانات قياس السيتومترية: استراتيجية التجمع المستخدمة لتحليل الخلايا المفردة المركزة فقط، غير المغطى التي تحتوي على الفلورة الذاتية المنخفضة والتعبير عن البروتين الفلورسنت. (أ) التسلسل الهرمي للبوابات للحصول على خلايا واحدة مركزة بشكل جيد، حية، لتحليلها. (ب) الرسم البياني من RMS التدرج من قناة برايتفيلد. يسمح هذا القياس باختيار الخلايا التي تركز بشكل صحيح تحت الضوء المنقول. (C) قطعة كثافة من التعميم مقابل منطقة تظهر السكان المسور من الخلايا الكروية أحادية اللانهاية. (D) مؤامرة الكثافة تظهر الفلورة الذاتية (Ch07) مقابل كثافة الفلورة المانحة (Ch02) تظهر مجموعات منفصلة من الخلايا الصريحة (بوابات) والخلايا المظلمة. (هـ)مؤامرة مبعثرة للمانح مقابل كثافة المقبول ية تبين خسارة واضحة في الفلورة المانحة في مجموعة فرعية من الخلايا، ناتجة عن فريت بين المانح والمانح الفلوروفور. (F) النهائي DAmFRET مؤامرة. تتمحور الخلايا التي تحتوي على بروتين غير مجمع حول صفر AmFRET، في حين أن الخلايا التي تحتوي على البروتين تجميعها الذاتي تظهر قيمة AmFRET إيجابية. اثنين من السكان المتداخلة في المؤامرة يدل على وجود حاجز محدود لnucleating هذا البروتين في جمعيات أعلى ترتيب مثل الأميلويدات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3 البيانات التمثيلية للبروتينات الأحادية والسباعية عن طريق قياس التدفق والفحص المجهري. (أ) DAmFRET الشخصي من البروتين mEos3.1 أحادية (يسار) وHSPE1 السباعية الموسومة mEos3.1 (يمين) تظهر زيادة نسبة التفريق الناتجة عن التجميع المتجانس. (B) صور من مقياس الخلايا، من الخلايا التي تعبر عن mEos3.1 (يسار) و HSPE1 (يمين) تظهر في جميع القنوات التي تم التقاطها. (C) الصور التمثيلية لخلايا الخميرة التي تعبر عن mEos3.1 أحادية (يسار) وHSPE1 (يمين). الصور هي إسقاطات مجموع من شرائح confocal. وقد تم تصوير ما لا يقل عن خمسين زنزانة لدعم هذه الملاحظة. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4 ملامح DAmFRET تظهر سلوك التجميع الذاتي مماثلة من الإنسان ASCPYD: البروتين في S. cerevisiae وHEK293T الخلايا. (أ) قطع الكثافة التي تظهر AmFRET مقابل التركيز الدوري (بالكم) من mEos3.1 (يسار)، أو mEos3.1 تنصهر إلى WT (وسط) أو متحولة أحادية اللون من ASCPYD (يمين) في S. cerevisiae. (ب) صور من مقياس الخلايا، من الخلايا من البوابات السفلى والعليا (الألواح اليسرى والمركزية، على التوالي) تعبر عن WT ASCPYD؛ والخلايا التي تعبر عن ASCPYD R41E من البوابة المشار إليها (اللوحة اليمنى). (C) قطع الأراضي الكثافة التي تظهر AmFRET مقابل كثافة مقبول لنفس السلسلة من البروتينات كما هو الحال في (A) ولكن أعرب في خلايا HEK293T. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
DAmFRET هو الأسلوب الأكثر شمولا للكشف عن البروتين التجميع الذاتي في الجسم الحي. DAmFRET يجمع بين القراءة المباشرة للتفاعلات المتجانسة البروتين البروتين على مجموعة واسعة من التركيز، مع قرار خلية واحدة والإنتاجية العالية. القراءة المباشرة من DAmFRET وحقيقة أن البروتينات المنصهرة لا تتطلب توطين تحت الخلية محددة أو حالة غير قابلة للذوبان يلغي إيجابيات كاذبة ويمتد انطباقه إلى مجموعة واسعة من البروتينات في مواقعها الفرعية الأصلية. وتجدر الإشارة إلى أنه من خلال وضع علامات على العضيات ذات الفلوروفورات المتوافقة مع mEos3.1، مثل T-Sapphire وmCardinal، يمكن تحديد التوطين دون الخلوي لأشكال البروتينات القابلة للذوبان والمجمعة جنباً إلى جنب مع DAmFRET.
باستخدام مقياس تدفق التصوير كما هو موضح هنا، فإنه يأخذ 8 ساعة لتحليل لوحة 96 جيدا مع ما يقرب من 20،000 خلية مسورة في بئر. ومع ذلك، فإننا أيضا أداء بشكل روتيني DAmFRET مع قياس السيتومترات القياسية (غير التصوير) التي تحقق الإنتاجية أعلى بكثير (ما يصل إلى 20 عينة في الدقيقة الواحدة). في الواقع، أي تدفق مقياس السيتومتر مع الليزر 488 و 561 نانومتر مفصولة مكانيا خالية من القطع الأثرية أمبير سجل ويحتوي على PMTs المناسبة والمرشحات للكشف عن المانحة، فريت، وإشارات مقبول يكفي لأداء DAmFRET. في الوقت الحاضر، يأتي هذا المكسب في الإنتاجية على حساب معلومات التعريب وتحديد الحجم، بحيث يجب بعد ذلك تحليل التجميع الذاتي كدالة للتعبير البروتين يُعنى به بدلاً من التركيز. وهذه ليست مشكلة بالنسبة للتحليلات النوعية. وبالإضافة إلى ذلك، قد يكون من الممكن تقدير الحجم السيتوسي عن طريق دمج فلوروفور متميز طيفياً ببروتين "التدبير المنزلي" المحلي الذي يرتبط تعبيره ارتباطاً شديداً بحجم السيتوسول.
كما أظهرنا من خلال نشرنا لDAmFRET في كل من الخميرة وخلايا الثدييات، يمكن تكييف DAmFRET بسهولة مع أنظمة التعبير المختلفة. وهذا يمكّن من التجميع الذاتي للبروتينات لدراستها في سياقاتها الخلوية الأصلية. وعلاوة على ذلك، فإنه يوفر القدرة على مقارنة تجميع البروتين عبر نماذج زراعة الخلايا المتباينة على نطاق واسع لدراسة الحفاظ على الآليات التي تحكم تجميع البروتين الذاتي.
Disclosures
ولا يعلن صاحبا البلاغ عن أي مصالح متنافسة.
Acknowledgements
ونود أن نشكر جيف لانج، وجاي أونروه، وجيانتشنغ وو، وتاريك خان، وإلين كيتر على عملهم من أجل تطوير الإنعاب. وقد تم القيام بهذا العمل للوفاء، جزئيا، بمتطلبات البحث في رسالة الدكتوراه لT.S.K. وA.R.G كطلاب مسجلين في الجامعة المفتوحة، المملكة المتحدة، ومعهد أبراج للبحوث الطبية كلية الدراسات العليا، الولايات المتحدة الأمريكية، على التوالي. ويمكن الاطلاع على معلومات إضافية تتعلق بالفحص في https://doi-org.remotexs.ntu.edu.sg/10.1016/j.molcel.2018.06.016. يمكن الوصول إلى البيانات الأصلية التي تستند إليها هذه المخطوطة من مستودع البيانات الأصلية في Stowers على http://www.stowers.org/research/publications/libpb-1372. تم تمويل هذا العمل من قبل مدير المعهد الوطني للصحة جائزة الاستقلال المبكر DP5-OD009152، مارس من مؤسسة ديميس منحة رقم 5-FY17-32، ومعهد أبراج للبحوث الطبية.
وفيما يلي مساهمات المؤلفين. التصور: T.S.K., S.V., and R.H.; المنهجية: T.S.K., S.V., A.R.G., and A.B; التحقيق: S.V., T.S.K., and A.R.G.; التحليل الرسمي: S.V., and T.S.K. ; معالجة البيانات: T.S.K.; التصور: T.S.K, and S.V., Writing (Original Draft): S.V., and T.S.K.; الكتابة (مراجعة، تحرير): R.H., S.V., and T.S.K.; والحصول على التمويل: ر. ح.
Materials
| Name | Company | Catalog Number | Comments |
| 96 Well Plate | Axygen | P96-450R-C-S | |
| ASC 2-92 (mammalian plasmid) | rhm1.0095 | Available on request | |
| ASC 2-92 (R41E) (mammalian plasmid) | rhm1.0096 | Available on request | |
| ASC 2-92 (R41E) (yeast plasmid) | rhx2432 | Available on request | |
| ASC 2-92 (yeast plasmid) | rhx2431 | Available on request | |
| Centrifuge | Eppendorf | 5430R | "centrifuge" in text |
| CSM -Ura | Sunrise Science Products | 1004-100 | |
| Dextrose | EMD Millipore | DX0145-5 | |
| DMEM | Gibco | 11966025 | |
| EDTA | Sigma-Aldrich | EDS-500G | |
| FCS Express 6 | DeNovo | FCS Express 6 Flow | "flow cytometry software" in text |
| Fetal Bovine Serum | VWR Life Science | 45001-108 | |
| Flow Cytometer | BioRad | ZE5 | Non-imaging flow cytometer |
| FUGENE HD | Promega | E2311 | "transfection reagent" in text |
| Galactose | VWR Life Science | 0637-500g | |
| HSPE1 (yeast plasmid) | rhx1531 | Available on request | |
| Imaging Flow Cytometer | EMD Millipore | ImageStream X Mark II | "imaging flow cytometer" in text |
| Mammalian Cells | HEK293T | ||
| mEos3.1 (mammalian plasmid) | rhm1 | Available on request | |
| mEos3.1 (yeast plasmid) | rhx0935 | Available on request | |
| optiMEM | Gibco | 31985062 | "reduced serum media" in text |
| PBS | VWR Life Science | 45000-446 | |
| PenStrep | Gibco | 15070063 | |
| PFA | Sigma-Aldrich | P6148-1KG | |
| Photoconversion Lamp | OmniCure | S1000 | |
| Plasmid #54525 | Addgene | #54525 | "publicly available plasmid" in text |
| Titramax 1000 Plate Shaker | Heidolph Instruments | 1000 | "plate shaker" in text |
| Trypsin-EDTA | Gibco | 25200056 | |
| Yeast Strain | rhy1713 | Available on request- S288c (MATα lyp1Δ can1Δ::STE2pr_SpHIS5 his3Δ1 leu2Δ0 ura3Δ0 met15Δ0 cln3Δ0::GAL1pr_WHI5_hphMX) |
References
- Krissinel, E., Henrick, K. Inference of macromolecular assemblies from crystalline state. Journal of Molecular Biology. 372 (3), 774-797 (2007).
- Kühner, S., van Noort, V., et al. Proteome organization in a genome-reduced bacterium. Science. 326 (5957), 1235-1240 (2009).
- Marianayagam, N. J., Sunde, M., Matthews, J. M. The power of two: protein dimerization in biology. Trends in Biochemical Sciences. 29 (11), 618-625 (2004).
- Matthews, J. M., Sunde, M. Dimers, oligomers, everywhere. Advances in Experimental Medicine and Biology. 747, 1-18 (2012).
- Glover, J. R., Kowal, A. S., Schirmer, E. C., Patino, M. M., Liu, J. J., Lindquist, S. Self-seeded fibers formed by Sup35, the protein determinant of [PSI+], a heritable prion-like factor of S. cerevisiae. Cell. 89 (5), 811-819 (1997).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Michaels, T. C. T., Dear, A. J., Knowles, T. P. J. Stochastic calculus of protein filament formation under spatial confinement. New journal of physics. , (2018).
- Khan, T., Kandola, T. S., et al. Quantifying Nucleation In Reveals the Physical Basis of Prion-like Phase Behavior. Molecular Cell. 71 (1), 155-168 (2018).
- Cai, X., Chen, J., et al. Prion-like polymerization underlies signal transduction in antiviral immune defense and inflammasome activation. Cell. 156 (6), 1207-1222 (2014).
- Lu, A., Magupalli, V. G., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Zhang, M., Chang, H., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nature Methods. 9 (7), 727-729 (2012).
- Gietz, D., Jean, A., Woods, R. A., Schiestl, R. H. Improved method for high efficiency transformation of intact yeast cells. Nucleic Acids Research. 20 (6), 1425 (1992).
- Nishizawa, K., Kita, Y., Kitayama, M., Ishimoto, M. A red fluorescent protein, DsRed2, as a visual reporter for transient expression and stable transformation in soybean. Plant Cell Reports. 25 (12), 1355-1361 (2006).
- Luke, K., Apiyo, D., Wittung-Stafshede, P. Dissecting homo-heptamer thermodynamics by isothermal titration calorimetry: entropy-driven assembly of co-chaperonin protein 10. Biophysical Journal. 89 (5), 3332-3336 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved