Method Article
유세포분석으로 생체내 단백질 자가 조립 검출 및 특성화
요약
본 문서는 S. 세레비시아 및 HEK293T 세포 모두에서 단백질 자가 조립을 정량화하는 FRET 기반 유동 세포 분석 프로토콜에 대해 설명합니다.
초록
단백질 자가 조립은 단백질 기능을 제어하고 공간과 시간에 세포 과정을 구획화합니다. 그것을 연구하는 현재 방법은 낮은 감도, 간접 판독, 제한된 처리량 및 / 또는 단일 세포 해상도보다는 인구 수준에서 고통받습니다. 분산 양피플루오성 FRET 또는 DAmFRET : 우리는 이러한 모든 한계를 해결하는 흐름 세포 분석 기반의 단일 방법론을 설계했다. DAmFRET는 생체 내 감작 방출 FRET에 의해 단백질 자가 어셈블리를 감지하고 정량화하고, 효모에서 인간 세포에 이르는 모델 시스템 전반에 배포할 수 있으며, 단백질에 관계없이 민감한 단일 세포, 고처리량 판독을 달성합니다. 현지화 또는 용해도.
서문
상동성 단백질 상호 작용을 연구하는 아세, 또는 "자기 조립"은 단백질의 올리고메 상태와 용해도가 그들의 기능을 지시하기 때문에 중요합니다. 프로테오메는 호모 멀티머 1,2,3,4로풍부하지만 상대적으로 적은 단백질이 단량체로 기능합니다. 단백질은 또한 활동의 병리학적인 변경으로 이끌어 내는 긴장, 나이, 또는 잘못 조절 때문에 비차등으로 집합할 수 있습니다. 이러한 이벤트 또는 어셈블리의 물리적 특성을 조절하는 요인을 식별하는 것은 매우 어려운 경우가 많습니다.
단백질의 증가는 지금 단백질 조밀한 단계로 그밖 세포 성분에서 그들의 demixing 결과로 특별한 협력성 및 불확실한 stoichiometry를 가진 각자 집합하기 위하여 인식됩니다. 이들은 물방울과 젤과 같은 무질서한 응축수의 양식, 또는 아밀로이드 섬유와 같은 고도로 주문한 필라멘트의 양식을 취합니다. 후자와 관련된 형태 변동은 분자 수준5,6에서본질적으로 확률적으로 초기 형성 또는 핵 형성을 렌더링합니다. 핵 형성의 확률이 부피가 있는 스케일이기 때문에, 이러한 어셈블리의 형성은 살아있는 세포7,8의공간 적 경계에서 매우 확률적일 수 있다. 과식 핵 형성 제한 상 분리의 극단에서 프리온, 거의 자발적으로 핵을 핵화하지 않는 고도로 정렬 된 단백질 어셈블리, 하지만 일단 형성, 템플릿 자신의 자신의 성장을 무기한. ASC로 알려진 한 개의 단백질은 포유류 선천적 면역 세포의 활성에서 디지털 프리온과 같은 스위치를 실행합니다. ASC 자가 조립은 결합 병원체 또는 위험 관련 분자 패턴에 따라 올리고머화 된 특정 단백질과의 상호 작용에 의해 핵화됩니다. ASC 어셈블리는 차례로 프로카스파제-1을 자체 조립하고 활성화하여 세포9,10의사이토카인 성숙 및 발열로 이어진다. 그 어셈블리를 담당하는 ASC의 영역은 인간의 프로테오메에서 100 명 이상의 회원으로 구성된 죽음 영역 슈퍼 패밀리에 속한다. 선천적인 면역과 프로그램된 세포 사멸에 있는 죽음 도메인의 중추적인 역할에도 불구하고, 그들의 대부분은 아직 자기 집합에 관하여 특징이지 않았습니다. 이러한 거동을 가진 추가 단백질의 발견 및 특성화는 단백질 자가 조립의 직접적인 단세포 판독에 의해 크게 촉진될 것이다.
크기 배제 크로마토그래피 및 초원심분리와 같은 단백질 자가 조립을 연구하는 고전 적 단백질 생화학 접근법은 주로 인구 수준 평가에 국한됩니다. 그러나, 핵 형성 제한된 상 전이에서 유래하는 세포 간 이질성은 이 세부 수준으로 모델링될 수 없습니다. 형광 현미경 검사법에 근거를 둔 단세포 접근은 이 기능을 회복합니다, 그러나 정확하게 핵을 정량화하거나 희소한 어셈블리를 검출하기 위하여 필요한 처리량이 부족합니다. 또한 대부분의 효소 및 사전 아밀로이드 올리고머와 같은 수용성 자가 조립체는 너무 작고 이동성이 있어 표준 광 현미경 검사법으로 해결할 수 없습니다. 그들은 형광 상관 분광법과 같은 보다 정교한 접근법에 의해 검출될 수 있지만, 이들은 세포 수와 처리량에서 매우 제한적입니다.
FRET 및 분할 형광부 보완과 같은 단백질 조립의 근접 기반 어설션은 이러한 문제에 대한 잠재적인 해결책을 제공합니다. 그러나, 이들은 일반적으로 FRET의 경우 보상적 태그-공여자 및 수용기 형광소에 융합된 관심의 단백질을 발현하는 2개의 상이한 구성물의 사용을 요구한다. 이것은 실험적인 처리량을 타협하고 또한 기증자와 수용자의 상대적인 수준에 있는 세포 간 변이로 인해 감도를 감소시킵니다. 이를 우회하기 위해, 우리는 하나의 구조가 기증자 및 수용자 태그 단백질을 모두 표현할 수 있도록 광전환 형광포, mEos3.111을사용하는 분석방법을 설계했습니다. 변환되지 않은 mEos3.1 (GFP와 같은 기증자)의 방출 스펙트럼은 분자가 근접할 때 FRET가 발생할 수 있도록 포토 컨버터블 mEos3.1 (dsRed와 같은 수용자)의 여기 스펙트럼과 충분히 겹칩니다(<10 nm). 따라서, 세포를 경험적으로 결정된 405 nm 광량에 노출시킴으로써, 총 mEos3.1의 최적 분율을 수용자 형태로 포토컨버터게 변환함으로써, 우리는 여러 샘플에 걸쳐 기증자 및 수용자의 일관되고 재현 가능한 상대적 수준을 달성하고, 표현 수준 및 실험을 할 수 있습니다. 우리는 561 nm 빛으로 직접 또는 간접적으로 (기증자로부터의 에너지 전송에 의해) 488 nm 빛 (즉, 과민 방출 FRET)으로 흥분 할 때 수용자 형광을 측정합니다. 우리는 이 두 값의 비율로 단백질 집합을 보고하고 양피불소화 FRET 또는 AmFRET를 기간합니다.
유세포분석으로 단백질 농도를 계산하기 위해 먼저 mEos3.1로 태그가 지정된 Spc42의 평균 형광 강도를 계산합니다. 효모 세포는 Spc42의 대략 1000 분자를 포함하기 때문에, 우리는 그 때 단 하나 형광 녹색 mEos3.1 분자의 형광 강도를 계산합니다. 모든 세포 농도에서 짝수 광변환을 활용함으로써(그림1E),우리는 광변환 다음의 모든 수용자 강도에 대한 총 mEos3.1 형광 값을 상관시낸다. 우리는 그 때 관심 있는 단백질의 총 세포토솔 농도를 얻기 위하여 대략적인 세포토솔성 부피 (화상 진찰 교류 세포측정을 사용하여 결정된 대로)에 의하여 형광 성 단백질의 총 두더지의 수를 분할할 수 있습니다. 정확한 계산은 원고 8을 참조하십시오.
효모에서 2μ 플라스미드에서 mEos3.1 융합 단백질을 발현함으로써, 우리는 모든 샘플 8에서 약천 배의 단백질 농도를 조사합니다. 우리는 형질전환 도중 플라스미드 섭취량에 있는 변이의 미덕에 의해 HEK293T 세포에서 동일을 달성하고, 그러므로 가변 복사 수.
수천 개의 세포에 대한 AmFRET 또는 DAmFRET의 결과 분포는 관심 있는 모든 단백질에 대해 시토솔에서 자가 조립의 농도 의존성을 밝혀낸다. 전반적으로 DAmFRET는 감도, 처리량 및 재현성의 전례없는 조합으로 단백질 자가 조립을 발견하고 특성화할 수 있는 방법을 나타냅니다.
이미징 세포계를 사용하면 생체 내 단백질 농도 측정을 얻을 수 있지만, 이러한 세포계는 아직 대부분의 연구 기관에서 사용할 수 없습니다. 그럼에도 불구하고, DAmFRET는 단백질 발현의 범위에 걸쳐 단백질 조립의 분포를 얻기 위해 전형적인 비 이미징 세포계에서도 실행될 수 있다.
프로토콜
1. 담프렛 분석에 대한 사카로미세세세리바시아의 준비
- 표준 리튬 아세테이트 프로토콜12를 사용하여 mEos3.1로 C 또는 N 종점에서 태그된 관심 있는 단백질 8을 발현하는 2μ갈락-유도성 플라스미드로 실험적으로 관련 효모 균주를 변형시킨다.
- 액체 배양에서 효모를 성장시다.
- 모든 질의 단백질에 대해, 접종 효모 콜로니(형질전환)에서, 각각 200 μL의 적절한 비유도 성장 매체(즉, 2% 덱스트로스, 효모 질소 염기 및 플라스미드선택을 위한 아미노산을 함유하는 매질)를 96웰 플레이트에서 ( 그림1C)를 참조하십시오.
- 플레이트 셰이커상에서 흔들면서 세포를 인큐베이션(재료 표참조)에서 1.5 mm 궤도에서 1200 rpm에서 30°C에서 16시간 동안 배양한다.
- 관심 있는 유전자의 발현을 유도한다(16h-일부 단백질에 대한 대표적인 프로토콜은 더 많거나 적은 시간이 걸릴 수 있다).
- 16시간의 유도에 이어, 실온에서 2분 동안 2200 x g에서 플레이트를 회전시다(RT0에서 샘플을 펠릿한다).
- 강력한 반전으로 미디어를 제거합니다. 적절한 유도 매체의 200 μL로 세포를 다시 일시 중단합니다 (즉, 플라스미드의 선택을 위한 2% 갈락토제, 효모 질소 염기 및 아미노산을 함유하는 매체). 그림 1C를참조하십시오.
- 12 시간 동안 30 °C에서 흔들면서 세포를 배양하였다.
- 원심분리기 (재료 표참조) 2200 x g의 플레이트를 RT에서 2 분 동안 샘플을 펠렛합니다. 강력한 반전으로 미디어를 제거합니다. 유도 매체의 200 μL로 세포를 다시 일시 중단하십시오.
- 30°C에서 1200 rpm에서 1200 rpm에서 추가로 4시간 동안 흔들면서 세포를 인큐베이트한다. 자동 형광을 줄이기 위해 DAmFRET를 실행하기 4 시간 전에 새로운 미디어에서 이러한 재서스펜션이 발생해야합니다.
2. 포유류 플라스미드 생성
- 관심 있는 유전자와 그 사이에 링커를 삽입하는 자리 표시자와 함께 구성 프로모터 및 mEos3.1을 가지는 포유류 벡터를 구성한다.
참고 : 우리는 다음과 같은 수정과 함께 공개적으로 사용할 수있는 플라스미드 (재료의 표참조)에서 골든 게이트 호환 벡터, M1을 구성 : 기존의 BsaI 사이트는 점 돌연변이 G에 A에 의해 제거되었다 (위치에 3719 에 증착에 따라 시퀀스)를 참조하십시오. mEos3.1은 I157V에서 형광포의 부위 지시 돌연변이 발생을 사용하여 수득하였다. 반전된 BsaI 부위에 4x(EAAAR) 링커가 삽입되었고, 깁슨 어셈블리에 의해, CMV 프로모터와 mEos3.1 사이의 프레임 내로 최종 M1 벡터를 생성하였다. 단백질 발현은 CMV 인핸서 및 프로모터에 의해 구동된다; 및 SV40 폴리아데닐화 신호에 의한 전사 종단. - 구성된 벡터와 호환되는 삽입 라이브러리를 만듭니다.
참고 : 우리는 CMV 프로모터와 4x (EAAAR) - mEos3.1 사이의 M1에 결찰을위한 BsaI 사이트에 의해 측면 합성 선형 조각 (재료의 테이블 참조)로 골든 게이트 어셈블리에 대한 우리의 삽입을 주문합니다.
3. 포유류 세포 배양 및 형질 감염
- DMEM에서 의 배양 HEK293T 세포 + 10% FBS + 5% CO2에서 37°C에서 1x PenStrep 배지.
- 형질감염 전날, 종자 5 x 105 세포를 2 mL의 매체로 6 웰 플레이트에.
- 형질감염 시약을 사용하여 플라스미드 DNA 2 μg를 가진 트랜스펙트 세포 (재료 표참조)의 비율로 3:1 (형질감염 시약 :DNA). 감소 된 혈청 매체의 150 μL에서 성분을 혼합하고 (재료 표참조) 15 분 동안 RT에서 배양하고 각 웰에 혼합물을 추가하고 단백질 발현을 위해 48 시간 동안 배양하십시오.
- 에피노레시엑션 현미경(488 nm 여기, 515 nm 방출)에 의해 24시간 후 단백질 발현을 확인하였다.
4. DAmFRET 분석에 대한 포유류 세포의 준비
- 48시간 의 단백질 발현 후, 각 우물에서 매체를 제거하고 37°C의 1 mL로 세포를 조심스럽게 세척하여 인산완충식염수(PBS)를 하였다. 세척 후, PBS를 흡인한다.
- 트립신 에틸렌디아미네테트라아세트산 0.5 mL 추가 (EDTA) (0.25%) 37 °C에서 5 분 동안 배양하십시오.
- 0.5mL의 완전한 DMEM 미디어를 각 웰에 추가하고 셀을 다시 일시 중단하고 큰 덩어리가 보이지 않도록 합니다.
- 각 웰의 전체 부피를 1.5 mL 튜브로 옮김.
- 실온(RT)에서 1000 x g에서 5분 동안 세포를 회전시다.
- PBS + 10 mM EDTA의 1 mL에서 상류및 재중단 세포 펠릿을 제거합니다.
- RT에서 1000 x g에서 5 분 동안 세포를 돌이시다.
- 상류를 제거하고 PBS에서 1 mL 4 % 파라 포름 알데히드 (PFA) + 10 mM EDTA에서 세포 펠릿을 다시 중단하십시오.
- 일정한 움직임으로 쉐이크 테이블에 5분 동안 세포를 고정합니다.
- RT에서 1000 x g에서 5 분 동안 세포를 회전시다.
- 상급체를 제거하고 1 mL의 PBS + 10 mM EDTA에서 세포 펠릿을 다시 중단합니다.
- RT에서 1000 x g에서 5 분 동안 세포를 회전시다.
- 상판을 제거하고 세포 분석 실행을위한 적절한 양의 버퍼로 세포를 다시 일시 중단하십시오 (96 웰 플레이트의 1 웰의 경우 PBS + 10 mM EDTA의 200 μL사용).
- 재중단된 세포를 둥근 바닥 96웰 플레이트의 한 웰로 옮김을 전송한다.
5. 분석에 대한 효모 및 포유류 세포의 광 변환
- UV 램프를 사용하여 커버가없는 마이크로 플레이트의 포토 컨버터 (재료 표참조)는 320-500 nm (보라색) 필터와 플레이트 위에 45cm 위에 위치한 빔 콜리메이터가 장착되어 있으며 흔들리는 동안 25 분 동안 지속됩니다. 이러한 조건은 플레이트의 빔 전력이 11.25 mW/ cm 2일 때, 총 광자 용량의 약 17,000 mJ / cm2 인 경우8이 적합합니다.
6. DAmFRET 데이터 수집
- 비 콜리선 488/561 레이저를 사용하여 세포계를 사용하는 분석 세포. 다음 데이터는 FRET 계산에 대한 최소 요구 사항입니다.
- 공여체 형광의 수집을 위해 488 nm 여기/ 515 nm 방출 채널을 사용한다.
- FRET 신호의 형광을 수집하기 위해 488 nm 여기/ 595 nm 방출 채널을 사용하십시오.
- 수용자 형광의 수집을 위해 561 nm 여기/ 595 nm 방출 채널(488/595 채널의 비공선)을 사용합니다.
- 자동 형광의수집을위한 405 nm 여기 / 457 nm 방출 채널을 사용합니다 8.
- 볼륨 계산을 위해 밝은 필드 이미지 채널을 사용합니다.
참고 : S. cerevisiae에 대한 이미징 세포계 설정은 낮은 유속및 높은 감도에서 다음과 같습니다 : 60x 목표; HEK293T 셀에 대한 레이저 파워는 15 mW에서 405 nm, 15 mW에서 488 nm, 20 mW에서 561 nm로 설정됩니다.HEK293T 셀에 대한 이미징 세포계 설정은 낮은 유량 및 고감도에서 다음과 같습니다: 40x 목표; 레이저 파워는 15mW에서 405 nm, 15mW에서 488 nm, 20mW에서 561 nm로 설정되었습니다.또한 우리의 이미징 세포계는 공간적으로 488 nm 및 561 nm 레이저 (즉, 다른 카메라에서)를 분리하여 플루오레플러에서 FRET의 명확한 해상도를 얻을 수 있도록 사용자 정의 설계되었습니다. Ce.
- 형광 양성 게이트 내에서 샘플당 20,000-50,000개의 단일 세포에 대한 데이터를 수집합니다.
- 게이트 단일 세포는 각각 낮은 종횡비 및 크거나 매우 작은 세포 영역을 가질 것이다 응집 된 세포 또는 파편반대로 높은 종횡비 및 작은 세포 영역에 의해.
참고: 비이미징 세포계의 등가 파라미터는 대략적인 셀 크기에 대한 FSC(순방향 산란)이고 셀 세분성에 대한 SSC(측면 산란)입니다. 또한 단일 셀 게이팅의 프록시로 FSC 펄스 높이 대 펄스 폭을 사용합니다. 또한 세포계의 감도 상한을 초과하는 형광 값이 있는 이벤트를 수집하지 않는 것이 중요합니다. 이미징 세포계에서는 수집한 모든 형광 채널에 대한 포화 한계보다 1픽셀 미만의 원시 최대 픽셀 값으로 이벤트 컬렉션을 제한합니다. 마찬가지로, 기존의 유동 세포계의 경우 가장 높은 강도의 저장소에 있는 데이터 포인트(감지의 동적 범위를 벗어난 이벤트를 포함)를 분석해서는 안 됩니다.
- 게이트 단일 세포는 각각 낮은 종횡비 및 크거나 매우 작은 세포 영역을 가질 것이다 응집 된 세포 또는 파편반대로 높은 종횡비 및 작은 세포 영역에 의해.
7. 데이터 분석
- 순수 응집자 신호(13)에 대해 mEos3.1의 적색 형태와 유사한 스펙트럼을 가지는 순수 공여자 신호 및 단조로운 DsRed2에 대해 비광변환 된 mEos3.1 샘플을 사용하여 보정을 수행한다. 감도를 높이기 위해, FRET 검출기 채널이 분석 프로그램에서 유출 대상으로 간주되도록 하십시오.
- 게이트 샘플은 형광 양성인 단일 세포만을 선택합니다(그림 2에서와 같이).
- 총 FRET 신호(488ex/595em)의 비율로 AmFRET 파라미터를 총 FRET 수락기(561ex/595em) 신호로 나눈 값입니다.
- 유세포분석 소프트웨어를 사용하여 데이터를 시각화합니다(재료 표참조).
참고 : 이 연구에서 S. cerevisiae에 대한 세포질 농도는 칸 외 8에서와 같이 아래 설정으로 계산되었습니다. 데이터 분석은 유세포분석 소프트웨어를 사용하여 수행하였다(재료 표참조).
결과
puncta를 형성하지 않는 올리고머의 검출
우리는 이전에 형광 현미경 검사법에 의해 검출될 수 있는 큰 단백질 어셈블리의 대형 의 형성에서 전형적으로 초래하는 단백질 상 분리의 특성화를 위해 DAmFRET를 적용했습니다. DAmFRET가 회절 제한 단백질 어셈블리에 적용가능성을 입증하기 위해, 우리는 빛 현미경검사법에 의해 시각화되기에는 너무 작은 이산 호모-헵타머를 형성하는 생화학적으로 잘 특성화된 단백질을 분석했습니다: 인간 코샤페로닌, HSPE114. 우리는 mEos3.1 단독으로, 또는 HSPE1-mEos3.1를 발현하는 효모 세포의 DAmFRET 프로파일을 비교했습니다. 후자는 균일 한 긍정적 인 AmFRET 값을 나타내고, 전자는무시할 만한 AmFRET (그림 3A)를 나타냈다. 이미징 유동 세포계에 의해 취득된 세포의 이미지는 (재료표참조) mEos3.1- 및 HSPE1-mEos3.1 발현 세포 모두에 대한 모든 채널-공여자, FRET 및 수용자에서 확산 형광을 밝혀냈다(그림3B). 더 높은 광학 적인 해결책에서 이 사실 인정을 확인하기 위하여는, 우리는 세포의 다중 필드를 위한 z 스택을 붙잡기 위하여 공초점 현미경 검사법을 이용했습니다. 실제로, 형광은 세포가 HSPE1-mEos3.1 또는 형광단 단독을 발현하는지 여부(도 3C)를 검출할 수 없는puncta 없이 시토솔 전체에 균일하게 분포되었다. HSPE1의 특징 K d는 우리 시스템의 감도보다 약간 낮은 약 3 μM이며, 따라서 우리는이 개별 호모 올리고머에 대해 예상되는 농도에 대한 FRET의 지그모이드 관계를 관찰하지 않습니다. 그럼에도 불구하고, 우리는 DAmFRET가 단세포 분해능에서 생체 내에서 수용성 호모 올리고머화를 강력하게 검출한다는 결론을 내립니다.
핵 형성 제한 어셈블리 검출
DAmFRET가 프리온과 같은 핵 형성 제한 어셈블리와 이산 호모 올리고머를 구별하는 능력을 보여주기 위해 인간 인플루언서 단백질 ASC를 분석했습니다. WT ASCPYD는 생체 내에서필라멘트를 형성하는 반면, ASCPYD의 비활성 R41E 돌연변이체는9,10이아니다. 우리는 효모 세포에서 mEos3.1 단독, 또는 mEos3.1 WT 또는 R41E ASCPYD에융합된 것을 발현했습니다. 불소 단독 또는 ASCPYD의 돌연변이 형태를 발현하는 효모 세포는 전체 농도 범위에서 무시할 수 있는 AmFRET를 나타내며, 자가 상호작용할 수 없음을 나타낸다. 대조적으로, WT ASCPYD는 두 개의 인구로 DAmFRET 프로파일을 나타냈다: 무시할 수 있는 AmFRET를 가진 하나 및 높은 AmFRET를 가진 다른 (그림4A). 형광 이미지(도 4B)에의해 확인된 바와 같이, 이들 집단은 수용성 단백질만을 함유하거나 대신에 대부분 자가 조립된 단백질을 각각 함유하는 세포를 나타낸다. 인구 간의 불연속적 관계, 그리고 중첩 된 농도에서 발생 한다는 사실은 핵 형성 장벽 단백질의 단일 형태를 안정화 하 고 실험의 기간 동안 조립에서 그것을 유지할 수 있습니다 나타냅니다. 8. 두 집단 사이의 AmFRET의 간격은 핵이 발생하면 즉시 다른 단량체를 조립 된 형태로 템플릿화하고 AmFRET의 새로운 정상 상태를 달성한다는 것을 나타냅니다. DAmFRET는 점 돌연변이체 ASCPYD R41E가 이러한 발현 시스템에 의해 달성 가능한 농도에 걸쳐 핵형성을 방해했다는 선행 구조 데이터를 확증하였다(도4A).
포유류 세포에서 DAmFRET의 적용 가능성
효모 세포는 DAmFRET에 이상적인 숙주 세포이지만, 우리는 포유류 세포에 DAmFRET의 적용 가능성을 확장하고자했습니다. 기능성 ASC 폴리머에 의한 세포 사멸을 방지하기 위해 카스파제-1 발현이 부족한 HEK293T 세포에서 DAmFRET를 테스트했습니다. 우리는 그림 4A에서효모 세포에서와 마찬가지로 HEK293T 세포에서 동일한 단백질을 발현했습니다. HEK293T 세포에서 생성된 DAmFRET 프로파일은 효모 세포에서의 프로파일과 질적으로 유사하다(도4A,C). 따라서 DAmFRET는 세포 유형뿐만 아니라 현미경으로 보이는 풍록의 존재에 관계없이 높은 처리량으로 단일 세포 해상도에서 핵단백질 자가 어셈블리를 검출하고 정량화하는 생체 내 가장 다재다능한 방법입니다.

그림 1 : 실험설계 개요 S. 세레비시아. 이 그림은 칸 외 8에서 허가를 받아 조정되었습니다. (A) 2μ 플라스미드 맵은 관심 있는 단백질에 대한 개방 판독 프레임을 나타내고, 포토컨버터블 mEos3.1로 태그가 부착되고 유도성 프로모터에 의해 구동된다. (B) 효모 세포로 변형될 때, 2μ 복제 시스템은 세포 간 높은 카피 수 변동성을 유도한다. GAL1 프로모터로부터의 전사 잡음과 결합된 그 변이는, 세포의 집단에서 단백질 발현의 광범위한 분포를 초래한다. (C) 효모 DAmFRET 분석에 대한 실험 개요. 분석에 대한 건강한 세포를 보장하기 위해, 콜로니는 먼저 비 유도 탄소 공급원, 덱스트로오스를 함유하는 합성 배지에서 16시간 이상 증식을 위해 접종된다. 증식 후, 세포는 16시간 동안 유도 탄소 공급원, 갈락토스를 함유하는 합성 배지로 이송된다. 유도 다음, 세포는 405 nm 빛에 노출에 의해 부분적으로 균일하게 포토 변환됩니다. (D) 샘플은 이미징 유동 세포측정을 사용하여 분석됩니다. 녹색 및 빨간색 mEos3.1의 스펙트럼과 강도는 각각 FRET 기증자와 수용자에게 적합합니다. 서로 근접할 때, 하단 세포에 묘사된 중합체에서 발생하듯이, 적색 분자는 녹색 분자(FRET)의 여기시 형광을 것이다. (e) 광변환 시 긴밀한 선형 관계를 나타내는 기증자 대 수용자 강도의 플롯은 광변환의 효율성이 표현 수준에 의해 좌우되지 않음을 보여준다. (F) 다양한 mEos 태그 단백질을 발현하는 세포의 집단으로부터의 평균 수용자 대 기증자 의 산란도, 용해성 및 아밀로이드 형태 모두에서, 광변환의 효율이 융합에 의해 영향을 받지 않음을 보여주는 파트너 또는 용해도(오류 막대는 생물학적 삼중분의 표준 편차를 나타낸다). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
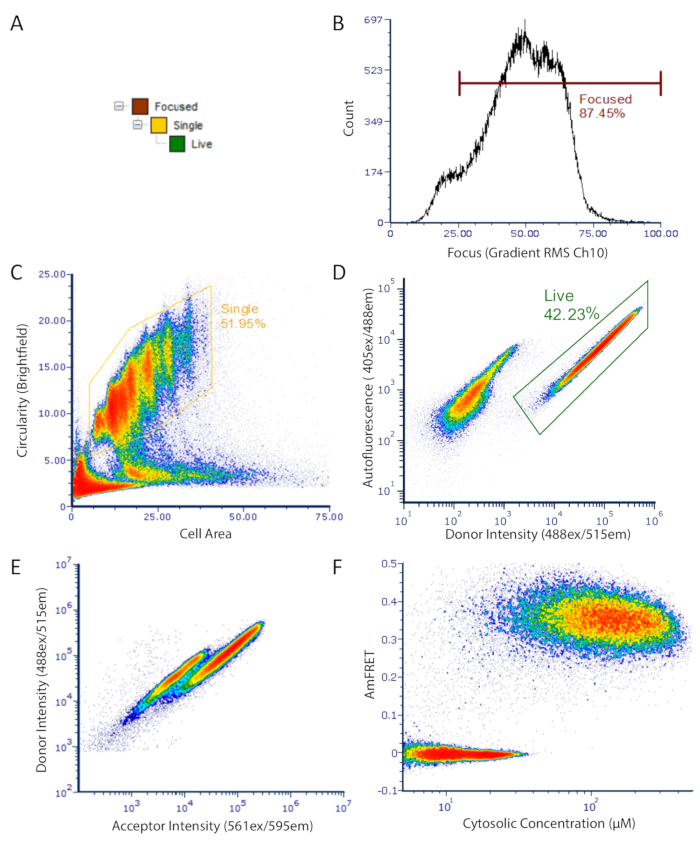
그림 2 : DAmFRET 게이팅 전략으로 유세포분석 데이터를 이미징합니다. 게이팅 전략은 낮은 자가형광을 가지고 형광 단백질을 발현하는 집중된, budded 단일 세포만을 분석하는 데 사용됩니다. (A) 분석을 위해 잘 초점을 맞춘 라이브, 단일 셀을 얻기 위해 게이트의 계층 구조. (B) 브라이트필드 채널의 그라데이션 RMS의 히스토그램. 이 측정을 통해 투과된 빛 에 적절하게 초점을 맞춘 셀을 선택할 수 있습니다. (C) 미직 구형 단일 세포의 문이 닫힌 모집단을 보여주는 영역 대 원형의 밀도 플롯. (D) 자가형광(Ch07) 대 공여자 형광(Ch02) 강도를 나타내는 밀도 플롯은 발현 세포(gated) 및 암흑 세포의 분리된 집단을 나타내는 것이다. (e) 기증자와 수용자 형광단 사이의 FRET에서 유래하는 세포의 서브세트에서 공여자 형광의 명확한 손실을 나타내는 수용자 강도 대 기증자의 분산도. (F) 최종 DAmFRET 플롯. 조립되지 않은 단백질을 함유하는 세포는 제로 AmFRET를 중심으로, 자가 조립된 단백질을 함유하는 세포는 양수 AmFRET 값을 나타낸다. 플롯에 있는 2개의 겹치는 인구는 아밀로이드와 같은 고차 어셈블리로 그 단백질을 핵화하는 유한한 방벽을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 : 유세포분석및현미경검사법에 의한 단일성 및 히포머 단백질의 대표적인 데이터. (A) 단모성 mEos3.1 단백질의 DAmFRET 프로파일(왼쪽)과 헤프타머 HSPE1은 mEos3.1(오른쪽)으로 태그가 지정되어 상동성 조립으로 인한 증가된 비메트릭 FRET를 나타냈다. (B) 세포계에서 이미지, mEos3.1을 발현하는 세포의 (왼쪽) 및 HSPE1 (오른쪽) 모든 캡처 된 채널에 도시된. (C) 단모 세포의 대표적인 이미지 [mEos3.1](왼쪽) 및 HSPE1(오른쪽)을 발현한다. 이미지는 공초점 슬라이스의 합계 투영입니다. 적어도 50개의 세포가 이 관찰을 확증하기 위해 이미지화되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : DAmFRET 프로파일은 인간 ASCPYD의 유사한 자체 조립 동작을 보여줍니다. 단백질에서 S. 세레비시아 및 HEK293T 세포. (a) MEos3.1(왼쪽) 또는 mEos3.1의 암프레트 대 세포농도(μM)를 나타낸 밀도 플롯은 S. 세레비시아에서AsCPYD(오른쪽)의 WT(중앙) 또는 단면화 돌연변이체에 융합된다. (B) 세포계에서 이미지, 하부 및 상부 게이트에서 세포의 (왼쪽 및 중앙 패널, 각각) WT ASCPYD를발현; 및 표시된 게이트(오른쪽 패널)의 ASCPYD R41E를 발현하는 셀의 (C) (A)에서와 동일한 일련의 단백질에 대한 AmFRET 대 수용자 강도를 나타내는 밀도 플롯은 HEK293T 세포에서 발현된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
DAmFRET는 생체 내에서 단백질 자가 조립을 검출하는 가장 포괄적인 방법입니다. DAmFRET는 단일 세포 분해능및 높은 처리량과 함께 광범위한 농도에 걸쳐 동종 단백질-단백질 상호 작용의 직접 판독을 결합합니다. DAmFRET의 직접적인 판독과 융합된 단백질이 특정 세포외 국소화 또는 불용성 상태를 필요로 하지 않는다는 사실은 거짓 긍정을 제거하고 그들의 기본 세포 내 소위치에서 광범위한 단백질에 적용가능성을 확장합니다. 특히, T-사파이어 및 mCardinal과 같은 mEos3.1과 관전적으로 호환되는 형광단으로 세포기관을 태그함으로써 수용성 및 조립된 형태의 단백질의 세포내국소화를 DAmFRET와 함께 결정할 수 있습니다.
여기에 설명된 바와 같이 이미징 유동 세포계를 사용하여, 웰당 약 20,000개의 문이 있는 세포를 가진 96웰 플레이트를 분석하는 데 8시간이 걸린다. 그러나, 우리는 또한 일상적으로 훨씬 더 높은 처리량 (분당 20 샘플)을 달성 표준 (비 이미징) 세포계와 DAmFRET를 수행합니다. 사실, 공간적으로 분리 된 모든 유량 세포계 488 및 561 nm 레이저로 로그 앰프 아티팩트가 없고 기증자, FRET 및 수용자 신호를 감지하기위한 적절한 PMT 및 필터가 DAmFRET를 수행하기에 충분합니다. 현재, 처리량의 이득은 현지화 정보 및 부피 결정의 비용으로 온다, 이러한 자기 조립은 농도보다는 단백질 발현의 함수로 분석되어야한다. 이는 정성적 분석에 문제가 되지 않습니다. 추가적으로, 그의 발현이 세포질 양과 단단히 상관관계가 있는 내인성 "하우스키핑" 단백질에 스펙트럼적으로 명백한 불소 를 융합해서 세포질 부피를 추정하는 것이 가능할 지도 모릅니다.
효모 및 포유류 세포에 DAmFRET의 배치를 통해 입증했듯이 DAmFRET는 다양한 발현 시스템에 쉽게 적응할 수 있습니다. 이것은 단백질의 자기 집합이 그들의 네이티브 세포 문맥에서 공부될 수 있게 합니다. 더욱이, 단백질 자가 조립을 지배하는 기계장치의 보존을 연구하기 위하여 넓게 발산하는 세포 배양 모형에 걸쳐 단백질 집합을 비교하는 기능을 제안합니다.
공개
저자는 경쟁적인 이익을 선언하지 않습니다.
감사의 말
제프 랭, 제이 운루, 젠정 우, 타리크 칸, 엘렌 케터가 분석 개발을 위해 노력한 것에 대해 감사드립니다. 이 작업은 부분적으로, 오픈 대학에 등록 된 학생으로 T.S.K. 및 A.R.G에 대한 박사 학위 학위 연구에 대한 요구 사항을 충족하기 위해 수행되었다, 영국, 의학 연구 대학원에 대한 Stowers 연구소, 미국. 추가 분석 관련 정보는 https://doi-org.remotexs.ntu.edu.sg/10.1016/j.molcel.2018.06.016 찾을 수 있습니다. 이 원고의 기본 원본 데이터는 http://www.stowers.org/research/publications/libpb-1372 Stowers 원본 데이터 저장소에서 액세스할 수 있습니다. 이 작품은 NIH 이사의 조기 독립 상 DP5-OD009152, Dimes 재단 보조금 제 5-FY17-32의 행진, 및 의학 연구를위한 Stowers 연구소에 의해 지원되었다.
작성자 기여는 다음과 같습니다. 개념화: T.S.K., S.V., 및 R.H.; 방법론: T.S.K., S.V., A.R.G., 및 A.B; 조사: S.V., T.S.K., 및 A.R.G.; 공식 분석: S.V., 및 T.S.K. ; 데이터 큐레이션: T.S.K.; 시각화: T.S.K, S.V., 쓰기(원본 초안): S.V., 및 T.S.K.; 쓰기 (검토, 편집): R.H., S.V., 및 T.S.K.; 및 자금 조달 인수: R.H.
자료
| Name | Company | Catalog Number | Comments |
| 96 Well Plate | Axygen | P96-450R-C-S | |
| ASC 2-92 (mammalian plasmid) | rhm1.0095 | Available on request | |
| ASC 2-92 (R41E) (mammalian plasmid) | rhm1.0096 | Available on request | |
| ASC 2-92 (R41E) (yeast plasmid) | rhx2432 | Available on request | |
| ASC 2-92 (yeast plasmid) | rhx2431 | Available on request | |
| Centrifuge | Eppendorf | 5430R | "centrifuge" in text |
| CSM -Ura | Sunrise Science Products | 1004-100 | |
| Dextrose | EMD Millipore | DX0145-5 | |
| DMEM | Gibco | 11966025 | |
| EDTA | Sigma-Aldrich | EDS-500G | |
| FCS Express 6 | DeNovo | FCS Express 6 Flow | "flow cytometry software" in text |
| Fetal Bovine Serum | VWR Life Science | 45001-108 | |
| Flow Cytometer | BioRad | ZE5 | Non-imaging flow cytometer |
| FUGENE HD | Promega | E2311 | "transfection reagent" in text |
| Galactose | VWR Life Science | 0637-500g | |
| HSPE1 (yeast plasmid) | rhx1531 | Available on request | |
| Imaging Flow Cytometer | EMD Millipore | ImageStream X Mark II | "imaging flow cytometer" in text |
| Mammalian Cells | HEK293T | ||
| mEos3.1 (mammalian plasmid) | rhm1 | Available on request | |
| mEos3.1 (yeast plasmid) | rhx0935 | Available on request | |
| optiMEM | Gibco | 31985062 | "reduced serum media" in text |
| PBS | VWR Life Science | 45000-446 | |
| PenStrep | Gibco | 15070063 | |
| PFA | Sigma-Aldrich | P6148-1KG | |
| Photoconversion Lamp | OmniCure | S1000 | |
| Plasmid #54525 | Addgene | #54525 | "publicly available plasmid" in text |
| Titramax 1000 Plate Shaker | Heidolph Instruments | 1000 | "plate shaker" in text |
| Trypsin-EDTA | Gibco | 25200056 | |
| Yeast Strain | rhy1713 | Available on request- S288c (MATα lyp1Δ can1Δ::STE2pr_SpHIS5 his3Δ1 leu2Δ0 ura3Δ0 met15Δ0 cln3Δ0::GAL1pr_WHI5_hphMX) |
참고문헌
- Krissinel, E., Henrick, K. Inference of macromolecular assemblies from crystalline state. Journal of Molecular Biology. 372 (3), 774-797 (2007).
- Kühner, S., van Noort, V., et al. Proteome organization in a genome-reduced bacterium. Science. 326 (5957), 1235-1240 (2009).
- Marianayagam, N. J., Sunde, M., Matthews, J. M. The power of two: protein dimerization in biology. Trends in Biochemical Sciences. 29 (11), 618-625 (2004).
- Matthews, J. M., Sunde, M. Dimers, oligomers, everywhere. Advances in Experimental Medicine and Biology. 747, 1-18 (2012).
- Glover, J. R., Kowal, A. S., Schirmer, E. C., Patino, M. M., Liu, J. J., Lindquist, S. Self-seeded fibers formed by Sup35, the protein determinant of [PSI+], a heritable prion-like factor of S. cerevisiae. Cell. 89 (5), 811-819 (1997).
- Tanaka, M., Collins, S. R., Toyama, B. H., Weissman, J. S. The physical basis of how prion conformations determine strain phenotypes. Nature. 442 (7102), 585-589 (2006).
- Michaels, T. C. T., Dear, A. J., Knowles, T. P. J. Stochastic calculus of protein filament formation under spatial confinement. New journal of physics. , (2018).
- Khan, T., Kandola, T. S., et al. Quantifying Nucleation In Reveals the Physical Basis of Prion-like Phase Behavior. Molecular Cell. 71 (1), 155-168 (2018).
- Cai, X., Chen, J., et al. Prion-like polymerization underlies signal transduction in antiviral immune defense and inflammasome activation. Cell. 156 (6), 1207-1222 (2014).
- Lu, A., Magupalli, V. G., et al. Unified polymerization mechanism for the assembly of ASC-dependent inflammasomes. Cell. 156 (6), 1193-1206 (2014).
- Zhang, M., Chang, H., et al. Rational design of true monomeric and bright photoactivatable fluorescent proteins. Nature Methods. 9 (7), 727-729 (2012).
- Gietz, D., Jean, A., Woods, R. A., Schiestl, R. H. Improved method for high efficiency transformation of intact yeast cells. Nucleic Acids Research. 20 (6), 1425 (1992).
- Nishizawa, K., Kita, Y., Kitayama, M., Ishimoto, M. A red fluorescent protein, DsRed2, as a visual reporter for transient expression and stable transformation in soybean. Plant Cell Reports. 25 (12), 1355-1361 (2006).
- Luke, K., Apiyo, D., Wittung-Stafshede, P. Dissecting homo-heptamer thermodynamics by isothermal titration calorimetry: entropy-driven assembly of co-chaperonin protein 10. Biophysical Journal. 89 (5), 3332-3336 (2005).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유