Method Article
Наночастицы полиэтиленимина покрытием оксида железа как средство для доставки малые интерферирующие РНК макрофаги In Vitro и In Vivo
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы описываем метод использования полиэтиленимина (PEI)-покрытием суперпарамагнетическим оксида железа наночастицы для transfecting макрофагов с siRNA. Эти наночастицы могут эффективно поставлять малых интерферирующих РНК к макрофагов в пробирке и в естественных условиях и молчание экспрессии генов цели.
Аннотация
Из-за их решающую роль в регулировании иммунной реакции Макрофаги непрерывно были предметом интенсивных исследований и представляют собой многообещающие терапевтические целевой многих расстройств, таких как аутоиммунных заболеваний, атеросклероза и рак. Сайленсинга генов, опосредованного системой РНК-интерференции является ценным подход выбора зонд и манипулировать функции макрофагов; Однако transfection макрофагов с siRNA часто считается чтобы быть технически сложным, и в настоящее время, доступны несколько методик, посвященный siRNA передачи макрофагов. Здесь мы представляем протокол использования наночастиц полиэтиленимина покрытием суперпарамагнетическим оксида железа (пей-SPIONs) в качестве транспортного средства для доставки целевых интерферирующей РНК макрофагов. Пей-SPIONs способны привязки и полностью конденсации siRNA, когда массовая доля Fe: siRNA достигает 4 и выше. В пробирке, эти наночастицы могут эффективно поставлять малых интерферирующих РНК в первичных макрофагов, а также в Макрофаг как RAW 264.7 клеток линии, без ущерба для жизнеспособности клеток при оптимальной дозе для transfection, и, в конечном счете, они вызывают малых интерферирующих РНК опосредованной целевой сайленсинга генов. Помимо используется для в vitro трансфекции siRNA, пей-SPIONs также являются перспективным инструментом для доставки siRNA макрофагов в естественных условиях. С учетом его комбинированных особенностей магнитные свойства и способность заставлять замолчать гена системно управляемых Пей-SPION/siRNA частицы, как ожидается, не только чтобы модулировать функции макрофагов, но и для включения макрофаги образы и отслеживаются. По сути, пей-SPIONs представляют собой простой, безопасный и эффективный синцитиального платформу для доставки siRNA макрофагов в пробирке и в естественных условиях.
Введение
Макрофаги являются тип innate иммунных клеток, распространен во всех тканях организма, хотя и в разных количествах. Производя различные цитокины и других посредников, они играют важнейшую роль в принимающей обороны против вторжения патогенных микроорганизмов, в ткани ремонт после травмы и в поддержании гомеостаза ткани1. Из-за их важности макрофаги непрерывно были предметом интенсивных исследований. Однако, несмотря на его распространенности в ген регулирования и исследования функции, малых интерферирующих РНК опосредованной генов меньше шансов на успех в макрофагах, потому что эти клетки — в частности, первичного макрофаги — зачастую трудно transfect. Это можно объяснить сравнительно высокой степени токсичности связанные с наиболее устоявшихся трансфекции подходов, в которых клеточной мембраны является химически (например, полимеров и липидами) или физически (например, путем электропорации и Джин пушек) нарушается позволить siRNA молекул через мембрану, тем самым значительно снижая макрофаги жизнеспособности2,3. Кроме того макрофаги, посвященный фагоцитов богаты деструктивные ферментов. Эти ферменты могут нарушить целостность siRNA, ослабляет эффективность глушителя, даже если ген специфического siRNA был доставлен в ячейке3,4. Таким образом эффективный siRNA Макрофаг целевой системы доставки необходимо защищать целостность и стабильность малых интерферирующих РНК во время доставки4.
Становится все более очевидным, что неблагополучных макрофаги замешаны в инициации и прогрессирования некоторых общих клинических расстройств как аутоиммунных заболеваний, атеросклероза и рак. По этой причине, модулирует функции макрофагов с, например, siRNA формируется как привлекательный методологию для лечения этих расстройств по5,6,7. Хотя был достигнут значительный прогресс, главной задачей стратегии на основе малых интерферирующих РНК лечения является бедным ячейки специфика системно управляемых siRNA и недостаточно siRNA поглощение макрофагами, которые соответственно приводят к нежелательным побочным эффектам. По сравнению с свободной нуклеиновые кислоты терапевтов, которые обычно не имеют оптимальное ячейки избирательности и часто приводят к негативным последствиям, загруженных наркотиков наночастиц (NPs), ввиду их спонтанной склонность быть захвачен ретикулоэндотелиальной системы,-цели могут быть спроектированы для пассивной ориентации макрофагов в естественных условиях, позволяя для улучшения терапевтической эффективности с минимальными побочными эффектами8. Текущий NPs, изучены для доставки молекул РНК включают неорганических nanocarriers, различные липосомы и полимеров9. Среди них полиэтиленимина (PEI), тип катионных полимеров, способных привязки и конденсации нуклеиновых кислот в стабилизированное NPs, показывает высокий РНК, обеспечивая потенциал9,10. PEI защищает нуклеиновые кислоты от ферментативного и nonenzymatic деградации, является посредником при их передаче через клеточную мембрану и способствует их внутриклеточного релиз. Хотя первоначально введено как реагент доставки ДНК, пей впоследствии был продемонстрирован быть привлекательной платформой для в естественных условиях доставки siRNA, либо локально или системно9,10.
Наночастицы суперпарамагнетическим оксида железа (SPIONs) показали большие перспективы в биомедицине, вследствие их магнитные свойства, биосовместимость, сопоставимого размера биологически важных объектов, высокий коэффициент площадь поверхности и объем и легко адаптируется поверхностью для bioagent крепления11. Например из-за их потенциальной полезности в качестве контрастного вещества и быстрое поглощение макрофагами, SPIONs появились как любимый клинический инструмент для изображения ткани макрофагами12. В то время как SPIONs также были широко изучены как нуклеиновые кислоты доставки транспортных средств11,13,14,15, к нашему знанию, литература содержит несколько сообщений о SPIONs как носитель для Макрофаг целевой siRNA доставки. Для доставки генов, SPIONs их поверхность обычно покрыты слоем гидрофильные катионных полимеров, на которые отрицательно заряженных нуклеиновые кислоты может быть электростатически привлекают и привязал. Здесь мы представляем метод синтеза SPIONs, поверхность которых изменяется с низким молекулярным весом (10 кДа), разветвленные Пей (пей-SPIONs). Затем эти магнитные nanoplatforms заняты уплотнить siRNA, образуя комплексы Пей-SPION/siRNA, позволяющие транспорта малых интерферирующих РНК в клетку. Мы причина что спонтанное фагоцитоза SPIONs клеток ретикулоэндотелиальной системы16, в сочетании с сильной способности привязки и конденсации нуклеиновых кислот, пей, оказывает Пей-SPIONs подходит для эффективной перевозки малых интерферирующих РНК в макрофаги. Представленные здесь данные поддерживают возможности подавления экспрессии гена Пей-SPION/малых интерферирующих РНК опосредованной в макрофагах в культуре, а также в естественных условиях.
протокол
Все методы, которые были проведены с участием живых животных в соответствии с животное уход и использовать руководящие принципы Юго-Восточный университет, Китай.
1. Подготовка Пей SPIONs
-
Подготовка олеиновая кислота модифицированных SPIONs
- Растворите FeCl3•6H2O и FeSO4•7H2O в воде под защитой N2.
- Добавьте 28 g O FeCl3•6H2и 20 г FeSO4•7H2O 80 мл обессоленной воды в стакан. Ввести N2 в воду через проводник стекла и размешать до полного растворения твердых веществ.
- Нагрейте смесь реакции до 72 ° C со скоростью перемешивания 800 об/мин, последующим добавлением 40 мл воды аммиака (28%). Мешайте в течение 5 мин.
- Добавить 9 мл олеиновой кислоты каплям в вышеупомянутых раствор и размешать в 72 ° C для 3 h.
- Прохладный полученный раствор до комнатной температуры (RT). Осадок решение через магнитной сепарации.
- Вымойте преципитат, содержащие SPIONs 3 x с абсолютного этилового спирта и, затем, разогнать осадок в 100 мл-гексана.
- Растворите FeCl3•6H2O и FeSO4•7H2O в воде под защитой N2.
-
Подготовка dimercaptosuccinic кислота модифицированных SPIONs
- Добавить 800 мг олеиновой кислоты (OA)-изменен SPIONs, диспергированных в 200 мл-гексана, и 400 мг dimercaptosuccinic кислоты (ДМСА) в 200 мл ацетона, разогнали в три шеи колбу в водяной бане при температуре 60 ° C.
Примечание: Чтобы определить концентрацию OA-модифицированных SPION, полученные на предыдущем шаге, Возьмите небольшой объем (например, 1 мл) SPION дисперсии, испарения гексана и весят полученный порошок. - Добавьте 200 мкл триэтиламин каплям в вышеупомянутых раствор с перемешивая при 1000 об/мин и орошения.
- После 5 h перемешивания и орошения получите черный осадок, магнитной сепарации.
- Разогнать гидрофильные SPIONs в деионизированной воде однородно, регулируя рН раствора с помощью Тетраметиламмония гидроксид.
- Добавить 800 мг олеиновой кислоты (OA)-изменен SPIONs, диспергированных в 200 мл-гексана, и 400 мг dimercaptosuccinic кислоты (ДМСА) в 200 мл ацетона, разогнали в три шеи колбу в водяной бане при температуре 60 ° C.
-
Подготовка Пей SPIONs
- Добавить ДМСА модифицированных SPION коллоидного раствора каплям в раствор (10 кДа) PEI в три шеи колбе 500 мл под механического перемешивания при 1000 об/мин 2 h (WFe: WPEI = 1:3).
Примечание: Заряд и размер Пей-SPIONs зависимости от соотношение WFe для WPEI. WFe: WPEI соотношение 1:3 может быть хорошей отправной точкой для синтеза Пей-SPIONs подходит для доставки siRNA. - Добавьте полученный раствор в трубу ультрафильтрации, имеющие молекулярный вес отсечки 100 кДа и содержание 15 мл; затем центрифуги на 5400 x g за 10 мин до оставшийся раствор 1 мл. Добавьте деионизированной воды решение сделать объемом 15 мл снова и повторите описанный выше процесс 10 x для получения конечного продукта. Затем фильтр решение через фильтр 0,22 мкм и хранения конечного продукта при 4 ° C.
- Определите концентрацию Fe Пей-SPIONs колориметрическим методом с использованием фенантролиновый17. Разбавить Пей-SPIONs с дейонизированной стерильной воды до концентрации 1 мг Fe/мл и хранить при 4 ° C.
- Разбавляют 10 мкл раствора Пей-SPION (1 мг Fe/мл) до 1 мл с дейонизированной водой; затем протестируйте его гидродинамические размер и Зета потенциальных устройством динамического рассеяния света.
Примечание: Подготовьте Пей-SPIONs в диапазоне около 30-50 Нм. В этом диапазоне размеров влияние размера NP на Связывание siRNA и клеточного поглощения не представляется значительным. Пей-SPIONs подшипник средняя Зета потенциал более чем 37 mV могут быть токсичными в диапазоне доз для transfection и цитотоксичность assay должны выполняться для обеспечения безопасности. Поверхности заряд и гидродинамические размеров наночастиц можно управлять в пределах требуемого диапазона, регулируя PEI содержание.
- Добавить ДМСА модифицированных SPION коллоидного раствора каплям в раствор (10 кДа) PEI в три шеи колбе 500 мл под механического перемешивания при 1000 об/мин 2 h (WFe: WPEI = 1:3).
2. Подготовка и электрофорез геля агарозы Пей-SPION/siRNA ЯИЭ
- Разбавьте siRNA с РНКазы свободной воды приносить конечная концентрация 20 мкм (0.26 мкг/мкл).
- Подготовьте пять свободных РНКазы microcentrifuge трубки помечены 0, 1, 2, 4 и 8. Метки представляют собой соотношение веса различных Fe: siRNA. Накапайте 3 мкл siRNA решения всех трубок (~0.8 мкг siRNA/трубки).
- Добавьте 0, 0,8, 1.6, 3.2, и 6.4 мкг Fe в виде Пей-SPIONs для трубки помечены 0, 1, 2, 4 и 8, соответственно. Сохраните объем общей выборки каждой трубы менее 20 мкл. Смешайте нежно закупорить вверх и вниз.
- Инкубируйте смеси на RT 30 мин разрешить комплекс формирования Пей-SPION/siRNA. В течение этого периода сделайте 3% агарозном гель с высокой чистоты агарозы.
Примечание: Дополнительные Пей-SPION/siRNA комплексы с другими Fe: siRNA соотношения (например, 5 или 6) могут быть подготовлены и испытаны. - Добавить 1 мкл 6 x ДНК загрузки буфера за 5 мкл пример и осторожно перемешать. Загрузить все образцы и запустить электрофорез на 5 V/см до тех пор, пока бромфеноловый синий мигрирует по мере две трети длины геля. Пятно гель бромидом ethidium (EB) для 15-20 мин.
Примечание: Следует использовать буфер электрофореза свежеприготовленные и решения EB. - Визуализируйте siRNA банды под УФ изображений системы. Проверьте Fe: siRNA коэффициенты на котором siRNA образует комплексы с Пей-SPIONs, и в результате, группы, представляющие бесплатно siRNA отсталых или не поддаются обнаружению.
3. transfection RAW264.7 макрофагов в пробирке
- Культура клетки RAW264.7 Макрофаг как мыши в 10 см блюдо с помощью DMEM завершить среднего содержащий 10% плода бычьим сывороточным (ФБС) на 100 ед/мл пенициллин за 100 мкг/мл стрептомицина при 37 ° C в 5% CO2 инкубатора.
- Один день до трансфекции, аспирационная среднего из клеток и промойте их фосфат амортизированное saline (рН 7,4). Добавьте 1 мл 0,25% трипсина на 10 см блюдо. Trypsinize RAW264.7 клетки около 5-10 мин при 37 ° C в 5% CO2 инкубатора.
- Когда большинство клеток отдельный (после 5-10 мин), добавьте 5 мл DMEM полного среднего блюдо, чтобы инактивировать трипсина. Накапайте вверх и вниз, чтобы разогнать кластеры клеток в одиночных камерах.
- Суспензию клеток передавать стерильные 15 мл Конические трубки. Центрифуги, на 300 g x 3 мин на RT. удалить супернатант.
- Ресуспензируйте клетки с 5 мл свежего DMEM полного среднего и подсчитать количество ячеек.
- Плита 9 x 104 клетки на хорошо в 6-ну плита с 2 мл полного DMEM среды и инкубировать при 37 ° C в 5% CO2 инкубатора для около 24 часов.
Примечание: При использовании тарелку другого размера, отрегулируйте плотность покрытием клеток пропорционально относительной площади поверхности так, что клетки достигают 80% confluency в то время transfection. - Когда ячейка confluency составляет 80%, извлеките носитель из клеток и заменить его с 1 мл раствора DMEM полного среднего за хорошо. Пластину можно вернуть инкубатора пока не пей-SPION/siRNA комплексы были подготовлены и готовы к использованию (около 30 мин).
- Подготовить Пей-SPION/siRNA комплексы: рассчитать количество комплексов Пей-SPION/siRNA, необходимые для transfection эксперимент. В 1,5 мл бесплатно РНКазы microcentrifuge трубку Смешайте соответствующее количество Пей-SPIONs с малых интерферирующих РНК в соотношении данной Fe: siRNA. К примеру, подготовить Пей-SPION/siRNA NPs, содержащие 100 мкг Fe в Fe: siRNA соотношении 4, добавить 100 мкл (1 мг Fe/мл) Пей-SPIONs до 96 мкл интерферирующей РНК (0.26 мкг/мкл), а затем осторожно смешивая его с микропипеткой. Инкубируйте 30 мин на RT.
Примечание: Подготовка тома Пей-SPION/siRNA комплекса, что составляет 10% сверх общей массы окончательный счет для любых непредвиденных потерь. Сделайте Пей-SPION/siRNA комплексов на низких Fe: siRNA коэффициенты, при которых молекул siRNA полностью погружены на ОПЭ-SPIONs и, следовательно, небольшое количество Пей-SPIONs может использоваться для минимизации потенциальных цитотоксичности. Экспериментальный экспериментов (гель отсталости пробирного) для оптимизации соотношения Fe: siRNA являются необходимыми. - Выньте пластину 6-ну из инкубатора (шаг 3.7). Добавьте необходимый объем Пей-SPION/siRNA комплекса каплям каждой скважины и вихрем пластину осторожно, чтобы обеспечить равномерное распределение. Возвращение пластину в инкубаторе до оценки клеточного поглощения или гена нокдаун эффективности (1-3 d).
Примечание: Transfecting макрофагов с Пей-SPION/малых интерферирующих РНК в концентрации ~ 15 мкг Fe/мл может максимизировать эффективность трансфекции при минимизации потенциальных цитотоксичности.
4. Системные доставка малых интерферирующих РНК в макрофагов крыс с экспериментального артрита
- Получение конкретного возбудителя бесплатный мужской крыс Вистара которые 7 недель. Приучать крыс для 7 d до использования и их обеспечения надлежащей пищей и водой. Вызвать артрит адъювантной (AA) у крыс как описано18.
- Подготовьте Пей-SPION/siRNA комплексы, как описано в шаге 3.8.
- Inject Пей-SPION/siRNA NPs (0,3 мг siRNA/кг) в AA крыс через Вену хвост. Оценки клеточного поглощения через, например, проточной цитометрии, ткань накопление через, например, в реальном времени флуоресценции изображений системы, или терапевтические эффекты на основе, например, клинические, гистологическое и рентгенографических анализы в нужный момент очка18.
Примечание: Для клеточных и тканевых накопление исследований, лечения крыс с одной инъекции желаемого ЯИЭ; для терапевтических исследований придать крыс с NPs протестированных 1 x в неделю в течение трех недель подряд.
Результаты
Размер и Зета потенциал Пей-SPIONs, приготовленные этот протокол были в диапазоне от 29-48 Нм (полиизопрена индекс: 0.12 - 0,23) и 30-48 м, соответственно. Они были стабильными в воде при температуре 4 ° C в течение 12 месяцев без очевидных агрегации. Чтобы оценить их siRNA привязки способности, пей-SPIONs были смешаны с малых интерферирующих РНК в различных соотношениях вес Fe: siRNA. Рисунок 1 показывает, что когда массовая доля Fe: siRNA достигает 4 и выше, Группа бесплатно siRNA полностью отсутствует, подразумевая успешных малых интерферирующих РНК привязки к PEI-SPIONs. Основной задачей PEI в биомедицинские приложения является его токсичности, который является результатом сильной положительного заряда, особенно на высокой молекулярной массой и высоких дозах. Как показано на рисунке 2А, пей-SPIONs с Зета потенциал 30.5 и 37 mV сделал не проявляют явное цитотоксичность в концентрациях до 30 мкг Fe/мл, что примерно вдвое выше, чем концентрация (15 мкг Fe/мл) обычно используется для transfection клетки. Однако Пей-SPIONs с потенциалом Зета 48 mV были токсичных даже при низкой дозе изучены (10 мкг Fe/мл). Таким образом Пей-SPIONs обладают заряда зависимых токсичности. Так как катионного заряда не важна для NP поглощение макрофагами19, мы предполагаем, что ПЭЙ-SPIONs с средний Зета потенциалом, не выше, чем 37 mV используются для передачи siRNA, хотя связывания siRNA бы уменьшить заряд в определенной степени и облегчить цитотоксичность18.
Чтобы проверить потенциального применения Пей-SPIONs для доставки siRNA макрофагов, transfection в vitro была выполнена с линией клеток мышиных макрофагов RAW 264.7. Как анализируемой проточной цитометрии, более 90% клеток были transfected дневно обозначенные Пей-SPION/siRNA комплексами на 15 мкг Fe/мл (рис. 2B). Что касается эффективности трансфекции был на самом деле никакой разницы между PEI-SPION/siRNA NPs, сформированные в Fe: siRNA вес пропорции 4 и 8, хотя, при условии, последний, NPs, которые были созданы были меньше по размеру и слабее в положительный заряд потому что меньшее количество малых интерферирующих РНК была загружена за частиц. Мы также оценку эффекта Пей-SPION/siRNA концентрации клеточных интернализации прусского синего окрашивания. Как показано на рис. 2 c, синие пятна в пределах transfected клеток были минимально обнаруживаемые на 7.5 мкг Fe/мл, но ясно видны на 15 мкг Fe/мл. Интересно, что повышение концентрации Пей-SPION/siRNA 32 мкг Fe/мл не увеличили окрашивание интенсивности, вероятно потому, что поглощение Пей-SPION/малых интерферирующих РНК был насыщенный при концентрациях около 15 мкг Fe/мл. Кроме того способность Пей-SPIONs для посредничества siRNA передача была подтверждена в первичной макрофаги18, и метод, представленные здесь эффективность трансфекции высокий малых интерферирующих РНК в крыса перитонеальных макрофагов, эквивалентный тому, который в RAW264.7 клетки. Перитонеальные макрофаги transfected с Пей-SPIONs, укрывательство определенных малых интерферирующих РНК, показали значительное снижение уровня мРНК целевого по сравнению с неспецифическими siRNA (Рисунок 2D), подразумевая, что малых интерферирующих РНК может скрыться от эндоцитоза пузырьки в Цитоплазма и охвата механизма RNAi.
Ранее мы также исследовали в естественных условиях клеточного поглощения системно управляемых Пей-SPION/siRNA комплексов у крыс с адъювантом артрит18. Мы проанализировали эффективность трансфекции Пей-SPION/siRNA фагоцитирующих макрофагов и nonphagocytic Т-лимфоцитов. Как показано на рисунке 3, CD11b + клетки более эффективно, чем CD3 + клеток в любой момент времени все органы рассмотрели, указав, что ПЭЙ-SPION/siRNA NPs преференциально целевой макрофаги18взял Пей-SPION/siRNA комплексов. В частности высокого уровня накопления NPs наблюдалось в воспаленные суставы18, предполагая, что ПЭЙ-SPION может быть привлекательной платформой для системных доставки siRNA терапии при ревматоидном артрите, чьи патогенез связан с дисфункции макрофагов и для которых местные siRNA администрация не является излюбленным выбором из-за участия нескольких органов болезни.
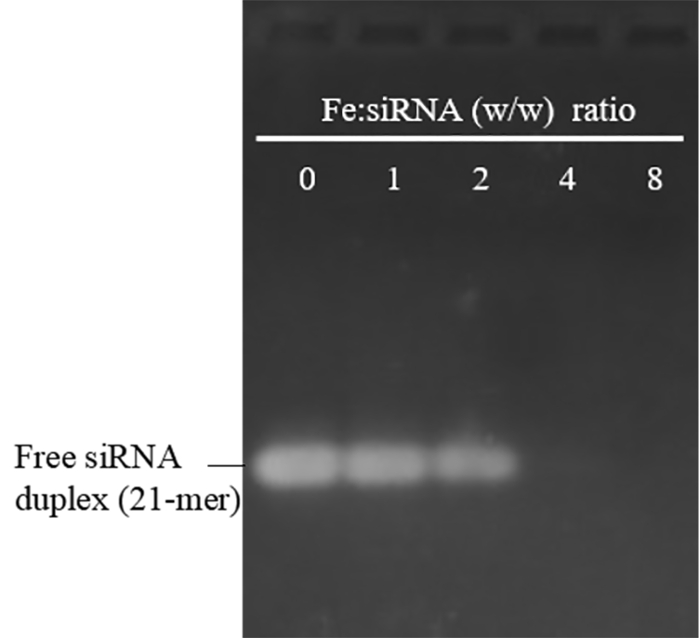
Рисунок 1: электрофорез геля агарозы Пей-SPION/siRNA комплексов формируется в различных соотношениях Fe: siRNA (w/w). Fe: siRNA коэффициент 0 представляет бесплатные siRNA дуплексы без Пей-SPIONS. Средний размер и Зета потенциал бесплатно Пей-SPIONs, здесь были 30 Нм и 45 МВ. малых интерферирующих РНК может полностью привязку к PEI-SPIONs когда Fe: siRNA соотношение достигает 4 и выше, в соответствии с ранее полученными результатами, используя Пей-SPIONs с средним размером 48 Нм и Зета потенциал 30,5 м18. Отсутствие отсталых групп (пей-SPION/siRNA комплексы) может отражать недоступность малых интерферирующих РНК к EB во время окрашивания, признаком сильного siRNA привязки, и/или конденсации способность Пей-SPIONs. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2: Биологическая характеристика Пей-SPION и пей-SPION/siRNA NPs. (A) Эта группа показывает жизнеспособность assay клетки. RAW 264.7 клетки относились для 16 h с указанной дозы Пей-SPIONs с учетом различных Зета потенциал и, затем, assay МТС была выполнена. Жизнеспособность клеток нормализуется против управления (без воздействия частиц). Данные являются среднее ± SD повторяющихся скважин. (B) Эта группа показывает гранулярных анализ потока Пей-SPION/Cy3-siRNA поглощения клетками RAW 264.7. Клетки инкубировали за 24 ч с 15 мкг Fe/мл (Верхняя панель) или 5 мкг Fe/мл (Нижняя панель) Пей-SPIONs complexed с Cy3-меченых малых интерферирующих РНК в соотношении (w/w) Fe: siRNA 4 и 8, соответственно. SiRNA неспецифические (NC) представляет собой не–флуоресцентные siRNA. M2: условного региона; PE-H: Cy3 интенсивности флуоресценции. Эффективность трансфекции siRNA Пей-SPIONs здесь (37,8 Нм, 48 МВ) был похож на предыдущие исследования с использованием Пей-SPIONs с средним размером 48 Нм и Зета потенциал 30,5 м18. (C) Эта группа показывает анализ Пей-SPION/siRNA поглощения визуализации клеточных железа месторождений. RAW 264.7 клетки инкубировали с 7,5, 15 и 32 мкг Fe/мл Пей-SPIONs (48 Нм, 30,5 МВ) complexed с малых интерферирующих РНК (Fe: siRNA = 8) и запятнана лазурь. Масштаб гистограммы являются 20 мкм. (D) этой панели отображается в vitro проверки глушителей эффективности siRNA, поставляемые Пей-SPIONs. Конкретной ориентации siRNA крыса цепи β-15 рецепторов ИЛ-2 было погружено на ОПЭ-SPIONs (48 Нм, 30,5 mV) в Fe: siRNA = 8 и, затем, transfected в перитонеальных макрофагов крыс. Интерферирующей NC был использован в качестве управления. Количественная ПЦР оценивали эффект экспрессию гена. Клетки инкубировали с комплексами на 15 мкг Fe/мл. Данные являются среднее ± SD тройные скважин. Группа D был изменен от Дуань и др. 18 с разрешения издателя. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 3: В естественных условиях клеточного поглощения Пей-SPION/siRNA ЯИЭ. Три артритом крысам вводили внутривенно с разовая доза-0,3 мг/кг, Cy3-siRNA сформулированы с Пей-SPION (48 Нм, 30,5 м). Крыса, вводится с PBS использовался в качестве элемента управления. Кровь, селезенке, печени, почек и воспаленные суставы были собраны на 2, 8 и 24 ч после инъекции. Клеточного поглощения Пей-SPION/Cy3-siRNA NPs оценивали проточной цитометрии с помощью анти CD3 (A) и (B) анти CD11b моноклональных антител. Процентные показатели поглощения Cy3-интерферирующей РНК в закрытом CD3 + или CD11b + клеток. Результаты, показанные здесь, представитель двух независимых экспериментов. Эта цифра была изменена от Дуань и др. 18 с разрешения издателя. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Макрофаги являются тугоплавкие transfect часто используемые синцитиального подходы, например, электропорация, Катионный липосомы и липидов видов. Здесь мы описали надежный и эффективный метод для transfect макрофагов с siRNA. Используя настоящий Протокол, свыше 90% Макрофаг как RAW 264.7 клеток (рис. 2B) и крыса перитонеальных макрофагов18 может transfected с siRNA без заметного ущерба жизнеспособность клеток. Этот метод зависит от доставки платформы Пей-SPION, который является nanocarrier, состоит из основного оксида железа и оболочки PEI. Таким образом первый ключевой шаг протокола является синтез Пей-SPIONs подходит для доставки siRNA. Обычно Пей покрытием SPIONs готовятся из олеиновой кислоты покрытием SPIONs лиганд обмен методом, в котором олеиновой кислоты непосредственно обменивались с поверхности SPIONs ПЭЙ или его производные15, генерации гидрофильные NPs с положительно заряженные поверхности. В дело, представленные здесь олеиновая кислота, ограничен на поверхности SPIONs был заменен водорастворимый dimercaptosuccinic кислоты, а затем Пей был загружен на SPION поверхности через электростатического взаимодействия. Этот метод является мягким и легко подготовить в больших количествах, и синтезированных NPs имеют отличную стабильность в воде20. Хорошо известно, что ПЭЙ цитотоксических, и токсичность сильно коррелирует с его молекулярный вес21. Для обеспечения безопасности, важным соображением при синтезировать Пей-SPIONs является, что эти частицы покрыты с низким молекулярным весом Пей, который является 10 кДа в настоящем Протоколе. Нежелательных токсическое действие PEI главным образом при посредничестве его положительный заряд; Таким образом, измерение потенциала Зета Пей-SPIONs имеет важное значение, и значение должно быть не выше, чем 37 МВ. Снижение положительный заряд можно достичь просто путем уменьшения содержания PEI. Еще один важный шаг для успешного применения этой системы доставки малых интерферирующих РНК является оптимизация Fe: siRNA коэффициент гель отсталости. Кажется разумным сделать Пей-SPION/siRNA комплексов при низкой Fe: siRNA соотношениях, под которой siRNA молекулы способны по-прежнему привязки к PEI-SPIONs. В таком случае может использоваться небольшое количество Пей-SPIONs, таким образом минимизируя свои потенциальные цитотоксичность.
В случае, если желаемый глушителей эффективности или терапевтический эффект не производится, проверьте эффективность трансфекции потока цитометрии или флуоресцентной микроскопии с помощью перевозчик загружен с дневно обозначенные siRNA. Кроме того Пей-SPION/siRNA поглощение может быть проверен обычных Прусский голубой окраски, который является достаточно чувствительным, чтобы обнаружить одной гранулы железа в клетки. Если эффективность трансфекции действительно мало, это может потребоваться для оптимизации трансфекции условий, таких как плотность клеток, transfection время и доза Пей-SPION/siRNA частиц. Мобильный номер прохода может также повлиять на эффективность трансфекции22. В большинстве случаев недостаточно глушителей эффект обусловлен в не недостаточно Пей-SPION/siRNA, поглощаемого подтверждением нынешней системы Пей-SPION для облегчения эффективной siRNA передачи макрофагов. Иногда сочетая несколько малые интерферирующие РНК ориентации же ген может быть хорошей стратегией для повышения эффективности нокдаун. Примечательно, что, хотя интерферирующих РНК обычно происходит в течение 24 ч трансфекции, начала и продолжительность сайленсинга генов зависит от текучести целевого объекта, скорость растворения и долговечность siRNA и даже концентрации сыворотки в среде. Таким образом время, конечно, эксперименты могут быть необходимы для точного определения времени точки максимального эффекта2,22. В естественных условиях применения Терапевтическая эффективность также зависит от того, и в какой степени, siRNA цели способствует фенотипов болезни; Таким образом выбор цели соответствующих малых интерферирующих РНК имеет решающее значение для достижения ожидаемых результатов.
Есть несколько преимуществ этого протокола для доставки siRNA макрофагов. (1) метод легко выполнить и дешевый способ производства Пей-SPIONs в больших количествах, и NPs производства являются стабильными в воде для более чем 12 месяцев, если они хранятся при 4 ° C. (2) SPIONs спонтанное фагоцитоз макрофагами способствует эффективной siRNA, пей-SPION-опосредованной передачи, что приводит к высоким трансфекции эффективности. Ожидается, что помимо RAW 264.7 клетки и крыса перитонеальных макрофагов, этот подход применима к другие линии клетки макрофагального и первичных макрофагов, до тех пор, как доза для transfection оптимизирован. (3) siRNA трансфекции быстро и легко проводить по сравнению с другими методами трансфекции макрофагов, например nucleofection, который является трудоемким и требует Nucleofector устройство2. (4) Пей-SPION может быть идеальным средством для доставки Макрофаг целевой системный малых интерферирующих РНК в некоторых моделях заболеваний. Макрофаги играют важную роль в развитии и прогрессировании различных хронических воспалительных заболеваний, а также опухоли; и одна заметная гистологические особенность этих заболеваний является ненормальные кровеносные сосуды с вытекающей эндотелия. Таким образом, ввиду повышения проницаемости и удержания эффект, системно управляемых загружен наркотиков NPs имеют тенденцию накапливаться в пораженной ткани и легко захвачен местными макрофагов, ведущих к расширенной специфичности, уменьшить побочные эффекты и улучшить Терапевтическая эффективность. В мышиной модели адъювантной артрита внутривенно вводят Пей-SPION/siRNA комплексы были рассмотрены на ~ 40% CD11b + клеток в течение первых 24 ч после инъекции18. В противоположность этому когда Катионный липосом была используется в качестве носителя для доставки Системные малых интерферирующих РНК в мышей, менее 5% CD11b + клеток в артритом суставов захваченного siRNA lipoplexes23. Кроме того ввиду их магнитные свойства, применение внешнего магнитного поля может далее способствовать накопление в тканях-мишенях Пей-SPION/siRNA комплексов и увеличить их клеточного поглощения. Также следует отметить, что таких малых интерферирующих РНК загружен NPs может использоваться не только для модулирует функции макрофагов, но и для визуализации макрофагов для предоставления диагностической информации, мониторинг эффективности лечения и предсказать клинические исходы пациентов12.
Однако существуют ограничения, связанные с настоящим Протоколом. Пей-SPION системы экспонатов узкий спектр дозировка для доставки siRNA. Максимальное поглощение произошел, когда RAW264.7 клетки подвергаются к PEI - SPION/малые интерферирующие РНК в концентрации 15 мкг Fe/мл (Рисунок 2B и 2 C). Повышение концентрации Пей-SPION/siRNA 32 мкг Fe/мл не привело к увеличению клеточного поглощения (рис. 2 c), но, напротив, может увеличить риск вызывая гибель клеток из-за внутренней токсичность PEI. С другой стороны снижение Пей-SPION/siRNA до 5 или 7,5 мг Fe/мл очевидно сокращение ее усвоение клетками RAW264.7 (Рисунок 2B и 2 C). Таким образом мы предлагаем, что оптимальная концентрация Пей-SPION/siRNA для в vitro трансфекции макрофагов ~ 15 мкг Fe/мл (конечная концентрация в скважине). Еще одно ограничение, которое необходимо принимать во внимание является возможный эффект Пей-SPIONs на активность макрофагов. Наночастицы могут вызвать иммунный ответ24, в зависимости от их модификации поверхности, поверхности заряд, размер, форма и даже о методологии, используемой для их синтеза. Mulens-Ариас et al. недавно сообщила, что ПЭЙ покрытием SPIONs вызвать активацию макрофага25. Метод синтеза Пей-SPION, представленные здесь значительно отличается от что Mulens-Ариас et al., и таким образом, ли подготовлен Пей-SPIONs на основе настоящего Протокола триггера активации макрофагов ожидает дальнейшего расследования. Однако, чтобы однозначно решить эту проблему, мы предполагаем, что, помимо complexed с схватка siRNA, само (пей-SPION только) транспортное средство Пей-SPION может служить в качестве другого элемента управления, при использовании настоящего Протокола. Наконец этот протокол не подходит для доставки ДНК из-за его относительно большого размера.
Таким образом мы представили здесь метод использования Пей покрытием SPIONs как средство для transfection малых интерферирующих РНК в макрофагах. Эти NPs можно эффективно поставлять siRNA увековечен макрофагов клеточных линий, а также основной макрофагов в пробиркеи функционально побудить сайленсинга генов, не затрагивая жизнеспособность клеток при оптимальной дозе для transfection. Кроме того, пей-SPIONs может использоваться для в естественных условиях доставки siRNA макрофаги, что делает его возможным для изображения, а также модулировать, макрофаги, чьи дисфункции вносит вклад в развитие и прогрессирование многих хронических воспалительных заболеваний и раковые заболевания.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа была поддержана Фонд национального естественных наук Китая (81772308) и Национальный исследовательский ключ и Программа развития Китая (№ 2017YFA0205502).
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | C11995500BT | Warm in 37°C water bath before use |
| Fetal bovine serum | Gibco | A31608-02 | |
| Penicillin/streptomycin (1.5 ml) | Gibco | 15140122 | |
| Tetrazolium-based MTS assay kit | Promega | G3582 | For cytotoxicity analysis |
| RAW 264.7 cell line | Cell Bank of Chinese Academy of Sciences, Shanghai, China | TCM13 | |
| Tissue culture plates (6-well) | Corning | 3516 | |
| Tissue culture dishes (10 cm) | Corning | 430167 | |
| RNase-free tubes (1.5 ml) | AXYGEN | MCT-150-C | |
| Centrifuge tubes (15 ml) | Corning | 430791 | |
| Trypsin | Gibco | 25200-056 | |
| Wistar rats | Shanghai Experimental Animal Center of Chinese Academy of Sciences | ||
| Bacillus Calmette–Guérin freeze-dried powder | National Institutes for Food and Drug Control, China | for inducing adjuvant arthritis in rats | |
| siRNA | GenePharma (Shanghai, China) | ||
| Cy3-siRNA | RiboBio (Guangzhou, China) | ||
| Polyethyleneimine (10 kDa) | Aladdin Chemical Reagent Co., Ltd. | E107079 | |
| Ammonia water | Aladdin Chemical Reagent Co., Ltd. | A112077 | |
| Oleic acid | Aladdin Chemical Reagent Co., Ltd. | O108484 | |
| Dimethylsulfoxide | Aladdin Chemical Reagent Co., Ltd. | D103272 | |
| FeSO4•7H2O | Sinopharm Chemical Reagent Co., Ltd | 10012118 | |
| FeCl3•6H2O | Sinopharm Chemical Reagent Co., Ltd | 10011918 | |
| Dimercaptosuccinic acid | Aladdin Chemical Reagent Co., Ltd. | D107254 | |
| ultrafiltration tube | Millipore | UFC910096 | |
| Tetramethylammonium hydroxide solution | Aladdin Chemical Reagent Co., Ltd. | T100882 | |
| Particle size and zeta potential analyzer | Malvern, England | Nano ZS90 |
Ссылки
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nature Reviews Immunology. 11 (11), 723(2011).
- Maeß, M. B., Wittig, B., Lorkowski, S. Highly efficient transfection of human THP-1 macrophages by nucleofection. Journal of Visualized Experiments. (91), e51960(2014).
- Zhang, X., Edwards, J. P., Mosser, D. M. The Expression of Exogenous Genes in Macrophages: Obstacles and Opportunities. Macrophages and Dendritic Cells. , Springer. 123-143 (2009).
- Zhang, M., Gao, Y., Caja, K., Zhao, B., Kim, J. A. Non-viral nanoparticle delivers small interfering RNA to macrophages in vitro and in vivo. PLoS ONE. 10 (3), e0118472(2015).
- Davignon, J. -L., et al. Targeting monocytes/macrophages in the treatment of rheumatoid arthritis. Rheumatology. 52 (4), 590-598 (2012).
- Brown, J. M., Recht, L., Strober, S. The promise of targeting macrophages in cancer therapy. Clinical Cancer Research. 23 (13), 3241-3250 (2017).
- Karunakaran, D., et al. Targeting macrophage necroptosis for therapeutic and diagnostic interventions in atherosclerosis. Science Advances. 2 (7), e1600224(2016).
- Prosperi, D., Colombo, M., Zanoni, I., Granucci, F. Drug nanocarriers to treat autoimmunity and chronis inflammatory diseases. Seminars in Immunology. 34, 61-67 (2017).
- Höbel, S., Aigner, A. Polyethylenimines for siRNA and miRNA delivery in vivo. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 5 (5), 484-501 (2013).
- Whitehead, K. A., Langer, R., Anderson, D. G. Knocking down barriers: advances in siRNA delivery. Nature Reviews Drug Discovery. 8 (2), 129(2009).
- Liu, G., et al. N-Alkyl-PEI-functionalized iron oxide nanoclusters for efficient siRNA delivery. Small. 7 (19), 2742-2749 (2011).
- Weissleder, R., Nahrendorf, M., Pittet, M. J. Imaging macrophages with nanoparticles. Nature Materials. 13 (2), 125(2014).
- Magro, M., et al. Covalently bound DNA on naked iron oxide nanoparticles: Intelligent colloidal nano-vector for cell transfection. Biochimica et Biophysica Acta (BBA)-General Subjects. 1861 (11), 2802-2810 (2017).
- Abdelrahman, M., et al. siRNA delivery system based on magnetic nanovectors: Characterization and stability evaluation. European Journal of Pharmaceutical Sciences. 106, 287-293 (2017).
- Zhang, H., Lee, M. -Y., Hogg, M. G., Dordick, J. S., Sharfstein, S. T. Gene delivery in three-dimensional cell cultures by superparamagnetic nanoparticles. ACS Nano. 4 (8), 4733-4743 (2010).
- Moghimi, S. M., Hunter, A. C., Murray, J. C. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacological Reviews. 53 (2), 283-318 (2001).
- Harvey, A. E. Jr, Smart, J. A., Amis, E. Simultaneous spectrophotometric determination of iron (II) and total iron with 1, 10-phenanthroline. Analytical Chemistry. 27 (1), 26-29 (1955).
- Duan, J., et al. Polyethyleneimine-functionalized iron oxide nanoparticles for systemic siRNA delivery in experimental arthritis. Nanomedicine. 9 (6), 789-801 (2014).
- Fröhlich, E. The role of surface charge in cellular uptake and cytotoxicity of medical nanoparticles. International Journal of Nanomedicine. 7, 5577(2012).
- Wu, Y., et al. Ultra-small particles of iron oxide as peroxidase for immunohistochemical detection. Nanotechnology. 22 (22), 225703(2011).
- Xia, T., et al. Polyethyleneimine coating enhances the cellular uptake of mesoporous silica nanoparticles and allows safe delivery of siRNA and DNA constructs. ACS Nano. 3 (10), 3273-3286 (2009).
- Mocellin, S., Provenzano, M. RNA interference: learning gene knock-down from cell physiology. Journal of Translational Medicine. 2 (1), 39(2004).
- Courties, G., et al. et al.In vivo RNAi-mediated silencing of TAK1 decreases inflammatory Th1 and Th17 cells through targeting of myeloid cells. Blood. 116 (18), 3505-3516 (2010).
- Zolnik, B. S., Gonzalez-Fernandez, A., Sadrieh, N., Dobrovolskaia, M. A. Minireview: nanoparticles and the immune system. Endocrinology. 151 (2), 458-465 (2010).
- Mulens-Arias, V., Rojas, J. M., Pérez-Yagüe, S., Morales, M. P., Barber, D. F. Polyethylenimine-coated SPIONs trigger macrophage activation through TLR-4 signaling and ROS production and modulate podosome dynamics. Biomaterials. 52, 494-506 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены