Method Article
Nanopartículas de óxido de ferro revestido de Polyethyleneimine como um veículo para a entrega de RNA de interferência pequeno para macrófagos In Vitro e In Vivo
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Nós descrevemos um método de usar polyethyleneimine (PEI)-revestido de nanopartículas de óxido de ferro superparamagnético para macrófagos transfecting com siRNA. Essas nanopartículas podem eficientemente entregar siRNA expressão macrófagos gene-alvo em vitro e in vivo e silêncio.
Resumo
Devido ao seu papel crítico na regulação da resposta imune, os macrófagos continuamente tenham sido objecto de intensa investigação e representam um alvo terapêutico promissor em muitas doenças, como doenças auto-imunes, aterosclerose e câncer. Silenciamento de genes mediada por RNAi é uma valiosa abordagem de escolha para investigar e manipular a função de macrófagos; no entanto, o transfeccao de macrófagos com siRNA é considerado frequentemente para ser tecnicamente desafiador, e, neste momento, algumas metodologias dedicadas para a transferência de siRNA para macrófagos estão disponíveis. Aqui, apresentamos um protocolo do uso de nanopartículas de óxido de ferro superparamagnético polyethyleneimine-revestido (PEI-SPIONs) como um veículo para a entrega de alvo de siRNA para macrófagos. PEI-SPIONs são capazes de vinculação e completamente condensação siRNA quando a relação de peso de Fe: siRNA atinge 4 e acima. In vitro, essas nanopartículas podem eficientemente entregar siRNA em macrófagos primários, bem como para a linha de celular de macrófagos, como 264.7 crus, sem comprometer viabilidade celular na dose ideal para transfeccao, e, em última análise, eles induzem silenciamento de genes mediada por siRNA alvo. Além de ser usado para em vitro transfeccao siRNA, PEI-SPIONs são também uma ferramenta promissora para a entrega de siRNA para macrófagos na vivo. Tendo em conta as suas características combinadas de propriedade magnética e silenciamento capacidade, sistemicamente administrado PEI-SPION/siRNA partículas são esperadas não só para modular a função de macrófagos, mas também para ativar macrófagos para ser fotografado e rastreado. Em essência, PEI-SPIONs representam uma plataforma nonviral simples, segura e eficaz para a entrega de siRNA para macrófagos tanto in vitro e in vivo.
Introdução
Os macrófagos são um tipo de células do sistema imune inatos distribuídos em todos os tecidos do corpo, embora em quantidades diferentes. Produzindo uma variedade de citocinas e outros mediadores, eles desempenham papéis críticos na defesa do hospedeiro contra patógenos microbianos a invadir, na reparação de tecidos após lesão e na manutenção da homeostase de tecido1. Devido à sua importância, os macrófagos continuamente tenham sido objecto de intensa investigação. No entanto, apesar de sua prevalência em estudos de função e regulação gênica, silenciamento de genes mediada por siRNA é menos susceptível de ter êxito em macrófagos, porque estas células — particularmente, macrófagos primários — são frequentemente difíceis de transfect. Isto pode ser atribuído a um grau relativamente elevado de toxicidade associado com abordagens de transfeccao mais bem estabelecidas que a membrana celular é quimicamente (por exemplo, com polímeros e lipídios) ou fisicamente (por exemplo, por eletroporação e armas de gene) interrompeu deixar siRNA moléculas atravessam a membrana, reduzindo assim drasticamente viabilidade de2,3 dos macrófagos. Além disso, os macrófagos são os fagócitos dedicados ricos em enzimas degradativos. Estas enzimas podem danificar a integridade do siRNA, enfraquecendo sua eficiência silencioso mesmo se siRNA gene-específico foi entregue para a célula3,4. Portanto, precisa de um sistema de entrega de siRNA macrófago-alvo eficaz proteger a integridade e a estabilidade de siRNA durante entrega4.
É cada vez mais evidente que macrófagos disfuncionais estão implicados na iniciação e progressão de certas desordens clínicas comuns como doenças auto-imunes, aterosclerose e câncer. Por este motivo, modulando a função do macrófago com, por exemplo, siRNA, tem sido a emergir como uma metodologia atraente para o tratamento destes transtornos5,6,7. Embora muito progresso tem sido feito, um grande desafio da estratégia de tratamento baseado em siRNA é a especificidade da célula pobre de siRNA sistemicamente administrado e a absorção de siRNA insuficiente pelos macrófagos, que, consequentemente, levar a efeitos colaterais indesejados. Comparado com terapêutica de ácido nucleico livre que geralmente carecem de seletividade de célula ideal e muitas vezes levam a efeitos adversos, carregado de drogas nanopartículas (NPs), devido à sua propensão espontânea de ser capturado pelo sistema reticuloendotelial, fora do alvo pode ser projetada para o direcionamento passiva de macrófagos na vivo, permitindo a maior eficácia terapêutica com efeitos colaterais mínimos8. Atual NPs explorado para a entrega de moléculas do RNA incluem nanocarriers inorgânicos e lipossomas diversos polímeros9. Entre eles, o polyethyleneimine (PEI), um tipo de polímeros cationic capazes de vinculação e condensação de ácidos nucleicos em NPs estabilizado, mostra o RNA maior fornecimento de capacidade9,10. PEI protege os ácidos nucleicos de degradação enzimática e nonenzymatic, Medeia sua transferência através da membrana celular e promove sua liberação intracelular. Embora inicialmente introduzido como um reagente de entrega de DNA, PEI foi posteriormente demonstrado ser uma plataforma atrativa para na vivo entrega siRNA, localmente ou sistemicamente9,10.
Nanopartículas de óxido de ferro superparamagnético (SPIONs) tem mostrado grande promessa na biomedicina, devido às suas propriedades magnéticas, biocompatibilidade, tamanho comparável aos objetos biologicamente importantes, alta proporção de superfície-área-volume e facilmente adaptável superfície para o bioagente anexo11. Por exemplo, por causa de sua utilidade potencial como um agente de contraste e rápida absorção por macrófagos, SPIONs surgiram como uma ferramenta clínica favorita para imagem de macrófagos de tecido12. Enquanto SPIONs também têm sido muito estudados como ácido nucleico entrega veículos11,13,14,15, nosso conhecimento, a literatura contém alguns relatos de SPIONs como um portador para entrega de siRNA macrófago-alvo. Para a entrega do gene por SPIONs, sua superfície geralmente é revestida com uma camada de polímeros cationic hidrofílicos na qual carregados negativamente ácidos nucleicos pode ser eletrostaticamente atraiu e amarrados. Aqui, apresentamos um método para a síntese de SPIONs cuja superfície é modificada com baixo peso molecular (10 kDa), ramificada PEI (PEI-SPIONs). Estes nanoplatforms magnéticos então são empregados para condensar siRNA, formando complexos de PEI-SPION/siRNA que permitem o transporte de siRNA para a célula. Nós razão aquela espontânea fagocitose de SPIONs pelas células do sistema reticuloendotelial16, juntamente com a forte capacidade de ligação e condensação de ácidos nucleicos por PEI, processa a PEI-SPIONs apropriado para o transporte eficiente de siRNA em macrófagos. Os dados apresentados aqui apoiar a viabilidade de silenciamento de genes PEI SPION/siRNA-mediada em macrófagos na cultura, bem como na vivo.
Protocolo
Todos os métodos que envolvem animais vivos foram realizados em conformidade com o animal cuidado e usam as diretrizes da Universidade do sudeste, China.
1. preparação do PEI-SPIONs
-
Preparação do ácido oleico-modificado SPIONs
- Dissolva FeCl3•6H2O e Filipa4•7H2O na água sob a proteção de N2.
- Adicione 28 g de FeCl3•6H2O e 20 g de Filipa4•7H2O em 80 mL de água desionizada num copo. Introduzir a água através de uma canalização de vidro N2 e mexa até dissolver a matéria sólida.
- Aqueça a mistura de reação a 72 ° C, a uma taxa de agita de 800 rpm, seguido pela adição de 40 mL de água de amônia (28%). Mexa por 5 min.
- Adicionar 9 mL de ácido oleico gota a gota, na solução acima mencionada e agite-a 72 ° C por 3 h.
- Esfrie a solução resultante a temperatura ambiente (RT). Precipitar a solução através da separação magnética.
- Lavar o precipitado contendo SPIONs 3 x com absoluto álcool etílico e, em seguida, dispersar o precipitado em 100 mL de N-hexano.
- Dissolva FeCl3•6H2O e Filipa4•7H2O na água sob a proteção de N2.
-
Preparação de dimercaptosuccínico ácido-modificado SPIONs
- Adicionar 800 mg de ácido oleico (OA)-modificado SPIONs dispersadas em 200 mL de N-hexano, e 400 mg de ácido dimercaptosuccínico (DMSA) dispersos em 200 mL de acetona, para um balão de três-pescoço em um banho de água a 60 ° C.
Nota: Para determinar a concentração de SPION OA-modificado obtido na etapa anterior, tomar um volume pequeno (por exemplo, 1ml) de dispersão SPION, volatilize o N-hexano e pesar o pó resultante. - 200 µ l de trietilamina adicione gota a gota a solução acima mencionada com agitação a 1.000 rpm e refluxo.
- Após 5h de agitação e refluxo, obter um precipitado preto por separação magnética.
- Disperse homogeneamente os hidrofílicos SPIONs em água desionizada, ajustando o pH da solução usando hidróxido de tetrametilamónio.
- Adicionar 800 mg de ácido oleico (OA)-modificado SPIONs dispersadas em 200 mL de N-hexano, e 400 mg de ácido dimercaptosuccínico (DMSA) dispersos em 200 mL de acetona, para um balão de três-pescoço em um banho de água a 60 ° C.
-
Preparação do PEI-SPIONs
- Adicionar a solução coloidal de DMSA-modificado SPION gota a gota em solução de PEI (10 kDa) em um balão de 500 mL três-pescoço sob agitação mecânica a 1.000 rpm por 2 h (WFe: WPEI = 1:3).
Nota: A carga e tamanho de PEI-SPIONs variam dependendo da proporção de WFe para WPEI. O WFe: WPEI rácio de 1:3 pode ser um bom ponto de partida para a síntese de PEI-SPIONs apropriados para entrega de siRNA. - Adicionar a solução resultante em um tubo de ultrafiltração, tendo um peso molecular de corte de 100 kDa e um teor de 15 mL; em seguida, centrifugar 5.400 x g por 10 min até que o restante da solução é de 1 mL. Adicionar água desionizada para a solução para tornar o volume 15 mL novamente e repita o processo acima 10 x para obter o produto final. Em seguida, filtrar a solução através de um filtro de 0,22 μm e armazenar o produto final a 4 ° C.
- Determine a concentração de Fe de PEI-SPIONs pelo método colorimétrico, utilizando fenantrolina17. Diluir a PEI-SPIONs com água desionizada estéril, a uma concentração de 1 mg Fe/mL e armazená-lo em 4 ° C.
- Diluir 10 μL da solução de PEI-SPION (1 mg Fe/mL) para 1 mL com água desionizada; em seguida, teste seu tamanho hidrodinâmico e potencial zeta por um dispositivo de dispersão de luz dinâmico.
Nota: Preparar PEI-SPIONs na faixa de aproximadamente 30-50 nm. Nesta faixa de tamanho, o efeito do tamanho da NP na ligação de siRNA e absorção celular parece não ser significativa. PEI-SPIONs tendo um potencial zeta média mais + 37 mV pode ser tóxica na faixa de dose para transfeccao, e um ensaio de citotoxicidade deve ser realizado para garantir a segurança. A carga de superfície e tamanho hidrodinâmico das nanopartículas podem ser controlados dentro de um intervalo desejado ajustando o conteúdo de PEI.
- Adicionar a solução coloidal de DMSA-modificado SPION gota a gota em solução de PEI (10 kDa) em um balão de 500 mL três-pescoço sob agitação mecânica a 1.000 rpm por 2 h (WFe: WPEI = 1:3).
2. preparação e electroforese do Gel do Agarose de PEI-SPION/siRNA NPs
- SiRNA diluído com água livre de RNase para produzir uma concentração final de 20 μM (0.26 μg/μL).
- Prepare cinco livre de RNase microcentrifuga tubos rotulados 0, 1, 2, 4 e 8. As etiquetas representam Fe: siRNA diferentes relações de peso. Pipetar 3 μL de solução de siRNA para todos os tubos (~0.8 μg de siRNA/tubo).
- Adicionar 0, 0.8, 1.6, 3.2, e 6.4 μg de Fe na forma de PEI-SPIONs aos tubos rotulados 0, 1, 2, 4 e 8, respectivamente. Manter o volume total da amostra de cada tubo inferior a 20 μL. Misture suavemente pipetando acima e para baixo.
- Incube as misturas em RT por 30 min para permitir a formação do complexo PEI-SPION/siRNA. Durante este período, fazer um agarose a 3% gel de agarose de alta pureza.
Nota: Adicionais PEI-SPION/siRNA complexos com outros rácios de Fe: siRNA (por exemplo, 5 ou 6) podem ser preparados e testados. - Adicione 1 μL de 6x do amortecedor do DNA-carregamento por amostra 5 μL e misture com cautela. Carregar todas as amostras e executar eletroforese em 5 V/cm até que o azul de bromofenol migra até dois terços do comprimento do gel. Manche o gel com brometo de etídio (EB) por 15-20 min.
Nota: Tampão de eletroforese preparados na hora e EB solução devem ser usados. - Visualize siRNA bandas sob um sistema de imagem de UV. Verifique os rácios de Fe: siRNA na quais complexos de formas de siRNA com PEI-SPIONs e, como resultado, as bandas representando siRNA livre são retardados ou não detectável.
3. a transfeccao de RAW264.7 macrófagos In Vitro
- Cultura do mouse macrófago RAW264.7 células em um prato de 10 cm, usando DMEM completam médio contendo 10% fetal de soro bovino (FBS) por 100 penicilina U/mL por 100 estreptomicina μg/mL a 37 ° C numa incubadora 5% CO2 .
- Um dia antes o transfeccao, Aspire médio das células e enxaguá-los com tampão fosfato salino (pH 7,4). Adicione 1 mL de tripsina 0,25% para o prato de 10 cm. Trypsinize RAW264.7 células por cerca de 5-10 min a 37 ° C numa incubadora 5% CO2 .
- Quando a maioria das células ter desanexado (após 5-10 min), adicione 5 mL de meio completo DMEM ao prato para inactivar a tripsina. Pipetar para cima e para baixo dispersar clusters de célula em células únicas.
- Transferi a suspensão de células para um tubo cônico de 15 mL estéril. -Centrifugar a 300 x g por 3 min em RT. Remove o sobrenadante.
- Ressuspender as células com 5 mL de meio de completa DMEM fresco e contar as células.
- Células de4 placa 9 x 10 por bem em uma placa de 6 com 2 mL de meio DMEM completo e incubam a 37 ° C numa incubadora 5% CO2 por cerca de 24 h.
Nota: Se utilizar uma placa de um tamanho diferente, ajuste a densidade de celular chapeado na proporção de área de superfície relativa para que as células alcançar confluência de 80% na época do transfection. - Quando a confluência de célula é de 80%, remover o meio das células e substituí-lo com 1 mL de meio completo DMEM por alvéolo. Devolve a chapa para a incubadora até PEI-SPION/siRNA complexos foram preparados e estão prontos para uso (cerca de 30 min).
- Preparar o PEI-SPION/siRNA complexos: calcular a quantidade de PEI-SPION/siRNA complexos necessários para uma experiência do transfection. Em um 1,5 mL RNase-livre microcentrifuga tubo, misture uma quantidade adequada de PEI-SPIONs com siRNA em uma proporção de Fe: siRNA determinado. Por exemplo, para preparar o NPs PEI-SPION/siRNA contendo 100 µ g de Fe em uma proporção de Fe: siRNA de 4, adicionar 100 µ l (1 mg Fe/mL) de PEI-SPIONs para 96 μL de siRNA (0.26 μg/μL), seguido de misturá-lo suavemente com uma micropipeta. Incubar durante 30 min à RT.
Nota: Prepare um volume de PEI-SPION/siRNA complexo que é 10% superior a massa total final responsáveis por quaisquer perdas acidentais. Faça PEI-SPION/siRNA complexos em baixa Fe: siRNA rácios, em que moléculas de siRNA são completamente carregadas na PEI-SPIONs e, portanto, pequenas quantidades de PEI-SPIONs podem ser usadas para minimizar a citotoxidade potencial. Experiências piloto (ensaio de retardo de gel), para a otimização da relação de Fe: siRNA são necessárias. - Retire a placa de 6 da incubadora (etapa 3.7). Adicionar um volume necessário de PEI-SPION/siRNA complexo gota a gota a cada poço e agite a placa cautelosamente para garantir uma distribuição uniforme. Devolve a chapa para a incubadora até o balanço do celular absorção ou gene "knockdown" eficiência (1-3 d).
Nota: Transfecting macrófagos com PEI-SPION/siRNA em uma concentração de ~ 15 μg Fe/mL podem maximizar a eficiência de transfeccao minimizando a citotoxidade potencial.
4. sistêmica entrega de siRNA para macrófagos em ratos com artrite Experimental
- Obter ratos da linhagem Wistar masculinos isentos de organismos patogénicos específicos que são 7 semanas de idade. Se habituar os ratos para 7 d antes da utilização e fornecê-los com água e uma alimentação adequada. Induzi a artrite adjuvante (AA) de ratos como descrito anteriormente,18.
- Prepare-se complexos de PEI-SPION/siRNA conforme descrito na etapa 3.8.
- Injete o NPs PEI-SPION/siRNA (0,3 mg de siRNA/kg) a AA ratos através da veia da cauda. Avaliar a absorção celular através de, por exemplo, citometria de fluxo, tecido biodistribuição através de, por exemplo, uma sistema, de imagem em tempo real da fluorescência ou efeitos terapêuticos com base em, por exemplo, clínica, radiográfica e histológica 18pontos de análises no tempo desejado.
Nota: Para estudos de biodistribuição celular e tecidos, tratar os ratos com uma única injeção do NPs desejado; para estudos terapêuticos, injete os ratos com o NPs para ser testado 1x por semana durante três semanas consecutivas.
Resultados
O tamanho e a zeta potencial de PEI-SPIONs preparado com este protocolo foram na faixa de 29-48 nm (índice de polidispersividade: 0.12 - 0,23) e 30-48 mV, respectivamente. Eles estavam estáveis em água a 4 ° C por mais de 12 meses sem agregação óbvia. Para avaliar sua capacidade de vinculação de siRNA, PEI-SPIONs foram misturadas com siRNA em várias relações de peso de Fe: siRNA. A Figura 1 mostra que quando a relação de peso de Fe: siRNA atinge 4 e acima, a banda de siRNA livre foi completamente ausente, o que implica siRNA bem sucedida ligação a PEI-SPIONs. Uma grande preocupação do PEI em aplicação biomédica é sua toxicidade, que é um resultado da forte carga positiva, particularmente no alto peso molecular e altas doses. Como mostrado na Figura 2A, PEI-SPIONs com uma zeta potencial de 30,5 e 37 mV não exibem aparente citotoxicidade em concentrações até 30 μg Fe/mL, que é sobre dupla superior a concentração (15 μg Fe/mL), normalmente usada para transfeccao de célula. No entanto, PEI-SPIONs com um potencial zeta de 48 mV eram tóxicos, mesmo com a menor dose examinada (10 μg Fe/mL). Portanto, PEI-SPIONs possuem uma toxicidade dependente da carga. Desde carga catiônica não é importante para a absorção de NP por macrófagos19, sugerimos que PEI-SPIONs com um potencial zeta média não superior a + 37 mV são usados para a transferência de siRNA, embora siRNA vinculação diminuiria a carga em certa medida e aliviar a citotoxicidade18.
Para testar a potencial aplicação do PEI-SPIONs para entrega de siRNA para macrófagos, o transfection em vitro foi realizado com a linha de celular de macrófagos murino 264.7 crus. Como analisado por citometria de fluxo, mais de 90% das células foram transfectadas com complexos de PEI-SPION/siRNA fluorescente etiquetados em 15 µ g Fe/mL (Figura 2B). No que diz respeito a eficiência de transfeccao, na verdade não houve diferença entre PEI-SPION/siRNA NPs formada em Fe: siRNA relações de peso de 4 e 8, embora, sob a condição deste último, o NPs que se formaram eram menores em tamanho e mais na carga positiva Porque uma quantidade menor de siRNA foi carregada por partículas. Também avaliamos o efeito da concentração de PEI-SPION/siRNA na internalização celular pela coloração azul prussiano. Como mostrado na Figura 2, os pontos azuis no interior das células transfectadas foram minimamente detectáveis a 7,5 µ g Fe/mL, mas claramente visível em 15 µ g Fe/mL. Curiosamente, aumentando a concentração de PEI-SPION/siRNA para 32 µ g Fe/mL não aumentar as intensidades de coloração, provavelmente porque a absorção de PEI-SPION/siRNA estava saturada em concentrações em torno de 15 µ g Fe/mL. Além disso, a capacidade de PEI-SPIONs para mediar a transferência de siRNA foi corroborada em macrófagos primários18, e o método apresentado aqui teve uma eficiência de transfeccao siRNA alta em macrófagos peritoneais de rato, equivalentes em RAW264.7 células. Os macrófagos peritoneais transfectados com PEI-SPIONs abrigando siRNA específico mostrou uma significativa diminuição do nível de mRNA do alvo em comparação com siRNA inespecífico (Figura 2D), implicando que siRNA poderia escapar de vesículas de endocitose na citoplasma e alcance a maquinaria de RNAi.
Anteriormente investigamos também na vivo captação celular dos complexos de PEI-SPION/siRNA sistemicamente administrados em ratos com adjuvante artrite18. Analisamos a eficiência de transfeccao PEI-SPION/siRNA em macrófagos fagocíticas e nonphagocytic linfócitos T. Como mostrado na Figura 3, CD11b + células assumiram PEI-SPION/siRNA complexos mais eficientemente do que células CD3 + em qualquer ponto do tempo em todos os órgãos examinados, indicando que o NPs PEI-SPION/siRNA alvo preferencialmente macrófagos18. Notavelmente, observou-se uma acumulação de alto nível do NPs em articulações inflamadas18, sugerindo que o PEI-SPION pode ser uma plataforma atrativa para a entrega sistêmica de siRNA terapêutica em artrite reumatoide, cuja patogênese está ligada à disfunção do macrófago e para qual local siRNA administração não é uma escolha favorita devido o envolvimento de múltiplos órgãos da doença.
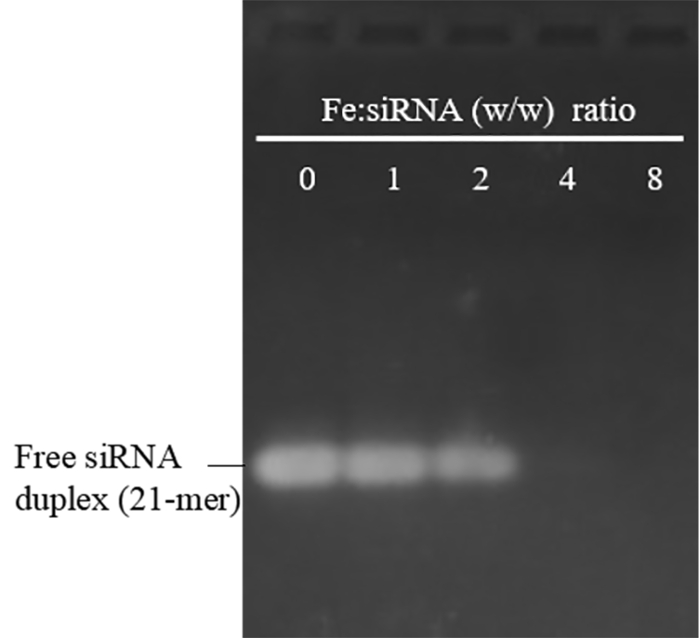
Figura 1: electroforese do gel do Agarose de PEI-SPION/siRNA complexos formados em várias relações de Fe: siRNA (w/w). Uma proporção de Fe: siRNA de 0 representa livre siRNA duplex sem PEI-SPIONS. O tamanho médio e potencial zeta de as PEI-SPIONs livre usados aqui foram 30 nm e 45 mV. siRNA completamente poderia vincular a PEI-SPIONs quando a proporção de Fe: siRNA atinge 4 e acima, consistente com os resultados anteriores usando PEI-SPIONs com um tamanho médio de 48 nm e um potencial zeta de 30,5 mV18. A ausência de bandas retardadas (complexos de PEI-SPION/siRNA) pode refletir a inacessibilidade de siRNA para EB durante a coloração, uma indicação de siRNA forte ligação e/ou a capacidade de condensação de PEI-SPIONs. Clique aqui para ver uma versão maior desta figura.

Figura 2: caracterização biológica de PEI-SPION e PEI-SPION/siRNA NPs. (A), este painel mostra um ensaio da viabilidade celular. RAW 264,7 células foram tratadas por 16 h com as doses indicadas de PEI-SPIONs rolamento potencial zeta diferentes e, em seguida, realizou-se um ensaio MTS. A viabilidade celular foi normalizada contra o controle (sem exposição de partícula). Os dados são da média ± DP de poços duplicados. (B), este painel mostra uma análise do fluxo cytometric do PEI-SPION/Cy3-siRNA captação por 264.7 pilhas. As células foram incubadas durante 24 h com 15 µ g Fe/mL (painel superior) ou 5 μg Fe/mL (painel inferior) de PEI-SPIONs complexados com siRNA Cy3-rotulado na proporção Fe: siRNA (w/w) de 4 e 8, respectivamente. SiRNA inespecíficos (NC) representa siRNA fluorescente não–. M2: condomínio fechado região; PE-h: Cy3 intensidade de fluorescência. A eficiência de transfeccao siRNA de PEI-SPIONs usado aqui (37,8 nm, 48 mV) foi semelhante ao estudo anterior usando PEI-SPIONs com um tamanho médio de 48 nm e um potencial zeta de 30,5 mV18. (C), este painel mostra uma análise de absorção de PEI-SPION/siRNA visualizando os depósitos de ferro celular. RAW 264,7 células foram incubadas com 7.5, 15 e 32 μg PEI-SPIONs de Fe/mL (48 nm, 30.5 mV) complexado com siRNA (siRNA: Fe = 8) e manchadas pelo azul da Prússia. As barras de escala são 20 μm. (D) este painel mostra uma validação em vitro da eficiência de siRNA entregado por PEI-SPIONs silencioso. Um rato de siRNA-direcionamento específico Cadeia de β-15 receptores IL-2 foi carregado no PEI-SPIONs (48 nm, 30.5 mV) no siRNA: Fe = 8 e, em seguida, transfectadas em macrófagos peritoneais de ratos. Um siRNA NC foi usado como controle. O efeito de silenciamento do gene foi avaliado por PCR quantitativo. As células foram incubadas com os complexos em 15 μg Fe/mL. Os dados são da média ± SD de poços triplicados. Painel D foi modificado de Duan et al 18 com permissão do editor. Clique aqui para ver uma versão maior desta figura.

Figura 3: No vivo absorção celular de PEI-SPION/siRNA NPs. Três ratos artríticos foram injetados por via intravenosa com uma única dose de 0,3 mg/kg Cy3-siRNA formulado com PEI-SPION (48 nm, 30.5 mV). Um rato injetado com PBS foi usado como um controle. Sangue, baço, fígado, rim e articulações inflamadas foram coletadas em 2, 8 e 24 h após a injeção. A absorção celular de PEI-SPION/Cy3-siRNA NPs foi avaliada por citometria de fluxo, usando o (A) anti-CD3 e (B) os anticorpos monoclonais anti-CD11b. As percentagens são de absorção de Cy3-siRNA dentro do gated CD3 + ou CD11b + células. Os resultados mostrados aqui são representativos de dois experimentos independentes. Esta figura foi modificada de Duan et al 18 com permissão do editor. Clique aqui para ver uma versão maior desta figura.
Discussão
Os macrófagos são refratários a transfect por abordagens nonviral comumente usadas, como espécie de lipídios, lipossomas catiônicos e eletroporação. Aqui nós descrevemos um método confiável e eficiente para transfect macrófagos com siRNA. Utilizando o presente protocolo, mais 90% dos macrófagos, como 264.7 pilhas (Figura 2B) e de macrófagos peritoneais de ratos18 pode ser transfected com siRNA sem deterioração significativa da viabilidade celular. Esse método depende da plataforma de entrega PEI-SPION, que está um nanocarreador composto por um núcleo de óxido de ferro e uma concha de PEI. Então, o primeiro passo chave do protocolo é a síntese de PEI-SPIONs apropriados para entrega de siRNA. Geralmente, SPIONs PEI-revestido são preparados a partir SPIONs ácido oleico-revestido por um método de ligante-troca na qual ácido oleico é trocado diretamente da superfície da SPIONs pelo PEI ou seus derivados15, gerando NPs hidrofílico com uma carga positiva superfície. No caso aqui apresentado, o ácido oleico tampado na superfície do SPIONs foi substituído por ácido dimercaptosuccínico solúvel em água, e então PEI foi carregado em superfícies SPION através de interações eletrostáticas. Este método é suave e fácil de preparar em grandes quantidades, e o NPs sintetizado têm excelente estabilidade em água20. É sabido que o PEI é citotóxico, e a toxicidade se correlaciona fortemente com o seu peso molecular de21. Para garantir a segurança, uma consideração importante quando sintetizando PEI-SPIONs é que estas partículas são revestidas com PEI baixo peso molecular, que é 10 kDa no presente protocolo. O efeito tóxico indesejado do PEI é mediado principalmente por sua carga positiva; Portanto, a medição do potencial zeta de PEI-SPIONs é essencial, e o valor não deve ser superior a 37 mV. Uma diminuição na carga positiva pode ser conseguida simplesmente reduzindo o conteúdo de PEI. Outro passo crítico para o sucesso da aplicação deste sistema de entrega de siRNA é a otimização da relação de Fe: siRNA por gel de retardo. Parece razoável tornar complexos de PEI-SPION/siRNA em rácios de baixa Fe: siRNA sob qual siRNA moléculas são ainda capazes de se ligar a PEI-SPIONs. Nesta circunstância, pequenas quantidades de PEI-SPIONs podem ser usadas, minimizando sua citotoxidade potencial.
No caso de uma eficiência desejada de silenciar ou efeito terapêutico não é produzido, verificar a eficiência da transfecção por fluxo cytometry ou fluorescência microscopia usando o transportador carregado com um siRNA fluorescente etiquetado. Alternativamente, a absorção de PEI-SPION/siRNA pode ser examinada pela coloração azul prussiano convencional, que é suficientemente sensível para detectar único grânulos de ferro nas células. Se a eficiência do transfection é realmente baixa, pode ser necessário para otimizar as condições de transfeccao, tais como a densidade celular, tempo de transfeccao e a dose de PEI-SPION/siRNA partículas. O número de passagem de células também pode afetar a eficiência da transfecção22. Na maioria dos casos, um efeito de silenciamento insuficiente não é causado por uma absorção insuficiente de PEI-SPION/siRNA, como o actual sistema de PEI-SPION foi demonstrado para facilitar uma transferência eficaz de siRNA para macrófagos. Às vezes, combinar vários siRNAs visando o mesmo gene pode ser uma boa estratégia para melhorar a eficiência "knockdown". Vale ressaltar que, apesar de RNAi geralmente ocorre dentro de 24h do transfection, o início e a duração do silenciamento de genes dependem a taxa de rotatividade do alvo, a taxa de diluição e longevidade de siRNA e até mesmo a concentração de soro no meio. Assim, o tempo curso de experiências podem ser necessária para determinar com precisão o ponto do tempo de efeito máximo2,22. Para aplicação em vivo , a eficácia terapêutica também depende, e em que medida, o destino de siRNA contribui para fenótipos de doença; assim, a escolha de um destino de siRNA apropriado é fundamental para os resultados esperados.
Existem várias vantagens do presente protocolo para entrega de siRNA para macrófagos. (1) o método é fácil de executar e é uma maneira barata de produzir PEI-SPIONs em grandes quantidades, e o NPs produzido são estável na água por mais de 12 meses se forem mantidos a 4 ° C. (2) fagocitose espontânea de SPIONs por macrófagos facilita uma transferência eficaz de siRNA PEI SPION-mediada, resultando em eficiência elevada do transfection. Espera-se que além de 264.7 pilhas e macrófagos peritoneais de ratos, esta abordagem é aplicável a outras linhas de células de macrófagos e macrófagos primários, enquanto a dose para transfeccao é otimizada. (3) siRNA transfeccao é rápido e fácil de realizar em comparação com outros métodos de Transfeccao de macrófagos como nucleofection, que é demorado e requer um dispositivo de Nucleofector2. (4) PEI-SPION pode ser um veículo ideal para a entrega de siRNA sistêmica macrófago-alvo em certos modelos de doença. Os macrófagos desempenham um papel crítico no desenvolvimento e progressão de várias doenças inflamatórias crônicas, bem como tumores; e notável característica histológica dessas doenças é os vasos sanguíneos anormais com endotélio gotejante. Daí, devido à maior permeabilidade e efeito de retenção, sistemicamente administrado drogas-carregado NPs tendem a se acumular nos tecidos doentes e são facilmente capturado por macrófagos locais, levando a maior especificidade, reduzidos efeitos colaterais e melhorado eficácia terapêutica. Em um modelo do rato de artrite adjuvante, injetado por via intravenosa PEI-SPION/siRNA complexos foram retomados por ~ 40% das células CD11b + durante as primeiras 24 horas após a injeção de18. Em contraste, quando em lipossomas catiônicas foi usada como um portador para entrega de siRNA sistêmica em ratos, menos de 5% das células CD11b + nas articulações artríticas aprisionado o siRNA lipoplexes23. Além disso, devido às suas propriedades magnéticas, a aplicação de um campo magnético externo pode ainda facilitar o acúmulo de complexos de PEI-SPION/siRNA nos tecidos-alvo e aumentar sua penetração no celular. Também digno de nota é que tais NPs siRNA-carregado pode ser usado não somente para modular a função de macrófagos, mas também para macrófagos de imagem para fornecer informações de diagnóstico, eficácia do tratamento do monitor e prever de desfechos clínicos dos pacientes12.
No entanto, existem limitações associadas com este protocolo. O sistema de PEI-SPION apresenta uma estreita faixa de dosagem para a entrega de siRNA. A máxima absorção ocorreu quando as células RAW264.7 foram expostas para PEI - SPION/siRNAs em uma concentração de 15 µ g Fe/mL (Figura 2B e 2C). Aumentando a concentração de PEI-SPION/siRNA para 32 µ g Fe/mL não resultou em um aumento na captação celular (Figura 2), mas, pelo contrário, pode aumentar o risco de induzir a morte celular devido a toxicidade intrínseca do PEI. Por outro lado, diminuindo PEI-SPION/siRNA para 5 ou 7,5 µ g Fe/mL obviamente reduziu sua absorção pelas células RAW264.7 (Figura 2B e 2C). Assim, propomos que a concentração ideal de PEI-SPION/siRNA para em vitro transfeccao macrófago é ~ 15 µ. g Fe/mL (concentração final em um poço). Outra limitação que precisa ser levado em consideração é o possível efeito de PEI-SPIONs na atividade de macrófagos. Nanopartículas podem induzir a resposta imune24, dependendo de sua carga de superfície, tamanho, modificação da superfície, forma e até mesmo sobre a metodologia utilizada para sintetizá-los. Mulens-Arias et al relataram recentemente que PEI-revestido SPIONs desencadear a ativação de macrófagos25. O método de síntese de PEI-SPION aqui apresentado difere significativamente da Mulens-Arias et al, e portanto, se o PEI-SPIONs preparada com base no gatilho presente protocolo ativação de macrófagos aguarda mais investigação. No entanto, para atender a esta preocupação inequivocamente, sugerimos que, além do PEI-SPION complexado com siRNA scramble, o veículo em si (PEI-SPION somente) pode servir como outro controle ao utilizar o presente protocolo. Finalmente, este protocolo não é adequado para a entrega do DNA devido ao seu tamanho relativamente grande.
Em resumo, apresentamos aqui um método de usar SPIONs PEI-revestido como um veículo para transfeccao siRNA em macrófagos. Estas NPs pode eficientemente entregar siRNA em linha de celular macrófago imortalizado, assim como em macrófagos primários em vitroe funcionalmente induzir silenciamento sem afetar a viabilidade celular na dose ideal para transfeccao. Além disso, PEI-SPIONs pode ser utilizados para na vivo siRNA entrega aos macrófagos, tornando possível a imagem, bem como modular, cuja disfunção contribui para o desenvolvimento e progressão de doenças inflamatórias crônicas muitos de macrófagos e tipos de câncer.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pelo programa de desenvolvimento da China (n. º 2017YFA0205502) e nacional chave de pesquisa e a Fundação Nacional de ciências naturais da China (81772308).
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM | Gibco | C11995500BT | Warm in 37°C water bath before use |
| Fetal bovine serum | Gibco | A31608-02 | |
| Penicillin/streptomycin (1.5 ml) | Gibco | 15140122 | |
| Tetrazolium-based MTS assay kit | Promega | G3582 | For cytotoxicity analysis |
| RAW 264.7 cell line | Cell Bank of Chinese Academy of Sciences, Shanghai, China | TCM13 | |
| Tissue culture plates (6-well) | Corning | 3516 | |
| Tissue culture dishes (10 cm) | Corning | 430167 | |
| RNase-free tubes (1.5 ml) | AXYGEN | MCT-150-C | |
| Centrifuge tubes (15 ml) | Corning | 430791 | |
| Trypsin | Gibco | 25200-056 | |
| Wistar rats | Shanghai Experimental Animal Center of Chinese Academy of Sciences | ||
| Bacillus Calmette–Guérin freeze-dried powder | National Institutes for Food and Drug Control, China | for inducing adjuvant arthritis in rats | |
| siRNA | GenePharma (Shanghai, China) | ||
| Cy3-siRNA | RiboBio (Guangzhou, China) | ||
| Polyethyleneimine (10 kDa) | Aladdin Chemical Reagent Co., Ltd. | E107079 | |
| Ammonia water | Aladdin Chemical Reagent Co., Ltd. | A112077 | |
| Oleic acid | Aladdin Chemical Reagent Co., Ltd. | O108484 | |
| Dimethylsulfoxide | Aladdin Chemical Reagent Co., Ltd. | D103272 | |
| FeSO4•7H2O | Sinopharm Chemical Reagent Co., Ltd | 10012118 | |
| FeCl3•6H2O | Sinopharm Chemical Reagent Co., Ltd | 10011918 | |
| Dimercaptosuccinic acid | Aladdin Chemical Reagent Co., Ltd. | D107254 | |
| ultrafiltration tube | Millipore | UFC910096 | |
| Tetramethylammonium hydroxide solution | Aladdin Chemical Reagent Co., Ltd. | T100882 | |
| Particle size and zeta potential analyzer | Malvern, England | Nano ZS90 |
Referências
- Murray, P. J., Wynn, T. A. Protective and pathogenic functions of macrophage subsets. Nature Reviews Immunology. 11 (11), 723 (2011).
- Maeß, M. B., Wittig, B., Lorkowski, S. Highly efficient transfection of human THP-1 macrophages by nucleofection. Journal of Visualized Experiments. (91), e51960 (2014).
- Zhang, X., Edwards, J. P., Mosser, D. M. The Expression of Exogenous Genes in Macrophages: Obstacles and Opportunities. Macrophages and Dendritic Cells. , 123-143 (2009).
- Zhang, M., Gao, Y., Caja, K., Zhao, B., Kim, J. A. Non-viral nanoparticle delivers small interfering RNA to macrophages in vitro and in vivo. PLoS ONE. 10 (3), e0118472 (2015).
- Davignon, J. -. L., et al. Targeting monocytes/macrophages in the treatment of rheumatoid arthritis. Rheumatology. 52 (4), 590-598 (2012).
- Brown, J. M., Recht, L., Strober, S. The promise of targeting macrophages in cancer therapy. Clinical Cancer Research. 23 (13), 3241-3250 (2017).
- Karunakaran, D., et al. Targeting macrophage necroptosis for therapeutic and diagnostic interventions in atherosclerosis. Science Advances. 2 (7), e1600224 (2016).
- Prosperi, D., Colombo, M., Zanoni, I., Granucci, F. Drug nanocarriers to treat autoimmunity and chronis inflammatory diseases. Seminars in Immunology. 34, 61-67 (2017).
- Höbel, S., Aigner, A. Polyethylenimines for siRNA and miRNA delivery in vivo. Wiley Interdisciplinary Reviews: Nanomedicine and Nanobiotechnology. 5 (5), 484-501 (2013).
- Whitehead, K. A., Langer, R., Anderson, D. G. Knocking down barriers: advances in siRNA delivery. Nature Reviews Drug Discovery. 8 (2), 129 (2009).
- Liu, G., et al. N-Alkyl-PEI-functionalized iron oxide nanoclusters for efficient siRNA delivery. Small. 7 (19), 2742-2749 (2011).
- Weissleder, R., Nahrendorf, M., Pittet, M. J. Imaging macrophages with nanoparticles. Nature Materials. 13 (2), 125 (2014).
- Magro, M., et al. Covalently bound DNA on naked iron oxide nanoparticles: Intelligent colloidal nano-vector for cell transfection. Biochimica et Biophysica Acta (BBA)-General Subjects. 1861 (11), 2802-2810 (2017).
- Abdelrahman, M., et al. siRNA delivery system based on magnetic nanovectors: Characterization and stability evaluation. European Journal of Pharmaceutical Sciences. 106, 287-293 (2017).
- Zhang, H., Lee, M. -. Y., Hogg, M. G., Dordick, J. S., Sharfstein, S. T. Gene delivery in three-dimensional cell cultures by superparamagnetic nanoparticles. ACS Nano. 4 (8), 4733-4743 (2010).
- Moghimi, S. M., Hunter, A. C., Murray, J. C. Long-circulating and target-specific nanoparticles: theory to practice. Pharmacological Reviews. 53 (2), 283-318 (2001).
- Harvey, A. E., Smart, J. A., Amis, E. Simultaneous spectrophotometric determination of iron (II) and total iron with 1, 10-phenanthroline. Analytical Chemistry. 27 (1), 26-29 (1955).
- Duan, J., et al. Polyethyleneimine-functionalized iron oxide nanoparticles for systemic siRNA delivery in experimental arthritis. Nanomedicine. 9 (6), 789-801 (2014).
- Fröhlich, E. The role of surface charge in cellular uptake and cytotoxicity of medical nanoparticles. International Journal of Nanomedicine. 7, 5577 (2012).
- Wu, Y., et al. Ultra-small particles of iron oxide as peroxidase for immunohistochemical detection. Nanotechnology. 22 (22), 225703 (2011).
- Xia, T., et al. Polyethyleneimine coating enhances the cellular uptake of mesoporous silica nanoparticles and allows safe delivery of siRNA and DNA constructs. ACS Nano. 3 (10), 3273-3286 (2009).
- Mocellin, S., Provenzano, M. RNA interference: learning gene knock-down from cell physiology. Journal of Translational Medicine. 2 (1), 39 (2004).
- Courties, G., et al. et al.In vivo RNAi-mediated silencing of TAK1 decreases inflammatory Th1 and Th17 cells through targeting of myeloid cells. Blood. 116 (18), 3505-3516 (2010).
- Zolnik, B. S., Gonzalez-Fernandez, A., Sadrieh, N., Dobrovolskaia, M. A. Minireview: nanoparticles and the immune system. Endocrinology. 151 (2), 458-465 (2010).
- Mulens-Arias, V., Rojas, J. M., Pérez-Yagüe, S., Morales, M. P., Barber, D. F. Polyethylenimine-coated SPIONs trigger macrophage activation through TLR-4 signaling and ROS production and modulate podosome dynamics. Biomaterials. 52, 494-506 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados